利拉鲁肽在制备治疗急慢性移植排斥反应药物中的应用的制作方法
本发明涉及医药制备技术领域,具体指利拉鲁肽在制备治疗急慢性移植排斥反应药物中的应用。
背景技术:
人体的免疫系统对各种致病因子有着非常完善的防御机制,在进行组织或器官移植时常常会产生移植排斥反应。为了改善移植器官的存活及其功能,人们在不断探索新的免疫抑制剂,近年来有报道显示糖尿病药物的使用可以改善移植器官的功能及存活,例如chen-fanglee等人使用糖分解抑制剂2-脱氧葡萄糖、抗糖尿病药物二甲双胍及谷氨酰胺代谢抑制剂偶氮亮氨酸以抑制糖酵解及谷氨酰胺代谢可以负向调节cd4+和cd8+效应t活性并进一步改善小鼠移植心脏的存活。
利拉鲁肽,作为一种糖尿病治疗药物,是一种长效胰高血糖素样肽-1(glp-1)类似物,可以促进胰岛细胞分泌胰岛素,抑制胰高血糖素分泌,并促进胃排空。利拉鲁肽的活性由其与glp-1受体间特定的相互作用介导,研究表明,glp-1受体在肾脏、心脏、肺等多种器官组织中也有表达,在心脏中又以内皮细胞中表达丰度最高。近年来,利拉鲁肽已经被证实可以用作肾脏纤维化药物。利拉鲁肽在其他治疗药物中的应用还有待进一步研究。
技术实现要素:
为了探究利拉鲁肽在移植排斥反应中的作用,本发明建立了主要组织相容性抗原(mhc-1和mhc-ii)完全错配的小鼠心脏移植急性排斥反应模型和单个主要组织相容性ii类抗原(mhc-ⅱ)分子不完全匹配的小鼠心脏移植慢性排斥反应模型,研究利拉鲁肽对移植心脏急性排斥和慢性排斥的影响并探讨其可能机制。
本发明的目的在于提供利拉鲁肽在制备治疗急慢性移植排斥反应药物中的应用,为移植排斥的治疗提供一种新的药品。
进一步地,所述急慢性移植排斥反应中的移植物为心脏、肺部或肾脏。
进一步地,所述药物为皮下注射药物。
进一步地,利拉鲁肽的使用剂量为75μg/kg-300μg/kg,每天给药两次。优选地,利拉鲁肽以100μg/kg-200μg/kg的剂量、或者以200μg/kg-300μg/kg的剂量使用,每天给药两次。具体的剂量可为75μg/kg、100μg/kg、150μg/kg、200μg/kg、250μg/kg、300μg/kg。
利拉鲁肽除用于单一治疗外,还可与其他活性物质结合使用,借此可获得改良的治疗结果。
本发明的有益效果:
研究证实glp-1可以通过作用于内皮细胞上glp-1受体,从而保护内皮细胞功能,而内皮细胞功能完整性与慢性移植排斥的发生及进展密切相关。本发明通过实验证明利拉鲁肽可以通过供体内皮细胞上glp-1受体来发挥作用,下调黏附分子表达,抑制移植心脏炎性浸润,抑制内皮向间质转化,从而改善移植物血管病及移植后纤维化进展,最终缓解或治疗慢性移植排斥反应。利拉鲁肽可运用于慢性移植排斥反应药物中,改善移植物血管病的治疗。
另外,本发明通过实验证明利拉鲁肽可以通过降低效应t细胞活性,改善急性移植排斥反应,延长移植物存活,利拉鲁肽可以用于制备治疗急性移植排斥的药物。
综上所述,本发明为探索新的免疫抑制剂提供新的视角,与其他免疫抑制剂相比,利拉鲁肽没有明显的副作用。实验证明,利拉鲁肽可以改善移植物急性或者慢性排斥反应进程对器官移植患者、尤其是那些合并糖尿病患者的治疗和存活。
附图说明
图1-a为实施例1移植8周后两组心脏标本的外观对比图;图1-b为实施例1移植8周后两组心脏标本的evg染色对比图;图1-c为实施例1移植8周后两组心脏标本的血管病评分柱状对比图;图1-d为实施例1移植8周后两组心脏标本的masson染色对比图;图1-e为实施例1移植8周后两组心脏标本的纤维化面积百分比柱状对比图。
图2-a为实施例1移植8周后两组心脏标本中glp-1r的westernblot对比图;图2-b为实施例1移植8周后两组心脏标本的glp-1r蛋白含量柱状对比图;图2-c为检测实施例1移植8周后两组心脏标本中glp-1r表达和分布的免疫荧光对比图;图2-d为实施例1移植8周后两组心脏标本中glp-1r+cd31+双染的细胞相对于所有glp-1r+细胞的百分比柱状对比图;图2-e为实施例1移植8周后两组心脏标本中glp-1r+cd31+双染的细胞相对于所有cd31+细胞的百分比柱状对比图。
图3-a为实施例1移植2周后两组心脏标本的炎性细胞免疫组化对比图;图3-b为实施例1移植8周后两组心脏标本的炎性细胞免疫组化对比图;图3-c为实施例1移植2周和8周后两组心脏标本的cd4+细胞核分裂像计数对比图;图3-d为实施例1移植2周和8周后两组心脏标本的cd8+细胞核分裂像计数对比图;图3-e为实施例1移植2周和8周后两组心脏标本的cd11b细胞核分裂像计数对比图;图3-f为实施例1移植2周后两组心脏标本的vcam-1和mcp-1免疫组化对比图;图3-g为实施例2细胞试验一中六组细胞标本的vcam-1相对mrna表达量对比图。
图4-a为实施例1移植8周后两组心脏标本的tgf-β1免疫组化对比图;图4-b为实施例1移植8周后两组心脏标本的tgf-β1表达量柱状对比图;图4-c为检测实施例1移植8周后两组心脏标本间质中endmt的免疫荧光对比图;图4-d为检测实施例1移植8周后两组心脏标本血管周围endmt的免疫荧光对比图;图4-e为实施例1移植8周后两组心脏标本中cd31+α-sma+双染的细胞相对于所有cd31+细胞的百分比柱状对比图;图4-f为实施例1移植8周后两组心脏标本中cd31+α-sma+双染的细胞相对于所有α-sma+细胞的百分比柱状对比图;图4-g为实施例1移植8周后两组心脏标本中α-sma+细胞相对于所有心脏细胞的百分比柱状对比图;图4-h为实施例1移植8周后两组心脏标本的α-sma和cd31westernblot对比图;图4-i为实施例1移植8周后两组心脏标本的α-sma蛋白含量柱状对比图;图4-j为实施例1移植8周后两组心脏标本的cd31蛋白含量柱状对比图。
图5-a为实施例2细胞实验二第(1)组实验中四组细胞标本的cd31和α-sma免疫荧光对比图;图5-b为实施例2细胞实验二第(1)组实验中四组细胞标本的cd31和α-sma的westernblot对比图;图5-c为实施例2细胞实验二第(1)组实验中四组细胞标本的α-sma蛋白含量柱状对比图;图5-d为实施例2细胞实验二第(1)组实验中四组细胞标本的cd31蛋白含量柱状对比图;图5-e为实施例2细胞实验二第(1)组实验中四组细胞标本的p-akt、t-akt、p-smad3、t-smad3的westernblot对比图;图5-f为实施例2细胞实验二第(1)组实验中四组细胞标本的p-smad3/t-smad3比率柱状对比图;图5-g为实施例2细胞实验二第(1)组实验中四组细胞标本的p-akt/t-akt比率柱状对比图。
图6为为实施例3三组受体小鼠的存活时间对比图。
图7-a为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd4+记忆性t细胞及cd8+记忆性t细胞的比例对比图;图7-b为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd4+记忆性t细胞的百分比柱状对比图;图7-c为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd8+记忆性t细胞的百分比柱状对比图;图7-d为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd4+th1细胞及cd8+th1细胞的比例对比图;图7-e为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd4+中ifn-γ+细胞的百分比柱状对比图;图7-f为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd8+中ifn-γ+细胞的百分比柱状对比图。
图8-a为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd4+th2细胞及cd8+th2细胞的比例对比图;图8-b为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd4+中il-4+细胞的百分比柱状对比图;图8-c为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd8+中il-4+细胞的百分比柱状对比图;图8-d为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd4+th17细胞及cd8+th17细胞的比例对比图;图8-e为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd4+中il-17+细胞的百分比柱状对比图;图8-f为实施例3移植7天后三组受体小鼠的脾脏淋巴细胞cd8+中il-17+细胞的百分比柱状对比图。
图9-a为实施例3受体小鼠脾脏来源的细胞与供体来源的脾脏淋巴细胞(γ射线35gy照射)共培养(1:1)48小时后th1(ifn-γ+)细胞的比例对比图;图9-b为受体小鼠脾脏来源的细胞与供体来源的脾脏淋巴细胞(γ射线35gy照射)共培养(1:1)48小时后cd4+细胞中ifn-γ+细胞的百分比柱状对比图;图9-c为受体小鼠脾脏来源的细胞与供体来源的脾脏淋巴细胞(γ射线35gy照射)共培养(1:1)48小时后cd8+细胞中ifn-γ+细胞的百分比柱状对比图。
图10-a为实施例3移植7天后三组受体小鼠脾脏cd4+t细胞中treg(cd25+foxp3+)细胞的比例对比图;图10-b为实施例3移植7天后三组受体小鼠脾脏cd4+细胞中foxp3+细胞的百分比柱状对比图。
图11-a为实施例3移植7天后三组受体小鼠心脏标本的he染色对比图及免疫组化对比图;图11-b为实施例3移植7天后三组受体小鼠心脏标本的cd4+细胞核分裂像计数对比图;图11-c为实施例3移植7天后三组受体小鼠心脏标本的cd8+细胞核分裂像计数对比图;图11-d为实施例3移植7天后三组受体小鼠心脏标本的foxp3+细胞核分裂像计数对比图。
具体实施方式
以下结合附图详细说明本发明的实施情况,但它们不构成对本发明的限定,仅作举例而已。同时通过和具体实施对本发明作进一步的详细描述。同时通过说明,本发明的优点将变得更加清楚和容易理解。
缩写词
glp-1:胰高血糖素样肽-1
glp-1r:胰高血糖素样肽-1受体
liraglutide:利拉鲁肽
vehicle:媒介物
mhc-ⅱ:主要组织相容性二类抗原
bm12:b6.c-h2bm12/khegj
endmt:内皮向间质转化
evg:弹性纤维染色
masson:马森三色染色法
interstitial:间质
prevascular:血管周围
dapi:6-二脒基-2-苯基吲哚
α-sma:α-平滑肌肌动蛋白
hpf:高倍视野
mcp-1:单核细胞趋化蛋-1
vcam-1:血管细胞粘附分子-1
tgf-β1:转化生长因子-β1
hcaec:人原代冠状动脉内皮细胞
ecm:内皮细胞培养基
tnf-α:肿瘤坏死因子-α
ex9-39:glp-1受体拮抗剂
实验选用8周龄的雄性c57bl/6j小鼠作为受体,8周龄的雄性balb/c小鼠或b6.c-h2bm12/khegj(bm12)小鼠作为心脏供体。所用小鼠均为spf级,其中c57bl/6j及balb/c小鼠购于北京华阜康公司,b6.c-h2bm12/khegj(bm12)小鼠购于美国jackson实验室。小鼠饲养于华中科技大学同济医学院附属同济医院器官移植研究所动物实验中心屏障环境中,受华中科技大学同济医学院动物中心伦理委员会监管。实验小鼠每两只喂养于塑料笼中,给予标准饮食和正常饮水,室温控制在20~25℃,相对湿度50~60%,12小时光照循环。
供体小鼠麻醉满意后,正中切口进入腹腔,经下腔静脉静推注0.2ml肝素钠,使供体小鼠全身肝素化。约1min后,剪断腹主动脉放血,摘取供体心脏,置于4℃生理盐水中保存。将受体小鼠麻醉后,剃去腹部鼠毛,于下腔静脉近心端和远心端各置1根阻断带,行供心主动脉和受体腹主动脉端侧吻合,再行肺动脉和下腔静脉端侧吻合,吻合完毕后,先开放远端血流,后松开近端阻断带。将肠管复位后,分两层连续缝合关闭腹腔。小鼠多在术后10~30min苏醒。给予保暖,单笼饲养,不禁饮食。每天通过视、触诊观察供心的搏动情况。如供心有搏动,而且小鼠存活2d以上者视为手术成功。
实施例1慢性移植排斥反应研究中的小鼠心脏移植实验
手术前一天开始给连续予利拉鲁肽(300μg/kg/12h),直至实验终止,对照组给予等体积的生理盐水。实验选用8周龄的雄性bm12小鼠作为供体,c57bl/6j作为受体,将受体小鼠随机分为2组,移植对照组(皮下注射等量生理盐水);移植+利拉鲁肽处理组(皮下注射利拉鲁肽。移植术后观察小鼠移植心脏跳动,2周时取一批小鼠移植心脏,做炎性细胞免疫组化检测,比较各组小鼠移植心脏组织结构及炎性细胞浸润情况;8周时取一批小鼠移植心脏,做免疫荧光,免疫组化,western等检测,比较各组中移植物血管病发生及间质纤维化进展情况,同时评估glp-1受体在移植心脏中分布及与纤维化相关的内皮向间质转化(endmt)的发生情况。
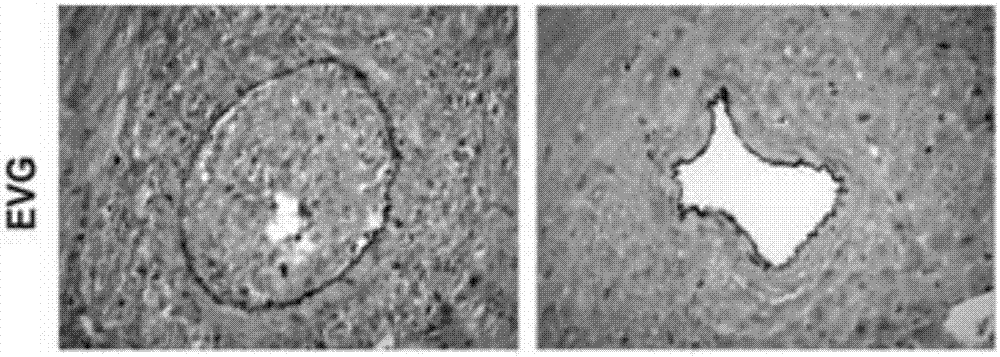
图1-a至图1-e为利拉鲁肽对移植后移植物血管病及间质纤维化分析结果。其中图1-a显示了移植后8周的移植心脏,对照组移植心肿大发硬,利拉鲁肽处理组心脏变得小且柔软。图1-b的evg染色结果显示利拉鲁肽显著改善了移植物血管病。图1-c显示利拉鲁肽组中移植物血管病评分减低(利拉鲁肽,1.22±0.26;对照,2.33±0.23,p<0.05)。图1-d和图1-e则证明利拉鲁肽组中,间质以及血管周围纤维化程度明显减轻(利拉鲁肽,13.76±1.493;对照,22.82±2.67,p<0.05)。*p<0.05vs.对照组(vehicle)。
图2-a至图2-e为glp-1受体在移植心脏上的分布情况及利拉鲁肽对其调节作用。图2-a和图2-b为westernblot结果,其显示利拉鲁肽处理组glp-1受体较对照组高,约为对照组2.71倍。图2-c的免疫荧光结果印证了westernblot结果。图2-d证明在移植物中glp-1r+cd31+双染的细胞在移植心中占所有glp-1r+细胞50%以上,但两组之间并无差异。图2-e则发现利拉鲁肽上调了内皮细胞上glp-1受体的表达。ns示无差异;*p<0.05vs.对照组(vehicle)。
图3-a至3-g为利拉鲁肽对移植心脏炎症细胞浸润以及对供心血管内皮细胞黏附分子表达的影响。图3-a至图3-e分别为2周和8周时cd4,cd8,cd11b等炎性细胞浸润情况,由图可发现,2周时利拉鲁肽表现出炎症减轻的趋势,以cd4及cd11b细胞浸润减少为主,8周时利拉鲁肽组中炎性细胞浸润显著减少。同时,图3-g显示,2周时,移植心脏中血管内皮细胞表达黏附分子减少,趋化因子mcp-1表达下调。ns示无差异,*p<0.05vs.对照组(vehicle)。
图4-a至图4-j显示了利拉鲁肽对移植心脏中内皮向间质转化(endmt)的作用。图4-a和图4-b显示利拉鲁肽下调移植心脏中tgf-β1的表达(p<0.05)。图4-c和4-d显示间质及小动脉中利拉鲁肽抑制移植植物中内皮向间质转化,从而抑制纤维化的发生和发展。图4-e表示移植心中正在发生endmt的内皮细胞的比例,两组有统计学差异(p<0.05)。图4-f表示发生endmt的间质表型的细胞占所有α-sma阳性细胞的比例,两组间有统计学差异(p<0.05)。图4-g表示两组间纤维化发生的程度,两组间有明显的统计学差异(p<0.001)。图4-h、4-i和4-j为western实验结果,其进一步证实了利拉鲁肽能抑制endmt的发生。*p<0.05;**p<0.001vs.对照组(vehicle)。
实施例2慢性移植排斥反应研究中的细胞实验
人原代冠状动脉内皮细胞(hcaec)至于内皮细胞培养基(ecm)中,并添加生长因子,5%的胎牛血清,100单位/ml青霉素及100μg/ml链霉素的dmem培养液中,于37℃、5%co2培养箱中孵育,细胞传代用0.25%胰蛋白酶消化细胞。隔两天换液,至细胞贴壁生长至亚融合状态(达到底面积的75%~80%)传代,选3-15代细胞进行实验。干预前先用无血清培养基平衡6小时后给予不同刺激。
细胞实验一:
分组如下:
c:无任何干预;
l:给予利拉鲁肽刺激(100nm);
e:给予ex9-39(1μm);
t:给予tnf-α(10ng/ml)
l+t:给予tnf-α(10ng/ml)+利拉鲁肽刺激(100nm);
l+t+e:给予tnf-α(10ng/ml)+ex9-39(1μm)+利拉鲁肽刺激(100nm)。
如上刺激16小时后行实时定量pcr(q-pcr)检测vcam-1的mrna表达水平。图3-g显示利拉鲁肽通过glp-1受体下调黏附分子vcam-1的表达。未给予tnf-α刺激的试验组中,vcam-1的表达量极少,在给予tnf-α刺激后,黏附分子在mrna上进行表达,给予利拉鲁肽刺激的组(l+t和l+t+e)尽管都可以下调黏附分子的表达,但l+t+e组中由于gcp-1r拮抗剂ex9-39的作用,其下调水平不如l+t组好。由此可见,内皮细胞中黏附分子的表达可以在利拉鲁肽的作用下得到明显的降低。
细胞实验二:
分组如下:
sham:无任何干预;
vehicle:给予tgf-β1(10ng/ml)刺激;
liraglutide:给予tgf-β1(10ng/ml)+利拉鲁肽刺激(100nm);
liraglutide+ex9-39:给予tgf-β1(10ng/ml)+利拉鲁肽刺激(100nm)
+ex9-39(1μm)。
第(1)组实验:如上刺激72小时后行免疫荧光、及α-sma、cd31、westernblot检测;
第(2)组实验:刺激1小时后行p-akt、t-akt、p-smad3、t-smad3的westernblot检测。
图5-a至5-d为第(1)组实验的测试结果,其中图5-a为免疫荧光检测结果,其显示利拉鲁肽能抑制tgf-β1诱导的α-sma的上调及cd31的下调,提示利拉鲁肽能明显抑制冠状动脉内皮细胞endmt,图5-b、5-c和5-d为westernblot检测结果,其进一步印证了免疫荧光的结果。
图5-e、5-f和5-g为第(2)组实验的测试结果,表示利拉鲁肽通过抑制smad-3及akt的磷酸化从而抑制endmt的发生,并且该效应是通过glp-1受体依赖的途径起作用的。
综合实施例1和实施例2的数据说明:利拉鲁肽可以通过供体内皮细胞上glp-1受体来发挥作用,下调黏附分子表达,抑制移植心脏炎性浸润,抑制内皮向间质转化,从而,改善移植物血管病及移植后纤维化进展,最终慢性移植排斥反应。利拉鲁肽可用于制备慢性移植排斥反应药物中。
实施例3急性移植排斥反应研究中的小鼠心脏移植实验
实验选用8周龄的雄性c57bl/6j小鼠作为受体,将受体小鼠随机分为3组,移植对照组(皮下注射等量生理盐水);移植+glp-1处理组(皮下注射利拉鲁肽200μg/kg);移植+glp-1r拮抗剂ex-9-(39)(皮下注射利拉鲁肽200μg/kg+ex-9-(39))。雄性balb/c小鼠作为心脏供体,移植术后观察小鼠移植心脏跳动情况至心脏停跳,做小鼠移植心脏生存分析;每组小鼠取3只于术后第7天取小鼠脾脏,检测小鼠cd4+与cd8+记忆性t细胞、th1、th2、th17及treg的比例,并体外将受体脾脏细胞与供体脾脏细胞进行混合培养,体外检测混合培养体系中th1比例。并取小鼠移植心脏,做he检测及炎性细胞免疫组化检测,比较各组小鼠移植心脏组织结构及炎性细胞浸润情况。
图6为各组小鼠移植心脏存活时间,可见利拉鲁肽显著延长了移植心脏的存活时间。利拉鲁肽干预将对照组移植心脏平均存活时间8天延长为12天,当给予glp-1r拮抗剂后,小鼠移植心脏存活时间显著减少。图中:利拉鲁肽干预组lgvs.对照组con=0.0001;利拉鲁肽干预组lgvs.glp-1r拮抗剂lg+ex-(9-39)=0.0029,glp-1r拮抗剂lg+ex-(9-39)vs.对照组con=0.2425>0.05。
图7-a、7-b和7-c为心脏移植术后7天,流式检测受体小鼠脾脏淋巴细胞cd4+及cd8+记忆性t细胞的比例,图7-d、7-e和7-f为心脏移植术后7天,流式检测受体小鼠脾脏淋巴细胞cd4+及cd8+th1细胞的比例。由图可见,利拉鲁肽处理的小鼠组,cd4+及cd8+记忆性t细胞比例较对照组显著降低,应用glp-1r拮抗剂后,glp-1r拮抗剂阻断了利拉鲁肽降低记忆性t细胞生成的作用。th1细胞的变化趋势与记忆性t细胞变化趋势一致。图中:ns示无差异,*代表p<0.05,**代表p<0.01,***代表<0.001。
图8-a、8-b和8-c为心脏移植术后7天,流式检测受体小鼠脾脏淋巴细胞th2细胞比例,图8-d、8-e和8-f为心脏移植术后7天,流式检测受体小鼠脾脏淋巴细胞th17细胞比例。由图可见,三组小鼠脾脏细胞中th2及th17均无显著差异。图中:ns示无差异。
图9-a、9-b和9-c为受体小鼠脾脏来源的细胞与供体来源的脾脏淋巴细胞(γ射线35gy照射)共培养(1:1)48小时,流式检测th1(ifn-γ+)细胞比例。由图可见,利拉鲁肽干预组脾脏中th1细胞比例显著降低,给予glp-1r拮抗剂lg+ex-(9-39)后,th1细胞比例又显著升高,和对照组无显著差异。图中:ns示无差异,*代表p<0.05,**代表p<0.01,***代表<0.001。
图10-a和图10-b为各组小鼠脾脏cd4+t细胞中treg(cd25+foxp3+)细胞的比例,可见三组小鼠中treg细胞不显著差异。图中:ns示无差异。
图11-a、11-b、11-c和11-d为he及免疫组化检测各组小鼠移植心脏组织结构病理变化及cd4+、cd8+t和treg(foxp3+)细胞浸润情况,由图可见,利拉鲁肽治疗组移植心脏组织结构完整,心肌坏死及浸润的炎性细胞较空白对照组及glp-1r拮抗剂lg+ex-(9-39)和glp-1合并干预组得到明显的改善;免疫组化可见glp-1干预后浸润的cd4+t和cd8+t显著减少,在三组中,foxp3+treg无显著差异。图中:ns示无差异,*代表p<0.05,**代表p<0.01。
综合以上数据说明:利拉鲁肽可以通过降低效应t细胞活性来改善急性移植排斥反应,延长移植物存活,利拉鲁肽可以用于制备急性移植排斥反应药物。
- 还没有人留言评论。精彩留言会获得点赞!