间充质干细胞分泌的外泌体在生物制剂中的应用的制作方法
本发明属于生物
技术领域:
,具体涉及间充质干细胞分泌的外泌体的应用。
背景技术:
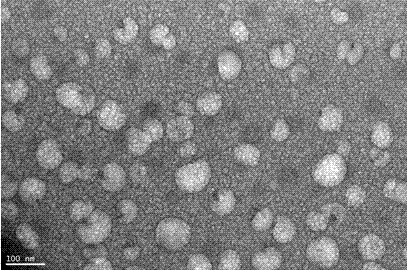
皮肤缺损是外科常见疾患,在各临床医院屡见不鲜,缺损皮肤需经过炎性细胞的趋化、肉芽组织的形成、局部成纤维细胞的增殖、角质形成细胞的迁移等几个过程,只有些步骤顺利完成才能使得创面皮肤得以完整的恢复,新的研究发现,角质化细胞生长因子(kgf)蛋白的表达,可促进损伤皮肤的愈合。目前临床常见的方法主要是皮肤移植,但其不可避免让患者再次形成新的损伤。间充质干细胞(msc)是具有自我更新能力的多潜能细胞,msc移植治疗多种疾病的研究报道越来越多,后来研究者证实有msc分泌的营养因子-外泌体,以内分泌和旁分泌的方式促进组织修复。间充质干细胞分泌的外泌体作为间充质干细胞分泌的一种有效生物学活性物质越来越受到关注。外泌体较易与邻近细胞的细胞膜发生融合,将生物学活性物质选择性地递送至受体细胞,在不同细胞间进行信息传递,调节细胞间的信号传导,发挥多种生物学功能。它是真核细胞的多泡内涵体与质膜融合后,以胞吐的方式释放到胞外环境中纳米量级的膜性小囊泡,其内含有大量不同种类的蛋白质、脂质成分以及核酸,其中以microrna为主。后续的研究又证实由于外泌体的包裹作用,使得其中的microrna不仅能对抗核糖核酸酶(rnase)的作用,而且在不同酸碱环境、缺氧、高温、反复冻融等恶恶劣条件下仍能保持较高稳定性,目前研究表明间充质干细胞分泌的外泌体携带的蛋白质、信使核糖核酸(mrna)和微小核糖核酸(mirna)与机体及细胞的生理疾病状态密切相关,释放至细胞外面的外泌体参与一系列生物过程,如免疫应答、凋亡、血管生成、炎症反应、凝结过程、抗原提呈和治疗受损器官等,因此,利用间充质细胞分泌的外泌体治疗疾病的研究也收到广泛关注,例如cn201510915717利用间充质干细胞分泌的外泌体治疗丙型肝炎,cn105861430a利用优化的脐带间充质干细胞分泌的外泌体治疗脓毒症,但目前关于间充质干细胞分泌的外泌体治疗皮肤损伤或促进损伤皮肤愈合,还未见报道。如何能使缺损皮肤尽快修复愈合,又避免损伤完整健康的皮肤,已成为临床医生迫切需要解决的难题。技术实现要素:本发明针对现有技术在治疗皮肤损伤时,易造成患者新的损伤的缺陷,提供了间充质干细胞在治疗皮肤损伤的生物制剂或促进皮肤伤口愈合的生物试剂中的应用。本发明的目的可通过以下技术措施来实现:间充质干细胞分泌的外泌体在生物制剂中的应用,其不同之处在于,所述生物制剂包括治疗皮肤损伤的生物制剂或促进皮肤伤口愈合的生物制剂。上述技术方案中,所述间充质干细胞分泌的外泌体以下方法制备:步骤(1)将间充质干细胞进行传代培养,从中筛选出细胞状态良好、增殖能力强的间充质干细胞;步骤(2)将步骤(1)中选取的间充质干细胞使用空培养基进行培养,培养后,去除杂质,分离出培养上清液;步骤(3)将步骤(2)所述培养上清液与外泌体提取液混合后进行孵育,孵育后得第一孵化液,对第一孵化液进行离心浓缩,得到含外泌体的浓缩液;步骤(4)将步骤(3)所述含外泌体的浓缩液加入无菌pbs溶解后加入外泌体提取液进行孵育,孵育后得第二孵化液,将第二孵化液进行离心收集底部沉淀,得间充质干细胞外泌体。上述技术方案中,所述间充质干细胞为脐带间充质干细胞、骨髓间充质干细胞或外周血间充质干细胞中的一种。上述技术方案中,所述间充质干细胞分泌的外泌体制备步骤(2)通过以下步骤完成:步骤2a:将不含外泌体血清的空白干细胞ɑ-mem培养基加入步骤(1)所述筛选的间充质干细胞中,24小时至48小时后收取细胞培养上清液即为条件培养基;步骤2b:将步骤2a中所述条件培养基在4℃,2000g条件下离心30min,弃去沉淀杂质,收集上层液体,即培养上清液。上述技术方案中,所述间充质干细胞分泌的外泌体制备步骤(3)通过以下步骤完成:步骤3a:将步骤2b中所述培养上清液与totalexosomeisolation外泌体提取液以体积比为2:1进行混合后,在4℃条件下孵育过夜,孵育后得到第一孵育液;步骤3b:将步骤3a所得第一孵育液在1℃至4℃,10000g条件下离心60min,所得肉眼不可见的底部沉淀,即为含外泌体的浓缩液。上述技术方案中,所述间充质干细胞分泌的外泌体制备步骤(4)通过以下步骤完成:4a:将步骤3b中所述含外泌体的浓缩液用磷酸缓冲盐溶液(pbs)进行溶解,得到外泌体盐溶液;4b:在步骤4a所述外泌体盐溶液中加入外泌体提取液,在4℃条件下孵育1小时至12小时,所述外泌体盐溶液与totalexosomeisolation外泌体提取液的体积比为2:1,孵育后得到第二孵育液;4c:将步骤4b中所述第二孵育液在4℃,10000g条件下离心60min,所得下层肉眼不可见的沉淀即为间充质干细胞分泌的外泌体。与现有技术相比,本发明的有益效果在于,通过间充质干细胞分泌的外泌体在生物制剂中的应用,显著上调创面角质化细胞生长因子(kgf)蛋白的表达,从而达到促进皮肤伤口愈合的目的;通过间充质干细胞分泌的外泌体在生物制剂中的应用,也有效解决了临床皮肤预后损伤的问题。附图说明图1为间充质干细胞外泌体的电镜检测图;图2为流式细胞仪检测间充质干细胞的特异性标志物cd63、cd81的检测图;图3为间充质干细胞外泌体的高分辨率显微成像;图4为he染色图;图5为免疫组化sabc法检测kgf蛋白的表达图。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,下面结合附图和具体实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。间充质干细胞分泌的外泌体的制备:步骤(1)将间充质干细胞进行传代培养,从中筛选出细胞状态良好、增殖能力强的间充质干细胞;步骤(2)将步骤(1)中选取的间充质干细胞使用空培养基进行培养,培养一段时间后,去除杂质,分离出培养上清液;步骤(3)将步骤(2)所述培养上清液与外泌体提取液混合后进行孵育,孵育后得第一孵化液,对第一孵化液进行离心浓缩,得到含外泌体的浓缩液;步骤(4)将步骤(3)所述含外泌体的浓缩液加入无菌pbs溶解后加入外泌体提取液进行孵育,孵育后得第二孵化液,将第二孵化液进行离心收集底部沉淀,得间充质干细胞外泌体。优选地,所述间充质干细胞为脐带间充质干细胞、骨髓间充质干细胞或外周血间充质干细胞中的一种。优选地,所述间充质干细胞分泌的外泌体制备步骤(1)通过以下步骤完成:用无菌瓶(200ml生理盐水+1%青链霉素)取新生儿的新鲜脐带,用无菌剪刀分离血管周围的沃顿胶(wharton’sjelly),剪碎,加入15ml浓度为2mg/mlⅰ型胶原酶中(约15ml);加入200μl的双抗和200μl的两性霉素b,混合均匀后置于37℃培养箱中过夜;取出后视胶原酶消化情况而定,加入10ml0.25%胰酶,再次置于37℃培养箱中消化30min;取出,用生理盐水稀释4~6倍后3000rpm离心15~20min;弃上清,加干细胞培养基混悬后转入2个150mm培养皿中,每皿加1ml干细胞专属添加剂,置5%co2、37℃饱和湿度培养;待7至10日后可见间充质干细胞爬出组织,去除组织块后以胰蛋白酶消化进行传代培养,培养后选取细胞状态良好、增殖能力强的第3至5代间充质干细胞。优选地,所述间充质干细胞分泌的外泌体制备步骤(2)通过以下步骤完成:步骤2a:将不含外泌体血清的hylone公司的空白干细胞ɑ-mem培养基加入步骤(1)所述筛选的间充质干细胞中,24小时至48小时后收取细胞培养上清液即为条件培养基;步骤2b:将步骤2a中所述条件培养基在4℃,2000g条件下离心30min,弃去沉淀杂质,收集上层液体,即培养上清液。优选地,所述间充质干细胞外泌体制备步骤(3)通过以下步骤完成:步骤3a:将步骤2b中所述培养上清液与invitogen公司totalexosomeisolation外泌体提取液以体积比为2:1进行混合后,在4℃条件下孵育过夜,孵育后得到第一孵育液;步骤3b:将步骤3a所得孵育液在1℃至4℃,10000g条件下离心60min,所得肉眼不可见的底部沉淀,即为含外泌体的浓缩液。优选地,所述间充质干细胞分泌的外泌体制备步骤(4)通过以下步骤完成:步骤4a:将步骤3b中所述含外泌体的浓缩液用磷酸缓冲盐溶液(pbs)进行溶解,得到外泌体盐溶液;步骤4b:在步骤4a所述外泌体盐溶液中加入外泌体提取液,在4℃条件下孵育1小时至8小时,所述外泌体盐溶液与invitogen公司totalexosomeisolation外泌体提取液的体积比为2:1,孵育后得到第二孵育液;4c:将步骤4b中所述第二孵育液在4℃,10000g条件下离心60min,所得下层肉眼不可见的沉淀即为间充质干细胞分泌的外泌体。间充质干细胞外泌体的鉴定:(1)间充质干细胞外泌体的电镜检测:图1为间充质干细胞外泌体的电镜检测图。(2)间充质干细胞外泌体的流式检测:将收集的外泌体用200ulpbs溶解后;加入20ulcd83,5ulcd61,避光孵育半小时,上机检测;图2为流式细胞仪检测间充质干细胞的特异性标志物cd63、cd81的检测图,结果外泌体特异性标志物cd63、cd81均阳性高表达。(3)间充质干细胞外泌体的高分辨率共聚焦成像:用pbs溶液将外泌体稀释20倍;分别加1ul(抗cd-63和抗cd-69),稀释20倍取100ul混合物在涂有poly-l-lysine的盖玻片,室温孵育1.5小时,pbs洗3次;添加二抗抗兔alexa647和抗鼠alexa750,稀释1000;室温孵育1.5小时,用0.1mol/l的dil脂膜染料染色5分钟;用pbs洗3次;图3为间充质干细胞外泌体的高分辨率显微成像,结果外泌体特异性标志物cd63、cd81均阳性高表达,证明了分离纯化的样品为外泌体。间充质干细胞分泌的外泌体修复皮肤损伤的疗效观察:(1)豚鼠皮肤损伤造模:豚鼠分组并建立皮肤损伤模型:分别剔除实验组及对照组大鼠背部体毛,水合氯醛0.5ml/100g剂量腹腔注射麻醉豚鼠;备皮区常规消毒,左右两侧各一块,中心部制作一个直径为1cm*1cm的正方形创面,需要深达至真皮层(真皮层不切),创面自然止血,不包扎;建模当天,选取造模成功、体重相近的豚鼠,随机分3组,每组四只,第一组治疗时间为3天,第二组治疗时间为7天,第三天治疗时间为14天,主要观察随之时间的延长,外泌体修复皮肤损伤的效果如何,每只豚鼠是同体对照,左边皮肤创面注射外泌体的实验组,右边注射生理盐水的空白对照。(2)配制间充质干细胞外泌体生理盐水悬液:配制密度为300μg/ml的间充质干细胞外泌体生理盐水悬液。(3)分组试验:组别注射试剂对照组100μl生理盐水实验组300μg/ml100μl间充质干细胞外泌体生理盐水悬液将试剂注射于实验组与对照组大鼠创面中心部位,动物普通饲养,正常饮食。(4)疗效观察:a:he染色及结果观察:取对照组与实验组处理后的3d、7d、14d的豚鼠背部创面全层皮肤组织,将其一半固定于40g/l多聚甲醛中,固定12h,制作石蜡切片;二甲苯脱蜡;梯度酒精脱水;苏木素染色1min,自来水洗10~30s;盐酸分化液分化1~3s,自来水洗10~30s;返蓝(45℃温水)15s;80%乙醇脱水;伊红染色1~2s,四步无水乙醇脱水每步10~30s,吹干,二甲苯中性树胶封片,显微镜下观察并对比两组创面愈合情况;图4为he染色图片,可看出实验组样品毛细血管增生明显,肉芽组织形成,创伤愈合明显优于对照组。b:免疫组化sabc法检测kgf蛋白的表达:取对照组与实验组处理后的3d、7d、14d的豚鼠背部创面及周围约正常组织的皮肤,将其固定于甲醛中,经脱蜡、水化,pbs洗,h2o2室温封闭5~10分钟,抗原修复,后滴加正常山羊血清封闭液,室温20分钟,滴加ⅰ抗,室温1小时,pbs洗三次,滴加生物素化二抗,20℃~37℃20分钟,pbc洗3次,滴加试剂sabc,20℃~37℃20分钟,pbs洗4次,dab显色、脱水、透明、封片、镜检;图5为免疫组化sabc法检测kgf蛋白的表达图片,结果显示7天左右痂下复层扁平上皮基本形成,创面角质化细胞生长因子(kgf)蛋白量明显高于对照组,14天左右表皮基本修复完成,形成的痂基本脱落,明显优于对照组。综上,间充质干细胞分泌的外泌体促进修复皮肤愈合的速度快于空白对照。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1