一种用于2型糖尿病治疗的纳米制剂及其制备方法与流程
本发明属于纳米生物技术领域,具体涉及一种用于2型糖尿病治疗的纳米制剂,本发明还涉及一种用于2型糖尿病治疗的纳米制剂的制备方法。
背景技术:
sirt1(sirtuin1)是一种存在于哺乳动物的沉默信息调节因子同源物。其为烟酰胺腺嘌呤二核苷酸依赖的组蛋白去乙酰化酶,能够调控多种细胞功能,如基因沉默、细胞周期、细胞凋亡及能量代谢紊乱。sirt1通常被认为一种长寿基因。sirt1在葡萄糖代谢的平衡及胰岛素敏感性具有重要的调节作用。srt1720是sirt1的特异性小分子激动剂,其激动效果是常用的sirt1非特异性激动剂白藜芦醇的1000倍。有研究在全球注明学术期刊《自然》上报道,srt1720能够显著改善二型糖尿病的症状。然而,srt1720由于在水相中的可溶性较差且毒性较大,导致该化合物的生物利用度低及临床应用前景黯淡。因此,降低srt1720毒性,提高其水溶性,增强生物利用度是srt1720开发为治疗糖尿病药物所必须的。
通过纳米药物载体可使非水溶性化合物在水溶液中有效分散,增加其在体内的稳定性,延长体内循环时间,从而有效提高药物的生物利用度,还可起到缓释和控释作用,可使血液或病灶部位一直维持较高的药物浓度。两亲性材料可通过自组装形成核壳式结构的纳米胶束,内核是疏水性超微结构,疏水性药物可被牢固的包裹在其中,而外壳则是由亲水骨架而构成,使得整个体系具有非常好的水溶液分散度。通过自组装方法就可比较容易的制备获得此类纳米药物载体。
普郎尼克
小分子化合物str1720在水中溶解度极差,从而导致其无法进一步发挥其在2型糖尿病治疗方面的作用,可通过普郎尼克所制备的纳米药物而解决。虽然普郎尼克可用于非水溶性药物的包裹,但是可用的纳米制剂必须包括良好包裹性能;足够小的粒径;在体内循环保持一定的稳定性;缓慢有效的释放包裹药物分子,具备长期保存能力。要同时满足上述条件十分困难,其他相关技术方法无法直接起到参考作用。例如,申请人前期公开了一种棉酚纳米制剂的制备方法(公开号:cn104523606a),但是更换药物之后所制备的纳米药物颗粒完全无法达到理想粒径,且载药性能也比较差,根本无法用于进一步应用。所以需要在新的构建工艺中结合实际经验不断探索测试,对关键节点进行优化和变革。
技术实现要素:
本发明的目的是提供一种用于2型糖尿病治疗的纳米制剂,解决了现有技术中存在的纳米制剂粒径达不到要求且载药性能比较差的问题。
本发明的另一目的是提供一种用于2型糖尿病治疗的纳米制剂的制备方法。
本发明所采用的第一技术方案是,一种用于2型糖尿病治疗的纳米制剂,按质量百分比由以下原料的有效组分组成:普郎尼克35%-45%,srt17207%-12%,冻干保护剂40%-60%,以上各组分的质量百分比之和为100%。
本发明第一技术方案的特点还在于,
普郎尼克规格包括:f68、f87、f108、f127。
本发明所采用的第二技术方案是,一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克35%-45%,srt17207%-12%,冻干保护剂40%-60%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720按照4:1的比例进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,滴入混合溶液后继续搅拌,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉。
本发明第二技术方案的特点还在于,
步骤2中过滤实用孔径为0.22微米的脂溶性滤膜。
步骤3中将混合溶液滴入生理盐水的搅拌速度控制在3-5ml/min。
步骤3中投入的srt1720与生理盐水的质量体积比为10mg:80ml,搅拌速度为1000-1500转/分钟。
步骤4中每次超声处理时间6-8秒,间隔时间3-4秒,总处理时间为10-15min,超声功率为300-500w。
步骤5中透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为12-24小时,期间更换外液生理盐水3-5次。
步骤6中纳米药载颗粒分散液的搅拌速度为200-400转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7中去除水分是在-70-80℃超低温冰箱预冻24-48小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
本发明的有益效果是,一种用于2型糖尿病治疗的纳米制剂及其制备方法,利用两亲性化合物普郎尼克对srt1720通过自组装方法制备出纳米级的药物载体颗粒。具体是利用能够与水任意比例混溶的二甲基亚砜将srt1720与包裹材料普郎尼克共同溶,再将混合溶液加入生理盐水中,之后通过超声处理直接获得稳定的纳米药载颗粒分散液,整个省去中间成膜、再分散等导致质量差异或者影响产率的步骤,之后利用透析的方法除去分散液中的二甲基亚砜和可溶性杂质,然后加入保护剂,最后通过冷冻干燥法将溶液中的水分去除,从而获得终产物——纳米制剂干粉。
附图说明
图1是本发明一种用于2型糖尿病治疗的纳米制剂的制备方法流程图;
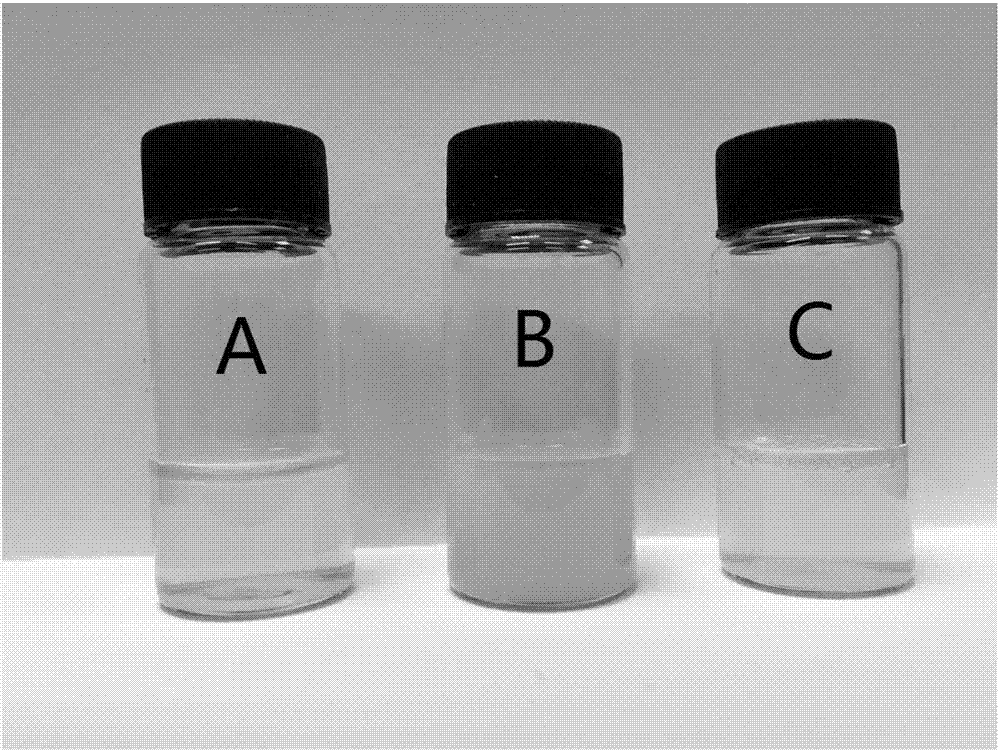
图2是本发明一种用于2型糖尿病治疗的纳米制剂的制备方法实施例1所制备普郎尼克包裹srt1720纳米制剂分散度情况比较图,其中a为冻干之前的纳米制剂溶液,b为srt1720水分散液对照组,c为冻干粉重溶后的纳米制剂溶液;
图3是本发明一种用于2型糖尿病治疗的纳米制剂的制备方法中实施例1普郎尼克包裹srt1720纳米制剂重溶后透射电子显微镜照片;
图4是本发明一种用于2型糖尿病治疗的纳米制剂的制备方法中实施例1普郎尼克包裹srt1720纳米制剂重溶后粒径分析结果图;
图5是本发明一种用于2型糖尿病治疗的纳米制剂的制备方法中实施例1所制备普郎尼克包裹srt1720纳米制剂溶液粒径稳定性测试结果图;
图6是本发明一种用于2型糖尿病治疗的纳米制剂的制备方法中实施例1所制备srt1720纳米制剂对自发性高血糖zuckerfa/fa大鼠模型血糖影响的实验结果;
图7是本发明一种用于2型糖尿病治疗的纳米制剂的制备方法中实施例1所制备srt1720纳米制剂对自发性高血糖zuckerfa/fa大鼠模型葡萄糖耐量影响的实验结果。
具体实施方式
下面结合附图和具体实施方式对本发明进行详细说明。
本发明一种用于2型糖尿病治疗的纳米制剂及其制备方法,利用两亲性化合物普郎尼克对srt1720通过自组装方法制备出纳米级的药物载体颗粒。具体是利用能够与水任意比例混溶的二甲基亚砜将srt1720与包裹材料普郎尼克共同溶,再将混合溶液加入生理盐水中,之后通过超声处理直接获得稳定的纳米药载颗粒分散液,整个省去中间成膜、再分散等导致质量差异或者影响产率的步骤,之后利用透析的方法除去分散液中的二甲基亚砜和可溶性杂质,然后加入保护剂,最后通过冷冻干燥法将溶液中的水分去除,从而获得终产物——纳米制剂干粉,如图1所示,具体如下:
本发明一种用于2型糖尿病治疗的纳米制剂,按质量百分比由以下原料的有效组分组成:普郎尼克35%-45%,srt17207%-12%,冻干保护剂40%-60%,以上各组分的质量百分比之和为100%,其中,普郎尼克规格包括:f68、f87、f108、f127,冻干保护剂包括甘露醇、羟乙基淀粉中的一种或者两种的混合物。
一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克35%-45%,srt17207%-12%,冻干保护剂40%-60%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720按照4:1的比例进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液,其中,过滤实用孔径为0.22微米的脂溶性滤膜;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,生理盐水的搅拌速度控制在3-5ml/min,滴入混合溶液后的搅拌速度为1000-1500转/分钟,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴,每次超声处理时间6-8秒,间隔时间3-4秒,总处理时间为10-15min,超声功率为300-500w;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质,透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为12-24小时,期间更换外液生理盐水3-5次;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液,其中,纳米药载颗粒分散液的搅拌速度为200-400转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉,其中,去除水分是在-70-80℃超低温冰箱预冻24-48小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
本发明一种用于2型糖尿病治疗的纳米制剂,用灭菌纯水溶解,利用马尔文粒度仪测定其粒径,分析其性能:利用非离子型两亲性材料普郎尼克包裹构建srt1720的纳米制剂,以克服srt1720存在的水溶性差、生物利用度低等缺点。所获得的纳米药载颗粒具有稳定性好,包裹效率高,粒径均一等优势,能有效保证药物在体内的长效循环,显著降低用药剂量,可用于2型糖尿病治疗。其核心是针对多数普郎尼克制剂成分复杂,制备工艺繁琐的问题,直接利用普郎尼克构建一个在水环境下可以高度分散的srt1720纳米制剂,在不影响srt1720活性的情况下,提高其在水溶液中的分散度。所建立的工艺体系简单实用,各步骤均可进行精密的质量控制,获得的纳米药载颗粒具有非常高的包裹率和载药量,冻干后的制剂干粉可以稳定存放一年以上。
实施例1
一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克(f68)35%,srt17208.75%,冻干保护剂56.25%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液,其中,过滤实用孔径为0.22微米的脂溶性滤膜;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,生理盐水的搅拌速度控制在3ml/min,滴入混合溶液后的搅拌速度为1500转/分钟,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴,每次超声处理时间8秒,间隔时间4秒,总处理时间为10min,超声功率为300w;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质,透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为12小时,期间更换外液生理盐水5次;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液,其中,纳米药载颗粒分散液的搅拌速度为200转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉,其中,去除水分是在-70℃超低温冰箱预冻24小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
将本实施例所获得的部分纳米制剂干粉用灭菌纯水重新溶解,利用马尔文粒度仪测定其粒径。
本实施例所得srt1720纳米制剂,平均粒径为153±4.5nm,包裹率为93±3.6%。
参照图2可见,图2中标签为a的是冻干之前的纳米制剂溶液;标签为b的是srt1720水分散液对照组,因为该化合物不溶于水,其分散液浑浊,静置后有明显沉淀;标签为c的是溶解后的srt1720纳米制剂,较之冻干之前的纳米制剂基本一致,溶液整体清澈均匀;说明本实施例利用普郎尼克包裹制备纳米药载颗粒可以显著的增加非水溶性药物srt1720在水中的溶出度。粒径也符合治疗需要。
实施例2
一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克(f87)45%,srt172011.25%,冻干保护剂43.75%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液,其中,过滤实用孔径为0.22微米的脂溶性滤膜;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,生理盐水的搅拌速度控制在5ml/min,滴入混合溶液后的搅拌速度为1000转/分钟,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴,每次超声处理时间6秒,间隔时间3秒,总处理时间为15min,超声功率为500w;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质,透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为24小时,期间更换外液生理盐水3次;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液,其中,纳米药载颗粒分散液的搅拌速度为400转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉,其中,去除水分是在80℃超低温冰箱预冻48小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
将本实施例所获得的部分纳米制剂干粉用灭菌纯重新水溶解,利用马尔文粒度仪测定其粒径。
本实施例所得srt1720纳米制剂,平均粒径为160±5.3nm,包裹率为94±2.7%。
实施例3
一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克(f108)38%,srt17209.5%,冻干保护剂52.5%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液,其中,过滤实用孔径为0.22微米的脂溶性滤膜;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,生理盐水的搅拌速度控制在3ml/min,滴入混合溶液后的搅拌速度为1100转/分钟,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴,每次超声处理时间6秒,间隔时间3秒,总处理时间为12min,超声功率为320w;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质,透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为12小时,期间更换外液生理盐水3次;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液,其中,纳米药载颗粒分散液的搅拌速度为200转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉,其中,去除水分是在-90℃超低温冰箱预冻24小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
将本实施例所获得的部分纳米制剂干粉用灭菌纯水溶解,利用马尔文粒度仪测定其粒径。
本实施例所得srt1720纳米制剂,平均粒径为154±5.7nm,包裹率为93±4.9%。
实施例4
一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克(f68)39%,srt17209.7%,冻干保护剂51.3%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液,其中,过滤实用孔径为0.22微米的脂溶性滤膜;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,生理盐水的搅拌速度控制在5ml/min,滴入混合溶液后的搅拌速度为1200转/分钟,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴,每次超声处理时间7秒,间隔时间4秒,总处理时间为15min,超声功率为400w;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质,透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为18小时,期间更换外液生理盐水5次;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液,其中,纳米药载颗粒分散液的搅拌速度为280转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉,其中,去除水分是在10℃超低温冰箱预冻28小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
将本实施例所获得的部分纳米制剂干粉用灭菌纯水溶解,利用马尔文粒度仪测定其粒径。
本实施例所得srt1720纳米制剂,平均粒径为155±7.1nm,包裹率为92±3.8%。
实施例5
一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克(f87)40%,srt172010%,冻干保护剂50%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液,其中,过滤实用孔径为0.22微米的脂溶性滤膜;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,生理盐水的搅拌速度控制在4ml/min,滴入混合溶液后的搅拌速度为1300转/分钟,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴,每次超声处理时间6秒,间隔时间3.5秒,总处理时间为13min,超声功率为380w;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质,透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为20小时,期间更换外液生理盐水4次;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液,其中,纳米药载颗粒分散液的搅拌速度为300转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉,其中,去除水分是在30℃超低温冰箱预冻30小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
将本实施例所获得的部分纳米制剂干粉用灭菌纯水溶解,利用马尔文粒度仪测定其粒径。
本实施例所得srt1720纳米制剂,平均粒径为150±7.1nm,包裹率为91±4.3%。
实施例6
一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克(f108)41%,srt172010.25%,冻干保护剂48.75%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液,其中,过滤实用孔径为0.22微米的脂溶性滤膜;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,生理盐水的搅拌速度控制在5ml/min,滴入混合溶液后的搅拌速度为1500转/分钟,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴,每次超声处理时间8秒,间隔时间4秒,总处理时间为15min,超声功率为400w;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质,透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为21小时,期间更换外液生理盐水5次;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液,其中,纳米药载颗粒分散液的搅拌速度为350转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉,其中,去除水分是在40℃超低温冰箱预冻40小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
将本实施例所获得的部分纳米制剂干粉用灭菌纯水溶解,利用马尔文粒度仪测定其粒径。
本实施例所得srt1720纳米制剂,平均粒径为161±5.0nm,包裹率为91±4.9%。
实施例7
一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克(f127)42%,srt172010.5%,冻干保护剂47.5%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液,其中,过滤实用孔径为0.22微米的脂溶性滤膜;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,生理盐水的搅拌速度控制在4ml/min,滴入混合溶液后的搅拌速度为1400转/分钟,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴,每次超声处理时间7.5秒,间隔时间3.5秒,总处理时间为14min,超声功率为450w;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质,透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为22小时,期间更换外液生理盐水4次;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液,其中,纳米药载颗粒分散液的搅拌速度为380转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉,其中,去除水分是在60℃超低温冰箱预冻44小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
将本实施例所获得的部分纳米制剂干粉用灭菌纯水溶解,利用马尔文粒度仪测定其粒径。
本实施例所得srt1720纳米制剂,平均粒径为151±5.2nm,包裹率为92±6.6%。
实施例8
一种用于2型糖尿病治疗的纳米制剂的制备方法,具体按照以下步骤实施:
步骤1、称量原料:按质量百分比称取普郎尼克(f127)44%,srt172011%,冻干保护剂45%,以上各组分的质量百分比之和为100%;
步骤2、将普郎尼克与srt1720进行混合,再将混合物与二甲基亚砜按10mg:1ml的比例进行混合,并过滤除去杂质,制成混合溶液,其中,过滤实用孔径为0.22微米的脂溶性滤膜;
步骤3、将步骤2得到的混合溶液缓慢滴入高速搅拌状态下的生理盐水中,生理盐水的搅拌速度控制在5ml/min,滴入混合溶液后的搅拌速度为1100转/分钟,获得纳米药载颗粒分散液;
步骤4.利用探头式超声破碎仪对步骤3得到的纳米药载颗粒分散液进行超声处理,超声处理过程中一直保持冰浴,每次超声处理时间6秒,间隔时间3秒,总处理时间为14min,超声功率为450w;
步骤5.将经过步骤4超声处理后的纳米药载颗粒分散液进行透析,除去分散液中的二甲基亚砜溶剂和其他可溶性杂质,透析具体是将纳米药载颗粒分散液装入截留分子量为3.5kda的透析袋内,利用生理盐水透析,透析时间为12小时,期间更换外液生理盐水5次;
步骤6.将冻干保护剂缓慢加入快速搅拌状态下的纳米药载颗粒分散液中,待完全溶解之后再过滤除去其他非可溶性杂质及微生物,使用生理盐水最终定容,获得含srt1720为0.1mg/ml的纳米制剂溶液,其中,纳米药载颗粒分散液的搅拌速度为280转/min,过滤利用孔径为0.22微米的无菌水溶性滤膜。
步骤7.将纳米制剂溶液等量分装,去除水分获得最终纳米制剂干粉,其中,去除水分是在70℃超低温冰箱预冻46小时,再利用冷冻干燥机,压力低于0.1帕斯卡条件下进行。
将本实施例所获得的部分纳米制剂干粉用灭菌纯水溶解,利用马尔文粒度仪测定其粒径。
本实施例所得srt1720纳米制剂,平均粒径为157±5.1nm,包裹率为91±5.6%。
对所制备的srt1720纳米制剂的粒径分布及稳定性进行测定,并通过透射电子显微镜观察其形态特征,结果表明:该纳米制剂具有很高的稳定性,对药物包裹能力强,形态特征均一,单分散性良好,具体参见图2、图3、图4、图5。srt1720纳米制剂的体外sirt1通路激活能力进行了检测,结果发现相比于游离药物,该纳米制剂的激活能力更为明显。通过对大鼠糖尿病模型进行干预,结果发现该纳米制剂可在仅为游离药物五分之一的给药剂量下增强模型大鼠的糖代谢能力,降低血糖浓度,相比之下,srt1720直接给药组在非常高的给药剂量下仍无法达到纳米制剂组的治疗效果,参见图6及图7,其中,图6为所制备srt1720纳米制剂(20mg/kg,尾静脉给药,4周)对自发性高血糖zuckerfa/fa大鼠模型血糖影响的实验结果(注:由于srt1720不溶于生理盐水,无法进行静脉注射,因此,游离srt1720组中srt1720剂量为100mg/kg,灌胃给药,4周),图7为所制备srt1720纳米制剂(20mg/kg,尾静脉给药,4周)对自发性高血糖zuckerfa/fa大鼠模型葡萄糖耐量影响的实验结果(注:由于srt1720不溶于生理盐水,无法进行静脉注射,因此,srt1720组中srt1720剂量为100mg/kg,灌胃给药,4周),此外高剂量srt1720还存在心血管毒性。
前期预实验发现,使用常用的吐温及斯班系列医用或食品用非离子型表面活性剂无法形成稳定的srt1720纳米制剂,且还存在保存时间较短,不能制备冻干剂等问题。更为重要的是制剂质量控制无法无法达标。而本发明所使用的普郎尼克包材可有效克服srt1720纳米制剂制备中存在的不足。虽有不少相关的技术方案被公布,然而经过一系列预备实验发现,直接参考其他相关文件的工艺参数无法获得所需的纳米制剂。本发明依托前期经验,通过大量实验对试剂配比,制备工艺及辅料使用等关键参数进行反复测试修改,克服了其在制备过程中存在的稳定性不足和重复性较差的缺点,最终获得最优的制备工艺。保证了制剂的质量控制。
本发明一种用于2型糖尿病治疗的纳米制剂的制备方法,简便、高效、制备得到的用于2型糖尿病治疗的纳米制剂质量稳定,可有效克服srt1720本身存在的水溶性差、生物利用率低的问题,进一步推进其应用水平,具有非常好的使用前景。
- 还没有人留言评论。精彩留言会获得点赞!