治疗或预防肥胖或其相关疾病的化合物及其应用的制作方法
本发明涉及药物化学领域,更具体地涉及一种治疗或预防肥胖或其相关疾病的化合物及其应用。
背景技术:
肥胖,癌症,心血管疾病,神经退行性疾病等慢性疾病是现代人类社会的主要健康威胁,严重影响人体的健康和生活质量,同时也给社会带来巨大的经济压力。肥胖同时有心血管疾病,糖尿病,高血压等并发症。所以降低体重的药物治疗对于肥胖本身和肥胖相关的伴随症都是有利的,但是过去的几十年我们见证了太多的药物由于严重的毒副作用而被迫下市,比如导致肺动脉高压、心血管系统毒性、神经及精神问题。到现在为止,选择安全有效的治疗肥胖的药物依然面临严峻挑战。
肥胖,定义为个体脂肪过度积累,量化为体重指数(bmi,bodymassindex,bmi等于体重(kg)除以身高(m)的平方)大于30,已然是一个全球性的生物医学问题,虽然曾经主要流行在北美,欧洲等西方发达国家。然而根据世界卫生组织统计,全球大约13%的人口为肥胖人群,肥胖的人数从1980年的8.57千万到2013年的21千万,大约20年间总数翻了一倍。以特别严重的美国为例,2013-2014年间,总人口的大约1/3为肥胖人群,其中男性的肥胖率大约为35%,而女性的肥胖率则高达40%。肥胖伴随着一系列并发症,如2型糖尿病,心血管疾病和高血压,同时有着发生脂肪肝,肾疾病,中风,癌症,骨关节炎,不育等的高风险性,严重的影响了人体健康和生活质量,同时也给社会带来巨大的经济压力。目前主要有三种方式来应对肥胖问题:(1)生活方式的调整,如降低饮食,增加锻炼等,(2)手术治疗,如改变胃肠吸收的面积,从而降低能量输入,(3)药物治疗。但是用于治疗肥胖的药物的研发史是一个相当不成功的过程,几乎所有治疗肥胖的药物都伴随着严重的副作用,导致大部分药物上市后很快就下市。2,4-二硝基苯酚(dnp,2,4-dinitrophenol),最早于1933年报道有很好的减肥作用,当年,在美国有十万人使用,但由于伴随高热,心跳加速,神经反应,死亡等案例,它于1938年被叫停。胸腺激素(thyroidhormone)从上世纪50年代被用来治疗肥胖,后来发现降低的部分主要是非脂肪组织,主要是水含量减少,而且对心脏,肌肉及骨有副作用而下市。
leptin的发现掀起了肥胖与能量代谢的分子遗传学领域的研究热潮。leptin主要由白色脂肪组织(whiteadiposetissue,wat)中的脂肪细胞合成并分泌,leptin作用于大脑及外周各器官或组织,起着控制摄食、促进能量消耗、调节神经内分泌与免疫等功能,本来人们寄希望于用leptin治疗肥胖,但后来发现leptin本身并不适合用来治疗肥胖,很多肥胖病人血清leptin水平虽然相当高,但不发挥作用,表现为leptin阻抗或leptin不敏感。当前以leptin为目标的药物包括leptin的类似物如metreleptin(商品名myalept)以及leptin的增敏剂如雷公藤醇和糊精(amylin)。以leptin作为减肥药物开发的靶标会遇到leptin阻抗或leptin分子及信号途径失效等问题,因此寻找新的靶标至关重要。
可能由于营养摄入和储存对个体的生存来说是如此的重要,所以发展减肥药物去调控这个过程的道路才如此艰辛,这也使得肥胖药物市场有着巨大的空缺。虽然有很多的副作用,但是肥胖给人体的各个组织和器官如此大的压力和负担,所以对于很多肥胖的人而言,减轻体重是势在必行的。
因此,本发明迫切需要开发一种针对新靶点的用于减肥的小分子化合物。
技术实现要素:
本发明的目的在于提供一种针对新靶点的用于减肥的小分子化合物。
在本发明的第一方面,提供了一种式i化合物或其药学上可接受的盐的用途,用于制备一组合物或制剂,所述组合物或制剂用于治疗或预防肥胖或其相关疾病,
式中,r0为1、2或3个各自独立地选自下组的基团或取代基:h、卤素、取代或未取代的c1-c5烷基、取代或未取代的c2-c5链烯基、取代或未取代的c2-c5链炔基、取代或未取代的c3-c8环烷基、-oh、取代或未取代的-oc1-c5烷基、-nrarb、取代或未取代的苄基、或其组合;并且所述的取代指基团中的h被选自下组的一个或多个取代基所取代:卤素、-oh、-cn、-nh2、和硝基;
r1选自下组:h、取代或未取代的c1-c5烷基、取代或未取代的c2-c5链烯基、取代或未取代的c2-c5链炔基、取代或未取代的c3-c8环烷基、-oh、取代或未取代的苄基、或其组合;并且所述的取代指基团中的h被选自下组的一个或多个取代基所取代:卤素、-oh、-cn、-nh2、和硝基;
ra、rb各自独立地为h、c1-c5烷基。
在另一优选例中,各个r0可以相同,也可以不同。
在另一优选例中,r0为1个或2个各自独立地选自下组的基团或取代基:h、卤素、取代或未取代的c1-c4烷基、取代或未取代的c2-c4链烯基、取代或未取代的c2-c4链炔基、取代或未取代的c3-c6环烷基、-oh、取代或未取代的-oc1-c4烷基、-nrarb、取代或未取代的苄基、或其组合;并且所述的取代指基团中的h被选自下组的一个或多个取代基所取代:卤素、-oh、-cn、-nh2、和硝基;其中,ra、rb各自独立地为h、c1-c3烷基。
在另一优选例中,所述的r0为1个基团或取代基。
在另一优选例中,r1选自下组:h、取代或未取代的c1-c3烷基、取代或未取代的c2-c4链烯基、取代或未取代的c2-c4链炔基、取代或未取代的c3-c6环烷基、-oh、取代或未取代的苄基、或其组合;并且所述的取代指基团中的h被选自下组的一个或多个取代基所取代:卤素、-oh、-cn、-nh2、和硝基。
在另一优选例中,所述r1为甲基。
在另一优选例中,所述卤素选自下组:f、cl、br、或i。
在另一优选例中,所述化合物为光学异构体或外消旋体。
在另一优选例中,所述化合物具有式ia所示的结构:
其中,r0、r1的定义如本发明第一方面所述。
在另一优选例中,所述化合物选自下组:
在另一优选例中,所述肥胖或其相关疾病选自下组:肥胖、糖尿病、高血脂、高胆固醇、脂肪肝、动脉粥样硬化、或其组合。
在另一优选例中,所述肥胖包括对瘦素(leptin)不敏感的肥胖。
在另一优选例中,所述的瘦素(leptin)不敏感包括leptin阻抗和/或leptin分子及信号途径失效。
在另一优选例中,所述组合物或制剂还用于(a)减少进食量;(b)降低体重;(c)减少饮水;(d)降低脂肪含量;(e)改善肥胖相关的指标;(f)改善代谢相关的指标;(g)调控脂代谢基因的表达;(h)促进脂肪的利用;(i)减少脂肪组织的脂肪储存和合成;和/或(j)增加脂肪组织的脂肪分解。
在另一优选例中,所述改善肥胖相关的指标包括降低选自下组的一种或多种指标:血糖、三酰甘油、胆固醇、谷丙转氨酶alt、体脂含量、或其组合。
在另一优选例中,所述改善代谢相关的指标包括降低选自下组的一种或多种指标:能量耗散、呼吸交换率、夜间物理活动、或其组合。
在另一优选例中,所述调控脂代谢基因的表达包括降低选自下组的一种或多种基因的表达:dgat、fas、scd1、或其组合。
在另一优选例中,所述调控脂代谢基因的表达包括提高选自下组的一种或多种基因的表达:atgl、fat(cd36)、fatp2、fatp5、cpt1a、acadm、fatp1、fatp4、cpt1b、或其组合。
在另一优选例中,所述组合物包括药物组合物、食品组合物或保健品组合物。
在另一优选例中,所述的组合物或制剂还包括选自下组的额外组分:其他的用于治疗或预防肥胖或其相关疾病的药物。
在另一优选例中,所述其他的用于治疗或预防肥胖或其相关疾病的药物选自下组:苯丁胺(phentermine)、奥利司他(orlistat)、氯卡色林(lorcaserin)、利拉鲁肽(liraglutide)、托吡酯(topiramate)、苄非他明(benzphetamine)、苯二甲吗啉(phendimetrazine)、二乙氨苯丙酮(diethylpropion)、纳曲酮(naltrexone)、丁氨苯丙酮(bupropion)、或其组合。
在另一优选例中,所述的药物组合物含有(i)式i化合物或其药学上可接受的盐;以及(ii)药学上可接受的载体。
在另一优选例中,所述组分(i)占所述药物组合物总重量的0.001-99.9wt%,较佳地0.1-99wt%,更佳地1%-90wt%。
在另一优选例中,所述的式i化合物或其药学上可接受的盐的浓度为0.001ug-10000000ug/ml,较佳地为0.1ug-1000000ug/ml,更佳地,10ug-100000ug/ml。
在另一优选例中,所述的组合物或药物包括:口服制剂和非口服制剂。
在另一优选例中,所述的制剂包括:粉剂、颗粒剂、胶囊剂、注射剂、酊剂、口服液、片剂或含片。
在另一优选例中,所述组合物为口服制剂。
在另一优选例中,所述的组合物(如药物组合物)通过以下方式施用于哺乳动物:口服、静脉注射、或局部注射。
在另一优选例中,所述哺乳动物包括人或非人哺乳动物。
在另一优选例中,所述非人哺乳动物包括啮齿动物,如小鼠、大鼠。
本发明第二方面提供了一种药物组合物,包括:
(a1)用于治疗或预防肥胖或其相关疾病的第一活性成分,所述第一活性成分为式i化合物或其药学上可接受的盐;和
(a2)用于治疗或预防肥胖或其相关疾病的第二活性成分,所述第二活性成分为其他的用于治疗或预防肥胖或其相关疾病的药物;和
(b)药学上可接受的载体;
其中式i化合物或其药学上可接受的盐的定义如本发明第一方面中所述。
在另一优选例中,所述其他的用于治疗或预防肥胖或其相关疾病的药物选自下组:苯丁胺(phentermine)、奥利司他(orlistat)、氯卡色林(lorcaserin)、利拉鲁肽(liraglutide)、托吡酯(topiramate)、苄非他明(benzphetamine)、苯二甲吗啉(phendimetrazine)、二乙氨苯丙酮(diethylpropion)、纳曲酮(naltrexone)、丁氨苯丙酮(bupropion)、或其组合。
在另一优选例中,所述第一活性成分和第二活性成分的重量比为1:100至100:1,较佳地为1:10至10:1。
在另一优选例中,所述药物组合物中,含有0.0001-99wt%(较佳地0.01-90wt%,更佳地,0.1-80wt%)的组分(a1),以药物组合物的总重量计。
在另一优选例中,所述药物组合物中,含有0.0001-99wt%(较佳地0.01-90wt%,更佳地,0.1-80wt%)的组分(a2),以药物组合物的总重量计。
在另一优选例中,所述药物组合物中可以是单一化合物,也可以是多个化合物的混合物。
在另一优选例中,所述的药物组合物用于制备治疗或预防肥胖或其相关疾病的药物或制剂。
在另一优选例中,所述的药物剂型为口服给药或非口服给药剂型。
在另一优选例中,所述的口服给药剂型是片剂、散剂、颗粒剂或胶囊剂,或乳剂或糖浆剂。
在另一优选例中,所述的非口服给药剂型是注射剂或针剂。
在另一优选例中,所述的活性成分(a1)和活性成分(a2)的总含量为组合物总重的1~99wt%,更佳地为5~90wt%。
本发明第三方面提供了一种药盒,所述药盒含有:
(i)第一容器,以及装于该第一容器中的活性成分(a1)式i化合物或其药学上可接受的盐,或含有活性成分(a1)的药物;其中式i化合物或其药学上可接受的盐的定义如本发明第一方面中所述;
(ii)第二容器,以及装于该第二容器中的活性成分(a2)其他的用于治疗或预防肥胖或其相关疾病的药物,或含有活性成分(a2)的药物。
在另一优选例中,所述的第一容器和第二容器是相同或不同的容器。
在另一优选例中,所述的第一容器的药物是含式i化合物或其药学上可接受的盐的单方制剂。
在另一优选例中,所述的第二容器的药物是其他的用于治疗或预防肥胖或其相关疾病的药物的单方制剂。
在另一优选例中,所述药物的剂型为口服剂型或注射剂型。
在另一优选例中,所述的试剂盒还含有说明书,所述说明书中记载了联合给予活性成分(a1)和活性成分(a2)从而治疗或预防肥胖或其相关疾病的说明。
在另一优选例中,所述含有如本发明第一方面中定义的式i化合物或其药学上可接受的盐的制剂或含有其他的用于治疗或预防肥胖或其相关疾病的药物的制剂的剂型分别包括胶囊、片剂、栓剂、或静脉注射剂。
在另一优选例中,所述含有如本发明第一方面中定义的式i化合物或其药学上可接受的盐的制剂中,所述如本发明第一方面中定义的式i化合物或其药学上可接受的盐的浓度为0.001ug-10000000ug/ml,较佳地为0.1ug-1000000ug/ml,更佳地,10ug-100000ug/ml。
本发明第四方面提供了一种体外非治疗性的(a)减少进食量;(b)降低体重;(c)减少饮水;(d)降低脂肪含量;(e)改善肥胖相关的指标;(f)改善代谢相关的指标;(g)调控脂代谢基因的表达;(h)促进脂肪的利用;(i)减少脂肪组织的脂肪储存和合成;和/或(j)增加脂肪组织的脂肪分解的方法,包括:
(i)给需要的对象施用如本发明第一方面中定义的式i化合物或其药学上可接受的盐、本发明第二方面所述的药物组合物、或本发明第三方面所述的药盒。
在另一优选例中,所述的施用包括口服。
在另一优选例中,所述的施用剂量为10-30mg/kg体重/天,较佳地,10mg/kg体重/天。
在另一优选例中,施用频率为1-2次/天,较佳地1次/天。
在另一优选例中,施用包括一个或多个周期,各周期为1-7天,较佳地2-3天。
在另一优选例中,所述的对象包括人或非人哺乳动物。
在另一优选例中,所述非人哺乳动物包括啮齿动物(如小鼠、大鼠)、灵长类动物(如猴)。
本发明第五方面提供了一种制备用于治疗或预防肥胖或其相关疾病的药物组合物的方法,包括步骤:将如本发明第一方面中定义的式i化合物或其药学上可接受的盐与药学上可接受的载体混合,从而形成药物组合物。
在另一优选例中,所述药物组合物包括其他的用于治疗或预防肥胖或其相关疾病的药物。
在另一优选例中,所述其他的用于治疗或预防肥胖或其相关疾病的药物选自下组:苯丁胺(phentermine)、奥利司他(orlistat)、氯卡色林(lorcaserin)、利拉鲁肽(liraglutide)、托吡酯(topiramate)、苄非他明(benzphetamine)、苯二甲吗啉(phendimetrazine)、二乙氨苯丙酮(diethylpropion)、纳曲酮(naltrexone)、丁氨苯丙酮(bupropion)、或其组合。
本发明第六方面提供了一种筛选治疗或预防肥胖或其相关疾病的候选药物的方法,包括步骤:
(a)提供一待测化合物以及阳性对照化合物,所述的阳性对照化合物为式i化合物或其药学上可接受的盐,其中式i化合物或其药学上可接受的盐的定义如本发明第一方面所述;
(b)在测试组中,检测所述待测化合物对非人动物模型的dgat、fas、scd1和/或atgl、fat(cd36)、fatp2、fatp5、cpt1a、acadm、fatp1、fatp4、cpt1b的影响,并与阳性对照组以及阴性对照组中相应的实验结果进行比较,其中,在阳性对照组中,检测阳性对照化合物对dgat、fas、scd1和/或atgl、fat(cd36)、fatp2、fatp5、cpt1a、acadm、fatp1、fatp4、cpt1b的影响;
其中,如果所述待测化合物对非人动物模型的dgat、fas、scd1的降低程度显著高于阴性对照组,和/或所述待测化合物对非人动物模型的atgl、fat(cd36)、fatp2、fatp5、cpt1a、acadm、fatp1、fatp4、cpt1b的提高程度显著高于阴性对照组,则提示所述待测化合物是治疗或预防肥胖或其相关疾病的候选药物。
在另一优选例中,在步骤(b)中,将测试组与阳性对照组相比,并比较v1与v2的比值,其中v1为所述待测化合物对非人动物模型的dgat、fas、scd1的降低幅度v1,而v2为阳性对照化合物对非人动物模型的dgat、fas、scd1的降低幅度,如果v1/v2≥80%,则提示所述待测化合物是治疗或预防肥胖或其相关疾病的候选药物。
在另一优选例中,在步骤(b)中,将测试组与阳性对照组相比,并比较v1与v2的比值,其中v1为所述待测化合物对非人动物模型的atgl、fat(cd36)、fatp2、fatp5、cpt1a、acadm、fatp1、fatp4、cpt1b的提高幅度v1,而v2为阳性对照化合物对非人动物模型的atgl、fat(cd36)、fatp2、fatp5、cpt1a、acadm、fatp1、fatp4、cpt1b的提高幅度,如果v1/v2≥80%,则提示所述待测化合物是治疗或预防肥胖或其相关疾病的候选药物。
在另一优选例中,所述的方法还包括步骤(c):对步骤(b)中筛选出的待测化合物,进一步测定其对肥胖或其相关疾病的治疗效果。
在另一优选例中,所述的“显著高于”指v1/v0≥2,较佳地≥3,更佳地≥4,
其中,v1为所述待测化合物对非人动物模型的dgat、fas、scd1的降低幅度;而v0为阴性对照组(或模型组)中人动物模型的dgat、fas、scd1的降低幅度;和/或
v1为所述待测化合物对非人动物模型的atgl、fat(cd36)、fatp2、fatp5、cpt1a、acadm、fatp1、fatp4、cpt1b的提高幅度;而v0为阴性对照组(或模型组)中人动物模型的atgl、fat(cd36)、fatp2、fatp5、cpt1a、acadm、fatp1、fatp4、cpt1b的提高幅度。
在另一优选例中,所述的方法是非诊断和非治疗性的。
本发明第七方面提供了一种治疗或预防肥胖或其相关疾病的方法,包括:
(i)给需要的对象施用如本发明第一方面中定义的式i化合物或其药学上可接受的盐、本发明第二方面所述的药物组合物、或本发明第三方面所述的药盒。
在另一优选例中,所述的施用包括口服。
在另一优选例中,所述的施用剂量为10-30mg/kg体重/天,较佳地,10mg/kg体重/天。
在另一优选例中,施用频率为1-2次/天,较佳地1次/天。
在另一优选例中,施用包括一个或多个周期,各周期为1-7天,较佳地2-3天。
在另一优选例中,所述的对象包括人或非人哺乳动物。
在另一优选例中,所述非人哺乳动物包括啮齿动物(如小鼠、大鼠)、灵长类动物(如猴)。
本发明第八方面提供了一种nucb2多肽片段或其药学上可接受的盐,所述多肽片段具有以下特征:
(i)该多肽片段的序列来源于nucb2多肽的氨基酸序列;和
(ii)该多肽片段为nucb2多肽全长氨基酸序列的第m位到第n位,且长度为40-50个氨基酸,其中m为75-85的任一正整数,n为110-125的任一正整数。
在另一优选例中,所述nucb2多肽的氨基酸序列来源于小鼠或人。
在另一优选例中,所述的多肽片段还具有选自下组的一个或多个(或全部)特征:
(iii)该多肽片段具有结合如本发明第一方面所定义的式i化合物的能力;
(iv)该多肽片段是nucb2蛋白功能的重要调控区域。
在另一优选例中,pm-n表示从nucb2多肽氨基酸序列第m位至第n位所构成的多肽。
在另一优选例中,m为80,81、82、83、或84。
在另一优选例中,m为82或83。
在另一优选例中,n为120、121、122、123、124、或125。
在另一优选例中,n为122。
在另一优选例中,野生型nucb2多肽的氨基酸序列的登录号为小鼠:np_001123951.1,和/或人:np_005004.1。
在另一优选例中,所述多肽片段的n端和/或c端还带有用于纯化分离等目的的标签序列(如6his、或his6-sumo-tev片段)。
在另一优选例中,所述多肽片段为以酵母为宿主进行表达获得的多肽片段。
在另一优选例中,所述多肽片段是重组的。
在另一优选例中,所述的多肽是在大肠杆菌bl21中表达的。
本发明第九方面提供了一种融合蛋白,所述融合蛋白包括本发明第八方面所述的nucb2多肽片段以及与所述片段融合在一起的标签序列。
在另一优选例中,所述标签序列融合于所述多肽片段的n端和/或c端。
在另一优选例中,所述的标签序列选自下组:his6、his6-sumo、his6-sumo-tev片段。
本发明第十方面提供了一种多核苷酸序列,所述多核苷酸序列编码本发明第八方面所述的多肽片段、或本发明第九方面所述的融合蛋白。
本发明第十一方面提供了一种表达载体,该载体含有编码本发明第八方面所述的多肽片段的多核苷酸。
在另一优选例中,所述载体为大肠杆菌bl21。
本发明第十二方面提供了一种宿主细胞,所述宿主细胞选自下组:
(a)含有本发明第十一方面所述的载体的宿主细胞;
(b)染色体中整合有编码本发明第八方面所述的多肽片段的多核苷酸的宿主细胞。
在另一优选例中,所述的宿主细胞选自下组:酵母细胞、大肠杆菌、昆虫细胞、哺乳类细胞、或其组合。
本发明第十三方面提供了一种制备本发明第八方面所述的多肽片段的方法,包括步骤:
(a)在适合表达的条件下,培养本发明第十二方面所述的宿主细胞,从而表达本发明第八方面所述的多肽片段;和
(b)从培养产物中分离出本发明第八方面所述的多肽片段。
本发明第十四方面提供了一种筛选治疗或预防肥胖或其相关疾病的候选化合物的方法,包括步骤:
(a)将本发明第八方面所述的nucb2多肽片段或其药学上可接受的盐与化合物库混合,测定化合物库中的化合物与所述nucb2多肽片段或其药学上可接受的盐的结合情况;
其中,如果所述测试化合物库中的化合物与所述nucb2多肽片段或其药学上可接受的盐有结合,则表明与所述nucb2多肽片段或其药学上可接受的盐结合的化合物为候选化合物;
(b)将步骤(a)中所确定的候选化合物施用于非人动物模型,测定候选化合物对非人动物模型的肥胖或其相关疾病的影响。
在另一优选例中,所述步骤(b)还包括步骤(c):将步骤(b)中所确定的候选化合物与阳性对照化合物相比,所述的阳性对照化合物为式i化合物或其药学上可接受的盐,其中式i化合物的定义如本发明第一方面所述;检测所述候选化合物和所述阳性对照化合物对非人动物模型的进食量、体重、饮水情况、脂肪含量、肥胖相关的指标、代谢相关的指标、脂代谢基因的表达情况、脂肪的利用情况、脂肪组织的脂肪储存和合成情况、和/或脂肪组织的脂肪分解情况的影响。
在另一优选例中,所述的方法是非诊断和非治疗性的。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
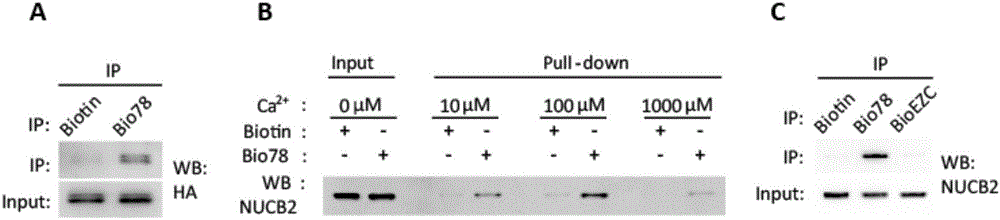
图1hly78特异性结合nucb2
其中,(a)bio78结合293t细胞表达的nucb2-ha(c)ca2+对纯化的nucb2蛋白与bio78结合是重要的(d)纯化的nucb2蛋白结合hly78而不结合bio-ezc。
图2hly78减少小鼠进食量
其中,(a)20mg/kg的hly78分子腹腔注射后的1,3,6,12和24小时时小鼠的进食量(每组8只小鼠)(b)hly78注射前两天和注射当天两组小鼠的体重(每组8只小鼠)(c,d)hly78注射前三天两组小鼠注射dmso后3h和24h小鼠的进食量(每组小鼠8只)。
图3hly78类似物hly72有减少进食功能,而hly103,hss49a不能
其中,(a)hly72,hly103,hss49a的分子结构式(b)hly72,hly103,hss49a没有wnt激活活性(c)hly78,hly72能竞争bio78与nucb2的结合而hly103,hss49a不能。
图4hly72降低小鼠进食量
其中,(a)hly72腹腔注射20mg/kg后的1,3,6,12和24小时内降低小鼠的进食量而hly103没作用(每组8只小鼠)(b)注射hly72,hly103前两天和注射当天两组小鼠的体重(每组8只小鼠)(c,d)注射hly72,hly103前三天注射dmso两组小鼠3小时和24小时小鼠进食量(每组8只小鼠)(e,f)hly72剂量依赖性的降低小鼠进食量(每组8只小鼠)。
图5腹腔注射hly72都能够减轻小鼠体重
连续5天腹腔注射(i.p.)20mg/kg的hly72,(a)小鼠体重,(b)体重降低百分率,(c)每天进食量(每组12只小鼠)。
图6口服灌胃hly72都能够减轻小鼠体重
连续5天口服灌胃20mg/kg的hly72,(a)小鼠体重,(b)体重降低百分率,(c)每天进食量(每组12只小鼠)。
图7hly72浓度梯度依赖性降低小鼠体重,而hly103不能
连续3天腹腔注射hly7210mg/kg和20mg/kg,hly10320mg/kg(a)3天小鼠体重(b)3天小鼠进食量(每组6只小鼠)。
图8hly72对ob/ob肥胖模型小鼠的减肥作用
20mg/kghly72处理下ob/ob肥胖小鼠(a)体重,(b)体重降低百分率,(c)小鼠每天进食量(dmso组8只小鼠,hly72组10只小鼠)。
图9hly72减少小鼠饮水量
图10hly72对高脂诱导肥胖小鼠减肥作用
(a)周期性间断给药模式图(b,c,d)20mg/kg的hly72处理下高脂诱导肥胖小鼠体重,体重降低百分率,每天进食量(每组9只小鼠)。
图11hly72显著降低肥胖小鼠和正常小鼠的脂肪含量
(a)20mg/kghly72使用3个疗程前后,两组小鼠体重(dmso组6只小鼠,hly72组6只小鼠)(b,c)hly72使用后,小鼠脂肪含量,肌肉含量变化(dmso组4只小鼠,hly72组6只小鼠)(d,e)正常小鼠腹腔注射20mg/kg的hly72,5天后,小鼠脂肪含量,肌肉含量变化(dmso组8只小鼠,hly72组8只小鼠)(f,g)正常小鼠口服灌20mg/kg的hly72,5天后,小鼠脂肪含量,肌肉含量变化(dmso组12只小鼠,hly72组12只小鼠)。
图12hly72对肥胖及伴随症的改善
20mg/kg的hly72使用后,(a)血糖,(b)血液三酰甘油,(c)胆固醇,)(d)谷丙转氨酶,(e)谷草转氨酶的变化(dmso组4只小鼠,hly72组6只小鼠)(f)dmso组和hly72组,肝切片苏木精和伊红染色(标尺,200μm)。
图13hly72对代谢的作用
正常饲料喂养的小鼠(a,b,c)(每组14只小鼠),高脂饲料喂养的小鼠(d,e,f)(每组14只小鼠)被放入代谢笼3天,每天注射一次20mg/kg的hly72或dmso小鼠的能量耗散(a,d),呼吸交换率(b,e),物理活动(c,f)。
图14配对饲养实验
高脂饲料喂养的小鼠(每组8只小鼠)放入代谢笼3天,每天注射一次20mg/kg的hly72或dmso,注射dmso组一半数量的小鼠为hly72组的配对组。3组小鼠平均每天进食量(a),能量耗散(b),呼吸交换率(c),物理活动(d)(e)3天代谢笼实验结束后,3组小鼠体重。
图15hly72对脂代谢相关基因表达的影响
正常饲料喂养小鼠连续3天注射20mg/kg的hly72,取其白色脂肪组织(a)检测脂肪储存,脂肪酸合成和分解相关基因表达。肝(b)检测脂肪酸转运和氧化基因的表达。肌肉(c)检测脂肪酸转运和氧化的基因表达(每组14只小鼠)。
图16nucb2的83-122位氨基酸为hly72结合的关键部位
(a)nucb2蛋白片段化的模式图(b)bio78主要结合片段nesfatin-2(c)nesfatin-1+有比nesfatin-2更强的结合bio78的能力(d)nucb2蛋白的第83位到第122位的氨基酸序列。
图17hly72对nucb2基因敲出杂合小鼠作用减弱
(a)小鼠nucb2基因信息和sgrna序列(b)pcr鉴定杂合子nucb2敲出小鼠系(c)杂合子小鼠系的测序鉴定(d)hly72对nucb2杂合小鼠降低进食量作用减弱(e)hly72对nucb2杂合小鼠降低体重作用减弱。
具体实施方式
本发明人经过广泛而深入地研究,通过大量筛选,首次意外地筛到一类能够特异性的针对nucb2蛋白的治疗肥胖或其相关疾病的化合物。实验表明,本发明式i化合物、或其药学上可接受的盐,具有(a)减少进食量;(b)降低体重;(c)减少饮水;(d)降低脂肪含量;(e)改善肥胖相关的指标;(f)改善代谢相关的指标;(g)调控脂代谢基因的表达;(h)促进脂肪的利用;(i)减少脂肪组织的脂肪储存和合成;和/或(j)增加脂肪组织的脂肪分解的作用。此外,本发明的化合物对leptin不敏感的肥胖也有极好的治疗效果。
此外,申请人还首次意外的发现,nucb2多肽的82-122位氨基酸或83-122位氨基酸为本发明式i化合物的结合关键位点。本发明式i化合物通过与nucb2多肽的关键位点结合,从而更有效的治疗或预防肥胖或其相关疾病。在此基础上,本发明人完成了本发明。
基团定义
如本文所用,术语“取代或未取代的”指所述基团可以是未取代的,或者所述基团中的h被一个或多个(如1-10个,较佳地1-5个,更佳地1-3个,最佳地,1-2个)取代基所取代。
如本文所用,所述的“取代”或“取代的”指所述基团具有一个或多个(较佳地1-6个,更佳地1-3个)选自下组的取代基:卤素、c1-c6烷基、c1-c6卤代烷基、c2-c6链烯基、c2-c6链炔基。
如本文所用,术语“c1-c5烷基”是指具有1-5个碳原子的直链或支链烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、或类似基团。
如本文所用,术语“c1-c4烷基”是指具有1-4个碳原子的直链或支链烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、或类似基团。
如本文所用,术语“c1-c3烷基”是指具有1-3个碳原子的直链或支链烷基,例如甲基、乙基、丙基、异丙基、或类似基团。
如本文所用,术语“c2-c5链烯基”指具有2-5个碳原子的直链或支链的烯基,例如乙烯基、烯丙基、1-丙烯基、异丙烯基、1-丁烯基、2-丁烯基、或类似基团。
如本文所用,术语“c2-c4链烯基”指具有2-4个碳原子的直链或支链的烯基,例如乙烯基、烯丙基、1-丙烯基、异丙烯基、1-丁烯基、2-丁烯基、或类似基团。
如本文所用,术语“c2-c5链炔基”是指具有2-5个碳原子的直链或支链的炔基,例如乙炔基、丙炔基、或类似基团。
如本文所用,术语“c2-c4链炔基”是指具有2-4个碳原子的直链或支链的炔基,例如乙炔基、丙炔基、或类似基团。
如本文所用,术语“c1-c5烷氧基”是指具有(c1-c6烷基)-o-结构的基团,例如,ch3-o-、c2h5-o-、c3h8-o-、或类似基团。
如本文所用,术语“c3-c8环烷基”指具有3-8个碳原子的环状烷基,例如环丙基、环丁基、环戊基、环己基、环庚基、或类似基团。
如本文所用,术语“c3-c6环烷基”指具有3-6个碳原子的环状烷基,例如环丙基、环丁基、环戊基、环己基、环庚基、或类似基团。
如本文所用,术语“卤素”是指氟、氯、溴、或碘,优选氟和氯。
如本文所用,术语“卤代的”指被相同或不同的一个或多个上述卤原子取代的基团,可以部分卤代或全部卤代,例如三氟甲基、五氟乙基、七氟异丙基、或类似基团。
本发明的化合物可以含有一个或多个不对称中心,并因此以消旋体、外消旋混合物、单一对映体、非对映异构体化合物和单一非对映体的形式出现。可以存在的不对称中心,取决于分子上各种取代基的性质。每个这种不对称中心将独立地产生两个旋光异构体,并且所有可能的旋光异构体和非对映体混合物和纯或部分纯的化合物包括在本发明的范围之内。本发明包括化合物的所有异构形式。
如本文所用,术语“本发明多肽片段”、“本发明的nucb2的多肽片段”、“本发明片段”或“本发明短肽”,可互换使用,指本发明所定义的nucb2多肽片段或其药学上可接受的盐。此外,应理解,本发明的nucb2多肽片段可以来源于人,也可来自其他哺乳动物(如啮齿动物,如小鼠或其他非人灵长动物)。
nucb2
nucb2(nucleobindin2)蛋白nucb2是一个包含420个氨基酸的分泌蛋白,由氨基端的24个氨基酸作为信号肽,和后面的396个氨基酸组成的结构。
在本发明中,通过大量筛选,首次发现针对nucb2靶点的能够有效治疗肥胖或其相关疾病的式i化合物或其药学上可接受的盐,式i化合物或其药学上可接受的盐具有很好的成药性(优异的溶解度、生物利用等)。
nucb2多肽片段
本发明主要提供了一类nucb2多肽片段,其具有以下特征:
(i)该多肽片段的序列来源于nucb2多肽的氨基酸序列(如来源于人或小鼠);和
(ii)该多肽片段为nucb2多肽全长氨基酸序列(396个氨基酸)的第m位到第n位,且长度为40-50个氨基酸,其中m为75-85的任一正整数,n为110-125的任一正整数。
本发明的代表性多肽片段,包括但不限于p82-122、p83-122、或其组合。其中数字代表在nucb2多肽片段的氨基酸序列中始端和末端氨基酸位置。
如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多聚核苷酸和多肽是没有分离纯化的,但同样的多聚核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。
如本文所用,“分离的本发明多肽片段”是指本发明多肽片段基本上不含天然与其相关的其它蛋白、脂类、糖类或其它物质。本领域的技术人员能用标准的蛋白质纯化技术纯化本发明多肽片段。基本上纯的多肽在非还原聚丙烯酰胺凝胶上能产生单一的主带。本发明多肽片段的纯度能用氨基酸序列分析。
本发明的多肽片段可以是重组多肽、天然多肽、合成多肽,优选重组多肽。本发明的多肽片段可以是天然纯化的产物包括经由蛋白酶水解后的产物,或是化学合成的产物,或使用重组技术从原核或真核宿主(例如,细菌、酵母、高等植物、昆虫和哺乳动物细胞)中产生。根据重组生产方案所用的宿主,本发明的多肽可以是糖基化的,或可以是非糖基化的。本发明的多肽还可包括或不包括起始的甲硫氨酸残基。
本发明还包括本发明多肽片段的片段、衍生物和类似物。如本文所用,术语“片段”、“衍生物”和“类似物”是指基本上保持本发明的天然本发明多肽片段相同的生物学功能或活性的多肽。本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的,或(ii)在一个或多个氨基酸残基中具有取代基团的多肽,或(iii)成熟多肽与另一个化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽,或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或与抗原igg片段的形成的融合蛋白)。根据本文的教导,这些片段、衍生物和类似物属于本领域熟练技术人员公知的范围。
在本发明中,术语“本发明短肽”指具有本发明多肽片段活性的登录号为np_001123951.1或np_005004.1多肽的m-n位氨基酸的短肽(其中长度为40-50个氨基酸,其中m为75-85的任一正整数,n为110-125的任一正整数)。该术语还包括具有与本发明多肽片段相同功能的变异形式。这些变异形式包括(但并不限于):一个或多个(通常为1-50个,较佳地1-30个,更佳地1-20个,最佳地1-10个)氨基酸的缺失、插入和/或取代,以及在c末端和/或n末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在c末端和/或n末端添加一个或数个氨基酸通常也不会改变蛋白质的功能。该术语还包括本发明多肽片段的活性片段和活性衍生物。
本发明还提供本发明多肽片段的类似物。这些类似物与天然本发明短肽的差别可以是氨基酸序列上的差异,也可以是不影响序列的修饰形式上的差异,或者兼而有之。这些多肽包括天然或诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可通过定点诱变法或其他已知分子生物学的技术。类似物还包括具有不同于天然l-氨基酸的残基(如d-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的多肽并不限于上述例举的代表性的多肽。
修饰(通常不改变一级结构)形式包括:体内或体外的多肽的化学衍生形式如乙酰化或羧基化。修饰还包括糖基化,如那些在多肽的合成和加工中或进一步加工步骤中进行糖基化修饰而产生的多肽。这种修饰可以通过将多肽暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高了其抗蛋白水解性能或优化了溶解性能的多肽。
在本发明中,“本发明多肽片段保守性变异多肽”指与具有本发明多肽片段活性的登录号为np_001123951.1或np_005004.1多肽的m-n位氨基酸的短肽(其中长度为40-50个氨基酸,其中m为75-85的任一正整数,n为110-125的任一正整数)的氨基酸序列相比,有至多8个,较佳地至多5个,更佳地至多3个,最佳地至多2个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表1进行氨基酸替换而产生。
表1
本发明的多核苷酸可以是dna形式或rna形式。dna形式包括cdna、基因组dna或人工合成的dna。dna可以是单链的或是双链的。dna可以是编码链或非编码链。编码成熟多肽的编码区序列可以与seqidno.:1(nucb2多肽的核苷酸序列)所示的编码区序列相同或者是简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码具有本发明多肽片段活性的登录号为np_001123951.1或np_005004.1中第m-n位所示序列的多肽片段,但与seqidno.:1所示的编码区序列有差别的核酸序列。
atgaggtggaggatcatccaagtacagtactgttttctcttggttccgtgcatgctgaccgctctggaagctgttcctatcgatgtggacaagaccaaagtacacaacactgagccagtggaaaatgcaaggatagagccaccagatactggactttattatgatgaatacctcaagcaagtgattgaagtcttggaaacagatccacatttcagagaaaagctccagaaagcagacatagaggagataaggagcgggaggctgagtcaagagctggacttagtaagtcacaaagtgaggacgagactggatgagctgaagaggcaagaagtaggaagactgcggatgctcatcaaagctaagctggatgcccttcaagacactggcatgaatcaccaccttcttctgaagcagtttgaacacctgaaccaccagaatcctaacacatttgaatccagagatttggatatgctaatcaaagcagctaccgcggatctggagcaatatgaccggactcggcatgaagagtttaagaagtacgagatgatgaaggaacacgagcggagagagtatttaaaaacgctgagtgaggagaagaggaaagaagaagagtctaagtttgaagagatgaagaggaagcacgaagaccaccccaaagttaatcatcccggaagcaaagatcaactaaaagaggtttgggaagagactgatggattggaccctaatgactttgaccccaagacatttttcaaattacatgatgttaacaacgatggattcctggatgaacaagaattagaagcactattcacaagagagttggagaaagtgtataacccacaaaatgcagaggacgatatgatagaaatggaagaggagaggctcaggatgagagaacacgtcatgagtgagattgataacaacaaagaccgattggtgactctggaggaattcctgagagctacagagaagaaagaattcctggagcctgatagctgggagacactggaccagcaacagttattcaccgaggacgagcttaaagagtatgaaagcattattgctatccaagagaacgagcttaagaagagggcggaagagctgcagaaacagaaggaggatctgcagcggcagcacgaccacctcgaggcgcagaagcaggagtatcatcaggccgtccagcacctggaacagaagaaacttcaacaaggcattgctccatcagggccagcgggagagctgaagtttgagccacacacataa(seqidno.:1)
编码本发明多肽片段活性的登录号为np_001123951.1或np_005004.1的第m-n位所示多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。
本发明中的多肽和多核苷酸优选以分离的形式提供,更佳地被纯化至均质。
本发明短肽的核苷酸全长序列或其片段通常可以用pcr扩增法、重组法或人工合成的方法获得。对于pcr扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cdna库或按本领域技术人员已知的常规方法所制备的cdna库作为模板,扩增而得有关序列。
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
目前,已经可以完全通过化学合成来得到编码本发明蛋白(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
通过常规的重组dna技术(science,1984;224:1431),可利用本发明的多聚核苷酸序列可用来表达或生产重组的本发明多肽片段。一般来说有以下步骤:
(1).用本发明的编码本发明短肽的多核苷酸(或变异体),或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
(2).在合适的培养基中培养的宿主细胞;
(3).从培养基或细胞中分离、纯化蛋白质。
本发明中,编码本发明多肽的多核苷酸序列可插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其他载体。在本发明中适用的载体包括但不限于:在细菌中表达的基于t7的表达载体(rosenberg,etal.gene,1987,56:125);在哺乳动物细胞中表达的pmsxnd表达载体(leeandnathans,jbiochem.263:3521,1988)和在昆虫细胞中表达的来源于杆状病毒的载体。总之,只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
包含上述的适当dna序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母;植物细胞;果蝇s2或sf9的昆虫细胞;cho、cos、293细胞、或bowes黑素瘤细胞的动物细胞等。优选的宿主细胞是酵母细胞。
用重组dna转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收dna的感受态细胞可在指数生长期后收获,用cacl2法处理,所用的步骤在本领域众所周知。另一种方法是使用mgcl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的dna转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
nesfatin-1
2006年oh-i等人从大鼠脑脊液中分离出了一种新的抑食性神经肽—nesfatin-1。nesfatin-1事实上是nucb2n端1-82个氨基酸的片段,但nesfatin-1是否真的存在还没定论。在下丘脑第三脑室或外周腹腔注射nesfatin-1均能起到抑制大鼠或小鼠摄食的功效。作为食欲调节肽之一,血清nesfatin-1/nucb2的水平是与机体的能量水平正相关。饥饿条件下小鼠血清nesfatin-1含量降低,重新喂食血清nesfatin-1含量回到正常水平。人体血清nesfatin-1含量与bmi呈现一定的正相关性。长期给小鼠喂食高脂饲料能提升nesfatin-1在脂肪组织的表达量,炎症因子如tnfα、il-6刺激也能诱导nesfatin-1的表达量上升。
下丘脑弓状核是调节能量代谢的重要区域,它处在血脑屏障之外。弓状核中的神经元能直接接受血液循环中的脂肪因子(如leptin,insulin,cck,adiponectin,pyy等)刺激,被认为是摄食调节的第一级神经元。
脑干的一些区域也存在nesfatin-1阳性的神经元,这些区域包括中缝苍白核与中缝隐核、迷走神经背核以及孤束核。交感神经元轴突起源于中缝核而终止于棕色脂肪组织,暗示nesfatin-1在交感神经支配棕色脂肪组织产热的过程中发挥作用。
本发明首次鉴定出靶向nucb2的小分子化合物hly78,并且证明hly78以不依赖于leptin的方式协同nucb2抑制食欲,长期施用hly78对db/db小鼠和dio小鼠都有很好的减肥效果。
活性成分
本文所用,术语“本发明的活性成分”、“本发明的式i化合物或其药学上可接受的盐”可互换使用,都指能够特异性的针对nucb2蛋白的治疗或预防肥胖或其相关疾病的活性成分。
在本发明中,本发明的活性成分具有式i所示的通式:
式中,r0为1、2或3个各自独立地选自下组的基团或取代基:h、卤素、取代或未取代的c1-c5烷基、取代或未取代的c2-c5链烯基、取代或未取代的c2-c5链炔基、取代或未取代的c3-c8环烷基、-oh、取代或未取代的-oc1-c5烷基、-nrarb、取代或未取代的苄基、或其组合;并且所述的取代指基团中的h被选自下组的一个或多个取代基所取代:卤素、-oh、-cn、-nh2、和硝基;
r1选自下组:h、取代或未取代的c1-c5烷基、取代或未取代的c2-c5链烯基、取代或未取代的c2-c5链炔基、取代或未取代的c3-c8环烷基、-oh、取代或未取代的苄基、或其组合;并且所述的取代指基团中的h被选自下组的一个或多个取代基所取代:卤素、-oh、-cn、-nh2、和硝基;
ra、rb各自独立地为h、c1-c5烷基。
在一优选实施方式中,所述化合物具有式ia所示的结构:
其中,r0、r1的定义如本发明第一方面所述。
在一优选实施方式中,所述化合物选自下组:
组合物和施用方法
如本文所用,术语“组合物”包括(a)治疗或预防肥胖或其相关疾病的组合物,任选的(b)其他治疗或预防肥胖或其相关疾病的药物(苯丁胺(phentermine)、奥利司他(orlistat)、氯卡色林(lorcaserin)、利拉鲁肽(liraglutide)、托吡酯(topiramate)、苄非他明(benzphetamine)、苯二甲吗啉(phendimetrazine)、二乙氨苯丙酮(diethylpropion)、纳曲酮(naltrexone)或丁氨苯丙酮(bupropion));此外,所述的组合物包括药物组合物、食品组合物或保健品组合物。
在一优选实施方式中,本发明的组合物还用于(a)减少进食量;(b)降低体重;(c)减少饮水;(d)降低脂肪含量;(e)改善肥胖相关的指标;(f)改善代谢相关的指标;(g)调控脂代谢基因的表达;(h)促进脂肪的利用;(i)减少脂肪组织的脂肪储存和合成;和/或(j)增加脂肪组织的脂肪分解。
通常,可将本发明的活性成分配制于无毒的、惰性的和药学上可接受的载体介质。配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):口服、肌内、腹膜内、静脉内、皮下、皮内、或局部给药。
本发明还提供了一种药物组合物,它含有安全有效量的本发明的活性成分以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。诸如片剂和胶囊之类的药物组合物,可通过常规方法进行制备。药物组合物如针剂、溶液、片剂和胶囊宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约1微克-10毫克/千克体重,优选地,甘草利酮或其衍生物的用量可以为:成年人每日0.1~2000mg,优选1~300mg/天。
作为治疗或预防肥胖或其相关疾病的药物,可以制成口服和非口服制剂。口服给药可制成片剂、散剂、颗粒剂、胶囊剂等常用剂型,所用的赋型剂可以为淀粉、乳糖、蔗糖、甘露糖、羟甲基纤维素等中的一种或几种。崩解剂可以为马铃薯淀粉、羟甲基纤维素等中的一种或几种。粘合剂可以为阿拉伯胶、玉米淀粉、明胶、糊精等中的一种或几种。口服制剂除上述剂型外,还可以制成乳剂、糖浆剂等。
非口服制剂可以制成注射剂,可以与注射用水、生理盐水、葡萄糖水制成注射剂,也可以在其中加入一定比例的乙醇、丙醇、乙二醇等。
本发明的进一步目的是提供一种治疗或预防肥胖或其相关疾病的药物的制备方法,采用所述的式i所示的化合物或其药学上可接受的盐以及任选的其他治疗或预防肥胖或其相关疾病的药物为药物原料,用相应的赋型剂,按照常规的方法制成口服和非口服制剂,其中式i所示的化合物或其药学上可接受的盐的用量可以为:成年人每日0.1~2000mg,优选10~500mg/天,每日服用1次;儿童的用量和次数需在成人的基础上酌情递减。
药盒
本发明还提供了一种药盒,所述的药盒含有:
(i)第一容器,以及装于该第一容器中的活性成分(a1)式i化合物或其药学上可接受的盐,或含有活性成分(a1)的药物;
(ii)第二容器,以及装于该第二容器中的活性成分(a2)其他的用于治疗或预防肥胖或其相关疾病的药物,或含有活性成分(a2)的药物;和
(iii)说明书;
其中,式i化合物或其药学上可接受的盐如本发明第一方面中定义。
所述含有式i化合物或其药学上可接受的盐的制剂可以是含有式i化合物或其药学上可接受的盐的单元剂型,所述含有其他的用于治疗或预防肥胖或其相关疾病的药物的制剂可以是含有抗其他的用于治疗或预防肥胖或其相关疾病的药物的单元剂型。
药盒中装有至少两个含有式i化合物或其药学上可接受的盐的单元剂型和含有其他的用于治疗或预防肥胖或其相关疾病的药物的单元剂型;较佳地,各为4-10个。
如本文所用,术语“单元剂型”是指为了服用方便,将组合物制备成单次服用所需的剂型,包括但不限于各种固体剂(如片剂)、液体剂、胶囊剂、缓释剂。
此外,可用于本发明药盒的其他的用于治疗或预防肥胖或其相关疾病的药物可以为一种或多种,优选地,所述其他的用于治疗或预防肥胖或其相关疾病的药物可以为多种,更优选地,可以为本领域技术人员所熟知的其他的用于治疗或预防肥胖或其相关疾病的药物的药物组合。
(a)减少进食量;(b)降低体重;(c)减少饮水;(d)降低脂肪含量;(e)改善肥胖相关的指标;(f)改善代谢相关的指标;(g)调控脂代谢基因的表达;(h)促进脂肪的利用;(i)减少脂肪组织的脂肪储存和合成;和/或(j)增加脂肪组织的脂肪分解的方法
本发明还提供了体外非治疗性的(a)减少进食量;(b)降低体重;(c)减少饮水;(d)降低脂肪含量;(e)改善肥胖相关的指标;(f)改善代谢相关的指标;(g)调控脂代谢基因的表达;(h)促进脂肪的利用;(i)减少脂肪组织的脂肪储存和合成;和/或(j)增加脂肪组织的脂肪分解的方法,包括步骤:
(i)给需要的对象施用如本发明第一方面中定义的式i化合物或其药学上可接受的盐、本发明第二方面所述的药物组合物、或本发明第三方面所述的药盒。
本发明的主要优点包括:
(a)本发明首次发现一类能够特异性的针对nucb2蛋白的,并可有效治疗肥胖或其相关疾病的式i化合物或其药学上可接受的盐。
(b)本发明筛出的式i化合物或其药学上可接受的盐还具有非常好的成药性(优异的溶解度、生物利用度等)。
(c)本发明首次发现本发明筛出的式i化合物或其药学上可接受的盐可(a)减少进食量;(b)降低体重;(c)减少饮水;(d)降低脂肪含量;(e)改善肥胖相关的指标;(f)改善代谢相关的指标;(g)调控脂代谢基因的表达;(h)促进脂肪的利用;(i)减少脂肪组织的脂肪储存和合成;和/或(j)增加脂肪组织的脂肪分解。
(d)nucb2基因到目前为止,发挥功能的分子机制还不明确,本发明首次找到了结合nucb2蛋白的化学小分子(如本发明第一方面所定义的式i化合物),作为研究工具也能促进基础研究的进步。
(e)本发明首次发现nucb2的83-122位氨基酸为与本发明第一方面所定义的式i化合物(如hly78)结合的关键部位。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照《微生物:实验手册》(jamescappuccino和nataliesherman编,pearsoneducation出版社)中所述的条件,或按照制造厂商所建议的条件。
如无特别说明,实施例所用的材料和试剂均为市售产品。
通用材料和方法
1.质粒与抗体
小鼠nucb2基因全长通过pcr得到并克隆到哺乳动物表达载体pcmv-ha和原核表达载体pet-28a中。nesfatin-1,nesfatin-2,nesfatin-3,nesfatin1+片段克隆于pet-28a中。nucb2(n6789)抗体购自sigmaaldrich公司,ha(16b12)抗体购自covance公司,his抗体购自sigmaaldrich公司。化学修饰的环糊精captisol(hy-17031)购买自mce公司。hly72,hly78,hly103,hss49a,hly179化学小分子来自中科院昆明植物所郝小江老师实验室。
2.蛋白质表达与纯化
wnt3a蛋白从果蝇s2细胞培养液中制备,经过bluesepharose阳离子交换柱和分子筛两步纯化法制备,使用前测定效价以确定使用时的稀释比例。
nucb2全长与片段均在大肠杆菌bl21-codonplus(de3)中表达。在37℃摇至od值约为0.8后于20℃降温半小时,加iptg至终浓度为500μm,20℃诱导18小时后收菌。菌液在裂解缓冲液(50mmhepesph7.4,1mmmgcl2,1mmcacl2,5mmimidazole,edta-freecompleteproteaseinhibitorcocktail)中重悬,利用破菌仪破碎细菌。8000g,4℃离心30分钟,上清结合ni-nta柱1小时。用400mm咪唑洗脱,浓缩换缓冲液于50mmhepesph7.4中。
3.细胞培养与转染
hek293t细胞在含10%胎牛血清的dmem(invitrogen)培养液中培养,37℃,co2浓度为5%。细胞在转染前18-24小时分盘,6孔盘总的质粒量为2μg/孔,转染质粒量不足时用lacz补足。转染试剂为lipo3000(invitrogen)。转染后24小时时做相应的实验。
4.报告基因测活
将用于测定报告基因活性的hek293t细胞在转染前20小时铺盘,培养至覆盖率50%左右转染,转染方法如上所述。对于hek293t细胞,按照20ngtopflash,20nggfp与460nglacz每孔进行转染,在转染后18小时加入wnt3a或nesfatin-1/nucb2蛋白刺激6-8小时,用boehringermannheimluciferaseassaykit裂解细胞(200μl/孔)15分钟,取50μl裂解液于荧光计bio-teksynergy2(genecompanylimited)测细胞裂解液中的gfp荧光强度作为内标,然后加入20μl荧光素酶的底物(roche)反应,于化学发光通道检测荧光素酶的活性,最后用gfp读值作为内标均一化。
5.生物素化的hly78体外结合实验和westernblot
结合实验时,(1)先预处理streptavidin-agarose,用ip的缓冲液洗streptavidin-agarosebeads,在转子上旋转10分钟。(2)再预结合小分子hly179(20μm)和streptavidin-agarosebeads,4℃冷库旋转1-2小时。(3)在上一步进行了大概1小时时,同时预处理(pre-clear)蛋白,把蛋白和清洗过的streptavidin-agarose在4℃冷库旋转30分钟。(4)将结合了hly179的streptavidin-agarosebeads离心,吸掉上清,再用600μl的ipbuffer清洗一次(4℃旋转3分钟),离心,小心吸去上清。(5)加入被pre-clear的蛋白,4℃冷库旋转2小时。用ipbuffer800μl洗2次,2分钟每次(都在4℃冷库旋转)。最后一次洗完后,吸掉上清,加入40μl的2*loading煮10分钟,-20℃保存。在做竞争结合实验时,第三步预处理蛋白的同时加入不同的小分子化合物,终浓度为100μm,其余做法相同.westernblot:配制适当浓度的sds-page胶,加入蛋白样品电泳分离。电转胶中蛋白到nc(硝酸纤维素)膜,用0.5%的脱脂牛奶封闭1小时。tbst洗涤3次,每次5分钟,再加入相应的一抗4℃孵育过夜。回收抗体后,tbst洗涤3次,每次5分钟,加入相应hrp偶联的二抗,室温孵育1小时。洗涤三次后,加入显影液扫描。对于分子量很小的蛋白nesfatin1和2,使用tricine-sds-page方法,过程与文献一致。
6小分子和nucb2蛋白结合实验
结合实验时,(1)先预处理streptavidin-agarose,用ip的缓冲液洗streptavidin-agarosebeads,在转子上旋转10分钟。(2)再预结合小分子hly179(20μm)和streptavidin-agarosebeads,4℃冷库旋转1-2小时。(3)在上一步进行了大概1小时时,同时预处理(pre-clear)蛋白,把蛋白和清洗过的streptavidin-agarose在4℃冷库旋转30分钟。(4)将结合了hly179的streptavidin-agarosebeads离心,吸掉上清,再用600μl的ipbuffer清洗一次(4℃旋转3分钟),离心,小心吸去上清。(5)加入被pre-clear的蛋白,4℃冷库旋转2小时。用ipbuffer800μl洗2次,2分钟每次(都在4℃冷库旋转)。最后一次洗完后,吸掉上清,加入40μl的2*loading煮10分钟,-20℃保存。在做竞争结合实验时,第三步预处理蛋白的同时加入不同的小分子化合物,终浓度为100μm,其余做法相同。
7westernblot
配制适当浓度的sds-page胶,加入蛋白样品电泳分离。电转胶中蛋白到nc(硝酸纤维素)膜,用0.5%的脱脂牛奶封闭1小时。tbst洗涤3次,每次5分钟,再加入相应的一抗4℃孵育过夜。回收抗体后,tbst洗涤3次,每次5分钟,加入相应hrp偶联的二抗,室温孵育1小时。洗涤三次后,加入显影液扫描。对于分子量很小的蛋白nesfatin1和2,使用tricine-sds-page方法,过程与文献一致。
8小鼠
所有动物实验被生化细胞所动物管理委员会批准。c57bl/6小鼠购买自灵畅公司(正常小鼠和高脂饲料诱导肥胖小鼠),c57/blj6(nucb2基因敲出小鼠的繁殖和背景纯化用)购买自灵畅公司,ob/ob小鼠购买自斯莱克公司。用于诱导肥胖小鼠的高脂饲料(45%kcal,d12451)购买自researchdiets。从第六周开始,喂高脂饲料14-25周。其余小鼠用正常饲料(13.5%kcal)。小鼠饲养于生化细胞所spf级别动物房,12小时关灯(19:00-07:00),12小时开灯(07:00-19:00)。
9进食量,体重和体脂含量测定
小鼠在关灯前2小时内腹腔注射dmso或hly72(溶于dmso)25μl,灌胃实验时,溶于dmso的高浓度hly72溶于10%的环糊精,灌胃100μl的总体积,使dmso的最终浓度小于10%。在息灯后的第3小时,第6小时,第12小时,第24小时时分别称量饲料的重量。相应的小鼠体重也在每天给药前相同的时间称量。小鼠脂肪含量用所里动物平台的磁共振脂肪含量测量仪测定。
10代谢笼
在开始代谢笼实验前,小鼠先单笼饲养适应1周。一周单笼适应期后,小分子化合物注射开始的三天前,在每天下午关灯前2小时内给小鼠注射dmso25μl,使其适应注射3天。3天注射适应后的小鼠被放入代谢笼,当天开始任然是在关灯前2小时内分别注射dmso和hly72(20mg/kg)25μl,连续3天。分析数据时,第一天晚上的数据不被收录用来分析,后面连续收集两个白天(第二天白天,第三天白天),两个夜晚(第二天夜晚,第三天夜晚),分别48小时的数据作为代谢笼最终展示的数据。
11组织,细胞rna的抽提和rt-pcr
小鼠被安乐死后,马上剥离出相应的组织,并用液氮速冻,-80℃保存。对于6孔培养皿里的细胞样品,吸掉培养基后,加入1ml的trizol,室温放置10分钟后,转移到1.5ml的ep管中,-80℃保存。抽提组织rna时,先在含有钢珠的组织匀浆管中加入1.5ml的trizol,将组织从-80℃冰箱取出放入匀浆管中匀浆破碎。用酚-氯仿-异丙醇方法抽提rna。利用superscripttmiiifirststrandsynthesissystem(invitrogen)试剂盒将1μg的mrna反转录为cdna,反转录时使用随机引物。使用quantitativesybrgreenpcrkit(takara)试剂盒做定量pcr反应,pcr反应的仪器为abi-quantstudio6realtimepcr仪。
用于q-pcr检测的小鼠相应基因引物(musmusculus)见表2
表2
12小鼠肝组织石蜡切片
采取小鼠肝组织于4%的多聚甲醛4℃固定过夜。pbs缓冲液洗两次后于30%,50%乙醇中各30分钟,4℃保存于70%乙醇中。(1)乙醇梯度脱水:80%乙醇30分钟,95%乙醇30分钟,100%乙醇15分钟,新的100%乙醇15分钟。(2)二甲苯透明:1/2无水乙醇加1/2二甲苯中15分钟,二甲苯中10分钟,新的二甲苯中10分钟。(3)浸蜡,包埋,切片:1/2二甲苯加1/2石蜡30分钟,石蜡1中90分钟,石蜡2中120分钟,石蜡3中过夜后包埋,常规切片厚4μm,贴于处理过的干净载玻片上,37℃烤片过夜,收集于载片盒中4℃密封保存。(4)二甲苯脱蜡,梯度乙醇复水:组织切片经3次二甲苯脱蜡,每次10分钟,放入1/2二甲苯加1/2无水乙醇中15分钟。经100%,90%,80%,70%,50%,30%的乙醇各5分钟后,放入纯水中5分钟。(5)he染色,拍片:苏木精室温染色20分钟,流水冲洗,0.1%的盐酸乙醇分色1秒钟,流水冲洗,经30%,50%,70%,80%,95%的乙醇各1分钟后,1%伊红染色1分钟。放入无水乙醇中1分钟,用新的无水乙醇脱水2次,每次5分钟。再放入1/2无水乙醇加1/2二甲苯中15分钟,后经二甲苯1,2,3,每次5分钟。中性树胶封片,室温干燥保存。使用细胞平台olympusbx51显微镜拍片。
13数据统计分析
数据以平均值±标准误(means±s.e.m)的方式呈现。p值通过t检验(student′stest)得出,显著性表示为*:p<0.05,**:p<0.01,***:p<0.001。
实施例1小分子化合物hly78与nucb2之间存在相互作用
质谱鉴定表明小分子化合物hly78可能与nucb2之间存在相互作用,为验证这个推测,首先,克隆了小鼠的nucb2基因,用hek293t细胞过表达的带有ha标签的全长nucb2蛋白和bio78(连接有biotin的hly78)进行体外结合实验。结果表明bio78能够结合细胞表达的nucb2蛋白(图1a)。
紧接着纯化了大肠杆菌表达的小鼠全长的nucb2蛋白。在分析nucb2蛋白特点的时候,发现其含有2个ef-hand结构域,暗示它是ca2+结合蛋白。因此在实验中使用了不同的ca2+浓度。结果显示太高或太低的ca2+都不是很好的条件,当ca2+的浓度为100μm时,nucb2可能有较好的构像,表现出与小分子有较好的结合能力(图1b)。
为了进一步了解hly78与nucb2蛋白结合的特异性,为此选用了实验室正在研究的另一个小分子ezc(ezc为小分子的代号,同hly78一样,ezc也有连接有biotin的bio-ezc,)。结合实验发现纯化的nucb2蛋白特异结合hly78而不结合ezc(图1c)。
实施例2hly78减少小鼠进食量
接下来我们很关心的下一个问题是:hly78是否在小鼠上有着和nucb2蛋白相似的功能。到现在为止,对于nucb2蛋白报道最金典的功能就是减少小鼠夜间的进食量。因此,设计实验:在晚上熄灯前的两小时内腹腔注射20mg/kg的hly78,然后在不同时间点测定小鼠的进食量(0-3h,0-6h,0-12h,0-24h)。结果清晰地表明了hly78的确显著地减少了小鼠的进食量(图2a)。在注射hly78前的适应注射期三天中,两组小鼠都注射了dmso。注射hly78的当天和其之前的注射dmso的两天,两组小鼠的体重情况也是一致的(图2b)。统计这3天两组小鼠进食数据显示:两组小鼠的进食情况没有明显的差异,包括0-3小时和0-24小时(图2c,2d)。
实施例3hly78类似物hly72竞争hly78与nucb2的结合
鉴于hly78是能够协同激活wnt信号通路,而wnt信号通路的活性与很多生物学过程有关,比如对脂肪细胞的分化和一些神经活动等。两个原因:(1)为了简化研究中的复杂性,(2)为了找到hly78发挥其降低进食量作用的关键基团,因此我们决定从hly78的衍生物中去寻找能够与nucb2结合但又没有激活wnt信号的小分子作为新的目标小分子。我们关注了hly72,hly103,hss49a这三个小分子(图3a)。因为这几个分子的结构与hly78最为相似,此外它们都没有wnt信号激活的活性(图3b)。所以第一个生化实验设计就是:这3个小分子能否竞争hly179与nucb2蛋白的结合。结果表明:hly78能够竞争bio78结合nucb2,hly72也能够竞争bio78结合nucb2,而hly103和hss49a没有这种竞争能力(图3c)。
实施例4hly72减少小鼠进食量
接下来就先选择了hly72和hly103两个小分子在小鼠上面做影响进食量的功能实验。与生化结合实验完全一致,20mg/kg的hly72有显著抑制进食量的作用(0-3h,0-6h,0-12h,0-24h),而hly103没有作用(图4a)。给药的前两天和当天两组小鼠的体重情况也是一致的(图4b),而在注射hly72前的适应注射期三天中,两组小鼠都注射dmso的数据统计显示,小鼠的进食情况没有差异(图4c,4d)。随后用3个浓度的剂量的hly72,发现hly72对小鼠的降低进食量的作用是呈现剂量梯度的。在7.5mg/kg时,hly72对小鼠进食量没有显著作用,在15mg/kg和30mg/kg时呈现明显梯度作用(图4e,4f)。
所以,通过生化竞争结合实验和进食量的功能试验,重新确立了hly72作为靶向nucb2治疗肥胖的小分子化合物。同时,通过这些实验,我们初步确定了hly72发挥相关功能的关键基团为氮原子附近的部位。
实施例5腹腔注射hly72能减轻正常小鼠的体重
在筛选到了更好的小分子化合物和大概确定了其关键的基团后,hly72是否有减肥作用就成为了马上最想知道的结果。对于这个问题我们直接选用正常的小鼠腹腔注射hly72连续的5天。结果表明20mg/kg的hly72能显著降低正常小鼠的体重,从25.73±0.29g降低到23.37±0.36g(图5a),对应于9.21%±0.74%体重总量的降低(图5b),同时相比于对照组hly72组每天的进食量也显著的减少(图5c)。
实施例6口服灌胃hly72也能减轻正常小鼠的体重
为了进一步探究hly72用口服灌胃的给药方式是否也有减肥作用,同时也由于口服方便,很多药物都是口服的方式,我们也向以后的应用多考虑了一步,所以用了口腔灌胃的给药方式看hly72对正常小鼠体重的影响。同样是20mg/kg的hly72灌胃处理5天,小鼠体重从25.26±0.37g降低到23.14±0.45g(图6a),对应于8.43%±0.81%的体重总量的降低(图6b),相比于对照组hly72组小鼠每天的进食量也显著的减少(图6c)。
实施例7hly72特异性降低小鼠体重而hly103不能
确认了hly72的确能降低小鼠体重后,我们再看了两个问题:(1)hly72降低体重的作用是否剂量依赖?(2)hly72类似分子hly103不结合nucb2是否有降低体重的作用。连续3天的实验清晰的表明,hly72对体重的降低作用是呈现浓度梯度的(图7a),而hly103对体重完全没有影响(图7b)。我们也统计了这三天中小鼠的每天进食量,跟前面的一天内短时统计的数据结论也是一致的。
实施例8hly72对ob/ob肥胖模型小鼠有很好的减肥作用
得到了上述一些列结果后,现在开始将小分子hly72用于肥胖小鼠模型。我们首先选择了leptin突变而导致的肥胖小鼠模型(ob/ob)。肥胖之所以顽固有一个重要的原因就是对于调控因子,比如insulin,leptin的抵抗和耐受。而让我们很欣喜的一个事实是nucb2能够降低leptin受体突变的zucker大鼠的进食量。对此,我们完全可以合理的推测小分子hly72应该对ob/ob小鼠也有作用。果然,注射hly72对ob/ob小鼠有显著的减肥效果。连续7天的20mg/kg的hly72注射,ob/ob小鼠体重从42.02±1.01g降低到37.73±0.87g(图8a),对应于10.15%±0.87%的体重总量的降低(图8b)。ob/ob小鼠的每天进食量相比于dmso组,hly72组也有显著的降低(图8c)。
实施例9hly72对小鼠饮水的影响
由于ob/ob小鼠是糖尿病小鼠模型,有多食,多饮,多尿的特点,在ob/ob小鼠实验过程中我们也注意到一个现象:注射hly72的小鼠的尿液明显减少。再次检测了hly72是否有降低小鼠饮水的作用。通过连续三天注射20mg/kghly72,实验数据显示对于正常饲料的小鼠(ncd,normalchowdiet),三天的饮水量只有对照组的39.68%±2.29%,高脂饲料饲养小鼠(hfd,high-fatdiet)三天的饮水量只有对照组的26.38%±2.06%(图9)。因此,hly72像nucb2/nesfatin-1一样,有减少小鼠饮水的作用。
实施例10hly72对高脂诱导肥胖模型的减肥作用
根据前面的结果,认为hly72最好不要连续长时间的使用。鉴于目前nucb2发挥功能的很多机制还不清楚,所以选择了最简单的间断给药办法,即给药3天,停4天,一周一个给药周期,往复3个疗程。(图10a)。
在高脂诱导的肥胖小鼠模型中,第一个注射hly72的3天,小鼠体重从33.56±0.63g降低到31.61±0.74g,第二个给药3天,小鼠体重从31.23±0.57g降低到29.36±0.58g,第三个给药3天,小鼠体重从29.39±0.51g降低到27.80±0.62g,3个循环21天结束后,小鼠的总体重从33.56±0.63g降低到27.65±0.54g(图10b)。整个过程对应于16.88%±0.51%的体重总量的降低(图10c)。统计3个给药时间阶段小鼠的平均每天进食量,相比于dmso组,hly72组有显著的降低(图10d)。所以,上面的这些结果明确的显示了hly72分子对两种前临床肥胖小鼠模型有很好的减肥效果。
实施例11hly72降低脂肪含量
实验中使用高脂饲料喂养22周,体重约为40克的肥胖小鼠,按照前面3个疗程的使用的方式。首先,4个疗程的hly72注射显著的降低了小鼠的体重(图11a)。磁共振脂肪含量测量仪的分析也显示脂肪的含量显著降低(图11b),同时肌肉的比重增高大概9个百分点(图11c)。
对于正常小鼠,不管是腹腔注射(图11d,11e)还是口服灌胃(图11f,11g),连续5天处理,小鼠脂肪含量明显降低,而肌肉含量不变。
实施例12hly72对肥胖各种指标的改善
检测了用药后对肥胖的各种不良指标的影响。通过血液生化检测,hly72组小鼠的血糖也显著下降(图12a),三酰甘油(图12b),胆固醇含量也明显的降低(图12c),说明糖脂代谢相关的异常有所改善。同时谷丙转氨酶alt降低(图12d),谷草转氨酶ast没有变化(图12e),说明使用hly72后,小鼠的肝功能有所提升和改善。小鼠的肝脏切片也清晰地显示了高脂导致的脂肪肝得以很好的治疗(图12f)。
实施例13hly72对代谢的影响
接下来研究了hly72对小鼠代谢的影响。我们采用两种方法:(1)代谢笼直接测量小鼠相关代谢指标,(2)检测相关的关键代谢基因的表达情况。代谢笼实验得到了3个代谢参数:(1)能量耗散(ee,energyexpenditure),能量输出作为能量平衡的一个重要方面,在限制饮食,禁食等条件下,小鼠会降低基础代谢,减少能量耗散;(2)呼吸交换率(rer,respiratoryexchangeratio),根据产生的co2和使用o2计算的比率,rer为1意味着主要以碳水化合物为能量,rer为0.7意味着主要以脂肪为燃料;(3)物理活动(activity)。
对于正常饲养的小鼠(lean),hly72处理显著减少了夜间和白天小鼠的能量耗散(图13a)。呼吸交换率在hly72处理组夜间有明显的降低,白天没有变化,说明了实验组小鼠夜间增加了以脂肪作为能量的能量利用方式(图13b)。物理活动分析显示hly72处理组夜间活动减少,对白天的活动没影响,很可能是减少了夜间的寻找食物的行为(图13c),所以夜间的能量耗散也减少。
对于高脂饲料喂养的肥胖小鼠(dio),hly72组夜间和白天的能量耗散显著的减少了(图13d)。呼吸交换率相比dmso组,hly72组夜间和白天也都明显降低,说明了实验组小鼠增加了以脂肪作为能量的能量利用方式(图13e)。物理活动是夜间明显的降低,而白天没有变化(图13f)。
实施例14配对饲养实验
接下来比较hly72注射组和它们的配对饲养组,dmso注射的小鼠分成了两组,第一组可以自由获得足量食物,而另一组每天定量提供hly72组相同量的食物。结果显示,hly72组跟其配对饲养组每天进食量几乎一致(图14a)。hly72组及其配对饲养组与dmso组比,不管白天还是夜间,能量耗散都有所下降,hly72组与其配对饲养组白天和夜间的能量耗散没差异(图14b)。和配对饲养组及dmso处理组相比,hly72组的夜间和白天呼吸交换率都显著降低,配对饲养组和dmso处理组白天和夜间也表现出了显著的差异(图14c)。物理活动方面,hly72组比dmso组和配对饲养组都明显降低,而dmso组和配对饲养组无显著差别(图14d)。hly72组和配对饲养组的体重都显著下降,但两组之间没有明显的差异(图14e)。
实施例15hly72对脂代谢基因表达的影响
小鼠注射hly72后取附睾白色脂肪组织,肝脏,肌肉组织去检测脂代谢相关基因的表达情况。结果显示在白色脂肪组织(图15a):(1)脂肪储存的基因dgat显著降低,说明hly72减少白色脂肪组织的脂肪储存。(2)脂肪酸合成的基因fas,scd1显著下调,说明hly72减少白色脂肪组织的脂肪酸合成。(3)脂肪分解的基因atgl增加,说明hly72增加白色脂肪的分解。肝脏细胞膜上脂肪酸转运蛋白基因fat(cd36),fatp2,fatp5表达增加,脂肪酸进入线粒体的转运蛋白基因cpt1a和脂肪酸β-氧化的关键酶基因acadm表达增加(图15b)。同时肌肉细胞膜脂肪酸转运蛋白基因fatp1,fatp4表达增加,脂肪酸进入线粒体的转运蛋白基因cpt1b和脂肪酸β-氧化的关键酶基因acadm表达增加(图15c)。这些组织基因表达的变化说明了肝脏和肌肉组织都增加了对脂肪酸的利用。
实施例16nucb2的83-122位氨基酸为hly78结合的关键部位
为了找出小分子与nucb2蛋白结合的区域,我们用体外结合实验(pull-down)的方法。参考前人对nucb2分段的方式,我们同样也将小鼠的nucb2蛋白分为nesfatin-1(1-82氨基酸),nesfatin-2(77-171氨基酸)和nesfatin-3(161-396氨基酸)三个片段(图16a)。
随后用大肠杆菌原核表达系统表达并纯化了这几个片段,并且用bio78和这几个片段进行体外结合实验。结果表明nucb2蛋白的第二个片段nesfatin-2主要和bio78结合(图16b)。但是根据结构预测和序列分析,发现nucb2蛋白的1-122个氨基酸可能是一个较完整的结构,所以我们又构建了nucb2的1-122个氨基酸的这个片段,并命名为nesfatin-1+。结合实验显示,nesfatin-1+比nesfatin-2对bio78有更好的结合能力(图16c)。根据上述的几个结果,nesfatin-1不与bio78结合,nesfatin-2与bio78结合,nesfatin-1+与bio78有最强的结合,我们分析第83-122位这40个氨基酸可能是nucb2蛋白与bio78结合的关键区域(图16d)。
实施例17hly72对nucb2基因敲除杂合子小鼠的作用减弱
前面的一系列结果虽然表明小分子hly72和nucb2的作用完全吻合:(1)小分子与nucb2直接结合,(2)都有减少小鼠进食量的作用,(3)都能减少饮水,(4)都能对ob/ob小鼠有减肥作用。但我们还是没有明确的直接证据证明hly72通过靶向nucb2发挥上述这些功能。为了回答这个问题,决定构建nucb2基因敲除小鼠。
从厦门大学获得crispr-cas9系统做的杂合子的小鼠。具体的做法是,在nucb2基因翻译成蛋白的第一个外显子e3(exon3,前两个外显子e1,e2不含编码蛋白的序列)设计2条sgrna(图17a)。杂合子小鼠删除了e3中的83个碱基,通过测序方式加以了确认(图17c)。为了方便实验对于删除了83个碱基的小鼠,我们设计引物通过pcr的方式进行检测(图17b)。由于多次配对都未能拿到nucb2敲出纯合小鼠,所以只能用杂合子小鼠进行研究。实验显示hly72对杂合小鼠的作用减弱,不管是每天进食量(图17d)还是小鼠体重(图17e),这个结果也意味着hly72通过靶向nucb2发挥功能。
结论
1.hly78是一个结合nucb2蛋白并且有其功能的小分子
小鼠实验表明和nucb2影响小鼠进食量的功能类似,hly78也有显著降低小鼠夜间进食量的功能。进一步对hly78化学改造同系物的筛选,选择了hly72作为新的靶向nucb2的小分子。和hly78相比,hly72没有激活wnt信号的作用,却保留了结合nucb2的功能,且hly72也表现出降低小鼠夜间进食量的功能。所以功能实验非常明确的表明了hly78,hly72有nucb2一样的功能。
通过体外直接结合实验表明hly78是一个结合nucb2的小分子,而且这个结合受钙离子的影响。同时,hly78同系物的实验数据也帮助我们初步确定了hly72和nucb结合及发挥降低小鼠夜间进食量功能的关键基团,为氮原子附近的部分。虽然通过免疫沉淀的方式,hly179能够从过量的nucb2蛋白中结合部分蛋白,目前我们很难用这个样品去精确测定小分子hly72与nucb2蛋白的结合常数。可能原因:(1)纯化的nucb2蛋白是由单体和多种不同形式的多聚合体组成的混杂状态,到现在为止nucb2蛋白没有晶体结构报道,我们实验室研究生赵剑飞也尝试筛选了很多的结晶条件,也没能拿到可用的晶体,(2)hly72分子水溶性很差,(3)nucb2基因本身的代表的生物学意义的复杂性,目前已知的对其的认知可能还是肤浅的。
2.hly72对正常小鼠和前临床肥胖模型小鼠都有减肥作用
以腹腔注射和口服灌胃的给药方式,小分子hly72都有明显的减轻体重的作用,通过磁共振脂肪含量检测仪确定了减轻的部分主要是脂肪组织。而且对脂肪组织的减少作用是显著的。由于hly72分子在减少小鼠进食量的同时,也更加显著地减少了小鼠每天的饮水量,目前我们初步采取了缓进稳妥的周期性给药的方式,达到长时间的给药和大尺度的减肥目的,结果显示hly72能够显著的降低高脂饲料诱导的肥胖小鼠的体重。关于这个问题后面还有必要进一步的深究。另外hly72分子对于ob/ob肥胖小鼠模型也有很好的作用,这对于肥胖中出现的leptin抵抗是个好的消息,也令关于nucb2的分子机制和生物学机制的研究显得更加的紧迫和吸引人。
3.hly72对代谢和肥胖相关指标的改善
对于正常饲养的小鼠和高脂饲料喂养的肥胖小鼠,hly72分子的注射显著地降低了呼吸交换率,说明实验组小鼠增加了以脂肪作为能量的能量利用方式。取白色脂肪组织去检测相关基因表达发现hly72减少脂肪储存和脂肪酸合成,增加了脂肪的分解。取肝脏和肌肉组织检测脂肪酸利用相关基因的表达,也发现这两个组织增加了对脂肪酸的利用。同时血糖血脂等显著降低,肝功能得以提升。所有的这些测试指标是完全吻合的,也说明了整个由肥胖导致的不健康状态有所好转。然而,小分子是作用于脂肪组织本身(外周,因为有报道指出nucb2在脂肪组织的分化中有重要作用),还是作用于大脑(中枢)去调控的外周代谢,还是同时都有作用等问题目前任然不清楚。
4.展望
肥胖现象在包括发达国家和发展中国家在内的全球范围内的增加不能直接归结于遗传因素,因为对于整个人群体的基因,在这短短几十年内时间是不会有太大的改动。非常容易地获得食物,而且是高能量可口的食物,以及生活状态的改变,比如长时间的坐着而少动等,以及环境的改变,可能是比遗传更为重要的原因。所以通过各种层面,不管是稳态机制面上还是非稳态能量调控层面,降低能量输入作为重要减肥策略是合乎逻辑的。统计过去60年中,25个退出市场的减肥药,其中23个作用于脑,有降低食欲的作用,主要作用于肾上腺受体,多巴胺受体,色胺受体,大麻素受体等。但从另一个层面,这些失败的例子反映了个问题:很多有效的减肥策略依然是通过减少能量的输入,而且这些药物之所以有效主要是由于作用于中枢系统,因为控制中枢才能够更好地控制整个个体的状态,通过中枢改变整体和通过局部改变整体的效果是可想而知的。
小分子hly72是中药石蒜科植物石蒜的鳞茎内的生物碱石蒜碱的衍生改造小分子,石蒜碱及其一些衍生改造分子已进成为了药物分子供临床使用。所以根据目前的本发明的实验结果,将hly72向减肥药物方向发展还是可以期望的。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>中国科学院上海生命科学研究院
中国科学院昆明植物研究所
<120>治疗或预防肥胖或其相关疾病的化合物及其应用
<130>p2016-0697
<160>37
<170>siposequencelisting1.0
<210>1
<211>1263
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgaggtggaggatcatccaagtacagtactgttttctcttggttccgtgcatgctgacc60
gctctggaagctgttcctatcgatgtggacaagaccaaagtacacaacactgagccagtg120
gaaaatgcaaggatagagccaccagatactggactttattatgatgaatacctcaagcaa180
gtgattgaagtcttggaaacagatccacatttcagagaaaagctccagaaagcagacata240
gaggagataaggagcgggaggctgagtcaagagctggacttagtaagtcacaaagtgagg300
acgagactggatgagctgaagaggcaagaagtaggaagactgcggatgctcatcaaagct360
aagctggatgcccttcaagacactggcatgaatcaccaccttcttctgaagcagtttgaa420
cacctgaaccaccagaatcctaacacatttgaatccagagatttggatatgctaatcaaa480
gcagctaccgcggatctggagcaatatgaccggactcggcatgaagagtttaagaagtac540
gagatgatgaaggaacacgagcggagagagtatttaaaaacgctgagtgaggagaagagg600
aaagaagaagagtctaagtttgaagagatgaagaggaagcacgaagaccaccccaaagtt660
aatcatcccggaagcaaagatcaactaaaagaggtttgggaagagactgatggattggac720
cctaatgactttgaccccaagacatttttcaaattacatgatgttaacaacgatggattc780
ctggatgaacaagaattagaagcactattcacaagagagttggagaaagtgtataaccca840
caaaatgcagaggacgatatgatagaaatggaagaggagaggctcaggatgagagaacac900
gtcatgagtgagattgataacaacaaagaccgattggtgactctggaggaattcctgaga960
gctacagagaagaaagaattcctggagcctgatagctgggagacactggaccagcaacag1020
ttattcaccgaggacgagcttaaagagtatgaaagcattattgctatccaagagaacgag1080
cttaagaagagggcggaagagctgcagaaacagaaggaggatctgcagcggcagcacgac1140
cacctcgaggcgcagaagcaggagtatcatcaggccgtccagcacctggaacagaagaaa1200
cttcaacaaggcattgctccatcagggccagcgggagagctgaagtttgagccacacaca1260
taa1263
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggccttcggattatccctgg20
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
cagccaggttctacgccaag20
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
actggaacacgcccaagaaa20
<210>5
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>5
atgggcggaatggtctctttc21
<210>6
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>6
ggaggtggtgatagccggtat21
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>7
cgagggcttccacaactacc20
<210>8
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>8
caacgccactcacatctacgg21
<210>9
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>9
gatttacgcacgatgacacagt22
<210>10
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>10
aggcgaactccacagaatgtt21
<210>11
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>11
gcaattattccccatgaacg20
<210>12
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>12
agatgacgtggcaaagaacag21
<210>13
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>13
cgctttctgcgtatcgtctg20
<210>14
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>14
gatgccgtgtccgtcttttac21
<210>15
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>15
actgttctccaagctagtgct21
<210>16
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>16
gttctcccgtccaagaccatt21
<210>17
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>17
ctccgcctgagccatgaag19
<210>18
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>18
catgtatcgccgcaaactgg20
<210>19
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>19
agggtttagttttgagttgacgg23
<210>20
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>20
cttgggggctcctttctgaa20
<210>21
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>21
tgatgctcatgttatccacggt22
<210>22
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>22
gtagtctcggaagtagcgcc20
<210>23
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>23
tggggaccttgtcttcatcat21
<210>24
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>24
tgggtaatccatagagcccag21
<210>25
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>25
aactcagaagcccaaagctca21
<210>26
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>26
ggacacctcaataatgttggcac23
<210>27
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>27
acctgcaaagacattagacagc22
<210>28
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>28
acaaaagaggtactgtccgtct22
<210>29
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>29
ggcctcactaaaccatccaa20
<210>30
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>30
ccttggctagataacgaactctg23
<210>31
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>31
gatgcacgggatcgtgtct19
<210>32
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>32
gacttcagacctccacgactc21
<210>33
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>33
gatgaagacccggatgaaacg21
<210>34
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>34
gctccgtacagagtgtagcaag22
<210>35
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>35
caccagtgatgatgccattct21
<210>36
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>36
cctgggatgcgtgtagtgtt20
<210>37
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>37
ccccgcttttgtcatattccg21
- 还没有人留言评论。精彩留言会获得点赞!