壳寡糖双胍衍生物在制备治疗脂代谢紊乱药物中的应用的制作方法
本发明属于药学领域,更加具体地说,涉及一种壳寡糖双胍衍生物的微波合成制备方法及其在改善脂代谢紊乱方面的应用。
背景技术:
随着现代研究的深入,对代谢综合征发生机制的认识已从“胰素抵抗-血糖”中心论转向以“脂代谢紊乱”为中心。“糖尿病脂毒性学说”认为脂代谢异常可以引起胰岛素敏感组织的脂沉积,从而致使胰岛素敏感组织功能的异常,发挥其脂毒性作用。另外,脂代谢紊乱及脂质异常沉积还可以促进免疫细胞及固有细胞分泌大量炎性因子以激活炎症通路。研究证实,超过50%的t2dm患者,在糖尿病初期即有以高甘油三酯(tg)为主的脂代谢异常及非酒精性脂肪肝。糖尿病的血脂异常既包括脂蛋白数量和质量的异常又包括脂蛋白代谢的紊乱。t2dm典型脂谱:主要以高密度脂蛋白(hdl)水平降低,总胆固醇(tc)、甘油三酯(tg)和低密度脂蛋白(ldl)水平升高,小而密的ldl和hdl、餐后脂血症和过多的残粒堆积为特征。其中,低密度脂蛋白(简称ldl),能对动脉造成损害,而高密度脂蛋白(简称hdl)主要由肝和小肠合成,是一种抗动脉粥样硬化的血浆脂蛋白,俗称“血管清道夫”。游离脂肪酸(ffa)是指血中非酯化的脂肪酸,是脂肪代谢的中间产物,也是人体主要能源物质之一,ffa的变化相比于血清中甘油三酯、总胆固醇能更敏感地反映机体脂代谢情况。ffa浓度渐渐升高,说明患者表现出严重脂代谢异常。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供壳寡糖双胍衍生物及其微波合成方法,将二甲双胍的结构引入到壳寡糖中,该产物既具有改善脂代谢紊乱功效,又具有天然性、安全性和独特的生物活性,且该方法生产效率高,操作工艺简单,反应过程清洁环保,产品性能好。
本发明的技术目的通过下述技术方案予以实现:
壳寡糖双胍衍生物,以壳寡糖和双氰胺反应制备,以壳寡糖侧基nh2和双氰胺在盐酸和微波条件下进行反应并形成与壳寡糖键接的双胍基团,如下化学式所示:
壳寡糖是自然界中唯一带有正电荷的碱性氨基寡糖,它的分子量小,溶解性很好,容易被生物体吸收利用,重均分子量为3000以下,优选1500—3000(kda),脱乙酰度在97%以上,优选97—99%。
壳寡糖双胍衍生物中,双胍取代度为40—60%,优选45—55%。
上述化学式中,m和n分别为壳寡糖中乙酰化单元和脱乙酰化单位的聚合度。
壳寡糖双胍衍生物的制备方法,按照下述步骤进行:将壳寡糖分散在盐酸中并在微波160w~560w条件下搅拌,进行第一步微波反应;之后加入双氰胺水溶液并使用盐酸调整反应体系ph值为1—2,继续在微波160w~560w条件下搅拌,进行第二步微波反应,以使壳寡糖和双氰胺反应制备壳寡糖双胍衍生物,具体如下式所示:
其中在第一步微波反应中,微波功率为300—400w,反应时间为3—7min,优选5—7min,搅拌速度为每分钟100—200转。
在第二步微波反应中,微波功率为300—400w,反应时间为10—20min,优选15—20min,搅拌速度为每分钟100—200转。
反应结束后,将反应液冷却至室温,对混合溶液进行醇沉,烘干,研磨,得到壳寡糖双胍衍生物粉末。
双氰胺与壳寡糖中氨基的摩尔比为(0.5—3):1,优选(1—3):1,更加优选1:1。
盐酸为0.2~0.8mol/l的氯化氢水溶液,使用盐酸调整反应体系ph值为1。
本发明生产效率高,操作工艺简单,反应过程清洁环保,产品性能好。经动物实验证实,本发明中的壳寡糖双胍衍生物可明显降低其血清胆固醇(tc)、甘油三酯(tg)、低密度脂蛋白(ldl)和游离脂肪酸(ffa)水平,升高高密度脂蛋白(hdl)水平,原料壳寡糖重均分子量为1500以及衍生物55%胍取代度的效果更好,有明显的改善脂代谢紊乱的作用,且与单独使用二甲双胍相比效果更佳。
附图说明
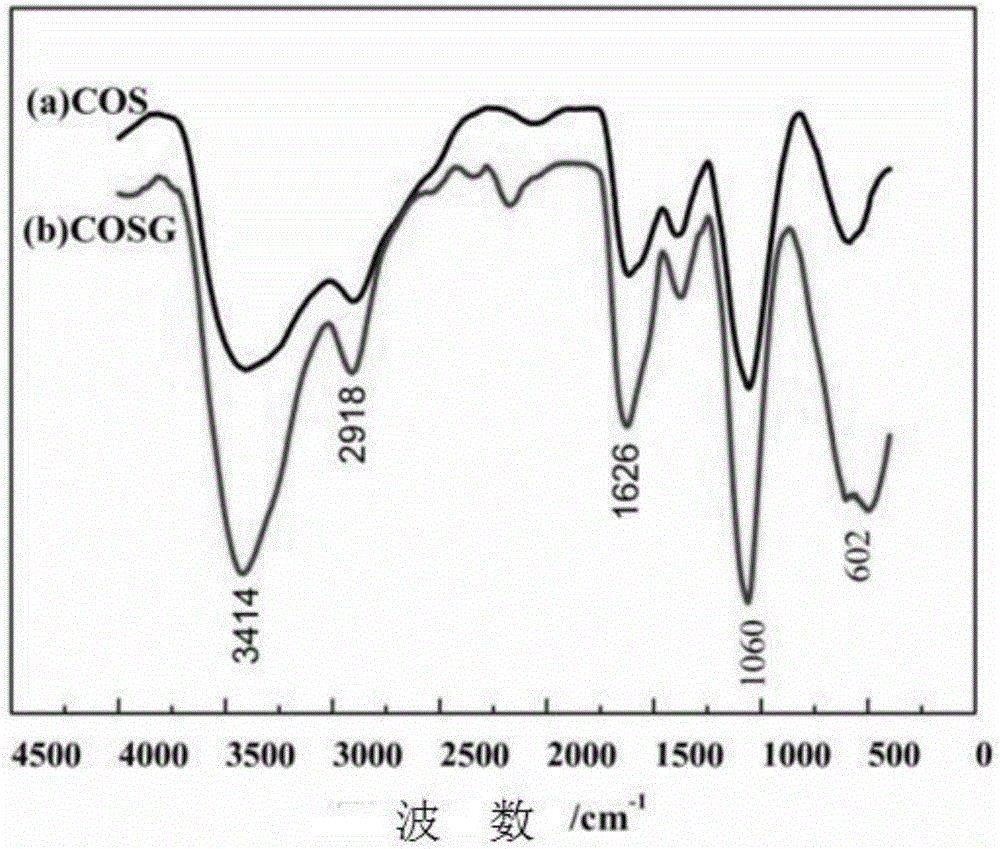
图1为本发明中壳寡糖(cos)和壳寡糖胍(cosg)的红外光谱图。
图2为本发明中壳寡糖(cos)和壳寡糖胍(cosg)的13c图谱。
图3为cosg对stz诱导的糖尿病大鼠的血糖的动态变化,其中数据是均值±标准差,n=6,#p<0.05,##p<0.01,###p<0.001和空白对照组相比,*p<0.05,**p<0.01,***p<0.001和模型组相比。
图4为cosg对stz诱导的糖尿病大鼠血清tc含量的影响,其中数据是均值±标准差,n=6,#p<0.05,##p<0.01,###p<0.001和空白对照组相比,*p<0.05,**p<0.01,***p<0.001和模型组相比。
图5为cosg对stz诱导的糖尿病大鼠血清tg含量的影响,其中数据是均值±标准差,n=6,#p<0.05,##p<0.01,###p<0.001和空白对照组相比,*p<0.05,**p<0.01,***p<0.001和模型组相比。
图6为cosg对stz诱导的糖尿病大鼠血清ldl含量的影响,其中数据是均值±标准差,n=6,#p<0.05,##p<0.01,###p<0.001和空白对照组相比,*p<0.05,**p<0.01,***p<0.001和模型组相比。
图7为cosg对stz诱导的糖尿病大鼠血清hdl含量的影响,其中数据是均值±标准差,n=6,#p<0.05,##p<0.01,###p<0.001和空白对照组相比,*p<0.05,**p<0.01,***p<0.001和模型组相比。
图8为cosg对stz诱导的糖尿病大鼠血清ffa含量的影响,其中数据是均值±标准差,n=6,#p<0.05,##p<0.01,###p<0.001和空白对照组相比,*p<0.05,**p<0.01,***p<0.001和模型组相比。
具体实施方式
下面是对本发明的进一步说明,而不是限制本发明的范围。选择进行机械搅拌,搅拌速速为每分钟150转。
实施例1壳寡糖双胍衍生物的制备(双胍取代度为55%)
按照原料配比为1:1称取1.44g双氰胺置于锥形瓶中,加入15ml蒸馏水,在50℃恒温震荡培养箱中振荡溶解双氰胺。待壳寡糖(重均分子量3000)和双氰胺均完全溶解后,将双氰胺水溶液倒入盛有壳寡糖盐酸溶液的四口瓶中,使用1mol/l的盐酸调节溶液ph=1。在微波功率为400w,微波时间为15min条件的下进行反应。反应结束后,对混合溶液醇沉,抽滤,烘干,研磨,得到壳寡糖双胍衍生物粉末cosg。产物经红外光谱、核磁共振谱等鉴定为壳寡糖双胍衍生物,如附图1和2所示。
cos的红外光谱图中,3414cm-1附近处的强吸收峰为缔合氢键的o-h和n-h伸缩振动吸收峰部分重叠而增宽的多重吸收峰。由于cos分子中存在大量的分子间、分子内氢键,且氢键的长短、强弱也不尽相同,因此其伸缩振动峰出现在较宽的频率范围内。2918cm-1左右为c-h的伸缩振动吸收峰。1626cm-1附近处为仲胺的n-h伸缩振动峰。此外,指纹区的1060cm-1附近处为仲胺的n-h面内弯曲振动吸收峰,因为cos脱乙酰化并不完全,分子中含有少量的-nh-co-结构,故在该处有吸收峰;602cm-1附近处对应着n-h的面外摇摆振动吸收带。与cos相比,cosg在1626cm-1处、1060cm-1附近处吸收峰明显增强,这两个峰都是仲胺基团的特征峰,说明分子内仲胺类基团增多,表明cos氨基上发生了胍基化反应。此外,3414cm-1附近处吸收峰为缔合氢键的o-h和n-h伸缩振动吸收峰部分重叠而增宽的多重吸收峰,由于cos分子中存在大量的分子间、分子内氢键,且氢键的长短、强弱也不尽相同,因此其伸缩振动峰出现在较宽的频率范围内,而cosg相对于cos,该峰明显增强,同样说明分子内n-h含量增多,表明了cos氨基上发生了胍基化反应。
壳聚糖环上各个c的化学位移为:c1:97.03,c4:76.03,c5:75.01,c3:71.49,c6:60.23,c2:56.23。壳寡糖是壳聚糖降解后得到的,因此,其糖环上各个c化学环境,化学位移也应与壳聚糖一致。用13cnmr分析技术进一步确定壳寡糖改性后的结构变化,壳寡糖胍盐的化学位移分别为:c7:165.21,c8:155.13,c1:98.91,c4:78.17,c5:77.03,c3:69.13,c6:60.17,c2:56.43。其中c7:165.21和c8:155.13处新出现的碳的化学位移确定了胍基团的存在。
在确定壳寡糖和双氰胺反应生成胍基团后,本发明使用naoh标准溶液滴定产物,测得产物的胍取代度ds并以此为判断标准。naoh和壳寡糖胍中的=nh2+cl-反应,滴定等当点时,ph发生突变,naoh摩尔数等于产物中的=nh2+cl-摩尔数。壳寡糖胍的ds可用下列式计算:
式中:
n1——被胍基取代的结构单元摩尔数;
n2——未被胍基取代的结构单元摩尔数;
δv——到达突越点(ph=9.1)消耗naoh的体积/ml;
cnaoh——naoh标准溶液的浓度/mol·l-1;
g——产品质量/g;
318——被胍基取代的结构单元的相对摩尔质量/g·mol-1;
161——未被胍基取代的结构单元的相对摩尔质量/g·mol-1;
ds——(双)胍取代度/%。
在本发明内容记载的工艺参数基础上进行变更,以实现壳寡糖双胍衍生物的制备并测试其双胍取代度,可达40—60%,其中各个参数的影响如下:微波辐射功率对产率和胍取代度的影响:随着微波辐射功率的增加,取代度逐渐增加,而产率呈现先增加后减小的趋势,原因是过高的微波辐射功率将导致更多的副反应发生。反应时间对产率和胍取代度的影响:随着反应时间的延长,产率和胍取代度提高,达到一定时间后取代度无明显增加。反应物配比对产率和胍取代度的影响:随着壳寡糖结构单元与双氰胺物质量配比增大,胍取代度也逐渐升高,当反应物配比增大到一定值时,产率达到最大值。继续增加反应物配比,由于加入的原料不易溶解,不利于反应的进行,产率有所下降。反应溶剂的选择:反应溶剂对胍取代度的影响较大。选用盐酸作为反应溶剂得到的产率和胍取代度较高,这是由于用盐酸作为极性溶剂,反应在给质子化的液体介质中进行,双氰胺分子中氰基质子化程度较大,反应活性较强。
实施例2选取实施例1中制备的壳寡糖双胍衍生物粉末cosg进行动物药效学实验
通过以下动物实验对本发明应用效果作进一步说明。
1、实验动物及分组
实验动物选用sd成年雄性大鼠30只,每组6只,总共5组,清洁级,体重在500克左右,由天津市动物实验中心提供。动物分笼饲养,动物每笼4~5只。动物饲养实验室符合国标清洁级,空间30m2,室内照明控制在12h/12h光暗周期节律。室内平均气温23℃,相对湿度50%~60%。
30只大鼠分为对照组(标记为c,即空白组),模型组(标记为m,即诱发糖尿病并灌水),二甲双胍组(标记为met,即诱发糖尿病并给药甲福明),壳寡糖组(标记为cos,即诱发糖尿病并给药壳寡糖,重均分子量1500),壳寡糖胍组(标记为cosg,即诱发糖尿病并给药实施例1中制备的壳寡糖双胍衍生物粉末cosg)5组。对照组喂食正常饮食,其他组饲喂高脂肪和高糖饮食1周,然后禁食12小时,然后以25mg/kg的剂量静脉注射stz至尾静脉,构建糖尿病肾病大鼠模型(即诱导大鼠产生糖尿病发病)。实验组按照500mg/kg的剂量灌胃给药(溶于蒸馏水,ph值为7),模型组用相应剂量的蒸馏水进行灌胃。所有大鼠每天一次给予胃洗液,直到实验结束。
2、标本采集
针对动物实验需检测的指标,对实验大鼠血清作如下处理,用于下面各项检测。
血液样品的采集:分别在第二周、第四周和第六周的周二采血,采血前12h内隔夜禁食但不禁水,第二周和第四周采用内眦取血(约2ml),第六周实施股动脉处放血术,处死大鼠,收集血样。静置血样1h后,对其进行离心处理,转速2500r/min,时间20min,取上清液制备血清。
3、研究情况
1)对stz诱导的大鼠血糖含量的影响:
大鼠在6周内出现高血糖症。研究结束时,他们表现出糖耐量降低和空腹血糖显著升高的症状。相对于模型对照组,cosg组中cosg的治疗显著降低了空腹血糖水平(时间为0时)。在葡萄糖耐量试验中,和模型对照组相比,使用cosg治疗的糖尿病大鼠在摄入葡萄糖120分钟后的血糖水平显著降低。然而,用cosg治疗的糖尿病大鼠的血糖水平仍高于空白对照组。模型组的血清葡萄糖比空白对照组的高很多。和模型组相比,用cosg治疗使血清葡萄糖大概降低了31%(图3)。
2)对stz诱导的大鼠血清tc含量的影响:
糖尿病患者经常会出现高血脂症,高血脂症通常表现为脂蛋白、载脂蛋白等的代谢异常,使血浆中一种或几种脂质比正常水平偏高或者偏低,如胆固醇、甘油三酯和低密度脂蛋白高于正常水平,而高密度脂蛋白低于正常水平。
从图中可看出,模型组tc含量明显高于正常对照组,而且数据显示出显著性差异。在经过met,cos和cosg的治疗后,tc含量都有所下降,而且cosg组中的治疗效果比met和cos效果更佳(图4)。
3)对stz诱导的大鼠血清tg含量的影响:
从图中可看出,模型组tg含量明显高于正常对照组,而且数据显示出显著性差异。在经过met,cos和cosg的治疗后,tg含量都有所下降。其中,met治疗后下降效果不明显,与模型组相比稍有下降。cosg组中的治疗效果比met和cos效果更佳(图5)。
4)对stz诱导的大鼠血清ldl含量的影响:
血清中低密度脂蛋白(ldl)含量升高,可对动脉造成损害。从图中可看出,模型组ldl含量明显高于正常对照组,而且数据显示出显著性差异。在经过met,cos和cosg的治疗后,ldl含量都有所下降。其中,met治疗效果十分明显,而cosg组中的治疗效果比cos治疗效果更佳(图6)。
5)对stz诱导的大鼠血清hdl含量的影响:
高密度脂蛋白(hdl)主要由肝和小肠合成,是一种抗动脉粥样硬化的血浆脂蛋白。对于高密度脂蛋白含量,模型组含量明显低于正常对照组。与模型组相比,在经过met,cos和cosg的治疗后,hdl含量均有所上升,而且cosg组中的治疗效果比met和cos效果更佳(图7)。
6)对stz诱导的大鼠血清游离脂肪酸(ffa)含量的影响:
大鼠游离脂肪酸(ffa)变化相比于血清中甘油三酯、总胆固醇能更敏感地反映机体脂代谢情况。而且血浆中增多的ffa可通过使机体活性氧增加促成氧化应激反应的发生,同时削弱机体的抗氧化能力。ffa浓度渐渐升高,说明2型糖尿病肾病患者表现出严重脂代谢异常。
从图中我们可以看出,模型组的游离脂肪酸含量均高于正常对照组,出现显著性差异。而与模型组相比,在经过met,cos和cosg的治疗后可使大鼠ffa含量有不同程度的下降,而且cosg组中的治疗效果比met和cos效果更佳(图8)。通过上述实验和分析可知,本专利发明的壳寡糖双胍衍生物能明显降低血清胆固醇(tc)、甘油三酯(tg)、低密度脂蛋白(ldl)和游离脂肪酸(ffa)水平,升高高密度脂蛋白(hdl)水平,即本发明壳寡糖双胍衍生物在制备治疗脂代谢紊乱药物中的应用(有效改善脂代谢紊乱的症状)。
根据本发明内容进行制备工艺参数的调整,均可实现壳寡糖的双胍取代制备,且表现出与实施例一致的性能。以上对本发明做了示例性的描述,应该说明的是,在不脱离本发明的核心的情况下,任何简单的变形、修改或者其他本领域技术人员能够不花费创造性劳动的等同替换均落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!