一种靶向胰腺癌的核酸多肽纳米药物及其制备方法与流程
本发明属于靶向胰腺癌的纳米颗粒药物,主要是一种靶向胰腺癌的核酸多肽纳米药物及其制备方法。
背景技术:
目前,尚未有批准应用于临床的靶向胰腺癌的药物。但有大量靶向治疗药物正在胰腺癌临床试验中,如以血管内皮生长因子(vegf)和表皮生长因子(egf)为靶点的靶向抗癌药,以及针对肿瘤环境下的免疫系统的肿瘤疫苗等。
现有的靶向药物应用于胰腺癌临床试验数据包括:
1、egfr靶点:
厄洛替尼,一项ⅲ期临床试验显示,厄洛替尼联合吉西他滨相比吉西他滨单药治疗,可明显延长胰腺癌患者的整体os,其中位os分别为6.24和5.91个月,一年存活率分别为23%和17%(p=0.023),无进展生存期(pfs)也有所延长(分别为3.75和3.55个月)。另有一项研究显示,厄洛替尼联合吉西他滨治疗局部晚期或转移性胰腺癌,可使患者的整体os显著增加,但相关的药物不良反应也有所增加。
西妥昔单抗(爱必拓),爱必拓对胰腺癌患者没有显著的疗效,相反其药物不良反应发生率较高。
吉非替尼,易瑞沙在胰腺癌的治疗中也未显示具有良好的疗效。
2、her2靶点:
曲妥珠单抗,her2在胰腺癌标本中的表达水平相对较低,一项多中心ⅱ期临床试验研究显示,接受曲妥珠单抗联合卡培他滨治疗方案组与卡培他滨单药治疗组胰腺癌患者的中位os分别为6.9和6.0个月,在生存期上并无明显获益。
3、mapk抗体
胰腺癌很多涉及到kras基因突变,相关研究显示,对于吉西他滨治疗无效的胰腺癌患者,司美替尼的疗效与卡培他滨近似(中位os分别为5.4和5.0个月)。曲美替尼联合egfr抗体和her2抗体可提高其抑制胰腺癌细胞增殖的效率,其机制可能是通过抑制mapk信号通路,反馈激活酪氨酸激酶信号通路。
4、mtor抑制剂
mtor抑制剂,依维莫司和替西罗莫司,已对吉西他滨耐药的胰腺癌患者进行了ⅱ期临床试验,但均未见明显疗效。另一种mtor抑制剂,雷帕霉素,也未能证实对胰腺癌患者具有疗效。
5、igf-ir抑制剂
一项ⅱ期临床研究表明,抗igf-ir单克隆抗体(ganitumab)可使igf-i高表达的晚期胰腺癌患者的生存期显著延长,ganitumab治疗组与空白对照组患者的中位os分别为16.0和6.8个月;但随后进行的一项ⅲ期临床试验结果显示,ganitumab联合吉西他滨治疗胰腺癌相较吉西他滨单药治疗对患者生存期并无明显改善,且增加了药物的不良反应。另有相关研究表明,igf-ir单克隆抗体(nvp-aew541)联合egfr单克隆抗体在胰腺癌的治疗中显示出可喜的结果,而另一种igf-ir单克隆抗体(cixutumumab)联合厄洛替尼和吉西他滨并未能延长伴有远处转移胰腺癌患者的生存期。
6、jak抑制剂
在血清c反应蛋白指标高水平(>13mg/l)的亚组中,卢佐替尼联合卡培他滨治疗组胰腺癌患者的中位os明显高于卡培他滨单药治疗组(分别为2.7和1.8个月)。因此,卢佐替尼联合卡培他滨可能会作为转移性胰腺癌患者二线治疗的新选择,现已经开始大规模的ⅲ期临床研究。
7、vegf抑制剂,抗血管生成药物
vegf在胰腺癌细胞中过表达,可能预示了不良的预后。虽然大多抗血管生成药物在临床前期所建立的胰腺癌模型中表现出潜在的疗效,但采用抗血管生成药物治疗胰腺癌患者,在临床上大多是无效的。多项ⅱ和ⅲ期临床试验表明,采用贝伐单抗联合吉西他滨和厄洛替尼治疗的胰腺癌患者并没有生存获益。其他的vegf抑制剂,如阿西替尼和阿柏西普都不能提供生存优势;索拉非尼的临床获益相比吉西他滨也无优势。
8、内皮抑素
内皮抑素是一种内源性血管生成的抑制剂,对生长的血管具有抑制作用,而对静止的血管组织不起作用,因而对多种依赖血管生成的实体瘤都有抑制作用。一项ⅱ期研究显示,胰腺癌患者对重组人血管内皮抑素的反应性低,但其药物毒性也较小。
9、mmps抑制剂
胰腺肿瘤的微环境主要是由广泛的细胞外基质(ecm)成分沉积组成,并促进结缔组织增生,这被认为是药物到达肿瘤的屏障,可能与原发性耐药有关。mmps是一类锌离子依赖性的细胞外基质蛋白水解酶,负责结缔组织蛋白的分解。然而,ⅱ期和ⅲ期研究表明,无论是mmps抑制剂单药还是联合吉西他滨用于治疗胰腺癌,均未见明显的临床获益。即便针对mmps相关临床试验中未得到预期的结果,但关于mmps抑制剂的研究仍在继续。
10、dna拓扑异构酶ⅰ抑制剂
一项ⅱ期临床试验显示,接受伊立替康联合吉西他滨治疗胰腺癌患者的中位os为11.8个月(95%可信区间为7.7-15.9),2年生存率为22%,且患者对药物的耐受性较好。
11、抑制微rna(micrornas,mirna)
研究发现,79%的胰腺癌患者中可有mirna-21的过度表达,且对于无淋巴结转移的胰腺癌患者,预示了不良预后(mir-21高表达与mir-21低表达胰腺癌患者的中位os分别为15.2和27.7个月);mir-21的表达也在对化疗药物抵抗的胰腺组织中多见,患者对吉西他滨药物反应性与其表达水平的高低成反比关系;通过给胰腺癌细胞导入以mir-221和mir-21为目标的反义寡核苷酸可诱导细胞凋亡,并提高患者对吉西他滨的药物敏感性。
从上面的研究来看,目前仍没有单一的靶向药物对胰腺癌具有显着的疗效;与常规化疗药物联用临床试验也表明,没有一种靶向药物明确能显著增强化疗效果。而临床上,目前也并没有针对胰腺癌的靶向药物获批用于胰腺癌患者。
技术实现要素:
本发明的目的在于克服现有技术存在的不足,而提供一种靶向胰腺癌的核酸多肽纳米药物及其制备方法。
本发明的目的是通过如下技术方案来完成的。这种靶向胰腺癌的核酸多肽纳米药物,胰腺癌靶向多肽与mirna自组装生成纳米复合物,分成两部分,其中一:嵌合肽pl-1是由一段胰腺癌靶向多肽通过四个甘氨酸接头将胰腺癌特异性肽与九个d-或l-精氨酸残基的n末端融合;二:嵌合肽pl-1通过静电相互作用捕获阴离子mirna,通过自组装形成纳米复合物。
更进一步的,一段精氨酸富集的多肽序列d型rrrrrrrrr,通过四个甘氨酸接头与胰腺癌靶向序列ktllptp通过n末端融合的方式连接,与核酸通过阴阳离子相互吸引的静电相互作用自组装形成纳米复合物;精氨酸为疏水性氨基酸,将于核酸紧紧包裹在里面,仅暴露出具有胰腺癌靶向性的疏水端。
本发明所述的这种靶向胰腺癌的核酸多肽纳米药物的制备方法,该方法具体步骤如下:
(1)、核酸多肽纳米颗粒合成:将一定多肽干粉用ddh2o溶解,浓度换算成400um;同时用depc水溶解核酸,配制成20um;取等体积核酸与多肽溶液室温混合,孵育15min,即可形成核酸多肽纳米颗粒;
(2)、多肽合成:选取fmoc-d-arg-wagresin树脂,六氢吡啶去除树脂上的fmoc;用hobt+dic为缩合剂加入第二个氨基酸fmoc-cys(trt)-oh反应;反应完全后,继续去除fmoc,接下一个氨基酸,循环直到接完最后一个;用tfa溶液处理做好的树脂,得到粗品多肽;溶解掉粗品多肽,加入配比好的谷胱甘肽低温下搅拌,隔6-12小时去打一下ms确认氧化状态,同时用巯基检测剂辅助判断是否氧化完全,氧化完全后送至纯化得到精品多肽;
(3)、mirna合成:化学合成后hplc纯化。
本发明的有益效果为:现有靶向药物并不能特异性的靶向作用于胰腺癌。本发明在体内外实验中均表明该纳米颗粒对胰腺癌具有特异的靶向亲和力并能显著增强化疗药治疗效果,为临床开发新型的胰腺癌靶向药物提供技术支持和临床前研究证据,结合多肽和mirna生成靶向纳米制剂,也为研发其他肿瘤药物提供新思路。期望寻找企业合作进行临床i期甚至ii-iv期验证,成为国内自主研发的多肽纳米靶向药物,提高胰腺癌患者生存率并降低副反应,并通过mirna合成和多肽合成等方法的优化,降低成本,减轻患者经济负担。
附图说明
图1:纳米复合物的自组装及序列表示意图。
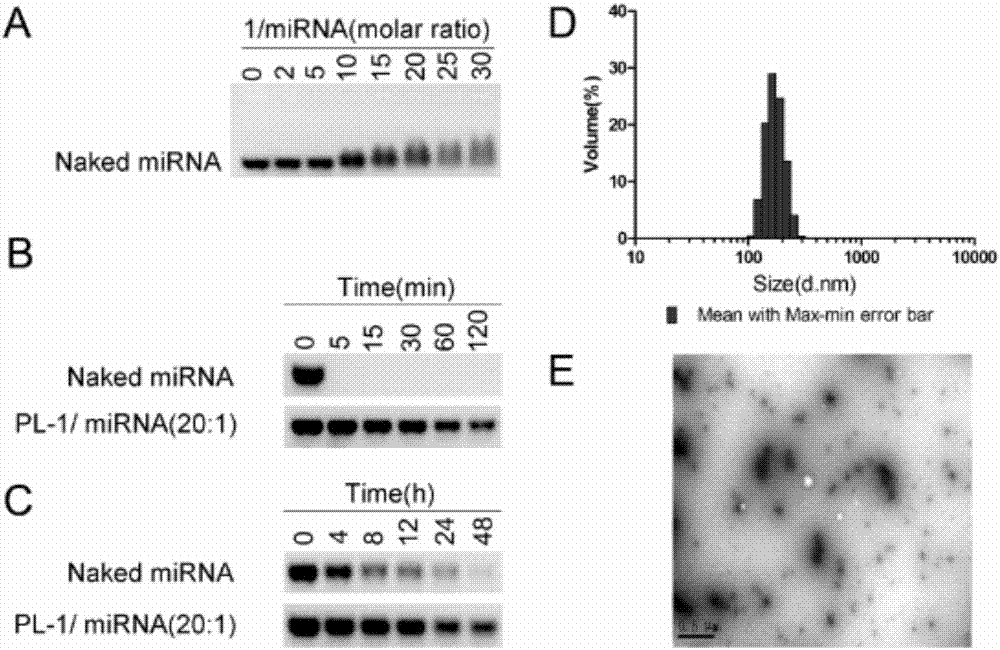
图2:纳米复合物的mirna与靶向多肽摩尔质量比、rna酶、血清稳定性和颗粒大小示意图。
图3:纳米复合物靶向性检测示意图
图4:纳米复合物对胰腺癌细胞活性及增殖抑制较常规转染试剂效果明显的示意图。
图5-1:体内检测纳米复合对胰腺癌肿瘤模型的治疗作用较常规转染试剂好的示意图1。
图5-2:体内检测纳米复合对胰腺癌肿瘤模型的治疗作用较常规转染试剂好的示意图2。
图5-3:体内检测纳米复合对胰腺癌肿瘤模型的治疗作用较常规转染试剂好的示意图3。
图5-4:体内检测纳米复合对胰腺癌肿瘤模型的治疗作用较常规转染试剂好的示意图4。
图5-5:体内检测纳米复合对胰腺癌肿瘤模型的治疗作用较常规转染试剂好的示意图5。
图6-1:纳米复合物对胰腺癌细胞促进凋亡和自噬的作用较常规转染试剂效果明显的示意图1。
图6-2:纳米复合物对胰腺癌细胞促进凋亡和自噬的作用较常规转染试剂效果明显的示意图2。
图6-3:纳米复合物对胰腺癌细胞促进凋亡和自噬的作用较常规转染试剂效果明显的示意图3。
图6-4:纳米复合物对胰腺癌细胞促进凋亡和自噬的作用较常规转染试剂效果明显的示意图4。
图6-5:纳米复合物对胰腺癌细胞促进凋亡和自噬的作用较常规转染试剂效果明显的示意图5。
具体实施方式
下面将结合附图对本发明做详细的介绍:
本发明中胰腺癌靶向多肽与mirna自组装生成纳米颗粒,用于直接治疗胰腺癌或者与其它治疗手段(如化疗)联合用于治疗胰腺癌。
胰腺癌靶向多肽与mirna自组装生成纳米复合物,分成两部分,其中一:嵌合肽(pl-1)是由一段胰腺癌靶向多肽(氨基酸序列:ktllptp)通过四个甘氨酸接头将胰腺癌特异性肽与九个d-或l-精氨酸残基(阳离子)的n末端融合。二:嵌合肽(pl-1)通过静电相互作用捕获阴离子mirna,通过自组装形成纳米复合物。示意图见图1。
f1-a表示嵌合肽pl-1(一段精氨酸富集的多肽序列d型rrrrrrrrr,通过四个甘氨酸接头与胰腺癌靶向序列ktllptp通过n末端融合的方式连接)与核酸通过阴阳离子相互吸引的静电相互作用自组装形成纳米复合物。精氨酸为疏水性氨基酸,将于核酸紧紧包裹在里面,仅暴露出具有胰腺癌靶向性的疏水端。
f2-b为pl-1与sp-94dr多肽的氨基酸序列。其中pl-1为胰腺癌靶向多肽,而sp-94dr为非胰腺癌靶向多肽,为后续试验对照作用。
具体制备方法如下:
1:核酸多肽纳米颗粒合成方式如下:将一定多肽干粉用ddh2o溶解,浓度换算成400um;同时用depc水溶解核酸,配制成20um;取等体积核酸与多肽溶液室温混合,孵育15min,即可形成核酸多肽纳米颗粒。
2:多肽合成,由试剂公司完成,具体方法如下:选取fmoc-d-arg-wagresin树脂;六氢吡啶去除树脂上的fmoc;用hobt+dic为缩合剂加入第二个氨基酸fmoc-cys(trt)-oh反应;反应完全后,继续去除fmoc,接下一个氨基酸,循环直到接完最后一个;用tfa溶液处理做好的树脂,得到粗品多肽;溶解掉粗品多肽,加入配比好的谷胱甘肽低温下搅拌,隔6-12小时去打一下ms确认氧化状态,同时用巯基检测剂辅助判断是否氧化完全;氧化完全后送至纯化得到精品多肽。
3:mirna合成,由试剂公司采用化学方法合成。
本发明的纳米粒,有效的将mirna包裹其中,纳米大小颗粒均匀,具有较好的酶和血清稳定性,使其在血液中稳定直至到达胰腺癌组织内并发挥作用。(f2)
本发明的效果验证:已验证pl-1/mir212,pl-1/mir-9对胰腺癌的治疗作用。
1、pl-1/mir-212纳米颗粒递送给pdac细胞。
用cy3标记的mirna-212和pl-1组装的纳米颗粒转染不同的肿瘤细胞6小时。然后,在正常细胞培养基中进一步培养12小时后,通过流式细胞术检测细胞。如图3a所示,肺癌细胞株nci-h1299和a549中cy3阳性细胞的比例分别为0.4%和0.4%。然而,胰腺癌细胞株panc-1和cfpac-1中的相应比例分别为90.1%和43.4%。这些结果表明纳米颗粒对pdac细胞的优异靶向亲和力(图3a)。
为了进一步验证mirna-212进入pdac细胞并探索内在化的潜在机制,通过活细胞共聚焦荧光显微镜检测了pdac细胞对pl-1/cy3-mir-212纳米颗粒的摄取。在高度放大的显微镜图像中,转染6h后,在panc-1和cfpac-1细胞的细胞质中观察到来自cy3-mir-212的可见荧光信号。此外,cy3-mir-212信号的细胞内定位与来自fitc标记的葡聚糖,内体/溶酶体追踪器的信号显着重叠(图3b)。
为了进一步研究pl-1/mir-212的功能,进行蛋白质表达检测,usp9x是mir-212的下游靶点(图3c),在pl-1-和脂转染介导的转染中通过western印迹检测pdac细胞。pl-1/mir-212纳米颗粒明显导致usp9x在panc-1和cfpac-1细胞中的表达显着降低。相比之下,脂质体介导的转染导致usp9x的下调更少(图3d)。此外,通过rt-pcr也证实了两种转染后递送至pdac细胞的mir-212的量和usp9x的相应mrna表达。与pani-1和cfpac-1细胞相比,pl-1/mir-212纳米颗粒转染显着高于脂质体转染,mir-212表达明显高于对照组(图3e)。此外,rt-pcr结果表明,与对照组相比,pl-1/mir-212纳米颗粒转染同时导致比lipofectamine介导的转染显着更少的usp9xmrna表达(图3f)。
2、pl-1/mir-212纳米颗粒使体外pdac细胞对多柔比星敏感。
采用cck-8测定方法测定不同治疗方案后的相对细胞活力。与阴性对照组相比,多柔比星联合pl-1/mir-212转染的panc-1和cfpac-1细胞的细胞活力显着降低。值得注意的是,进行pl-1/mir-212纳米颗粒处理的细胞对阿霉素的敏感性高于脂质体治疗组(图4a)。并且用多柔比星联合pl-1/mir-212处理的panc-1和cfpac-1细胞计算的ic50值分别为0.5591μg/ml和0.4319μg/ml,明显低于两种细胞系计算的相对值用多柔比星和lipofectamine(panc-1:0.8316μg/ml,cfpac-1:0.6467μg/ml)或阴性对照组(图4b)。
进一步用edu实验,测定评估细胞增殖,与对照组或多柔比星组相比,mir-212干预组合多柔比星导致panc-1和cfpac-1细胞中af488-edu的荧光信号明显降低。此外,根据cck-8测定的结果,通过pl-1/mir-212纳米粒子转染的多柔比星治疗导致细胞增殖显着降低,约16%的edu阳性(panc-1:16.3±0.87%cfpac-1:16.2±1.04%(图4c),低于通过脂质体转染的mir-212干预组(panc-1:31.3±0.91%,cfpac-1:37.4±1.19%)。
3、pl-1/mir-212纳米颗粒增强多柔比星对pdac的体内功效。
为了研究多柔比星和pl-1/mir-212纳米颗粒联合治疗pdac的体内作用,建立了pdx小鼠模型。在不同的治疗方案期间每两天测量裸鼠的肿瘤体积和体重。发现单独腹膜内注射多柔比星两周可抑制肿瘤生长。多柔比星与静脉注射pl-1/mir-212纳米颗粒的联合给药可显著增强化疗药对肿瘤生长的抑制作用。相比之下,mir-212和肝细胞癌细胞特异性sp94dr肽的组合没有发挥类似的治疗作用(图5a和b)。同时,在化疗过程中,单独使用多柔比星和多柔比星和纳米颗粒组合组之间的裸鼠重量之间没有观察到显着差异(图5d)。两周后,将小鼠安乐死,将肿瘤切开并称重。如图5a-c所示,pl-1/mir-212纳米颗粒显着增加多柔比星对pdac异种移植物的疗效,肿瘤消退率为68.82±8.6%。进一步的免疫组织化学测定实验表明,与多柔比星单独组相比,pl-1/mir-212纳米颗粒的掺入导致更高的tunel阳性和较低ki67阳性或usp9x阳性pdac细胞比例(图5e-j)。另外,静脉注射近红外荧光(nirf)探针cy5.5标记的mir-212纳米颗粒后4h和24h,处死小鼠,观察肿瘤部位,nirf图像显示,与不可靶向的精氨酸/mir-212纳米颗粒相比,在施用pl-1/mir-212纳米颗粒后,cy5.5信号在胰腺肿瘤中更高度分布(图5k)。免疫组织化学结果还显示,与其他组相比,多柔比星上调usp9x表达,而pl-1/mir-212纳米颗粒可有效降低usp9x表达(图5i)。
4、pl-1/mir-212纳米颗粒增加多柔比星诱导的凋亡和自噬。
为了研究pl-1/mir-212纳米颗粒更有效的治疗pdac的机制,首先检测通过不同处理后的pdac细胞中mir-212的下游效应蛋白usp9x的western印迹进行检测。与对照组相比,多柔比星治疗显着促进了panc-1和cfpac-1细胞中usp9x和波形蛋白的蛋白表达。然而,通过pl-1或脂质体转染的组合的mir-212干预逆转多柔比星诱导的usp9x和波形蛋白的高表达,同时导致lc3-ii/lc3-i和活化的caspase3的表达上调。值得注意的是,在pl-1/mir-212纳米颗粒介入后,蛋白质的改变比通过lipofectamine的mir-212干预更明显(图6a)。
为了评估在mir-212干预后多柔比星诱导的pdac细胞凋亡,进行流式细胞仪测定不同处理下pdac细胞的相对凋亡率。通过pl-1或lipofectamine联合多柔比星和mir-212的干预导致比单独的多柔比星更高量的fitc阳性/pi阳性pdac细胞(凋亡细胞)。多柔比星和pl-1/mir-212纳米颗粒联合治疗导致panc-1和cfpac-1细胞的凋亡率为40.2±0.68%,明显高于通过lipofectamine的mir-212干预组的23.1±1.04%(图6b)。
为了进一步探讨mir-212干扰对pdac细胞自噬流的影响,用gfp-rfp-lc3质粒转染panc-1和cfpac-1细胞,探针监测自噬体和自体脂质体的形成。不同处理之后在共聚焦显微镜下观察细胞,图6c。可以在对照pdac细胞中观察到几个点状荧光图案,鉴定gfp阳性/rfp阳性自噬体(黄点)和gfp阴性/rfp阳性自溶体(红点)。多柔比星治疗导致点状荧光图案的积累。此外,在组合的mir-212干预组中也发现显着增加的黄色和红色斑点数量。对于pl-1/mir-212纳米颗粒组,观察到的红色斑点的增加明显高于通过lipofectamine的两种细胞类型的mir-212干预,表明更无阻碍的自噬流。此外,tem观察结果与双荧光测定观察到的结果一致(图6d)。
可以理解的是,对本领域技术人员来说,对本发明的技术方案及发明构思加以等同替换或改变都应属于本发明所附的权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!