细胞自噬抑制剂及其制备方法与应用与流程
本发明属于医药技术,具体涉及以茜草科类型环肽作为有效成分的细胞自噬抑制剂,及其制备方法与应用。
技术背景
kras基因是细胞内信号传导途径中的“下游区”的一种信号传导蛋白,对细胞的生长存活和分化等具有重要的影响。正常生理情况下,在细胞受到外界刺激后激活egfr等信号通路,野生型的kras被活性egfr等酪氨酸激酶磷酸化后短暂活化,活化后的kras可以激活信号通路下游的信号蛋白,而后kras迅速失活,kras激活/失活效应是受控的。突变型kras蛋白导致蛋白功能异常,在无egfr活化信号刺激下仍处于激活状态,其功能状态不可控,导致肿瘤细胞持续增殖等,如kras突变型的hct116细胞。kras突变型又分为kras依赖型如h441、h358细胞及非依赖型如a549、h460细胞,其中kras依赖型的肿瘤细胞生长存活完全依赖于kras基因。在多种人类癌症中,kras基因在人类恶性肿瘤中包括结肠癌、直肠癌、肺癌和胰腺癌频发突变,使得相关癌症难以治疗。针对kras基因激活突变进行靶向药物治疗,成为医药工作者的极佳选择,遗憾的是迄今为止临床上仍无有效治疗kras基因突变肿瘤的药物策略。近些年来,通过全基因组rnai筛选,国际领先课题组己发现了多个与癌基因kras具有协同致死关系的基因,tak1就是其中之一,抑制tak1的活性可诱导kras依赖的细胞凋亡,tak1的活性对维持kras依赖的细胞生存很重要,故应用tak1抑制剂能选择性抑制kras依赖的肿瘤细胞生存,为kras依赖肿瘤细胞提供新的靶向治疗策略。
细胞自噬是一种细胞分解代谢过程,在细胞的生长、分化、体内平衡和营养缺乏的条件下细胞存活发挥着重要的作用,是一种机体重要的自我保护和防御机制。细胞自噬具体指细胞内的双层膜结构将部分细胞质、受损的蛋白质以及衰老或损伤的细胞器如线粒体、高尔基体、内质网等包裹形成自噬小体,递送至溶酶体,并与之融合形成自噬溶酶体,通过蛋白质水解酶水解内容物进行消化降解,以满足细胞自身的代谢及更新。kras依赖的肿瘤细胞具有较高的基底自噬,饥饿及肿瘤发生条件下,较高的基底自噬对肿瘤细胞的生存所必须。在kras依赖的肿瘤细胞中,激活tak1从而激活tak-ampk信号通路增强肿瘤细胞的基底自噬,保护细胞免受trail诱导的细胞死亡。
聚合物胶束是纳米体系研究的重要内容之一,已成为近年来的研究热点。聚合物胶束包括两个部分,载药的疏水核心和亲水性外壳。两亲性嵌段聚合物包括疏水段和亲水段,在水溶液中浓度超过临界胶束浓度,疏水段相互靠近,形成疏水核心,亲水段面向外侧形成亲水性外壳,自发地形成胶束,疏水性药物通过疏水作用或者共价结合的方式被包在疏水核心,因此聚合物胶束作为水难溶性药物载体,在传递药物过程中显示出巨大的优势和潜力。聚合物胶束能够传递各种类型的药物,包括低分子量的抗癌药、显影剂、蛋白质、质粒dna、逆转录dna等,当前亦有较多的抗肿瘤候选药物正在以该种剂型进行临床实验,如阿霉素、紫杉醇,这些研究证明胶束作为纳米给药系统具有很好的使用价值,为开发胶束纳米给药系统药物的研发提供了坚实的实践基础。
茜草科类型环肽(rubiaceae-typecyclopeptides,ras)为茜草科植物所特有,普遍存在于茜草属植物中,是一类双环均环六肽类化合物,主要由一个d-型α-丙氨酸、一个l-型α-丙氨酸、三个l-型n取代α-酪氨酸和一个其他l-型编码的α-氨基酸以肽链相连形成的环六肽,六个氨基酸缩合成十八元环,其中两个邻位的酪氨酸之间的苯环经氧桥连接形成一个具有较大张力的十四元环。ras因其新颖的双环结构和显著的体内外抗肿瘤活性而备受关注。我们前期研究表明,ras能抑制tak1的激酶活性(中国发明专利号:cn201410445325.0)。现有技术中未见有茜草科类型环肽抑制kras突变,尤其是kras依赖的肿瘤细胞保护性自噬促进其凋亡、及其纳米胶束注射剂作为抗肿瘤药物的制备方法及其应用。
技术实现要素:
针对现有技术的空白,本发明的目的在于提供一种以茜草科类型环肽化合物为有效成分的细胞自噬抑制剂,特别是抑制kras突变,尤其是kras依赖的肿瘤细胞保护性自噬、促进肿瘤细胞凋亡,本发明还提供了上述茜草科类型环肽化合物的纳米胶束注射剂及其制备方法与应用。
技术方案:本发明所述的细胞自噬抑制剂,其有效成分为茜草科类型环肽。
进一步的,所述抑制剂特别适用于抑制kras突变,尤其是kras依赖的肿瘤细胞保护性自噬,诱导肿瘤细胞凋亡。
具体的,本申请以kras依赖的肿瘤细胞为对象,用ras处理培养的肿瘤细胞,采用westernblot方法检测自噬相关蛋白,gfp-lc3转染检测自噬泡形成,并检测细胞死亡的程度,证实所述的化合物抑制细胞保护性自噬;以kras依赖的肿瘤细胞为对象,用ras处理培养的肿瘤细胞,采用westernblot方法检测凋亡相关蛋白,pi/annexinv双染检测凋亡细胞比例,证实所述的化合物诱导细胞凋亡。选择kras突变的hct116移植瘤模型及kras依赖的h441移植瘤模型评价ras体内抗肿瘤活性。
进一步的,所述茜草科类型环肽为如下结构式所示的ra-v(1)或ra-xii(2)。
所述抑制剂可以为任何药物治疗学上可接受的剂型,其使用剂量为任何药物治疗学上可接受的剂量。
所述抑制剂优选为纳米胶束注射剂。所述纳米胶束注射剂的制备方法是,以茜草科类型环肽为有效成分,以嵌段共聚物为载体,形成嵌段共聚物胶束,这样可以明显提高有效成分的溶解度和生物利用度,改善其药物代谢动力学的性质,提高了疗效。其中,所述嵌段共聚物载体材料优选为mpeg2000-pdlla2000两亲性嵌段共聚物。
具体的,所述纳米胶束注射剂的制备方法包括以下步骤:将有效成分和mpeg2000-pdlla2000嵌段共聚物共溶于有机溶剂中,振摇使其充分溶解混合均匀,真空旋蒸除去有机溶剂,得混合药膜,然后加入注射用水,振荡充分溶解药膜,得胶束溶液;微孔滤膜过滤除菌,冷冻干燥,无菌条件下分装,制得纳米胶束注射剂。
在本发明中,所述胶束是胶体分散系中的一种,属于缔合胶体,是两亲性嵌段聚物在溶液中的浓度超过某一临界值后,其分子或离子自动缔合成的胶体大小的聚集体纳米微粒,用于药物的增溶,也可作为给药系统的载体,提高稳定性,增强疗效,降低毒性。本发明所述的聚合物胶束制剂,能够明显提高有效成分的水溶性,利用聚合物胶束对于肿瘤血管的渗透性和滞留效应(epr效应),使得纳米胶束被动靶向而浓集于肿瘤组织,以提高抗肿瘤治疗效果,降低药物毒副作用。
制备所得纳米胶束注射剂粒径为10-100nm。
其中,制备所得纳米胶束注射剂的载药量,即有效成分占mpeg2000-pdlla2000两嵌段共聚物的重量百分含量,为1-10%。
上述抑制剂用于制备治疗与预防能够受益于细胞自噬抑制的疾病的药物上的应用,也在本发明的保护范围内。所述应用包括但不仅限于抑制肿瘤细胞保护性自噬的受益于的疾病上的应用。
本发明的抑制剂还可与其它药物一起使用以提供联合疗法,其中,其它药物可以和上述抑制剂组成组合物制剂或者可以作为单独的组合物提供,用于同时或不同时给药。
其中,上述茜草科类型环肽ras的制备方法参考中国发明专利cn201410445325.0。
有益效果:本发明所述的细胞自噬抑制剂可以有效抑制细胞自噬,其有效成分茜草科类型环肽来源广泛,提取工艺成熟,其剂型和用药方式多样化,可以应用于kras相关癌症的治疗和预防,具有广泛的临床应用前景。
附图说明
图1为茜草科类型环肽ra-v(1)抑制kras依赖的肿瘤细胞保护性自噬,其中,(1):ra-v(1)抑制kras依赖肺癌细胞h441和h358的增殖;(2):ra-v(1)抑制kras依赖肺癌细胞h441和h358的gfp-lc3自噬小体的形成;(3):ra-v(1)抑制kras依赖肺癌细胞自噬相关蛋白的表达;
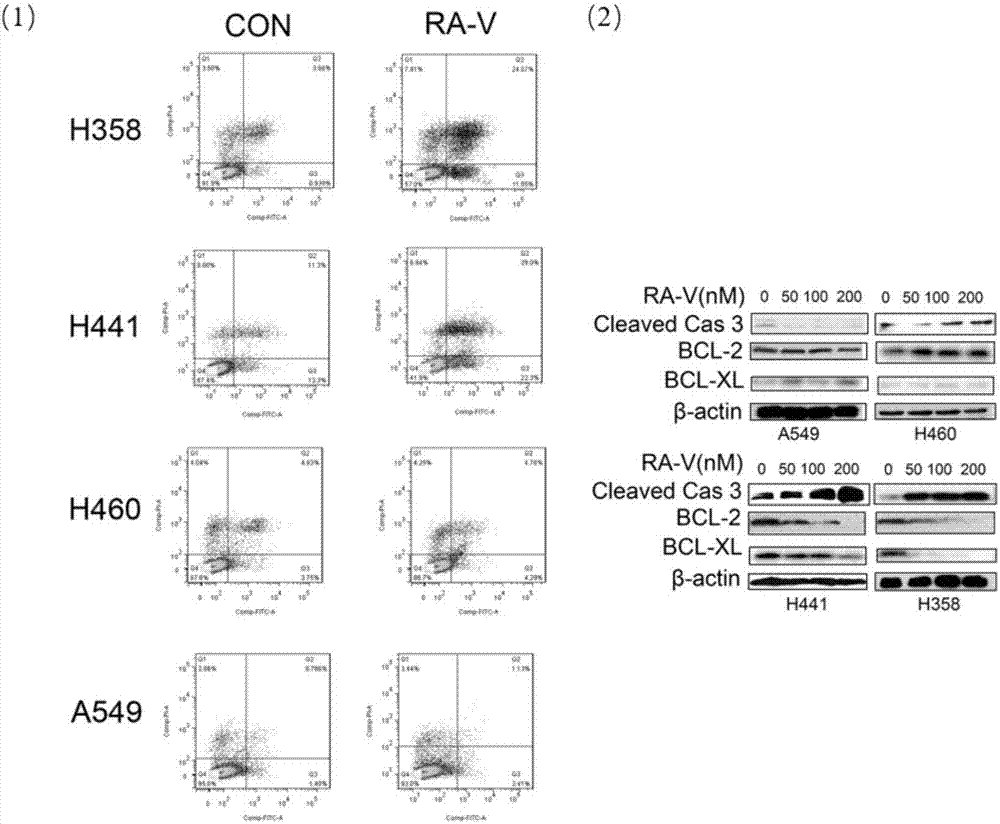
图2为茜草科类型环肽ra-v(1)诱导kras依赖的肿瘤细胞凋亡,其中,(1):annxin-v/pi染色检测发现ra-v(1)促进kras依赖肺癌细胞凋亡;(2):westernblot检测发现ra-v(1)诱导kras依赖肺癌细胞凋亡;
图3为茜草科类型环肽ra-v(1)纳米胶束的表征,其中,(1):胶束粒径;(2):释药曲线;
图4为茜草科类型环肽ra-v(1)和ra-xii(2)纳米胶束注射剂体内抗肿瘤试验,其中,(1):ra-v(1)对kras依赖的肺癌细胞具有更好的实体瘤抑制效果;(2):ra-v(1)在kras突变的hct116模型上的抗肿瘤效果;(3):ra-xii(2)在kras突变的hct116模型上的抗肿瘤效果。
具体实施方式
下面结合附图,用具体实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。根据本发明的实质对本发明进行的改进都属于本发明的范围。
所述茜草科类型环肽ra-v(1)和ra-xii(2)的制备参考专利cn201410445325.0。
实施例1
ra-v(1)抑制kras依赖的肿瘤细胞保护性自噬:
采用mtt法测定细胞活力。含10%的fbs培养基培养过夜的非kras依赖的a549和h460及kras依赖的h441和h358细胞系,加入胰酶消化,形成细胞悬浮液,按照合适浓度接种在96孔板上,100μl/孔,在co2培养箱中培养24小时至细胞完全贴壁,加入终浓度为0,50,100,200nmra-v(1),作用24h后,每孔加20μlmtt溶液(5mg/ml用pbs配制,ph=7.4),继续孵育4h,终止培养,小心吸弃孔内培养上清液。每孔加150μldmso,振荡10min,使结晶物充分融解。选择490nm波长,在酶联免疫检测仪上测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
将含10%fbs培养基培养过夜的kras依赖的h441和h358细胞按照合适的密度种植于24孔板,24h后加入0,50,100,200nmra-v(1),作用24h后收集细胞,westernblot实验检测自噬相关蛋白lc3、atg7及beclin1表达水平。
将含10%fbs培养基培养过夜的kras依赖的h441和h358细胞按照合适的密度种植于24孔板,转染gfp-lc3质粒,24h后加入ra-v(1),作用24h后采用荧光显微镜观察gfp-lc3定位情况,定量计算自噬细胞数。
试验结果见图1,结果显示,ra-v(1)抑制kras依赖肺癌细胞生存,lc3-ii、atg7及beclin1随着ra-v(1)的浓度增加而减少,ra-v(1)处理的细胞相对于空白组gfp-lc3明显减少,证实ra-v(1)明显抑制h441和h358的保护性自噬。
实施例2
ra-v(1)明显诱导kras依赖肿瘤细胞凋亡:
将含10%fbs培养基培养过夜的非kras依赖的a549和h460及kras依赖的h441和h358细胞系,加入胰酶消化,形成细胞悬浮液,按照合适浓度接种在6孔板上,24h后加入ra-v(1),处理24h,胰酶消化,于室温2000rpm离心5~10min,收集细胞;用预冷1×pbs(4℃)重悬细胞一次,2000rpm离心5~10min,洗涤细胞;加入300μl的1×bindingbuffer悬浮细胞;加入5μl的annexinv-fitc混匀后,避光,室温孵育15min;上机前5min再加入5μl的pi染色,流式细胞仪检测细胞。
将含10%fbs培养基培养过夜的非kras依赖的a549和h460、kras依赖的h441和h358细胞按照合适的密度种植于24孔板,作用24h后收集细胞,westernblot实验检测凋亡相关蛋白bcl-2,bcl-xl及capsase3表达水平。
试验结果见图2,结果显示,pi/annexinv双染检测凋亡表明ra-v(1)明显诱导h358和h441细胞凋亡,对h460和a549无明显影响。检测相关凋亡蛋白capsase3,以及凋亡抑制蛋白bcl-2,bcl-xl的表达,同样证明ra-v明显诱导h358和h441细胞凋亡,对h460和a549无明显影响。
实施例3
mpeg200-pdlla2000胶束的制备方法:
(1)溶解:按照mpeg2000-pdlla2000和ra-v(1)重量比30-10:1制备载药纳米胶束,按照表1精密称取mpeg2000-pdlla2000和ra-v(1),将其混溶于含100ml二氯甲烷的梨形瓶中,不断震荡,至药物和材料溶解后,再加入25ml的甲醇,不断震荡,至药物和材料溶解完全,约5分钟后得到澄清溶液。
(2)蒸除溶剂:将梨形瓶置于旋转蒸发仪上,真空旋蒸,转速为100转/分,控制温度为60℃,除有机溶剂,待其除尽后,将温度降为40℃,继续真空旋蒸3小时,以除去残留的有机溶剂,得到透明凝胶状的ra-v(1)和mpeg2000-pdlla2000混合药膜。
(3)再溶解:加入60℃预热的含0.9%氯化钠注射用水25ml,快速震荡,充分溶解凝胶状药膜,得到1mg/ml的ra-v(1)纳米胶束溶液。
(4)过滤除菌:将ra-v(1)纳米胶束溶液经0.22μm微孔滤膜过滤以除菌。
(5)分装,冷冻干燥,制得ra-v(1)纳米胶束冻干粉。
(6)轧盖,得到成品ra-v(1)纳米胶束注射剂。
实施例4
ra-v(1)纳米胶束的表征:
(1)ra-v胶束的粒径测试:将实施例3制备的胶束溶液用水稀释50倍,用马尔文粒度仪测胶束的粒径,其结果如表1:
表1胶束粒径的检测
根据图3的表征可见,胶束的粒径一般在10-100nm,本发明制备的胶束粒径均在范围内,说明本发明的工艺可行。
(2)包封率检测:将实施例3制备的注射用纳米胶束用1ml水溶解,取50μl溶液加入950μl乙腈,震荡混匀,离心3分钟,取上清液过0.45μm微孔滤膜,hplc检测ra-v(1)的含量,从而计算出共聚物和ra-v(1)制备的包封率以评价其增溶效果。其结果如下:
表2载药胶束的包封率实验结果
纳米胶束含量检测结果显示,本发明中共聚物对ra-v(1)的载药能力很强,90%以上的ra-v(1)被制成纳米胶束,充分体现该发明方法的增溶效果。
(3)纳米胶束对ra-v(1)的体外释放能力的检测:将实施例3制备的ra-v(1)纳米胶束或等量的ra-v(1)粉末置于透析袋中进行透析,透析介质为0.5%sds的pbs溶液,于各个时间点取出1ml透析液,并补充1ml透析液,用hplc检测ra-v(1)含量。将各次换液时测得的ra-v(1)含量累加,并以时间作图,即可得到胶束对ra-v(1)的释药曲线见图3。结果显示ra-v(1)纳米胶束释放达到89%,说明实施例3制备的ra-v(1)纳米胶束释放性能良好。
实施例5
(1)ra-v(1)纳米胶束注射剂对人肺癌移植瘤的体内抑瘤作用
将人肺癌细胞kras依赖的h441和kras非依赖的h460用生理盐水稀释成1×107个/ml,取100μl该细胞悬浮液接种于babl/c裸鼠左侧腋窝皮下,生长7天,形成荷瘤小鼠模型。取接种生长良好的荷瘤小鼠,随机分组,取实施例3制备的ra-v纳米胶束注射剂通过尾静脉给药,隔天给药一次,给药14天后处死所用动物,剥瘤称重,计算抑瘤率,统计处理。抑瘤率(%)=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重×100%。试验结果见图4,结果表明ra-v(1)的2.5mg/kg在kras非依赖的h460模型上没效,而在kras依赖的h441模型上有效,抑瘤率50.4%。
(2)ra-v(1)纳米胶束注射剂对人结肠癌kras突变的hct116裸鼠移植瘤的体内抑瘤作用:
将hct116用无血清mccoy's5a培养基稀释为1×107个/ml,取100μl该细胞悬浮液接种于babl/c裸鼠左侧腋窝皮下,生长7天,形成荷瘤小鼠模型。取接种生长良好的荷瘤小鼠,随机分组,取实施例3制备的ra-v纳米胶束注射剂通过尾静脉给药,隔天给药一次,给药14天后处死所用动物,剥瘤称重,计算抑瘤率,统计处理。抑瘤率(%)=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重×100%。试验结果见图4,结果表明ra-v(1)的高和中剂量的抑瘤率为66.67%和41.67%。
(3)ra-xii(2)纳米胶束注射剂对人结肠癌kras突变的hct116裸鼠移植瘤的体内抑瘤作用:
将hct116用无血清mccoy’s5a培养基稀释为1×107个/ml,取100μl该细胞悬浮液接种于babl/c裸鼠左侧腋窝皮下,生长7天,形成荷瘤小鼠模型。取接种生长良好的荷瘤小鼠,随机分组,ra-xii(2)注射剂通过尾静脉给药,隔天给药一次,给药14天后处死所用动物,剥瘤称重,计算抑瘤率,统计处理。抑瘤率(%)=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重×100%。试验结果见图4,结果表明ra-xii(2)的高和中剂量的抑瘤率为79.92%和68.47%。
- 还没有人留言评论。精彩留言会获得点赞!