一种可完全降解宫腔内术后防粘连器械的制作方法
本发明涉及宫腔手术后的创面的隔离、治疗和修复,更具体地涉及一种可完全降解宫腔内术后防粘连器械。
背景技术:
子宫是产生月经和孕育胎儿的器官,位于骨盆腔中央,是女性独有的脏器。子宫大小与年龄及生育有关,未产者约长7.5cm、宽5cm、厚3cm,子宫可分为底、体与颈三个部分。宫腔呈倒置三角形,深约6cm,上方两角为“子宫角”,通向输卵管。下端狭窄为“峡部”,长约1cm。
流产、放取环、手术等宫腔操作、以及感染等原因,会引起子宫区域发生各种病变,子宫疾病是女性最常见的疾患之一,严重影响到患者的正常生活和健康,进而影响孕育新生命的能力。这些病变包括,子宫内膜炎、子宫内膜异位症、子宫肥大、子宫息肉、子宫肌瘤、子宫囊肿、子宫脱垂、子宫内膜癌等。
药物治疗对上述病变治疗的效果有限,随着微创技术在手术领域的迅速发展,宫腔镜检查和手术在妇科诊疗领域得到了广泛的推广,创伤小、术中出血少等一系列的优势,使宫腔镜称为微创外科手术重要的组成部分。
然而,大部分手术都要对宫腔造成损伤,息肉、肌瘤、囊肿、粘连切除,刮宫等一系列操作都可能会导致子宫内膜基底层受损,导致内膜纤维化和宫腔粘连。
子宫主要组成部分是肌肉,宫体的前壁和后壁几乎相互接触,中间的子宫腔仅为一裂缝。宫体壁由三层组织所组成,即浆膜层、肌肉层和黏膜层;黏膜层即子宫内膜层,又可分为三层,致密层、海绵层和基底层。致密层和海绵层是由基底层再生的增殖带,合称为功能层,对性激素敏感,在卵巢激素的影响下发生周期性变化,若未受孕则功能层在每一周期最后脱落伴子宫出血,临床上表现为月经来潮。基底层紧贴肌肉层,对卵巢激素不敏感,无周期性变化。正常子宫内膜腺体可分泌稀薄的碱性液体,以保持宫腔潮湿,因此,正常子宫前壁和后壁虽然离得很近,但不会粘连和生长在一起。
宫内手术后,子宫内膜基底层受损,特别是相同位置的前壁和后壁同时受损,宫腔即发生粘连。目前一致认为,对妊娠子宫的创伤是宫腔粘连的主要原因。创伤经常发生在产后或流产后1-4周因过量出血需刮宫者。在此易感期,任何创伤都可引起子宫内膜基底层脱落,导致子宫壁相互粘着,形成永久粘连,致使子宫变形和对称性消失。其次,对非孕子宫内膜的创伤也可以引起宫腔粘连。文献报道,宫腔粘连可以发生在诊断性刮宫、开腹肌瘤剔除、宫颈活检、子宫内膜息肉取出术、宫内置避孕器或者应用放射线治疗后。此外宫腔粘连还可以发生在各种宫腔镜手术后,例如宫腔镜下子宫肌瘤切除术、子宫纵膈切除术后等。
由此可见,在微创手术后,由于宫腔受损,相对创面贴合后粘连在一起的几率很大,宫腔粘连后经血无法畅通排出,育龄女性没有办法正常受孕,通常的方法是再次采用宫腔镜粘连切开术将粘连部位分割开来。但是,尽管宫腔镜手术得到了广泛应用,宫腔粘连的治疗仍然十分困难,宫腔粘连治疗的预后仍不理想,宫角等部位粘连或严重宫腔粘连,即便经过了宫腔分离术,仍然很容易出现复发现象,很难根治。而宫腔粘连术后妊娠为具有高度流产危险和胎盘异常的高危妊娠,需密切监护,防治并发症出现。因此,宫腔粘连的治疗不仅包括宫腔镜手术恢复宫腔正常形态,还应采取措施促进子宫内膜修复,预防宫腔粘连复发,最终恢复患者正常生活和生育功能。
对宫腔粘连分离术后预防再次粘连有众多的方法和手段,但至今仍缺乏能绝对有效完全避免再次粘连的方法,也缺乏一个统一的治疗标准。目前主要治疗方法有,药物治疗、宫内屏障介质、球囊扩张法、生物胶治疗、羊膜移植、纤维宫腔镜探查及钝性分离术。
药物治疗疗法使用药物主要为雌激素,宫腔粘连分离术后常规予以雌孕激素序贯人工周期2~3个月或单独应用雌激素的措施在预防轻-中度宫腔粘连患者粘连分离术后再粘连形成上效果肯定,月经恢复及生殖预后均明显改善。但重度宫腔粘连患者效果不乐观,术后再粘连率可达到50%以上,这可能与重度宫腔粘连患者内膜基底层破坏严重,缺乏对雌激素的反应有关。近年国内学者研究发现,宫腔粘连患者血清雌激素水平无差异的情况下,粘连组织表面的雌激素受体(er)和转化生长因子β1(tgf-β1)明显升高,怀疑局部高雌激素水平可能通过提升tgf-β1等促纤维化细胞因子的水平,参与了粘连的发生。提示重度宫腔粘连患者内膜基底层破坏严重,对雌激素缺乏反应的情况下,一味强调高雌激素水平是否会导致某些促粘连因子水平上升,加重再粘连及内膜纤维化的发生。因此,雌激素在重度宫腔粘连患者粘连分离术后再粘连形成中的作用有待进一步探讨。
宫内屏障介质疗法,即将隔离物塞入子宫,将创面用隔离物隔开,使子宫壁不能轻易贴合在一起。目前多数学者已将宫腔粘连分离术后宫腔放置宫内节育器2~3个月作为预防术后再粘连的经典方法。但用于预防重度宫腔粘连患者术后再粘连效果欠佳,术后月经恢复及生殖预后均无明显改善,可能与此类患者子宫内膜基底层破坏严重,几乎无正常内膜残存有关。有研究者认为,目前临床所用含铜宫内节育器面积有限,不能有效的分离子宫前后壁,而且可能引起过度的炎症反应,导致大量炎症介质和促粘连形成细胞因子释放,加速术后再粘连的形成,相比而言,目前临床渐弃用的“o”型不锈钢节育器则可能以较大的有效面积和较轻的炎症反应起到更好的预防宫腔粘连术后再粘连形成的效果。尽管“o”型节育器的形状适应性好,轻度和重度分离术后复粘发生几率得到了一定的控制。但这种“o”型节育器也有两个主要缺点,其一,宫腔粘连多发生于子宫中央和宫角,“o”型节育器中间空,也不能像“t”型节育器一样可以到达宫角位置,因此,防粘连效果有限。而“t”型节育器,虽然对子宫大小适应性好,但是如上所述,棒状的形状注定不能承载大的面积。因此,节育器作为屏障介质疗法并不理想,节育器不能完全覆盖宫腔创面,治疗效果不佳。
球囊扩张法,是以球囊尿管作为囊体。临床资料显示,轻-中度宫腔粘连患者于粘连分离术后宫腔留置foley球囊尿管7~14天,月经恢复率高达80%,甚至90%以上,足月妊娠率达到40%~50%,效果好于宫内节育器,且不存在宫腔放置宫内节育器2~3月后取出时,可能造成二次损伤内膜的潜在问题。cook公司推出的倒梨形子宫球囊支架,为硅树脂材料制成的异型球囊,更能适合女性的生理特征。球囊(支架)做为支架使子宫内膜沿球囊表面增殖、修复;导管中开放的通路可充分引流宫炎性渗出液,有利于修复子宫内膜。但是球囊(支架)存在一下不足和缺陷,治疗期间要住院,有继发感染甚至宫颈机能不全的可能;用宫腔内球囊压迫的同时,再试图促进子宫内膜生长实际上是很困难的(力过大);该方法治疗期短,预防再粘连长远疗效尚不肯定。
为了给患者子宫留出修复时间,有学者建议采用间歇性放置宫腔球囊弥补不足。这种处理方式为,放入球囊支撑一段时间,然后取出球囊,施药,给子宫修复生长时间,然后再次放入球囊,周而复始,治疗至少延续3个循环周期。且不论最终治疗结果如何,反复施行球囊术大大增加了患者痛苦和感染几率,可施行度不高。因此,球囊扩张法并不能得到良好的治疗效果。因此,目前更多的学者倾向于将球囊用于粘连分离术中出血较多的病例,可起到局部压迫止血作用。
生物胶治疗方法,是将生物胶放入宫腔粘连术后的子宫中,防止再粘连形成。生物胶主要是透明质酸的衍生物-自交联多糖凝胶(auto-cross-linkedpolysaccharidesgel,acpgel)。acpgel由透明质酸(hyaluronicacid,ha)交联缩合形成,能在无菌,重蒸水中形成黏性极大网状微粒的悬浮液,与ha相比具有更强的黏附性和更持久的降解时间,可以长久停留在粘连分离后的创面表面,避免创面相贴,抑制炎症细胞迁移,限制纤维蛋白原扩散,从而起到预防术后再粘连形成的作用。acpgel降解时间虽与ha相比有明显改善,但最长为72小时,在创面愈合的早期阶段虽有预防再粘连的作用,但是因为存留时间过短,防止创面愈合后期再粘连形成效果不佳。
羊膜移植疗法,羊膜是胎盘的最内层,与人眼结膜组织结构相似,其光滑,无血管、神经及淋巴,具有一定的弹性,厚约0.02-0.5mm,在电镜下,其分为五层:上皮层、基底膜、致密层、纤维母细胞层和海绵层,羊膜基底膜和羊膜基质层含有大量不同的胶元,主要为i、iii、iv、v、vii型胶原和纤维粘连蛋白、层粘连蛋白等成份,正是这些成份使羊膜可以充当"移植的基底膜"而发挥一种新的健康合适的基质作用来促进上皮化。羊膜用于宫腔防止再粘连的作用机理不甚明确,主要可能如下(1)抗感染作用:羊膜能借助自身纤维素紧贴创面表面,减少创面和羊膜之间的死腔,抑制细菌增生和扩散;纤维素支架也有助于巨噬细胞迁移,使巨噬细胞顺利到达细菌繁殖部位,起杀菌作用;羊膜还能通过自分泌作用分泌抗生素预防术后感染发生;(2)生物学作用:羊膜具有降调促纤维生长最主要因子-tgf-β1水平的作用,从而可避免再粘连及内膜纤维化发生;(3)作为“移植的内膜基底层”,羊膜能够为新上皮再生提供可靠的环境,增加细胞移入和上皮黏附,减少上皮细胞凋亡。羊膜上皮细胞膜表面不表达人类组织相容性复合体(humanleukocyteantigen,hla),包括hla-a、b、c或dr、β2-m等,因而不存在同种异体移植的排异反应,不需要进行系统的免疫抑制治疗。2006年amer等尝试为25例中-重度宫腔粘连患者行tcra术后,借助foley球囊尿管的支托作用行宫腔内羊膜移植,试图通过羊膜上皮的再生替代子宫内膜基底层,预防tcra术后再粘连形成,促进月经及生育功能恢复。术后4个月二次宫腔探查结果显示12例中度宫腔粘连患者均未形成再粘连,13例重度宫腔粘连患者中1例无再粘连形成,12例均有不同程度再粘连的发生:但83.33%(10/12)的患者再粘连仅为轻度,只有16.67%(2/12)重度结核性宫腔粘连患者为中度再粘连。可见,虽然中-重度宫腔粘连患者术后进行羊膜移植,恢复比其他疗法效果好,但并没有完全避免粘连再生。
纤维宫腔镜探查及钝性分离术是新发展起来的一种治疗方法,即,宫腔粘连分离术后定期进行宫腔探查及早处理新生疏松轻微粘连,监控术后宫内恢复状况,及时做出反应,避免了致密粘连的再形成及由此导致新的内膜损伤。这种治疗方法的效果尚不十分明确,未见大量临床研究和报告数据,就可操作性而言,医生和患者都需要频繁进行探查术和钝性分离,每次探查术再分离新生疏松轻微粘连的同时都有很大几率造成新的创伤,会延缓病患治愈时间,增加感染疾病的几率。
例如,cn201110058056.9公开了一种防治宫腔粘连的药物带膜支架,具有形状记忆特性的镍钛合金丝编织和缓释载药膜组成,而且取出时会损伤组织,有感染风险。cn201210049248.8公开了一种宫腔粘连防治装置,包括宫形环和薄膜,薄膜直接贴服组织阻碍内膜生长,有感染风险。cn201210150391.6公开了一种应用于防治宫腔粘连的载体屏障系统,包括球囊和注入载体组成,同样贴服阻碍内膜生长,有感染风险。cn201410540232.6公开了一种宫腔粘连阻断器,其包括与宫腔的形态相适应“v”型骨架、基座杆和可降解网片组成,需要取出,有感染风险。
显然,现有技术中的防粘连器械都需要在植入一段时间后取出,再次取出会造成组织二次撕裂,对脆弱的内膜组织是致命的伤害;另外,为方便取出,取出器械一般带有取出用的“引线”,在植入的时间段内,“引线”会一直通过宫颈管,延伸并滞留于阴道内,这就给细菌等人为创造了一个可以上达子宫内部的通道,大大增加病患感染疾病的几率。
技术实现要素:
为了解决上述现有技术存在的无法有效防止术后再粘连的问题,本发明旨在提供一种可完全降解宫腔内术后防粘连器械。
本发明所述的可完全降解宫腔内术后防粘连器械,包括支架和药物涂层,其中,该支架由完全可降解聚合物形成,该药物涂层为负载于支架的外表面和/或内表面的用于促进子宫内膜修复和防止粘连的药物涂层,该支架具有植入前无束缚状态、植入时压缩状态和植入后展开状态;在植入前无束缚状态下,该支架呈现为围绕着中心纵轴展开的筒状结构,该筒状结构的顶部的第一直径大于底部的第二直径;在植入时压缩状态下,该支架呈现为围绕着中心纵轴被压缩的管状结构,该管状结构的直径小于第二直径;在植入后展开状态下,该支架呈现为中空扁平薄片。
应该理解,在植入后展开状态下,该支架的形状被选择为适应于子宫的生理形状和尺寸而将子宫前壁和后壁尽可能全面积隔离,从而将子宫前壁和后壁的接触机会降至最低。
该完全可降解聚合物包括但不仅限于聚乳酸(polylacticacid,pla)、l-聚乳酸(polyllacticacid,plla或lpla)、聚羟基乙酸/聚乳酸共聚物(polyglycolicacid/polylacticacid,pgla)、聚己内酯(polycaprolactone,pcl)、聚羟基丁酸戊酯(polyhydroxylbutyratevalerate,phbv)、聚乙酰谷氨酸(polyacetylglutamicacid,paga)、聚正酯(polyorthoesters,poe)和聚氧化乙烯/聚丁烯共聚物(polyethyleneoxide/polybutyleneterephthalate,peo/pbtp)、聚对二氧环己酮(poly-p-dioxanone,ppdo)、聚丁二酸丁二醇酯(poly(butylenesuccinate),pbs)、聚癸二酸甘油酯(poly(glycerolsebacate),pgs)、壳聚糖、聚乙烯醇(polyvinylalcoho,pva),及上述材料的共聚物或共混物,及其同系物。
该完全可降解聚合物可以在子宫内存放7天至6个月时间,优选为14天至3个月。
该药物涂层由可降解聚合物载体和有效药物组成,其中,可降解聚合物载体的降解周期与支架的降解周期相吻合或短于支架的降解周期。在将根据本发明的可完全降解宫腔内术后防粘连器械植入子宫宫腔内后,随着可降解聚合物载体的降解,有效药物可以缓慢释放以治疗创面。在女性的各个时期,雌二醇的含量是不同的,女性卵泡期为94~433pmol/l;黄体期为499~1580pmol/l;排卵期为704~2200pmol/l;绝经期为40~100pmol/l。根据女性不同时期的激素水平,可通过调节有效药物浓度和涂层厚度来控制药物的释放速率,从而匹配女性特定时期的激素水平。降低单位厚度涂层上的有效药物浓度,通过增加涂层厚度来提高药物总含量,涂层厚度增加必然延长降解时间,达到减缓药物释放速率的目的,反之则可加快药物释放。在药物浓度和涂层厚度一定的情况下,也可以通过改变可降解聚合物载体的种类来调节涂层的降解周期,从而控制药物的释放。药物释放时间为7天至6个月,优选为1个月至3个月。
该可降解聚合物载体包括但不限于聚乳酸(polylacticacid,pla)、l-聚乳酸(polyllacticacid,plla或lpla)、聚羟基乙酸/聚乳酸共聚物(polyglycolicacid/polylacticacid,pgla)、聚己内酯(polycaprolactone,pcl)、聚羟基丁酸戊酯(polyhydroxylbutyratevalerate,phbv)、聚乙酰谷氨酸(polyacetylglutamicacid,paga)、聚正酯(polyorthoesters,poe)和聚氧化乙烯/聚丁烯共聚物(polyethyleneoxide/polybutyleneterephthalate,peo/pbtp)、聚对二氧环己酮(poly-p-dioxanone,ppdo)、聚丁二酸丁二醇酯(poly(butylenesuccinate),pbs)、聚癸二酸甘油酯(poly(glycerolsebacate),pgs)、壳聚糖、聚乙烯醇(polyvinylalcoho,pva),及上述材料的共聚物或共混物,及其同系物。
该有效药物包括但不仅限于17β雌二醇或其他雌激素,以促进内膜生长。
更近一步地,有效药物可以是两种以上药物的组合,比如17β雌二醇与吲哚美辛的组合。雌二醇的释放量为每天10至500μg,吲哚美辛与雌二醇的重量比在0-20:80之间。该支架由单根或单束的完全可降解聚合物丝线反复来回缠绕形成,各丝线形成多个交点,至少部分的交点点接。
优选地,该有效药物为重量比为10-20:80-90的吲哚美辛和17β雌二醇。
优选地,该可完全降解宫腔内术后防粘连器械的有效药物的载药量在100-2000μg之间。
优选地,该药物涂层的厚度在5-30μm之间。
丝线的直径为0.1-4mm,优选为0.1-1mm。
支架通过穿插编织或覆盖编织丝线形成。
丝线编织相交形成的孔面积大小范围为0.5mm2至25mm2,优选的孔面积大小范围为1mm2至16mm2。
该支架具有相对的顶部和底部,其中,顶部适配于子宫角。
在植入前无束缚状态下,顶部的第一编织密度小于底部的第二编织密度。
在植入后展开状态下,中空扁平薄片的顶部的宽度为20-70mm,优选为40-50mm;底部的宽度为5-20mm,优选为10-15mm;厚度为0.3-10mm,优选为2-6mm;顶部和底部之间的距离为10-50mm,优选为20-40mm。
为了将子宫侧壁和宫底部分完全隔离和撑开,薄片两侧需要具备较大的支撑力。薄片两侧的支撑力是薄片中间的数倍或数十倍。
为达到上述加强两侧支撑力的目的,可以将支架形成薄片两侧的部分进行加强处理。例如,加强两侧编织密度,将两侧部分加入更粗的丝线编织;再比如,将“o”型宫内节育器在支架植入后再次植入,放置于支架释放后形成薄片的中间,或者任意一侧,节育器的形状适应性好,可以帮助支架支撑子宫侧壁和宫底。
“o”型宫内节育器可以是普通的金属节育器,或者完全可降解的材料节育器,这类节育器的共性是环形辐射的弹性将支架侧壁和宫底向外支撑,而节育器占位也起到了隔离作用。
根据本发明的可完全降解宫腔内术后防粘连器械可以治疗各种宫腔内手术后因创伤引起的宫腔粘连,特别适用于宫腔粘连分离术后再次粘连。宫腔镜粘连切开术后,将该器械输送入子宫,器械将创面隔开,使子宫壁不能轻易贴合在一起,特别是可以通过药物治疗来完成内膜的修复。根据本发明的可完全降解宫腔内术后防粘连器械由完全可降解聚合物形成,具备可生物降解特性,仅在植入子宫宫腔内时对患者有可能造成部分创伤,植入后不需要再行手术取出,降解后被人体完全吸收,也不会留下引线(尾丝),无经阴道侵入病菌的感染风险。
附图说明
图1a是根据本发明的第一实施例的可完全降解宫腔内术后防粘连器械的支架在植入前无束缚状态下的立体图;
图1b是根据本发明的第一实施例的可完全降解宫腔内术后防粘连器械的支架在植入前无束缚状态下的侧视图;
图1c是根据本发明的第一实施例的可完全降解宫腔内术后防粘连器械的支架在植入前无束缚状态下的俯视图;
图2a是根据本发明的第二实施例的可完全降解宫腔内术后防粘连器械的支架在植入前无束缚状态下的立体图;
图2b是根据本发明的第二实施例的可完全降解宫腔内术后防粘连器械的支架在植入前无束缚状态下的侧视图;以及
图2c是根据本发明的第二实施例的可完全降解宫腔内术后防粘连器械的支架在植入前无束缚状态下的俯视图。
具体实施方式
下面结合附图,给出本发明的较佳实施例,并予以详细描述。
实施例1
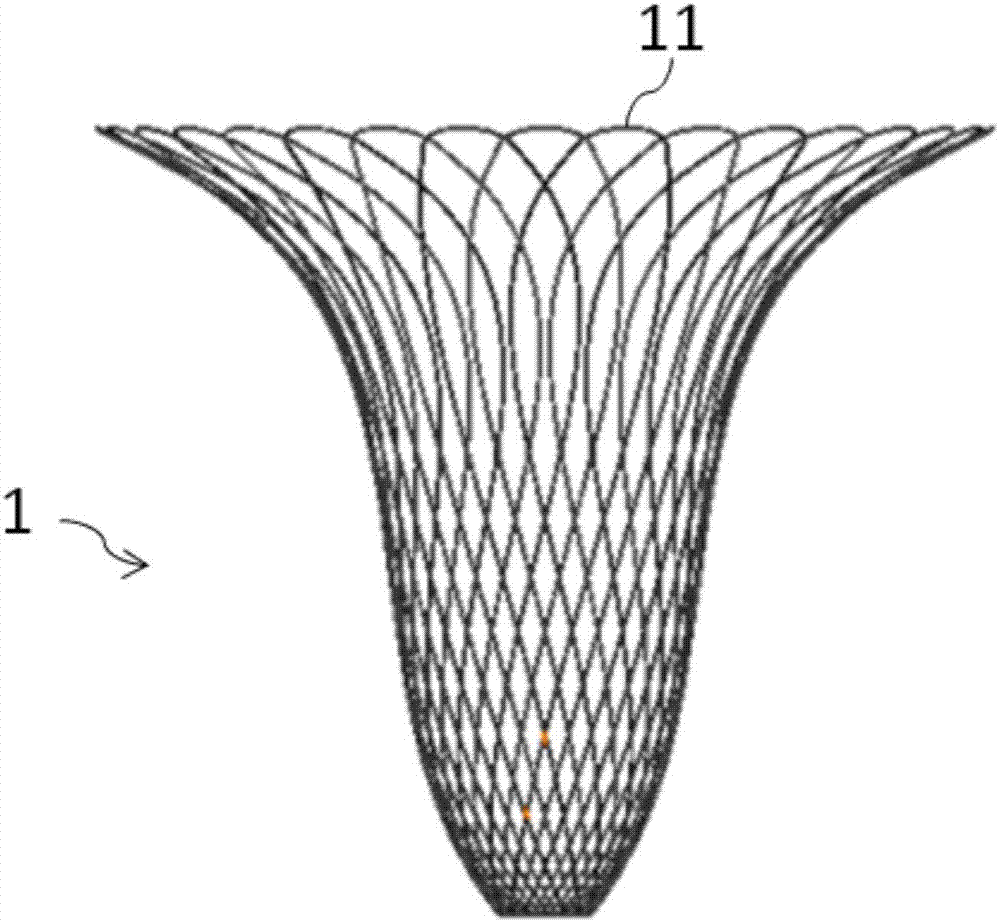
如图1a-图1c所示,根据本发明的第一实施例的可完全降解宫腔内术后防粘连器械的支架1由单根或单束的完全可降解聚合物丝线11反复来回缠绕形成,各丝线11在交点12处可以部分点接、完全点接或不点接。其中,丝线11的直径为0.5mm。其中,支架1通过穿插编织丝线11形成。
该支架1具有顶部13和底部14,在图示植入前无束缚状态下,顶部13具有第一直径,底部14具有第二直径,而且,第一直径逐渐的减小至第二直径。在本实施例中,该减小的趋势是曲线减小,从而使得该支架1在植入前无束缚状态下呈现为梨形。在植入时压缩状态下,该支架1会呈现为围绕着中心纵轴被压缩的管状结构,该管状结构的直径小于第二直径,从而便于植入操作。在植入后展开状态下,该支架呈现为中空扁平薄片,其顶部13的两个末端分别伸入子宫角区域,丝线11容置于宫体的前壁和后壁之间并将其分开,从而避免粘连。其中,该中空扁平薄片的顶部宽度为40mm,底部宽度为10mm,厚度为3mm,顶部和底部之间的距离为25mm。
而且,在图示植入前无束缚状态下,顶部13具有第一编织密度,底部14具有第二编织密度,而且,第一编织密度逐渐的增加至第二编织密度。在植入时压缩状态下,顶部13由于具有较小的编织密度而更容易被压缩,底部14由于具有较大的编织密度而更难被压缩,从而使得顶部13和底部14被整体压缩至直径大致相等的管状,该管状至第三直径,该支架1会呈现为围绕着中心纵轴被压缩的管状结构,该管状结构的直径小于第二直径,从而便于植入操作。
另外,围绕着中心纵轴,位于同一水平面上的交点12被称为一排交点,各排交点在轴向上彼此间隔开。在本实施例中,临近顶部13的一排交点中的至少三个交点被点接,临近底部14的一排交点中的至少三个交点被点接,从而使得交点附近的丝线11无法滑移而仅能围绕着该被点接的交点进行扭转,便于支架1的压缩和扩张,并在压缩和扩张后维持稳定的形状。其中,各被点接的交点22错开排列。
编织好的支架利用支架喷涂机进行药物喷涂,在支架的外表面涂覆药物涂层,所用可降解聚合物载体为聚乳酸,所用药物为17β雌二醇的丙酮溶液,所述17β雌二醇的载药量在100μg左右,涂层厚度在5μm。
载药后的支架置于40℃对流烘箱干燥15分钟,使得支架上的溶剂成分完全挥发。
实施例2
如图2a-图2c所示,根据本发明的第一实施例的可完全降解宫腔内术后防粘连器械的支架2由单根或单束的完全可降解聚合物丝线21反复来回缠绕形成,各丝线21在交点22处可以部分点接、完全点接或不点接。其中,丝线21的直径为1mm。其中,支架2通过覆盖编织丝线21形成。
该支架2具有顶部23和底部24,在图示植入前无束缚状态下,顶部23具有第一直径,底部24具有第二直径,而且,第一直径逐渐的减小至第二直径。在本实施例中,该减小的趋势是线性减小,从而使得该支架2在植入前无束缚状态下的横截面呈现为梯形。在植入时压缩状态下,该支架2会呈现为围绕着中心纵轴被压缩的管状结构,该管状结构的直径小于第二直径,从而便于植入操作。在植入后展开状态下,该支架呈现为中空扁平薄片,其顶部23的两个末端分别伸入子宫角区域,丝线21容置于宫体的前壁和后壁之间并将其分开,从而避免粘连。其中,该中空扁平薄片的顶部宽度为50mm,底部宽度为15mm,厚度为8mm,顶部和底部之间的距离为30mm。
而且,在图示植入前无束缚状态下,顶部23具有第一编织密度,底部24具有第二编织密度,而且,第一编织密度逐渐的增加至第二编织密度。在植入时压缩状态下,顶部23由于具有较小的编织密度而更容易被压缩,底部24由于具有较大的编织密度而更难被压缩,从而使得顶部23和底部24被整体压缩至直径大致相等的管状,该管状至第三直径,该支架2会呈现为围绕着中心纵轴被压缩的管状结构,该管状结构的直径小于第二直径,从而便于植入操作。
另外,围绕着中心纵轴,位于同一水平面上的交点22被称为一排交点,各排交点在轴向上彼此间隔开。在本实施例中,临近顶部23的一排交点中的至少三个交点被点接,临近底部24的一排交点中的至少三个交点被点接,位于支架2的中部的一排交点中的至少三个交点被点接,从而使得交点附近的丝线21无法滑移而仅能围绕着该被点接的交点进行扭转,便于支架1的压缩和扩张,并在压缩和扩张后维持稳定的形状。其中,各被点接的交点22错开排列。
编织好的支架利用支架喷涂机进行药物喷涂,在支架的外表面涂覆药物涂层,所用可降解聚合物载体为聚乳酸,所用药物为吲哚美辛与17β雌二醇混合丙酮溶液,所述吲哚美辛与17β雌二醇的重量比例为20:80,载药量在2000μg左右,涂层厚度在30μm。
载药后的支架置于40℃对流烘箱干燥15分钟,使得支架上的溶剂成分完全挥发。
实施例3
如图1a-图1c所示,根据本发明的第一实施例的可完全降解宫腔内术后防粘连器械的支架1由单根或单束的完全可降解聚合物丝线11反复来回缠绕形成,各丝线11在交点12处可以部分点接、完全点接或不点接。其中,丝线11的直径为0.5mm。其中,支架1通过穿插编织丝线11形成。
该支架1具有顶部13和底部14,在图示植入前无束缚状态下,顶部13具有第一直径,底部14具有第二直径,而且,第一直径逐渐的减小至第二直径。在本实施例中,该减小的趋势是曲线减小,从而使得该支架1在植入前无束缚状态下呈现为梨形。在植入时压缩状态下,该支架1会呈现为围绕着中心纵轴被压缩的管状结构,该管状结构的直径小于第二直径,从而便于植入操作。在植入后展开状态下,该支架呈现为中空扁平薄片,其顶部13的两个末端分别伸入子宫角区域,丝线11容置于宫体的前壁和后壁之间并将其分开,从而避免粘连。其中,该中空扁平薄片的顶部宽度为40mm,底部宽度为10mm,厚度为3mm,顶部和底部之间的距离为25mm。
而且,在图示植入前无束缚状态下,顶部13具有第一编织密度,底部14具有第二编织密度,而且,第一编织密度逐渐的增加至第二编织密度。在植入时压缩状态下,顶部13由于具有较小的编织密度而更容易被压缩,底部14由于具有较大的编织密度而更难被压缩,从而使得顶部13和底部14被整体压缩至直径大致相等的管状,该管状至第三直径,该支架1会呈现为围绕着中心纵轴被压缩的管状结构,该管状结构的直径小于第二直径,从而便于植入操作。
另外,围绕着中心纵轴,位于同一水平面上的交点12被称为一排交点,各排交点在轴向上彼此间隔开。在本实施例中,临近顶部13的一排交点中的至少三个交点被点接,临近底部14的一排交点中的至少三个交点被点接,从而使得交点附近的丝线11无法滑移而仅能围绕着该被点接的交点进行扭转,便于支架1的压缩和扩张,并在压缩和扩张后维持稳定的形状。其中,各被点接的交点22错开排列。
编织好的支架利用支架喷涂机进行药物喷涂,在支架的外表面涂覆药物涂层,所用可降解聚合物载体为聚羟基乙酸/聚乳酸共聚物,所用药物为17β雌二醇的丙酮溶液,所述17β雌二醇的载药量在100μg左右,涂层厚度在5μm。
载药后的支架置于40℃对流烘箱干燥15分钟,使得支架上的溶剂成分完全挥发。
实施例4
如图2a-图2c所示,根据本发明的第一实施例的可完全降解宫腔内术后防粘连器械的支架2由单根或单束的完全可降解聚合物丝线21反复来回缠绕形成,各丝线21在交点22处可以部分点接、完全点接或不点接。其中,丝线21的直径为1mm。其中,支架2通过覆盖编织丝线21形成。
该支架2具有顶部23和底部24,在图示植入前无束缚状态下,顶部23具有第一直径,底部24具有第二直径,而且,第一直径逐渐的减小至第二直径。在本实施例中,该减小的趋势是线性减小,从而使得该支架2在植入前无束缚状态下的横截面呈现为梯形。在植入时压缩状态下,该支架2会呈现为围绕着中心纵轴被压缩的管状结构,该管状结构的直径小于第二直径,从而便于植入操作。在植入后展开状态下,该支架呈现为中空扁平薄片,其顶部23的两个末端分别伸入子宫角区域,丝线21容置于宫体的前壁和后壁之间并将其分开,从而避免粘连。其中,该中空扁平薄片的顶部宽度为50mm,底部宽度为15mm,厚度为8mm,顶部和底部之间的距离为30mm。
而且,在图示植入前无束缚状态下,顶部23具有第一编织密度,底部24具有第二编织密度,而且,第一编织密度逐渐的增加至第二编织密度。在植入时压缩状态下,顶部23由于具有较小的编织密度而更容易被压缩,底部24由于具有较大的编织密度而更难被压缩,从而使得顶部23和底部24被整体压缩至直径大致相等的管状,该管状至第三直径,该支架2会呈现为围绕着中心纵轴被压缩的管状结构,该管状结构的直径小于第二直径,从而便于植入操作。
另外,围绕着中心纵轴,位于同一水平面上的交点22被称为一排交点,各排交点在轴向上彼此间隔开。在本实施例中,临近顶部23的一排交点中的至少三个交点被点接,临近底部24的一排交点中的至少三个交点被点接,位于支架2的中部的一排交点中的至少三个交点被点接,从而使得交点附近的丝线21无法滑移而仅能围绕着该被点接的交点进行扭转,便于支架1的压缩和扩张,并在压缩和扩张后维持稳定的形状。其中,各被点接的交点22错开排列。
编织好的支架利用支架喷涂机进行药物喷涂,在支架的外表面涂覆药物涂层,所用可降解聚合物载体为聚羟基乙酸/聚乳酸共聚物,所用药物为吲哚美辛与17β雌二醇混合丙酮溶液,所述吲哚美辛与17β雌二醇的重量比例为20:80,载药量在2000μg左右,涂层厚度在30μm。
载药后的支架置于40℃对流烘箱干燥15分钟,使得支架上的溶剂成分完全挥发。
以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
- 还没有人留言评论。精彩留言会获得点赞!