CDO1在制备与铁死亡相关的胃癌治疗药物中的应用的制作方法
本发明属于基因和蛋白的功能与应用领域,涉及cdo1的代谢应用,特别是涉及cdo1在制备与铁死亡相关的胃癌治疗药物的应用。
背景技术:
胃癌是全球范围内死亡率第二的恶性肿瘤。在中国,尽管城市居民的胃癌发病率呈下降趋势,但其死亡率仍在恶性肿瘤死因顺序中占第三位,严重威胁着人民健康。手术切除是目前胃癌根治的唯一手段,但超过2/3的胃癌病人在确诊时已是晚期,错失手术根治性治疗的最佳时机。目前针对胃癌化疗的药物种类繁多,晚期胃癌的化疗方案也在40余年的发展中不断改进。但常规化疗方案的总有效率仅为20%~58%,中位生存时间不超过10个月。所以,挖掘新的抗胃癌药物仍是目前攻克胃癌亟待解决的问题。
铁死亡(ferroptosis)是2012年发现的一种新的铁依赖的脂质过氧化导致的细胞死亡方式。与经典死亡方式不同,铁死亡具有“铁离子依赖”和“脂质过氧化”这两大特征,在形态学、生物化学和遗传学方面均与以往死亡方式不同。这一过程可以被铁螯合剂和亲脂性抗氧化剂所逆转,且无法被细胞凋亡、坏死、自噬抑制剂所逆转。铁死亡已被证实存在于多种肿瘤细胞中并调控着其生长、侵袭和化疗耐药,如肺癌细胞、宫颈癌细胞、纤维肉瘤细胞、骨肉瘤细胞、前列腺癌细胞、淋巴瘤细胞、肾癌细胞等。铁死亡诱导剂sorafenib(多吉美)也被应用于治疗晚期肾细胞癌和晚期肝细胞癌的临床用药中。然而铁死亡这一新型的死亡形式在胃癌细胞中的具体调控机制和生物学功能尚不明确,与铁死亡相关的药物在晚期胃癌治疗的应用报道亦较缺乏。
目前研究表明,经典铁死亡诱导剂erastin可通过抑制细胞膜的胱氨酸/谷氨酸盐逆向转运体(cystine/glutamateantiporter,system,xc-)减少细胞对胱氨酸的摄取,从而减少细胞内半胱氨酸含量。而细胞内半胱氨酸这一原料的减少会下调谷胱甘肽(glutathione,gsh)的合成,打破细胞内氧化还原平衡并最终导致铁死亡。然而eratstin是否可诱导胃癌细胞发生铁死亡及其内在机制的研究仍在研究之中。
半胱氨酸加双氧酶-1(cysteinedioxygenase1,cdo1)能够催化半胱氨酸氧化反应生成半胱亚磺酸,是合成牛磺酸的关键酶。编码cdo1的基因作为一种新发现的抑癌基因,因其启动子甲基化导致的基因失活在人类多种肿瘤的发生、发展中起重要作用。cdo1的活性影响细胞内半胱氨酸的含量,提高细胞内cdo1的活性能避免半胱氨酸高水平导致的细胞毒性。研究表明,细胞内半胱氨酸的含量影响着gsh的合成及细胞内抗氧化能力,从而与铁死亡的发生和进展息息相关。然而,cdo1所引起的半胱氨酸代谢变化在胃癌细胞铁死亡中所起的作用仍未清楚,亟待深入研究。
技术实现要素:
本发明的目的在于提供cdo1的新应用。
在本发明中,发明人对人类胃癌细胞株和胃癌患者新鲜组织样本进行cdo1表达量的评估,并在功能学实验中验证cdo1对铁死亡标志物的调控作用。最后,针对转录因子c-myb在铁死亡过程中对cdo1表达的转录调控机制进行研究。综合有关实验结果表明,cdo1的表达水平与胃癌细胞铁死亡的发生发展相关。因而确定所述的新应用是cdo1应用于制备与铁死亡相关的胃癌治疗药物。
本发明的另一目的是提供可诱导胃癌细胞发生铁死亡的试剂。
在本发明中,发明人使用erastin及多种死亡抑制剂验证胃癌细胞可被erastin诱导发生铁死亡。因而确定所述的可诱导胃癌细胞发生铁死亡的试剂是erastin。
本发明还提供了胃癌细胞铁死亡过程的促进剂。
发明人构建过表达cdo1质粒,并验证该质粒对胃癌细胞株铁死亡过程的正性调控作用,因而确定所述的胃癌细胞铁死亡过程的促进剂是过表达cdo1质粒。
本发明的创新性在于:首次揭示了cdo1调控半胱氨酸代谢在erastin诱导的胃癌细胞铁死亡中的作用机制以及c-myb在铁死亡过程中对cdo1表达的转录调控作用。在本研究中,使用不同浓度的铁死亡诱导剂erastin刺激胃癌细胞株ags和bgc823,结果显示,胃癌细胞的生长抑制率与erastin的浓度呈正相关,并且这种细胞生长抑制能且仅能被铁死亡抑制剂所逆转。表明胃癌细胞可被erastin诱导发生铁死亡。在体外实验中,过表达cdo1可促进erastin诱导的胃癌细胞铁死亡过程。随着cdo1的过表达,可发现,铁死亡过程的标志分子gpx4在细胞内的mrna表达水平显著下降。相反地,沉默cdo1可抑制胃癌细胞的铁死亡事件的发生。此外,转录因子c-myb调控cdo1表达对于erastin诱导的胃癌细胞铁死亡也有着重要的意义。c-myb与cdo1启动子结合调节cdo1的表达水平,进而影响胃癌细胞铁死亡的发生发展。总的来说,cdo1在胃癌中是c-myb信号通路的重要组成部分,是铁死亡过程的重要代谢节点。可以认为,cdo1有可能成为erastin诱导胃癌细胞死亡的重要手段之一。因此,本发明为研究以铁死亡为基础的胃癌治疗提供了理论依据,为制备新的胃癌治疗药物提供了一个嵌入点。
附图说明
图1a是不同浓度的erastin处理胃癌细胞进行mtt法检测细胞活力的结果图。
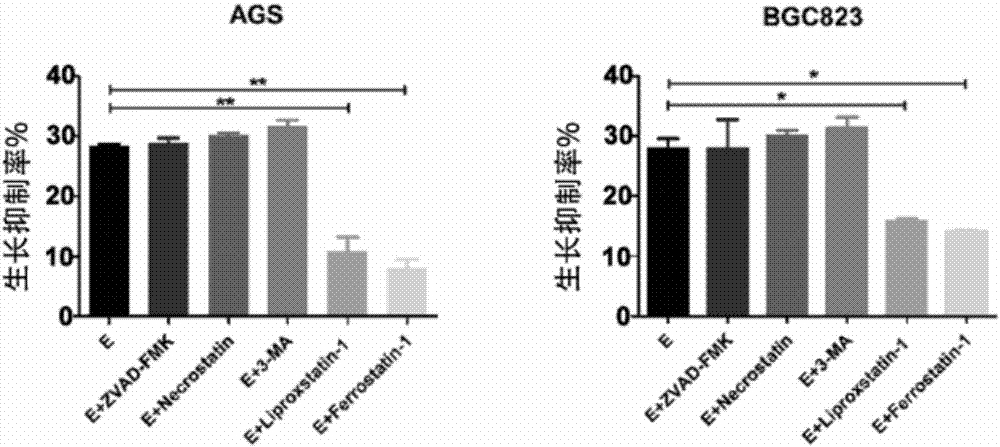
图1b是在erastin诱导下,同时加入铁死亡抑制剂(ferrostatin-1andliproxstatin-1)、凋亡抑制剂(z-vad-fmk)、坏死抑制剂(necrostatin)、自噬抑制剂(3-ma)后胃癌细胞mtt检测的结果图。
图1c是westernblot验证3条cdo1沉默序列的沉默效率的结果图。
图1d是不同浓度的erastin处理过表达cdo1的胃癌细胞,进行mtt法检测细胞活力的结果图。
图1e是10μg/mlerastin处理过表达cdo1的胃癌细胞,cdo1及gpx4表达水平的q-pcr结果图。
图2a至图2b是6种胃癌细胞及胃黏膜上皮细胞ges-1中,cdo1表达水平的q-pcr、westernblot结果图。
图2c是临床胃癌及癌旁标本中,cdo1表达水平的q-pcr结果图。
图2d是临床胃癌及癌旁标本中,cdo1表达水平的westernblot结果图。
图3a至图3c是10μg/mlerastin处理cdo1沉默的胃癌细胞,进行细胞内gsh、mda、ros水平检测的结果图。
图3d至图3f是10μg/mlerastin处理cdo1沉默的胃癌细胞,cdo1和gpx4表达水平的q-pcr、westernblot以及免疫荧光图。
图3g是10μg/mlerastin处理cdo1沉默的胃癌细胞进行透射电子显微镜观察不同处理组线粒体形态的结果图(左侧放大倍数,×1×104;右侧放大倍数,×5×104)。
图4a是不同浓度erastin刺激下,cdo1、c-myb、gpx4表达水平的westernblot代表图。
图4b是在erastin刺激下,3条c-myb沉默序列处理胃癌细胞进行mtt检测的结果图。
图4c显示c-myb沉默可以抑制erastin引起的胃癌细胞铁死亡过程。
图4d和图4e是c-myb过表达的胃癌细胞中,cdo1、gpx4表达水平的q-pcr结果图以及westernblot代表图。
图4f是cdo1与c-myb相互作用的荧光素酶报告基因实验结果。每种实验均完成3次重复实验(*p<0.05,**p<0.01,***p<0.001)。
图5a是裸鼠皮下成瘤实验,各分组裸鼠皮下瘤体的图片。
图5b是皮下成瘤瘤体体积大小的变化线图(s,shcdo1,e,erastin,n,control,,p<0.05,n=5)。
图5c和图5d是对各分组裸鼠肺、肝、脾、肾、心组织及皮下瘤体进行苏木精-伊红染色的结果图(左侧放大倍数:100倍,右侧放大倍数:400倍,比例尺:10um)。
图5e是对各分组裸鼠皮下瘤体进行免疫组织化学染色的结果图(左侧放大倍数:100倍,右侧放大倍数:400倍,比例尺:10um),显示cdo1、gpx4的表达水平。
图6是对本实验的总结图。erastin抑制细胞膜的胱氨酸/谷氨酸盐逆向转运体减少细胞对半胱氨酸的摄取,从而减少细胞内gsh的合成,导致gpx4的失活、ros的生成增加,进而引起细胞的氧化性损伤和铁死亡的发生。在c-myb的转录调控作用下,cdo1催化半胱氨酸合成牛磺酸,从而竞争性剥夺用于合成gsh的胞内半胱氨酸。cdo1对铁死亡发生发展的调控具有重要的意义。沉默cdo1通过减少牛磺酸的合成,促进gsh的合成和gpx4的活性,抑制脂质过氧化的发生和胃癌细胞铁死亡的过程。
具体实施方式
材料和方法
细胞培养
本发明所涉及的所有实验是在南方医科大学南方医院伦理委员会的许可下进行的。本发明者培养了胃癌细胞系ags、bgc823(购自foleibaobiotechnology,上海)所用培养基为rpmi1640并加入了10%胎牛血清,培养条件为37℃,5%浓度二氧化碳。
对于erastin刺激实验,野生型或cdo1沉默的胃癌细胞在加入10ng/mlerastin(购自selleck,美国)的培养基中连续培养24h,再进行后续处理。
sirna瞬时转染
本实验所用的sirna由广州市锐博生物科技有限公司设计及合成。sirna转染使用购自invitrogen(ny,美国)的lipofectamine2000转染试剂盒,操作方法依照生产商提供的说明书。根据实验需求,转染开始时间为q-pcr实验进行前24~48h,westernblot实验为48~72h。
所用的沉默cdo1序列如下:
sicdo1-#1序列:5‘gcgaugaggucaauguagadtdt3‘
sicdo1-#2序列:5‘ccaucauggaagccuacgadtdt3‘
sicdo1-#3序列:5‘acgccaaguucgaccaguadtdt3‘
所用的沉默c-myb序列如下:
sic-myb-#1序列:5‘ggaacagaauggaacagaudtdt3‘
sic-myb-#2序列:5‘gguuaucugcaggagucuudtdt3‘
sic-myb-#3序列:5‘gcacuugcagcucaagaaadtdt3‘
载体构建及瞬时转染
本发明者将pcr扩增cdo1cdna克隆到pcdna载体中,构建pcdna-cdo1过表达载体。cdo1序列参见geneid1036。
用过表达载体转染胃癌细胞系ags和bgc823,建立cdo1过表达的细胞系ags-cdo1和bgc823-cdo1。转染使用购自invitrogen(ny,美国)的lipofectamine2000转染试剂盒,操作方法依照生产商提供的说明书。
实时定量pcr
胃癌细胞总rna提取使用trizolkit(购自takara,shiga,日本),具体操作流程依照产品说明书。cdna合成使用firststrandcdna试剂盒(购自takara),反应体系为10μl。q-pcr使用sybrgreendye试剂盒(购自roche,mannheim,德国)完成。实验中所用引物序列如下:
cdo1:
(f)5'–tctctgttggggtgaaggac-3'
(r)5'–gccaggcaaataatgtctcc-3'
gpx4:
(f)5'–accgaagtaaactacactcag-3'
(r)5'–ggcgaactctttgatctct-3'
β-actin:
(f)5'–tggcacccagcacaatgaa-3'
(r)5'–ctaagtcatagtccgcctagaagca-3’
gapdh
(f)5'–acccagaagactgtggatgg-3’
(r)5'–tctagacggcaggtcaggtc-3’
蛋白质印迹法(westernblot)
胃癌细胞总蛋白提取使用全蛋白抽提试剂盒(购自南京凯基,中国),具体操作流程依照产品说明书。提取到的细胞蛋白中按4:1的比例加入5×上样缓冲液,95℃加热10分钟得到凝胶栽样,对其进行sdspage凝胶电泳。按照分子量大小分离得到的蛋白条带将被转移到硝酸纤维素膜上,然后用5%脱脂牛奶封闭1h,一抗4℃下孵育过夜。用tbst缓冲液洗涤硝酸纤维素膜,然后二抗室温孵育1h。经tbst缓冲液洗涤后使用了odyssey成像系统(购自li-cor)显像条带。
兔单克隆cdo1、gpx4以及c-myb抗体(购自abcam,英国),gadph、β-actin抗体(购自康成生物公司,中国上海),鼠抗兔荧光二抗(购自li-cor,lincoln,ne,美国)及alexafluor448标记的二抗(购自beyotime,中国上海)在本实验中使用。
免疫荧光染色
经过4%多聚甲醛固定20min,1%triton溶液孵育20min后,使用3%bsa溶液封闭30min。gpx4一抗稀释比例根据产品说明书调整,一抗4℃孵育过夜。用pbs缓冲液洗涤3遍后,使用荧光二抗(购自beyotime,中国上海)室温孵育1h。结果观察使用olympusfluoview共聚焦显微镜(olympusoptical,日本东京)。
mtt法
将mtt试剂用于检测胃癌细胞的增殖活力。将胃癌细胞(4×103个)接种于96孔板,根据不同的实验分成不同的实验分组,分组设置5个副孔;按照实验要求处理细胞后,每孔加100ul的mtt1640混合液(1640:mtt=90:10),继续避光孵育4-6h,终止培养,小心吸弃孔内培养上清液。每孔加150uldmso,置摇床上低速振荡3-5min,使结晶物充分融解。在酶联免疫监测仪上选择470/590nm波长,测定各孔光吸收值,记录结果。
gsh、mda检测
本发明者使用gsh/gssg检测试剂盒(购自abcam公司,英国)及mda检测试剂盒(购自abcam公司,英国)检测细胞内gsh、mda水平,具体操作流程依照产品说明书。
活性氧ros检测
取生长状态良好的细胞(1.5×105个细胞)接种于6孔板,按照实验需要分别对各实验组进行处理。每个处理孔中2ulros探针+2000ul培基,避光孵育培养1h,取出6孔板可见培养细胞的培基呈现绿色。后面操作均需避光。用胰蛋白酶消化细胞,800rpm,5min离心后pbs重悬,将细胞悬液转移到流式检测管中,上机检测ros探针的荧光值。
双萤光素酶报告基因检测(启动子活性检测)实验
本发明者使用荧光素酶报告基因实验检测转录因子c-myb与cdo1启动子区dna相互作用。取293t细胞株(来源于中科院细胞库,70%的汇合度)接种于96孔板,24小时后转染萤光素酶报告基因质粒和反式作用因子基因质粒,每个样品设置6个复孔,每孔质粒比例为萤火虫萤光素酶载体(firefly):海肾萤光素酶载体(renilla):转染试剂=0.1μg:0.002μg:0.25μl。用1xplb(passivelysisbuffer)裂解细胞提取蛋白并用于荧光素酶检测。10μl蛋白上清液置于黑色不透光的96孔酶标板,加入100μl荧光素酶报告子底物,使用发光仪测定荧光素酶的活性。计算相对荧光强度,并与空载对照比较,检测c-myb与cdo1启动子区dna相互作用强度。
致瘤性试验
本发明者使用裸鼠进行致瘤性试验。所涉及的动物实验是在南方医科大学南方医院伦理委员会的许可下进行的,实验操作亦与委员会要求相一致。利用腺相关病毒构建人胃癌细胞bgc823稳定沉默cdo1基因的胃癌细胞,分别将shcdo1-bgc823胃癌细胞和对照shn-bgc823细胞(1×107个细胞/裸鼠)接种到裸鼠股后外侧皮下,5只裸鼠为一个实验组,一共分为4各实验组,分别是:shn+vehicle,shn+erastin,shcdo1+vehicle,shcdo1+erastin。接种第7d观察致瘤性,用游标卡尺测量成瘤的长、短径,并测量记录下每只裸鼠的体重。然后,各分组的成瘤裸鼠均设置erastin处理组和对照组,处理组给予20mg/kgi.p.erastin腹腔注射处理(2次/2天),对照组不予处理。连续培养到第21天时,将裸鼠利用断颈方式处死,拍照,并且收集各组裸鼠的心、肝、脾、肺、肾,放置于多聚甲醛中固定,为h&e及免疫组化实验准备。期间测量各组裸鼠皮下瘤体的大小,并通过公式:长×宽×(长+宽)/2对瘤体大小进行数字化用于比较,绘制曲线图。
苏木精-伊红染色
取各实验组的裸鼠皮下成瘤及心、肝、脾、肺、肾,经固定后,常规石蜡包埋,4um切片。切片常规二甲苯脱蜡,经各级乙醇至水洗:二甲苯(i)5min-二甲苯(ii)5min-100%乙醇2min-95%的乙醇1min-80%乙醇1min-75%乙醇1min-蒸馏水洗2min(各两次,然后把水吸干)。苏木素染色5min,自来水冲洗。吸干水后,盐酸乙醇分化30s,自来水浸泡15min或温水(约50℃)5min。置伊红液2min。常规脱水,透明,封片:95%乙醇(i)1min-95%乙醇(ii)1min-100%乙醇(i)1min-100%乙醇(ii)1min-二甲苯石炭酸(3:1)1min(省略)-二甲苯(i)1min-二甲苯(ii)1min-中性树脂封固。
免疫组织化学染色
本发明者使用半定量的方法分析蛋白的免疫组织化学染色。染色深度共分为0分(无色)、1分(淡黄色)、2分(黄色)、3分(棕黄色),每种染色所占面积则依照0分(无细胞染色)、1分(25%染色)、2分(50%染色)、3分(75%染色)及4分(100%染色)。然后染色深度评分和对应的染色面积评分相乘后相加,既得到了最后的cdo1及gpx4染色评分。其中0-2分定义为阴性表达,3-5分定义为弱阳性表达,6-12分定义为强阳性表达。
统计分析
在本实验中,双侧p值小于0.05即被视为有统计学意义。所有的统计学分析都是用spss20.0完成的,实验均重复三次,本文数据都是以平均值±标准误展示的,用one-wayanova的方法来计算p值分析组间的差异。
实施例一:erastin诱导胃癌细胞发生铁死亡。
为了验证erastin能否诱导人胃癌细胞发生铁死亡,用不同浓度的erastin(0,5,10,15,20μg/ml)处理人胃癌细胞系ags、bgc823,24h后用mtt法检测细胞的增殖活力。结果显示,随着erastin刺激浓度的增加,人胃癌细胞的生长抑制率逐渐升高(图1a),并且此生长抑制(10μg/mlerastin刺激下)能且仅能被铁死亡抑制剂ferrostain-1andliprostatin-1所逆转,而凋亡抑制剂zvad-fmk、自噬抑制剂3-methyladenine、坏死抑制剂necrostatin的效果并没有统计学意义(图1b)。根据上述实验结果,认为erastin能诱导胃癌细胞发生铁死亡。
实施例二:cdo1在胃癌细胞及组织中的表达谱。
为了探索胃癌细胞中cdo1的表达水平,取6种人胃癌细胞系及永生化的人胃黏膜上皮细胞ges-1,检测其mrna和蛋白质表达水平(图2a和2b)。q-pcr和westernblot结果均显示,cdo1在胃癌细胞中的低表达,在ges-1细胞中的高表达。
对于胃癌组织,取了16对临床确诊为胃癌的患者手术标本,检测其mrna的表达水平(图2c),结果表明,相比癌旁标本,胃癌标本中的cdo1表达量普遍较低。进一步选取其中的4对胃癌患者手术标本,检测其蛋白质的表达水平,westernblot结果也提示,在胃癌标本中,cdo1的蛋白质水平呈现低表达(图2d)。
实施例三:过表达cdo1促进胃癌细胞的铁死亡过程。
为明确cdo1在胃癌细胞铁死亡过程中的作用,将过表达cdo1质粒用瞬时转染法转入ags及bgc823细胞系中,再给予不同浓度的erastin刺激(0,10,20ug/ml)。mtt实验结果表明,过表达cdo1可促进erastin诱导的胃癌细胞铁死亡过程(图1d)。
目前研究表明,erastin通过抑制细胞半胱氨酸的摄取而导致一系列铁死亡事件的发生,包括gsh缺乏,gpx4失活,ros积累以及线粒体形态的改变。为了进一步探索过表达cdo1对铁死亡的作用,用10μg/mlerastin处理cdo1过表达的ags、bgc823人胃癌细胞系,以dmso做对照,研究在erastin诱导的铁死亡过程中,过表达cdo1对铁死亡分子标志物gpx4的影响。在q-pcr实验中,注意到过表达cdo1可明显抑制gpx4的mrna表达水平(图1e)。
实施例四:cdo1调控铁死亡过程中的分子事件。
在本部分实验中,使用了3条sirna序列以沉默cdo1表达。
sicdo1-#1序列:5‘gcgaugaggucaauguagadtdt3‘
sicdo1-#2序列:5‘ccaucauggaagccuacgadtdt3‘
sicdo1-#3序列:5‘acgccaaguucgaccaguadtdt3‘
使用了westernblot的方法以验证这3条sirna序列的沉默效率。结果显示,sicdo1-#2序列及sicdo1-#3序列均能有效的沉默cdo1的蛋白表达,其中的sicdo1-#3序列是沉默效率最高的(图1c)。
为了进一步探索cdo1对铁死亡的代谢调控作用,用10μg/mlerastin处理cdo1沉默(sicdo1-#3序列)的ags、bgc823人胃癌细胞系,研究在erastin诱导的铁死亡过程中,沉默cdo1对铁死亡分子事件的影响。
使用相关试剂盒,可检测到沉默cdo1,细胞内gsh的含量明显增加(图3a),而脂质过氧化产物mda含量则明显降低(图3b)。
流式细胞仪检测细胞ros含量,实验结果表明,相比于对照组,沉默cdo1可降低ros基础量(图3c)。
在q-pcr实验中,注意到沉默cdo1可明显促进gpx4的mrna表达水平(图3d)。同样的,在westernblot(图3e)和免疫荧光染色实验(图3f)中,得到了相似的结果。沉默cdo1促进了gpx4的蛋白表达水平。
然后,使用透射电子显微镜观察胃癌细胞线粒体形态、结构的变化(图3g)。对于cdo1沉默的胃癌细胞,尽管使用erastin处理,但其并没有呈现出铁死亡特有的线粒体形态改变(线粒体缩小,双层膜密度增加)。
上述结果表明,cdo1可调控铁死亡过程中的分子事件,沉默cdo1阻碍gsh缺失,gpx4失活及ros积累,最终抑制铁死亡的发生。
实施例五:在铁死亡的过程中,c-myb转录调控cdo1的表达。
研究已证明,cdo1启动子在-71位点含有c-myb结合元件(gttg)。鉴于cdo1与c-myb的相互作用,猜测在铁死亡过程中,转录因子c-myb可能转录调控cdo1的表达。
为了验证猜想,使用westernblot检测不同浓度erastin(10,30μg/ml)处理的胃癌细胞中,cdo1,c-myb和gpx4的蛋白表达水平。结果显示,随着erastin浓度的增加,cdo1,c-myb和gpx4的蛋白表达水平均下降,并呈浓度依赖(图4a)。
在本部分实验中,使用了3条sirna序列以沉默c-myb表达。
sic-myb-#1序列:5‘ggaacagaauggaacagaudtdt3‘
sic-myb-#2序列:5‘gguuaucugcaggagucuudtdt3‘
sic-myb-#3序列:5‘gcacuugcagcucaagaaadtdt3‘
使用了mtt法以验证这3条sirna序列的沉默效率。结果显示,sic-myb-#3序列是沉默效率最高的(图4b)。
将sic-myb-#3序列用瞬转法转入ags及bgc823细胞系中,再给予10μg/mlerastin刺激。mtt实验结果表明,eratin诱导的胃癌细胞铁死亡过程可被沉默c-myb所抑制(图4c)。
利用生物信息学知识,在数据库jasparcoredatabase和website-promo中发现转录因子c-myb含有与cdo1相互作用的dna结合区域。
构建过表达c-myb基因质粒,并在人胃癌细胞中过表达c-myb基因。在蛋白质和mrna表达水平,注意到,过表达c-myb可明显促进gpx4表达下降,而cdo1表达升高(图4d和4e)。
萤光素酶报告基因实验结果也进一步验证了c-myb与cdo1反应元件之间的直接相互作用(图4f)。
因此,可以认为,在胃癌细胞的铁死亡过程中,转录因子c-myb与cdo1启动子相互结合,从而转录调控cdo1的表达。
实施例六:沉默cdo1能抑制裸鼠体内瘤体的铁死亡过程。
为了验证cdo1在体内复杂环境下是否仍对铁死亡过程具有相似的调控作用,使用裸鼠进行致瘤性试验,观察裸鼠皮下成瘤的瘤体大小,并绘制瘤体体积变化曲线。实验分组有:shn+vehicle,shn+erastin,shcdo1+vehicle,shcdo1+erastin。结果显示,对比shn+vehicle组,shn+erastin组的瘤体体积明显减小;同时,对比shn+erastin组,shcdo1+erastin组的瘤体体积却明显增大(图5a和5b)。
第21天取裸鼠的肺、肝、脾、肾、心组织以及瘤体进行苏木精-伊红染色,发现erastin处理组和对照组之间,组织和瘤体的组织结构和功能并没有显著的差异(图5c)。
免疫组织化学染色实验中,shcdo1+erastin组皮下瘤体组织中的gpx4表达水平较shn+erastin组的明显升高(图5e)。
至此,可以从上述实验结果中推断,沉默cdo1能抑制裸鼠体内瘤体的铁死亡过程,从而使胃癌细胞对erastin诱导剂敏感性降低。
综上所述,本发明首次确认了cdo1在erastin诱导的胃癌细胞铁死亡中的作用机制以及c-myb在铁死亡过程中对cdo1表达的转录调控作用。
自从铁死亡的概念于2012年被dr.brentr.stockwell提出后,越来越多的研究已经证实了铁死亡与某些肿瘤疾病之间的内在分子机制。尽管如此,铁死亡作为一种独特的细胞死亡形式,它的调控机制和生物学功能仍不明确,亟待具体而深入的研究。尤其是在胃癌治疗领域,并没有一个明确的理论依据去证实铁死亡在胃癌细胞中的存在性和可能机制,这也局限了与铁死亡相关药物在晚期胃癌中的应用。在本发明中,证明了erastin能诱导胃癌细胞发生铁死亡,这对于以铁死亡为基础的胃癌治疗药物的制备有着重要的意义。
鉴于铁死亡和胃癌治疗的关系,进一步寻找相关的药物靶点以深入探索其中的分子机制。cdo1在调控半胱氨酸代谢的过程中扮演者一个不可或缺的角色,而此前的研究已经证实,半胱氨酸对于gsh的合成、细胞内的氧化还原平衡以及铁死亡的发生发展都有着重要的意义,因此,立足于半胱氨酸代谢这一大环境,深入研究了cdo1对胃癌细胞铁死亡过程的调控作用以及可能涉及的相关分子机制。结合体内、体外实验,证明了沉默cdo1可以通过促进gsh的合成和gpx4的活性,减少ros和mda的产生,从而抑制胃癌细胞的铁死亡过程。而过表达cdo1可抑制gpx4的表达水平,促进胃癌细胞的铁死亡过程,有利于阻碍胃癌细胞的生长。推断cdo1是胃癌细胞铁死亡过程中的重要代谢节点,是可应用于胃癌治疗药物制备的嵌入点。
此外,本发明还证明了,转录因子c-myb转录调控cdo1的表达水平而影响铁死亡过程。c-myb结合cdo1启动子区域,从而参与调控半胱氨酸的代谢。而过表达c-myb可降低gpx4的表达水平,沉默c-myb可抑制erastin诱导的铁死亡过程,因此,可以认为c-myb通过转录调控cdo1的表达参与调节半胱氨酸代谢,从而影响铁死亡的过程。
- 还没有人留言评论。精彩留言会获得点赞!