一种医药组合物用于制备治疗或预防个体感染病毒的药物的用途的制作方法
本发明的实施方式是关于一种医药组合物用于制备治疗或预防个体感染病毒的药物的用途。
背景技术:
流行性感冒病毒(influenzavirus)极易藉由飞沫传染与接触传染在人与人、人与脊椎动物间散开,因其抗原变化快的特性,所以常在世界各地规模或大或小的流行。感染病毒的患者常会引起许多并发重症,而这些并发重症通常是流感患者主要的死因,其中最普遍的为流感所引起的急性肺发炎所造成的肺损伤。当病毒被细胞的受体所辩识,便会去活化巨噬细胞,而巨噬细胞可以藉由nf-κb的路径去释放一些促发炎的细胞激素或蛋白质,包括inos、cox-2、il-6等等,而细胞激素会活化并启动先天性免疫反应以抵御病毒入侵,但若免疫反应过度会造成严重的发炎现象发生。据此,发展具有良好疗效的治疗方案,为当前急迫的需求。
技术实现要素:
本发明的一个方面在于提供一种医药组合物用于制备治疗或预防个体感染病毒的药物的用途,其中该医药组合物包含一有效成分,所述有效成是选自由1,2,3,4-四甲氧基-5-甲苯、1,2-二甲氧基苯、1,2,3-三甲氧基苯、2,3,4-三甲氧基-6-甲基酚、3,4-二甲氧基-6-甲苯-1,2-二醇、3,4-二甲氧基-5-甲苯-1,2-二醇、2,4-二甲氧基-6-甲苯-1,3-二醇、3,6-二甲氧基-4-甲苯-1,2-二醇、4,5-二甲氧基-7-甲苯并[d][1,3]二氧杂环、4,5-二甲氧基-6-甲苯并[d][1,3]二氧杂环、4,7-二甲氧基-5-甲苯并[d][1,3]二氧杂环、5-碘-4,7-二甲氧基-6-甲苯并[d][1,3]二氧杂环、1-碘-2,3,4,5-四甲氧基-6-甲苯、1,2,3,4-四甲氧基-5-甲基-6-(3-甲基丁3-烯-1-炔-1-基)苯、4,7-二甲氧基-5-甲基-6-(3-甲基丁-3-烯-1-炔-1-基)苯并[d][1,3]二氧杂环、1,2,4-三甲氧基苯、1-碘-2,4,5-三甲氧基苯、3,4-二甲氧基酚、4,5-二甲氧基-2-甲基酚、2,5-二甲氧基酚、2,4-二甲氧基酚及其组合所组成的群组。
根据本发明的一些实施方式,该药物是能降低细胞受病毒的感染。
根据本发明的一些实施方式,该药物是能降低该个体肺部感染病毒的数量。
根据本发明的一些实施方式,该药物是能降低该个体肺部感染病毒所造成的肺损伤。
根据本发明的一些实施方式,该药物是能降低细胞发炎反应。
根据本发明的一些实施方式,该药物的使用剂量为该个体每公斤体重施予12.5-37.5毫克。
根据本发明的一些实施方式,该病毒为h1n1、h2n2、h3n2、h5n1、h7n7、h1n2、h9n2、h7n2、h7n3、h10n7、h5n2、h5n3、h5n6、h5n8、h6n1、h7n9、h10n8、鸡传染性贫血病毒(cav)、新城病毒(ndv)、鸡传染性华氏囊病毒(ibdv)、猪生殖与呼吸综合症病毒(prrsv)、第二型猪环状病毒(pcv2)、猪瘟病毒(csfv)、猪呼吸道冠状病毒(prcv)、猪细小病毒(ppv)或猪传染性肠胃炎病毒(tgev)。
根据本发明的一些实施方式,该药物是能降低介白素(il-6)、肿瘤坏死因子(tnf)及介白素-1β(il-1β)的表现量。
本发明另一方面在于提供一种化合物的制造方法,包含:在氯化铝的存在下,将具有化学式(iii)的结构的化合物与二氯甲烷于氩气保护的环境中反应,以形成具有化学式(i)的结构的化合物,
其中该化学式(iii)的结构为:
在该化学式(iii)中,r7与r8是独立选自由氢、甲氧基、氢氧基及甲基所组成的群组;
该化学式(i)为:
在该化学式(i)中,r1、r2、r3与r4是独立选自由氢、甲基、甲氧基以及氢氧基所组成的群组。
根据本发明的一些实施方式,上述具有化学式(i)的结构的化学物,其中r1为氢氧基,r2为氢氧基,r3为甲氧基,以及r4为氢或甲基。
附图说明
本发明的实施例是依据以下详尽的叙述搭配附图做阅读。
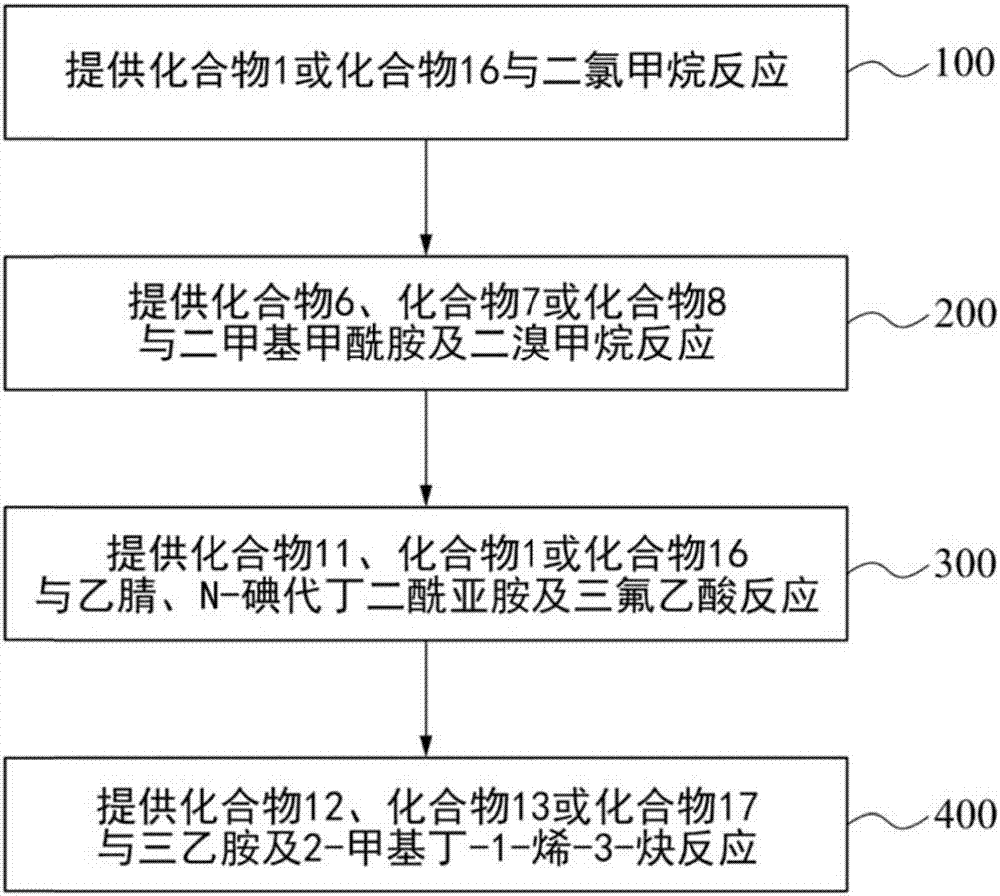
图1绘根据各种不同的实施方式,化合物1-22合成的流程图;
图2至图5绘示根据各种不同实施方式,预防试验中细胞存活率的结果图;
图6至图9绘示根据各种不同实施方式,治疗试验中细胞存活率的结果图;
图10绘示根据各种不同实施方式,小鼠血液中所含的各种免疫细胞数量;
图11绘示根据各种不同实施方式,小鼠肺部组织h1n1核蛋白基因表现量的结果图;
图12绘示根据各种不同实施方式,小鼠肺部组织经切片后,以苏木精-伊红染色后的染色结果图;
图13绘示根据各种不同实施方式,小鼠肺部组织经切片后,以免疫荧光染色后的染色结果图;
图14至图15绘示根据各种不同实施方式,小鼠感染病毒后其存活率及体重变化结果图;
其中,符号说明:
100步骤200步骤
300步骤400步骤。
具体实施方式
为使本揭示内容的叙述更加详尽与完备,下文针对本发明的实施态样与具体实施例提出说明性的描述;但这并非实施或运用本发明具体实施例的唯一形式。以下所揭露的各实施例,在有益的情形下可相互组合或取代,也可在一实施例中附加其他的实施例,而无须进一步的记载或说明。在以下描述中,将详细叙述许多特定细节以使读者能够充分理解以下的实施例。然而,可在无此等特定细节的情况下实践本发明的实施例。
本发明是关于一种医药组合物用于制备治疗或预防个体感染病毒的药物的用途,其中此医药组合物包含一有效成分,所述有效成分是选自由具有化学式(i)的化合物及化学式(ii)的化合物所组成的群组,其中,该化学式(i)具有下列的化学结构:
在一实施例中,上述医药组合物包含的有效成分是选自由1,2,3,4-四甲氧基-5-甲苯(1,2,3,4-tetramethoxy-5-methylbenzene)、1,2-二甲氧基苯(1,2-dimethoxybenzene)、1,2,3-三甲氧基苯(1,2,3-trimethoxybenzene)、2,3,4-三甲氧基-6-甲基酚(2,3,4-trimethoxy-6-methylphenol)、3,4-二甲氧基-6-甲苯-1,2-二醇(3,4-dimethoxy-6-methylbenzene-1,2-diol)、3,4-二甲氧基-5-甲苯-1,2-二醇(3,4-dimethoxy-5-methylbenzene-1,2-diol)、2,4-二甲氧基-6-甲苯-1,3-二醇(2,4-dimethoxy-6-methylbenzene-1,3-diol)、3,6-二甲氧基-4-甲苯-1,2-二醇(3,6-dimethoxy-4-methylbenzene-1,2-diol)、4,5-二甲氧基-7-甲苯并[d][1,3]二氧杂环(4,5-dimethoxy-7-methylbenzo[d][1,3]dioxole)、4,5-二甲氧基-6-甲苯并[d][1,3]二氧杂环(4,5-dimethoxy-6-methylbenzo[d][1,3]dioxole)、4,7-二甲氧基-5-甲苯并[d][1,3]二氧杂环(4,7-dimethoxy-5-methylbenzo[d][1,3]dioxole)、5-碘-4,7-二甲氧基-6-甲苯并[d][1,3]二氧杂环(5-iodo-4,7-dimethoxy-6-methylbenzo[d][1,3]dioxole)、1-碘-2,3,4,5-四甲氧基-6-甲苯(1-iodo-2,3,4,5-tetramethoxy-6-methylbenzene)、1,2,3,4-四甲氧基-5-甲基-6-(3-甲基丁3-烯-1-炔-1-基)苯(1,2,3,4-tetramethoxy-5-methyl-6-(3-methylbut-3-en-1-yn-1-yl)benzene)、4,7-二甲氧基-5-甲基-6-(3-甲基丁-3-烯-1-炔-1-基)苯并[d][1,3]二氧杂环(4,7-dimethoxy-5-methyl-6-(3-methylbut-3-en-1-yn-1-yl)benzo[d][1,3]dioxole)、1,2,4-三甲氧基苯(1,2,4-trimethoxybenzene)、1-碘-2,4,5-三甲氧基苯(1-iodo-2,4,5-trimethoxybenzene)、1,2,4-三甲氧基-5-(3-甲基丁-3-烯-1-炔-1-基)苯(1,2,4-trimethoxy-5-(3-methylbut-3-en-1-yn-1-yl)benzene)、3,4-二甲氧基酚(3,4-dimethoxyphenol)、4,5-二甲氧基-2-甲基酚(4,5-dimethoxy-2-methylphenol)、2,5-二甲氧基酚(2,5-dimethoxyphenol)、2,4-二甲氧基酚(2,4-dimethoxyphenol)以及其组合所组成的群组。
在一实施例中,本发明的实施方式提供一种具有化学式(i)结构的化合物的制造方法,包含:在一催化剂的存在下,将具有化学式(iii)的结构的化合物与一卤化甲烷化合物反应,以形成具有化学式(i)的结构的化合物,其中该化学式(iii)的结构为:
根据一些实施方式,该卤化甲烷化合物可包含但不限于二氯甲烷、二溴甲烷、三氯甲烷或三溴甲烷。此外,在一些实施方式中,上述卤烷类化合物除了卤化甲烷化合物之外,尚可包含但不限于一级卤烷类化合物、二级卤烷类化合物、三级卤烷类化合物。
术语「卤」,意指氟、氯、溴或碘。
在一实施例中,前述具有化学式(iii)结构的化合物与卤化甲烷化合物的反应是于含有惰性气体的环境中进行以提供保护作用(例如防止不必要的氧化反应产生),而此惰性气体可包含但不限于氮气、氩气或氦气。
在一实施例中,所述的病毒为流感病毒、鸡传染性贫血病毒(chickeninfectiousanemiavirus,cav)、新城病毒(newcastlediseasevirus,ndv)、鸡传染性华氏囊病毒(infectiousbursadiseasevirus,ibdv)、猪生殖与呼吸综合症病毒(porcinereproductiveandrespiratorysyndromevirus,prrsv)、第二型猪环状病毒(porcinecircovirustype2,pcv2)、猪瘟病毒(classicalswinefevervirus,csfv)、猪呼吸道冠状病毒(porcinerespiratorycoronavirus,prcv)、猪细小病毒(porcineparvovirus,ppv)或猪传染性肠胃炎病毒(transmissiblegastroenteritisvirus,tgev)。在另一实施例中,所述的病毒为流感病毒,且此流感病毒为a型流感病毒。流感病毒可依据病毒核蛋白(nucleoprotein,np)与基质蛋白(matrixprotein,mp)所产生的抗原性蛋白来区分a、b、c三型。
在一实施例中,上述药物是用于预防或治疗个体感染a型流感病毒。此处所称「感染a型流感病毒」是指由a型流感病毒所造成的感染。此外,根据病毒封套糖蛋白血球凝集素(ha)及神经胺酸酶蛋白(na)的不同组合,a型流感病毒可进一步区分成不同的亚型。在一实施例中,用于试验的a型流感病毒可包含但不限于h1n1、h2n2、h3n2、h5n1、h7n7、h1n2、h9n2、h7n2、h7n3、h10n7、h5n2、h5n3、h5n6、h5n8、h6n1、h7n9以及h10n8。在一较佳实施例中,用于试验的a型流感病毒为h1n1。
此处所称「个体」(subject)指包含人类的动物,其是承受本发明的各种实施方式。
此处所称「预防」是指用于保护或防止尚未感染病毒的个体所做的预防性措施。此处所称「治疗」是指在个体感染病毒后,通过本发明的各种实施方式可治愈、改善、减轻、缓和、影响或改变此病毒的感染情形。在一较佳实施例中,接受预防或治疗的个体为哺乳类或禽类。前述所提的哺乳类,可包含但不限于人类、鼠、猪、羊、牛、马、猫、兔、鹿、猴子及狗。前述所提的禽类,可包含但不限于鸽子、鸡、鸭及鹅。在一实施例中,当接受预防或治疗的个体为人类时,此个体可为新生儿、青少年或成年人。上述新生儿是指出生28天内(包含28天)的婴儿。
于细胞阶段试验时,在一实施例中,非预期地发现利用前述各种不同化合物所制备的医药组合物可用于降低细胞受a型流感病毒的感染。部分具体实施例中,上述细胞是衍生自细胞株包含但不限于bhk-21细胞、鸡胚胎细胞、cho细胞、cho-k1细胞、cho-k1细胞、ns-1细胞、mrc-5细胞、wi-38细胞、3t3细胞、293细胞、per.c6细胞、bsc细胞、hela细胞、hepg2细胞、llc-mk细胞、cv-1细胞、raf细胞或llcpk细胞。举例来说,在某些实施例中,用于试验的细胞为bhk-21细胞。bhk-21细胞受到前述的h1n1病毒感染前或感染后,若经苯2,4-二甲氧基-6-甲苯-1,3-二醇处理,可有效提升bhk-21细胞的存活率。上述苯2,4-二甲氧基-6-甲苯-1,3-二醇的浓度为约3.125–100μg/ml。在一些实施例中,苯2,4-二甲氧基-6-甲苯-1,3-二醇所使用的剂量可例如为3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml或100μg/ml。
此外,个体因流感病毒感染后,肺部发炎所引起的肺损伤(lunginjury)为因流感死亡的关键因子。在一实施例中,经由前述药物治疗或预防性施予该药物的个体,可有效降低该个体肺部受a型流感病毒的感染量。在一实施例中,此药物能降低该个体肺部因感染a型流感病毒所造成的肺损伤,例如在肺泡中免疫细胞球浸润的情形,或因发炎所造成的支气管肿胀。在另一实施例中,此药物亦能降低细胞发炎反应的情形。
此外,病毒感染后所引起的发炎反应亦会造成个体中发炎相关的细胞激素上升。这些细胞激素为免疫相关的细胞激素,当免疫反应程度过高时则会引起发炎。在一实施例中,本发明的药物能降低介白素(il-6)、肿瘤坏死因子(tnf)及介白素-1β(il-1β)于受感染个体中的表现量。
根据本发明的一些实施方式,于动物试验中非预期地发现该药物是能提升所需个体感染a型流感病毒的存活率。在一实施例中,上述药物所施予的剂量为该个体每公斤体重施予12.5-37.5毫克。在一实施例中,上述药物所施予的剂量为该个体每公斤体重施予15毫克、17.5毫克、20毫克、22.5毫克、25毫克、27.5毫克、30毫克、32.5毫克或35毫克。举例来说,在某些实施例中,接受预防或治疗的个体为哺乳类或禽类。前述哺乳类或禽类感染h1n1病毒前或病毒后,若施予本发明的药物每公斤体重25毫克,则可有效提高其存活率。在一较佳实施例中,施予的药物包含苯2,4-二甲氧基-6-甲苯-1,3-二醇,接受预防或治疗的个体为哺乳类或禽类,且较佳的施用剂量为该个体每公斤体重施予25毫克。本发明的药物的施予对于该个体无害,意即不会有副作用的产生。此外,部分具体实施例中,本发明的药物是于感染病毒前立即施予该个体或感染病毒后立即施予该个体。在一实施例中,上述药物是用于制备治疗或预防个体感染a型流感病毒的药物,其可依投药方式调配成各种剂型,例如锭剂、液剂、颗粒、胶囊、粉剂或其组合。
本发明的实施方式尚可包含药学上可接受的稀释剂、赋形剂或载剂。应当理解的是,上述药学上可接受的稀释剂、赋形剂或载剂可与有效成分相容,且对所施予的个体无害。在一实施例中,稀释剂可包含但不限于缓冲生理食盐水、氯化钾、磷酸氢钾、磷酸二氢钾、硫酸钠、氯化钠、氢氧化钾或其组合。上述稀释剂可用于调整本发明的药物的渗透压、酸碱值、降低/增加浓稠度或溶解度。
在一实施例中,赋形剂可为抗氧化剂、甜味剂、调味剂、着色剂、防腐剂或其组合。
在一实施例中,载剂可包含但不限于各种乳化剂、醇类液体、聚山梨醇酯、甘油或其组合。上述醇类液体可为但不限于一元醇或多元醇,例如,一元醇包含甲醇、乙醇、正丙醇、异丙醇、正丁醇、第二丁醇、第三丁醇、异丁醇、正己醇、正庚醇、正辛醇或正癸醇。而在一实施例中,聚山梨醇可例如为聚山梨醇酯20(tween20)、聚山梨醇酯40(tween40)、聚山梨醇酯60(tween60)、聚山梨醇酯80(tween80)或其组合。
根据一些实施方式,本发明的药物尚可协同其他补充物一起使用或制备成其他组合物。上述补充物包含但不限于多糖体(polysaccharides)、腺苷(adenosine)、维生素、三帖类化合物(triterpenoids)、固醇类、木质素或其组合。
在一实施态样中,本发明的药物尚可包含抗体、免疫球蛋白或其他已知的免疫因子治疗剂,利用免疫疗法针对目标物(例如病毒)的特异性加强本发明的药物的效果。
为证实本发明的实施方式可制备具有治疗或预防流感病毒的药物遂通过以下试验进行说明,应注意的是下述实施方式仅供作为示范目的,而非限制本发明。
化合物的制备
实施例1、实施例2、实施例3及实施例16所用的化合物1、化合物2、化合物3及化合物16皆购自美国sigma公司,分别为1,2,3,4-四甲氧基-5-甲苯、1,2-二甲氧基苯、1,2,3-三甲氧基苯及1,2,4-三甲氧基苯。其中化合物1及化合物16是用于作为实施例中化合物合成的起始物。
接着请参照图1,为实施例中化合物的制备方法的流程图,利用下述步骤100-400合成实施例的化合物。
步骤100:在室温下,于25毫升圆底瓶中添加4.43毫摩尔(mmol)的1,2,3,4-四甲氧基-5-甲苯(化合物1),随后加入6毫升(ml)的二氯甲烷(dichloromethane,dcm)中,再加入0.65克氯化铝(alcl3)然后灌氩气。加热至40℃持续反应16小时后以薄层色层分析法(thinlayerchromatorgraphy,tlc)做追踪。随后将上述反应物移至室温冷却,加入30毫升冰水以及二氯甲烷做萃取。最后利用管柱层析法,以不同比例的正己烷(hexane)与乙酸乙酯(ethylacetate,ea)作为冲提剂纯化,可得2,3,4-三甲氧基-6-甲基酚、2,4-二甲氧基-6-甲苯-1,3-二醇、3,4-二甲氧基-6-甲苯-1,2-二醇、3,4-二甲氧基-5-甲苯-1,2-二醇以及3,6-二甲氧基-4-甲苯-1,2-二醇,分别为实施例4-8的化合物4-8。
前述步骤100的起始物(化合物1)若换成化合物16,即将1,2,3,4-四甲氧基-5-甲苯换成1,2,4-三甲氧基苯,可以相同步骤制得3,4-二甲氧基酚、4,5-二甲氧基-2-甲基酚、2,5-二甲氧基酚及2,4-二甲氧基酚,分别为实施例19-22的化合物19-22。
步骤200:在室温下,于25毫升圆底瓶中添加1.49毫摩尔的3,4-二甲氧基-6-甲苯-1,2-二醇(化合物6),随后加入250毫克氢氧化锂(lioh)后灌氩气,再加入3毫升二甲基甲酰胺(dimethylformamide,dmf)。接着缓慢加入0.42毫升的二溴甲烷(dibromomethane),加热至80℃持续反应过夜(overnight)后以薄层色层分析法做追踪。待上述反应物移至室温冷却后,加入15毫升冰水及15毫升乙酸乙酯萃取,再加入等体积的饱和食盐水。最后利用管柱层析法,以不同比例的正己烷与乙酸乙酯作为冲提剂纯化,可得4,5-二甲氧基-7-甲苯并[d][1,3]二氧杂环,为实施例9的化合物9。
前述步骤200的起始物(化合物6)若换成化合物7,可以相同步骤制得4,5-二甲氧基-6-甲苯并[d][1,3]二氧杂环,为实施例10的化合物10。
前述步骤200的起始物(化合物6)若换成化合物8,可以相同步骤制得4,7-二甲氧基-5-甲苯并[d][1,3]二氧杂环,为实施例11的化合物11。
步骤300:在室温下,于25毫升圆底瓶中添加4.43毫摩尔的4,7-二甲氧基-5-甲苯并[d][1,3]二氧杂环(化合物11),随后加入2毫克乙腈(acetonitrile),1.1毫摩尔n-碘代丁二酰亚胺(n-iodosuccinimide,nis),再加入0.3毫升三氟乙酸(cf3cooh),并以锡箔纸包住。加热至50℃持续反应5小时后以薄层色层分析法做追踪。待上述反应物移至室温冷却后,加入5毫升连二亚硫酸钠(sodiumdithionite)。接着以6毫升二氯甲烷萃取,再加入10毫升以水萃取可得5-碘-4,7-二甲氧基-6-甲苯并[d][1,3]二氧杂环,为实施例12的化合物12。
前述步骤300的起始物(化合物11)若换成化合物1,可以相同步骤制得1-碘-2,3,4,5-四甲氧基-6-甲苯,为实施例13的化合物13。
前述步骤300的起始物(化合物11)若换成化合物16,可以相同步骤制得1-碘-2,4,5-三甲氧基苯,为实施例17的化合物17。
步骤400:在室温下,于25毫升圆底瓶中添加10毫摩尔的5-碘-4,7-二甲氧基-6-甲苯并[d][1,3]二氧杂环(化合物12)、130毫克碘化亚铜(cui)、130毫克、乙酸钯(pd(oac)2),随后加入1.0毫升三乙胺(trimethylamine,et3n),加热至60℃进行反应,并于反应途中缓慢加入192毫克2-甲基丁-1-烯-3-炔(2-methylbut-1-en-3-yne)并反应36小时,接着以薄层色层分析法做追踪。待上述反应物移至室温冷却后,加入15毫升乙酸乙酯萃取,然后过滤,以水6毫升洗去杂质、浓缩并抽真空干燥,最后利用管柱层析法,以不同比例的正己烷与乙酸乙酯作为冲提剂纯化可得4,7-二甲氧基-5-甲基-6-(3-甲基丁-3-烯-1-炔-1-基)苯并[d][1,3]二氧杂环,为实施例15的化合物15。
前述步骤400的起始物(化合物12)若换成化合物13,可以相同步骤制得1,2,3,4-四甲氧基-5-甲基-6-(3-甲基丁3-烯-1-炔-1-基)苯,为实施例14的化合物14。
前述步骤400的起始物(化合物12)若换成化合物17,可以相同步骤制得1,2,4-三甲氧基-5-(3-甲基丁-3-烯-1-炔-1-基)苯,为实施例18的化合物18。
如下表一所述,利用化合物1-22遂调制成不同浓度的溶液以进行后续各种试验。
表一
细胞培养
本实施方式用于试验的细胞为幼仓鼠肾细胞bhk-21(atccccl-10,babyhamsterkidneycells)。当细胞于培养基上长至八分满时进行继代培养。首先,吸除细胞培养液,以磷酸盐缓冲液(phosphatebufferedsaline,pbs)洗去残留血清及细胞代谢物,加入1毫升胰蛋白酶-edta(typsin-edta)后,置于37℃下作用3-5分钟。接着以0.5毫升胎牛血清(fetalbovineserum,fbs)中止胰蛋白酶-edta的作用,以rpmi-1640培养液清洗并收集细胞。分装于50毫升离心管中,于4℃的温度下以500g离心5分钟,去除上清液,再以rpmi-1640培养液悬浮细胞,进行细胞计数后,最后再培养于含10%胎牛血清的细胞培养液中。
病毒培养
注射a型流感病毒(h1n1)100微升(μl)至鸡蛋胚的尿囊膜后以蜡封住洞口进行繁殖,放置培养箱中培养1至2天,再置于4℃等待凝结。最后将尿囊膜中液体抽出,置于-80℃保存。
病毒效价测定
继代培养时将bhk-21细胞接种于6孔培养盘中,置于含5%co2的培养箱。待其细胞培养至6至7分满时,吸取细胞培养液,以pbs清洗残留细胞液,并加入不同稀释倍数的病毒悬浮液。置于培养箱感染1小时后,将病毒悬浮液吸除,加入含2%fbs与2%琼脂糖凝胶(agarosegel)的rpmi-1640培养液,静置待其凝固后于培养箱中培养2至3天。接着加入2毫升10%福马林(formalin),于室温下静置1小时后将凝胶移除,以1%结晶紫(crystalviolet)染色1小时。最后以清水洗去残余结晶紫,计算病毒班数量,定出病毒效价。单位为pfu/ml(plaqueformingunit)。
统计分析
试验结果的数据以平均值(means)±标准误差(sem)表示之,并以student’st-test来比较各处理组间的差异性。以星号「*」表示具有显著差异,*表示p<0.05;**表示p<0.01;***表示p<0.001。
细胞毒性测试
细胞毒性测试采用mts试验(mtsassay)进行检测。以1×104细胞/孔的bhk-21细胞量接种于96孔培养盘中,置于37℃下含有5%co2的培养箱中培养24小时后,使其待细胞贴覆,分别加入不同浓度的待测样品与细胞在培养箱中培养作用48小时。最后,加入mts试剂于培养液中避光反应1小时后测其在波长490nm的吸光值,以检测细胞存活率。
利用mts试验得以测定本实施方式的各种化合物(化合物1-22)对于流感病毒的预防或治疗效果。实施例1-22中,每一化合物皆调制成6种不同的浓度供试验,为3.125μg/ml、6.25μg/ml、12.5μg/ml、25μg/ml、50μg/ml及100μg/ml。未做任何处理的细胞为控制组(control),并以控制组的存活率为100%可计算出其他处理组别的相对存活率。仅感染病毒但未做任何预防及治疗处理的组别为病毒组。此外,由于化合物1-22皆以dmso作为溶剂,故dmso组是指感染病毒后仅以dmso处理的对照组。tamiflu为市售抗病毒制剂,作为正控制组试验浓度分别为25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml及800μg/ml。根据上述,本试验遂依照待测化合物1-22添加时间点分为两大组:
(1)预防(prophylaxis)试验组:将bhk-21细胞培养于96孔培养盘中,先加入不同浓度的化合物1-22于培养箱中作用1小时。随后再加入病毒感染剂量(multiplicitiesofinfection,moi)为0.1的h1n1流感病毒作用1小时。接着移除培养液,加入含2%fbs的prmi-1640培养液,置于37℃含有5%co2的培养箱中培养48小时,以mts试验测其细胞存活率。
(2)治疗(treatment)试验组:将bhk-21细胞培养于96孔培养盘中,先加入moi为0.1的h1n1流感病毒作用1小时。接着再移除病毒,添加不同浓度的化合物1-22于培养箱中作用1小时。最后移除培养液,加入含2%fbs的prmi-1640培养液,置于37℃含有5%co2的培养箱中培养48小时,以mts试验测其细胞存活率。
参照图2至图5,显示预防试验组的细胞存活率。结果显示感染病毒后不做任何处理的病毒组存活率仅为35.27%。与病毒组相比,经实施例1-22的化合物1-22处理过后,皆可有效预防病毒感染,并且具有显著差异。实施例20于剂量12.5μg/ml时存活率可达80%以上。而实施例4、实施例5及实施例9效果最佳,存活率皆接近80%并且呈现剂量相关(dose-dependent)。
继续参照图6至图9,显示治疗试验组的细胞存活率。结果显示感染病毒后不做任何处理的病毒组存活率仅为36.52%。与病毒组相比,经实施例1-22的化合物1-22处理过后,皆可有效治疗病毒感染,并且具有显著差异。此外,tamiflu组显示在浓度25μg/ml、50μg/ml、100μg/ml、200μg/ml、400μg/ml及800μg/ml时,存活率分别为57.60±4.73%、55.51±4.07%、66.39±4.68%、61.39±3.72%、55.57±2.76%、54.18±4.79%。实施例5除了在治疗阶段呈现剂量相关之外,于试验浓度50μg/ml及100μg/ml皆接近80%,效果亦高于正控制组的tamiflu。根据上述,遂选择实施例5的化合物5进一步进行动物试验。
动物模式建立
本试验使用购自国家实验动物中心的balb/c品是小鼠,所有小鼠皆饲养于台湾海洋大学生命科学院动物房。
本试验将动物试验模式分为四组:
(1)控制组:小鼠于攻毒前管喂pbs,攻毒时以鼻腔吸入pbs。
(2)病毒组:小鼠于攻毒前管喂pbs,攻毒时以鼻腔吸入500pfu/小鼠的h1n1病毒。
(3)tamiflu组:小鼠于攻毒前管喂pbs,攻毒时以鼻腔吸入500pfu/小鼠的h1n1病毒一小时后,以每天每公斤体重约20毫克的tamiflu(20mg/kg/day)进行管喂。
(4)实施例5:小鼠于攻毒前管喂pbs,攻毒时以鼻腔吸入500pfu/小鼠的h1n1病毒一小时后,以每天每公斤体重约25毫克的化合物5(25mg/kg/day)进行管喂。
血液分析免疫
小鼠于第九天以co2牺牲后,以心脏采血方式收集小鼠全血。利用血球分析仪(exigoveterinaryhematologyanalyzer,medonic,stockholm,sweden)进行血液分析。
如图10所示,显示经上述四种不同组别处理过后,白血球(leukocyte)、淋巴球(lymphocyte)、中间细胞(intermediatecell)及嗜中性粒细胞(neutrophilegranulocyte)的细胞数量。相较于控制组,经实施例5处理过后的小鼠血液中所的白血球、淋巴球、中间细胞及嗜中性粒细胞不具显著差异。由此可知,实施例5并不会影响小鼠的免疫细胞数量。
即时定量聚合酶连锁反应(real-timepcr)检测病毒表现量
由于h1n1病毒为rna病毒,故需先萃取其rna后再反转录为cdna方可进行即时定量聚合酶连锁反应。
首先,秤取肺部组织块将其以研磨棒磨碎后利用市售rna萃取套件rneasy(qiagen,germantown,usa)进行总rna萃取,取2μlrna与depc(diethylpyrocarbonate)水稀释10倍,测其在波260nm与280nm波长下的吸光值后换算成rna浓度及纯度。随后取已定量的rna于pcr管中,加入depc水补至12.5μl,再加入1μloligo(dt)引子,于72℃反应2分钟后立即置入冰浴,依序加入4μl5倍缓冲液、1μl10mmdntp混合物、1μlm-mlv逆转录酶及0.5μlrnase抑制剂,均匀混合后于42℃反应1小时,接着于95℃反应5分钟去除反转录酶的活性,即可得前述rna的cdna。
接着,取5μl经100倍稀释的cdna,接着加入12.5μliqtmsybr
参照图11,显示经前述四种不同组别处理过后,h1n1核蛋白基因表现量。相较于攻毒后未做处理的病毒组,tamiflu及实施例5的组别皆下降约5倍以上并有显著差异。此外,实施例5下降程度近似tamiflu组,由此可知,实施例5可使病毒感染力下降。
小鼠肺部病理组织石蜡包埋切片
将小鼠肺组织浸泡在10%福马林溶液中,于4℃静置一天后,依序以70%、90%以及100%酒精以及二甲苯进行脱水。石蜡包埋后进行组织切片。将玻片置于50℃烘箱中烘片,而后可于4℃保存或进行组织染色。
苏木精-伊红染色(hematoxylinandeosinstain,h&estain)
染色前,将前述包覆组织的石蜡以二甲苯脱蜡覆水,之后将玻片浸泡苏木精染色10秒后以流水冲洗15分钟。接着以伊红染色1分钟后,以流水冲洗,待玻片干后,依序浸泡70%、90%以及100%酒精以及二甲苯5分钟进行脱水,待玻片干后即可封片保存。
如图12所示,攻毒后未做治疗处理的病毒组,周围肺泡有免疫细胞球浸润的范围较控制组密集,显示其造成的肺损伤较为严重。相较于病毒组,经tamiflu及实施例5治疗的小鼠其浸润范围较为轻微。由此可知实施例5可降低流感病毒所造成的肺损伤。
免疫荧光染色(immunofluorescencestain)
利用前述石蜡包埋切片制得玻片,于65℃烘箱作用5分钟后,将玻片以二甲苯进行脱蜡,接着以pbst(pbs-tween20)清洗三次后,加入5%牛血清蛋白(bovineserumalbumin,bsa)进行填补(blocking)作用1小时。填补作用结束后以pbst清洗三次,加入小鼠抗流感a/wsn/33m蛋白抗体(mouseanti-influenzaa/wsn/33m-protein),置于4℃反应隔夜(overnight)。次日以pbst清洗三次,加入荧光异硫氰酸盐-山羊抗小鼠抗体(fitc-goatantimouseigg)作用1小时,再以pbst清洗三次,以1μg/ml的4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindoledihydrochloride,dapi)染核,接着利用荧光显微镜观察组织荧光信号的表现。
参照图13,根据荧光染色结果显示攻毒后未做治疗处理的病毒组有大量病毒存在。反之,实施例5荧光信号减少许多,并与tamiflu结果类似。再次证明实施例5能有效降低肺部组织的病毒感染量。
小鼠存活率及体重变化
如前述的动物模式建立,试验组别为控制组、病毒组、tamiflu组及实施例5。但小鼠不进行牺牲,而是观察其感染病毒后的存活率并且记录其体重变化。
参照图14及图15,显示小鼠经过四种组别处理过后,为期19天的存活率及体重变化。控制组未受病毒感染一直到19天为止小鼠存活率为100%;病毒组仅单独感染病毒未做任何治疗,故在第9天开始出现死亡,到第19天时小鼠存活率仅剩25%;tamiflu组在第14天开始出现死亡,到第19天时小鼠存活率为40%;经实施例5的化合物5处理的组别,在第14天开始出现死亡,到第19天时小鼠存活率可达80%,并且相较于其他组别,体重逐渐回升至原有重量。
综上所述,本发明的实施方式是利用前述22种化合物,其制备成的药物可用于治疗或预防a型流感病毒。具体来说,利用本发明的实施方式所制备的药物不仅可降低a型流感病毒感染量及降低其所造成的肺损伤,并且于动物试验中可提升小鼠存活率及减少体重下降的百分比。
前文概述数个实施例的特征以使得熟习该项技术者可更好地理解本揭示内容的态样。熟习该项技术者应了解,可容易地将本揭示内容用作设计或修改用于实现相同目的及/或达成本文引入的实施例的相同优点的其他方法或制程的基础。熟习该项技术者亦应认识到,此类等效物不违背本揭示内容的精神及范畴,且可在不违背本揭示内容的精神及范畴的情况下于此作出各种变化、替代以及变更。
- 还没有人留言评论。精彩留言会获得点赞!