哇巴因在制备抗肾结石肾小管损伤药物中的应用的制作方法
本发明涉及钠钾atp酶抑制剂哇巴因在治疗结石性肾病肾小管损伤中的新用途。
背景技术:
肾结石是常见的梗阻性肾病之一。目前,全球人口的肾结石发病率大约为5%-15%,其中,大约80%的结石晶体为草酸盐晶体。传统方法治疗复杂肾结石以开放性手术和体外冲击碎石术为主,但开放性手术创伤大,术后并发症多,恢复时间较长;而体外冲击波碎石对于复杂性肾结石患者的治疗效果不够理想,结石难以取净。且体外冲击波碎石治疗复杂结石患者,常需要进行多次碎石,对患者身体影响较大,易引起并发症。随着医疗技术的不断发展,经皮肾镜取石术(pcnl)以及经输尿管软镜取石术(rirs)由于手术时间短、结石清除效果好,术后恢复快等优点,已成为目前临床上广泛使用的复杂肾结石治疗方法。尽管如此,国内已有研究表明,pcnl以及rirs均对患者肾功能存在不同程度的损伤。
对于肾结石患者,尿路梗阻并不是唯一的威胁,更值得注意的是结石导致的肾功能减退。在一项注册管理机构的研究中,一次或多次发生肾结石的患者与终末期肾病(esrd)的高风险密切相关,并且这种不良预后的风险在女性中更为显著。在中国上海的一项基于社区的研究发现,慢性肾病(ckd)患者与非ckd患者相比,ckd患者中肾结石的比例明显高于非ckd患者。
肾小管上皮细胞损伤是肾结石导致肾功能减退的主要风险因素之一。草酸盐、草酸钙结晶等结石组成成分都被认为参与了肾小管上皮细胞的损伤。病理研究显示,肾小管中草酸钙的沉积与近端肾小管细胞的坏死以及随后的肾衰竭具有强烈的相关性。一水草酸钙(com)结晶已被报道能够导致肾小管上皮细胞之间的紧密连接受损,细胞间的通透性增加,极性丢失。同时,草酸盐还能够导致肾小管细胞发生炎症反应,继而引发细胞损伤与凋亡。
值得注意的是,结石晶体在肾小管上皮细胞表面的成核现象是肾结石形成的必要过程。正常情况下,尿液从肾小球到肾盂大约需要3分钟,而晶体形成需要数小时的时间才能达到堵塞肾小管的大小,因此这些晶体只有结合至肾小管上皮细胞表面,才有形成结石的可能。有研究发现,受损的肾小管上皮细胞膜会发生脂质不对称丢失以及极性丢失的现象,能够为初期的微小晶体提供有效的成核位点,同时还能诱导com晶体的形成(该晶体对细胞具有很强的粘附力)。随后,细胞表面迅速并更加牢固地粘附更多的钙结晶,从而触发结石形成的级联反应。因此,与目前的结石治疗方法相比,减轻或消除初期结石晶体对肾小管上皮细胞的损伤能够从源头预防结石的形成,最终缓解结石引起的肾功能减退。
na+/k+-atpase是分布于真核细胞细胞膜上重要的离子转运泵,它能够利用atp水解的能量使2个k+进入细胞内,3个na+泵出细胞外。其最主要的生理功能就是建立并维持细胞膜内外的电化学梯度。这对于很多生理过程是至关重要的,比如神经元的电传导,渗透压的调节等。强心苷是一类自然来源的,能与na+/k+-atpase结合并抑制其活性的化合物。起初,该类化合物主要在洋地黄叶、夹竹桃科、玄参科、十字花科等植物中被分离,其中最为重要的有洋地黄毒苷(digitoxin),地高辛(digoxin),夹竹桃苷(oleandrin)以及哇巴因(ouabain)等。近年来,随着质谱技术的进步,哺乳动物内源性强心苷被发现,总称为内源性地高辛样化合物(endogenousdigoxinlikesubstances,edls)。它们主要分布于哺乳动物组织(下丘脑、肾上腺)以及体液(血液、尿液以及脑脊液)中。该家族成员在用于治疗心衰以及心律不齐时已在临床上使用了数百年,其可以通过对na+/k+-atpase的抑制,使得细胞内na+增多,继而na+与ca2+交换增多,最终导致细胞内ca2+浓度升高,起到正性肌力的作用。
除了作为离子泵发挥作用,最近的研究指出na+/k+-atpase可以作为脚手架蛋白发挥作用,它可以集合多个蛋白信号结构域,并传递信号至多个细胞内组分。该复合物成员包括src激酶、egfr、ip3受体以及小窝蛋白等。有趣的是,该酶的信号转导活性在很多情况下并不依赖于其作为离子泵的特性。当强心苷类化合物与na+/k+-atpase结合后,能够导致该复合物发生构象变化,从而触发下游多个信号通路,在生理以及病理状态的调节中发挥作用。遵循该思路,有研究发现,强心苷类化合物能够激活ras-raf-mapk级联反应,从而调节多个细胞内过程,包括细胞粘附、细胞的极性、蛋白转运以及诱导增殖等。此外,还有一些研究显示强心苷类药物在中风、心肌缺血以及神经退行性疾病中的潜在治疗效应。
在肾脏疾病方面,低浓度的ouabain能够触发低频率的钙离子振荡,继而激活nf-κ3信号通路,诱导血清饥饿肾脏细胞的增殖,减轻饥饿导致的细胞凋亡效应。在一项关于溶血性尿毒症综合征的研究中,ouabain能够通过na+/k+-atpase-ip3r-nf-κb信号通路,上调bcl-xl的表达,减轻志贺毒素2触发的肾脏细胞凋亡。然而,强心苷类药物对于肾结石情况下的肾小管上皮细胞的损伤作用至今没有报道,我们在前期的工作中发现了na+/k+-atpase抑制剂ouabain能够在低剂量的情况下减轻com引起的肾小管上皮细胞的损伤,同时缓解由乙醛酸导致的草酸钙在小鼠肾脏中的聚集以及由此造成的肾脏损伤。
技术实现要素:
本发明的目的是提供na+/k+-atpase抑制剂哇巴因在减轻结石性肾病肾小管损伤中的新用途。
本发明所述的哇巴因,其分子式为c29h44o12·8h2o,分子量为728.77,英文名称为ouabain,其化学结构式见图1。
本发明所述的哇巴因用于减轻结石性肾病肾小管损伤,在hk-2细胞实验中,哇巴因的浓度为3nm;在乙醛酸诱导的小鼠结石性肾病模型中,哇巴因的给药方式为腹腔注射,给药剂量为0.1mg/kg。
本发明中哇巴因能减轻草酸钙晶体引起的肾小管损伤,由于结石晶体都能对肾小管造成损伤且机制相似,因此哇巴因对其他结石晶体引起的肾小管损伤也具有相同(或相似)的效应。
本发明人首次采用植物来源的哇巴因,经实验表明,该化合物能有效改善一水草酸钙引起的人近端肾小管上皮细胞hk-2活力的下降,减少一水草酸钙引起的hk-2细胞乳酸脱氢酶释放增多并减轻由此引起的细胞凋亡。同时,哇巴因还能够缓解由乙醛酸导致的小鼠体重下降以及肾功能减退,减少由乙醛酸引起的草酸钙结晶在肾脏中的沉积,并减轻由此导致的小鼠肾脏肾小管损伤以及肾脏细胞的凋亡。目前临床上治疗肾结石主要还是集中在“解除梗阻”上,对于肾结石引起的肾小管上皮细胞损伤关注度较低,然而肾小管上皮细胞损伤是肾结石导致肾功能减退的主要风险因素之一。因此,哇巴因作为一种良好的肾小管上皮细胞功能保护的化合物,在结石治疗方面有很好的开发价值与应用前景。
附图说明
图1:哇巴因的化学结构式。
图2:哇巴因逆转com引起的hk-2细胞活力降低,hk-2细胞用0.3mm的com以及3nm的哇巴因处理24h,cck-8检测细胞的活力(n=3)。***p<0.001,与control组相比;###p<0.001,与3nmouabain组相比;
图3:哇巴因减少由com引起的hk-2细胞中ldh的释放,hk-2细胞用0.3mm的com以及3nm的哇巴因处理24h,检测细胞培养液中的ldh水平(n=3)。***p<0.001,与control组相比;##p<0.01,与0.3mmcom组相比。
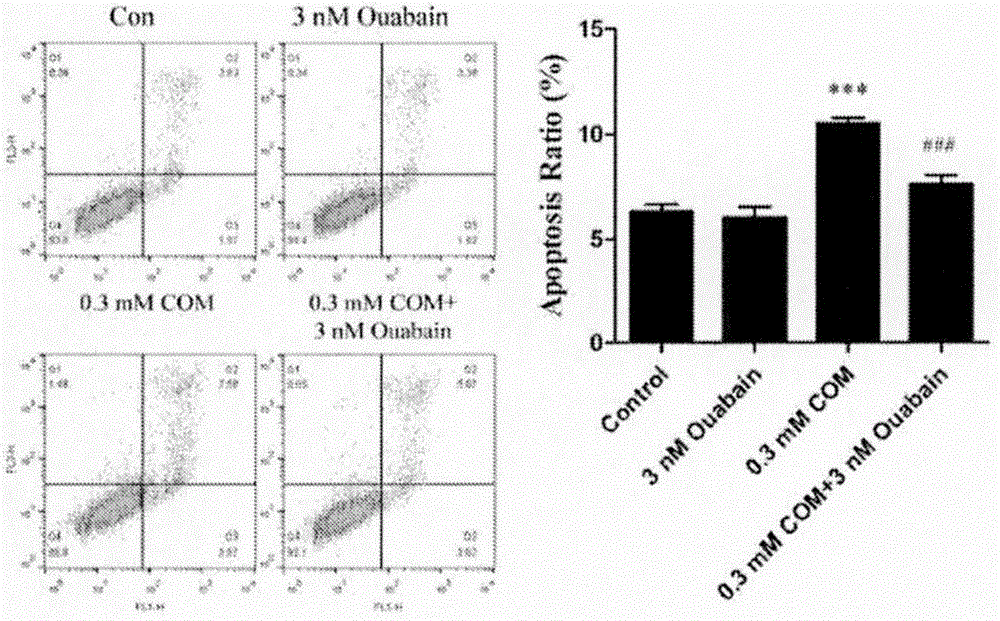
图4:哇巴因逆转由com导致的hk-2细胞凋亡,hk-2细胞用0.3mm的com以及3nm的哇巴因处理24h,流式细胞术(annexinv/pi双染法)检测细胞凋亡率(n=3)。左侧为流式细胞散点图,右侧为凋亡细胞比例统计结果。***p<0.001,与control组相比;###p<0.001,与0.3mmcom组相比。
图5:哇巴因降低由com导致的hk-2细胞中凋亡蛋白的表达,hk-2细胞用0.3mm的com以及3nm的哇巴因处理24h,westernblotting检测细胞中凋亡蛋白papr以及caspase3的剪切水平(n=3)。左侧图为westernblotting条带图,右侧两幅分别为凋亡蛋白parp以及caspase3的剪切水平的统计结果。**p<0.01,与control组相比;#p<0.05,##p<0.01,与0.3mmcom组相比。
图6:小鼠给予乙醛酸连续腹腔注射12d的体重变化,乙醛酸的剂量为50mg/kg/d(n=5-6)。*p<0.05,**p<0.01,***p<0.001,与control组相比。
图7:乙醛酸连续腹腔注射12d后导致小鼠肾脏肥大,小鼠处死后取小鼠双侧肾脏称重,并计算双侧肾重总和与体重的比值(n=5-6)。***p<0.001,与control组相比。
图8:乙醛酸连续腹腔注射12d后小鼠血清中cr与bun的水平(n=5-6)。***p<0.001,与control组相比。
图9:乙醛酸连续腹腔注射12d后引起草酸钙在肾脏中的沉积,小鼠处死后取部分肾脏固定、包埋、切片,vonkossa染色检测肾组织中钙结晶的沉积。图中第一行为40倍视野,第二行为200倍近端肾小管视野,第三行为200倍远端肾小管视野,显黑褐色的为草酸钙结晶。
图10:哇巴因缓解由乙醛酸导致的小鼠体重下降,哇巴因的给药剂量为0.1mg/kg/d(n=7-9)。左侧为各组小鼠的体重变化图,右侧为第12d小鼠体重与第1d小鼠体重的差值。**p<0.01,与glyoxylate组相比。
图11:哇巴因降低乙醛酸导致的小鼠肾脏肥大,小鼠处死后取小鼠双侧肾脏称重,并计算双侧肾重总和与体重的比值(n=7-9)。***p<0.001,与control组相比;##p<0.01,与glyoxylate组相比。
图12:哇巴因改善由乙醛酸导致的小鼠肾功能减退,小鼠处死前取血并分离血清,检测血清中的肌酐与尿素氮以反映肾功能水平(n=7-9)。*p<0.05,***p<0.001,与control组相比;###p<0.001,与glyoxylate组相比。
图13:哇巴因减少乙醛酸引起的草酸钙在肾脏中的沉积,小鼠处死后取部分肾脏固定、包埋、切片,vonkossa染色检测肾组织中钙结晶的沉积(n=3)。左图为肾脏切片镜检图,其中第一行为200倍肾皮质视野,第二行为肾皮-髓质交界处视野,第三行为髓质视野,右图为草酸钙沉积分数统计结果。*p<0.05,***p<0.001,与control组相比;###p<0.001,与glyoxylate组相比。
图14:哇巴因减轻乙醛酸所致肾结石对肾小管的损伤,pas染色检测小鼠肾脏切片中肾小管损伤的比例(n=3)。左图为肾脏切片镜检图,其中第一行为200倍肾皮质视野,第二行为肾皮-髓质交界处视野,第三行为髓质视野,右图为肾小管损伤比例的统计结果。**p<0.01,***p<0.001,与control组相比;#p<0.05,##p<0.01,###p<0.001,与glyoxylate组相比。
图15:哇巴因降低乙醛酸诱导的肾脏中kim-1的基因表达(rt-pcr)(n=4)。上图为kim-1pcr产物的水平电泳图,下图为kim-1相对表达量的统计结果。*p<0.05,***p<0.001,与control组相比;##p<0.01,与glyoxylate组相比。
图16:哇巴因降低乙醛酸所致肾结石对肾脏细胞中凋亡蛋白的表达,westernblotting检测小鼠肾脏细胞中凋亡蛋白parp以及caspase3的剪切水平(n=3)。上图为westernblotting条带图,下侧两张图分别为凋亡蛋白parp以及caspase3的剪切水平的统计结果。**p<0.01,***p<0.001,与control组相比;##p<0.01,###p<0.001,与glyoxylate组相比。
具体实施方案
下面的实施方案可详细地说明本发明,但不以任何形式限制本发明。
实施例一哇巴因减轻一水草酸钙引起的hk-2细胞的损伤
1.1实验材料
人近端肾小管上皮细胞hk-2购自中国科学院典型培养物保藏委员会细胞库(上海细胞库);哇巴因、pi购自美国sigma公司;一水草酸钙com购自生工生物工程(上海)股份有限公司;cck-8检测试剂盒购自碧云天,ldh检测试剂盒购自南京建成生物工程研究所;egfp-annexinv为南京大学医药生物技术国家重点实验室纯化制备;cleaved-parp以及cleaved-caspase3抗体购自cellsignaling公司。
1.2实验方法
1.2.1com对hk-2细胞损伤模型的建立以及哇巴因的给药方法
正常的hk-2细胞为贴壁生长细胞,常规培养于含10%胎牛血清的1640培养基中,5%co2,37℃恒温培养箱中培养。待细胞长至80%融合时,弃培养液,pbs洗涤2次,0.25%胰酶消化。将细胞按一定密度分别接种于96孔板(用于cck-8检测,详细方法见1.2.2)、24孔板(用于ldh以及凋亡检测,详细方法见1.2.3以及1.2.4)以及6孔板(用于凋亡蛋白的检测,详细方法见1.2.5)中。待细胞贴壁生长完全后,在相应孔中加入0.3mm的com或者0.3mm的com+3nm的哇巴因,继续在培养箱中培养24h。以细胞活力、细胞中ldh的释放以及细胞的凋亡来反应com对hk-2细胞的损伤以及哇巴因对损伤的减轻作用。
1.2.2cck-8检测hk-2细胞的活力
正常培养的hk-2细胞以5000个/孔的密度接种于96孔板,待细胞贴壁完全后分别给予com以及哇巴因处理(每种处理至少5个重复)。24h后,每孔中每100μl培养液中加入10μlcck-8溶液,37℃恒温培养箱中孵育1h,酶标仪以450nm的测定波长以及620nm的参比波长测定每孔的吸光度值。该实验至少重复3次,以对照组为基准,计算其他处理组与对照组的比值。
1.2.3检测hk-2细胞中ldh的释放
正常培养的hk-2细胞以105个/孔的密度接种于24孔板,分别给予com以及哇巴因处理。24h后,收集细胞培养液,2500rpm离心10min后取上清,采用ldh测定试剂盒(微量酶标法)测定每种处理组细胞培养上清中的ldh活力,培养液中的ldh活力越高,代表细胞中ldh释放越多,细胞损伤越严重,该实验至少进行3次重复。
1.2.4流式细胞术检测hk-2细胞凋亡
正常培养的hk-2细胞以105个/孔的密度接种于24孔板,分别给予com以及哇巴因处理。24h后,采用0.25%胰酶消化、低速离心(不超过1500rpm)的方式收集细胞,用预冷的pbs洗涤2次后,每管细胞中加入egfp-annexinv(2μl)冰上孵育30min(避光),迅速加入pi(1μg/ml),于流式细胞仪上检测细胞凋亡情况。采用fl1/fl3双通道分别检测egfp-annexinv与pi的着色情况,每个处理组收集10000个细胞,其中annexinv(+)/pi(-)为早期凋亡细胞,annexinv(+)/pi(+)为晚期凋亡细胞。
1.2.5westernblotting检测hk-2细胞中凋亡蛋白的表达
正常培养的hk-2细胞以5×105个/孔的密度接种于6孔板,分别给予com以及哇巴因处理。24h后,弃去培养液,预冷的pbs洗涤3次后加入100μlripa裂解液(含cocktail蛋白酶抑制剂),细胞刮收集细胞于离心管中,冰上裂解30min,4℃,12000rpm离心15min,取上清,考马斯亮蓝法测定上清蛋白浓度。蛋白中加入loadingbuffer后于98℃变性5min,随后使用westernblotting的方法检测每组蛋白样品中凋亡蛋白parp以及caspase3的剪切水平,剪切越明显的代表细胞凋亡数越多。
1.3实验结果
对细胞活力的检测发现,0.3mm的com能明显降低hk-2的细胞活力,大约为control组细胞的60%。单独使用3nm的哇巴因可增强细胞的活力,当存在com的情况下,哇巴因能明显逆转由com导致的细胞活力下降(图2)。细胞培养液中的ldh活力结果显示,0.3mm的com处理细胞可显著增加ldh从细胞内释放至培养液中,其ldh活力与control相比大约增加1倍,单独使用3nm的哇巴因对培养液中的ldh活力影响不大,而与0.3mm的com联合处理细胞后,能很大程度上减少细胞中ldh的释放(图3)。流式细胞术检测细胞凋亡发现,与control组相比,0.3mm的com能明显诱导hk-2细胞凋亡,且晚期凋亡居多,联合运用哇巴因能明显降低凋亡细胞的比率(图4)。对细胞中凋亡蛋白的检测进一步验证了上述结果,0.3mmcom处理的hk-2细胞中,parp以及caspase3的剪切与control组细胞相比明显增加,而哇巴因能不同程度地减少这两种凋亡蛋白的剪切,尤其是caspase3的剪切(图5)。以上结果说明,0.3mm的com作用于hk-2细胞24h能够导致细胞发生明显的损伤与凋亡,该细胞模型能够用于模拟草酸钙结石对于肾小管上皮细胞的损伤。哇巴因在细胞水平上能够部分逆转com对肾小管上皮细胞的损伤,并且该浓度的哇巴因未表现出对正常生长的肾小管上皮细胞有明显的毒性。
实施例二小鼠结石性肾病模型的建立
2.1实验材料
6-8周龄的雄性c57bl/6小鼠来源于南京大学-模式动物研究所;乙醛酸购自东京化成工业株式会社;肌酐(cr)测定试剂盒、尿素氮(bun)测定试剂盒购自南京建成生物工程研究所;vonkossa染色试剂盒购自武汉塞维尔生物科技有限公司。
2.2实验方法
2.2.1小鼠结石性肾病模型的建立
6-8周龄的雄性c57bl/6小鼠适应性喂养数天,随机分为对照组与实验组。实验组小鼠给予50mg/kg/d剂量的乙醛酸连续腹腔注射小鼠12d,对照组小鼠给予等体积的无菌生理盐水腹腔注射同样的时间,期间每天监测小鼠体重变化。给药结束后,采用摘眼球取血,3000rpm离心10min分离血清,用于检测肾功能指标cr与bun水平(详细方法见2.2.2)。取小鼠双侧肾脏,剥离包膜与输尿管等组织后称重,以双侧肾脏重量总和与最终体重的比值反应小鼠肾脏的肥大。取一侧肾脏的1/2于4%多聚甲醛中固定,梯度脱水,石蜡包埋并切片,用于后期病理学形态的检测。
2.2.2小鼠血清cr与bun的检测
本实验采用cr测定试剂盒(肌氨酸氧化酶法)以及bun测定试剂盒(二乙酰肟法)测定小鼠血清中的cr以及bun。
2.2.3vonkossa染色检测小鼠肾脏中草酸钙的沉积
组织切片二甲苯脱蜡,梯度乙醇水化(浓度从高到低),蒸馏水洗1min,切片滴加vonkossa染液于紫外灯光下照射30min,蒸馏水洗1-5min,将切片滴加苏木素染色复染5min,蒸馏水洗1min,1%盐酸酒精分化数秒,蒸馏水洗1min,稀氨水溶液反蓝数秒,蒸馏水洗1min,切片滴加伊红染色3-5min,梯度乙醇脱水(浓度从低到高),二甲苯透明,中性树胶封片。显微镜下钙盐呈褐黑色或深黑色,细胞核呈蓝色,胞浆呈红色。
2.3实验结果
乙醛酸腹腔注射的小鼠体重逐渐下降,在注射后第7天与control组小鼠体重呈现出统计学差异(图6)。且给予乙醛酸连续注射的小鼠肾重/体重比率较control组小鼠明显增加,表明该处理能够导致小鼠肾脏的肥大(图7)。对两组小鼠血清中cr以及bun的检测结果显示,乙醛酸腹腔注射的小鼠血清中此两种指标明显上调,显示出其肾功能已经出现恶化(图8)。同样,乙醛酸腹腔注射可导致草酸钙在小鼠肾脏中聚集,表现为小鼠肾脏切片vonkossa染色镜检结果中,近端以及远端肾小管中有大量褐黑色钙盐沉积(图9)。以上结果显示,采用该造模方法能够导致小鼠肾脏中明显的钙盐沉积,并且肾功能出现一定程度的恶化,能够用于本实验的后续研究。
实施例三哇巴因缓解乙醛酸导致的小鼠体重下降以及肾功能减退
3.1实验材料
哇巴因购自sigma,其他实验材料同实施例2。
3.2实验方法
雄性c57bl/6小鼠随机分为4组,每组7-9只。control组小鼠每天9时以及21时给予等量生理盐水腹腔注射;哇巴因组小鼠每天9时给予0.1mg/kg的哇巴因腹腔注射,21时给予等量生理盐水腹腔注射;草酸盐肾病组小鼠每天9时给予等量生理盐水腹腔注射,21时给予50mg/kg的乙醛酸腹腔注射;哇巴因治疗组小鼠每天9时给予0.1mg/kg的哇巴因腹腔注射,21时给予等量生理盐水腹腔注射,连续饲养12d,期间每天监测各组小鼠体重的变化。
小鼠的处死、肾重/体重比值的计算以及血清cr与bun的检测方法同实施例2。
3.3实验结果
单独给予哇巴因腹腔注射并未表现出小鼠的体重、肾重/体重比值以及血清cr与bun水平有明显影响(图10-12)。同实施例2,乙醛酸连续腹腔注射会导致小鼠体重逐渐下降,出现肾脏肥大,合并血清cr以及bun水平显著上调。而哇巴因与乙醛酸联合处理组的小鼠尽管也出现了体重的下降,但是该组小鼠的体重在乙醛酸注射后7d时出现回升,缓解了由乙醛酸导致的小鼠体重连续下降(图10)。同时,哇巴因也能够逆转乙醛酸引起的小鼠肾重/体重比值增加、血清cr以及bun水平的升高(图11、图12)。
实施例四哇巴因减少由乙醛酸导致的草酸钙结晶在肾脏中的聚集
4.1实验材料
实验材料同实施例2以及实施例3。
4.2实验方法
小鼠的造模、肾脏切片的染色以及哇巴因给药方法同实施例2以及实施例3。
小鼠肾脏切片vonkossa染色的评分标准:所有视野都没有钙盐沉积,记为0;肾脏髓质区域有钙盐沉积,记为1;肾脏皮-髓质交界处有钙盐沉积,记为2;肾脏皮质区域有钙盐沉积,记为3。每张切片统计5个视野,每组至少统计3张切片。
4.3实验结果
对照组以及哇巴因组的小鼠肾脏髓质、皮-髓质交界处以及皮质区域均未见有钙盐的沉积,而乙醛酸组小鼠在以上三个区域具有不同程度的钙盐沉积,显示其结石程度较为严重。哇巴因与乙醛酸联合处理组的小鼠尽管肾脏中也有钙盐沉积,但是结果显示钙盐主要出现在髓质以及皮-髓质交界处,且与乙醛酸组小鼠相比,这些区域的钙盐数量也有很大程度地减少(图13)。
实施例五哇巴因减轻由乙醛酸导致的小鼠肾小管损伤以及肾脏细胞的凋亡
5.1实验材料
哇巴因购自sigma公司;pas染色试剂盒购自武汉塞维尔生物科技有限公司;trizol购自生工生物工程(上海)股份有限公司;逆转录试剂盒购自toyobo;pcr-mix购自上海近岸科技有限公司;cleaved-parp以及cleaved-caspase3抗体购自cellsignaling公司。
5.2实验方法
小鼠的造模以及哇巴因的给药方法同实施例2以及实施例3。
5.2.1pas染色评价小鼠肾小管损伤
组织切片二甲苯脱蜡,梯度乙醇水化(浓度从高到低),蒸馏水洗1min,切片滴加高碘酸溶液染色10min,充分蒸馏水洗,小心擦干切片上的多余水分,滴加雪夫试剂避光染色15-30min,然后流水洗10min,mayer苏木素浅染细胞核1-2min,梯度乙醇脱水(浓度从低到高),二甲苯透明,中性树胶封片。显微镜下糖原呈红色(肾小管的基底膜),胞核呈蓝色。肾小管损伤评分标准:以肾小管出现刷状缘消失,肾小管上皮细胞扁平化,肾小管细胞与基底膜分离以及管型的出现定义为肾小管损伤,计算肾小管损伤所占的百分比。
5.2.2rt-pcr检测小鼠肾脏组织中kim-1的基因表达
5.2.2.1小鼠肾脏总rna提取
实验前所有实验器材均需经过无核酶处理,新鲜或低温保存的肾脏组织按50-100mg组织加入1mltrizol试剂进行匀浆,室温放置3-5min后,按1mltrizol试剂:0.2ml氯仿加入氯仿,用力上下摇晃离心管15s,室温放置2-3min,4℃,12000rpm离心15min,小心吸取上层水样至另一ep管中,避免吸到任何中间层及下层的液体,按1mltrizol试剂:0.5ml异丙醇加入异丙醇,上下轻轻颠倒混匀,冰上放置20min,4℃,12000rpm离心10min(离心后可于离心管底见到月牙形白色沉淀),弃上清,留下管底rna,加入1ml75%乙醇洗涤,4℃,7500rpm离心5min,弃上清,室温干燥,待乙醇挥发后根据rna的量用无核酶水(100-300μl)溶解rna,紫外分光光度计测定rna浓度。
5.2.2.2rna逆转录为cdna
以1μg的rna进行10μl体系的逆转录反应,具体体系参照试剂盒使用说明书。
5.2.2.3rt-pcr反应
取1μlcdna作为模板进行pcr扩增,采用20μl的pcr反应体系,反应条件为94℃预变性3min;94℃30s,56℃30s,72℃30s,扩增28-30个循环,然后72℃延伸10min,4℃o,pcr产物于1%琼脂糖凝胶电泳(含gelred核酸染料),紫外激发下显色并拍照。
kim-1的引物:
上游:5′-acagtggtctgtattgttgtcgagtg-3′;
下游:5′-tgtcacagtgccattccagtctg-3′。
5.2.2.4westernblotting检测小鼠肾脏组织中凋亡蛋白的表达
取100mg肾脏组织加入1mlripa裂解液(含cocktail蛋白酶抑制剂),匀浆后冰上裂解30min,4℃,12000rpm离心15min,取上清,考马斯亮蓝法测定上清蛋白浓度。蛋白中加入loadingbuffer后于98℃变性5min,随后使用westernblotting的方法检测每组蛋白样品中凋亡蛋白parp以及caspase3的剪切水平,剪切越明显的代表肾脏细胞凋亡越严重。
5.3实验结果
小鼠肾脏切片pas染色的镜检结果显示,单独给予哇巴因腹腔注射的小鼠并未出现明显的肾小管损伤。乙醛酸连续腹腔注射会导致小鼠肾小管出现刷状缘消失,上皮细胞扁平化,细胞与基底膜分离等肾小管损伤的现象(如图14中红色箭头所示),哇巴因能够明显减轻乙醛酸导致的肾小管损伤(图14)。kim-1是肾小管损伤分子1,有研究显示其在正常肾脏中几乎不表达,但是在缺血、中毒、蛋白尿等肾脏疾病中表达明显上调,是一种特异性的反应肾小管损伤的蛋白。在本实验中,对照组以及哇巴因单独注射组小鼠的肾脏中kim-1的基因表达较低,乙醛酸能够明显诱导小鼠肾脏中kim-1的表达,表明其能够引起明显的肾小管损伤。与乙醛酸单独注射组小鼠相比,哇巴因与乙醛酸联合处理组的小鼠肾脏中,kim-1的基因表达被明显抑制(图15)。通过对各组小鼠肾脏中凋亡蛋白的检测同样印证了上述结果,乙醛酸处理的小鼠肾脏细胞中凋亡蛋白发生明显的剪切,哇巴因的干预能够部分减轻乙醛酸导致的肾脏细胞凋亡(图16)。综合以上结果,哇巴因对乙醛酸导致的小鼠肾小管损伤以及肾脏细胞凋亡具有明确的保护作用,且其本身对肾脏并未显示出明显的毒性作用。
以上所述仅为本发明的较佳实施例,并非用来限定本发明的实施范围,如果不脱离本发明的精神和范围,对本发明进行修改或者等同替换的,均应涵盖在本发明的权利要求的保护范围当中。
- 还没有人留言评论。精彩留言会获得点赞!