β1,4-半乳糖基转移酶Ⅴ干扰核酸在制备抗胶质瘤血管生成制剂中的应用的制作方法
本发明属于生物医学领域,涉及β1,4-半乳糖基转移酶ⅴ干扰核酸的新的医用用途,具体涉及β1,4-半乳糖基转移酶ⅴ干扰核酸在制备抗胶质瘤血管生成制剂中的应用。
背景技术:
现有技术公开了持续的血管生成能力是恶性肿瘤的重要特性,它为肿瘤细胞的生长提供氧和营养物质。多种抗血管生成的治疗方案已在恶性胶质瘤中得到检验,是治疗脑瘤最有前途的措施之一,但是,实践显示,目前的肿瘤血管抑制剂并不能够完全抑制肿瘤的生长,甚至能够反向刺激肿瘤复发后的血管生成,这就需要对肿瘤的血管生成及调节作进一步详细的研究了解。
研究显示,脑胶质瘤是中枢神经系统最常见的原发性肿瘤,可造成神经系统的功能障碍,甚至威胁患者的生命,研究表明,无论原发性或继发性脑胶质瘤,其持续性生长都必须依赖于新血管的生成。在正常的成人中,除了创伤愈合及生殖周期外,几乎所有的新生血管形成都是病理性的。因此将血管作为靶点,抗肿瘤血管形成疗法成为有效的抗胶质瘤手段。
细胞表面糖复合物中的糖链在肿瘤生长、粘附、迁移、侵袭和转移过程中起着重要的作用,目前多项研究表明,肿瘤细胞的恶性表型与细胞表面的糖链结构改变相关,在恶性肿瘤和转化细胞中n聚糖的外链分支galβ1,4glcnacβ1,6man链高表达,引起完全型n聚糖高度分支结构的形成,这是恶性转化细胞的一个重要特征。
β1,4-半乳糖基转移酶参与细胞糖蛋白n-聚糖的修饰,从udp-半乳糖上添加半乳糖基到glcnacβ1->6man上,形成galβ1->4glcnacβ1->6man链。目前发现β1,4-半乳糖基转移酶共有七个家族成员在肿瘤的发生和个体发育中起重要的作用;β1,4-半乳糖基转移酶ⅴ是1998年克隆的β1,4-半乳糖基转移酶家族的成员之一;cd31又称为血小板-内皮细胞粘附分子,分子量为130kda,可以标记血管内皮细胞,其用来检测微血管密度,能定量反应胶质瘤血管生成情况,用于评估肿瘤血管生成。
基于现有技术的研究现状,本申请的发明人拟提供β1,4-半乳糖基转移酶ⅴ干扰核酸的新的医用用途,具体涉及β1,4-半乳糖基转移酶ⅴ干扰核酸在制备抗胶质瘤血管生成制剂中的应用。
技术实现要素:
本发明的目的在于基于现有技术的研究现状,提供β1,4-半乳糖基转移酶ⅴ干扰核酸的新的医用用途,具体涉及β1,4-半乳糖基转移酶ⅴ干扰核酸在制备抗胶质瘤血管生成制剂中的应用。本发明的抗胶质瘤血管发生的抑制剂,能为研发抗血管形成药物提供了新的靶点,对于胶质瘤的抗血管治疗具有重要提示意义。
本发明进行了β1,4-半乳糖基转移酶ⅴ对肿瘤血管生成的影响实验,选取了人的胶质母细胞瘤标本中分离出的胶质瘤起始细胞;研究显示,下调胶质瘤起始细胞中β1,4-半乳糖基转移酶ⅴ,能抑制胶质瘤起始细胞的成瘤能力,抑制胶质瘤组织中的血管密度;下调胶质瘤起始细胞中β1,4-半乳糖基转移酶ⅴ,能抑制胶质瘤起始细胞向血管内皮细胞的分化。进一步,所述的β1,4-半乳糖基转移酶ⅴ的下调可以用于制备抗胶质瘤血管生成制剂,为抑制胶质瘤血管形成提供新的有效手段,以及可以作为肿瘤病人预后的一个指标。
本发明提供了特异性抑制β1,4-半乳糖基转移酶ⅴ基因表达的shrna,用于抗胶质瘤血管研究,为实现上述目的,本发明将t698968细胞中的β1,4-半乳糖基转移酶ⅴ用慢病毒载体介导稳定下调后发现血管形成能力下降,说明β1,4-半乳糖基转移酶ⅴ干扰核酸可以抑制胶质瘤血管形成。
更具体的,
本发明提供了一种特异性抑制β1,4-半乳糖基转移酶ⅴ基因表达的shrna,所述的sirna正义链与反义链如上文所示,载体为pll3.7lacz质粒。
用于构建β1,4-半乳糖基转移酶ⅴ(β1,4galtⅴ)(human)shrna的引物:
β1,4galtvshrna1-f:
5’-tgatgacgacctctggaacattcaagagatgttccagaggtcgtcatcttttttc-3’
β1,4galtvshrna1-r:
5’-tcgagaaaaaagatgacgacctctggaacatctcttgaatgttccagaggtcgtcatca-3’;
β1,4galtvshrna2-f:
5’-tgacatcacatacgacgccttttcaagagaaaggcgtcgtatgtgatgtttttttc-3’
β1,4galtvshrna2-r:
5’-tcgagaaaaaaacatcacatacgacgcctttctcttgaaaaggcgtcgtatgtgatgtca-3’;
β1,4galtvshrna3-f:
5’-tcggagtgagtggcttaacattcaagagatgttaagccactcactccgttttttc-3’
β1,4galtvshrna3-r:
5’-tcgagaaaaaacggagtgagtggcttaacatctcttgaatgttaagccactcactccga-3’.。
进一步,本发明的β1,4-半乳糖基转移酶ⅴ干扰核酸可以用于制备靶向胶质瘤中β1,4-半乳糖基转移酶ⅴ表达的试剂,或此外,作为胶质瘤病人的治疗辅助手段以及可以作为肿瘤病人预后的一个指标。
本发明提供了包含编码所述shrna的rna干扰试剂盒,所述的试剂盒中包含所述的shrna,应用时,该质粒载体在真核细胞中转录表达所需的sirna,从而达到沉默β1,4-半乳糖基转移酶ⅴ基因的表达。
本发明还提供了所述shrna在制备β1,4-半乳糖基转移酶ⅴ基因表达抑制剂中的应用。
本发明提供的shrna能够特异性、高效地抑制β1,4-半乳糖基转移酶ⅴ基因的mrna和蛋白表达,从而达到抑制胶质瘤血管生成的作用。
本发明为制备抗胶质瘤药物的提供一个新的靶点,并可以作为肿瘤病人预后的一个指标,具有良好的临床应用前景。
附图说明
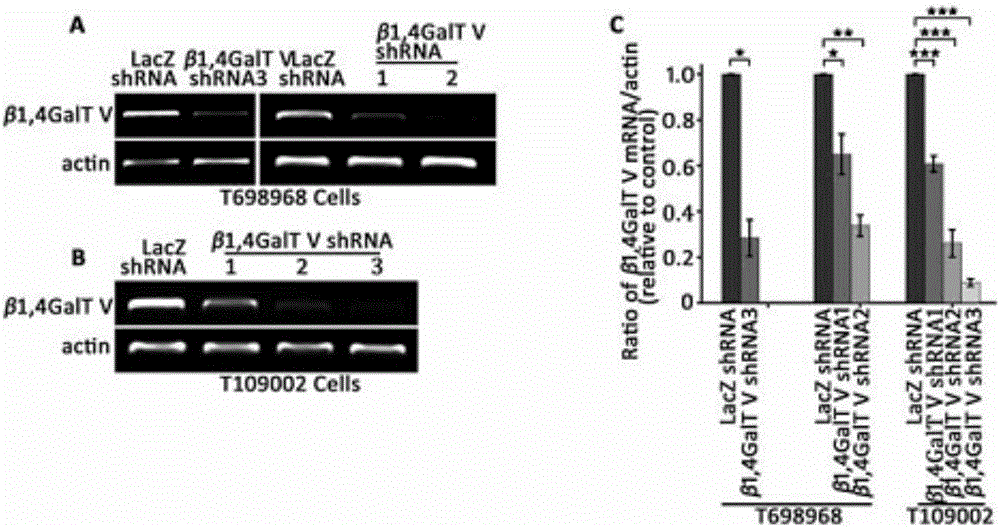
图1为rt-pcr及westernblotting检测对照组(shlacz)和β1,4-半乳糖基转移酶v敲低组(shrna)细胞中β1,4-半乳糖基转移酶mrna及蛋白的表达量,rt-pcr中actin作为内参。
图2为对照组和敲低组的细胞分别进行血管内皮细胞分化,显示β1,4-半乳糖基转移酶v干扰后形成的管腔结构减少(a-c,c为统计图),并且发现β1,4-半乳糖基转移酶v干扰后形成的细胞表达血管内皮细胞标志物cd31减少(d-e,e为统计图)。
图3显示了对照组和敲低组的细胞进行动物体内原位种植,发现β1,4-半乳糖基转移酶v干扰后形成的肿瘤较小、表面血管少(a-b);裸鼠kaplan-meier生存分析图,裸鼠颅内分别被植入含有pll3.7laczshrna对照质粒或β1,4galtⅴshrna干扰质粒的细胞,β1,4-半乳糖基转移酶ⅴ稳定干扰后小鼠存活时间延长(c)。
图4显示gfp标记的对照组和敲低组的细胞进行动物体内原位种植后,对其肿块进行免疫荧光分析,β1,4-半乳糖基转移酶ⅴ干扰后,来自肿瘤细胞的cd31血管内皮细胞减少(a-b,c图为统计图)。
图5为利用rembrandt数据库进行kaplan-meier生存曲线分析结果图,证实β1,4-半乳糖基转移酶ⅴ高表达的病人生存率低于β1,4-半乳糖基转移酶ⅴ低表达的病人。
具体实施方式
本发明提供的具体实施方式作详细说明,但本发明的实施并不仅限于此。
本实施例中未注明的具体条件和实验方法,通常按照《分子克隆实验指南》中所述常规条件,或者参照试剂生产商提供的条件实施。
实施例1:胶质瘤细胞中下调β1,4-半乳糖基转移酶v的表达实验
磷酸钙转染细胞
1)dna溶液的制备:将慢病毒包装系统中所需质粒dna溶于除菌的te中,以紫外光吸收法测定其浓度及纯度;
2)转染前24hr,用胰蛋白酶消化对数生长期的293t细胞,以含10%血清的培养基调整细胞密度为0.5×106个/ml,重新接种于25ml的细胞培养皿,37℃、5%co2,培养箱内培养,待细胞密度达60%-70%时即可用于转染;
3)向一灭菌离心管中加入所制备的各dna溶液,无菌水定容至900μl,再加入100μlcacl2(2.5mol/l)溶液,轻轻混匀;逐滴缓慢加入1000μl2×hepes缓冲盐溶液,轻弹管壁混匀,室温放置20-30min,其间将形成细小沉淀。温育结束时,用小吸尖轻轻吹打一次,重悬混合液;
4)将dna-磷酸钙混合液转移至含单层细胞的培养液中,混匀,于37℃、5%co2细胞培养箱中培养;
5)培养12hr后倒去含有转染混和物的培养基,每个培养皿中的细胞加入10ml的pbs液,轻轻左右晃动一下培养瓶以洗涤残余的转染混和物,然后倒去,重复该步骤3次;
6)每个培养皿中的细胞中加入含10%血清的细胞培养基10ml,于37℃、5%co2培养箱内继续培养48小时。
病毒的收集和浓缩
7)收集转染后72小时的293t细胞上清液;
8)于4℃,1000g离心10min,除去细胞碎片;
9)以0.45μl滤器过滤上清液于40ml100kd超滤离心管中;
10)含病毒的上清液6000rpm、4℃,离心10min;
11)以冰的pbs缓冲液洗,6000rpm、4℃,离心10min,重复3次;
12)以20μl/tube分装病毒,病毒液置于-70℃低温冰箱中保存。
实施例2:westernblotting检测β1,4-半乳糖基转移酶v的表达
1)裂解细胞细胞用1mlpbs冲洗两次。再加入1mlpbs(ph=7.4),用细胞刮刀刮下细胞,收集细胞悬液于eppendorf管中,4℃500g离心5min。尽弃上清,加入60μl细胞裂解液,吹打均匀;
2))sds-page取30-50ug蛋白裂解液,加入等体积的2×sds上样缓冲液,100℃煮沸5min,冰浴5min,于1×电泳缓冲液中进行sds聚丙烯酰胺凝胶电泳约2-3h;
3)转膜将胶剥下,做好上样标记及样品正、反面,浸于转膜缓液中(3.03gtris;14.2g甘氨酸;200ml甲醇;加水至1000ml)15min。剪6张与胶同样大小的3m滤纸,浸于转膜缓冲液中。再剪一张与胶同样大小的pvdf膜,先用甲醇湿润后浸于转膜缓冲液中。在转印仪的阳极和阴极之间,依次放置3张滤纸、膜、胶、3张滤纸,恒流350ma(约100v),转膜90min;
4)染色转膜结束后,将page胶浸于丽春红染液中(450ml甲醇;100ml冰醋酸;0.25g考马斯亮蓝r250;加水至1000ml),观察转膜情况,稍后去离子水洗去残留的丽春红;
5)封闭将转移好的pvdf膜放置于25ml封闭液(50mmnacl,ph8.010mmtris-hcl,0.1%tween-20,5%脱脂牛奶)中,4℃封闭过夜;
6)加抗体弃去封闭液,加入一抗抗体室温或37℃孵育2小时。ttbs(150mmnacl,10mmtris-hclph8.0,0.1%tween-20),15分钟洗3次,加入辣根过氧化物酶标记的二抗,37℃孵育1小时,ttbs,15min洗3次;
7)化学发光ecl化学发光系统检测。压片,冲片。
实施例3:小鼠颅内种植试验
1)gl261细胞80%融合后,消化后加入1mlpbs收集细胞,制成单细胞悬液,(或者是悬浮t698968细胞离心后用pbs吹打重悬,制成单细胞悬液),细胞的终浓度2×104个/ml;
2)将5μl的细胞悬液注射到裸鼠的颅内,细胞聚集在此处;
3)注射后每天观察肿瘤的生长情况及小鼠的状态,记录小鼠的死亡时间;
4)4个星期后,一批做小鼠活体成像,成像后猝死取脑组织;另一批小鼠继续饲养,并记录小鼠的死亡时间。
- 还没有人留言评论。精彩留言会获得点赞!