HER2靶向纳米颗粒、其药物组合物、其制备方法和用途与流程
本申请涉及生物技术领域,具体而言涉及一种HER2靶向纳米颗粒、其药物组合物、其制备方法和用途。
背景技术:
细胞外基质(ECM)在调节细胞行为中起重要作用。异常ECM可能通过产生致瘤性微环境促进细胞转化和癌转移。人类表皮生长因子受体2(HER2)是ECM的组成部分,它属于跨膜受体家族,HER2基因的扩增、HER2蛋白的过表达与许多癌症的发生、发展和转移有关,研究显示在乳腺癌、卵巢癌、肺癌、胃癌、前列腺癌和头颈癌中均存在不同程度的HER2过表达,这六种癌症在100多种不同的已知癌症中占比超过41%。
HER2在癌症发生、发展和转移中的重要作用及其在癌细胞中的高表达,使其成为癌症治疗的一个特异靶点。目前,以HER2为靶点的分子靶向药物主要包括抗HER2单克隆抗体(曲妥珠单抗、帕妥珠单抗)、小分子酪氨酸激酶抑制剂(拉帕替尼)以及药物偶联抗HER2单克隆抗体(曲妥珠单抗-DM1),这三类药物已被FDA批准用于治疗HER2阳性的乳腺癌和胃癌。其中,小分子药物拉帕替尼因其体积小、口服生物利用度高而成为一种治疗乳腺癌的重要药物,但是它也具有一定局限性,如特异性低、毒性较大;与小分子药物相比,单克隆抗体对HER2阳性的乳腺癌和胃癌患者的特异性更高,毒性更小,然而单克隆抗体因其分子量大也具有一定局限性,如组织渗透性差。因此,设计一种特异性强、毒性小、组织渗透性强的药物这一技术问题亟待解决。
技术实现要素:
本申请的主要目的在于提供一种治疗HER2阳性肿瘤的纳米颗粒,以解决现有HER2靶向药物存在的特异性低、毒性大、组织渗透性差的问题。
为了实现上述目的,本申请的第一方面,提供一种HER2靶向纳米颗粒,包括DNA纳米载体和通过小分子交联剂与所述DNA纳米载体相连接的亲和分子,所述亲和分子特异性地靶向HER2高表达癌细胞,所述DNA纳米载体用于运载小分子药物。
进一步的,所述DNA纳米载体包括1~100条单链DNA,所述单链DNA的长度为10~1000个碱基。
进一步的,所述亲和分子为多肽、蛋白质或多糖,所述多肽包括氨基酸序列为SEQ ID NO.1所示的多肽分子。
进一步的,所述小分子交联剂为脂链烃、芳香烃或杂环分子,所述杂环分子包括3-马来酰亚胺基苯甲酸N-羟基琥珀酰亚胺酯。
进一步的,所述HER2靶向纳米颗粒还包括小分子药物,所述小分子药物嵌入到所述DNA纳米载体中。
进一步的,所述小分子药物为表柔比星、伊达比星、放线菌素D、柔红霉素、阿霉素、阿克拉霉素、光辉霉素、伊立替康、拓扑替康和羟基喜树碱中的至少一种。
本申请的第二方面,提供一种药物组合物,包括以上所述的HER2靶向纳米颗粒。
进一步的,所述药物组合物的剂型包括散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂、注射剂、冻干粉针剂。
本申请的第三方面,提供制备以上所述的HER2靶向纳米颗粒的方法,包括下列步骤:
将末端氨基修饰的单链DNA与小分子交联剂反应,得到单链DNA-小分子交联剂中间体;
将单链DNA-小分子交联剂中间体与亲和分子反应,经过纯化、浓缩后得到单链DNA-亲和分子杂合体;
将单链DNA-亲和分子杂合体混合,将反应混合物加热后冷却至室温,各单链DNA-亲和分子杂合体中的单链DNA之间或内部依照碱基配对原则进行结合,得到所述HER2靶向纳米颗粒。
进一步的,所述制备方法还包括以下步骤:
将所述HER2靶向纳米颗粒浓缩后加入小分子药物,进行纯化除去过量的小分子药物,得到具有治疗作用的HER2靶向纳米颗粒。
本申请的第四方面,提供以上所述的HER2靶向纳米颗粒在抑制癌细胞生长、入侵和迁移中的应用。
在本申请实施例中,HER2靶向纳米颗粒采用双链DNA作为小分子抗癌药物的载体,通过小分子交联剂在双链DNA上连接特异性靶向HER2的亲和分子,将小分子抗癌药物靶向运输到HER2高表达的癌细胞,特异性强、毒性小;利用DNA纳米结构作为药物载体,粒径小,容易跨膜运输,组织渗透性强。该HER2靶向纳米颗粒能够抑制癌细胞生长、入侵和迁移,可以用于治疗HER2阳性肿瘤。综上所述,本申请提供的HER2靶向纳米颗粒克服了现有HER2靶向药物存在的局限,解决了特异性低、毒性大、组织渗透性差的技术问题。
附图说明
构成本申请的一部分的附图用来提供对本申请的进一步理解,使得本申请的其它特征、目的和优点变得更明显。本申请的示意性实施例附图及其说明用于解释本申请,并不构成对本申请的不当限定。在附图中:
图1是DNA-ZHER2-EPI纳米颗粒的制备步骤的示意图;
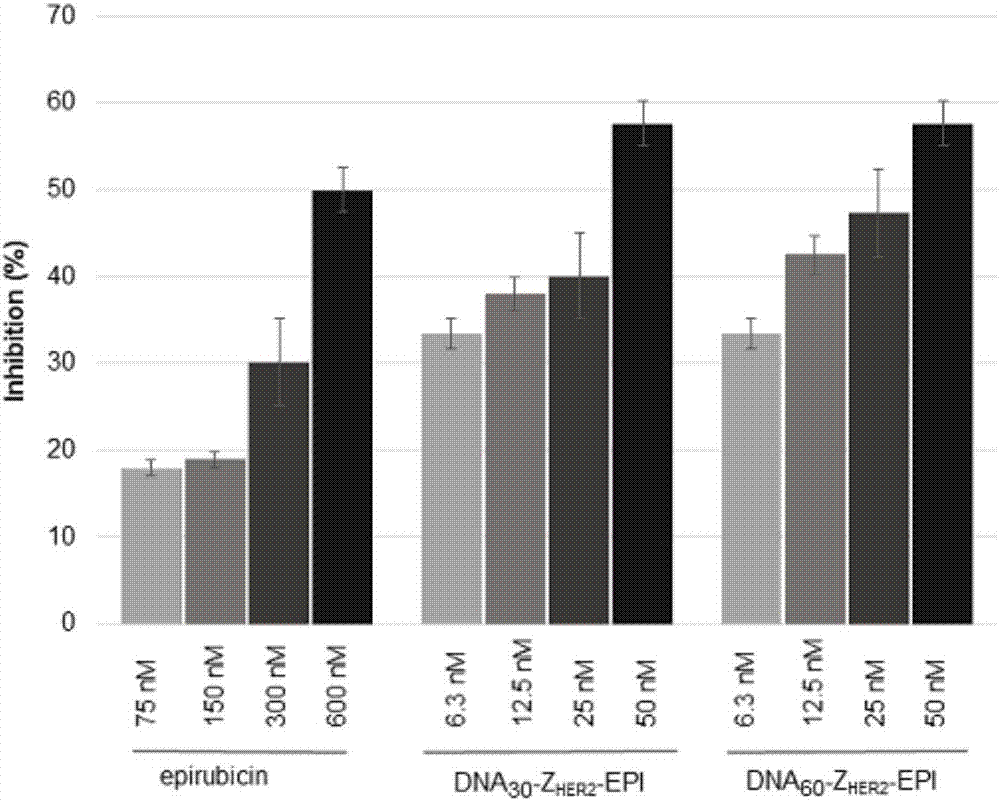
图2是纳米颗粒对癌细胞生长的抑制活性的MTT实验结果;
图3是纳米颗粒对癌细胞入侵的抑制活性的实验结果;以及
图4是纳米颗粒对癌细胞迁移的抑制活性的实验结果。
具体实施方式
为了使本技术领域的人员更好地理解本申请方案,下面将结合本申请实施例中的附图,对本申请实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本申请一部分的实施例,而不是全部的实施例。基于本申请中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本申请保护的范围。
需要说明的是,本申请的说明书和权利要求书及上述附图中的术语“包括”和“具有”以及他们的任何变形,意图在于覆盖不排他的包含,例如,包含了一系列原料或步骤,不必限于清楚地列出的那些原料或步骤,而是可包括没有清楚地列出的或对于这些原料或步骤固有的其它原料或步骤。
此外,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本申请。
本发明的主要目的在于提供一种HER2靶向纳米颗粒,以解决现有HER2靶向药物存在的特异性低、毒性大、组织渗透性差的问题。
本发明所述的HER2靶向纳米颗粒,包括DNA纳米载体和通过小分子交联剂与所述DNA纳米载体相连接的亲和分子,所述亲和分子特异性地靶向HER2高表达癌细胞,所述DNA纳米载体用于运载小分子药物。
以DNA为基础的纳米结构在溶液中依靠碱基配对原则可以高效、精确地完成自组装,而纳米级的尺寸能够有效提高DNA纳米结构的药物利用率。同时,由于自身固有的生物相容性和生物可降解性,DNA纳米结构往往具有长期积聚少、产生免疫反应小、生物毒性低的优点。
本发明所述的HER2靶向纳米颗粒以DNA纳米载体作为药物载体,以DNA纳米结构中的互补DNA链中相邻碱基对之间的凹槽来储存药物。最后该纳米颗粒中的DNA在体内降解为无毒的核苷酸,大大降低该纳米颗粒的生物毒性。
其中,本发明所述DNA纳米载体包括1~100条单链DNA,所述单链DNA的长度为10~1000个碱基。
本发明所述的HER2靶向纳米颗粒还包括通过小分子交联剂与DNA纳米载体相连接的亲和分子,该亲和分子对HER2具有较强的亲和作用,能够特异性地靶向HER2高表达癌细胞。该亲和分子可以为多肽、蛋白质或多糖。
其中,多肽包括含有10~100个氨基酸的肽链,如多肽亲和分子ZHER2、中性粒细胞肽αHNP3;蛋白质包括单克隆抗体,如曲妥珠单抗、帕妥珠单抗;多糖包括灵芝多糖。
本申请的实施例中使用的亲和分子是一种多肽亲和分子ZHER2,ZHER2特异性地靶向HER2的细胞外结构域,虽然它不抑制HER2阳性癌细胞,但它对HER2受体具有非常高的亲和力。该多肽亲和分子的氨基酸序列为SEQ ID NO.1所示。该多肽亲和分子ZHER2可以在大肠杆菌细胞中进行表达,后续使用Ni-NTA柱对其进行纯化。最后,该亲和分子在体内降解为无毒的氨基酸,也大大降低了该纳米颗粒的生物毒性。
本申请的实施例中使用的小分子交联剂包括但不限于脂链烃、芳香烃或杂环分子。
其中脂链烃包括:葡聚糖硫酸钠(DSS)、二(磺基琥珀)辛二酸(BS3);
芳香烃包括:N-Succinimidyl-4-((iodoacetyl)amino)benzoate(SIAB)、N-Sulfosuccinimidyl[4-iodoacetyl]aminobenzoate(Sulfo-SIAB);
杂环分子包括:3-马来酰亚胺基苯甲酸N-羟基琥珀酰亚胺酯(MBS)、马来酰亚胺基乙酸琥珀酰亚胺酯(AMAS)。
本发明所述的HER2靶向纳米颗粒还包括小分子药物,该小分子药物能够嵌入到DNA纳米载体中,运载有小分子药物的HER2靶向纳米颗粒具有治疗作用。
其中,该小分子药物为抗肿瘤药物,如表柔比星、伊达比星、放线菌素D、柔红霉素、阿霉素、阿克拉霉素、光辉霉素、伊立替康、拓扑替康和羟基喜树碱中的至少一种。
本发明所述的HER2靶向纳米颗粒的作用机理是:该HER2靶向纳米颗粒将大量的小分子药物特异性地传送到HER2阳性的肿瘤组织中,在肿瘤组织中小分子药物表柔比星从该纳米颗粒中释放出来,发挥治疗作用。
本申请还提供一种药物组合物,包括以上所述的HER2靶向纳米颗粒。
其中,该药物组合物的剂型包括散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂、注射剂、冻干粉针剂。
作为本申请的一优选实施例,图1示出了一种制备以上所述的具有治疗作用的HER2靶向纳米颗粒的方法,该HER2靶向纳米颗粒以两条互补单链DNA为原料制备得到,包括下列步骤:
(1)将两条末端氨基修饰的互补的单链DNA与小分子交联剂3-马来酰亚胺基苯甲酸N-羟基琥珀酰亚胺酯(MBS)反应,得到两个单链DNA-MBS中间体(产物1);
(2)将两个单链DNA-MBS中间体分别与亲和分子ZHER2反应,经过纯化、浓缩后得到两个单链DNA-ZHER2中间体(产物2);
(3)将两个单链DNA-ZHER2中间体混合,将反应混合物加热后冷却至室温,两个单链DNA-ZHER2中间体中的单链DNA依照碱基互补配对原则进行结合,得到双链DNA-ZHER2纳米颗粒(产物3)。
(4)将双链DNA-ZHER2纳米颗粒浓缩后加入小分子药物表柔比星(EPI),进行纯化除去过量的小分子药物,得到具有治疗作用的DNA-ZHER2-EPI纳米颗粒(产物4)。
经过以上所述的4个步骤,最终制备得到的产物4即为包括一条双链DNA、亲和分子和小分子药物的纳米颗粒。
此外,还可以以一条单链DNA为原料制备所述HER2靶向纳米颗粒,该单链DNA具有相应的碱基序列,自身依照碱基互补配对原则弯折形成DNA纳米载体;还可以以多条单链DNA为原料制备所述HER2靶向纳米颗粒,多条单链DNA依照碱基互补配对原则组装成特定的空间结构,用于容纳和运载小分子药物。
下面以两条互补单链DNA为原料为例,给出以上所述的DNA-ZHER2-EPI纳米颗粒的制备方法的具体实施方式:
实施例1:DNA30-ZHER2-EPI纳米颗粒的制备
(1)单链DNA30-MBS中间体的制备:将末端氨基修饰的两条互补的长度为30个碱基对的单链DNA(200μg,10.3nmol)分别溶解在160μL含有10mM PO43-、137mM NaCl和2.7mM KCl的磷酸缓冲盐溶液(PBS缓冲液)中,并加入40μL 10mM的小分子交联剂3-马来酰亚胺基苯甲酸N-羟基琥珀酰亚胺酯(MBS),将反应混合物在室温下孵育3小时,加入20μL 3M的NaOAc终止反应。
(2)单链DNA30-ZHER2杂合体的制备:向步骤(1)得到的单链DNA30-MBS中间体加入600μL的绝对乙醇,在4℃下温育30分钟,将反应混合物在15000g速度下离心30分钟,用70%乙醇洗涤,将得到的反应混合物溶于50μL 1X PBS缓冲液(含有10mM PO43-,137mM NaCl,and 2.7mM KCl)中,加入亲和分子ZHER2(300μg,38.1nmol),在室温下孵育1-5小时。
将反应混合物在DEAE-Sepharose柱(1×0.7cm)上纯化,该柱用PBS缓冲液(含有0.2~0.9M的NaCl)洗脱。通过8%变性聚丙烯酰胺凝胶电泳(SDS-PAGE)分析纯化的单链DNA30-MBS-ZHER2中间体,凝胶在110V下运行1小时,并用溴化乙锭染色。
通过Ni-NTA色谱柱继续纯化前一步的洗脱液,将洗脱液(900μL)装载在含有100μL的Ni-NTA树脂的柱上,然后将柱用100μL 50mM Tris·HCl(含有300mM NaCl和10mM咪唑,pH8.0)的溶液洗涤5次。最后用100μL 50mM Tris·HCl(含有300mM NaCl和150mM咪唑,pH 8.0)的溶液洗脱三次。通过15%SDS-PAGE分析进一步纯化的单链DNA30-MBS-ZHER2中间体。
使用超微离心过滤器(截留分子量为10kDa)浓缩即获得两个单链DNA30-ZHER2中间体。
(3)双链DNA30-ZHER2纳米颗粒的制备:将步骤(2)中制备的两个单链DNA30-ZHER2中间体(10.0nmol)加入到8mL 10mM Tris·HCl(含有12mM MgCl2,pH8.0)的溶液中。将反应混合物在70℃温育10分钟,然后在30分钟内冷却至室温,制得双链DNA30-ZHER2纳米颗粒。
通过5%聚丙烯酰胺凝胶电泳(PAGE)分析得到的双链DNA30-ZHER2纳米颗粒,凝胶在110V下运行1小时,并用溴化乙锭染色。
(4)DNA30-ZHER2-EPI纳米颗粒的制备:使用超微离心过滤器(截留分子量为50kDa)浓缩步骤(3)中制备的纯化的双链DNA30-ZHER2纳米颗粒。向100μL浓缩的双链DNA30-ZHER2纳米颗粒(5μM)中加入5μL10mM的表柔比星(EPI),并在室温下温育10分钟。
在凝胶色谱柱Sephadex G-25上除去过量的EPI,即获得DNA30-ZHER2-EPI纳米颗粒。
实施例2:DNA60-ZHER2-EPI纳米颗粒的制备
制备方法同实施例1,使用的两条互补单链DNA的长度为60个碱基对。
以上所述的HER2靶向纳米颗粒有诱导HER2阳性癌细胞凋亡和阻止HER2阳性癌细胞转移、入侵的活性。现以BT474乳腺癌细胞(HER2高表达的细胞)为例,通过以下实验例进行验证:
实验例1:纳米颗粒对癌细胞生长的抑制活性的MTT实验
实验方法:在37℃,5%CO2培养箱中培养BT474乳腺癌细胞,使用RPMI-1640培养基(含有10%胎牛血清(FBS)和1%的双抗(抗生素-抗真菌)溶液)。收获指数生长的BT474细胞,将其铺在96孔板中,浓度为2×104个细胞/孔。在37℃下孵育24小时后,用相应的含有相同浓度表柔比星的表柔比星(75nM,150nM,300nM,600nM)、DNA30-ZHER2-EPI纳米颗粒(6.3nM,12.5nM,25nM,50nM)和DNA60-ZHER2-EPI纳米颗粒(6.3nM,12.5nM,25nM,50nM)处理细胞72小时。然后向每个孔中加入20μL的MTT(5mg/ml),将培养板在37℃下孵育4小时。弃去上清液,向各孔中加入100μL的二甲基亚砜(DMSO),15分钟后在490nm记录吸光度值。同时设置对照组(培养基中只有BT474细胞,不加入实验药物)和凋零组(培养基中不加入BT474细胞,不加入实验药物),通过下式获得癌细胞生长抑制率:癌细胞生长抑制率(%)=(OD对照组-OD实验组)×100%/(OD对照组-OD凋零组)。每个浓度下的实验均进行三次,数据报告为三次独立实验的平均值。
实验结果:如图2所示,具有相同浓度表柔比星的三组实验中,DNA30-ZHER2-EPI纳米颗粒和DNA60-ZHER2-EPI纳米颗粒对BT474细胞具有相似的抑制作用,并且对BT474细胞生长的抑制率在温育72小时后均大于单独的表柔比星。特别是在较低浓度时,纳米颗粒(12.5nM)对BT474细胞的抑制率比单独的表柔比星(150nM)高将近2倍。根据图2所示的MTT实验结果,验证了制备得到的载药纳米颗粒相对于单独的药物对乳腺癌细胞BT474的生长具有良好的抑制活性。
实验例2:纳米颗粒对癌细胞入侵的抑制活性的实验
实验方法:入侵测定在24孔Transwell培养板中进行,该培养板的Transwell小室底部为含有直径8μm微孔的聚碳酸酯滤膜。首先,在5%CO2,37℃条件下,使用RPMI-1640培养基(无血清)将聚碳酸酯滤膜处理2小时,随后用100μLMatrigel基质胶包被Transwell小室底部的聚碳酸酯滤膜的上室面。然后,将1×105个BT474细胞(无血清)加入到培养板的上室。同时将700μL RPMI-1640培养基(含有10%胎牛血清(FBS)和1%的双抗(抗生素-抗真菌)溶液)加入到下室中。将每个细胞组铺在三个重复的孔中,每个孔中加入20μL500nM(含600nM表柔比星)的DNA30-ZHER2-EPI纳米颗粒、20μL 500nM的DNA60-ZHER2-EPI纳米颗粒或600nM的表柔比星。孵育18小时后,移除培养液,用1X PBS缓冲液洗涤三次。用棉签去除非侵入性细胞。已经迁移通过滤膜并粘附在膜的下表面的细胞用甲醇固定并用苏木精-伊红染色。最后,在光学显微镜下,在至少10个随机视野中计数下室中的细胞。
实验结果:如图3所示,表柔比星在600nM浓度下对BT474癌细胞的入侵抑制率20%;而DNA30-ZHER2-EPI纳米颗粒在50nM浓度下对BT474癌细胞入侵的抑制率高达90%;DNA60-ZHER2-EPI纳米颗粒与DNA30-ZHER2-EPI纳米颗粒相比,对BT474癌细胞入侵的抑制率较低,抑制率为69%。
实验例3:纳米颗粒对癌细胞迁移的抑制活性的实验
迁移测定实验方法与实验例2中的入侵测定类似,不同之处在于没有使用Matrigel基质胶包被Transwell小室底部的聚碳酸酯滤膜的上室面。
实验结果:如图4所示,表柔比星在600nM浓度下对BT474癌细胞迁移的抑制率约为40%;而DNA30-ZHER2-EPI纳米颗粒在50nM浓度下对BT474癌细胞迁移的抑制率约为60%;DNA60-ZHER2-EPI纳米颗粒与DNA30-ZHER2-EPI纳米颗粒相比,对BT474癌细胞迁移的抑制率较低,抑制率为44%。
从实验例1至3的实验结果中可以看出,实施例1和2中制得的DNA-ZHER2-EPI纳米颗粒具有抑制癌细胞生长、阻止癌细胞入侵和迁移的作用。
其中所述癌细胞为HER2高表达癌细胞,包括乳腺癌、卵巢癌、肺癌、胃癌、前列腺癌和头颈癌的癌细胞。
需要说明的是,虽然本发明实施例中所展示的HER2靶向纳米颗粒及其制备方法中,DNA纳米载体选择为一条双链DNA,但其仅仅作为一个例子,是一种基本的实现方式,不应理解为对本发明保护范围的限制,本发明中的DNA纳米载体还包括实施例之外的各种变性。例如DNA纳米载体中的单链DNA可以为一条,也可为多条,经过试验证明,DNA纳米载体选择为1~100条的单链DNA所合成的纳米颗粒均具有抑制癌细胞生长、阻止癌细胞入侵和迁移的作用;再如,DNA纳米载体中的DNA链的形状并不局限为线型结构,还可以为Y型,Y型DNA可以是双链DNA的末端为开链,形成Y型结构,也可以为末端分别与另外两条DNA互补后形成Y型结构;再如,每个DNA的长度也不应局限于本发明实施例所展示的30个碱基和60个碱基,实验证明,DNA链的长度为10~1000个碱基为优选的方案。总之,本发明DNA纳米载体中的单链DNA可以有多种组合方式,本领域技术人员在本发明提供的具体实施例的合成方法的精神原则指导下,可以根据DNA碱基互补配对的原理实现多种组合结构,用于实现本发明的目的。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化,但是本领域技术人员在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!