一种Legumain响应分步释放阿霉素/姜黄素缓释的纳米制剂的制备方法及应用与流程
本发明涉及纳米药物技术领域,具体涉及一种legumain响应分步释放阿霉素/姜黄素缓释的纳米制剂的制备方法及应用。
背景技术:
产生副作用和肿瘤组织产生多耐药性是化学药物治疗失败的两大因素。阿霉素是一种常用的光谱抗肿瘤化学药物,然而,阿霉素作为一种强细胞毒性药物,对正常组织(如心脏、肝、肾以及肿瘤周围正常组织等)带来不可逆转的伤害。如何实现药物靶向肿瘤组织,减少对正常组织的次生伤害,是恶性肿瘤药物治疗中的一大难点。由于恶性肿瘤组织具有“渗透和滞留增强效应”,纳米尺度下的药物-载体体系能够透过肿瘤组织的新生血管壁而不能透过正常组织的血管壁,达到“被动靶向”肿瘤组织效果,增强药物在肿瘤组织的聚集,从而减少对正常组织的伤害。然而,大量的研究表明这种仅仅依靠“被动靶向”效应,在实践中往往很难达到实际需要的靶向效率。利用肿瘤组织自身及其微环境的生物学特性(如低ph值,高还原势,过表达叶酸受体等),制备环境因子响应型纳米药物载体,达到对肿瘤组织“主动”和“被动”双重或多重靶向效应,能够极大提高药物在肿瘤组织中的聚集,从而提高药物治疗的效果。legumain是哺乳动物中唯一的特异性水解天冬酰胺残基的酶,研究表明legumain在许多恶性肿瘤及肿瘤相关细胞中高表达,可作为恶性肿瘤药物靶向设计的新靶点。以往利用肿瘤组织高表达legumain蛋白酶特性的药物缓释体系包括将药物与legumain底物肽段直接相连,并在肽段另一端连接细胞膜不透性因子,从而使药物只能legumain高活性的肿瘤组织中才能透过细胞。但这种设计的产物仍然是小分子药物,不具有纳米尺度下药物-载体体系的被动靶向效应,也不具有缓释效果。
同时,药物处理后,产生耐药性,进一步降低药物的疗效。多数研究认为,高表达耐药蛋白(一种将药物排出细胞的跨膜蛋白)是肿瘤产生耐药性的主要原因之一。研究表明,姜黄素具有抑制耐药蛋白的作用。共包载姜黄素和抗癌药物可以显著增强药物的抗癌活性。但是,目前所用的共包载体系同时释放抗癌药物和耐药蛋白抑制剂(如姜黄素),这样会导致抗癌药物与耐药蛋白抑制剂竞争耐药蛋白的活性位点,从而导致部分药物外排。
技术实现要素:
针对现有技术的缺点,本发明提供了一种legumain响应分步释放阿霉素/姜黄素缓释的纳米制剂的制备方法及应用。
本发明采用的技术解决方案是:一种legumain响应分步释放阿霉素/姜黄素缓释的纳米制剂的制备方法,包括以下步骤:
(1)阿霉素的多肽衍生物合成:
a、称取阿霉素盐酸溶液(dox·hcl)1mmol和磷酸烯醇式丙酮酸(pep)溶于50ml的dmf,加入n,n-二异丙基乙胺(dipea)2mmol,磁力搅拌,加入hatu溶液,室温避光搅拌,然后将反应置于-20℃条件下使反应停止,透析袋内透析,产物冷冻干燥,得到dox-pep-nh-fmoc产物;
b、将a步骤中得到的产物加二氯甲烷溶解,加入20%哌啶室温搅拌5min,迅速置于冷却液中,加丁二酸酐,待颜色变化后放置于室温反应10min,40℃旋干,加乙醚,10000r/min离心10min,去除dox-pep-nh-fmoc产物的fmoc保护基团,调节ph值至6.95,并用透析袋内透析去除小分子副产物,冷冻干燥,制备得到dox-pep-conh-ch2-ch2-cooh;
(2)壳聚糖(cs)阿霉素多肽衍生物纳米粒子制备:
a、称取dox-pep-conh-ch2-ch2-cooh溶于dmf中,超声5min,加入edc和dmap,震荡混匀,超声10min,将混合溶液在磁力搅拌下逐渐滴加到含cs的mes溶液中,常温过夜反应,用透析袋透析,干燥称量得到dox-pep-cs;
b、取dox-pep-cs溶于1%醋酸中,超声,加入环己烷,正辛醇和tritonx100混合,用高速匀质机操作5min,静置,加入京尼平溶液,继续超声10min,反应24h。将交联后加入丙酮,混匀,离心机离心10min,去上清,重复此操作3遍,收集沉淀,加入三氟乙酸、二氯甲烷、三异丙基硅烷反应1h去除三苯甲基氨基保护基团,旋蒸去除二氯甲烷,三氟乙酸,后加水复溶,将产物装入透析袋,超纯水透析;
(3)共包载姜黄素:姜黄素用dmso溶解,缓慢滴加至cs-pep-dox纳米粒子溶液中,透析去除未包载药物和dmso,即得本发明所述的legumain响应分步释放阿霉素/姜黄素缓释的纳米制剂。
所述的步骤a、b中透析袋内透析的透析袋内透析为comw=100-500。
所述的步骤a、b中透析袋内透析的透析袋内透析为comw=14000。
所述的步骤b中加入的京尼平溶液的量为0.05-0.3mmol。
所述的步骤b中离心机离心转速为10000r/min。
所述的步骤b中加入的三氟乙酸为20ml、二氯甲烷为20ml、三异丙基硅烷为800ul。
一种制备的legumain响应分步释放阿霉素/姜黄素缓释的纳米制剂在作为制备逆转肿瘤多耐药性药物的应用。
本发明的有益效果是:本发明提供了一种legumain响应分步释放阿霉素/姜黄素缓释的纳米制剂的制备方法及应用,用肿瘤组织高表达legumain的生物学特性,制备legumain响应的纳米凝胶,从而实现对肿瘤组织的双重靶向效应(主动靶向和被动靶向),减少阿霉素对正常组织的次生伤害,本发明制备的纳米制剂能使药物和抑制剂先后释放功能,进入细胞后,抑制剂先从载体中释放,占据耐药蛋白活性位点,再使药物释放,这样就能最大程度减少药物外排,逆转多耐药性。
附图说明
图1为本发明技术路线图。
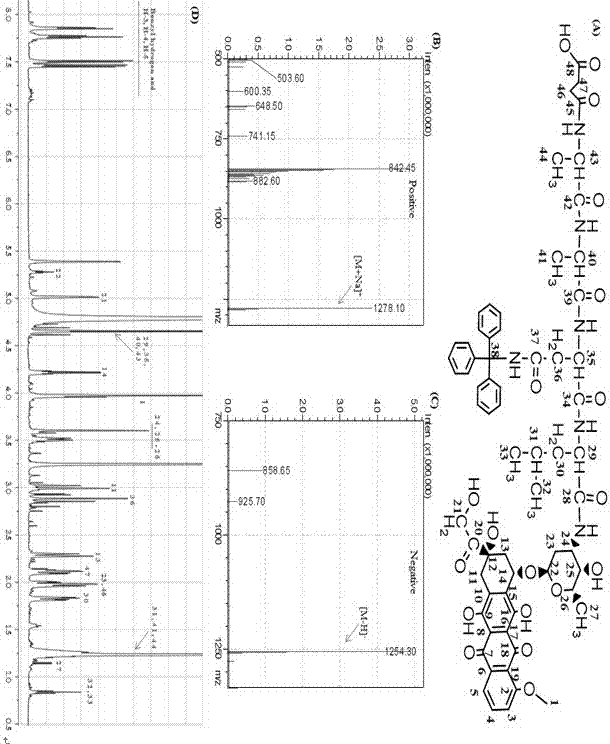
图2为本发明中间产物dox-pep-conh-ch2-ch2-cooh的质谱及核磁共振图谱。
图3为本发明产物cs-pep-dox化学结构式及红外图谱。
图4为本发明制备的纳米制剂药物释放效果图。
图5为本发明不同交联体系与不同京尼平浓度交联后纳米粒子示意图。
图6为本发明壳聚糖-阿霉素/姜黄素共包载缓释纳米粒子形貌电镜图。
图7为本发明制备的纳米粒子粒径与电位图。
图8为本发明制备的纳米制剂共包载体系抑制多耐药性肿瘤细胞效果。
具体实施方式
以下通过具体实施例并结合附图对本发明做进一步说明,但本发明并不限于以下实施例。
根据图1技术路线图,可将制备过程详细分为以下四个部分:
legumain底物多肽的设计合成
根据legumain的结构和催化特性,设计合成底物肽段,设计原则是:以天冬酰胺为中心,两侧连接若干中性氨基酸。
阿霉素的多肽衍生物合成
(1)称取dox·hcl(579mg即1mmol)和fmoc-a-a-n(trt)-l-oh(即pep)(923mg即1mmol)溶于dmf(50ml)中,加入dipea(0.36ml即2mmol)后,磁力搅拌15min(室温,避光),加入hatu溶液(0.42ghatu,即1.2mmol,溶于2mldmf中)。搅拌4h(室温避光)。然后将反应置于-20℃冰箱中使反应停止。置于comw=100-500的透析袋内透析。冷冻干燥,得到dox-pep-nh-fmoc产物。
(2)dox-pep-nh-fmoc加二氯甲烷溶解,加20%哌啶,室温搅拌5min左右,迅速置于冷却液中,加丁二酸酐,带颜色变化后放置于室温反应10min,40℃旋干,加乙醚,10000r/min离心10min。用naoh将ph调至6.95,并用comw=100-500的透析袋内透析去除小分子副产物,冷冻干燥。并用制备液相制备得到dox-pep-conh-ch2-ch2-cooh。
壳聚糖(cs)阿霉素多肽衍生物纳米粒子制备
(1)称取dox-pep-conh-ch2-ch2-cooh溶于dmf中,超声5min,加入edc和dmap,震荡混匀,超声10min。将混合溶液在磁力搅拌下逐渐滴加到含cs的mes溶液中,常温过夜反应,用comw=14000的透析袋,干燥称量得到cs-pep-dox。
(2)取dox-pep-cs溶于1%醋酸中,超声,加入环己烷,正辛醇和tritonx100混合,用高速匀质机操作5min,静置。加入京尼平(0.05,0.1,0.2,0.3mmol)溶液,继续超声10min,反应24h。将交联后加入丙酮,混匀,离心机离心10000r/min,离心10min,去上清,重复此操作3遍,收集沉淀。加入20ml三氟乙酸、20ml二氯甲烷、800ul三异丙基硅烷反应1h去除三苯甲基氨基保护基团。旋蒸去除二氯甲烷,三氟乙酸,后加水复溶,将产物装入透析袋(comw=14000),超纯水透析。
(3)共包载姜黄素:姜黄素用dmso溶解,缓慢滴加至cs-pep-dox纳米粒子溶液中,透析去除未包载药物和dmso。
细胞毒性检测
用cck-8试剂盒法对比分析legumain响应chi-pep-dox纳米粒子与游离阿霉素对肿瘤细胞和正常体细胞的抑制效果,结果如图8所示。
以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!