一种核酸和疏水性化学药物双载荷自组装纳米制剂及其制备方法与流程
本发明属于生物材料技术领域,具体涉及一种核酸和疏水性化学药物双载荷自组装纳米制剂及其制备方法。
背景技术:
当前我国的肿瘤发病率正在逐年上升,恶性肿瘤正威胁着人类的生命健康。恶性肿瘤的治疗主要包括手术切除、化学治疗、放射治疗、生物免疫疗法等。
其中化学治疗是利用化学药物阻止癌细胞的增殖、浸润、转移,直至最终杀灭癌细胞的一种治疗方式。由于化学药物在杀死肿瘤细胞的同时,也杀死正常细胞包括免疫细胞。由于化疗药物对细胞的选择性差,毒副作用较大,临床使用的抗肿瘤化学治疗药物均有不同程度的毒副作用;长期使用化疗药物也容易产生耐药性,因此化疗药物的广泛应用受到一定的限制。加之许多具有抗肿瘤活性的药物如阿霉素,紫杉醇等都是水难溶性药物,需要开发相应的制剂才能用于临床抗治疗治疗研究和应用,并实现低毒高效的目的。
基因治疗是一种通过将外源基因导入细胞,以纠正或补偿缺陷基因造成的疾病以达到治疗目的的治疗方法,随着肿瘤相关基因的发现及相关信号通路的阐明,为肿瘤的基因药物干预和治打下了基础。由于针对肿瘤的治疗基因的选择是建立在人们对肿瘤发生发展机理的认识基础上的,所以能够从分子层次干预肿瘤的生长和扩散、靶点明确、作用效果好、副作用小,因此对肿瘤的治疗效果比较明确,成为是一种新兴的,有潜力的肿瘤治疗模式。
基因治疗的关键是基因运输载体的设计。基因运输载体大致可分为两大类:病毒类和非病毒类。考虑到病毒载体的安全性问题和大量获得重组病毒载体相对困难等因素,非病毒载体的一些优点,如低毒低免疫原性、结构灵活可控、携带基因大小不限、合成简便且成本低等,使其有望成为基因治疗的理想载体。近年来,许多可用于基因载荷和输送的高分子载体相继问世,包括合成高分子载体如聚酰胺树状分子、聚乙烯亚胺、聚甲基丙烯酸酯;天然高分子载体如糖类高分子(β-环糊精、壳聚糖、葡聚糖)、多聚赖氨酸等。
化学药物和基因药物在肿瘤治疗中具有不同的作用机理和靶点,因此,联合使用化学药物和基因药物可以产生协同作用,提高肿瘤的治疗效果。或者,利用基因药物抑制肿瘤细胞耐药基因的表达,有助于解决化学药物用药的耐药问题。基于化学药物和基因药物联合作用的优势,已在肿瘤治疗中显示了巨大的潜力,而同时输送化学药物和基因药物也成为研究开发的热点。
技术实现要素:
为了克服现有技术中所存在的问题,本发明的目的在于提供一种核酸和疏水性化学药物双载荷自组装纳米制剂及其制备与应用。
为了实现上述目的以及其他相关目的,本发明采用如下技术方案:
本发明的第一方面,提供一种核酸和疏水性化学药物双载荷自组装纳米制剂,包括组分:金刚烷封端的聚乙二醇、金刚烷修饰的聚酰胺-胺、聚乙烯亚胺修饰的β-环糊精、核酸和化学药物。
优选地,所述金刚烷封端的聚乙二醇中,金刚烷可通过酰胺键连接到聚乙二醇的端部。
优选地,未封端前的聚乙二醇的分子量可以是2000~5000。
优选地,所述金刚烷修饰的聚酰胺-胺可以是连接有金刚烷的聚酰胺-胺。
优选地,金刚烷可通过异氰酸酯基团连接到聚酰胺-胺的胺基上。
优选地,每个聚酰胺-胺上可以连接有一个及一个以上金刚烷。
优选地,所述聚酰胺-胺可以是3-5代的聚酰胺-胺。
优选地,所述聚乙烯亚胺修饰的β-环糊精可以是接枝有聚乙烯亚胺的β-环糊精。
优选地,接枝前的聚乙烯亚胺的分子量范围可以是800~25,000。
优选地,所述接枝有聚乙烯亚胺的β-环糊精的中,每个β-环糊精分子中接枝有一个及一个以上聚乙烯亚胺长链。进一步地,每个β-环糊精分子中接枝有2~3个聚乙烯亚胺长链。
优选地,所述核酸和化学药物双载荷自组装纳米制剂中,所述金刚烷封端的聚乙二醇、金刚烷修饰的聚酰胺-胺和聚乙烯亚胺修饰的β-环糊精之间的摩尔比例范围是:(1~20):(1~3):(1~60)。
优选地,所述化学药物为疏水性化学药物。所述疏水性化学药物包载于自组装纳米制剂中,进一步包载于金刚烷修饰的聚酰胺-胺中。金刚烷修饰的聚酰胺-胺对所述疏水性化学药物的包封率是(1~100%)。
所述核酸通过电荷作用被包裹在自组装纳米制剂内部。所述核酸分子可以是基因药物。所述自组装纳米制剂中聚乙烯亚胺修饰的β-环糊精与所述核酸之间的氮磷比例范围是(2~30):1。
所述核酸包括但不限于反义核酸、核酶、适配体、干扰RNA、sgRNA等各种核酸药物及其质粒DNA或mRNA等表达载体,表达各种生物活性分子的质粒DNA或mRNA。
本发明的第二方面,提供了前述自组装纳米制剂的制备方法,包括:先将化学药物包载于金刚烷修饰的聚酰胺-胺中,获得包载了化学药物的金刚烷修饰的聚酰胺-胺;然后按照比例再与其他各组分混合,自组装获得核酸和化学药物双载荷自组装纳米制剂。
优选地,包载了化学药物的金刚烷修饰的聚酰胺-胺可通过包括如下步骤的方法获得:通过溶剂挥发法,利用金刚烷修饰的聚酰胺-胺内部的疏水性空腔物理装载疏水性化学药物。
优选地,金刚烷封端的聚乙二醇可通过包括如下步骤的方法获得:将金刚烷通过酰胺反应连接到聚乙二醇的端部。
优选地,可将金刚烷上的氨基与聚乙二醇上的羧基进行酰胺反应,获得金刚烷封端的聚乙二醇。
优选地,金刚烷修饰的聚酰胺-胺可通过包括如下步骤的方法获得:将1-金刚烷异氰酸酯与聚酰胺-胺反应,金刚烷可通过异氰酸酯基团连接到聚酰胺-胺的胺基上。
优选地,聚乙烯亚胺修饰的β-环糊精可通过包括如下步骤的方法获得:将β环糊精与活化剂反应获得活化后的β-环糊精,加入聚乙烯亚胺,获得聚乙烯亚胺修饰的β-环糊精。
本发明的第三方面提供了一种由前述制备方法获得的自组装纳米制剂。
本发明的第四方面提供了前述自组装纳米制剂在制备肿瘤药物输送载体中的用途。
本发明的核酸和化学药物双载荷自组装纳米制剂可用于同时输送具有肿瘤治疗作用的核酸和具有肿瘤治疗药物的化学药物,用于肿瘤的治疗。
与现有技术相比,本发明具有如下有益效果:
本发明的核酸和化学药物双载荷自组装纳米制剂包括金刚烷封端的聚乙二醇、金刚烷修饰的聚酰胺-胺、聚乙烯亚胺修饰的β-环糊精、核酸和化学药物四种分子模块,利用金刚烷修饰的3-5代聚酰胺-胺的疏水空腔装载疏水性化学药物,并通过模块分子间的电荷作用和分子识别作用实现核酸分子的载荷、双载荷自组装纳米制剂的可控制备和长循环特性,从而用于核酸分子和疏水性化学药物的共同载荷、递送和联合作用。
附图说明
图1A:实施例1中金刚烷封端的聚乙二醇(Ad-mPEG)的合成方程式。
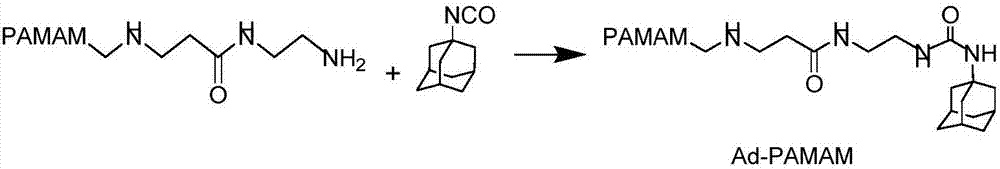
图1B:实施例2中金刚烷修饰的聚酰胺-胺(Ad-PAMAM,G5)的合成方程式。
图1C:实施例3中β-环糊精-聚乙烯亚胺(CD-PEI800)的合成方程式。
图2:实施例1中金刚烷封端的聚乙二醇(Ad-mPEG)在DMSO-d6中核磁共振氢谱表征图。
图3:实施例2中金刚烷修饰的聚酰胺-胺(Ad-PAMAM,G5)在DMSO-d6中核磁共振氢谱表征图。
图4:实施例3中聚乙烯亚胺修饰的β-环糊精(CD-PEI800)在D2O中核磁共振氢谱表征图。
图5:实施例4中核酸和疏水性化学药物双载荷自组装纳米制剂的粒径结果图。
图6:实施例4中核酸和疏水性化学药物双载荷自组装纳米制剂的生物透射电镜表征图。
图7:实施例4中核酸和疏水性化学药物双载荷自组装纳米制剂对核酸药物的包载能力结果图。
图8:实施例4中核酸和疏水性化学药物双载荷自组装纳米制剂在生理盐水中的稳定性结果图。
图9:实施例4中核酸和疏水性化学药物双载荷自组装纳米制剂载荷质粒DNA和阿霉素的A549细胞递送实验荧光成像结果图。
具体实施方式
本发明针对肿瘤联合治疗中同时输送化学药物和核酸药物的需要,构建一种同时载荷核酸药物与化学药物的自组装纳米运输载体,实现基因药物靶向治疗缺陷基因,同时又通过化疗药物对肿瘤细胞的杀伤作用,协同发挥肿瘤治疗的作用。
核酸和化学药物双载荷自组装纳米制剂
本发明的核酸和疏水性化学药物双载荷自组装纳米制剂,包括组分:金刚烷封端的聚乙二醇、金刚烷修饰的聚酰胺-胺、聚乙烯亚胺修饰的β-环糊精、核酸和化学药物。
所述自组装纳米制剂由自组装分子模块与疏水性化学药物通过疏水相互作用、电荷作用和分子识别作用自组装而成。
所述金刚烷封端的聚乙二醇是指采用金刚烷进行了封端的聚乙二醇。采用金刚烷对聚乙二醇进行封端属于本领域技术人员公知的技术。例如,所述金刚烷封端的聚乙二醇中,金刚烷可通过酰胺键连接到聚乙二醇的端部。每聚乙二醇上可以连接有一个及一个以上金刚烷。在一实施方式中,列举了每个聚乙二醇的端部都连接有一个金刚烷,但并不限于此。
未封端前的聚乙二醇的分子量可以是2000~5000。在一实施方式中,列举了所述聚乙二醇的分子量为5000,但是并不仅限于此。
所述金刚烷封端的聚乙二醇的结构示意图可参见图1A。
所述金刚烷修饰的聚酰胺-胺可以是连接有金刚烷的聚酰胺-胺。
将金刚烷连接到聚酰胺-胺上属于本领域技术人员所公知的技术。例如,金刚烷可通过异氰酸酯基团连接到聚酰胺-胺的胺基上。
所述聚酰胺-胺可以是3代、4代或5代的聚酰胺-胺。所述聚酰胺-胺的分子量可以是6909~28826。本发明实施例列举了聚酰胺-胺可以是带有1,2-二氨基乙烷芯核和胺末端的第五代聚酰胺树枝状聚合物。所述聚酰胺-胺可购于Dendritic Nanotechnologies,Inc(Mount pleasant,MI)。
所述金刚烷修饰的聚酰胺-胺的结构通式如下所示:
n:3,4或5;
n=3时:N为32,m为1到32;n=4时:N为64,m为1到64;n=5时:N为128,m为1到128。
每个聚酰胺-胺上可以连接有一个及一个以上金刚烷。例如,每个聚酰胺-胺上可以连接有1~128个金刚烷。本发明一实施方式中,列举了连接有6个金刚烷分子的聚酰胺-胺,但是并不仅限于此。
所述金刚烷修饰的聚酰胺-胺的结构示意图可参见图1B。
所述聚乙烯亚胺修饰的β-环糊精可以是接枝有聚乙烯亚胺的β-环糊精。
将聚乙烯亚胺接枝到β-环糊精上,获得接枝有聚乙烯亚胺的β-环糊精属于本领域技术人员所公知的技术。
接枝前的聚乙烯亚胺的重均分子量范围可以是800~25,000道尔顿。一实施例中,列举了接枝前的聚乙烯亚胺的重均分子量是800道尔顿,但是,其分子量并不仅限于此。
所述聚乙烯亚胺修饰的β-环糊精结构通式如下所示:
n为1到7,m为PEI分子量800到25000。
所述接枝有聚乙烯亚胺的β-环糊精中,每个β-环糊精分子上接枝有一个及一个以上聚乙烯亚胺长链。一实施例中,列举了枝接了2~3个聚乙烯亚胺长链的β-环糊精分子,但是其接枝率并不仅限于此。
所述聚乙烯亚胺修饰的β-环糊精的结构示意图可参见图1C。
所述核酸和化学药物双载荷自组装纳米制剂中,所述金刚烷封端的聚乙二醇、金刚烷修饰的聚酰胺-胺和聚乙烯亚胺修饰的β-环糊精之间的摩尔比例范围是:(1~20):(1~5):(1~60)。
所述核酸和化学药物双载荷自组装纳米制剂中,所述金刚烷封端的聚乙二醇、金刚烷修饰的聚酰胺-胺和聚乙烯亚胺修饰的β-环糊精之间的摩尔比例范围可以是:(11.6~20):1:(34~60)。
所述核酸和化学药物双载荷自组装纳米制剂中,所述金刚烷封端的聚乙二醇、金刚烷修饰的聚酰胺-胺和聚乙烯亚胺修饰的β-环糊精之间的摩尔比例范围可以是:(1~11.6):(1~3):(1~34)。
进一步地,所述化学药物为疏水性化学药物。所述疏水性化学药物可以是用于肿瘤治疗的疏水性药物如阿霉素、紫杉醇、多西紫杉醇、喜树碱、SN-38等。本发明的一些实施方式中,以阿霉素作为疏水性化学药物模型,但并不限于此。
所述疏水性化学药物通过疏水相互作用包载于自组装纳米制剂中,进一步包载于金刚烷修饰的聚酰胺-胺中。一般地,金刚烷修饰的聚酰胺-胺对所述疏水性化学药物的包封率是(1~100%)。进一步地,金刚烷修饰的聚酰胺-胺对所述疏水性化学药物的包封率在80%以上。再进一步地,金刚烷修饰的聚酰胺-胺对所述疏水性化学药物的包封率在90%以上。例如,本发明一些实施方式中所例举的,所述,金刚烷修饰的聚酰胺-胺对所述疏水性化学药物的包封率为96.5%。
所述核酸通过电荷作用被包裹在自组装纳米制剂内部。所述核酸分子可以是基因药物。所述自组装纳米制剂中聚乙烯亚胺修饰的β-环糊精与所述核酸之间的氮磷比例范围是(2~30):1。
所述核酸分子选自但不限于反义核酸、核酶、适配体、干扰RNA、sgRNA等各种核酸分子及其质粒DNA或mRNA等表达载体,表达各种生物活性分子的质粒DNA或mRNA等载体等载荷与转染。
核酸和化学药物双载荷自组装纳米制剂的制备方法
本发明的自组装纳米的制备方法,包括:先将化学药物包载于金刚烷修饰的聚酰胺-胺中,获得包载了化学药物的金刚烷修饰的聚酰胺-胺;然后按照比例再与其他各组分混合,自组装获得核酸和化学药物双载荷自组装纳米制剂。
其中,包载了化学药物的金刚烷修饰的聚酰胺-胺可通过包括如下步骤的方法获得:通过溶剂挥发法,利用金刚烷修饰的聚酰胺-胺内部的疏水性空腔物理装载疏水性化学药物。
金刚烷封端的聚乙二醇可通过包括如下步骤的方法获得:将金刚烷通过酰胺反应连接到聚乙二醇的端部。
亦即,可将金刚烷上的氨基与聚乙二醇上的羧基进行酰胺反应,获得金刚烷封端的聚乙二醇。
金刚烷修饰的聚酰胺-胺可通过包括如下步骤的方法获得:将1-金刚烷异氰酸酯与聚酰胺-胺反应,金刚烷可通过异氰酸酯基团连接到聚酰胺-胺的胺基上。
聚乙烯亚胺修饰的β-环糊精可通过包括如下步骤的方法获得:将β环糊精与活化剂反应获得活化后的β-环糊精,加入聚乙烯亚胺,获得聚乙烯亚胺修饰的β-环糊精。
所述活化剂可以是N,N'-羰基二咪唑。
核酸和化学药物双载荷自组装纳米制剂在制备肿瘤药物输送载体中的用途。
本发明的核酸和化学药物双载荷自组装纳米制剂可用于同时输送具有肿瘤治疗作用的核酸和具有肿瘤治疗药物的化学药物,用于肿瘤的治疗。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULAR CLONING:A LABORATORY MANUAL,Second edition,Cold Spring Harbor Laboratory Press,1989 and Third edition,2001;Ausubel等,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons,New York,1987and periodic updates;the series METHODS IN ENZYMOLOGY,Academic Press,San Diego;Wolffe,CHROMATIN STRUCTURE AND FUNCTION,Third edition,Academic Press,San Diego,1998;METHODS IN ENZYMOLOGY,Vol.304,Chromatin(P.M.Wassarman and A.P.Wolffe,eds.),Academic Press,San Diego,1999;和METHODS IN MOLECULAR BIOLOGY,Vol.119,Chromatin Protocols(P.B.Becker,ed.)Humana Press,Totowa,1999等。
实施例1金刚烷封端的聚乙二醇(Ad-PEG)的合成
合成方程式详见图1A。
具体地,金刚烷(Adamantane,Ad)。称取分子量为187.74g/mol的金刚烷盐酸盐28.0mg(0.15mmol),溶解于2ml的二氯甲烷中形成溶液,加入15.8mg(0.15mmol)三乙胺为反应催化剂,加入150mg(MW=5000,0.03mmol)甲氧基-聚乙二醇琥珀酰亚胺,室温下搅拌2h。反应结束,将反应液转移至茄型瓶中,减压蒸馏除去二氯甲烷所得,白色固体溶于2mL双蒸水,于10,000rpm离心10min,离心后的沉淀为未反应的1-金刚烷胺盐酸盐。取离心后的上清液于MW 3,500Da的透析袋中透析过夜,透析后的溶液用0.22μm微孔滤膜过滤后得到澄清溶液,冷冻干燥即得产物金刚烷封端的聚乙二醇,用核磁共振氢谱表征,结果如图2表明,每个聚乙二醇上都连接有一个金刚烷。
实施例2金刚烷修饰的聚酰胺-胺(Ad-PAMAM,G5)的合成
2.1金刚烷-聚酰胺-胺(Ad-PAMAM,G5)的合成
合成反应式详见图1B。
具体地,金刚烷,简称Ad。
本实施例所使用的聚酰胺-胺PAMAM是带有1,2-二氨基丁烷芯核和胺末端的第五代聚酰胺树枝状聚合物(PAMAM,G5)。所述聚酰胺-胺PAMAM可购于Dendritic Nanotechnologies,Inc(Mount pleasant,MI)。
将78.86mg(14.74%wt,2.74umol)的PAMAM(G5)的甲醇溶液加入至圆底烧瓶,进行减压蒸馏将甲醇除去,将粘性固体重新溶解在10mL干燥的二甲亚砜中,将3.27mg(18.5mmol)的1-异氰基金刚烷溶解于10mL干燥的二甲亚砜中,将溶解后的1-异氰基金刚烷溶液加入至PAMAM(G5)溶液中,室温下搅拌反应2h,反应结束后,取反应液于MW10,000Da透析袋中透析过夜,透析后的溶液用0.22μm微孔滤膜过滤后得到澄清溶液,冷冻干燥即得产物金刚烷修饰的聚酰胺-胺(Ad-PAMAM,G5),用核磁共振氢谱表征,结果如图3表明,每个PAMAM G5上连接有6个Ad。
2.2金刚烷聚修饰的酰胺-胺(Ad-PAMAM,G5)载荷阿霉素(Dox)
取617ug(1.038umol)盐酸阿霉素甲醇溶液于棕色西林瓶中,加入上述5.33mg(0.1785mol)金刚烷聚修饰的酰胺-胺(Ad-PAMAM,G5),用甲醇补充体积至2mL,室温下避光搅拌12h。减压蒸馏除去甲醇,加入1mL 1mM TES溶液重新溶解产物。用MW3,500Da超滤管离心除去未包封的阿霉素,于10,000rpm 25℃离心10min,离心后往超滤管中补充溶液在上述条件下离心,重复5次。
将滤液于479nm/594nm处进行荧光检测,得到的荧光值代入已建立的荧光分光光度法检测盐酸阿霉素含量的分析方法,计算滤液中游离的盐酸阿霉素含量。通过以下公式计算包封率与载药量:
包封率的计算公式:
载药量的计算公式:
实施例3聚乙烯亚胺修饰的β-环糊精(CD-PEI)的合成
合成反应式详见图1C。
具体地,取0.84g(0.74mmol)β-环糊精(β-CD)及1.60g(10.4mmol)N,N'-羰基二咪唑(CDI)溶于6mL干燥的N,N-二甲基甲酰胺溶液,室温条件下避光搅拌反应1小时,反应过程中充氮气保护。反应结束后,用冷乙醚沉淀,在5000rpm条件下离心5min,弃去上清,得到黄色油状产物CD-CDI并溶解于5ml的干燥二甲基亚砜中。
取3.0g(MW=800,5.0mmol)的聚乙烯亚胺溶解于3ml干燥二甲基亚砜中,在90分钟内将上述CD-CDI溶液缓慢滴加至PEI溶液中并加入0.3mL三乙胺作为反应催化剂,再反应5小时。取反应液用截取分子量为10,000Da透析袋24小时后,所得溶液用0.22μm微孔滤膜过滤后得到澄清溶液,冷冻干燥即得产物CD-PEI,用核磁共振氢谱表征,结果如图4表明,每个β-CD上连有2~3个PEI分子。
实施例4核酸和疏水性化学药物双载荷自组装纳米制剂的制备
4.1核酸和疏水性化学药物双载荷自组装纳米制剂的制备
向1.5mL EP管中加入600ul生理盐水,并依次加入各组分,分别为2.8nmol Ad-PEG涡旋15s,0.14nmol Ad-PAMAM/Dox涡旋20s,静置2分钟,加入6ug质粒DNA涡旋20s,最后加入CD-PEI 8.4nmol立即涡旋30秒,静置15分钟得到双载荷自组装纳米制剂(DNA&DOX@SNPs)。此时,自组装纳米制剂中,Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为20:1:60,简称为1号制剂。
向1.5mL EP管中加入600ul生理盐水,并依次加入各组分,分别为1.63nmol Ad-PEG涡旋15s,0.14nmol Ad-PAMAM/Dox涡旋20s,静置2分钟,加入6ug质粒DNA涡旋20s,最后加入CD-PEI 4.75nmol立即涡旋30秒,静置15分钟得到双载荷自组装纳米制剂(DNA&DOX@SNPs)。此时,自组装纳米制剂中,Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为11.6:1:34,简称为2号制剂。
向1.5mL EP管中加入600ul生理盐水,并依次加入各组分,分别为0.80nmol Ad-PEG涡旋15s,2.4nmol Ad-PAMAM/Dox涡旋20s,静置2分钟,加入6ug质粒DNA涡旋20s,最后加入CD-PEI 0.80nmol立即涡旋30秒,静置15分钟得到双载荷自组装纳米制剂(DNA&DOX@SNPs)。此时,自组装纳米制剂中,Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为1:3:1,简称为3号制剂。
4.2核酸和疏水性化学药物双载荷自组装纳米制剂对核酸的装载能力
称取0.3g琼脂糖至锥形瓶中,向锥形瓶中加入30mL 1×TAE缓冲溶液,微波炉加热至琼脂糖溶解,待温度降至60℃左右后加入3μL Gelred染色液,轻轻摇匀以避免产生气泡,摇匀后将琼脂糖溶液倒至琼脂糖胶平板中,静置30分钟至琼脂糖凝胶凝固后轻轻取出,放至1×TAE缓冲溶液中备用。取制备好核酸和疏水性化学药物双载荷自组装纳米制剂(DNA&DOX@SNPs)(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为11.6:1:34,2号制剂)在1%琼脂糖凝胶内电泳,每孔所加质粒DNA量为300ng。1×TAE作为电泳缓冲液,于100V电压下电泳30分钟,用凝胶成像系统拍照观察。如图7所示,凝胶电泳结果显示,与裸DNA上样组比较,核酸和疏水性化学药物双载荷自组装纳米制剂中没有明显的游离DNA跑出而留在加样孔位置,说明质粒DNA被包裹在核酸和疏水性化学药物双载荷自组装纳米制剂内部,其DNA荧光强度条带也较暗,说明质粒DNA几乎完全装载在SNP中。通过凝胶电泳结果发现,1号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为20:1:60)和3号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为1:3:1)中质粒DNA也均完全包裹在SNP内部。
4.3核酸和疏水性化学药物双载荷自组装纳米制剂的表征
取已制备好的自组装纳米制剂用激光散射粒度分析仪进行粒径表征。结果如图5所示,2号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为11.6:1:34)的粒径均一,粒径在220nm左右。此外,1号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为20:1:60)粒径均一,粒径在220nm左右。3号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为1:3:1)粒径均一,粒径在220nm左右。
取已制备好的自组装纳米制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为11.6:1:34,2号制剂)20ul滴于铜网上,自然干燥,重复2次,用FEI公司的120kV生物型透射电镜(Tecnai G2spirit Biotwin)观察纳米粒子大小及形貌。TEM电镜结果如图6显示,得到外观圆整,粒径均一,粒径在220nm左右的自组装纳米制剂。通过TEM电镜结果显示,1号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为20:1:60)与3号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为1:3:1)也得到外观圆整,粒径均一,粒径在220nm左右的自组装纳米制剂。
实施例5核酸和疏水性化学药物双载荷自组装纳米制剂的稳定性研究
按实施例4.1,4.2的方法制备核酸和疏水性化学药物双载荷自组装纳米制剂,于室温存放置,在0小时、2小时、4小时、6小时、12小时后取样用马尔文激光粒度仪测量自组装纳米粒子的粒径,粒子数和PDI。基因载荷及双载荷的自组装纳米制剂在生理盐水中的稳定性实验如图8结果显示,2号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为11.6:1:34),其粒径大小在12小时后没有明显变化,其中各个时间点所测得的自组装纳米粒子粒径,粒子数和PDI基本一致,因此,我们所制备的自组装纳米制剂具有很好的稳定性。通过生理盐水中的稳定性实验结果显示,1号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为20:1:60)与3号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为1:3:1)的粒径大小在12小时后没有明显变化,其中各个时间点所测得的自组装纳米粒子粒径,粒子数和PDI基本一致,因此,我们所制备的自组装纳米制剂具有很好的稳定性。
实施例6核酸和疏水性化学药物双载荷自组装纳米制剂对核酸和阿霉素细胞递送研究
本发明通过细胞摄取实验测定了核酸和疏水性化学药物双载荷自组装纳米制剂是否能被细胞有效摄取。其中以Ad-PAMAM物理包载化疗药物阿霉素,阿霉素在479nm激光激发产生红色荧光(594nm),可观察药物在细胞内的分布和摄取,以质粒DNA为核酸分子模型,以SYBR Green I为荧光染料结合于双链DNA双螺旋小沟区域,在497nm激发波长下产生绿色荧光(520nm)。在游离状态下,SYBR Green I发出微弱的荧光,但一旦与双链DNA结合后,荧光大大增强,可观察质粒DNA在细胞内的分布和摄取。实验结果表明,本发明的核酸和疏水性化学药物双载荷自组装纳米制剂能有效装载阿霉素和质粒DNA,并有效地与细胞结合并被细胞摄取。
6.1核酸和疏水性化学药物双载荷自组装纳米制剂A549细胞对双载荷自组装纳米颗粒的摄取
人非小细胞肺癌细胞系A549采用含10%胎牛血清的RPMI1640培养基于37℃、5%CO2培养箱培养,实验时选取对数生长期A549细胞。
A549细胞准备:细胞计数,以1X105个/孔接种于24孔板,每组设置三个平行孔。
组别设置:空白组(有细胞,无双载荷自组装纳米颗粒组);实验组(核酸和疏水性化学药物双载荷自组装纳米制剂DNA&Dox@SNP,阿霉素终浓度2.5ug/mL)。每个24孔加入制剂的体积为500ul,其中阿霉素质量为1.25ug,质粒DNA量为10ug。
核酸和疏水性化学药物双载荷自组装纳米制剂的制备:按4.1所述制备得到核酸和疏水性化学药物双载荷自组装纳米制剂-2号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为11.6:1:34),加入5ul 2xSG Fast qPCR Master Mix(Low Rox)。
细胞摄取实验:取处于对数生长期的A549细胞,以1X105个/孔接种于24孔板,于培养箱中37℃,5%CO2培养16h,待细胞贴壁生长后,弃去培养基,分别加入500uL无血清培养基稀释的游离阿霉素和核酸和疏水性化学药物双载荷自组装纳米制剂,置培养箱中孵育2h。孵育结束后,于荧光显微镜下观察。结果显示,绿色激发波长(460~550nm)下,空白组视野为黑色;核酸和疏水性化学药物双载荷自组装纳米制剂组可在绿色激发波长(460~550nm)下,细胞内观察到明亮红色,说明自组装纳米颗粒成功包载阿霉素进入细胞,在蓝色激发波长(420~485nm)下,核酸和疏水性化学药物双载荷自组装纳米制剂组也可在细胞内观察到明亮绿色,自组装纳米颗粒同时也成功装载核酸进入细胞。
此外,对于1号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为20:1:60)与3号制剂(Ad-PEG、Ad-PAMAM/Dox和CD-PEI的摩尔比为1:3:1)进行细胞摄取试验,也可同时将阿霉素和核酸成功载入细胞。
综上,本发明的核酸和疏水性化学药物双载荷自组装纳米制剂组确实成功地同时装载核酸和阿霉素进入细胞。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!