预测肺癌脑转移分子标记物miR-4270及在药物和诊断试剂盒中的应用的制作方法
本发明属于分子生物学
技术领域:
,具体地说,涉及一组预测肺癌脑转移分子标记物miR-4270及在药物和诊断试剂盒中的应用。
背景技术:
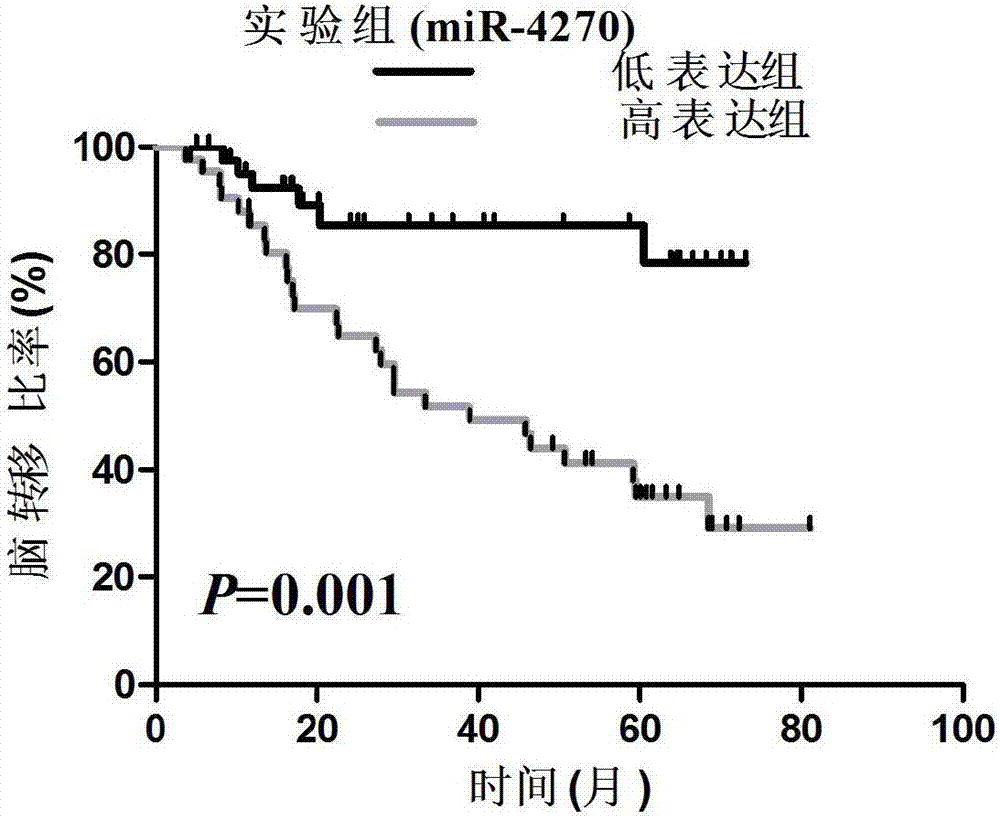
:世界范围内,肺癌是癌症死亡的首要因素。非小细胞肺癌约占全部肺癌的80%,约25%的非小细胞肺癌患者会发生脑转移。局部晚期非小细胞肺癌约占非小细胞肺癌的40%,并且脑转移是局部晚期非小细胞肺癌综合治疗后最常见的失败之一。早期非小细胞肺癌患者脑转移的风险为10%。然而,局部晚期非小细胞肺癌脑转移的风险高,约30-50%。脑转移严重危害患者的生存和生活质量。手术和放射技术的进步提高了局部晚期非小细胞肺癌的局部控制。系统化疗降低了颅外转移的风险。综合治疗显著延长了生存。近来的研究报道:局部晚期非小细胞肺癌综合治疗后的中位生存为20-43个月,3年生存为34-63%。尽管如此,血脑屏障的存在致使化疗对脑转移的作用有限,从而使脑的治疗相对不足。脑转移风险随着生存的提高而上升。研究显示:局部晚期非小细胞肺癌患者的生存和脑转移率呈正相关,脑转移对生存的危害逐渐上升。随着局部和颅外远处控制的改善,降低脑转移风险变得越来越重要。预防性脑照射能够改善小细胞肺癌患者的生存。然而,随机分组研究显示:尽管预防性脑照射降低了非小细胞肺癌的脑转移率,但是不能改善其生存。局部和颅外进展导致的死亡可能掩盖了预防性脑照射带来的可见获益。但是,并非所有的局部晚期非小细胞肺癌患者应该接受预防性脑照射,这促使本领域技术人员寻找脑转移的高危因素,以辨别最可能获益于预防性脑照射的脑转移高危亚组。利用分子生物学技术,能够有效地进行分子水平检测来判断恶性肿瘤患者脑转移的危险性,进而为个体化治疗这些疾病提供便利。MicroRNA是长约19-22个核苷酸的小片段单链非编码RNA。它通过有缺陷的碱基配对绑定其靶基因的3’非翻译区的互补序列来控制基因表达,从而使靶基因在转录或者翻译水平表达下调。近来microRNA成为从生长发育到癌症等很多病理生理过程的重要和革命性的保守调节因素。在不同的恶性肿瘤中,同一microRNA的作用可能不同。一个microRNA可以有很多属于不同通路的靶基因,而一个基因可以被几个microRNA调控。科学家发展技术来识别与肿瘤分期和患者预后相关的特异的基因表达标记,以改善预后和治疗。人们使用全面转录研究来识别以基因表达为基础的预后标识,但是,目前为止无一能应用于临床。与经典的mRNA表达谱相比,microRNA肿瘤表达谱似乎能够更准确地确定肿瘤亚型的分类。越来越多的证据支持实体肿瘤有特异的microRNA标记。与此同时,人们发现越来越多的microRNA的靶基因在肺癌发生中起重要作用,例如let-7、miR-34家族和miR-17-92簇。目前,科学家对microRNA的靶基因的识别仍然有限。在分子框架中,成熟microRNA带电后成为microRNA诱导的沉默复合体(miRISC)。该复合体含有Argonaute家族(一类庞大的蛋白质家族),与通常位于靶基因3’端非翻译区的互补位点反应。目前的模型认为microRNA和其靶基因的反应起源于位于microRNA的5’端的一段被称为“种子序列”的6至8个核苷酸短片段。MicroRNA诱导的沉默复合体能够将靶基因再配置成特别间隔,在其中处理翻译阻滞和mRNA衰变。许多研究证实了microRNA诱导的mRNA失稳。联合计算预测,mRNA表达谱的测量代表了识别功能microRNA-靶关系的有效方法。在非小细胞肺癌中,许多不同的microRNA调节异常,可能有致癌或抑癌作用,并预测预后。识别能够预测肺癌患者预后的microRNA是一项重要发现,这表明microRNA可能在肿瘤进展中起重要作用。现行的临床病理分期在预测患者脑转移上有其局限性。具有相似临床病理特点或者相同分期的肺癌患者的脑转移预后可能明显不同。分子标记物可以帮助医生鉴别高危患者,以便给予患者个体化治疗,从而改善生存。恶性肿瘤转移的自然进程包括:肿瘤细胞从原发灶脱落、对趋化因子的应答、侵入并降解胞外基质、血管再生、最终在靶器官内成功生长。尽管近年来随着分子生物学技术的进展,更加深入了解恶性肿瘤转移机制成为可能,但与其他器官转移相比,我们对介导肺癌脑转移的分子机制还不十分清楚,这主要因为脑组织具有一些不同于其他组织器官的特性,包括:存在血脑屏障、自我血流调节、缺乏淋巴引流及受损神经元无法再生等。转移至脑的肿瘤细胞必须先黏附至微血管内皮细胞,穿过血脑屏障,进入脑实质,生成血管。肺癌,特别是腺癌,是脑转移的主要来源,部分原因是肺癌细胞很容易通过由肺至脑的动脉循环到达脑。脑转移是肺腺癌治疗失败的重要原因。目前仅有3项研究涉及到非小细胞肺癌脑转移的microRNA表达差异,然而,这些研究的样本量太少,并且缺乏完整的机制研究。目前为止,没有较成熟的分子标记物可以或预期可能应用于临床来预测非小细胞肺癌脑转移高危亚群。我们的前期研究聚焦于217名完全切除术后病理ⅢA-N2期非小细胞肺癌患者,评价该组人群的脑转移的临床危险因素。在多因素分析中,非鳞状细胞癌(RR:4.13,95%CI:1.86—9.19和P=0.001)和淋巴结比率≥30%(RR:3.33,95%CI:1.79—6.18和P=0.000)与脑转移风险升高显著相关。腺鳞癌、腺癌、大细胞癌和鳞状细胞癌的脑转移率分别为41.7%(5/12)、35.7%(40/112)、16.7(1/16)和8.0%(7/87)。所以,我们选择了其中腺癌/腺鳞癌的患者的福尔马林固定石蜡包埋的手术肿瘤标本,采用高通量microRNA表达谱芯片技术研究脑转移的microRNA标记,为将来深入研究microRNA在肺腺癌脑转移的调控机制和临床应用筛选可能获益于预防性脑照射的脑转移高危亚组打下良好的基础。本发明人运用microRNA基因芯片及qRT-PCR技术对我国小细胞肺癌进行了研究,出人意料的发现,microRNA-423-5p在脑转移组表达明显上调;这个microRNA的表达水平和脑转移风险显著相关,它组成的microRNA标记是脑转移的独立预测因素。肿瘤分子标记物(TumorMarker)是反映肿瘤存在的化学类物质。它们或不存在于正常成人组织而仅见于胚胎组织,或在肿瘤组织中的含量大大超过在正常组织里的含量,它们的存在或量变可以提示肿瘤的性质,借以了解肿瘤的组织发生、细胞分化、细胞功能,以帮助肿瘤的诊断、分类、预后判断以及治疗指导。技术实现要素:为了解决目前非小细胞肺癌患者脑转移早期发现难,不能有效的进行分子水平检测来判断非小细胞肺癌患者脑转移的危险性的技术难题,本发明提供了预测肺癌脑转移分子标记物miR-4270及在药物和诊断试剂盒中的应用。为了解决上述技术问题,本发明通过下述技术方案得以解决:本发明第一方面提供了含有如下所述物质在制备具有抑制肿瘤药物中的应用:a)microRNA-4270;b)含有microRNA-4270的非编码基因的重组载体;c)含有microRNA-4270的非编码基因的重组病毒载体。其中microRNA-4270序列为3’CGGGAGGGGACUGAGGGACU5’。结合第一方面,在一种可能的实施方式中,所述肿瘤为非小细胞肺癌。本发明第二方面提供了含有如下所述物质在制备具有抑制肺癌脑转移药物中的应用:a)microRNA-4270;b)含有microRNA-4270的非编码基因的重组载体;c)含有microRNA-4270的非编码基因的重组病毒载体。结合第二方面,在一种可能的实施方式中,所述肺癌为非小细胞肺癌。结合第二方面,在一种可能的实施方式中,所述非小细胞肺癌为肺腺癌。本发明第三方面提供了用于非小细胞肺癌发生脑转移治疗的分子标记物,所述分子标记物为microRNA-4270。结合第三方面,在一种可能的实施方式中,所述非小细胞肺癌为肺腺癌。本发明第四方面提供了分子标记物microRNA-427在制备预测非小细胞肺癌发生脑转移的诊断试剂盒中的应用。结合第四方面,在一种可能的实施方式中,所述非小细胞肺癌为肺腺癌。分子标记物为microRNA-4270,简称miR-4270。与现有技术相比,本发明的有益技术效果如下:1)本发明提供一种分子标记物microRNA-4270,利用分子生物学技术,能够有效地进行分子水平检测来判断非小细胞肺癌患者脑转移情况及靶向治疗,进而为个体化治疗这些疾病提供便利。2)本发明提供一种分子标记物microRNA-4270制备的具有抑制肺癌脑转移药物,具有非常明确的抑制脑转移发生的临床疗效。3)本发明提供一种分子标记物microRNA-4270在制备预测非小细胞肺癌发生脑转移的诊断试剂盒中的应用,该试剂盒不仅精确度很高,而且对后续临床研究的开展具有重要的指导意义。附图说明图1为本发明在脑转移组(BM)和非脑转移组(NBM)表达显著差异的miR-4270的层次聚类分析图。图2为本发明miR-4270高表达组患者脑转移风险显著低于低表达组(实验组,n=87)对比图。图3为本发明miR-4270在具有脑转移的肺腺癌组织中表达降低实验图。图4为本发明miR-4270高表达组患者脑转移风险显著低于低表达组(验证组,n=68)对比图。图5为本发明miR-4270高表达组患者脑转移风险显著低于低表达组(全组,n=155)对比图。图6为本发明miR-4270高表达可以抑制非小细胞肺癌细胞株细胞的细胞增殖、平板克隆形成能力及细胞迁移转移能力图。图7为本发明miR-4270低表达可以促进非小细胞肺癌细胞株细胞的细胞增殖、平板克隆形成能力及细胞迁移转移能力图。图8为本发明体内实验证实miR-4270下调表达后,明显促进了裸鼠移植瘤的生长图。图9为本发明体内实验证实miR-4270下调表达后,明显促进了肺转移、脑转移的发生图。具体实施方式以下结合附图及实施例对本发明作进一步阐述,但实施例不对本发明构成任何限制。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例中未注明的具体的条件的实验方法,通常为本领域常规方法。本实施例涉及的检测方法包括microRNA探针设计、提取、qRT-PCR验证、细胞增殖、克隆集落形成、侵袭转移实验,裸鼠皮下移植瘤及转移瘤治疗实验。在今后临床应用中,仅运用microRNA提取及qRT-PCR两种技术即可。这两种方法对于本领域的技术人员为常规操作,因此,该模型在临床中容易被推广。本实施例中寻找非小细胞肺癌发生转移、预后及靶向治疗的标记物的方法如下:一、患者和标本:回顾了2003年1月至2005年12月,完全切除术后病理ⅢA-N2期肺腺癌或腺鳞癌并且术前未接受放化疗或其他针对肿瘤的治疗的患者。分期标准为第六版美国癌症分期联合委员会(Greene,2002)。同时患有其它原发肿瘤或之前有肺癌病史的患者排除在外。入组患者具有疗前的脑磁共振或CT检查。回顾了患者的病历和随访资料,以记录患者和治疗特点及复发模式。全部患者均知情同意。病例筛选标准如下:医学病案记录完备;患者术后生存大于4个月;随访完整;福尔马林固定石蜡包埋的手术肿瘤标本完好,并且标本肿瘤含量大于75%。最后共筛选出87例标本,包括脑转移组32例和非脑转移组55例。与非脑转移组比较,脑转移组有更多的患者接受过术后放疗,并有更多的患者的转移淋巴结个数和切除淋巴结个数的比率(淋巴结比率)≥1/3。除此之外,两组间性别、年龄、病理类型及分化、吸烟史、T分期和是否接受过辅助化疗等特点都是相匹配的。基因芯片检测肿瘤组织标本,筛选脑转移相关的基因microRNA-4270。芯片数据处理:采用SAM(SignificanceAnalysisofMicroarrays)软件进行差异表达基因的筛选:上调的基因,筛选标准为:(1)q-value≤5%;(2)差异倍数≥2。下调的基因,筛选标准为:(1)q-value≤5%;(2)差异倍数≤0.5。聚类分析软件为cluster3.0,采用hierarchical,MedianCenter(gene),averagelinkage算法。将脑转移组和非脑转移组表达显著差异的microRNA表达值按照其中位值分为低表达和高表达,随后进行单因素Cox回归分析脑转移风险。危险性microRNA的风险比>1。之后,基于危险分数中位值将患者分为高危组和低危组,利用log-rank方法比较两组脑转移风险。多因素Cox回归分析影响脑转移的独立变量。所有统计检验为双向,p<0.05为有统计学差异。统计分析应用SPSS18.0。PCR数据收集及处理:采用U6RNA作为内标,进行归一化处理。利用芯片所得模型评价预后。2、qRT-PCR进行microRNA验证临床资料回顾了2006年1月至2008年12月患者的病历和随访资料,以记录患者和治疗特点及复发模式。全部患者均知情同意。病例筛选标准如下:医学病案记录完备;患者术后生存大于4个月;随访完整;福尔马林固定石蜡包埋的手术肿瘤标本完好,并且标本肿瘤含量大于75%。最后共筛选出68例标本,包括脑转移组30例和非脑转移组38例。二、原位杂交:常规脱蜡至水,磷酸盐缓冲溶液(PBS,主要成分为K2HPO4、KH2PO)洗3min×2;0.1M甘氨酸孵育5min×2;0.3%TritonX-100(PBS)处理15min,PBS洗3min×3;蛋白酶K(浓度为20ug/ml)37℃(先预热)20min,PBS洗3min×3;4%多聚甲醛固定5min,PBS洗3min×3;0.25%乙酸酐(0.1M三乙醇胺,pH8.0)处理10min,PBS洗3min×3;在-20℃,分别用70%,85%和100%的酒精处理5min,进行脱水,最后风干;滴加探针(4个探针分别按1:250稀释,按要求加至各切片,50ul/张),加盖玻片,置于温盒,48℃杂交过夜,为16-18h;杂交后洗涤,SSC缓冲溶液(主要成分为氯化钠、枸橼酸钠、盐酸)脱盖片,37℃SSC缓冲溶液5min×3,SSC15min×2次;切片置于buffer缓冲液(主要成分为氯化钠、氯化钾、氯化镁、碳酸氢根)中浸5min;每个组织片在buffer缓冲液中0℃孵育15min;用buffer缓冲液按1:1000稀释地高辛DNA标记抗体,滴加50ul抗体稀释液,37℃孵育1h;用buffer缓冲液洗10minX2;用buffer缓冲液衡切片5min;配制显色液,用buffer缓冲液按1:50稀释四唑硝基蓝原液,临用前配制,避光。切片滴加显色液后,避光显色2-3h后观察显色情况,如显色较浅,可显色过夜。用buffer缓冲液洗涤终止显色,洗涤几次;滴加核固红复染,37℃,染色5-10min,水洗几次;快速脱水透明,中性树胶封片,显微镜观察。三、RNA提取、质量检测、芯片杂交及数据处理(一)、柠檬油精脱蜡处理石蜡包埋组织石蜡包埋组织样品的预处理:石蜡包埋组织如果已经切片,可选需厚度不大于50μm的切片十片左右,尽量除去周围石蜡,置于1.5mL离心管中。石蜡包埋组织如果是一整块,可用锋利刀片将组织轻轻刮下来并置于1.5mL离心管,尽量避免刮下石蜡。刮下的组织量控制在100mg以内。柠檬油精脱蜡处理:离心管中加入1ml柠檬油精(Limonen),55℃震荡混匀5min。13,200rpm室温离心2min,弃上清。此步骤总共进行3次。加入1ml无水乙醇至离心管中,55℃震荡混匀2min,13,200rpm室温离心2min,弃上清。重复此步骤一次。弃上清,室温短暂离心,用移液器将剩余的无水乙醇吸出。将离心管置于真空干燥仪中,抽干至组织呈干燥的粉末状。(二)、肺组织标本的RNA、microRNA的提取1.组织RNA的提取全部过程严格按照Trizol试剂盒说明书进行,在无RNA酶环境下操作,所用试管吸头及溶液均常规用1%焦碳酸二乙酯(DEPC)水处理(Tris除外),室温过夜。(1)分别取冻存的肺癌组织、癌旁正常组织各50~l00mg,置入预先加入0.5mlTrizol裂解液的1.5mlEppendorf小管中,用匀浆器不断研磨成浆液状,并添加Trizol裂解液至1ml。(2)15~30℃下孵育5分钟使核蛋白复合物完全溶解,每1mlTrizol反应液加氯仿0.2ml,强烈震荡15秒,15~30℃孵育2~3分钟。(3)4℃12,000g离心15分钟,移上清至另一Eppendorf小管中,体积约为加入Trizol反应液体积的60%。(4)沉淀RNA:每1mlTrizol加0.5ml异丙醇,15~30℃下孵育lO分钟。(5)2~8℃≤12,000g离心10分钟。(6)弃上清,70%乙醇(用DEPC处理的三蒸水配制)≥lml漂洗2次。(7)2~8℃≤7,500g离心5分钟。(8)真空抽干RNA,溶解于50μlDEPC水中。-70℃保存备用。(9)RNA定量及电泳鉴定A.取lμlRNA溶液加100μl水,混匀后用紫外可见分光光度计测定A260、A280及A260/A280比值,并读出RNA浓度。应为1.8~2.0。B.1.2%甲醛变性琼脂糖凝胶电泳鉴定RNA质量:①电泳槽用0.3%的H202浸泡30分钟,用DEPC水冲洗晾干。②制胶(20ml),含琼脂糖0.24g、无RNAase水17.4ml、10×MOPS2ml、37%甲醛0.6ml、EBlml,将琼脂糖加水微波炉加热融化后,加10×MOPS,待凝胶冷却至60℃再加甲醛和EB。然后在胶槽中灌制凝胶,插好梳子,水平放置待凝固后使用。③将凝胶预电泳5min,电压降为5V/cm。④取适量的RNA,加入电泳缓冲液(10×)2μl、甲醛3.5μl、甲酰胺l0μl混匀,置60℃保温10min,冰上速冷。加入3μl的上样缓冲液混匀,取适量加样于凝胶点样孔内。同时点RNA标准品。⑤电泳结束后在紫外灯下拍照。电泳后应见28S及18S两条条带,且28S:18S比值大于2,说明RNA未降解。2.细胞小RNA的提取细胞系小分子RNA(≤200nt)的提取用mirVanaTMmiRNA提取试剂盒按照说明书提取。方法简述如下:细胞(<107)收集后用600μl裂解/结合缓冲液裂解(取适量组织(<250mg),于液氮中研磨成粉末,转移至600μl裂解/结合缓冲液中裂解),再加入60μlmiRNA匀浆液,在冰上放置lOmin。加入600μl酸酚/氯仿,剧烈混匀30-60s后于室温以10000rpm离心5min(完全分层)。小心吸取上清转移至新的无RNase1.5ml离心管中。加入l/3体积的无水乙醇,完全混匀后加入到装在收集管中的离心柱中(每次最多700μl),室温以10000rpm离心lmin,收集流出液。在收集的流出液中再加入其2/3体积的无水乙醇,完全混匀后再加入到装在收集管中的另一新的离心柱中,室温以l0000rpm离心lmin,弃掉流出液。离心柱中加入700μlmiRNA洗液1,离心5-10s漂洗。再按上述方法用500μl洗液2/3漂洗两次。再离心lmin以完全去掉乙醇。加100μl室温的洗脱液,l0000rpm离心lmin,回收RNA。RNA稀释25倍后,紫外分光光度计测其OD260及OD280的值,并计算OD260/D280,比值大于1.8时,表明RNA纯度较好。同时根据OD260计算RNA的浓度。四、mimic或inhibitor的瞬时转染①mimic或inhibitor配制:在5nmol的双链siRNA中加入250μl1×通用缓冲液,得到浓度为20μM的mimic或inhibitor母液,置-20摄氏度保存。②取生长状态良好的细胞,于转染前一天将细胞接种于60mm培养皿中(不加抗生素),转染时细胞密度达到30%左右。③准备以下复合体:A液:将适当浓度的mimic或inhibitor稀释于500μl无血清培养基中,轻轻混匀;B液:取10μlLipofectamine2000(用前轻柔混匀)稀释于500μl无血清培养基中,混匀。室温孵育5min。④将稀释的脂质体与稀释的mimic或inhibitor混合,轻轻混匀,室温孵育20分钟(复合体于室温6小时内会保持稳定)。⑤将混合后的复合物1000μl加入细胞培养皿内,加无血清培养基至5ml,轻轻混匀。6小时后弃去原培养基,换含10%血清的培养基。⑥48小时后收集细胞进行Westernblot,RT-PCR,MTS等相应实验。五、MTS法检测细胞增殖曲线当细胞生长至对数生长期,进行细胞转染或进行相应处理,收集细胞,稀释成合适浓度的细胞悬液,将细胞悬液加入96孔细胞培养板中,每孔5000个细胞/100μl,在培养箱中继续培养至适当时间。每个实验组做6个平行孔,以只加培养基的孔作空白对照。设四个时间点:0h(细胞铺板后贴壁后既测),24h,48h,72h,96h。采用MTS比色法测定细胞活性,每孔加入15μlMTS试剂(500μg/ml),继续培养2h后用酶标分光光度计于波长570nm处测定光吸收值(OD),以空白孔调零,OD值越高细胞数量越多。六、克隆集落形成实验①按照实验要求进行细胞转染或者处理细胞。②准备大皿,每孔加入10ml培基,以及800个细胞。③细胞在标准条件下培养10天-14天,观察克隆形成情况。④当细胞形成肉眼可见的克隆时终止培养,弃去培养基,用PBS小心清洗细胞2次,加入4%甲醛固定,1ml/孔,固定15min,弃去固定液,以流水缓慢冲洗干净,加1ml结晶紫染液染色3min。以流水缓慢洗去染色液,通风橱中干燥,照相。七、趋化小室实验(Transwell)①细胞计数,小室中加入5×105个细胞,上室中加500ul无血清培养基,下室内加800ul含10%血清培养基。②迁移12-18小时后,弃去滤膜上、下室的培养液,用预热的PBS清洗,轻轻吹打PBS达到清洗滤膜下表面的作用,重复1次;③在下室移入4%多聚甲醛600μl,使滤膜下表面浸在其中固定细胞,15min;④弃去固定液,倒置transwell小室,使滤膜下表面朝上,自然风干;⑤风干后直接在倒置的transwell小室的滤膜下表面滴上数滴吉姆萨染液,10min;⑥蒸馏水清洗,用棉球擦去小室面未迁移的细胞,在倒置显微镜下观察计数。八、裸鼠移植瘤及肺转移瘤形成及治疗实验SPF级BABIC裸鼠(5-6周龄,雌雄各半,10只/组/细胞系),分别将1×106稳定转染miR-4270非小细胞肺癌细胞及空白对照细胞株接种于裸鼠右侧背部皮下及尾静脉,以形成裸鼠移植瘤及转移瘤模型。42天后统一采用拉颈法处死小鼠,解剖剥离裸鼠移植瘤及肺转移瘤组织,福尔马林固定处理。具体裸鼠移植瘤及肺转移瘤形成及治疗实验参见图8和图9,图8为体内实验证实miR-4270下调表达后,明显促进了裸鼠移植瘤的生长,表现为裸鼠移植瘤体积明显增加。图9中显示,体内实验证实miR-4270下调表达后,明显促进了肺转移、脑转移的发生。因此,miR-4270具有非常明确的抑制脑转移发生的临床疗效。本实施例还提供了含有如下所述物质在制备具有抑制肿瘤药物中的应用:a)microRNA-4270;b)含有microRNA-4270的非编码基因的重组载体;c)含有microRNA-4270的非编码基因的重组病毒载体。其中microRNA-4270序列为3’CGGGAGGGGACUGAGGGACU5’。优选的,该肿瘤为非小细胞肺癌。本实施例还提供了含有如下所述物质在制备具有抑制肺癌脑转移药物中的应用:a)microRNA-4270;b)含有microRNA-4270的非编码基因的重组载体;c)含有microRNA-4270的非编码基因的重组病毒载体。优选的,该肺癌为非小细胞肺癌。优选的,该非小细胞肺癌为肺腺癌。本实施例采用上述方法寻找非小细胞肺癌发生脑转移及靶向治疗的标记物microRNA-4270具有如下实验效果:microRNA-4270用于检测非小细胞肺癌脑转移。(1)表达情况作为非小细胞肺癌脑转移判断的标志。microRNA-4270在具有脑转移的非小细胞组织中的表达水平明显高于无脑转移的非小细胞组织;miR-4270表达水平与患者年龄、性别、肿瘤分化程度、肿瘤大小、临床分期、淋巴结转移无明显负相关,但与脑转移具有明显相关性。风险模型显示miR-4270高表达组患者脑转移风险显著低于低表达组。Cox风险比例模型分析显示miR-4270表达可作为非小细胞肺癌患者预后不良的独立标志。通过该预后模型,可以将非小细胞肺癌脑转移分为低危险性、高危险性两种类型,不同类型采用不同治疗方案,低危险性病变可以采用局部手段如手术、局部放疗等,而对于高危险性病变,治疗则相对激进,在手术、放化疗同时,则需要辅以全脑放疗。从而对非小细胞肺癌治疗模式的改变具有划时代意义。(2)研究了miR-4270对非小细胞肺癌细胞的增殖及迁移、侵袭能力的影响,研究表明miR-4270可以调控非小细胞肺癌细胞株的生长和细胞侵袭转移能力。miR-4270过表达可以抑制非小细胞肺癌细胞增殖和细胞侵袭转移能力。反之,miR-4270下调则导致了这种能力的增加。这也为miR-4270在非小细胞肺癌侵袭转移和治疗中的作用提供了证据。具体临床效果参见图1至图7,如下:参见图1,在脑转移组(BM)和非脑转移组(NBM)表达显著差异的miR-4270的层次聚类分析。参见图2,miR-4270高表达组患者脑转移风险显著低于低表达组(实验组,n=87)。参见图3,miR-4270在具有脑转移的肺腺癌组织中表达降低。参见图4,miR-4270高表达组患者脑转移风险显著低于低表达组(验证组,n=68)。参见图5,miR-4270高表达组患者脑转移风险显著低于低表达组(全组,n=155)。参见图6,miR-4270高表达可以抑制非小细胞肺癌细胞株细胞的细胞增殖、平板克隆形成能力及细胞迁移转移能力。参见图7,miR-4270低表达可以促进非小细胞肺癌细胞株细胞的细胞增殖、平板克隆形成能力及细胞迁移转移能力。本实施例提供了用于非小细胞肺癌发生脑转移治疗的分子标记物,该分子标记物为microRNA-4270。优选的,该非小细胞肺癌为肺腺癌。本实施例中分子标记物microRNA-4270在制备预测非小细胞肺癌发生脑转移的诊断试剂盒中的应用。优选的,该非小细胞肺癌为肺腺癌。本实施中的诊断试剂盒按照常规方法制备。本实施例中分子标记物microRNA-4270的试剂盒监控肺腺癌发生脑转移情况。选取10例病理学检查确诊为肺腺癌的患者,对其进行跟踪随访。患者样本来源于唐山市人民医院的肺腺癌患者,所有收集的患者经过有效的治疗,临床资料及随访资源完整。首先采集10例肺腺癌治疗后六周首次采集患者的血液,检测血液中相应基因的表达量,以后每三个月检查一次,跟踪九个月,共检测四次。利用试剂盒检测10例肺腺癌患者血液中相应基因的相对表达量。根据非小细胞肺癌患者治疗后6周,3个月,6个月,9个月时血液样本中相应基因的相对表达量与治疗前相比变化的水平来判断肺腺癌患者是否发生脑转移。判断标准定为,治疗后基因的相对表达量与治疗前相比下降大于或者等于35%时,判断为脑转移;治疗后基因的相对表达量与治疗前相比下降小于35%时,判断为无脑转移。试剂盒的检测判断结果如表1所示。表1:试剂盒的检测判断结果序号6周3个月6个月9个月临床结果1升高27%升高22%升高19%升高25%无脑转移2升高22%升高18%下降20%下降42%脑转移3升高26%升高22%升高23%升高20%无脑转移4升高19%升高16%升高10%下降48%脑转移5升高29%升高25%升高20%升高18%无脑转移6升高25%升高20%升高8%下降42%脑转移7升高23%升高20%升高15%升高13%无脑转移8升高25%升高20%升高15%升高12%无脑转移9升高28%升高15%下降20%下降61%脑转移10升高29%升高23%升高25%升高22%无脑转移从表1知,临床诊断结果显示10例肺腺癌患者中有4例治疗后出现脑转移,6例无脑转移。使用本实施例的试剂盒监控肺腺癌脑转移情况,可早于临床症状和体征发现,为医生提前进行干预提供参考。本发明说明书中未作详细描述的内容属于本领域技术人员的公知常识。以上仅是本发明的优选实施方式,应当指出,尽管参照优选实施例对本发明专利作了详细说明,对于本领域的普通技术人员来说,可以对本发明的技术方案进行若干改进和润饰,但不脱离本发明技术方案的实质和范围,这些改进和润饰也视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1