CDK抑制剂和溶瘤病毒在制备抗肿瘤药物的应用的制作方法
本发明属于生物医药领域,涉及cdk抑制剂与溶瘤病毒的联合在制备抗肿瘤药物中的应用。
背景技术:
溶瘤病毒(oncolyticvirus)是一类选择性的感染并杀伤肿瘤细胞,而不损伤正常细胞的可复制病毒。溶瘤病毒疗法(oncolyticvirotherapy)是一种创新的肿瘤靶向治疗策略,它利用天然的或经基因工程改造的病毒选择性的感染肿瘤细胞,并在肿瘤细胞中复制,达到靶向性溶解、杀伤肿瘤细胞的作用,但是对正常细胞没有损伤。
m1病毒(alphavirusm1)属于甲病毒属(alphavirus),其在制备抗肿瘤药物方面具有较好的应用效果。例如中国发明专利申请201410425510.3公开了m1病毒能选择性引起肿瘤细胞死亡而不影响正常细胞存活,其在抗肿瘤方面具有非常好的应用前景。然而,不同肿瘤对m1病毒的敏感性不一,对于某些肿瘤,m1病毒单独用药时,溶瘤作用还不够理想。例如中国发明专利申请201410425510.3所记载的,m1作为抗肿瘤药物使用时,对于结直肠癌、肝癌、膀胱癌和乳腺癌的效果不如胰腺癌、鼻咽癌、前列腺癌和黑色素瘤明显;而胶质瘤、宫颈癌、肺癌则更其次;而胃癌则最不显著。筛选增加溶瘤病毒肿瘤治疗效果的化合物有望增加溶瘤病毒的抗瘤谱及抗瘤强度。
发明人此前将大黄酚及其衍生物作为m1病毒的抗癌增效剂,经试验发现,50μm的大黄酚与(moi=0.001)m1病毒联用后,肿瘤细胞的存活率下降至39.6%。
药物的使用可能会给机体带来一些负面影响。但如果所采用的药物的使用剂量可以降至极低,大幅地降低这些负面影响,使得机体所受的影响大大降低,这无疑是一个很好地减轻毒副作用的途径,也是药物联用方案除了提高药效之外可以带来的另一个好处。
然而,对于溶瘤病毒的增效药物,尤其是甲病毒的增效药物,目前的研究还很少,并且大多数是在μm级的实验剂量下起作用。
技术实现要素:
本发明的目的在于提供一种溶瘤病毒抗肿瘤增效剂。
本发明的另一个目的在于提供一种可在低剂量下起到增效作用的溶瘤抗毒抗肿瘤增效剂。
本发明的另一个目的在于提供一种基于精确机制的溶瘤病毒抗癌增效剂,能够选择性的增强溶瘤病毒对肿瘤细胞的杀伤作用,而不影响正常细胞。
本发明的另一个目的在于提供一种cdk抑制剂在制备溶瘤病毒抗瘤增效剂方面的应用。
本发明的另一个目的在于提供一种抗瘤药物组合物,其可以使得溶瘤病毒发挥更好的抗瘤效果。
本发明的另一个目的在于提供一种针对溶瘤病毒不敏感的肿瘤,安全有效的溶瘤病毒增效药物。
发明通过以下技术方案实现上述目的:
发明人通过研究、筛选发现,cdk抑制剂出人意料地可以增强溶瘤病毒的溶瘤效果。
所述的cdk抑制剂为抑制cdk活性的物质、或降解cdk的物质、或降低cdk水平的基因工具。
细胞周期是细胞生命活动的重要部分。研究发现,多种恶性肿瘤的发生、发展都与细胞周期调节机制的紊乱有密切关系,因此肿瘤也被认为是一种细胞周期疾病。cdk(cyclin-dependentkinase,周期蛋白依赖性激酶)是一类重要的丝氨酸/苏氨酸激酶,负责调控细胞周期有序进行,因此cdk抑制剂可以阻断细胞周期,控制细胞增殖从而具有抗肿瘤活性。近年来,cdk抑制剂已成为当前抗癌药物的研究热点。
发明人通过抑制cdk可以显著增强溶瘤病毒的溶瘤效应。发明人采用了抑制cdk活性的化合物sns-032协同溶瘤病毒尤其是m1病毒作用于肿瘤细胞,实验结果发现,sns-032可以协同溶瘤病毒增强抗肿瘤效应。
本发明首次发现,cdk抑制剂可以作为溶瘤病毒的抗瘤增效剂/耐药逆转剂。
本发明提供了cdk抑制剂在制备溶瘤病毒抗瘤增效剂/耐药逆转剂方面的应用。
耐药逆转剂是指,当采用一些甲病毒作为抗肿瘤药物用于治疗肿瘤时,存在着一些肿瘤对溶瘤病毒并不太敏感,或者说这些肿瘤对溶瘤病毒具有抗性,此时,可以采用与cdk抑制剂(作为耐药逆转剂)联用溶瘤病毒的方式,以逆转肿瘤对所述溶瘤病毒的抗性。
所述的cdk抑制剂选自化合物;优选地,所述的cdk抑制剂包括但不限于选自以下化合物或其具有cdk抑制作用的衍生物、或其药学上可接受的盐、溶剂化物、互变异构体、同分异构体:sns-032、dinaciclib等抑制cdk活性的化合物。化合物的获取方式可选但不限于:自己化学分离或合成或者从商业途径购买。
在本发明一优选的实施例中,cdk蛋白抑制剂为sns-032,其结构式如式1所示:
在本发明另一优选的实施例中,cdk蛋白抑制剂为dinaciclib,其结构式如式2所示:
所述的cdk抑制剂还包括针对cdk基因表达抑制工具,包括但不限于基因、基因沉默以及基因编辑或敲除等工具手段。
作为一种可选的实施方式,所述cdk抑制剂选自dna、rna、pna或dna-rna-杂合体。它们可以是单链的或双链的。
cdk抑制剂可包括一些小的抑制核酸分子,例如短干扰rna(sirna),双链rna(dsrna),microrna(mirna),核酶,以及小发夹rna(shrna),这些都能减弱或消除cdk蛋白的表达。
这些小的抑制核酸分子可能包括第一、第二链,二者杂交彼此形成一个或多个双链区,每条链大约18~28个核苷酸的长度,大约18~23个核苷酸的长度,或者18,19,20,21,22个核苷酸的长度。另外,单链也可能包含能够相互杂交形成双链的区域,例如在shrna分子中。
这些小的抑制核酸分子在保持这种减弱或消除cdk蛋白的表达的能力时,可能包括修饰性核苷酸。修饰性核苷酸可用于改善体外或体内特性,如稳定性、活性和/或生物利用度。这些修饰性核苷酸可能含有脱氧核苷酸、2’-甲基核苷酸、2’-脱氧-2’-氟核苷酸、4’-三核苷酸、锁核酸(lna)核苷酸和/或2’-o-甲氧乙基核苷酸等。小的抑制核酸分子,如短干扰rna(sirna),也可能含有5’-和/或3’-帽结构,以此来防止核酸外切酶对其降解。
在一些实施例中,小抑制核酸分子组成的双链核酸含有两端钝、或悬垂的核苷酸。其他核苷酸可能包括会导致错位、凸起、循环、或摆动碱基对的核苷酸。小抑制核酸分子可以设计配方以便施用,例如,通过脂质体包裹,或掺入其他载体(如可生物降解聚合物水凝胶,或环糊精)。
或者,所述的cdk抑制剂还包括抗体、抗体功能性片段、肽类、和拟肽类中的一种或几种。其中,所述的抗体可能是单克隆抗体,多克隆抗体,多价抗体,多特异性抗体(例如:双特异性抗体),和/或连接在cdk上的抗体片段。该抗体可以是嵌合抗体、人源化抗体、cdr移植抗体或人型抗体。抗体片段可以是,例如,fab,fab’,f(ab’)2,fv,fd,单链fv(scfv),具二硫键的fv(sdfv),或vl、vh结构域。抗体可能是一个共轭的形式,例如,结合一个标签、一个可检测标记,或一种细胞毒性剂。抗体可能是同型igg(例如:igg1、igg2、igg3、igg4)、iga、igm、ige或igd。
所述的溶瘤病毒选自甲病毒、腺病毒、牛痘病毒、麻疹病毒、水泡口炎病毒、和单纯性疱疹病毒中的一种或多种;其中,所述的甲病毒选自m1病毒、盖塔病毒。作为优选的实施方式,所述的溶瘤病毒选自m1病毒、盖塔病毒或者它们的组合。
本发明所说的溶瘤病毒(m1病毒、盖塔病毒、腺病毒、牛痘病毒、麻疹病毒、水泡口炎病毒、和单纯性疱疹病毒)可以尤其地指目前已有的病毒,但也不排除一些可能发生的自然变异或者进行了突变(自然突变、强制性突变、或选择性突变)、基因修饰、序列增加或删除或部分替换的病毒。这里所述的溶瘤病毒包括已经进行了上述改变的病毒。最好是上述改变并不影响所说的溶瘤病毒发挥本发明所述的作用。所说的cdk抑制剂为能起到敲低或影响cdk基因表达或者降低cdk蛋白量或蛋白活性的物质(例如化合物、或氨基酸序列、核苷酸序列等)或工具等。本领域技术人员可以对其抑制化合物或者基因工具进行修饰、替换、改变等,但只要起到上述抑制cdk作用的,则属于本发明的cdk抑制剂,属于上述物质、化合物或工具等的同质替换。
在一些实施例中,甲病毒是保藏编号cctccv201423(保藏于中国典型培养物保藏中心,保藏日期2014年7月17日)的m1病毒。作为很可能来源于同一毒株的病毒,genbankaccessionno.ef011023记录了一株m1的序列。盖塔病毒作为与m1病毒具有高达97.8%(wenetal.virusgenes.2007;35(3):597-603)同源性的病毒,两者具有很高的同一性,m1病毒也被一些文献归类为类盖塔病毒。可以预期二者具有相似的功效。单个甲病毒株也可以施用。在其他实施方案中,也可使用多种菌株和/或类型的甲病毒。
本发明还提供一种用于治疗肿瘤的药物组合物,其包含cdk抑制剂以及溶瘤病毒。本发明还提供用于治疗肿瘤的药品套装,其包含cdk抑制剂或其衍生物或它们的组合,以及溶瘤病毒。药品套装区别于组合物的地方在于,cdk抑制剂不同于溶瘤病毒的剂型,而是独立包装(例如:药丸、或胶囊、或药片或安剖瓶中,含有cdk抑制剂;另外的药丸、或胶囊、或药片或安剖瓶中,含有溶瘤病毒)。在一些实施例中,溶瘤病毒、cdk抑制剂,以及溶瘤病毒和cdk抑制剂的组合,也可含一种或多种佐剂。所述的佐剂是指在药物组成中,可辅助药物疗效的成分。药品套装也可以包含独立包装的cdk抑制剂,以及独立包装的溶瘤病毒。药物套装中cdk抑制剂,以及溶瘤病毒的施用,可以是同时施用或者是以任意的前后顺序施用,例如在溶瘤病毒之前施用cdk抑制剂,或者在溶瘤病毒之后施用cdk抑制剂,或者两者同时施用。在各种实施例中,患者可以是哺乳动物。在一些实施例中,哺乳动物可以是人。
所述的cdk抑制剂包括但不限于sns-032(式1)或dinaciclib(式2)这一类的抑制cdk蛋白活性的化合物。或者针对cdk基因表达抑制工具,包括但不限于基因干扰、基因沉默以及基因编辑或敲除等工具手段。作为本发明优选的实施方式,所述的cdk抑制剂为sns-032。
所述的溶瘤病毒选自甲病毒、腺病毒、牛痘病毒、麻疹病毒、水泡口炎病毒、和单纯性疱疹病毒中的一种或多种;其中,所述的甲病毒选自m1病毒和盖塔病毒。作为优选的实施方式,所述的溶瘤病毒选自m1病毒和盖塔病毒的至少一种。
在组合物或药品套装中,sns-032或dinaciclib与溶瘤病毒的配比可选地为:0.005~200mg:103~109pfu;优选0.005~50mg:104~109pfu;进一步优选0.005~20mg:105~109pfu。
优选使用剂量为:sns-032或dinaciclib使用范围为0.01mg/kg至200mg/kg,同时溶瘤病毒使用滴度为moi从103至109(pfu/kg);优选sns-032或dinaciclib使用范围为0.05mg/kg至200mg/kg,同时溶瘤病毒使用滴度为moi从104至109(pfu/kg);更优选sns-032或dinaciclib使用范围为0.05mg/kg至20mg/kg,同时溶瘤病毒使用滴度为moi从105至109(pfu/kg)。
在一个实施方式中,所述溶瘤病毒选自m1病毒、盖塔病毒、腺病毒、牛痘病毒、麻疹病毒、水泡口炎病毒和单纯性疱疹病毒。优选地,所述溶瘤病毒为m1病毒和盖塔病毒中的至少一种。
在一个实施方式中,所述肿瘤为实体瘤或血液瘤。在一个实施方式中,所述实体瘤为肝癌、结直肠癌、膀胱癌、乳腺癌、宫颈癌、前列腺癌、胶质瘤、黑色素瘤、胰腺癌、鼻咽癌、肺癌、或胃癌。在优选的实施方式中,所述肿瘤为对溶瘤病毒不敏感的肿瘤。在更优选的实施方式中,所述肿瘤为对m1溶瘤病毒不敏感的肿瘤。
作为可选的实施方案,本发明所提供的sns-032或dinaciclib可以是注射剂、片剂、胶囊、贴剂、试剂盒等。作为优选的实施方案,本发明的增效药物是注射剂;优选地,可采用静脉注射。
作为本发明进一步优选的实施方案:
本发明发现了cdk抑制剂,尤其是sns-032可以增加溶瘤病毒的抗肿瘤效应,以提高溶瘤病毒作为抗肿瘤药物时的治疗有效性。细胞学实验证明m1病毒和sns-032联合应用,可显著引起肿瘤细胞的形态学病变,从而显著增强对肿瘤细胞的抑制作用。
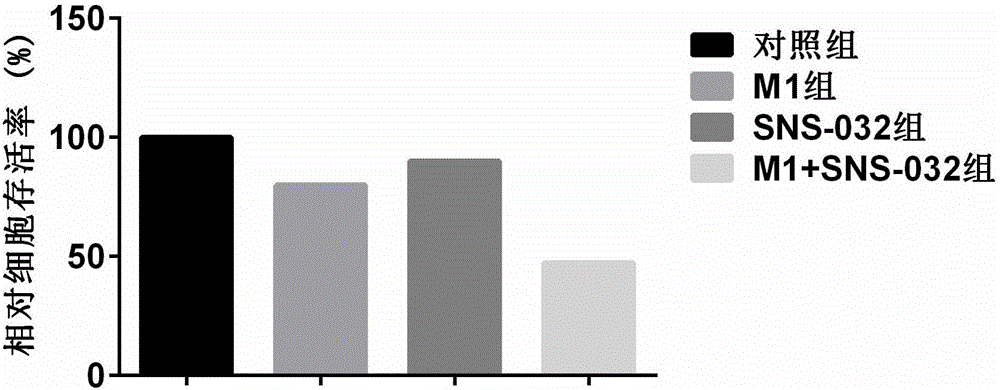
我们联合sns-032和m1病毒作用于人肝细胞癌hep3b株,出人意料的发现抗病毒化合物sns-032和m1病毒联合应用时,显著增加肿瘤细胞形态病变,显著降低肿瘤细胞生存率。例如在本发明的一个实施例中,当m1病毒(moi=0.001)单独处理肝癌细胞时,肿瘤细胞存活率为79.9%,当以50nm的sns-032单独处理肝癌细胞时,肿瘤细胞存活率仍高达为90.0%,而当以50nm的sns-032与同样moi的m1病毒联用时,肿瘤细胞存活率大幅下降至47.6%。与单用m1病毒的抗肿瘤效果相比,sns-032与m1联用时,溶瘤效果显著提升。可见,sns-032与m1联用时大幅提升的溶瘤效果,是得益于sns-032与m1病毒之间的协同性机制,并非简单地通过sns-032的抗肿瘤机制发挥作用。
本发明采用的溶瘤病毒增效剂还具备一个特点,其可以以极其低的施用剂量,而获得明显的增效溶瘤病毒的效果。例如,尽管在如此低的(例如,低至50nm)使用剂量时,sns-032对癌细胞的杀伤率几乎可以忽略(肝癌细胞存活率仍高达为90.0%)。然而,当同样以如此低的剂量与甲病毒(moi=0.001)联用时,肿瘤细胞存活率大幅下降至47.6%。极低剂量的使用,可以大大降低药物本身可能引起的其他毒副作用,使得用药对机体的影响降低。这对于正在接受癌症治疗的病人来说是十分重要的。
附图说明
图1sns-032与m1病毒联合处理显著降低人肝细胞癌株hep3b生存率。
具体实施方式
以下实施方式是对本发明作进一步说明,但本发明的实施方式不局限于以下的实施例介绍,凡依照本发明的原理或理念所作的等同的变化或变通都应视为本发明保护的范畴。
在没有特别指明的情况下,本发明采用的材料及实验方法为常规材料及方法。
说明书中的“选自”连接着所选对象,可以理解为,例如:“x选自:a、b、c、……、e”或“x选自:a、b、c、……和e中的一种或多种”,等等,均可理解为,x包括了a、b、c、……e中的一种、或者两者的任意组合、或者多者的任意组合。此时不排除x还包括了一些其他类别的物质。
除了上述提及的特定cdk抑制剂,本发明的抑制剂还可以选自现有技术中已经公知的cdk抑制剂、或者经后续研究发现具备cdk抑制作用的物质。
实施例1sns-032与m1病毒联合处理显著降低人肝细胞癌株hep3b生存率材料:
人肝细胞癌hep3b(购于atcc),m1病毒(保藏编号cctccv201423),高糖dmem培养基(购于corning),自动酶联检测酶标仪。
方法:
a)接种细胞、给药处理:选择对数生长期细胞,dmem完全培养液(含10%胎牛血清、1%双抗)制成细胞悬液,以每孔4×103/孔的密度接种在96孔培养板内。12小时后见细胞完全贴壁,实验分对照组,单独sns-032组,m1感染组和sns-032/m1联用组。所用剂量为:所用剂量为:m1病毒(moi=0.001)感染细胞;sns-032为50nm。
b)mtt与细胞内的琥珀酸脱氢酶反应:培养至48h时,每孔加入mtt20μl(5mg/ml),继续孵育4小时,此时镜检可观察到、活细胞内形成的颗粒状蓝紫色甲臜结晶。
c)溶解甲臜颗粒:小心吸去上清,加dmso100μl/孔溶解形成的结晶,在微型振荡器上震荡5min,然后在酶联检测仪上用波长570nm检测各孔的光密度(od值)。细胞存活率=药物处理组od值/对照组od值×100%。
结果:
如图1所示,m1病毒(moi=0.001)单独处理对肿瘤细胞hep3b具有较小的生存率抑制作用,肿瘤细胞存活率达到79.9%,50nm的sns-032处理组肿瘤细胞存活率仍高达90.0%,然而,当同样的50nm的sns-032与m1病毒(moi=0.001)联用(sns-032+m1)时,肿瘤细胞存活率大幅下降至47.3%。
- 还没有人留言评论。精彩留言会获得点赞!