脂肪干细胞‑ECM修饰SIS复合工程骨的制作方法
本实用新型涉及生物医学中组织工程及干细胞治疗技术领域,具体是一种可应用于骨再生的脂肪干细胞-ECM修饰SIS复合工程骨。
背景技术:
我国每年约有350万人因不同原因出现骨缺损,骨手术移植约为150万例,对替代骨的需求量非常大,尤其是大骨骼损伤的替代骨。体内骨修复是细胞与支架材料的协同作用过程,支架材料的三维微观结构能为宿主细胞提供良好黏附、增殖和迁移的微环境。随着组织工程技术的快速发展,利用组织工程原理将细胞与支架材料在体外复合后植入体内进行治疗,往往能有效减少炎症反应和瘢痕生成,促进血管新生和骨骼的再生等。
支架材料作为组织工程的核心要素,其表面性状、结构,机械性能和生物学性能均能调控细胞的各种生命活动和体内组织的修复再生。猪小肠黏膜下层(SIS),由于其优异的生物相容性、独特的生物力学特性和生物学活性,已被广泛用作再生医学的骨架材料。去细胞化的SIS 外观呈淡白色,含碱性成纤维细胞生长因子2(fibroblast growth factor 2, FGF-2)、转化生长因子β(transforming growth factor β, TGF-β)、血管内皮细胞生长因子(vascular endothelial cell growth factor, VEGF)、胰岛素样生长因子-1(insulin-like growth factors-1,IGF-1)、肿瘤坏死因子-α(Tumor Necrosis Factor,TNF-α)和血小板衍生生长因子-BB(Platelet derived growth factor BB,PDGF-BB)等多种生物活性因子,可用于促进细胞增殖分化与组织再生。功能细胞作为组织工程中的另一基本要素,对骨缺损处组织的重建起着非常重要的作用。骨髓间充质干细胞(bone mesenchymal stem cell,BMSC)和脂肪干细胞(adipose-derived stem cell, ADSC)由于具有很强的增殖能力及多向分化的潜能,是目前用于支架材料复合治疗的主要种子细胞。但相比于BMSC而言,ADSC具有来源广泛、取材容易以及在人和动物体内含量丰富等优点,使其在再生医学领域获得了更广泛的关注,并逐渐成为了干细胞研究的热点。目前,干细胞治疗已经显示了良好的组织再生能力,但在提高细胞治疗效率方面仍存在很大困难,主要有以下两个问题:①引入外源性物质或采用基因工程技术定向诱导干细胞的分化,存在诸多不可控因素;②干细胞注入到体内,怎样快速地黏附、融合进入受体组织,从而发挥功能,至今尚在争论中,因此,提高细胞治疗的效率是尚待研究的问题。
技术实现要素:
本实用新型所要解决的技术问题是:针对现有技术的不足,提供一种脂肪干细胞-ECM修饰SIS复合工程骨,该SIS复合工程骨具有较高的机械强度和高度类似于天然骨的微观结构,在植入体内初期能够提供较好的组织支撑,能够为干细胞植入提供优异的成骨微环境,植入后脂肪干细胞能够迅速增殖和成骨分化,促进大骨骼损伤的快速修复;此外,该复合工程骨具有纯天然内源性特点,可避免引入外源物质/基因等带来的不可控因素,具有很好的安全性,在骨再生领域具有广泛的临床应用前景。
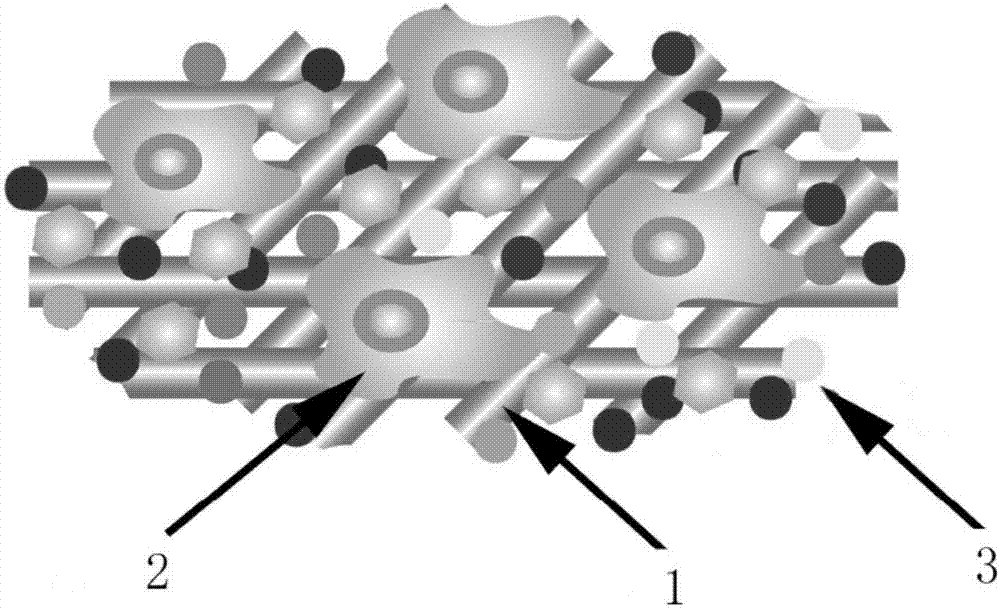
本实用新型解决上述技术问题所采用的技术方案为:脂肪干细胞-ECM修饰SIS复合工程骨,该复合工程骨的微观结构包括SIS胶原纤维骨架、人脂肪干细胞和细胞外基质层,所述的细胞外基质层由MC3T3-E1细胞指导和分泌的基质蛋白和多糖构成,所述的细胞外基质层覆盖在所述的SIS胶原纤维骨架的表面,所述的人脂肪干细胞黏附在所述的细胞外基质层上。
在所述的SIS胶原纤维骨架的表面覆盖的细胞外基质层的覆盖量为0.14±0.02 mg/cm2。
在所述的细胞外基质层上黏附的人脂肪干细胞的黏附量为5~10×105细胞/cm2。
该复合工程骨在干状态下的弹性模量为120±17MPa,在湿状态下的弹性模量为27±4MPa。
与现有技术相比,本实用新型的优点在于:本实用新型公开的脂肪干细胞-ECM修饰SIS复合工程骨,具有较高的机械强度,在干、湿状态下的弹性模量分别可达120±17MPa、27±4MPa,在植入体内初期能够提供较好的组织支撑,该复合工程骨与天然骨内部的矿物化结构和分布极为接近,具有高度类似于天然骨的微观结构,能够为干细胞植入提供优异的成骨微环境,植入后脂肪干细胞能够迅速增殖和成骨分化,促进大骨骼损伤的快速修复;此外,该复合工程骨具有纯天然内源性特点,可避免引入外源物质/基因等带来的不可控因素,具有很好的安全性,在骨再生领域具有广泛的临床应用前景。
附图说明
图1为实施例中复合工程骨的微观结构示意图一;
图2为实施例中复合工程骨的微观结构示意图二;
图3为实施例中细胞外基质层的微观结构示意图;
图4为实施例1中复合工程骨的扫描电镜照片;
图5为实施例中空白对照组、SIS组、ADSC/SIS组、ECM-SIS组、ADSC/ECM-SIS组的HE染色结果对比图。
具体实施方式
以下结合实施例对本实用新型作进一步详细描述。
实施例1的脂肪干细胞-ECM修饰SIS复合工程骨,如图1和图2所示,其微观结构包括SIS胶原纤维骨架1、人脂肪干细胞2和细胞外基质层3,如图3所示,细胞外基质层3由MC3T3-E1细胞指导和分泌的基质蛋白和多糖构成,细胞外基质层3覆盖在SIS胶原纤维骨架1的表面,人脂肪干细胞2黏附在细胞外基质层3上。该复合工程骨的扫描电镜照片如图4所示。该复合工程骨在干状态下的弹性模量为120±17MPa,在湿状态下的弹性模量为27±4MPa。
实施例2的脂肪干细胞-ECM修饰SIS复合工程骨,如图1和图2所示,其微观结构包括SIS胶原纤维骨架1、人脂肪干细胞2和细胞外基质层3,如图3所示,细胞外基质层3由MC3T3-E1细胞指导和分泌的基质蛋白和多糖构成,细胞外基质层3覆盖在SIS胶原纤维骨架1的表面,人脂肪干细胞2黏附在细胞外基质层3上,在SIS胶原纤维骨架1的表面覆盖的细胞外基质层3的覆盖量为0.14±0.02 mg/cm2。
实施例3的脂肪干细胞-ECM修饰SIS复合工程骨,如图1和图2所示,其微观结构包括SIS胶原纤维骨架1、人脂肪干细胞2和细胞外基质层3,如图3所示,细胞外基质层3由MC3T3-E1细胞指导和分泌的基质蛋白和多糖构成,细胞外基质层3覆盖在SIS胶原纤维骨架1的表面,人脂肪干细胞2黏附在细胞外基质层3上,在细胞外基质层3上黏附的人脂肪干细胞2的黏附量为5~10×105细胞/cm2。
以下评估本实用新型脂肪干细胞-ECM修饰SIS复合工程骨(简写为ADSC/ ECM-SIS复合工程骨)在加速体内临界骨缺损的修复方面的效果。具体过程如下:
将实施例1的ADSC/ ECM-SIS复合工程骨应用于小鼠头盖骨临界缺失模型,观察骨愈合修复过程,具体实验过程为:
1、选择实验对象:选取8周龄雄性C57BL/6小鼠作为实验对象。
2、建立头盖骨临界缺失模型:在小鼠头盖骨两侧部位用Miltex公司生产的Biopsy Punch设备移去直径为4mm的骨组织,然后分别随机植入SIS、ADSC/SIS、ECM-SIS、ADSC/ECM-SIS或无植入物作为对照;手术缝合后小鼠正常饲养4周后处死,取得头盖骨组织进行体内成骨状况分析。
3、组织学分析:结果如图5所示,五组分别为无植入物的空白对照组、SIS组、ADSC/SIS组、ECM-SIS组、ADSC/ECM-SIS组的HE染色。在空白对照骨缺失处,4周后几乎没有新生骨;ADSC/SIS组,靠近原始骨附近出现有限的新生骨;而在植入本实用新型ADSC/ ECM-SIS复合工程骨的位置,出现了较多的新生骨组织,且骨桥几乎覆盖了整个缺失区域。
4、统计学分析:采用软件Imagej对小鼠骨缺失处的新生骨面积比例进行计算,每个样品随机取5张不同截面的切片,通过统计学分析发现空白组中新生骨面积比例为0.53%±0.12% (Mean±S.D.),SIS组中新生骨面积比例为2.33%±2% (Mean±S.D.),ADSC/SIS组中新生骨面积比例为8.02%±4.42% (Mean±S.D.),ECM-SIS组中新生骨面积比例为6.77%±4.33% (Mean±S.D.),而植入本实用新型ADSC/ ECM-SIS复合工程骨组新生骨面积比例达到21.77%±6.99% (Mean±S.D.),较空白组具有显著差异(p<0.001),证明本实用新型ADSC/ECM-SIS复合工程骨在体内骨修复过程中效果显著。
- 还没有人留言评论。精彩留言会获得点赞!