包含抗逆转录病毒药物和药代动力学增效剂的药物组合物的制作方法
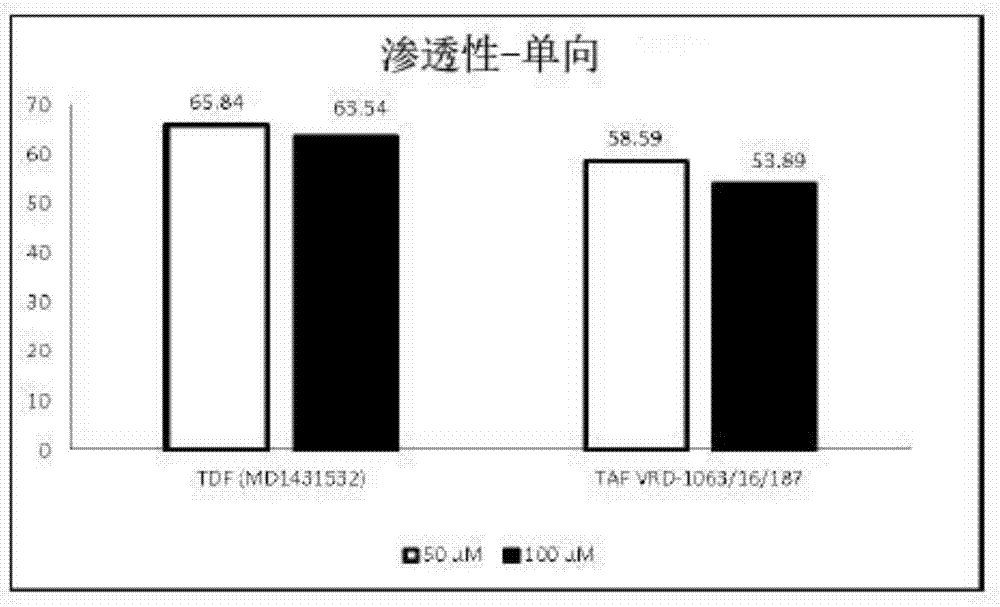
本申请要求2016年2月12日提交的共同未决的印度临时专利申请序列号201621005051,2016年9月23日提交的共同未决的印度临时专利申请序列号201621032504,以及2016年11月30日提交的共同未决的印度临时专利申请序列号201621040945的优先权。这些申请通过引用整体并入本文。领域本发明涉及包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂的药物组合物。本发明还提供了其制备方法和所述组合物用于预防、治疗或预防由逆转录病毒或乙型肝炎病毒特异性引起的病毒引起的疾病的用途。发明背景导致获得性免疫缺陷综合症(艾滋病,aids)的人类免疫缺陷病毒(hiv)已成为世界上最严重的健康问题之一。hiv属于一类称为逆转录病毒的病毒。逆转录病毒是rna(核糖核酸)病毒,为了复制,病毒必须制造其rna的dna(脱氧核糖核酸)拷贝。正是dna基因使病毒得以复制。像所有病毒一样,hiv只能在细胞内复制,从而使细胞的机制复制。然而,只有hiv和其他逆转录病毒一旦进入细胞内,就会使用一种叫做逆转录酶的酶将其rna转化为dna,这种dna可以整合到宿主细胞的基因中。hiv破坏cd4阳性(cd4)t细胞,cd4阳性t细胞是维持人免疫系统功能的关键白细胞。这些细胞的破坏使感染艾滋病毒的人易受其他感染,疾病和其他并发症的影响。这些细胞有时被称为“t辅助细胞”,在免疫反应中发挥核心作用,发信号给免疫系统中的其他细胞以发挥其特殊功能。由于艾滋病毒攻击这些细胞,感染该病毒的人对抗感染和疾病的能力较差,最终导致艾滋病的发展。健康的,未感染的人通常每立方毫米(mm3)血液具有800至1,200个cd4t细胞。hiv似乎对人类t-4淋巴细胞具有特殊的亲和力,t-4淋巴细胞在人体的免疫系统中起着至关重要的作用。hiv感染的白细胞(wbc)导致wbc群体减少。最终,免疫系统失效并且对各种机会性疾病无效。在未经治疗的hiv感染期间,人体血液中这些细胞的数量逐渐减少。hiv疾病的最后阶段,当cd4t细胞计数低于200/mm3时,一个人变得特别容易受到典型化的艾滋病的机会性感染和癌症的影响。患有艾滋病的人经常遭受肺、肠道、脑、眼睛和其他器官的感染,以及衰弱的体重减轻,腹泻,神经系统疾病以及卡波西肉瘤和某些类型的淋巴瘤等癌症。1981年报告了第一例病例,今天目前约有3690万人感染艾滋病毒,自疫情爆发以来,已有数千万人死于艾滋病相关原因。虽然世界各地都报告了新病例,但大约70%的病例发生在撒哈拉以南非洲地区。此外,根据联合国艾滋病规划署(unaids)2016年的实况报道,2015年有3670万人感染艾滋病毒。截至2015年12月,有1700万艾滋病毒感染者正在接受抗逆转录病毒治疗。2015年,全世界有110万人死于与艾滋病有关的原因。hiv是艾滋病的致病因子,其不仅在印度而且在全球范围内产生了重大的医疗保健问题。艾滋病导致身体免疫系统逐渐崩溃,以及中枢和周围神经系统逐渐恶化。自20世纪80年代初期首次获得认知以来,艾滋病已迅速蔓延,现已在相对有限的人口中达到流行病的比例。密集研究已经发现了责任者,人类t淋巴细胞逆转录病毒111(htlv-111),其通常被称为人类免疫缺陷病毒或hiv。目前可用于治疗hiv的抗逆转录病毒药物包括:齐多夫定或azt去羟肌苷或ddi司他夫定或d4t拉米夫定或3tc扎西他滨或ddc阿巴卡韦硫酸盐富马酸替诺福韦二吡呋酯恩曲他滨(含3tc和azt)、(含有阿巴卡韦、3tc和azt)、(含有阿巴卡韦和拉米夫定);奈韦拉平地拉夫定依法韦仑沙奎那韦indinavir利托那韦奈非那韦安普那韦atazanavir(含有atazanavir和cobicistat)、fosamprenavir(含有洛匹那韦和利托那韦)、enfuvirtide(t-20,)、(含有替诺福韦和恩曲他滨)、darunavir(含有darunavir和cobicistat)、dolutegravir(含有dolutegravir、阿巴卡韦和拉米夫定)、埃替拉韦(含有埃替拉韦,cobicistat,tenofoviralafenamidefumarte和恩曲他滨)、(含有埃替拉韦,cobicistat,富马酸替诺福韦二吡呋酯和恩曲他滨)raltegravir(含有恩曲他滨、富马酸替诺福韦二吡呋酯,利匹韦林)和(含有替诺福韦、恩曲他滨和efavirenz的固定剂量三联组合)。5至10%的hiv感染者也感染乙型肝炎病毒(通常称为共感染)。艾滋病病毒感染者不经治疗就不太可能自然清除乙型肝炎。艾滋病毒和肝炎合并感染的人可能有更快的肝病进展,并且可能对乙型肝炎治疗没有响应。然而,患乙型肝炎似乎并没有使艾滋病病情恶化。乙型肝炎病毒(hbv)感染是世界上最常见的慢性病毒感染。估计有20亿人受到感染,超过3.5亿人是该病毒的慢性携带者。hbv通过接触受感染的血液或精液传播。此外,aids(hiv)和乙型肝炎病毒在它们的共享逆转录,在它们的祖先起源和共同遗传元件以及在它们的传播方式中非常相似。两者都是高度可变的并且作为准物种存在,主要是由于逆转录的错误,尽管大多数乙型肝炎突变体的复制能力受到严格限制。它们的不同之处在于乙型肝炎病毒缺乏整合酶以及它们在受感染宿主中的发病机制。尽管病毒调控元件试图限制对宿主的致命伤害,但hiv主要通过抗原变异性、免疫逃避和免疫功能受损而存活。乙型肝炎病毒主要通过e抗原/核心基因的突变而存活,所述e抗原/核心基因直接消除感染的肝细胞的细胞毒性t细胞破坏,或通过诱导细胞毒性t细胞应答中的无反应间接限制受感染细胞的破坏。此外,抗逆转录病毒药物如拉米夫定、阿德福韦、恩替卡韦和替诺福韦已被批准用于治疗慢性hbv感染。药代动力学增效剂或增强剂用于增强抗逆转录病毒药物的有效性。当药代动力学增效剂或增强剂与抗逆转录病毒药物共同给药时,药代动力学增强剂干扰抗逆转录病毒药物的分解,这导致抗逆转录病毒药物在体内保留更长时间和更高浓度。药代动力学增效剂或增强剂特异性地引起细胞色素p4503a4酶系统的抑制,导致共同施用的抗逆转录病毒药物的血浆浓度增加。蛋白酶抑制剂是一类这样的抗逆转录病毒药物,其通常对耐药性表现出高的遗传屏障,因此需要共同施用药代动力学增效剂或增强剂。在用于治疗hiv的所有批准药物中,利托那韦和cobicistat被称为药代动力学“增效剂”或“增强剂”。使用利托那韦是因为其具有抑制药物代谢酶细胞色素p450(cyp)3a4的能力。以低剂量给药,利托那韦减少蛋白酶抑制剂如洛匹那韦和阿扎那韦的代谢(蛋白酶抑制剂被cyp3a4广泛代谢),从而增强药物暴露。cobicistat也是cyp3a同工酶的强抑制剂,并且增加由cyp3a代谢的药物,例如蛋白酶抑制剂即阿扎那韦和地瑞那韦的血浆浓度。除了利托那韦和cobicistat之外,还有许多天然存在的物质,这些物质在文献中有报道,并且可以进行探索以改善某些药物的药代动力学活性。这些作为生物增强剂的天然存在的物质是促进和增强与它们混合的药物的生物利用度并且不与药物发挥协同作用的化学实体。这些生物增强剂的实例包括胡椒碱、大蒜、葛缕子(carumcarvi)、孜然(cuminumcyminum)、麦角醇、柚皮苷、槲皮素、尼扎瑞丁(niaziridin)、甘草甜素、甜叶菊、牛尿、蒸馏姜等。这些药代动力学“增效剂”或“增强剂”可降低抗病毒治疗的成本,减少患者的药物负担,和/或降低亚治疗抗病毒浓度的风险(例如,抵抗力的发展以及增加对抗病毒治疗的依从性)。然而,这种药代动力学增强可能与其自身风险有关。沉淀剂药物,例如增效剂或增强剂可能必须以抑制目标药物消除,并且不产生其自身的副作用的剂量给药。因此,通常是有效抑制剂的增强剂可能无意中抑制其他药物的消除,导致不希望的副作用。此外,如果不仔细调整增强剂的剂量,或者不足或过量,则最终可能导致目标药物浓度的降低或增加。因此,考虑到这些方面,选择适当剂量的增强剂起着至关重要的作用。例如,尽管利托那韦具有抗病毒活性,但它会引起不希望的副作用,包括胃肠道问题,尤其是慢性腹泻和脂质异常。然后开发出cobicistat以产生与利托那韦大致相同程度的效果,但没有抗病毒活性或任何其他有问题的副作用。cobicistat是cyp3a4的底物(cyp2d6是代谢的次要途径)并抑制其自身的代谢。此外,cobicistat还抑制p-糖蛋白(p-gp)和cyp2d6,因此可能与cobicistat发生许多潜在的相互作用。此外,正在接受hiv治疗的患者总是处于与其他非hiv药物相互作用的风险中,并且已知cobicistat与抗酸剂、苯二氮卓类药物、β-受体阻滞剂、钙通道阻滞剂、勃起功能障碍药物、吸入/注射皮质类固醇、他汀类药物、口服避孕药、利福平和maraviroc展示关键的药物相互作用。目前使用的药代动力学增效剂或增效剂无意地抑制其他药物的消除,导致不希望的副作用。此外,使用胡椒碱和/或其结构类似物如四氢胡椒碱、顺式,反式胡椒碱、反式,顺式胡椒碱、顺式,顺式胡椒碱和反式,反式胡椒碱都不能提高这种抗逆转录病毒药物的生物利用度。因此,仍然需要提供药代动力学增效剂或增强剂与这些抗逆转录病毒药物的组合疗法,用于治疗hiv,这减少了这种抗逆转录病毒药物的剂量,减少了这些药物表现出的副作用,并保持这些药物的最佳浓度。此外,使用天然存在的药代动力学增效剂或增强剂将消除或减少与同时施用的其他非hiv药物的相互作用。概述在一些实施方案中,本发明的目的是提供包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂的组合物。在一些实施方案中,本发明的另一个目的是提供包含至少一种抗逆转录病毒药物和至少一种具有降低的副作用的药代动力学增效剂或增强剂的组合物。在一些实施方案中,本发明的另一个目的是提供包含至少一种抗逆转录病毒药物和至少一种具有降低的药物相互作用的药代动力学增效剂或增强剂的组合物。在一些实施方案中,本发明的另一个目的是提供包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂的组合物,其每天给药一次或两次。在一些实施方案中,本发明的另一个目的是提供包含至少一种抗逆转录病毒药物和至少一种具有减少剂量的药代动力学增效剂或增强剂的组合物。在一些实施方案中,本发明的另一个目的是提供一种试剂盒形式的组合物,其包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂。在一些实施方案中,本发明的另一个目的是提供预防、治疗或预防由病毒引起的,特别是由逆转录病毒引起的,特别是获得性免疫缺陷综合症或hiv感染引起的疾病的方法,该方法包括施用至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂。在一些实施方案中,本发明的另一个目的是提供一种治疗由病毒,特别是乙型肝炎病毒引起的疾病的方法,该方法包括施用至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂。在一些实施方案中,本发明的另一个目的是提供包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂的药物组合物用于治疗或预防由病毒,特别是逆转录病毒,特别是获得性免疫缺陷综合症或hiv感染引起的疾病的用途。在一些实施方案中,本发明的另一个目的是提供包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂的药物组合物用于治疗由病毒,特别是乙型肝炎引起的疾病的用途。根据本发明的一个方面,提供了药物组合物,其包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂,以及一种或多种药学上可接受的赋形剂。根据本发明的另一方面,提供了制备药物组合物的方法,所述药物组合物包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂,以及至少一种或多种药学上可接受的赋形剂。根据本发明的另一方面,提供了一种治疗由病毒,特别是逆转录病毒,特别是aids或hiv感染引起的疾病的方法,该方法包括给有需要的患者施用治疗有效量的根据本发明的药物组合物,所述药物组合物包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂。根据本发明的另一方面,提供了一种治疗由病毒,特别是乙型肝炎病毒引起的疾病的方法,该方法包括给有需要的患者施用治疗有效量的根据本发明的药物组合物,所述药物组合物包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂。根据本发明的另一方面,提供了包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂的根据本发明的药物组合物在制备用于治疗由病毒,特别是逆转录病毒,特别是aids或hiv感染引起的疾病的药物中的用途。根据本发明的另一方面,提供了根据本发明的药物组合物在制备用于治疗由病毒,特别是乙型肝炎病毒引起的疾病的药物中的用途,所述药物组合物包含至少一种抗逆转录病毒药物和至少一种药代动力学增效剂或增强剂。在一些实施方案中,提供口服或可注射药物组合物,其包含治疗有效量的至少一种抗逆转录病毒药物和治疗有效量的至少一种药代动力学增效剂或增强剂或其衍生物。在一些实施方案中,提供口服或可注射药物组合物,其包含治疗有效量的至少一种抗逆转录病毒药物;治疗有效量的至少一种药代动力学增效剂或增强剂或其衍生物;以及一种或多种药学上可接受的赋形剂,包括载体、稀释剂、填充剂、粘合剂、润滑剂、助流剂、崩解剂、填充剂、矫味剂或其任何组合。在一些实施方案中,提供了在需要这种治疗的患者中,治疗由病毒,特别是逆转录病毒或乙型肝炎病毒引起的疾病的方法,该方法包括施用药物组合物,所述药物组合物包含:(i)治疗有效量的至少一种抗逆转录病毒药物或抗病毒药物;(ii)治疗有效量的至少一种药代动力学增效剂或增强剂或其衍生物;(iii)一种或多种药学上可接受的赋形剂,包括载体、稀释剂、填充剂、粘合剂、润滑剂、助流剂、崩解剂、填充剂、矫味剂或其任何组合。在一些实施方案中,提供了制备增强抗逆转录病毒药物的生物利用度的药物组合物的方法,该方法包括:混合治疗有效量的至少一种抗逆转录病毒药物和治疗有效量的至少一种药代动力学增效剂或增强剂或其衍生物,以及一种或多种药学上可接受的赋形剂以制备药物组合物。在一些实施方案中,提供了用于治疗由逆转录病毒或乙型肝炎病毒引起的疾病的试剂盒,所述试剂盒包含治疗有效量的至少一种抗逆转录病毒药物和治疗有效量的至少一种药代动力学增效剂或增强剂或其衍生物,其中所述至少一种抗逆转录病毒药物与所述至少一种药代动力学增效剂或增强剂或其衍生物在分开的组合物中。在一些实施方案中,提供了增强口服抗逆转录病毒药物的生物利用度的方法,该方法包括:提供治疗有效量的至少一种抗逆转录病毒药物并提供治疗有效量的至少一种药代动力学增效剂或增强剂或其衍生物。附图简述图1描绘了单向测定的结果的条形图,其显示了富马酸替诺福韦艾拉酚胺(taf)和富马酸替诺福韦二吡呋酯(tdf)的渗透性。观察到tdf和taf是低至中等渗透性药物。图2描绘了地高辛10μm,地高辛10μm(ab)+胡椒碱10μm,taf100μm(vrd-1063/16/187),taf100μm(vrd-1063/16/187)+胡椒碱0.1μm和taf100μm(vrd-1063/16/187)+胡椒碱10μm)的双向测定的结果的条形图。结果表明,通过降低taf的流出比,taf吸收随胡椒碱增加。图3描绘了地高辛10μm,dolutegravir5μm,dolutegravir5μm+胡椒碱1μm,dolutegravir5μm+胡椒碱10μm,dolutegravir5μm+维拉帕米1μm和dolutegravir5μm+维拉帕米10μm的双向测定结果的条形图。图4描绘了地高辛10μm,达鲁那韦40μm,达鲁那韦40μm+胡椒碱1μm,达鲁那韦40μm+胡椒碱10μm,达鲁那韦40μm+cobicistat10μm和达鲁那韦40μm+cobicistat100μm的双向测定结果的条形图。结果表明,通过降低taf的流出比,达鲁那韦的吸收随胡椒碱增加。图5描绘了地高辛10μm,tdf200μm,tdf100μm,tdf100μm+胡椒碱10μm,tdf100μm+四氢胡椒碱10μm的双向测定结果的条形图。结果表明,通过降低流出比,tdf的吸收随胡椒碱增加,通过降低流出比,tdf的吸收随四氢胡椒碱增加,并且胡椒碱和四氢胡椒碱均观察到tdf渗透性的可比改善。图6描绘了在不同时间点对于tdf300mg和tdf300mg+胡椒碱20mg的替诺福韦的血浆浓度的条形图。图7描绘了在不同时间点对于tdf300mg和tdf300mg+胡椒碱20mg的替诺福韦的血浆浓度的条形图。图8描绘了对于300mgtdf,300mgtdf+20mg胡椒碱和150mgtdf+20mg胡椒碱,替诺福韦的时间依赖性血浆浓度。应当理解,附图未按比例绘制或拍照。此外,图中对象之间的关系可能不是按比例的,并且实际上可能与尺寸具有相反的关系。附图旨在理解和明晰所示每一对象的结构,因此,为了说明结构的特定特征,可夸大某些特征。发明详述为了治疗由逆转录病毒或乙型肝炎病毒引起的疾病,特别是aids、hiv感染或乙型肝炎,必须使药物的最大量到达作用部位。大多数抗逆转录病毒药物具有较差的溶解度和/或较差的渗透性,这在很大程度上降低了药物的生物利用度。本发明的发明人已经找到了解决这种抗逆转录病毒药物的生物利用度问题的方法。特别地,本发明人发现,通过使用药代动力学增效剂或增强剂可以改善这些药物的生物利用度性质。在几篇参考文献中公开了抗病毒药物的增强的生物利用度。胡椒碱作为生物利用度增强剂的作用,umeshkpatil等,internationaljournalofrecentadvancesinpharmaceuticalresearchoctober2011;4:16-23公开了胡椒碱作为生物利用度增强剂。wo2004067018公开了葛缕子(carumcarvi)的提取物作为生物增强剂的用途,其单独或与胡椒碱或与姜(zinzeberofficinale)提取物组合以改善齐多夫定的生物利用度。天然生物增强剂:anoverview,deepthiv.tatiraju等,journalofpharmacognosyandphytochemistry2013;2(3):55-60。本文公开了胡椒碱与奈韦拉平的组合,其中胡椒碱增强了奈韦拉平的生物利用度。使用草药生物增强剂mohammadasif增强抗病毒药物的口服生物利用度(提交给ganpat大学的论文)。本文公开了胡椒碱与依法韦仑的组合,其中胡椒碱增强了依法韦仑的生物利用度。胡椒碱和姜油树脂对阿扎那韦的生物利用度的生物增强作用,swatiprakash等,internationaljournalofpharmacyandpharmaceuticalsciencesvol7,issue10,2015。本文公开了胡椒碱与阿扎那韦的组合,其中胡椒碱增强了阿扎那韦的生物利用度。wo03084462公开了在单一药物组合物中制备含有抗逆转录病毒蛋白酶抑制剂如茚地那韦、沙奎那韦、安普那韦、奈非那韦、洛匹那韦和胡椒碱的药物组合物的方法。在一些实施方案中,根据本发明的抗逆转录病毒药物包括但不限于核苷逆转录酶抑制剂(nrti)、非核苷逆转录酶抑制剂(nnrti)、核苷酸类似物逆转录酶抑制剂、蛋白酶抑制剂(pi)、整合酶抑制剂、融合抑制剂、ccr5抑制剂、单克隆抗体、糖蛋白抑制剂及其任何组合。在一种实施方案中,核苷逆转录酶抑制剂(nrti)和非核苷逆转录酶抑制剂(nnrti)包括但不限于拉米夫定、阿巴卡韦、齐多夫定、恩曲他滨去羟肌苷、司他夫定、lobucavir、恩替卡韦、阿普力比碱、censavudine、zalcitabine、dexelvucitabine、alovudine、efavirenz、amdoxovir、elvucitabine、festinavir、racivir、lersivirine、利匹韦林、etravirine、stampidine、doravirine、dapivirine。在一些实施方案中,优选地,核苷逆转录酶抑制剂(nrti)和非核苷逆转录酶抑制剂(nnrti)是阿巴卡韦、去羟肌苷。优选地,阿巴卡韦的剂量范围为约3mg至约300mg,并且去羟肌苷的范围为约2mg至约200mg,每天两次给药。在另一种实施方案中,蛋白酶抑制剂包括但不限于洛匹那韦、利托那韦、沙奎那韦、奈非那韦、安普那韦、茚地那韦、奈非那韦、阿扎那韦、拉西那韦、帕利那韦、替罗那韦、福沙那韦、地瑞纳韦或替拉那韦。优选地,蛋白酶抑制剂是替拉那韦、地瑞纳韦。优选地,替拉那韦的剂量范围为约5mg至约500mg,地瑞那韦的范围为约1mg至约800mg,每天两次给药。在一些实施方案中,地瑞纳韦剂量范围为约1mg至约500mg,约20mg至约500mg,约25mg至约500mg,约30mg至约500mg,约35mg至约500mg,约25mg至约35mg,约50mg至约400mg,或约100mg至约300mg,每天两次给药。在一些实施方案中,地瑞纳韦剂量范围为约1mg,5,10,15,20,25,30,35,40,45,50,60,70,80,90,100,110,120,130,140,150,160,170,180,190,200,210,220,230,240,250,260,270,280,290,300,310,320,330,340,350,360,370,380,390,400,410,420,430,440,450,460,470,480,490,500,510,520,530,540,550,560,570,580,590,600,610,620,630,640,650,660,670,680,690,700,710,720,730,740,750,760,770,780,790至约800mg,每天一次或每天两次给药。如本文所述,每一剂量可以是一种或多种单位剂型。在另一种实施方案中,整合酶抑制剂包括但不限于dolutegravir,埃替拉韦,raltegravir,bictegravir,cabotegravir。优选地,整合酶抑制剂是埃替拉韦,dolutegravir,raltegravir。优选地,dolutegravir的剂量范围为约1mg至约50mg,埃替拉韦的范围为约1mg至约150mg,每天一次给药,raltegravir的剂量范围为约4mg至约400mg,每天一次给药。在一些实施方案中,所述dolutegravir剂量范围为约5mg至约50mg,约20mg至约50mg,约25mg至约50mg,约25mg至约45mg,约30mg至约50mg。施用50mg,约30mg至约40mg,或约35mg至约50mg,每天两次给药。在一些实施方案中,dolutegravir剂量范围为约1mg,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49至约50mg,每天一次或每天两次给药。如本文所述,每一剂量可以是一种或多种单位剂型。在另一种实施方案中,融合抑制剂包括但不限于maraviroc,enfuvirtide,griffithsin,aplaviroc,vicriviroc,plerixafor,fostemsavir,albuvirtide。在另一种实施方案中,ccr5抑制剂包括但不限于aplaviroc,vicriviroc,maraviroc,cenicriviroc。在另一种实施方案中,单克隆抗体包括但不限于艾巴利珠单抗。在另一种实施方案中,糖蛋白抑制剂包括但不限于西夫韦肽。在另一种实施方案中,核苷酸类似物逆转录酶抑制剂包括但不限于富马酸替诺福韦艾拉酚胺,富马酸替诺福韦二吡呋酯和阿德福韦。优选地,核苷酸类似物逆转录酶抑制剂是富马酸替诺福韦艾拉酚胺和富马酸替诺福韦二吡呋酯。在一些实施方案中,富马酸替诺福韦艾拉酚胺剂量范围为约1mg至约25mg,约2.5mg至约25mg,约5mg至约20mg,或约5mg至约15mg,一天两次给药。在一些实施方案中,富马酸替诺福韦艾拉酚胺剂量范围为约1mg,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24至约25mg,每天一次或每天两次给药。在一些实施方案中,富马酸替诺福韦二吡呋酯剂量范围为约1mg至约300mg,约1mg至约150mg,约75mg至约250mg,约100mg至约200mg,或约120mg至约180mg,每天两次给药。在一些实施方案中,富马酸替诺福韦二吡呋酯剂量范围为约1mg,5,10,15,20,25,30,35,40,45,50,60,70,80,90,100,110,120,130,140,150,160,170,180,190,200,210,220,230,240,250,260,270,280,290至约300mg,每天一次或每天两次给药。如本文所述,每一剂量可以是一种或多种单位剂型。术语“抗逆转录病毒药物”和“药代动力学增效剂或增强剂”在广义上使用不仅包括“抗逆转录病毒药物”本身和“药代动力学增效剂或增强剂”本身,还包括其药学上可接受的衍生物。适宜的药学上可接受的衍生物包括药学上可接受的盐、药学上可接受的溶剂化物、药学上可接受的水合物、药学上可接受的无水物、药学上可接受的对映体、药学上可接受的酯、药学上可接受的异构体、药学上可接受的多晶型物、药学上可接受的前药、药学上可接受的互变异构体等。术语“药代动力学增效剂或增强剂”是生物碱。在一些实施方案中,药代动力学增效剂或增强剂包括胡椒碱、四氢胡椒碱、顺式胡椒碱、反式胡椒碱、顺式反式胡椒碱、反式,顺式胡椒碱、顺式,顺式胡椒碱、反式,反式胡椒碱或其组合。更优选地,药代动力学增效剂或增强剂是胡椒碱或四氢胡椒碱及其类似物或衍生物。在一些实施方案中,与不使用药代动力学增效剂或增强剂相比,药代动力学增效剂或增强剂使抗逆转录病毒药物的血浆浓度增加10%,20%,30%,40%,50%,60%,70%,80%,90%,100%或更高。术语“可注射的”是施用药物组合物的模式。药物组合物可以多种方式给药。在人类中,药物组合物可以通过肠胃外途径给药。例如,药物组合物可以静脉内(例如静脉内注射)、皮下、皮内或通过肌内注射给药。如本领域技术人员所理解的,可以通过将药物组合物混合在适宜的药物载体(载体)或赋形剂中来实现静脉内施用。适于胃肠外给药的制剂方便地包含药物组合物的无菌水溶液制剂,其可配制成与患者的血液等渗。术语“治疗有效量”或“有效量”使得当施用时,药物组合物导致病毒或疾病的抑制。施用给患者的剂量可以是单剂量或多剂量,取决于多种因素,包括药物的给药药代动力学性质、给药途径、患者状况和特征(性别、年龄、体重、健康、大小等)、症状程度、同时治疗、治疗频率和所需效果。术语“治疗”或“处理”疾病、病毒或病症是指执行可包括向患者施用一种或多种药物的方案,以努力减轻疾病、病毒或病症的体征或症状。缓解可以在疾病、病毒或病症的迹象或症状之前发生,以及在它们出现之后发生。因此,治疗或处理包括减少、预防或预防疾病、病毒或病症。此外,治疗或处理不需要完全缓解体征或症状,不需要治愈,并且具体包括对患者仅具有边际效应的方案。黑胡椒(pipernigruml.)和长胡椒(piperlonguml.)的果实都是阿育吠陀(ayurvedic)和尤那尼(unani)(传统印度)药物系统中的重要药用植物,其中所述药物通常由草药的混合物组成。黑胡椒的广泛药用用途是已知的并且已被记录,包括其在治疗白斑病中的用途。胡椒碱可以是药代动力学增效剂或增强剂。胡椒碱是在黑胡椒(pipernigruml.;piperaceae)的果实中发现的主要生物碱,其刺激黑素细胞的复制并诱导黑素细胞树突的形成。预计胡椒碱会通过对病灶周围和滤泡黑素细胞的刺激作用引起白癜风斑块的再增殖。胡椒碱在化学上称为(1-2e,4e-胡椒基-胡椒碱),其结构如下所示。胡椒碱可通过增加胃肠道的血液供应促进药物和营养素的快速吸收,降低盐酸分泌以防止某些药物分解,增加肠道的乳化含量,增加γ-谷氨酰转肽酶等酶,从而提高药物的生物利用度。所述γ-谷氨酰转肽酶参与营养物质向肠细胞的主动和被动转运。胡椒碱可以通过抑制参与药物生物转化的酶来提高药物的生物利用度,从而防止它们的失活和消除。它还抑制p-糖蛋白,这种“泵”蛋白可以从细胞中去除物质,并可以减少葡萄糖醛酸的肠道产生,从而允许更多物质以活性形式进入体内。据报道胡椒碱还存在于其他胡椒属物种中,即p.acutisleginum,album,argyrophylum,attenuatum,aurantiacum,betle,callosum,chaba,cubeba,guineense,hancei,khasiana,longum,macropodum,nepalense,novaehollandiae,peepuloides,retrokacturn和sylvaticum。四氢胡椒碱是胡椒碱的结构类似物。位置2和4处的两个双键饱和以得到四氢类似物。四氢胡椒碱在化学上称为5-(1,3-苯并二氧杂环戊烯-5-基)-1-胡椒碱-1-基戊-1-酮,其结构如下所示。四氢胡椒碱类似于黑胡椒中的天然胡椒碱(黑胡椒油树脂中约0.7%)。四氢胡椒碱可由胡椒碱合成,胡椒碱先前从黑胡椒油树脂中提取。术语四氢胡椒碱的“类似物或衍生物”在广义上使用包括烷基四氢胡椒碱例如甲基四氢胡椒碱或乙基四氢胡椒碱,二烷基四氢胡椒碱例如二甲基四氢胡椒碱或二乙基四氢胡椒碱,烷氧基四氢胡椒碱例如甲氧基四氢胡椒碱,羟基四氢胡椒碱例如1-[(5,3-苯并二氧基-5-基)-1-羟基-2,4-戊二烯基]-胡椒碱、1-[(5,3-苯并二氧基-5-基)-1-甲氧基-2,4-戊二烯基]-胡椒碱,卤代四氢胡椒碱例如1-[(5,3-苯并二氧基-5-基)-1-氧代-4-卤代-2-戊烯基]-胡椒碱和1-[(5,3-苯并二氧基-5-基)-1-氧代-2-卤代-4-戊烯基]-胡椒碱,二氢胡椒碱,烷基二氢胡椒碱例如甲基二氢胡椒碱或乙基二氢胡椒碱,二烷基二氢胡椒碱例如二甲基二氢胡椒碱或二乙基二氢胡椒碱,烷氧基二氢胡椒碱例如甲氧基二氢胡椒碱和卤代二氢胡椒碱,以及它们药学上可接受的盐、药学上可接受的溶剂化物、药学上可接受的水合物、药学上可接受的无水物、药学上可接受的对映体、药学上可接受的酯、药学上可接受的异构体、药学上可接受的多晶型物、药学上可接受的前药、药学上可接受的互变异构体、药学上可接受的复合物等。在一些实施方案中,胡椒碱的剂量优选为约0.5mg至约400mg,四氢胡椒碱的剂量为约0.5mg至约400mg。在一些实施方案中,胡椒碱和/或四氢胡椒碱的剂量范围为约0.5mg,1,2,3,4,5,6,7,8,9,10,15,20,25,30,35,40,45,50,60,70,80,90,100,110,120,130,140,150,160,170,180,190,200,210,220,230,240,250,260,270,280,290,300,310,320,330,340,350,360,370,380,390至约400mg。在一些实施方案中,至少一种抗逆转录病毒药物与至少一种药代动力学增效剂或增强剂的重量比为约100:1至约1:1。优选地,药物组合物可以以剂型提供,例如但不限于单位剂型,包括片剂、胶囊(填充粉末、丸剂、珠子、迷你片剂、丸剂、微丸剂、小片剂单位、多个单元粒料系统(mups)、崩解片剂、可分散片剂、颗粒,和微球体、多颗粒)、小袋(填充有粉末、丸粒、珠、小片剂、丸剂、微球粒、小片剂单位、mups、崩解片剂、可分散片剂、颗粒,和微球体、多颗粒)、用于重构的粉剂、透皮贴剂和喷剂,然而,其它剂型如控制释放制剂、冻干制剂、冻干粉末、缓释制剂、延迟释放制剂、延长释放制剂、脉冲释放制剂、双重释放制剂等。液体、液体可注射的或半固体的剂型(液体、悬浮液、溶液、分散液、软膏、乳膏、乳剂、微乳剂、喷雾剂、贴剂、点涂)、注射制剂、肠胃外制剂、局部制剂、吸入制剂、含服制剂、经鼻制剂等,也可以设想在本发明的范围内。在一些实施方案中,药物组合物通过糖浆施用。糖浆可以通过将活性化合物加入到糖(例如蔗糖)的浓缩水溶液中来制备,也可以向其中加入任何辅助成分。这些辅助成分可包括调味剂、适宜的防腐剂、延缓糖结晶的试剂,以及增加任何其他成分(例如多元醇,例如甘油或山梨糖醇)的溶解度的试剂。在一些实施方案中,来自例如片剂的单位剂量可以通过压缩或模塑制备,其任选地含有一种或多种辅助成分。压缩片剂可以通过在适宜的机器中压制来制备,其中活性化合物是自由流动的形式,例如粉末或颗粒,活性化合物任选地与粘合剂、崩解剂、润滑剂、惰性稀释剂、表面活性剂或分散剂混合。包含适宜载体的模制片剂可以通过在适宜的机器中模制来制备。本发明的药物组合物包含至少一种抗逆转录病毒药物和胡椒碱或四氢胡椒碱。配制这些活性成分用于同时、分开或顺序给药。当顺序施用活性成分时,可以首先施用至少一种抗逆转录病毒药物或胡椒碱/四氢胡椒碱。当同时给药时,可以在相同或不同的药物组合物中给予活性成分。辅助治疗,例如其中一种活性成分用作主要治疗而其它活性成分用于辅助该主要治疗也是本发明的一种实施方案。因此,提供了一种产品,其包含至少一种抗逆转录病毒药物和胡椒碱或四氢胡椒碱作为组合制剂,用于同时、分别或依次用于治疗由逆转录病毒或乙型肝炎病毒引起的疾病,尤其是aids或hiv感染,或乙型肝炎。在一些实施方案中,本发明的药物组合物包含富马酸替诺福韦二吡呋酯和胡椒碱,用于治疗由逆转录病毒引起的疾病,尤其是获得性免疫缺陷综合症或hiv感染。根据优选的实施方案,本发明的药物组合物包含富马酸替诺福韦二吡呋酯和胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含富马酸替诺福韦艾拉酚胺和胡椒碱,用于治疗由逆转录病毒引起的疾病,尤其是aids或hiv感染。根据优选的实施方案,本发明的药物组合物包含富马酸替诺福韦艾拉酚胺和胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含dolutegravir和胡椒碱,用于治疗由逆转录病毒引起的疾病,尤其是获得性免疫缺陷综合症或hiv感染。根据优选的实施方案,本发明的药物组合物包含dolutegravir和胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含地瑞纳韦和胡椒碱,用于治疗由逆转录病毒引起的疾病,尤其是获得性免疫缺陷综合症或hiv感染。根据优选的实施方案,本发明的药物组合物包含地瑞纳韦和胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含富马酸替诺福韦二吡呋酯和胡椒碱,用于治疗由乙型肝炎病毒引起的疾病。根据优选的实施方案,本发明的药物组合物包含富马酸替诺福韦二吡呋酯和胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含富马酸替诺福韦艾拉酚胺和胡椒碱,用于治疗由乙型肝炎病毒引起的疾病。根据优选的实施方案,本发明的药物组合物包含富马酸替诺福韦艾拉酚胺和胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含富马酸替诺福韦二吡呋酯和四氢胡椒碱,用于治疗由逆转录病毒引起的疾病,尤其是获得性免疫缺陷综合症或hiv感染。根据优选的实施方案,本发明的药物组合物包含富马酸替诺福韦二吡呋酯和四氢胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含富马酸替诺福韦艾拉酚胺和四氢胡椒碱,用于治疗由逆转录病毒引起的疾病,尤其是获得性免疫缺陷综合症或hiv感染。根据优选的实施方案,本发明的药物组合物包含富马酸替诺福韦艾拉酚胺和四氢胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含dolutegravir和四氢胡椒碱,用于治疗由逆转录病毒引起的疾病,尤其是获得性免疫缺陷综合症或hiv感染。根据优选的实施方案,本发明的药物组合物包含dolutegravir和四氢胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含地瑞纳韦和四氢胡椒碱,用于治疗由逆转录病毒引起的疾病,尤其是获得性免疫缺陷综合症或hiv感染。根据优选的实施方案,本发明的药物组合物包含地瑞纳韦和四氢胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含富马酸替诺福韦二吡呋酯和四氢胡椒碱,用于治疗由乙型肝炎病毒引起的疾病。根据优选的实施方案,本发明的药物组合物包含富马酸替诺福韦二吡呋酯和四氢胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,本发明的药物组合物包含富马酸替诺福韦艾拉酚胺和四氢胡椒碱,用于治疗由乙型肝炎病毒引起的疾病。根据优选的实施方案,本发明的药物组合物包含富马酸替诺福韦艾拉酚胺和四氢胡椒碱,重量比为约100:1,50:1,40:1,30:1,20:1,10:1,8:1,6:1,5:1,4:1,3:1,2:1至约1:1。在一些实施方案中,当药代动力学增效剂或增强剂或其衍生物与药物组合物中的抗逆转录病毒药物一起施用时,施用于患者的至少一种抗逆转录病毒药物的给药频率降低。在一些实施方案中,所述至少一种药代动力学增效剂或增强剂或其衍生物将所述至少一种抗逆转录病毒药物的生物利用度从约10%增加至约100%,从约10%增加至约70%,从约10%增加至约50%,从约10%增加至约30%,或从约10%增加至约20%。在一些实施方案中,所述至少一种药代动力学增效剂或增强剂或其衍生物使所述至少一种抗逆转录病毒药物的生物利用度从约10%,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49,50,51,52,53,54,55,56,57,58,59,60,61,62,63,64,65,66,67,68,69,70,71,72,73,74,75,76,77,78,79,80,81,82,83,84,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99或100%增加。本发明的发明人还发现,抗逆转录病毒药物的生物利用度性质也可通过纳米级化来改善。在一些实施方案中,药物组合物通过尺寸为约1纳米(nm)至约50nm的纳米颗粒施用。在一些实施方案中,纳米颗粒的尺寸为约1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,43,44,45,46,47,48,49或50nm。在一些实施方案中,适宜的赋形剂可用于配制根据本发明的剂型,所述的适宜的赋形剂例如但不限于表面稳定剂或表面活性剂、粘度调节剂、包括延长释放聚合物的聚合物、稳定剂、崩解剂或超级崩解剂、稀释剂、增塑剂、粘合剂、助流剂、润滑剂、甜味剂、调味剂、抗结块剂、遮光剂、抗微生物剂、消泡剂、乳化剂、缓冲剂、着色剂、载体、填料、抗粘剂、溶剂、掩味剂、防腐剂、抗氧化剂、质地增强剂、沟道剂、包衣剂或其组合。在一些实施方案中,当药物组合物以单位剂型提供时,如上所述,单位剂型可以是未包衣的或包衣的。在考虑以下实施例后,将进一步理解本申请的这些和其它方面,这些实施例旨在说明本申请的某些特定实施方案,但不旨在限制由权利要求限定的其范围。实施例实施例1:表1方法:1)将富马酸替诺福韦艾拉酚胺、恩曲他滨、胡椒碱、乳糖、胶体二氧化硅、微晶纤维素和交联羧甲基纤维素钠在适宜的混合器中干混。2)将步骤(1)中获得的共混物用硬脂酸镁润滑并压实并干燥造粒。3)将步骤(3)中获得的颗粒、胶体二氧化硅、微晶纤维素和交联羧甲基纤维素钠混合以形成共混物。4)将步骤(3)中得到的混合物压制成片剂并用欧巴代(opadry)包衣。.实施例2:表2方法:1)将富马酸替诺福韦艾拉酚胺、胡椒碱、乳糖、胶体二氧化硅、微晶纤维素和交联羧甲基纤维素钠在适宜的混合器中干混。2)将步骤(1)中获得的共混物用硬脂酸镁润滑,压制成片剂并用欧巴代包衣。实施例3:表3成分标签重量%干混富马酸替诺福韦艾拉酚胺0.1%-10%恩曲他滨25%-40%胡椒碱0.1%-10%埃替拉韦10%-30%乳糖5%-40%胶体二氧化硅1%-10%微晶纤维素1%-15%交联羧甲基纤维素钠1%-10%硬脂酸镁1%-10%混合和润滑胶体二氧化硅1%-10%微晶纤维素1%-15%交联羧甲基纤维素钠1%-10%硬脂酸镁1%-10%薄膜包衣欧巴代1%-10%方法:1)将富马酸替诺福韦艾拉酚胺、恩曲他滨、胡椒碱、埃替拉韦、乳糖、胶体二氧化硅、交联羧甲基纤维素钠和微晶纤维素干混,得到混合物。2)将步骤(1)中获得的共混物用硬脂酸镁润滑,压实,施胶压制成片剂。实施例4:表4成分标签重量%干混富马酸替诺福韦二吡呋酯10%-40%恩曲他滨25%-40%胡椒碱0.1%–10%埃替拉韦10%-30%乳糖5%-40%胶体二氧化硅1%-10%微晶纤维素1%-15%交联羧甲基纤维素钠1%-10%硬脂酸镁1%-10%混合和润滑胶体二氧化硅1%-10%微晶纤维素1%-15%交联羧甲基纤维素钠1%-10%硬脂酸镁1%-10%薄膜包衣欧巴代1%-10%方法:1)将富马酸替诺福韦二吡呋酯、恩曲他滨、胡椒碱、埃替拉韦、乳糖、胶体二氧化硅、交联羧甲基纤维素钠和微晶纤维素干混,得到混合物。2)将步骤(1)中获得的共混物用硬脂酸镁润滑,压实,施胶压制成片剂。实施例5:表5方法:1)将dolutegravir钠盐、胡椒碱、甘露醇干混,将聚维酮溶于水中。2)将步骤(1)中得到的干混合物造粒,并将得到的颗粒研磨。3)将步骤(2)中获得的颗粒与甘露醇、羟基乙酸淀粉钠、微晶纤维素和胶体二氧化硅混合。4)将步骤(3)中得到的共混物用硬脂酰富马酸钠润滑,压缩并包衣。实施例6:表6方法:1)将达鲁那韦水合物、胡椒碱、微晶纤维素、交联聚维酮和胶体二氧化硅筛分并混合。2)将步骤(1)中获得的干混合物造粒并用硬脂酸镁润滑。3)将步骤(2)中获得的颗粒压缩并用欧巴代包衣。实施例7:表7方法:1)将达鲁那韦水合物、胡椒碱、聚维酮、微晶纤维素、交联聚维酮和胶体二氧化硅筛分并混合。2)将步骤(1)中获得的干混合物造粒并用硬脂酸镁润滑。3)将步骤(2)中获得的颗粒压缩并用欧巴代包衣。实施例8:表8序号成分数量/单位(mg)1darunavir乙酯50-6512胡椒碱5-3002硅化微晶纤维素10-5513胶体二氧化硅0-254交联聚维酮0.2-155硬脂酸镁0.1-10薄膜包衣7欧巴代5-508纯化水q.s.共计方法:1)将darunavir乙酯、胡椒碱、聚维酮、硅化微晶纤维素、交联聚维酮和胶体二氧化硅筛分并混合。2)将步骤(1)中获得的干混合物造粒并用硬脂酸镁润滑。3)将步骤(2)中获得的颗粒压缩并用欧巴代包衣。实施例9:表9方法:1)将darunavir乙酯、胡椒碱、羟丙基甲基纤维素、硅化微晶纤维素、交聚维酮和胶体二氧化硅筛分并混合。2)将步骤(1)中获得的干混合物造粒并用硬脂酸镁润滑。3)将步骤(2)中获得的颗粒压缩并用欧巴代包衣。实施例10:表10方法:1)将拉米夫定、微晶纤维素、交联羧甲基纤维素钠、预胶化淀粉和硬脂酸镁混合并压制成颗粒状物质。2)将富马酸替诺福韦二吡呋酯、胡椒碱、微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁混合并压制成颗粒状物质3)将微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁与步骤(1)和步骤(2)中获得的共混物混合并压制成具有密封包衣的片剂,然后进行薄膜包衣。实施例11:表11方法:1)将恩曲他滨、富马酸替诺福韦二吡呋酯、胡椒碱、乳糖一水合物、微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁混合并压制成颗粒状物质。2)将微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁混合并压制成颗粒状物质。3)将聚山梨醇酯80、聚维酮和乳糖溶解在水中。4)将利匹韦林加入到步骤(3)中获得的溶液中以形成浆液。5)将乳糖一水合物和交联聚维酮的干混合物加入到步骤(4)中获得的浆料中。6)将微晶纤维素、交联聚维酮和硬脂酸镁加入到步骤(5)中获得的干混物中。7)将步骤(1)中获得的共混物用步骤(6)中获得的共混物压制,以形成具有薄膜包衣的双层片剂。实施例12:表12方法:1)将恩曲他滨、富马酸替诺福韦二吡呋酯、胡椒碱、乳糖一水合物、微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁混合并混合以形成颗粒状物质。2)将微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁混合。3)将步骤(1)和步骤(2)中获得的共混物压缩并包衣以形成具有薄膜包衣的片剂。实施例13:表13方法:1)将恩曲他滨、富马酸替诺福韦二吡呋酯、胡椒碱、乳糖一水合物、微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁混合并混合以形成颗粒状物质。2)将微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁加入到步骤(1)中获得的共混物中并进一步混合。3)将依法韦仑、微晶纤维素和交联羧甲基纤维素钠加入到sls中,然后加入羟丙基纤维素以形成溶液并造粒。4)将乳糖一水合物和硬脂酸镁混合并压制,形成具有薄膜包衣的双层片剂。实施例14:表14方法:1)将拉米夫定、微晶纤维素、交联羧甲基纤维素钠、预胶化淀粉和硬脂酸镁混合以形成粒状物质。2)将富马酸替诺福韦二吡呋酯、胡椒碱、微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁混合以形成颗粒状物质。3)将微晶纤维素、交联羧甲基纤维素钠和硬脂酸镁与步骤(1)和步骤(2)中获得的共混物混合。4)将依法韦仑、微晶纤维素和交联羧甲基纤维素钠加入sls中,然后加入羟丙基纤维素以形成溶液并造粒。5)将乳糖一水合物和硬脂酸镁混合并压制以形成双层片剂,其具有密封包衣,然后进行薄膜包衣。为了更全面地理解本发明,提出了以下制备和测试方法。这些方法仅用于说明目的,不应被解释为以任何方式限制本发明的范围。制备和测试方法i)材料咖啡因(高渗透性标记物),阿替洛尔(低渗透性标记物),地高辛(已知的p-gp底物),tdf(md1431532),taf(vrd-1063/16/187),hbss缓冲液,mes水合物,hepes粉末,胎牛血清(fbs),最低必需培养基(mem),荧光黄,胡椒碱(p-gp抑制剂)方法1)caco-2细胞培养将caco-2细胞在含有10%血清的mem培养基中培养,并以75000个细胞/ml的密度接种,并在24孔反式孔板中于37℃,5%co2中培养21天。使用跨上皮电阻(transepithelialelectricresistance,teer)间歇地检查单层完整性(第0-21天)。细胞用药物处理如下:2)单向测定(a-b)储备制剂:在dmso中制备10mm的所有药物原液。根据平板图,在含有10mmmes水合物,ph6.8的hbss缓冲液中进一步制备测试浓度。此外,制备ph7.4的,具有10mmhepes的hbss缓冲液。研究计划板设置表15分析方案按照板设置一式两份的将在10mmmes水合物ph6.8中制备的0400μl样品加入到孔中至顶端,并将具有10mmhepesph7.4的800μlhbss加入到所有基孔(b)中。从基部侧在60、90和120分钟收集样品。从顶侧收集0和120分钟的质量平衡样品。在lcms-ms上分析样品。4)双向检测(a-b和b-a)研究胡椒碱(p-gp抑制剂)对渗透性的影响板计划表16分析方案按照板设置一式两份的将400μl样品加入到孔中至顶端,将800μlhbssph7.4加入基孔。从基部侧在60、90和120分钟收集样品。从顶侧收集0和120分钟的质量平衡样品。对于b-a,将一式两份的800μl各自的稀释液加入到基部侧,将400μlhbssph7.4加入顶侧。从顶侧在60、90和120分钟收集样品。从基部侧收集0和120分钟的质量平衡样品。在lcms-ms上分析样品。在实验结束时,使用路西法黄(luciferyellow)检查单层完整性,并通过用100μg/ml路西法(lucifer)孵育细胞来计算路西法黄的排斥%。5)数据分析:表观渗透率计算如下:可以通过使用以下等式计算以每秒为单位的表观渗透率(papp),对于单点法:papp=(v/(t*a))*(c0/ct)对于多点法:papp=(dq/dt)/(a*c0)质量平衡%=100-[cr120*vr+cd120*vd/c0*vd]对于路西法黄,路西法黄通过%=[rfu(实验)–rfu(空白)/rfu(平衡)–rfu(空白)]*100渗透性分类:表17渗透性papp(nm/s)低<50中50-200高>200流出比=pappb-a/pappa-b流出比≥2表明药物是p-gp底物。结果单向测定(图1)表18双向测定(图2)表19结论观察到tdf和taf是低至中等渗透性药物。此外,通过降低taf的流出比,taf吸收随胡椒碱增加。上述数据表明taf是外排转运蛋白的底物,因此其生物利用度低。从数据中可以看出,a-bpapp为34.49nm/s,其流出比为5.17。通过加入作为流出转运蛋白的已知抑制剂的胡椒碱,a-b,papp增加至超过282.66nm/s,而流出比降低至小于1.18。因此表明胡椒碱的添加改善了渗透性。因此,可以得出结论,胡椒碱的使用降低了流出比,这反过来会增加其生物利用度。ii)材料地高辛(已知的p-gp底物),dolutegravir(kk1406229),hbss缓冲液,mes水合物,hepes粉末,胎牛血清(fbs),最低必需培养基(mem),荧光黄,胡椒碱(p-gp抑制剂),cobicistat(p-gp抑制剂)。方法1)caco-2细胞培养将caco-2细胞在含有10%血清的mem培养基中培养,并以75000个细胞/ml的密度接种,并在24孔反式孔板中于37℃,5%co2下培养21天。使用跨上皮电阻(transepithelialelectricresistance,teer)间歇地检查单层完整性(第0-21天)。细胞用药物处理如下:双向检测(a-b和b-a)研究胡椒碱(p-gp抑制剂)对渗透性的影响板计划表20分析方案按照板设置一式两份的将400μl样品加入到孔中至顶端,将800μlhbssph7.4加入基孔。从基部侧在60、90和120分钟收集样品。从顶侧收集0和120分钟的质量平衡样品。对于b-a,将一式两份的800μl各自的稀释液加入到基部侧,将400μlhbssph7.4加入顶侧。从顶侧在60、90和120分钟收集样品。从基部侧收集0和120分钟的质量平衡样品。在lcms-ms上分析样品。在实验结束时,使用路西法黄(luciferyellow)检查单层完整性,并通过用100μg/ml路西法(lucifer)孵育细胞来计算路西法黄的排斥%。3)数据分析:表观渗透率计算如下:可以通过使用以下等式计算以每秒为单位的表观渗透率(papp),对于单点法:papp=(v/(t*a))*(c0/ct)对于多点法:papp=(dq/dt)/(a*c0)质量平衡%=100-[cr120*vr+cd120*vd/c0*vd]对于路西法黄,路西法黄通过%=[rfu(实验)–rfu(空白)/rfu(平衡)–rfu(空白)]*100渗透性分类:表21渗透性papp(nm/s)低<50中50-200高>200流出比=pappb-a/pappa-b流出比≥2表明药物是p-gp底物。结果双向测定(图3)表22结论dolutegravir是已知的p-gp底物。dolutegravir是一种高渗透性药物,胡椒碱不会影响dolutegravir穿过caco-2单层的渗透性。因此,可以得出结论,胡椒碱的使用降低了流出比,这反过来会增加其生物利用度。iii)材料地高辛(已知的p-gp底物),达鲁那韦(dn0011215),hbss缓冲液,mes水合物,hepes粉末,胎牛血清(fbs),最低必需培养基(mem),荧光黄,胡椒碱(p-gp抑制剂),cobicistat(p-gp抑制剂)方法1)caco-2细胞培养将caco-2细胞在含有10%血清的mem培养基中培养,并以75000个细胞/ml的密度接种,并在24孔反式孔板中于37℃,5%co2下培养21天。使用跨上皮电阻(transepithelialelectricresistance,teer)间歇地检查单层完整性(第0-21天)。细胞用药物处理如下:2.)双向检测(a-b和b-a)研究胡椒碱(p-gp抑制剂)对渗透性的影响板计划表23分析方案按照板设置一式两份的将400μl样品加入到孔中至顶端,将800μlhbssph7.4加入基孔。从基部侧在60、90和120分钟收集样品。从顶侧收集0和120分钟的质量平衡样品。对于b-a,将一式两份的800μl各自的稀释液加入到基部侧,将400μlhbssph7.4加入顶侧。从顶侧在60、90和120分钟收集样品。从基部侧收集0和120分钟的质量平衡样品。在lcms-ms上分析样品。在实验结束时,使用路西法黄(luciferyellow)检查单层完整性,并通过用100μg/ml路西法(lucifer)孵育细胞来计算路西法黄的排斥%。3.)数据分析:表观渗透率计算如下:可以通过使用以下等式计算以每秒为单位的表观渗透率(papp),对于单点法:papp=(v/(t*a))*(c0/ct)对于多点法:papp=(dq/dt)/(a*c0)质量平衡%=100-[cr120*vr+cd120*vd/c0*vd]对于路西法黄,路西法黄通过%=[rfu(实验)–rfu(空白)/rfu(平衡)–rfu(空白)]*100渗透性分类:表24渗透性papp(nm/s)低<50中50-200高>200流出比=pappb-a/pappa-b流出比≥2表明药物是p-gp底物。结果双向测定(图4)表25结论darunavir是一种已知的p-gp底物。通过降低taf的流出比,达鲁那韦的吸收随胡椒碱增加。因此,可以得出结论,胡椒碱的使用降低了流出比,这反过来会增加其生物利用度。iv)材料地高辛(已知的p-gp底物),tdf,hbss缓冲液,mes水合物,hepes粉末,胎牛血清(fbs),最低必需培养基(mem),荧光黄,胡椒碱(p-gp抑制剂),cobicistat(p-gp抑制剂),四氢胡椒碱(p-gp抑制剂)方法1)caco-2细胞培养将caco-2细胞在含有10%血清的mem培养基中培养,并以75000个细胞/ml的密度接种,并在24孔反式孔板中于37℃,5%co2下培养21天。使用跨上皮电阻(transepithelialelectricresistance,teer)间歇地检查单层完整性(第0-21天)。细胞用药物处理如下:2.)双向检测(a-b和b-a)研究胡椒碱(p-gp抑制剂)和四氢胡椒碱对渗透性的影响板计划表26分析方案按照板设置一式两份的将400μl样品加入到孔中至顶端,将800μlhbssph7.4加入基孔。从基部侧在60、90和120分钟收集样品。从顶侧收集0和120分钟的质量平衡样品。对于b-a,将一式两份的800μl各自的稀释液加入到基部侧,将400μlhbssph7.4加入顶侧。从顶侧在60、90和120分钟收集样品。从基部侧收集0和120分钟的质量平衡样品。在lcms-ms上分析样品。在实验结束时,使用路西法黄(luciferyellow)检查单层完整性,并通过用100μg/ml路西法(lucifer)孵育细胞来计算路西法黄的排斥%。3.)数据分析:表观渗透率计算如下:可以通过使用以下等式计算以每秒为单位的表观渗透率(papp),对于单点法:papp=(v/(t*a))*(c0/ct)对于多点法:papp=(dq/dt)/(a*c0)质量平衡%=100-[cr120*vr+cd120*vd/c0*vd]对于路西法黄,路西法黄通过%=[rfu(实验)–rfu(空白)/rfu(平衡)–rfu(空白)]*100渗透性分类:表27渗透性papp(nm/s)低<50中50-200高>200流出比=pappb-a/pappa-b流出比≥2表明药物是p-gp底物。结果:双向测定(图5)表28结论tdf是已知的p-gp底物。通过降低流出比,tdf的吸收随胡椒碱增加。此外,通过降低流出比,tdf的吸收随四氢胡椒碱增加。胡椒碱和四氢胡椒碱均观察到tdf渗透性的可比较的改善。因此,可以得出结论,胡椒碱和四氢胡椒碱的使用降低了流出比,这反过来会增加其生物利用度。动物研究体内大鼠pk研究该非glp研究的目的是确定单剂量静脉内给药和口服给药后不同组雄性wistar大鼠tdf单独和与胡椒碱组合的药代动力学。该研究是根据印度动物实验控制和监督委员会(committeeforthepurposeofcontrolandsupervisionofexperimentsonanimals,cpcsea)的要求,在机构动物伦理委员会(institutionalanimalethicscommittee,iaec)批准后进行的。研究设计如下表30所示,使用每组中的6只雄性wistar大鼠进行研究。表29配方制备溶液配方如下制备:静脉途径:称量所需量的化合物b(tdf)(23.03mg),向其中加入10.94ml媒介物(生理盐水),涡旋并超声处理2分钟,得到澄清的制剂。按口服途径:对于第2组:称量所需量的化合物b(79.37mg),向其中加入9.42ml媒介物(羧甲基纤维素钠),涡旋并超声处理2分钟,得到6.2mg/ml浓度的制剂。对于第3组:称量所需量的化合物b(46.14mg),向其中加入10.95ml媒介物(羧甲基纤维素钠),涡旋并超声处理2分钟以制备均匀的制剂。对于第4组:称量所需量的化合物b(79.56mg),向其中加入4.72ml媒介物(羧甲基纤维素钠),涡旋并超声处理2分钟,得到澄清的制剂。称量所需量的化合物b1(胡椒碱)(18.95mg),向其中加入22.71ml媒介物(羧甲基纤维素钠),涡旋并超声处理2分钟,得到澄清的制剂。将等体积(4.72ml)的每种制剂在分开的小瓶中混合,得到5ml/kg。对于第5组:称量所需量的化合物b(47.20mg)和化合物b1(18.95mg),向其中加入5.61ml媒介物(羧甲基纤维素钠),涡旋并超声处理2分钟,得到澄清的制剂。将等体积(5.61ml)的每种制剂在分开的小瓶中混合,得到5ml/kg。生物分析使用适合目的的lc-ms/ms方法进行生物分析,以定量大鼠血浆样品中的tdf和pmpa。该方法的校准曲线(cc)由九个非零校准标准品以及双空白和零标准样品组成。药代动力学分析血浆药代动力学参数使用phoenix软件(6.3版本)的非隔室分析工具计算,并从每组中的个体动物测定。峰值血浆浓度(cmax)、达到峰值血浆浓度的时间(tmax)、血浆浓度-时间曲线下面积(auc0-t和aucinf)、额外的auc(%)、消除半衰期(t1/2)、清除(cl)、分布容积vd(l/kg)和平均停留时间(mrt)由静脉组计算。从口服组计算峰值血浆浓度(cmax)、达到峰值血浆浓度的时间(tmax)、auc0-t和aucinf、额外的auc(%)、平均停留时间(mrt)和绝对口服生物利用度(f)。结果在雄性wistar大鼠中静脉内和口服施用tdf后,pmpa的血浆浓度-时间数据和血浆药代动力学参数列于表31中。表30图6和7显示在不同时间点对于tdf300mg和tdf300mg+胡椒碱20mg,替诺福韦的血浆浓度。表31:不同组合的cmax、tmax和auc值图8显示对于300mgtdf、300mgtdf+20mg胡椒碱和150mgtdf+20mg胡椒碱,替诺福韦的时间依赖性血浆浓度。结论大鼠pk研究清楚地表明,当tdf与胡椒碱组合施用时,替诺福韦的峰值血浆浓度显著增加。结果表明,与单独使用tdf300mg相比(34.39±6.07),当150mg的tdf与20mg胡椒碱一起施用时(52.48±13.48),生物利用度显著提高。所附权利要求的组合物和方法的范围不受本文所述的具体组合物和方法的限制,这些组合物和方法旨在说明权利要求的一些方面,并且功能上等同的任何组合物和方法都属于本发明的范围。除了本文所示和所述的那些之外,组合物和方法的各种修改旨在落入所附权利要求的范围内。此外,虽然仅具体描述了本文公开的某些代表性组合物和方法步骤,但组合物和方法步骤的其他组合也旨在落入所附权利要求的范围内,即使没有具体叙述。因此,本文可明确提及步骤、元件、组件或组件的组合,然而,包括步骤、元件、组件和组件的其它组合即使未明确说明也包括在内。本文使用的术语“包含”及其变体与术语“包括”及其变体同义使用,并且是开放的、非限制性的术语。尽管这里使用术语“包含”和“包括”来描述各种实施例,但是可以使用术语“基本上由......组成”和“由......组成”来代替“包含”和“包括”以提供本发明更具体的实施例并且也公开了。除了在实施例中或另有说明之外,在说明书和权利要求中使用的表示成分的量,反应条件等的所有数字应至少被理解为根据有效数字的数量和普通的舍入方法来解释,而不是试图限制权利要求范围的等同原则的应用。本公开中引用的所有专利和非专利出版物在此并入,其程度如同那些专利和非专利出版物中的每一个通过引用整体并入本文。此外,即使已经参考特定实施方案和实施例描述了本文的公开内容,但是应该理解,这些实施方案和实施例仅仅是对本公开的原理和应用的说明。因此,应当理解,可以对说明性实施例进行多种修改,并且可以设计不脱离由所附权利要求限定的本公开的精神和范围的其他布置。对于本领域技术人员显而易见的是,在不脱离本文的教导的精神或范围的情况下,可以对本文描述的各种实施方案进行各种修改和变化。因此,各种实施例旨在覆盖本教导的范围内的各种实施例的其他修改和变化。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1