用于癌症免疫疗法的受体选择性类视黄醇和rexinoid化合物和免疫调节剂的制作方法
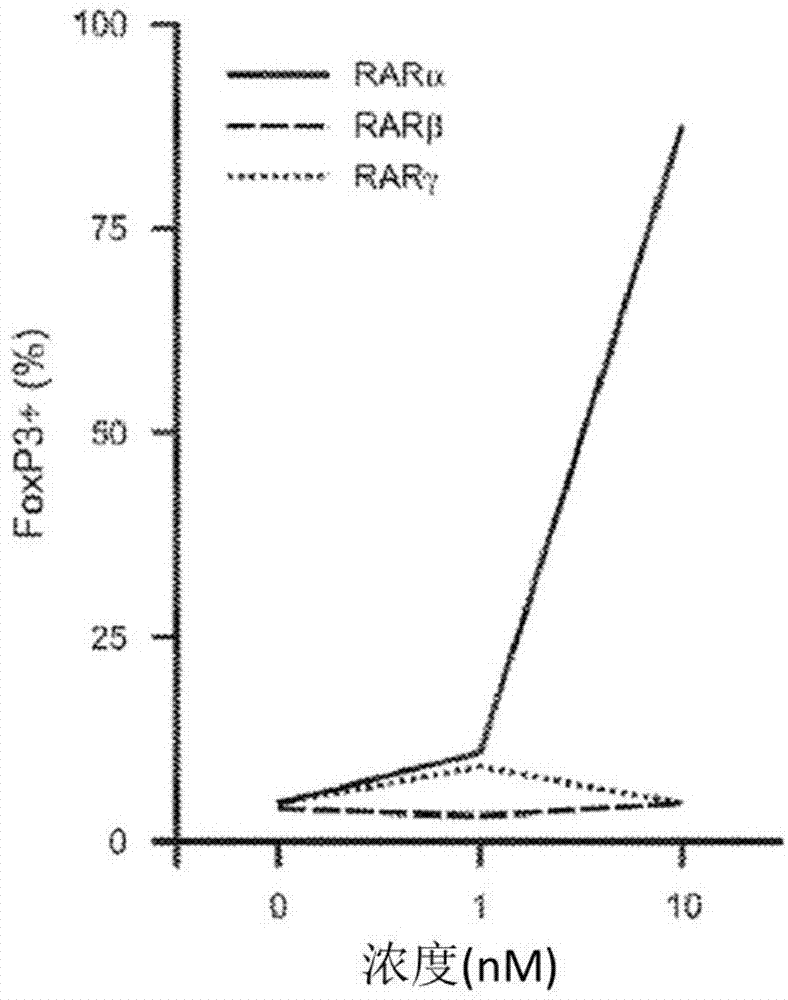
免疫监视系统为宿主提供针对外来抗原的防御,但也限制针对自身抗原的活性,从而预防自身免疫疾病。细胞表面免疫检查点分子是免疫应答的内源调节剂,其通过启用共抑制信号传导途径来限制自身免疫。免疫检查点途径在肿瘤生长中是重要的,其导致t细胞损耗并且允许肿瘤逃避免疫监视并使得肿瘤生长得以不受控制。可以设计诸如单克隆抗体(mab)的分子以靶向免疫检查点,并且此类分子可以拮抗共抑制性免疫途径,恢复免疫监视并产生抗肿瘤免疫应答。此外,免疫疗法的完全抗肿瘤作用仅在它们与其他化合物组合使用时才能够得到,所述化合物能够通过调节免疫途径克服发展到免疫疗法的抗性。技术实现要素:本申请公开了用于增强免疫检查点靶向治疗的化合物。作用于视黄酸受体(rar)和类视黄醇x受体(rxr)的化合物增强免疫检查点靶向剂的活性。因此,本申请提供了治疗癌症的方法,所述方法包括施用至少一种免疫检查点抑制剂和至少一种类视黄醇活性剂或rexinoid活性剂(统称为rar/rxr活性剂)。本申请还提供了至少一种rxr和/或rar活性剂和至少一种免疫检查点抑制剂在治疗疾病中的用途。在一些实施方式中,类视黄醇活性剂是视黄酸受体(rar)活性剂。在一些实施方式中,rexinoid活性剂是类视黄醇x受体(rxr)活性剂。在一些实施方式中,使用两种rar/rxr活性剂;它们可以是两种rar活性剂,两种rxr活性剂,或一种rar活性剂和一种rxr活性剂。在一些实施方式中,所述rar/rxr活性剂充当其受体的激动剂,而在其他实施方式中,所述rar/rxr活性剂充当其受体的拮抗剂。在利用多种rar/rxr活性剂的一些实施方式中,多种rar/rxr活性剂分开配制和施用。在这些实施方式的一些方面,所述rar/rxr活性剂分开施用,但在相同的治疗期施用。在这些实施方式的其他方面,rar/rxr活性剂在不同的治疗期中施用。在其他实施方式中,多种rar/rxr活性剂分开配制,但共同施用(即,在相同的治疗期施用)。在其他实施方式中,多种rar/rxr活性剂一起配制成单一的常用药物。在许多实施方式中,免疫检查点抑制剂是抗体或其他多肽分子。最典型地,这种分子是胃肠外给药的。相反,rar/rxr活性剂是可以口服给药的小分子,例如丸剂或胶囊剂等。因此,rar/rxr活性剂和免疫检查点抑制剂可以按照独立的时间表施用。在一些实施方式中,所述免疫检查点抑制剂与ctla-4、pd-1、tim-3、lag-3、pd-l1配体、b7-h3、b7-h4、btla、icos或ox40种的至少一种相互作用。在一些实施方式中,所述免疫检查点抑制剂是ctla-4、pd-1、tim-3、lag-3、pd-l1配体、b7-h3、b7-h4、btla、icos或ox40中的至少一种的特异性抗体。在一些实施方式中,所述类视黄醇活性剂是rarα拮抗剂。在一些实施方式中,所述rarα拮抗剂是通式(i)的化合物:其中r1、r2、r3和r6各自独立地为h或c1-6烷基;r4和r5各自独立地为h或f;ar为苯基、吡啶基、噻吩基、呋喃基或萘基;x为c(ch3)2、o、s、或nr7,其中r7为h或c1-6烷基;x1为h或卤素例如f、cl或b;r8为h或oh。在一些实施方式中,所述rarα拮抗剂是agn194301、agn193491、agn193618、agn194202或agn194574。在一些实施方式中,所述rarα拮抗剂是通式(ii)的化合物:其中,r1和r2各自独立地为c1-6烷基;x为o、s或ch2;y为o、s、ch2、或nr3,其中r3为c1-6烷基;z为cl或br;w为h或oh;u各自独立地为h或f。在一些实施方式,所述rarα拮抗剂为:在一些实施方式中,所述rarα拮抗剂是通式(iii)的化合物:其中,r1和r2各自独立地为h或c1-6烷基;r3为h或f;ar为苯基、吡啶基、噻吩基、呋喃基或萘基;x为o、s、n或ch2;w为h或oh;z为cl或br。在一些实施方式中,所述rarα拮抗剂为:在一些实施方式中,所述rarα拮抗剂为bms185411、bms614、ro41-5253或ro46-5471。在一些实施方式中,所述类视黄醇活性剂为rar激动剂。在一些实施方式中,所述rar激动剂为:在一些实施方式中,所述rar激动剂是通式(iv)的rarγ选择性激动剂:其中,r1和r2各自独立地为h或c1-6烷基;r3为h或f;以及x为o、s、ch2、c(r4)2或nr5,其中r4和r5各自独立地为h或c1-6烷基。在一些实施方式中,所述rar激动剂是选自cd437、cd2325、cd666、ly2813631和bms961的rarγ选择性激动剂。在一些实施方式中,所述类视黄醇活性剂是rxr拮抗剂。在一些实施方式中,所述rxr拮抗剂是:在一些实施方式中,所述rxr拮抗剂是agn195393或lgn100849。在一些实施方式中,所述用途或方法包括另外施用至少一种癌症化疗剂。在一些实施方式中,所述用途或方法包括施用至少两种类视黄醇活性剂。在一些实施方式中,所述两种类视黄醇活性剂是rarα拮抗剂和rarγ激动剂。附图说明图1a-c显示rar受体特异性激动剂调节foxp3、α4β7和ccr9表达。将纯化的cd4+cd25-foxp3-细胞在具有指定浓度的每种rar激动剂的培养基中培养,并通过流式细胞术分析总cd4t细胞中的foxp3(图1a)、α4β7(图1b)和ccr9(图1c)的表达。foxp3结果代表3次独立实验。ccr9和α4β7结果代表多个实验。图2显示化合物5183使用反式激活测定法激活rarα、rarβ和rarγ的转录的程度。图3a-b显示rxr特异性激动剂irx4204促进foxp3+treg细胞形成及抑制th17细胞形成的程度。详细描述本文公开了用于增强免疫检查点靶向治疗的化合物。作用于视黄酸受体(rar)和类视黄醇x受体(rxr)的化合物增强免疫检查点靶向剂的活性。通过增强意味着当rar/rxr活性剂与免疫检查点靶向剂一起使用相比rar/rxr活性剂不与免疫检查点靶向剂一起使用,免疫检查点靶向剂具有更大和/或更快的作用,或者,类似地,相比不使用rar/rxr活性剂,当使用rar/rxr活性剂时给定的效果可以使用较小剂量或浓度的免疫检查点靶向剂获得。在较高药理学浓度下,视黄酸(ra)通过增加抑制性cd4+调节性t细胞(treg细胞)的水平而引起抗炎作用。ra通过增强转录因子foxp3的表达来影响该功能,foxp3是treg细胞分化的主要调节因子。ra还降低促炎th17细胞的水平。ra通过激活视黄酸受体的rarα亚型引发这些作用。ra或rarα选择性激动剂的上述功能使得这些化合物有助于肿瘤对免疫疗法的抗性。抑制性treg细胞水平的增加阻碍了免疫疗法产生的t细胞的抗肿瘤活性。rarα激动剂也减少了攻击肿瘤的t细胞补体,因为它降低了th17细胞的水平。相反,rarα的拮抗剂使肿瘤对免疫疗法敏感,因为rarα拮抗剂降低抑制性treg细胞的水平并且还增加效应子th17细胞的水平。因此,在本申请公开的一个实施方式中,用一种或多种免疫检查点靶向剂与rarα拮抗剂的组合治疗靶癌症。在ra功能的另一个方面,已经显示ra的生理浓度对于t细胞介导的免疫应答的发展是关键的。向t细胞的ra信号传导是cd4+t细胞效应子功能的关键早期介质。使用表达显性阴性的rarα(dnrarα)的t细胞,消除rar功能的修饰的rarα或rar拮抗剂,已显示通过rarα的ra信号传导是t细胞介导的功能,例如皮肤移植物排斥所必需的。因此,在癌症免疫治疗的背景下,使用rarα拮抗剂或rarα反向激动剂与免疫检查点靶向剂组合具有抵消作用:它可以通过降低抑制性treg细胞的水平来促进抗肿瘤作用,但是这样的拮抗剂也可以通过阻断cd4+t细胞效应子功能来减少抗肿瘤作用。在这种情况下,rarα拮抗剂与癌症免疫疗法组合使用可能价值有限,甚至可能是有害的。在本申请公开的另一个实施方式中,对t细胞介导的免疫应答的发展至关重要的ra信号传导由rarγ介导。在上述情况中,仅用rarα拮抗剂与癌症免疫疗法结合将仅导致抑制性treg细胞的减少,并因此导致免疫疗法的抗肿瘤作用的有限增强。然而,该方法没有利用ra或其他通过rarγ作用的rar激动剂对促进cd4+t细胞效应子功能的早期作用以及共同施用癌症免疫疗法对抗肿瘤作用的潜在实质性增强作用。因此,通过rarγ特异性起作用的rar激动剂将促进cd4+t细胞效应子功能而不增加treg细胞,并且这种rarγ选择性激动剂将显著增强癌症免疫疗法的抗肿瘤作用。在另一个实施方式中,癌症免疫疗法与rarα拮抗剂和rarγ激动剂的组合一起治疗肿瘤。在这种情况下,类视黄醇化合物将通过以下机制增强免疫疗法的抗肿瘤活性:rarγ激动剂将促进由免疫检查点阻滞剂释放的强大的cd4+t细胞介导的免疫应答的发展;rarα拮抗剂将降低抑制性treg细胞的水平并维持th17细胞的水平,从而最小化免疫疗法的抗肿瘤作用的调节。在另一个实施方式中,rxr拮抗剂促进抑制性treg细胞的形成并抑制效应子th17细胞的形成。将rxr拮抗剂(或反向激动剂)与癌症免疫疗法组合使用将通过减少抑制性treg细胞的形成和通过增加th17效应子细胞的水平来增强抗肿瘤活性。总之,以下类别的化合物可以组合使用以增加癌症免疫疗法的抗肿瘤活性:rarα拮抗剂,rarγ激动剂和rxr拮抗剂。在本申请公开的方法中,在有或没有其它药物的情况下,一种或多种免疫检查点靶向分子(例如,抗-ctla-4抗体、抗-pd1/pd-l1抗体)与一种或多种rar/rxr活性剂(例如,rarα拮抗剂、rarγ激动剂、rxr拮抗剂)组合施用用于治疗某些癌症。rarα拮抗作用和rarγ激动作用的特性可以一起存在于同一分子中。因此,相同的分子在rarα中作为拮抗剂可以减少treg细胞形成,同时,在rarγ中作为激动剂,进一步减少treg细胞形成并促进cd4+t细胞效应子功能。以相同的方式,rxr拮抗作用的特性可以分别与不同分子中rarα拮抗作用或rarγ激动作用的特性组合。如本文所用,术语“类视黄醇活性剂”包括但不限于,任何作用于rar的化合物。类视黄醇活性剂的非限制性实例是rarα拮抗剂和rarγ激动剂。如本文所用,术语“rexinoid活性剂”包括但不限于,任何作用于rxr的化合物。rexinoid活性剂的非限制性实例是rxr拮抗剂。如本文所用的术语“激动剂”应理解为意指与受体结合并激活它,产生基因转录和随后的药理学反应(例如,收缩、松弛、分泌、酶活化等)的化合物。如本文所用,术语“rarγ激动剂”是指相比与另一分子(例如不同的rar)相结合,以更高亲和力与rarγ结合的化合物。在示例性实施方式中,相比rarα和/或rarβ,rarγ激动剂对rarγ具有选择性。因此,rar选择性激动剂倾向于以高的结合亲和力与特定rar受体靶结合。如本文所用,术语“激动剂”包括选择性激动剂。如本文所用的术语“拮抗剂”是指通过与激动剂相同的位点结合但不激活受体来减弱激动剂的作用的化合物。拮抗剂本身不会影响未被占据的受体的基因转录活性。通常,rarα拮抗剂是抑制rarα激动剂活性的化学试剂。如本文所用,术语“rxr拮抗剂”是指与rxr结合并且不激活它,而是拮抗由rxr激动剂产生的转录的化合物。如本文所用,术语“拮抗剂”包括选择性拮抗剂。如本文所用的术语“反向激动剂”应理解为意指产生与激动剂相反的作用但作用于相同受体的化合物。反向激动剂本身将降低未占据受体的基础基因转录活性。rarα拮抗剂在某些实施方式中,rarα选择性拮抗剂是由通式(i)表示的化合物:其中,r1、r2、r3和r6各自独立地为h或c1-6烷基;r4和r5各自独立地为h或f;ar为苯基、吡啶基、噻吩基、呋喃基或萘基;x为c(ch3)2、o、s或nr7,其中r7为h或c1-6烷基;x1为h或卤素,例如f、cl或br;以及r8为h或oh。通式(i)的rarα选择性拮抗剂的示例为化合物agn194301:通式(i)的一般类别的其他示例性rarα拮抗剂包括但不限于agn193491、agn193618、agn194202、agn193625和agn194574。在其他实施方式中,rarα选择性激动剂是通式(ii)代表的一类化合物的成员,其中,r1和r2各自独立地为c1-6烷基;x为o、s或ch2;y为o、s、ch2或nr3,其中r3为c1-6烷基;z为cl或br;w为h或oh;u独立为h或f。用于本文公开的方法的由通式(ii)表示的一类的示例性rarα选择性拮抗剂由以下结构(vtp196696)表示:在其他实施方式中,rarα选择性拮抗剂是通式(iii)的化合物,其中r1和r2各自独立地为h或c1-6烷基;r3为h或f;ar为苯基、吡啶基、噻吩基、呋喃基或萘基;x为o、s、n、或ch2;w为h或oh;z为cl或br。通式(iii)的示例性化合物是agn194777。其他示例性rarα拮抗剂包括但不限于,bms185411、bms614、ro41-5253和ro46-5471。其他的rar拮抗剂或反向激动剂描述在美国专利6037488、5612356、5776699、5958954、5877207、6225494、6455701、5723666、5739338和5919970以及美国专利申请2009/0176862中,所有这些专利中公开的rar拮抗剂的所有内容均通过引用并入本文。rarγ激动剂示例性rar激动剂公开在美国专利5234926、4326055、5324840、5824685和6452032中,包括但不限于以下化合物。另一种rar激动剂的示例为agn190168。尽管诸如agn190183、agn190205、agn190168(他扎罗汀)的化合物是rarγ激动剂,但它们不具有rarγ选择性,因为它们也激活rarα和/或rarβ。优选使用rarγ选择性激动剂,因为rarα的激活将通过增加treg细胞的产生来抵消rarγ激活产生的t效应细胞激活作用,从而抑制免疫检查点靶向剂的抗肿瘤作用。另一方面,rarγ选择性激动剂将增强癌症免疫治疗剂的抗肿瘤作用。高选择性rarγ激动剂的实例是化合物agn204647(irx4647):其他rarγ选择性激动剂是通式(iv)化合物家族的成员:其中r1和r2各自独立地为h或c1-6烷基;r3为h或f;x为o、s、ch2、c(r4)2或nr5,其中r4和r5各自独立地为h或c1-6烷基。其他的rarγ选择性激动剂包括但不限于cd437、cd2325、cd666、ly2813631和bms961。其他的rarγ激动剂描述在国际公布wo02/28810a2中,其公开的所有关于rarγ激动剂的内容通过引用并入本文。rxr拮抗剂示例性rxr拮抗剂包括但不限于agn195393、lgn100849、hx531、lg100754、pa451、pa452和uvi3003。免疫检查点靶向癌症治疗免疫检查点疗法靶向t细胞分化和活化中的调节途径,以通过这些检查点促进t细胞发育过程通道,从而可以实现抗肿瘤(或其他治疗)活性。引起免疫检查点治疗的药剂通常被称为免疫检查点抑制剂,并且应该理解的是,t细胞发育的检查受到抑制。因此,虽然许多免疫检查点抑制剂也抑制受体-配体对(例如,抗-pd-1,抗-pd-l1和ctla-4)的相互作用,但其他(如抗-ox40和抗-icos)则作为释放或抑制t细胞发育检查的靶标的激动剂起作用,最终促进效应子功能和/或抑制调节功能。本文公开了类视黄醇和rexinoid受体活性分子(rar/rxr活性剂)作为免疫检查点抑制剂分子的抗肿瘤作用的增效剂的用途。抑制免疫检查点蛋白质的分子包括对pd-1、pd-1配体、ctla-4、tim-3、lag-3、b7-h3和b7-h4中的一种或多种特异的抗体。程序性死亡-1(pd-1)是t细胞上的检查点蛋白,并且通常作为一种“关闭开关”起作用,其有助于防止t细胞攻击体内的其他细胞。它通过与程序性死亡配体-1(pd-l1)结合来实现这一点,pd-l1是一些正常细胞和癌细胞上的蛋白质。当pd-1与pd-l1结合时,t细胞不会攻击靶细胞。一些癌细胞含有大量的pd-l1,这有助于它们逃避免疫攻击。靶向pd-1或pd-l1的单克隆抗体可以增强针对癌细胞的免疫应答,并且在治疗某些癌症方面显示出很大的希望。靶向pd-1/pl-l1的单克隆抗体的实例包括:抗pd-1mabs单抗(bristol-myerssquibb)和派姆单抗(pembrolizumab)(merck&co.),bms-936559(bristol-myerssquibb),pidilizumab(medivation):和抗pd-l1mabsdurvalumab(medi4736,imfinzitm,medimmune),atezolizumab(mpdl3280a;hoffman-laroche),avelumab(emdserono)。这些抗体在治疗多种癌症中具有不同的用途,包括恶性黑素瘤(mm)、肾细胞癌(rcc)、merkel细胞癌、尿路上皮癌和非小细胞肺癌(nsclc)。还开发了pd-1/pd-11相互作用的非抗体抑制剂;例如,基于stefina的小工程蛋白(称为分子)。除pd-l1外,pd-1还可与pd-l2结合。除pd-1外,pd-l1还可与b7-1(cd80)结合。ctla-4是在cd4和cd8t细胞表面以及在cd25+,foxp3+t调节(treg)细胞上表达的免疫检查点分子。ctla-4产生抑制t细胞反应并使肿瘤生长的抑制信号。抗-ctla-4mabs如易普利姆玛(bristol-myerssquibb)引起动物模型中肿瘤的收缩。易普利姆玛可改善mm患者的总体生存率,并被批准用于治疗mm。在rcc和nsclc中也观察到了反应。其他抗-ctla-4抗体的示例包括tremelimumab(medimmune)。ctla-4-阻断抗体易普利姆玛仅在黑素瘤患者亚组中产生持久反应,并且其对总体存活的影响是有限的。这使得人们寻找ctla-4阻断的抗性机制并确定细胞溶质酶吲哚胺2,3-双加氧酶(ido)作为黑素瘤抗性的有效介质。ido直接抑制效应子t细胞并激活抑制性treg细胞,从而调节ctla-4阻断的抗肿瘤作用。ido的抑制剂如1-甲基-色氨酸具有t细胞依赖性抗肿瘤作用,并与ctla-4-阻断抗体协同作用以控制肿瘤生长并提高生存率。tim-3(t细胞免疫球蛋白粘蛋白分子,tcellimmunoglobulindomainandmucindomain-3)是在产生ifn-γ的cd4+t辅助细胞1(th1)和cd8+t细胞毒素1(tc1)t细胞上选择性表达的分子。tim-3是一种免疫检查点受体,其功能是特异性地限制th1和tc1t细胞应答的持续时间和程度。tim-3的抗体的示例公开在美国专利申请公开20160075783中,其包含关于抗tim-3抗体的全部内容通过引用并入本文。lag-3(淋巴细胞活化基因3;cd223)以与ctla-4和pd-1类似的方式负调节t细胞的细胞增殖、活化和体内稳态,并在treg抑制功能中起作用。lag-3的抗体的示例包括gsk2831781(glaxosmithkline),bms-986016(bristol-myerssquibb)和美国专利申请公开2011/0150892中公开的抗体,其包含关于抗lag-3抗体的全部内容通过引用并入本文。b7家族是共刺激蛋白家族,其在抗原呈递细胞的表面上表达并与t细胞上的配体相互作用。b7-h3(cd276)是该家族中的分子之一。b7-h3的抗体,enoblituzumab(emplicititm,bristol-myerssquibb)被批准用于治疗多发性骨髓瘤。该家族中的另一种分子是b7-h4(含有v-结构域的t细胞活化抑制剂1),针对该分子的抗体正在开发中。其他免疫检查点抑制剂靶标,b细胞和t细胞弱化子(btla),诱导型t细胞共刺激分子(icos),ox40(肿瘤坏死因子受体超家族,成员4)等可能在所公开的方法中有用。处于早期癌症临床试验中的几种抗ox40激动性单克隆抗体包括medi0562和medi6469(medimmune),moxr0916(genetech)和pf-04518600(pfizer);作为抗icos激动剂抗体,jtx-2011(jouncetherapeutics)。本申请公开了增强免疫检查点靶向免疫治疗剂的抗癌活性的方法,所述免疫治疗剂包括ctla-4抑制剂,pd-1抑制剂,tim-3抑制剂,lag-3抑制剂,pd-1配体(例如pdl-1),pd-1配体的抑制剂,ox40激动剂,icos激动剂,b7-h3蛋白,b7-h3蛋白的抑制剂,b7-h4蛋白和b7-h4蛋白的抑制剂。在一些实施方式中,抑制剂是抗体。所述免疫检查点靶向免疫治疗性抗体可以是完整抗体或抗体片段。术语“抗体的片段”、“抗体片段”和“抗体的功能片段”在本文中可互换使用,意指保留特异性结合抗原的能力的抗体的一个或多个片段。抗体片段理想地包含,例如,一个或多个互补决定区(cdrs)、可变区(或其部分)、恒定区(或其部分)、或其组合。抗体片段的实例包括但不限于,fab片段,其是由vl、vh、cl和ch1结构域组成的单价片段;f(ab')2片段,其是包含两个fab片段的二价片段,所述fab片段通过铰链区处的二硫键连接;由抗体单臂的vl和vh结构域组成的fv片段;单链fv,其中vl和vh结构域通过肽接头序列连接;fab'片段,其通过使用温和还原条件破坏f(ab')2片段的二硫键而产生;二硫键稳定的fv片段(dsfv);和结构域抗体(dab),其是特异性结合抗原的抗体单可变区结构域(vh或vl)多肽。在替代的实施方式中,抗体被另一种类似地结合免疫检查点靶分子的蛋白质替换。在一些情况下,这些非抗体分子包含免疫检查点靶分子的配体或结合配偶体的细胞外部分,即,至少介导与免疫检查点靶分子结合所需的细胞外部分。在一些实施方式中,配体的这种细胞外结合部分与融合蛋白中的另外的多肽连接。在一些实施方式中,另外的多肽包含抗体的fc或恒定区。治疗方法本申请提供了通过施用免疫检查点分子的抗体(或其他有结合能力的多肽)和一种或多种rar/rxr活性剂来治疗哺乳动物癌症的方法。其他实施方式涉及包含用于治疗癌症和用于制备用于治疗癌症的药物的试剂的组合物。应当理解,所使用的多种药剂可以以单独的组合物或药剂提供,其可以通过单独的给药途径和/或在不同的时间给药;尽管如此,这种多种组合物或药物的使用是协调的,以便使它们所施予的患者得到多种药剂的组合、相互作用的益处。在一些实施方式中,该方法包括施用免疫检查点抑制剂和rar活性剂。在一些实施方式中,该方法包括施用免疫检查点抑制剂和rarα拮抗剂。在一些实施方式中,该方法包括施用免疫检查点抑制剂和rarγ激动剂。在一些实施方式中,该方法包括施用免疫检查点抑制剂和两种rar活性剂。在一些实施方式中,该方法包括施用免疫检查点抑制剂和一种rarα拮抗剂和一种rar激动剂。在一些实施方式中,该方法包括给予免疫检查点抑制剂和一种rarα拮抗剂和一种rarγ选择性激动剂。在一些实施方式中,rarα拮抗剂是agn194301、agn193491、agn193618、agn194202、agn194574、vtp196696、agn19477、bms185411、bms614、ro41-5253或ro46-5471。在一些实施方式中,rar激动剂是agn190183、agn190205、afn204647或他扎罗汀。在一些实施方式中,rarγ选择性激动剂是cd437、cd2325、cd666,ly2813631或bms961。在一些实施方式中,该方法包括施用免疫检查点抑制剂和rxr活性剂。在一些实施方式中,该方法包括施用免疫检查点抑制剂和rxr拮抗剂。在一些实施方式中,所述rxr拮抗剂是agn195393或lgn100849。所公开的方法可用于治疗本领域已知的任何类型的癌症、例如黑素瘤、肾细胞癌、肺癌、膀胱癌、乳腺癌、宫颈癌、结肠癌、胆囊癌、喉癌、肝癌、甲状腺癌、胃癌、唾液腺癌、前列腺癌、胰腺癌或梅克尔细胞癌。在选择的实施方式中,治疗特定类型的癌症。在其他选择的实施方式中,特定类型的癌症排除在治疗之外。如本文所用,术语“治疗”,“治疗”等是指获得所需的药理学和/或生理学作用。优选地,该效果是治疗性的,即该效果部分或完全治愈由该疾病引起的疾病和/或不良症状。“治疗有效量”是指在必要的剂量和时间段内,有效实现所需治疗结果的量。治疗有效量可根据诸如疾病状态、年龄、性别和个体体重等因素以及免疫检查点抑制剂和一种或多种类视黄醇或rexinoid活性剂在个体中引发期望反应的能力而变化。例如,治疗有效量的本发明的类视黄醇活性剂是增加免疫检查点抑制剂抗体或多肽的抗癌活性的量。术语“治疗”或“治疗”广泛地包括任何类型的治疗活动,包括人或其他动物的疾病的诊断,缓解或预防,或者影响人或其他动物身体的结构或任何功能的任何活动。治疗活动包括由医疗专业人员、患者他/她自己或任何其他人向患者施用本文所述的药物、剂型和药物组合物,尤其是根据本文公开的各种治疗方法。治疗活动包括医疗专业人员例如医生、医师助理、执业护士等的命令、指示和建议,然后由任何其他人,包括其他医疗专业人员或患者他/她自己采取行动。在一些实施方式中,治疗活动还可以包括鼓励、诱导或强制选择特定药物或其组合用于治疗病症——并且该药物实际使用——通过从药物处方集上批准该药物的保险范围,拒绝替代药物的覆盖范围,包含该药物,或排除替代药物的药物,或如保险公司或药房福利管理公司可能做的那样提供使用药物的经济激励,等等。在一些实施方式中,治疗活动还可以包括鼓励,诱导或强制要求选择特定药物用于治疗病症——并且该药物实际使用实际——通过医院、诊所、健康维护组织、医疗实践或医师组等可能建立的政策或实践标准。免疫检查点抑制剂抗体或多肽的典型剂量可以是,例如,1pg/kg至20mg/kg动物或人体重;然而,低于或高于该示例范围的剂量在本公开的范围内。每日剂量可为约0.00001μg/kg至约20mg/kg总体重(例如,0.001μg/kg、约0.1μg/kg、约1μg/kg、约5μg/kg、约10μg/kg、约100μg/kg、约500μkg、约1mg/kg、约5mg/kg、约10mg/kg,或由前述任何两个值限定的范围),从约0.1μg/kg至约10mg/kg总体重(e.g.约0.5μg/kg、约1μg/kg、约50μg/kg、约150μg/kg、约300μg/kg、约750μg/kg、约1.5mg/kg、约5mg/kg或由前述任何两个值限定的范围),从约1μg/kg至5mg/kg总体重(例如,约3μg/kg、约15μg/kg、约75μg/kg、约300μg/kg、约900μg/kg、约2mg/kg、约4mg/kg,或由前述任何两个值限定的范围),和从约0.5至15mg/kg体重每天(例如,约1mg/kg,约2.5mg/kg,约3mg/kg,约6mg/kg,约9mg/kg,约11mg/kg,约13mg/kg,或由任何两种定义的范围上述值)。可以通过定期评估治疗的患者来监测治疗或预防功效。对于数天或更长时间的重复给药,取决于病症,可以重复治疗直至发生所需的疾病或疾病症状抑制。然而,其他剂量方案可能是有用的并且在本发明的范围内。所需剂量可以通过单次推注给予组合物,通过多次推注给予组合物,或通过连续输注给予组合物来递送。rarα拮抗剂的典型剂量为0.01至300mg/m2/天;然而,低于或高于该示例性范围的剂量在本公开的范围内。每日剂量可为约0.5至100mg/m2/天、1至90mg/m2/天、5至80mg/m2/天;或至少0.02、0.03、0.05、0.07、0.1、0.2、0.3、0.5、0.7、1、2、3、5、7、10、15、20、25、30、50、70或100mg/m2/天;或不高于0.1、0.2、0.3、0.5、0.7、1、2、3、5、7、10、15、20、25、30、50、60、70.80、90、100、125、150、175、200、225、250、275或300mg/m2/天;或由前述任何两个值定义的范围。rarγ激动剂的典型剂量为0.01至300mg/m2/天;然而,低于或高于该示例性范围的剂量在本公开的范围内。每日剂量可为约0.5至100mg/m2/天、1至90mg/m2/天、5至80mg/m2/天;或至少0.02、0.03、0.05、0.07、0.1、0.2、0.3、0.5、0.7、1、2、3、5、7、10、15、20、25、30、50、70或100mg/m2/天;或notmorethan0.1、0.2、0.3、0.5、0.7、1、2、3、5、7、10、15、20、25、30、50、60、70.80、90、100、125、150、175、200、225、250、275或300mg/m2/天;或由前述任何两个值定义的范围。rxr拮抗剂的典型剂量为0.01至300mg/m2/天;然而,低于或高于该示例性范围的剂量在本公开的范围内。每日剂量可为约0.5至100mg/m2/天、1至90mg/m2/天、5至80mg/m2/天;或至少0.02、0.03、0.05、0.07、0.1、0.2、0.3、0.5、0.7、1、2、3、5、7、10、15、20、25、30、50、70或100mg/m2/天;或notmorethan0.1、0.2、0.3、0.5、0.7、1、2、3、5、7、10、15、20、25、30、50、60、70.80、90、100、125、150、175、200、225、250、275或300mg/m2/天;或由前述任何两个值限定的范围。人体的平均表面积通常为成年男性1.9m2,成年女性为1.6m2,12-13岁的儿童为1.33m2。这些值可用于计算前面段落中的每日剂量的剂量范围。rar/rxr活性剂的总日剂量可以单剂量给药,或者以间隔8至16,或10至14小时在24小时内的两剂量给药。rar/rxr活性剂与免疫检查点抑制剂配合施用,并且如上所述,可以通过定期评估治疗的患者来监测治疗或预防功效。对于数天或更长时间的重复给药,取决于病症,可以重复治疗直至发生所需的疾病或疾病症状抑制。然而,其他剂量方案可能是有用的并且在本发明的范围内。所需剂量可以通过单次推注给予组合物,通过多次推注给予组合物,或通过连续输注给予组合物来递送。免疫检查点抑制剂抗体和类视黄醇或rexinoid活性剂可以使用标准给药技术施用给哺乳动物,包括口服、静脉内、腹膜内、皮下、肺、透皮、肌肉内、鼻内、口腔、舌下或栓剂给药。检查点抑制剂组合物优选适用于肠胃外给药。本文所用的术语“肠胃外”包括静脉内,肌肉内,皮下,直肠,阴道和腹膜内给药。更优选地,通过静脉内,腹膜内或皮下注射使用外周全身给药法将所述组合物施用于哺乳动物。类视黄醇或rexinoid活性剂优选适于口服给药,例如作为丸剂,片剂或胶囊剂。本发明公开的免疫检查点抑制剂抗体和类视黄醇或rexinoid活性剂可以在基本相同的时间(彼此在1小时内)或在不同的时间施用。在一些实施方式中,在施用免疫检查点抑制剂抗体或多肽之前,受试者用类视黄醇或rexinoid活性剂预处理至少30分钟,至少1小时或至少2小时。在一些实施方式中,类视黄醇或rexinoid活性剂在免疫检查点抑制剂抗体或多肽施用开始后施用。本文公开的免疫检查点抑制剂抗体和类视黄醇或rexinoid活性剂可以与其他药物组合施用,例如至少一种其他抗癌剂,包括例如,本领域已知的任何化学治疗剂,电离辐射,小分子抗癌剂,癌症疫苗,生物疗法(例如,其他单克隆抗体,癌症致死病毒,基因疗法和过继性t细胞转移)和/或手术。在其他实施方式中,免疫检查点抑制剂抗体和类视黄醇或rexinoid活性剂是施用的唯一治疗试剂或给予的唯一治疗;或给予的唯一治疗或试剂,其主要用途是促进抗癌免疫应答;或者给予的唯一治疗或试剂,其主要用途是促进t细胞介导的抗癌免疫应答。实施例提供以下非限制性实施例仅用于说明目的,以便于更完整地理解现在设想的代表性实施方式。这些实施例不应解释为限制本说明书中描述的任何实施方式。实施例1rarα信号传导诱导foxp3表达重要的是确定哪种rar(rarα、rarβ、rarγ)信号传导途径在foxp3表达的诱导中是重要的。为了确定这一点,使用流式细胞术通过基于gfp-表型的分选和分离从foxp3-gfp小鼠中纯化原初cd4+cd25-foxp3-细胞。在il-2和tgf-β存在下,这些细胞在体外用αcd3多克隆激活。为了鉴定参与ra诱导的foxp3表达的rar,将培养的细胞用rar选择性激动剂温育。然后对培养的细胞评估gfp+(foxp3+)的频率。关于选择性激动剂的使用,只有rarα激动剂对foxp3的表达产生显著影响,诱导几乎100%foxp3+t细胞,增强α4β7和ccr9(肠道归巢受体)的表达(图1)。rarγ和rarβ激动剂没有效果。这些结果表明rarα选择性激动剂可用于减轻炎症或自身免疫疾病的症状。相反,rarα选择性拮抗剂或反向激动剂可用于下调免疫抑制性treg细胞的产生,从而促进免疫应答,例如抗癌免疫应答。实施例2化合物5183是rarα特异性的为了确定具有式i结构的化合物是否是rarα选择性激动剂,使用置换测定法检测化合物5183结合rarα,rarβ和rarγ的能力以测量激动剂结合亲和力以及使用反式激活测定法测量激动剂活性。这些结果表明化合物5183以高亲和力选择性结合rarα(表1)并特异性激活rarα(图2)。这种rarα选择性激动剂可以最小化与泛激活有关的副作用,包括临床研究中的粘膜皮肤毒性,头痛和促炎症事件。表15183对rarα、rarβ和rarγ的结合亲和力rarαrarβrarγ4.7nm>10000nm>10000nm实施例3rarα选择性激动剂调节t细胞分化为了确定rarα选择性激动剂是否可以影响t细胞分化,将t细胞用rarα选择性激动剂温育以确定其对foxp3表达的影响。使用流式细胞术通过基于gfp-表型分选和分离从foxp3-gfp小鼠纯化原初cd4+cd25-foxp3-细胞。在il-2和tgf-β存在下,这些细胞在体外用αcd3多克隆激活。然后将这些细胞在含有各种浓度的化合物5183(rarα选择性激动剂)的培养基中培养,并通过流式细胞术分析foxp3-gfp的表达。rarα选择性激动剂化合物5183在体外增强免疫抑制性treg细胞的分化并抑制原初t细胞的分化成炎性th17细胞(表2)。表2rarα激动剂对t细胞分化的影响为了扩大上述发现,在小鼠模型中评估rarα选择性激动剂对t细胞分化的体内作用。每隔一天用100μg化合物5183(rarα激动剂)或等体积的dmso(载体对照)处理小鼠,持续10天。然后分离来自血液和脾脏的淋巴细胞,并评估cd4+t细胞中的foxp3表达。数据显示,在施用化合物5183后,处理小鼠的脾脏和血液中foxp3+t细胞的百分比显著增加(表3)。treg细胞增加两倍通过减少免疫反应显着影响宿主的总体免疫力。表3rarα激动剂对t细胞分化的影响相反,在上述体外和体内测定中,agar196996(rarα选择性拮抗剂)增加th17细胞数并降低treg细胞数。因此,rarα拮抗剂增加免疫应答并增强免疫检查点阻断抗体的抗肿瘤作用。实施例4测试化合物与rar和rxr受体的结合以及报告基因的激活视黄酸受体反式激活活性和结合效率基本上如美国专利no.4、522、576中所述测定,在此引入作为参考。反式激活测定使用编码全长受体rarα,rarβ,rarγ,rxrα,rxrβ和rxrγ的表达质粒。含有疱疹病毒胸苷激酶启动子和适当的视黄酸受体反应元件(rare)或类视黄醇x受体反应元件(rxre)的报道质粒置于编码萤火虫荧光素酶的开放编码区的上游。使用经典竞争测定形式进行结合测定,其中克隆的受体rar和rxr分子首先加载放射性标记的全反式视黄酸(rar)或放射性标记的9-顺式视黄酸(rxr),然后测量随着测试化合物浓度增加而释放的放射性量。如上文所公开的,该测定法用于鉴定rarα选择性拮抗剂,rarγ选择性激动剂和rxr选择性拮抗剂。实施例5使用rarγ激动剂对rarγ信号传导的药理学活化与抗ctla-4抗体在b16黑素瘤细胞排斥中具有协同作用在植入b16f10肿瘤细胞的c57bl/6小鼠中检查抗-ctla-4抗体治疗与10nmrarγ激动剂(agn204647(irx4647))组合的抗肿瘤作用。用载体处理的小鼠比未处理的对照小鼠仅不显示存活优势(0%)。在50天时,单独用抗-ctla-4抗体处理的小鼠的存活率为40%,而单独用rarγ激动剂处理的小鼠在相同时间内存活率为30%。值得注意的是,用抗-ctla-4抗体和rarγ激动剂治疗的小鼠在50天时具有100%的存活率,表明这两种药物合作消除b16黑素瘤细胞。经历组合治疗的存活小鼠对两次剂量的活肿瘤细胞的激发试验具有抗性,表明b16特异性记忆细胞的有效形成。重要的是,使用这种药物组合可以获得抗黑素瘤作用,而没有急性或延迟毒性的迹象除非另有说明,否则在说明书和权利要求中使用的表示成分的量,性质如分子量,反应条件等的所有数字应理解为在所有情况下均由术语“约”修饰。本文使用的术语“约”和“大约”意指在10至15%,优选5至10%范围内。因此,除非有相反的指示,否则说明书和所附权利要求书中列出的数值参数是近似值,其可以根据本发明寻求获得的所需性能而变化。至少,并不是试图将等同原则的应用限制在权利要求的范围内,每个数值参数至少应该根据报告的有效数字的数量并通过应用普通的舍入技术来解释。尽管阐述本发明广泛范围的数值范围和参数是近似值,但具体实施例中列出的数值尽可能精确地报告。然而,任何数值固有地包含必然由其各自的测试测量中发现的标准偏差引起的某些误差。在描述本发明的上下文中使用的术语“一”,“一个”,“该”和类似的指示物(特别是在下面权利要求的上下文中)应被解释为涵盖单数和复数,除非本文另有说明或明确与上下文相矛盾。本文中对数值范围的描述仅旨在用作单独提及落入该范围内的每个单独值的简写方法。除非本文另有说明,否则将各个单独的值并入本说明书中,如同其在本文中单独引用一样。除非本文另有说明或上下文明显矛盾,否则本文所述的所有方法均可以任何合适的顺序进行。本文提供的任何和所有实例或示例性语言(例如,“例如”)的使用仅旨在更好地说明本发明,而不是对要求保护的本发明的范围构成限制。说明书中的任何语言都不应被解释为表示对于本发明的实践必不可少的任何未要求保护的要素。本文公开的本发明的替代元素或实施方式的分组不应解释为限制。每个组成员可以单独地或与该组中的其他成员或本文中找到的其他元素任意组合地提及和要求保护。可以预期,出于方便和/或可专利性的原因,组中的一个或多个成员可以被包括在组中或从组中删除。当发生任何这样的包含或删除时,该说明书被认为包含经修改的组,从而满足所附权利要求中使用的所有马库什组的书面描述。本文描述了本发明的某些实施方式,包括发明人已知的实施本发明的最佳方式。当然,在阅读前面的描述后,对这些描述的实施例的变化对于本领域普通技术人员将变得显而易见。发明人期望熟练的技术人员适当地采用这些变化,并且发明人希望本发明以不同于本文具体描述的方式实施。因此,本发明包括适用法律允许的所附权利要求中所述主题的所有修改和等同物。此外,除非本文另有说明或上下文明显矛盾,否则本发明涵盖上述元素的所有可能变型的任何组合。本文公开的具体实施方式可以使用语言由......组成或基本上由……组成的在权利要求中进一步限制。当在权利要求中使用时,无论按照提交的还是按照修改添加的,过渡术语“由......组成”不包括权利要求中未指定的任何元素、步骤或成分。过渡术语“基本上由......组成”将权利要求的范围限制在指定的材料或步骤以及不会对基本和新颖特征产生实质性影响的那些。如此要求保护的本发明的实施例在本文中固有地或明确地描述和实现。此外,在整个说明书中已经对专利和印刷出版物进行了许多参考。以上引用的每篇参考文献和印刷出版物均通过引用整体并入本文。最后,应理解,本文公开的本发明的实施方式是对本发明原理的说明。可以采用的其他修改在本发明的范围内。因此,作为示例而非限制,可以根据本文的教导使用本发明的替代结构。因此,本发明不限于精确地如所示和所述的那些。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1