抗体佐剂缀合物的制作方法
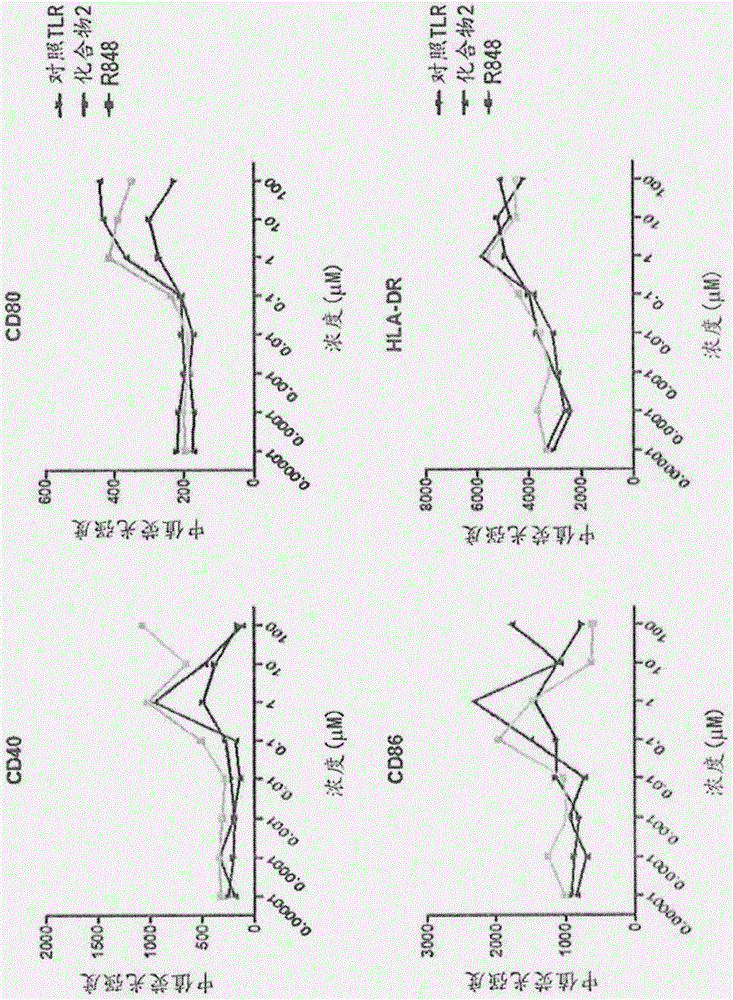
现在公认的是肿瘤生长需要获得促进免疫逃逸的突变。即使如此,肿瘤发生会导致突变抗原或新抗原的积累,这些抗原在离体刺激后容易被宿主免疫系统识别。免疫系统无法识别新抗原的原因和方式开始被阐明。carmi等人的开创性研究(nature,第521卷:第99-104页,2015年)表明,经由抗体-肿瘤免疫复合物将新抗原递送至活化的树突细胞可以克服免疫忽视。在这些研究中,经由肿瘤内注射来同时递送肿瘤结合抗体和树突细胞佐剂获得了强烈的抗肿瘤免疫。为了达到难以接近的肿瘤并扩大癌症患者和其他受试者的治疗选择,需要用于递送抗体和树突细胞佐剂的新组合物和方法。技术实现要素:在第一方面,本发明提供了一种免疫缀合物,该免疫缀合物包含:(a)抗体构建体,该抗体构建体包含(i)抗原结合结构域和(ii)fc结构域;(b)佐剂部分;以及(c)连接子,其中每个佐剂部分经由连接子与抗体构建体共价结合。在一些实施方案中,该免疫缀合物具有根据式i的结构:或其药学上可接受的盐,其中ab为抗体构建体;a为抗体构建体中未修饰的氨基酸侧链或抗体构建体中经修饰的氨基酸侧链;z为连接部分;adj为佐剂部分;并且下标r为1至10的整数。在相关方面,本发明提供了一种包含如本文所述的多个免疫缀合物的组合物。在另一方面,本发明提供了一种治疗癌症的方法。该方法包括向对其有需要的受试者施用治疗有效量的根据本发明的免疫缀合物。附图说明当结合附图阅读时,根据以下详细描述可以最好地理解本发明。根据惯例,附图的各种特征不按比例绘制。相反,为了清楚起见,各种特征的尺寸被任意地扩大或缩小。图1示出了官能化佐剂是骨髓细胞活化的有效诱导物。在37℃下,用10倍系列稀释的r848、化合物2或对照tlr激动剂刺激外周血抗原呈递细胞(apc)。18小时后,经由流式细胞术分析细胞。数据表示为每个指示标记的中值荧光强度;n=3。图2示出了官能化佐剂维持tlr激动剂活性。在融合到nf-κb和ap-1结合位点的ifn-β最小启动子控制下,hek293细胞与人tlr7或tlr8(上部两个图)或者鼠tlr7(下部图)以及诱导型分泌胚胎碱性磷酸酶报告基因共转染。随后将细胞与2倍系列稀释的指定佐剂在37℃下孵育12小时。加入碱性磷酸酶底物后,通过分光光度法(od650nm)测量活性。图3示出了经由液相色谱-质谱法(lc-ms)分析佐剂连接子化合物。图4示出了与未缀合的抗体和佐剂相比,抗体-佐剂缀合物在引发apc活化方面更为优越,如cd40、cd86和hla-dr的表达所示。在cfse标记的cd19+肿瘤细胞存在下,用利妥昔单抗-sata-smcc-化合物1(缀合的)、单独的利妥昔单抗(ab)、单独的化合物1或利妥昔单抗+化合物1(混合物)刺激人apc。18小时后,经由流式细胞术分析cd19-人apc;n=3。p值≤0.05以*表示,p值≤0.01以**表示,p值≤0.001以***表示,p值≤0.0001以****表示。图5示出了与未缀合的抗体和佐剂相比,抗体-佐剂缀合物诱导较低水平的pd-l1在人apc上表达。在cfse标记的cd19+肿瘤细胞存在下,用利妥昔单抗-sata-smcc-化合物1(缀合的)、单独的利妥昔单抗(ab)、单独的化合物1或利妥昔单抗+化合物1(混合物)刺激人apc。18小时后,经由流式细胞术分析cd19-人apc;n=3。p值≤0.05以*表示,p值≤0.01以**表示,p值≤0.001以***表示,p值≤0.0001以****表示。图6示出了抗体-佐剂缀合物引发dc分化。在cfse标记的肿瘤细胞存在下,用2倍系列稀释的利妥昔单抗-sata-smcc-化合物1(缀合的)、单独的利妥昔单抗(ab)、单独的化合物1或利妥昔单抗+化合物1(混合物)刺激约95%单核细胞的人apc。18小时后,经由流式细胞术分析cd19-人apc;n=3。p值≤0.05以*表示,p值≤0.01以**表示,p值≤0.001以***表示,p值≤0.0001以****表示。图7示出了在引发人apc的炎性细胞因子的分泌方面,抗体-佐剂缀合物优于未缀合的抗体和佐剂的混合物。在固定的cfse标记的肿瘤细胞存在下,用2倍系列稀释的利妥昔单抗-sata-smcc-化合物1(缀合的)、单独的利妥昔单抗(ab)、单独的化合物1或利妥昔单抗+化合物1(混合物)刺激人apc。18小时后,经由细胞因子微珠阵列分析无细胞上清液的细胞因子分泌;n=3。p值≤0.05以*表示,p值≤0.01以**表示,p值≤0.001以***表示,p值≤0.0001以****表示。图8a示出了具有可裂解连接子的免疫缀合物引发apc活化和dc分化。在cfse标记的肿瘤细胞存在下,用2倍系列稀释的利妥昔单抗-sata-spdp-化合物1(缀合的,可裂解)、单独的利妥昔单抗(ab)、单独的化合物1或利妥昔单抗+化合物1(混合物)刺激约95%单核细胞的人apc。如maldi-tof所确认,免疫缀合物(aac-可裂解)的药物与抗体比率(dar)为1.4。18小时后,经由流式细胞术分析cd19-人apc(cd14和cd123);n=3。图8b示出了具有可裂解连接子的免疫缀合物(aac)引发apc活化和dc分化。在cfse标记的肿瘤细胞存在下,用2倍系列稀释的利妥昔单抗-sata-spdp-化合物1(缀合的,可裂解)、单独的利妥昔单抗(ab)、单独的化合物1或利妥昔单抗+化合物1(混合物)刺激约95%单核细胞的人apc。如maldi-tof所确认,免疫缀合物(aac-可裂解)的药物与抗体比率(dar)为1.4。18小时后,经由流式细胞术分析cd19-人apc(cd16和cd163);n=3。图8c示出了具有可裂解连接子的免疫缀合物引发apc活化和dc分化。在cfse标记的肿瘤细胞存在下,用2倍系列稀释的利妥昔单抗-sata-spdp-化合物1(缀合的,可裂解)、单独的利妥昔单抗(ab)、单独的化合物1或利妥昔单抗+化合物1(混合物)刺激约95%单核细胞的人apc。如maldi-tof所确认,免疫缀合物(aac-可裂解)的药物与抗体比率(dar)为1.4。18小时后,经由流式细胞术分析cd19-人apc(cd40和pdl1);n=3。图9a示出了抗体-佐剂缀合物减少了体内肿瘤。将右腹侧具有b16f10肿瘤的c57bl/6小鼠肿瘤内注射pbs(未经处理的)、αgp75+化合物1(混合物)或αgp75-sata-smcc-化合物1(αgp75-免疫缀合物)。图9b示出了当经由肿瘤内(it)或静脉内(iv)注射施用时,αgp75-免疫缀合物减少了体内肿瘤。图10a示出了经由lc-ms分析伊匹单抗。图10b示出了与未缀合的伊匹单抗相比,伊匹单抗-佐剂(伊匹单抗boltbody)缀合物在引发apc活化方面更为优越,如hla-dr的表达所示。图10c示出了与未缀合的伊匹单抗相比,伊匹单抗-佐剂(伊匹单抗boltbody)缀合物在引发apc活化方面更为优越,如cd14的表达所示。图10d示出了与未缀合的伊匹单抗相比,伊匹单抗-佐剂(伊匹单抗boltbody)缀合物在引发apc活化方面更为优越,如cd40的表达所示。图10e示出了与未缀合的伊匹单抗相比,伊匹单抗-佐剂(伊匹单抗boltbody)缀合物在引发apc活化方面更为优越,如cd86的表达所示。图11a示出了经由lc-ms分析派姆单抗。图11b示出了与未缀合的派姆单抗相比,派姆单抗-佐剂(派姆单抗boltbody)缀合物在引发apc活化方面更为优越,如hla-dr的表达所示。图11c示出了与未缀合的派姆单抗相比,派姆单抗-佐剂(派姆单抗boltbody)缀合物在引发apc活化方面更为优越,如cd14的表达所示。图11d示出了与未缀合的派姆单抗相比,派姆单抗-佐剂(派姆单抗boltbody)缀合物在引发apc活化方面更为优越,如cd40的表达所示。图11e示出了与未缀合的派姆单抗相比,派姆单抗-佐剂(派姆单抗boltbody)缀合物在引发apc活化方面更为优越,如cd86的表达所示。图12a示出了经由lc-ms分析纳武单抗。图12b示出了与未缀合的纳武单抗相比,纳武单抗-佐剂(纳武单抗boltbody)缀合物在引发apc活化方面更为优越,如hla-dr的表达所示。图12c示出了与未缀合的纳武单抗相比,纳武单抗-佐剂(纳武单抗boltbody)缀合物在引发apc活化方面更为优越,如cd14的表达所示。图12d示出了与未缀合的纳武单抗相比,纳武单抗-佐剂(纳武单抗boltbody)缀合物在引发apc活化方面更为优越,如cd40的表达所示。图12e示出了与未缀合的纳武单抗相比,纳武单抗-佐剂(纳武单抗boltbody)缀合物在引发apc活化方面更为优越,如cd86的表达所示。图13a示出了经由lc-ms分析阿特珠单抗。图13b示出了与未缀合的阿特珠单抗相比,阿特珠单抗-佐剂(阿特珠单抗boltbody)缀合物在引发apc活化方面更为优越,如hla-dr的表达所示。图13c示出了与未缀合的阿特珠单抗相比,阿特珠单抗-佐剂(阿特珠单抗boltbody)缀合物在引发apc活化方面更为优越,如cd14的表达所示。图13d示出了与未缀合的阿特珠单抗相比,阿特珠单抗-佐剂(阿特珠单抗boltbody)缀合物在引发apc活化方面更为优越,如cd40的表达所示。图13e示出了阿特珠单抗-佐剂(阿特珠单抗boltbody)缀合物的活化水平,如cd86的表达所示。图14a示出了与阿特珠单抗分化细胞相比,阿特珠单抗免疫缀合物(阿特珠单抗igg1nqboltbody)分化细胞分泌更高量的tnfα。图14b示出了与阿特珠单抗分化细胞相比,阿特珠单抗免疫缀合物(阿特珠单抗igg1nqboltbody)分化细胞分泌更高量的il-1β。图15a示出了与纳武单抗分化细胞相比,纳武单抗免疫缀合物(纳武单抗igg4boltbody)分化细胞分泌更高量的tnfα。图15b示出了与纳武单抗分化细胞相比,纳武单抗免疫缀合物(纳武单抗igg4boltbody)分化细胞分泌更高量的il-1β。图16a示出了与派姆单抗分化细胞相比,派姆单抗免疫缀合物(派姆单抗boltbody)分化细胞分泌更高量的tnfα。图16b示出了与派姆单抗分化细胞相比,派姆单抗免疫缀合物(派姆单抗boltbody)分化细胞分泌更高量的il-1β。图17示出了经由lc-ms分析派姆单抗-佐剂缀合物。图18示出了经由lc-ms分析纳武单抗-佐剂缀合物。图19示出了经由lc-ms分析阿特珠单抗-佐剂缀合物。图20示出了与伊匹单抗分化细胞相比,伊匹单抗免疫缀合物(伊匹单抗boltbody)分化细胞分泌更高量的tnfα。图21示出了与暴露于等量的未缀合组分的细胞相比,dectin-2免疫缀合物分化细胞分泌更高量的tnfα、il-6和il-12p70。对于每种细胞因子,显著高于x轴的线是抗dectin-2免疫缀合物(抗dectin-2-cmpd1(与佐剂化合物1缀合的抗体))。沿x轴有三条线,均不可见,表明单独的抗dectin-2抗体和单独的佐剂化合物1以及抗dectin-2抗体和佐剂化合物1的混合物(抗dectin-2+cmpd1混合物,未缀合的)未能产生任何细胞因子应答。对于il-6,勉强高于x轴的线代表对照抗体,一种化合物1作为佐剂的acc和大鼠igg2a同型对照抗体(图21中标记为“iso-cmpd1”)。在tnfα和il-12p70图中,iso-cmpd1线不可见,因为其沿着x轴。图22a示出了佐剂cl264的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的末端羧酸。图22b示出了佐剂cl401的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的伯胺。图22c示出了佐剂cl413的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的第一个赖氨酸残基。图22d示出了佐剂cl413的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的第二个赖氨酸残基。图22e示出了佐剂cl413的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的第三个赖氨酸残基。图22f示出了佐剂cl413的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的第四个赖氨酸残基。图22g示出了佐剂cl413的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的伯胺。图22h示出了佐剂cl419的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的胺(图22h上部中的末端胺和图22h下部中的仲胺)。图22i示出了佐剂cl553的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的仲胺。图22j示出了佐剂cl553的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的另一个仲胺。图22k示出了佐剂cl553的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的伯胺。图22l示出了佐剂cl553的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的另一个仲胺。图22m示出了佐剂cl553的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的另一个仲胺。图22n示出了佐剂cl553的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的另一个仲胺。图22o示出了佐剂cl572的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是伯胺(图22o上部)和羰基(图22o下部)。图22p示出了佐剂pam2csk4的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的末端羧酸。图22q示出了佐剂pam2csk4的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的末端硫醇。图22r示出了佐剂pam2csk4的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的第二个赖氨酸残基。图22s示出了佐剂pam2csk4的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的第三个赖氨酸残基。图22t示出了佐剂pam2csk4的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的末端赖氨酸残基。图22u示出了佐剂pam3csk4的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的末端羧酸。图22v示出了佐剂pam3csk4的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的末端硫醇。图22w示出了佐剂pam3csk4的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的第二个赖氨酸残基。图22x示出了佐剂pam3csk4的结构,圆圈指示佐剂上可缀合到连接子的位置,具体地讲,是佐剂的第三个赖氨酸残基。图23a示出了与暴露于等量的未缀合组分的细胞相比,αclec5a免疫缀合物分化细胞分泌更高量的il-6。对于每种细胞因子,显著高于x轴的线是αclec5a免疫缀合物(与佐剂化合物1缀合的αclec5a抗体)。沿x轴的线示出了αclec5a抗体和佐剂化合物1的混合物(未缀合的)未能产生任何细胞因子应答。x轴和αclec5a免疫缀合物线之间的线代表对照缀合物,一种缀合到化合物1的大鼠igg2a同型对照。图23b示出了与暴露于等量的未缀合组分的细胞相比,αclec5a免疫缀合物分化细胞分泌更高量的il-12p40。对于每种细胞因子,显著高于x轴的线是αclec5a免疫缀合物(αclec5a-cmpd1aac)。沿x轴的线示出了αclec5a抗体和佐剂化合物1的混合物(未缀合的;αclec5a-cmpd1混合物)未能产生任何细胞因子应答。x轴和αclec5a免疫缀合物线之间的线代表对照缀合物,一种缀合到化合物1的大鼠igg2a同型对照。图23c示出了与暴露于等量的未缀合组分的细胞相比,αclec5a免疫缀合物分化细胞分泌更高量的il-12p70。对于每种细胞因子,显著高于x轴的线是αclec5a免疫缀合物(与佐剂化合物1缀合的αclec5a抗体)。沿x轴的线示出了αclec5a抗体和佐剂化合物1的混合物(未缀合的)未能产生任何细胞因子应答。x轴和αclec5a免疫缀合物线之间的线代表对照缀合物,一种缀合到化合物1的大鼠igg2a同型对照。图23d示出了与暴露于等量的未缀合组分的细胞相比,αclec5a免疫缀合物分化细胞分泌更高量的tnfα。对于每种细胞因子,显著高于x轴的线是αclec5a免疫缀合物(与佐剂化合物1缀合的αclec5a抗体)。沿x轴的线示出了αclec5a抗体和佐剂化合物1的混合物(未缀合的)未能产生任何细胞因子应答。x轴和αclec5a免疫缀合物线之间的线代表对照缀合物,一种缀合到化合物1的大鼠igg2a同型对照。图23e示出了经由lc-ms分析αclec5a免疫缀合物。图24示出了与抗her2抗体和tlr7/8激动剂化合物1佐剂组分(αher2和化合物1,闭合方形)作为未连接混合物递送相比,连接到相同佐剂组分的相同抗体佐剂缀合物(αher2免疫缀合物,闭合圆形)增加了树突细胞分化。图25示出了与抗egfr抗体和tlr7/8激动剂化合物1佐剂组分(αegfr和化合物1,闭合方形)作为未连接混合物递送相比,连接到相同佐剂组分的相同抗体佐剂缀合物(αegfr免疫缀合物,闭合圆形)增加了树突细胞分化。图26示出了缀合到tlr7/8激动剂的抗cd20抗体表现出强烈的树突细胞活化现象,而在去糖基化的缀合物中活化显著降低。图27比较了缀合到化合物1的利妥昔单抗和奥滨尤妥珠单抗。与利妥昔单抗相比,奥滨尤妥珠单抗具有降低的岩藻糖含量,并且表现出cd40上调增加。图28示出了使用连接到tlr7/8激动剂化合物1的αegfr免疫缀合物活化nk细胞。与αegfr和化合物1的未缀合混合物相比,免疫缀合物表现出显著更大的nk细胞活化。图29示出了来源于从含有αegfr免疫缀合物的人类受试者分离的外周血单核细胞的树突细胞群的强烈活化。图30a示出了使用sata方法合成的免疫缀合物bb-01的液相色谱-质谱分析。图30b示出了使用酯方法合成的免疫缀合物bb-01的液相色谱-质谱分析。图31a示出了使用sata方法合成的免疫缀合物bb-01的尺寸排阻色谱分析。图31b示出了使用酯方法合成的免疫缀合物bb-01的尺寸排阻色谱分析。图32示出了使用酯方法合成的免疫缀合物bb-14的液相色谱-质谱分析。图33示出了使用酯方法合成的免疫缀合物bb-14的尺寸排阻色谱分析。图34示出了使用酯方法合成的免疫缀合物bb-15的液相色谱-质谱分析。图35示出了使用酯方法合成的免疫缀合物bb-15的尺寸排阻色谱分析。图36示出了使用酯方法合成的免疫缀合物的液相色谱-质谱分析。图37示出了使用酯方法合成的免疫缀合物的尺寸排阻色谱分析。图38a示出了使用酯方法合成的bb-01和bb-17引发骨髓活化,如cd14下调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图38b示出了使用酯方法合成的bb-01和bb-17引发骨髓活化,如cd16下调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图38c示出了使用酯方法合成的bb-01和bb-17引发骨髓活化,如cd40上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图38d示出了使用酯方法合成的bb-01和bb-17引发骨髓活化,如cd86上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图38e示出了使用酯方法合成的bb-01和bb-17引发骨髓活化,如cd123上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图38f示出了使用酯方法合成的bb-01和bb-17引发骨髓活化,如人白细胞抗原-抗原d相关或称为“hla-dr”所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图39a示出了bb-01引发骨髓活化,如cd14下调所示,而比较性irm1和irm2免疫缀合物则无此现象。cd20是用作对照的未缀合单克隆抗体。图39b示出了bb-01引发骨髓活化,如cd16下调所示,而比较性irm1和irm2免疫缀合物则无此现象。cd20是用作对照的未缀合单克隆抗体。图39c示出了bb-01引发骨髓活化,如cd40上调所示,而比较性irm1和irm2免疫缀合物则无此现象。cd20是用作对照的未缀合单克隆抗体。图39d示出了bb-01引发骨髓活化,如cd86上调所示,而比较性irm1和irm2免疫缀合物则无此现象。cd20是用作对照的未缀合单克隆抗体。图39e示出了bb-01引发骨髓活化,如cd123上调所示,而比较性irm1和irm2免疫缀合物则无此现象。cd20是用作对照的未缀合单克隆抗体。图39f示出了bb-01引发骨髓活化,如hla-dr上调所示,而比较性irm1和irm2免疫缀合物则无此现象。cd20是用作对照的未缀合单克隆抗体。图40a示出了bb-01引发细胞因子分泌(il-1β),而比较性irm1和irm2免疫缀合物则无此现象。cd20是用作对照的未缀合单克隆抗体。图40b示出了bb-01引发细胞因子分泌(il-6),而比较性irm1和irm2免疫缀合物则无此现象。cd20是用作对照的未缀合单克隆抗体。图40c示出了bb-01引发细胞因子分泌(tnfα),而比较性irm1和irm2免疫缀合物则无此现象。cd20是用作对照的未缀合单克隆抗体。图41a示出了使用酯方法合成的免疫缀合物bb-26的尺寸排阻色谱分析。图41b示出了使用酯方法合成的免疫缀合物bb-26的液相色谱-质谱分析。图42a示出了使用酯方法合成的免疫缀合物bb-27的尺寸排阻色谱分析。图42b示出了使用酯方法合成的免疫缀合物bb-27的液相色谱-质谱分析。图43a示出了使用酯方法合成的免疫缀合物bb-36的尺寸排阻色谱分析。图43b示出了使用酯方法合成的免疫缀合物bb-36的液相色谱-质谱分析。图44a示出了比较性缀合物irm1的尺寸排阻色谱分析。图44b示出了比较性缀合物irm2的尺寸排阻色谱分析。图44c示出了bb-01的尺寸排阻色谱分析。图45a示出了在用pngasef过夜去糖基化后缀合物irm1的液相色谱-质谱分析。图45b示出了在用pngasef过夜去糖基化后缀合物bb-01的液相色谱-质谱分析。图46a示出了使用酯方法合成的免疫缀合物bb-45的尺寸排阻色谱分析。图46b示出了使用酯方法合成的免疫缀合物bb-45的液相色谱-质谱分析。图47a示出了使用酯方法合成的免疫缀合物bb-24的尺寸排阻色谱分析。图47b示出了使用酯方法合成的免疫缀合物bb-24的液相色谱-质谱分析。图48a示出了使用酯方法合成的免疫缀合物bb-37的尺寸排阻色谱分析。图48b示出了使用酯方法合成的免疫缀合物bb-37的液相色谱-质谱分析。图49a示出了使用酯方法合成的免疫缀合物bb-42的尺寸排阻色谱分析。图49b示出了使用酯方法合成的免疫缀合物bb-42的液相色谱-质谱分析。图50示出了使用酯方法合成的免疫缀合物bb-43的液相色谱-质谱分析。图51示出了使用酯方法合成的免疫缀合物bb-44的液相色谱-质谱分析。图52a示出了bb-14引发骨髓活化,如cd14下调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图52b示出了bb-14引发骨髓活化,如cd40上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图52c示出了bb-14引发骨髓活化,如cd86上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图52d示出了bb-14引发骨髓活化,如hla-dr上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图53a示出了bb-15引发骨髓活化,如cd14下调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图53b示出了bb-15引发骨髓活化,如cd40上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图53c示出了bb-15引发骨髓活化,如cd86上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图53d示出了bb-27引发骨髓活化,如hla-dr上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图54a示出了bb-27引发骨髓活化,如cd14下调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图54b示出了bb-27引发骨髓活化,如cd40上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图54c示出了bb-27引发骨髓活化,如cd86上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图54d示出了bb-27引发骨髓活化,如hla-dr上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图55a示出了bb-45引发骨髓活化,如cd14下调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图55b示出了bb-45引发骨髓活化,如cd40上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图55c示出了bb-45引发骨髓活化,如cd86上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图55d示出了bb-45引发骨髓活化,如hla-dr上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图56a示出了bb-24引发骨髓活化,如cd14下调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图56b示出了bb-24引发骨髓活化,如cd40上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图56c示出了bb-24引发骨髓活化,如cd86上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图56d示出了bb-24引发骨髓活化,如hla-dr上调所示,而对照则无此现象。cd20是用作对照的未缀合单克隆抗体。图57示出了bb-01结合到cd20toledo细胞,cd20toledo细胞是用于研究非霍奇金淋巴瘤的模型系统的细胞系。bb-01比抗体利妥昔单抗或西妥昔单抗具有更强的结合力。图58示出了具有化合物1的egfr免疫缀合物(aegfrboltbody)在活化nk细胞方面比抗体和佐剂的混合物更有效。用免疫缀合物或混合物活化pbmc18小时。根据谱系阴性(cd3、cd19、cd14阴性)和cd56阳性门控nk细胞。图59示出了经由lc-ms分析比较性免疫缀合物(dg)。该比较性缀合物是用曲妥珠单抗和含有带地喹莫德(gardiquimod)的五氟苯基基团的不可裂解马来酰亚胺-peg4连接子制备的(参见us2017/015772,第0275段,免疫缀合物atac3的描述)。图60示出了经由lc-ms分析比较性免疫缀合物(重链)。该比较性缀合物是用曲妥珠单抗和含有带地喹莫德(gardiquimod)的五氟苯基基团的不可裂解马来酰亚胺-peg4连接子制备的(参见us2017/015772,第0275段,免疫缀合物atac3的描述)。图61示出了经由lc-ms分析比较性免疫缀合物。该比较性缀合物是用曲妥珠单抗和含有带地喹莫德(gardiquimod)的五氟苯基基团的不可裂解马来酰亚胺-peg4连接子制备的(参见us2017/015772,第0275段,免疫缀合物atac3的描述)。图62示出了经由lc-ms分析比较性免疫缀合物(轻链)。该比较性缀合物是用曲妥珠单抗和含有带地喹莫德(gardiquimod)的五氟苯基基团的不可裂解马来酰亚胺-peg4连接子制备的(参见us2017/015772,第0275段,免疫缀合物atac3的描述)。图63示出了经由lc-ms分析比较性免疫缀合物(dg,重链)。该比较性缀合物是用曲妥珠单抗和含有带地喹莫德(gardiquimod)的五氟苯基基团的不可裂解马来酰亚胺-peg4连接子制备的(参见us2017/015772,第0275段,免疫缀合物atac3的描述)。图64示出了经由lc-ms分析比较性免疫缀合物(dg,轻链)。该比较性缀合物是用曲妥珠单抗和含有带地喹莫德(gardiquimod)的五氟苯基基团的不可裂解马来酰亚胺-peg4连接子制备的(参见us2017/015772,第0275段,免疫缀合物atac3的描述)。图65示出了经由lc-ms分析比较性免疫缀合物(dg)。该比较性缀合物是用曲妥珠单抗和含有带琥珀酰胺的paba基团的可裂解缬氨酸-瓜氨酸连接子制备的(参见us2017/015772,第0275段,免疫缀合物atac2的描述)。图66示出了经由lc-ms分析比较性免疫缀合物。该比较性缀合物是用曲妥珠单抗和含有带琥珀酰胺的paba基团的可裂解缬氨酸-瓜氨酸连接子制备的(参见us2017/015772,第0275段,免疫缀合物atac2的描述)。图67a示出了在刺激18小时后,与未缀合的利妥昔单抗(roche)以及用利妥昔单抗和缬氨酸-瓜氨酸-pabc或马来酰亚胺-peg4连接子(两者均含有带地喹莫德(gardiquimod)的五氟苯基基团)制备的等摩尔浓度的比较性缀合物(分别为利妥昔单抗-atac2、利妥昔单抗-atac3;us2017/015772)相比,根据bb-01sata方法制备的利妥昔单抗免疫缀合物(利妥昔单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图67b示出了在刺激18小时后,与未缀合的利妥昔单抗(roche)以及用利妥昔单抗和缬氨酸-瓜氨酸-pabc或马来酰亚胺-peg4连接子(两者均含有带地喹莫德(gardiquimod)的五氟苯基基团)制备的等摩尔浓度的比较性缀合物(分别为利妥昔单抗-atac2、利妥昔单抗-atac3;us2017/015772)相比,根据bb-01sata方法制备的利妥昔单抗免疫缀合物(利妥昔单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图67c示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备利妥昔单抗免疫缀合物或根据us2017/015772中描述的方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图67d示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物或根据us2017/015772中描述的方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图67e示出了在用pngasef过夜去糖基化后如us2017/015772中描述的使用缬氨酸-瓜氨酸-pabc连接子制备的利妥昔单抗免疫缀合物的同侧重-轻链的液相色谱-质谱分析。图67f示出了在用pngasef过夜去糖基化后如us2017/015772中描述的使用缬氨酸-瓜氨酸-pabc连接子制备的利妥昔单抗免疫缀合物的轻链的液相色谱-质谱分析。图67g示出了在刺激18小时后,根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)未能引发骨髓细胞上的cd123上调。图67g还示出了与ritux-atac2和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发cd123上调方面更为优越。图67h示出了在刺激18小时后,根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)未能引发骨髓细胞上的cd14下调。图67h还示出了与ritux-atac2和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发cd14下调方面更为优越。图67i示出了与根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发骨髓细胞上的cd16下调方面更为优越。图67j示出了在刺激18小时后,根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)未能引发骨髓细胞上的cd40上调。图67j还示出了与ritux-atac2和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发cd40上调方面更为优越。图67k示出了与根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发骨髓细胞上的cd86上调方面更为优越。图67l示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)刺激18小时后,骨髓细胞上的cd123表达。图67m示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)刺激18小时后,骨髓细胞上的cd14表达。图67n示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)刺激18小时后,骨髓细胞上的cd16表达。图67o示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)刺激18小时后,骨髓细胞上的cd40表达。图67p示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有缬氨酸-瓜氨酸-pabc连接子免疫缀合物的利妥昔单抗(ritux-atac2)刺激18小时后,骨髓细胞上的cd86表达。图68a示出了在刺激18小时后,与未缀合的利妥昔单抗(roche)以及用利妥昔单抗和缬氨酸-瓜氨酸-pabc或马来酰亚胺-peg4连接子(两者均含有带地喹莫德(gardiquimod)的五氟苯基基团)制备的等摩尔浓度的比较性缀合物(分别为利妥昔单抗-atac2、利妥昔单抗-atac3;us2017/015772)相比,根据bb-01sata方法制备的利妥昔单抗免疫缀合物(利妥昔单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图68b示出了在刺激18小时后,与未缀合的利妥昔单抗(roche)以及用利妥昔单抗和缬氨酸-瓜氨酸-pabc或马来酰亚胺-peg4连接子(两者均含有带地喹莫德(gardiquimod)的五氟苯基基团)制备的等摩尔浓度的比较性缀合物(分别为利妥昔单抗-atac2、利妥昔单抗-atac3;us2017/015772)相比,根据bb-01sata方法制备的利妥昔单抗免疫缀合物(利妥昔单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图68c示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备利妥昔单抗免疫缀合物或根据us2017/015772中描述的方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图68d示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物或根据us2017/015772中描述的方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图68e示出了在用pngasef过夜去糖基化后如us2017/015772中描述的使用马来酰亚胺-peg4连接子制备的利妥昔单抗免疫缀合物的同侧重-轻链的液相色谱-质谱分析。图68f示出了在用pngasef过夜去糖基化后如us2017/015772中描述的使用马来酰亚胺-peg4连接子制备的利妥昔单抗免疫缀合物的轻链的液相色谱-质谱分析。图68g示出了在刺激18小时后,根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)未能引发骨髓细胞上的cd123上调。图68g还示出了与ritux-atac3和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发cd123上调方面更为优越。图68h示出了在刺激18小时后,与根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发骨髓细胞上的cd14下调方面更为优越。图68i示出了在刺激18小时后,根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)未能引发骨髓细胞上的cd16下调。图68i还示出了与ritux-atac2和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发cd40上调方面更为优越。图68j示出了在刺激18小时后,根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)未能引发骨髓细胞上的cd40上调。图68j还示出了与ritux-atac2和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发cd40上调方面更为优越。图68k示出了在刺激18小时后,根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)未能引发骨髓细胞上的cd86上调。图68j还示出了与ritux-atac2和等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据sata方法制备的bb-01免疫缀合物[利妥昔单抗boltbody(bb-01)]在引发cd86上调方面更为优越。图68l示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)刺激18小时后,骨髓细胞上的cd123表达。图68m示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)刺激18小时后,骨髓细胞上的hla-dr表达。图68n示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)刺激18小时后,骨髓细胞上的cd14表达。图68o示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)刺激18小时后,骨髓细胞上的cd16表达。图68p示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)刺激18小时后,骨髓细胞上的cd40表达。图68q示出了与未缀合的利妥昔单抗(roche)相比,用根据us2017/015772中描述的方法制备的具有马来酰亚胺-peg4连接子免疫缀合物的利妥昔单抗(ritux-atac3)刺激18小时后,骨髓细胞上的cd86表达。图69a示出了在刺激18小时后,与等摩尔浓度的未缀合阿特珠单抗(roche)相比,根据bb-01方法制备的阿特珠单抗免疫缀合物(阿特珠单抗igg1nqboltbody)引发骨髓细胞分泌更高量的il-1β。图69b示出了在刺激18小时后,与等摩尔浓度的未缀合阿特珠单抗(roche)相比,根据bb-01方法制备的阿特珠单抗免疫缀合物(阿特珠单抗igg1nqboltbody)引发骨髓细胞分泌更高量的tnfα。图69c示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的阿特珠单抗免疫缀合物的液相色谱-质谱分析。图69d示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备阿特珠单抗免疫缀合物的未缀合阿特珠单抗(roche)的液相色谱-质谱分析。图69e示出了用于根据bb-01方法制备阿特珠单抗免疫缀合物的未缀合阿特珠单抗(roche)的液相色谱-质谱分析。图69f示出了与未缀合的阿特珠单抗(roche)相比,用根据bb-01方法制备的阿特珠单抗免疫缀合物(阿特珠单抗boltbody)刺激18小时后,骨髓细胞上的cd123表达。图69g示出了与未缀合的阿特珠单抗(roche)相比,用根据bb-01方法制备的阿特珠单抗免疫缀合物(阿特珠单抗boltbody)刺激18小时后,骨髓细胞上的hla-dr表达。图69h示出了在刺激18小时后,与未缀合的阿特珠单抗(roche)相比,根据bb-01方法制备的阿特珠单抗免疫缀合物(阿特珠单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图69i示出了在刺激18小时后,与未缀合的阿特珠单抗(roche)相比,根据bb-01方法制备的阿特珠单抗免疫缀合物(阿特珠单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图69j示出了在刺激18小时后,与未缀合的阿特珠单抗(roche)相比,根据bb-01方法制备的阿特珠单抗免疫缀合物(阿特珠单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图69k示出了与未缀合的阿特珠单抗(roche)相比,用根据bb-01方法制备的阿特珠单抗免疫缀合物(阿特珠单抗boltbody)刺激18小时后,骨髓细胞上的cd86表达。图70a示出了在刺激18小时后,与等摩尔浓度的未缀合贝伐珠单抗(roche)相比,根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图70b示出了在刺激18小时后,与等摩尔浓度的未缀合贝伐珠单抗(roche)相比,根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图70c示出了在刺激36小时后,与等摩尔浓度的未缀合贝伐珠单抗(roche)相比,根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图70d示出了在刺激36小时后,与等摩尔浓度的未缀合贝伐珠单抗(roche)相比,根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图70e示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的贝伐珠单抗免疫缀合物的液相色谱-质谱分析。图70f示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备贝伐珠单抗免疫缀合物的未缀合贝伐珠单抗(roche)的液相色谱-质谱分析。图70g示出了用于根据bb-01方法制备贝伐珠单抗免疫缀合物的未缀合贝伐珠单抗(roche)的液相色谱-质谱分析。图70h示出了在刺激18小时后,与未缀合的贝伐珠单抗(roche)相比,根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图70i示出了与未缀合的贝伐珠单抗(roche)相比,用根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)刺激18小时后,骨髓细胞上的hla-dr表达。图70j示出了在刺激18小时后,与未缀合的贝伐珠单抗(roche)相比,根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图70k示出了在刺激18小时后,与未缀合的贝伐珠单抗(roche)相比,根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图70l示出了在刺激18小时后,与未缀合的贝伐珠单抗(roche)相比,根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图70m示出了在刺激18小时后,与未缀合的贝伐珠单抗(roche)相比,根据bb-01方法制备的贝伐珠单抗免疫缀合物(贝伐珠单抗boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图71a示出了在用pngasef过夜去糖基化后由西妥昔单抗生物仿制药(alphamab)根据bb-01缀合方法制备的西妥昔单抗免疫缀合物的液相色谱-质谱分析。图71b示出了根据bb-01缀合方法制备的西妥昔单抗免疫缀合物的液相色谱-质谱分析。图71c示出了用于在用pngasef过夜去糖基化后根据bb-01方法制备西妥昔单抗免疫缀合物的未缀合西妥昔单抗生物仿制药(alphamab)的液相色谱-质谱分析。图71d示出了用于根据bb-01缀合方法制备西妥昔单抗免疫缀合物的未缀合西妥昔单抗生物仿制药(alphamab)的液相色谱-质谱分析。图71e示出了在刺激18小时后,由利妥昔单抗生物仿制药(amab,alphamab;jhl,jhlbiotech,lgm,lgmpharma)根据bb-01方法制备的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd123上调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图71f示出了在刺激18小时后,由利妥昔单抗生物仿制药(amab,alphamab;jhl,jhlbiotech,lgm,lgmpharma)根据bb-01方法制备的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的hla-dr表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图71g示出了在刺激18小时后,由利妥昔单抗生物仿制药(生物仿制药1,alphamab;生物仿制药2,jhlbiotech;生物仿制药3,lgmpharma)根据bb-01方法制备的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd14下调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图71h示出了在刺激18小时后,由利妥昔单抗生物仿制药(amab,alphamab;jhl,jhlbiotech,lgm,lgmpharma)根据bb-01方法制备的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd16下调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图71i示出了在刺激18小时后,由利妥昔单抗生物仿制药(amab,alphamab;jhl,jhlbiotech,lgm,lgmpharma)根据bb-01方法制备的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd40上调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图71j示出了在刺激18小时后,由利妥昔单抗生物仿制药(amab,alphamab;jhl,jhlbiotech,lgm,lgmpharma)根据bb-01方法制备的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd86上调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图71k示出了在用pngasef过夜去糖基化后由利妥昔单抗生物仿制药(alphamab)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。图71l示出了由利妥昔单抗生物仿制药(alphamab)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。图71m示出了用于在用pngasef过夜去糖基化后根据bb-01方法制备利妥昔单抗生物仿制药免疫缀合物的未缀合利妥昔单抗生物仿制药(alphamab)的液相色谱-质谱分析。图71n示出了用于根据bb-01方法制备利妥昔单抗生物仿制药免疫缀合物的未缀合利妥昔单抗生物仿制药(alphamab)的液相色谱-质谱分析。图71o示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药1),alphamab]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药1)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd123上调方面更为优越。图71p示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药1),alphamab]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药1)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的hla-dr上调方面更为优越。图71q示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药1),alphamab]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药1)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd14下调方面更为优越。图71r示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药1),alphamab]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药1)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd16下调方面更为优越。图71s示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药1),alphamab]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药1)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd40上调方面更为优越。图71t示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药1),alphamab]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药1)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd86上调方面更为优越。图71u示出了在用pngasef过夜去糖基化后由利妥昔单抗生物仿制药(lgmpharma)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。图71v示出了由利妥昔单抗生物仿制药(lgmpharma)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。图71w示出了用于在用pngasef过夜去糖基化后根据bb-01方法制备利妥昔单抗生物仿制药免疫缀合物的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图71x示出了用于根据bb-01方法制备利妥昔单抗生物仿制药免疫缀合物的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图71y示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)相比,由利妥昔单抗生物仿制药(bb-01)根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd123上调方面更为优越。图71z示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)相比,由利妥昔单抗生物仿制药(bb-01)根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的hla-dr上调方面更为优越。图71aa示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)相比,由利妥昔单抗生物仿制药(bb-01)根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd14下调方面更为优越。图71ab示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)相比,由利妥昔单抗生物仿制药(bb-01)根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd16下调方面更为优越。图71ac示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)相比,由利妥昔单抗生物仿制药(bb-01)根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd40上调方面更为优越。图71ad示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)相比,由利妥昔单抗生物仿制药(bb-01)根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd86上调方面更为优越。图71ae示出了在用pngasef过夜去糖基化后由利妥昔单抗生物仿制药(jhlbiotech)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。图71af示出了由利妥昔单抗生物仿制药(jhlbiotech)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。图71ag示出了用于在用pngasef过夜去糖基化后根据bb-01方法制备利妥昔单抗生物仿制药免疫缀合物的未缀合利妥昔单抗生物仿制药(jhlbiotech)的液相色谱-质谱分析。图71ah示出了用于根据bb-01方法制备利妥昔单抗生物仿制药免疫缀合物的未缀合利妥昔单抗生物仿制药(jhlbiotech)的液相色谱-质谱分析。图71ai示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药2),jhlbiotech]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药2)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd123上调方面更为优越。图71aj示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药2),jhlbiotech]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药2)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的hla-dr上调方面更为优越。图71ak示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药2),jhlbiotech]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药2)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd40上调方面更为优越。图71al示出了在刺激18小时后,与相应的未缀合利妥昔单抗生物仿制药[(cd20(生物仿制药2),jhlbiotech]相比,由利妥昔单抗生物仿制药[bb-01(生物仿制药2)]根据bb-01方法制备的利妥昔单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd86上调方面更为优越。图71am示出了未缀合的利妥昔单抗(roche)的液相色谱-质谱分析。图71an示出了在用pngasef过夜去糖基化后由曲妥珠单抗生物仿制药(jhlbiotech)根据bb-01缀合方法制备的曲妥珠单抗免疫缀合物的液相色谱-质谱分析。图71ao示出了由曲妥珠单抗生物仿制药(jhlbiotech)根据bb-01缀合方法制备的曲妥珠单抗免疫缀合物的液相色谱-质谱分析。图71ap示出了用于在用pngasef过夜去糖基化后根据bb-01方法制备曲妥珠单抗生物仿制药免疫缀合物的未缀合曲妥珠单抗生物仿制药(jhlbiotech)的液相色谱-质谱分析。图71aq示出了用于根据bb-01方法制备曲妥珠单抗生物仿制药免疫缀合物的未缀合曲妥珠单抗生物仿制药(jhlbiotech)的液相色谱-质谱分析。图71ar示出了在刺激18小时后,与相应的未缀合曲妥珠单抗生物仿制药(曲妥珠单抗(jhl),jhlbiotech)相比,由曲妥珠单抗生物仿制药(bb-40)根据bb-01方法制备的曲妥珠单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd123上调方面更为优越。图71as示出了在刺激18小时后,与相应的未缀合曲妥珠单抗生物仿制药(曲妥珠单抗(jhl),jhlbiotech)相比,由曲妥珠单抗生物仿制药(bb-40)根据bb-01方法制备的曲妥珠单抗生物仿制药免疫缀合物在引发骨髓细胞上的hla-dr上调方面更为优越。图71at示出了在刺激18小时后,与相应的未缀合曲妥珠单抗生物仿制药(曲妥珠单抗(jhl),jhlbiotech)相比,由曲妥珠单抗生物仿制药(bb-40)根据bb-01方法制备的曲妥珠单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd14下调方面更为优越。图71au示出了在刺激18小时后,与相应的未缀合曲妥珠单抗生物仿制药(曲妥珠单抗(jhl),jhlbiotech)相比,由曲妥珠单抗生物仿制药(bb-40)根据bb-01方法制备的曲妥珠单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd16下调方面更为优越。图71av示出了在刺激18小时后,与相应的未缀合曲妥珠单抗生物仿制药(曲妥珠单抗(jhl),jhlbiotech)相比,由曲妥珠单抗生物仿制药(bb-40)根据bb-01方法制备的曲妥珠单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd40上调方面更为优越。图71aw示出了在刺激18小时后,与相应的未缀合曲妥珠单抗生物仿制药(曲妥珠单抗(jhl),jhlbiotech)相比,由曲妥珠单抗生物仿制药(bb-40)根据bb-01方法制备的曲妥珠单抗生物仿制药免疫缀合物在引发骨髓细胞上的cd86上调方面更为优越。图72a示出了在刺激18小时后,与等摩尔浓度的未缀合西妥昔单抗(imclone/lilly)相比,根据bb-01方法制备的西妥昔单抗免疫缀合物(西妥昔单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图72b示出了在刺激18小时后,与等摩尔浓度的未缀合西妥昔单抗(imclone/lilly)相比,根据bb-01方法制备的西妥昔单抗免疫缀合物(西妥昔单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图72c示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备西妥昔单抗免疫缀合物的未缀合西妥昔单抗(imclone/lilly)的液相色谱-质谱分析。图72d示出了用于根据bb-01缀合方法制备西妥昔单抗免疫缀合物的未缀合西妥昔单抗(imclone/lilly)的液相色谱-质谱分析。图72e示出了在刺激18小时后,与未缀合的西妥昔单抗(闭合方形,黑色;imclone/lilly)相比,根据bb-01方法制备的西妥昔单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd123上调方面更为优越。图72f示出了在刺激18小时后,与未缀合的西妥昔单抗(闭合方形,黑色;imclone/lilly)相比,根据bb-01方法制备的西妥昔单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的hla-dr上调方面更为优越。图72g示出了在刺激18小时后,与未缀合的西妥昔单抗(闭合方形,黑色;imclone/lilly)相比,根据bb-01方法制备的西妥昔单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd14下调方面更为优越。图72h示出了在刺激18小时后,与未缀合的西妥昔单抗(闭合方形,黑色;imclone/lilly)相比,根据bb-01方法制备的西妥昔单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd16下调方面更为优越。图72i示出了在刺激18小时后,与未缀合的西妥昔单抗(闭合方形,黑色;imclone/lilly)相比,根据bb-01方法制备的西妥昔单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd40上调方面更为优越。图72j示出了在刺激18小时后,与未缀合的西妥昔单抗(闭合方形,黑色;imclone/lilly)相比,根据bb-01方法制备的西妥昔单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd86上调方面更为优越。图73a示出了在刺激18小时后,与等摩尔浓度的未缀合达雷木单抗(genmab/janssenbiotech)相比,根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图73b示出了在刺激18小时后,与等摩尔浓度的未缀合达雷木单抗(genmab/janssenbiotech)相比,根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图73c示出了在刺激36小时后,与等摩尔浓度的未缀合达雷木单抗(达雷木单抗[sic],genmab/janssenbiotech)相比,根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗[sic]boltbody)引发骨髓细胞分泌更高量的tnfα。图73d示出了在刺激36小时后,与等摩尔浓度的未缀合达雷木单抗(达雷木单抗[sic],genmab/janssenbiotech)相比,根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗[sic]boltbody)引发骨髓细胞分泌更高量的il-1β。图73e示出了用于在用pngasef过夜去糖基化后根据bb-01方法制备达雷木单抗免疫缀合物的未缀合达雷木单抗(genmab/janssenbiotech)的液相色谱-质谱分析。图73f示出了在用pngasef过夜去糖基化后根据bb-01方法制备的达雷木单抗免疫缀合物的液相色谱-质谱分析。图73g示出了用于根据bb-01方法制备达雷木单抗免疫缀合物的未缀合达雷木单抗(genmab/janssenbiotech)的液相色谱-质谱分析。图73h示出了在刺激18小时后,与未缀合的达雷木单抗(达雷木单抗[sic],genmab/janssenbiotech)相比,根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗[sic]boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图73i示出了与未缀合的达雷木单抗(genmab/janssenbiotech)相比,用根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗boltbody)刺激18小时后,骨髓细胞上的hla-dr表达。图73j示出了在刺激18小时后,与未缀合的达雷木单抗(达雷木单抗[sic],genmab/janssenbiotech)相比,根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗[sic]boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图73k示出了在刺激18小时后,与未缀合的达雷木单抗(达雷木单抗[sic],genmab/janssenbiotech)相比,根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗[sic]boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图73l示出了在刺激18小时后,与未缀合的达雷木单抗(达雷木单抗[sic],genmab/janssenbiotech)相比,根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗[sic]boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图73m示出了在刺激18小时后,与未缀合的达雷木单抗(达雷木单抗[sic],genmab/janssenbiotech)相比,根据bb-01方法制备的达雷木单抗免疫缀合物(达雷木单抗[sic]boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图74a示出了在刺激36小时后,与等摩尔浓度的未缀合埃罗妥珠单抗(bms)相比,根据bb-01方法制备的埃罗妥珠单抗免疫缀合物(埃罗妥珠单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图74b示出了在刺激36小时后,与等摩尔浓度的未缀合埃罗妥珠单抗(bms)相比,根据bb-01方法制备的埃罗妥珠单抗免疫缀合物(埃罗妥珠单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图74c示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的埃罗妥珠单抗免疫缀合物的液相色谱-质谱分析。图74d示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备埃罗妥珠单抗免疫缀合物的未缀合埃罗妥珠单抗(bms)的液相色谱-质谱分析。图74e示出了用于根据bb-01方法制备埃罗妥珠单抗免疫缀合物的未缀合埃罗妥珠单抗(bms)的液相色谱-质谱分析。图74f示出了在刺激18小时后,与未缀合的埃罗妥珠单抗(bms)相比,根据bb-01方法制备的埃罗妥珠单抗免疫缀合物(埃罗妥珠单抗boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图74g示出了在刺激18小时后,与未缀合的埃罗妥珠单抗(bms)相比,根据bb-01方法制备的埃罗妥珠单抗免疫缀合物(埃罗妥珠单抗boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图74h示出了在刺激18小时后,与未缀合的埃罗妥珠单抗(bms)相比,根据bb-01方法制备的埃罗妥珠单抗免疫缀合物(埃罗妥珠单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图74i示出了在刺激18小时后,与未缀合的埃罗妥珠单抗(bms)相比,根据bb-01方法制备的埃罗妥珠单抗免疫缀合物(埃罗妥珠单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图74j示出了在刺激18小时后,与未缀合的埃罗妥珠单抗(bms)相比,根据bb-01方法制备的埃罗妥珠单抗免疫缀合物(埃罗妥珠单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图74k示出了在刺激18小时后,与未缀合的埃罗妥珠单抗(bms)相比,根据bb-01方法制备的埃罗妥珠单抗免疫缀合物(埃罗妥珠单抗boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图75a示出了在刺激36小时后,与等摩尔浓度的未缀合伊匹单抗(bms)相比,根据bb-01方法制备的伊匹单抗免疫缀合物(伊匹单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图75b示出了在刺激18小时后,与等摩尔浓度的未缀合伊匹单抗(bms)相比,根据bb-01方法制备的伊匹单抗免疫缀合物(伊匹单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图75c示出了在刺激18小时后,与等摩尔浓度的未缀合伊匹单抗(bms)相比,根据bb-01方法制备的伊匹单抗免疫缀合物(伊匹单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图75d示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备伊匹单抗免疫缀合物的未缀合伊匹单抗(bms)的液相色谱-质谱分析。图75e示出了用于根据bb-01方法制备伊匹单抗免疫缀合物的未缀合伊匹单抗(bms)的液相色谱-质谱分析。图75f示出了在刺激18小时后,与未缀合的伊匹单抗(bms)相比,根据bb-01方法制备的伊匹单抗免疫缀合物(伊匹单抗boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图75g示出了在刺激18小时后,与未缀合的伊匹单抗(bms)相比,根据bb-01方法制备的伊匹单抗免疫缀合物(伊匹单抗boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图75h示出了在刺激18小时后,与未缀合的伊匹单抗(bms)相比,根据bb-01方法制备的伊匹单抗免疫缀合物(伊匹单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图75i示出了在刺激18小时后,与未缀合的伊匹单抗(bms)相比,根据bb-01方法制备的伊匹单抗免疫缀合物(伊匹单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图75j示出了在刺激18小时后,与未缀合的伊匹单抗(bms)相比,根据bb-01方法制备的伊匹单抗免疫缀合物(伊匹单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图75k示出了在刺激18小时后,与未缀合的伊匹单抗(bms)相比,根据bb-01方法制备的伊匹单抗免疫缀合物(伊匹单抗boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图76a示出了在刺激18小时后,与等摩尔浓度的未缀合纳武单抗(纳武单抗igg4,bms)相比,根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗igg4boltbody)引发骨髓细胞分泌更高量的il-1β。图76b示出了在刺激18小时后,与等摩尔浓度的未缀合纳武单抗(纳武单抗igg4,bms)相比,根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗igg4boltbody)引发骨髓细胞分泌更高量的tnfα。图76c示出了在刺激36小时后,与等摩尔浓度的未缀合纳武单抗(纳武单抗igg4,bms)相比,根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗igg4boltbody)引发骨髓细胞分泌更高量的il-1β。图76d示出了在刺激36小时后,与等摩尔浓度的未缀合纳武单抗(纳武单抗igg4,bms)相比,根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗igg4boltbody)引发骨髓细胞分泌更高量的tnfα。图76e示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的纳武单抗免疫缀合物的液相色谱-质谱分析。图76f示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备纳武单抗免疫缀合物的未缀合纳武单抗(bms)的液相色谱-质谱分析。图76g示出了用于根据bb-01方法制备纳武单抗免疫缀合物的未缀合纳武单抗(bms)的液相色谱-质谱分析。图76h示出了在刺激18小时后,与未缀合的纳武单抗(bms)相比,根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图76i示出了与未缀合的纳武单抗(bms)相比,用根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗boltbody)刺激18小时后,骨髓细胞上的hla-dr表达。图76j示出了在刺激18小时后,与未缀合的纳武单抗(bms)相比,根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图76k示出了在刺激18小时后,与未缀合的纳武单抗(bms)相比,根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图76l示出了在刺激18小时后,与未缀合的纳武单抗(bms)相比,根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图76m示出了在刺激18小时后,与未缀合的纳武单抗(bms)相比,根据bb-01方法制备的纳武单抗免疫缀合物(纳武单抗boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图77a示出了在刺激36小时后,与等摩尔浓度的未缀合奥滨尤妥珠单抗(roche)相比,根据bb-01方法制备的奥滨尤妥珠单抗免疫缀合物(奥滨尤妥珠单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图77b示出了在刺激36小时后,与等摩尔浓度的未缀合奥滨尤妥珠单抗(roche)相比,根据bb-01方法制备的奥滨尤妥珠单抗免疫缀合物(奥滨尤妥珠单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图77c示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备奥滨尤妥珠单抗免疫缀合物的未缀合奥滨尤妥珠单抗(roche)的液相色谱-质谱分析。图77d示出了用于根据bb-01缀合方法制备奥滨尤妥珠单抗免疫缀合物的未缀合奥滨尤妥珠单抗(roche)的液相色谱-质谱分析。图77e示出了在刺激18小时后,与未缀合的cd20mab(roche)相比,根据bb-01方法制备的奥滨尤妥珠单抗免疫缀合物(奥滨尤妥珠单抗boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图77f示出了与未缀合的cd20mab(roche)相比,用根据bb-01方法制备的奥滨尤妥珠单抗免疫缀合物(奥滨尤妥珠单抗boltbody)刺激18小时后,骨髓细胞上的hla-dr表达。图77g示出了在刺激18小时后,与未缀合的cd20mab(roche)相比,根据bb-01方法制备的奥滨尤妥珠单抗免疫缀合物(奥滨尤妥珠单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图77h示出了在刺激18小时后,与未缀合的cd20mab(roche)相比,根据bb-01方法制备的奥滨尤妥珠单抗免疫缀合物(奥滨尤妥珠单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图77i示出了在刺激18小时后,与未缀合的cd20mab(roche)相比,根据bb-01方法制备的奥滨尤妥珠单抗免疫缀合物(奥滨尤妥珠单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图77j示出了在刺激18小时后,与未缀合的cd20mab(roche)相比,根据bb-01方法制备的奥滨尤妥珠单抗免疫缀合物(奥滨尤妥珠单抗boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图78a示出了在刺激36小时后,与等摩尔浓度的未缀合奥拉单抗(lilly)相比,根据bb-01方法制备的奥拉单抗免疫缀合物(奥拉单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图78b示出了在刺激36小时后,与等摩尔浓度的未缀合奥拉单抗(lilly)相比,根据bb-01方法制备的奥拉单抗免疫缀合物(奥拉单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图78c示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的奥拉单抗免疫缀合物的液相色谱-质谱分析。图78d示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备奥拉单抗免疫缀合物的未缀合奥拉单抗(lilly)的液相色谱-质谱分析。图78e示出了用于根据bb-01缀合方法制备奥拉单抗免疫缀合物的未缀合奥拉单抗(lilly)的液相色谱-质谱分析。图78f示出了在刺激18小时后,与未缀合的奥拉单抗(lilly)相比,根据bb-01方法制备的奥拉单抗免疫缀合物(奥拉单抗boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图78g示出了在刺激18小时后,与未缀合的奥拉单抗(lilly)相比,根据bb-01方法制备的奥拉单抗免疫缀合物(奥拉单抗boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图78h示出了在刺激18小时后,与未缀合的奥拉单抗(lilly)相比,根据bb-01方法制备的奥拉单抗免疫缀合物(奥拉单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图78i示出了在刺激18小时后,与未缀合的奥拉单抗(lilly)相比,根据bb-01方法制备的奥拉单抗免疫缀合物(奥拉单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图78j示出了在刺激18小时后,与未缀合的奥拉单抗(lilly)相比,根据bb-01方法制备的奥拉单抗免疫缀合物(奥拉单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图78k示出了在刺激18小时后,与未缀合的奥拉单抗(lilly)相比,根据bb-01方法制备的奥拉单抗免疫缀合物(奥拉单抗boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图79a示出了在刺激36小时后,与等摩尔浓度的未缀合派姆单抗(merck)相比,根据bb-01方法制备的派姆单抗免疫缀合物(派姆单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图79b示出了在刺激36小时后,与等摩尔浓度的未缀合派姆单抗(merck)相比,根据bb-01方法制备的派姆单抗免疫缀合物(派姆单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图79c示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的派姆单抗免疫缀合物的液相色谱-质谱分析。图79d示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备派姆单抗免疫缀合物的未缀合派姆单抗(merck)的液相色谱-质谱分析。图79e示出了用于根据bb-01缀合方法制备派姆单抗免疫缀合物的未缀合派姆单抗(merck)的液相色谱-质谱分析。图79f示出了在刺激18小时后,与未缀合的派姆单抗(merck)相比,根据bb-01方法制备的派姆单抗免疫缀合物(派姆单抗boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图79g示出了在刺激18小时后,与未缀合的派姆单抗(merck)相比,根据bb-01方法制备的派姆单抗免疫缀合物(派姆单抗boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图79h示出了在刺激18小时后,与未缀合的派姆单抗(merck)相比,根据bb-01方法制备的派姆单抗免疫缀合物(派姆单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图79i示出了在刺激18小时后,与未缀合的派姆单抗(merck)相比,根据bb-01方法制备的派姆单抗免疫缀合物(派姆单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图79j示出了在刺激18小时后,与未缀合的派姆单抗(merck)相比,根据bb-01方法制备的派姆单抗免疫缀合物(派姆单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图79k示出了在刺激18小时后,与未缀合的派姆单抗(merck)相比,根据bb-01方法制备的派姆单抗免疫缀合物(派姆单抗boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图80a示出了在刺激18小时后,与等摩尔浓度的未缀合帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图80b示出了在刺激18小时后,与等摩尔浓度的未缀合的帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图80c示出了在刺激36小时后,与等摩尔浓度的未缀合帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图80d示出了在刺激36小时后,与等摩尔浓度的未缀合的帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图80e示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的帕妥珠单抗免疫缀合物的液相色谱-质谱分析。图80f示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备帕妥珠单抗免疫缀合物的未缀合帕妥珠单抗(roche)的液相色谱-质谱分析。图80g示出了用于根据bb-01缀合方法制备帕妥珠单抗免疫缀合物的未缀合帕妥珠单抗(roche)的液相色谱-质谱分析。图80h示出了在刺激18小时后,与未缀合的帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图80i示出了在刺激18小时后,与未缀合的帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图80j示出了在刺激18小时后,与未缀合的帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图80k示出了在刺激18小时后,与未缀合的帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图80l示出了在刺激18小时后,与未缀合的帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图80m示出了在刺激18小时后,与未缀合的帕妥珠单抗(roche)相比,根据bb-01方法制备的帕妥珠单抗免疫缀合物(帕妥珠单抗boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图81a示出了在刺激36小时后,与等摩尔浓度的未缀合利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗免疫缀合物(利妥昔单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图81b示出了在刺激36小时后,与等摩尔浓度的未缀合的利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗免疫缀合物(利妥昔单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图81c示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。图81d示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。图81e示出了根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。图81f示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图81g示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图81h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,roche)相比,根据bb-01方法制备的利妥昔单抗免疫缀合物(bb-01)在引发骨髓细胞上的cd123上调方面更为优越。图81i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,roche)相比,根据bb-01方法制备的利妥昔单抗免疫缀合物(bb-01)在引发骨髓细胞上的hla-dr上调方面更为优越。图81j示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,roche)相比,根据bb-01方法制备的利妥昔单抗免疫缀合物(bb-01)在引发骨髓细胞上的cd14下调方面更为优越。图81k示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,roche)相比,根据bb-01方法制备的利妥昔单抗免疫缀合物(bb-01)在引发骨髓细胞上的cd16下调方面更为优越。图81l示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,roche)相比,根据bb-01方法制备的利妥昔单抗免疫缀合物(bb-01)在引发骨髓细胞上的cd40上调方面更为优越。图81m示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,roche)相比,根据bb-01方法制备的利妥昔单抗免疫缀合物(bb-01)在引发骨髓细胞上的cd86上调方面更为优越。图82a示出了在刺激36小时后,与等摩尔浓度的未缀合曲妥珠单抗(roche)相比,根据bb-01方法制备的曲妥珠单抗免疫缀合物(曲妥珠单抗boltbody)引发骨髓细胞分泌更高量的il-1β。图82b示出了在刺激36小时后,与等摩尔浓度的未缀合曲妥珠单抗(roche)相比,根据bb-01方法制备的曲妥珠单抗免疫缀合物(曲妥珠单抗boltbody)引发骨髓细胞分泌更高量的tnfα。图82c示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的曲妥珠单抗免疫缀合物的液相色谱-质谱分析。图82d示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备曲妥珠单抗免疫缀合物的未缀合曲妥珠单抗(roche)的液相色谱-质谱分析。图82e示出了用于根据bb-01缀合方法制备曲妥珠单抗免疫缀合物的未缀合曲妥珠单抗(roche)的液相色谱-质谱分析。图82f示出了在刺激18小时后,与未缀合的曲妥珠单抗(闭合方形,黑色;roche)相比,根据bb-01方法制备的曲妥珠单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd123上调方面更为优越。图82g示出了在刺激18小时后,与未缀合的曲妥珠单抗(闭合方形,黑色;roche)相比,根据bb-01方法制备的曲妥珠单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的hla-dr上调方面更为优越。图82h示出了在刺激18小时后,与未缀合的曲妥珠单抗(闭合方形,黑色;roche)相比,根据bb-01方法制备的曲妥珠单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd14下调方面更为优越。图82i示出了在刺激18小时后,与未缀合的曲妥珠单抗(闭合方形,黑色;roche)相比,根据bb-01方法制备的曲妥珠单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd16下调方面更为优越。图82j示出了在刺激18小时后,与未缀合的曲妥珠单抗(闭合方形,黑色;roche)相比,根据bb-01方法制备的曲妥珠单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd40上调方面更为优越。图82k示出了在刺激18小时后,与未缀合的曲妥珠单抗(闭合方形,黑色;roche)相比,根据bb-01方法制备的曲妥珠单抗免疫缀合物(闭合圆形,红色)在引发骨髓细胞上的cd86上调方面更为优越。图83a示出了在刺激36小时后,与等摩尔浓度的未缀合依那西普(amgen)相比,根据bb-01方法制备的依那西普免疫缀合物(依那西普boltbody)引发骨髓细胞分泌更高量的il-1β。图83b示出了在刺激36小时后,与等摩尔浓度的未缀合依那西普(amgen)相比,根据bb-01方法制备的依那西普免疫缀合物(依那西普boltbody)引发骨髓细胞分泌更高量的tnfα。图83c示出了在刺激18小时后,与未缀合的依那西普(amgen)相比,根据bb-01方法制备的依那西普免疫缀合物(依那西普boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图83d示出了在刺激18小时后,与未缀合的依那西普(amgen)相比,根据bb-01方法制备的依那西普免疫缀合物(依那西普boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图83e示出了在刺激18小时后,与未缀合的依那西普(amgen)相比,根据bb-01方法制备的依那西普免疫缀合物(依那西普boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图83f示出了在刺激18小时后,与未缀合的依那西普(amgen)相比,根据bb-01方法制备的依那西普免疫缀合物(依那西普boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图83g示出了在刺激18小时后,与未缀合的依那西普(amgen)相比,根据bb-01方法制备的依那西普免疫缀合物(依那西普boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图83h示出了在刺激18小时后,与未缀合的依那西普(amgen)相比,根据bb-01方法制备的依那西普免疫缀合物(依那西普boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图84a示出了由利妥昔单抗生物仿制药(lgmpharma)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。所计算的dar为0.7。图84b示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图84c示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(lgmpharma)的液相色谱-质谱分析。图84d示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar0.7)]刺激18小时后,骨髓细胞上的cd14表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图84e示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar0.7)]刺激18小时后,骨髓细胞上的cd16表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图84f示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar0.7)]刺激18小时后,骨髓细胞上的cd40表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图84g示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar0.7)]刺激18小时后,骨髓细胞上的cd86表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图84h示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar0.7)]刺激18小时后,骨髓细胞上的cd123表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图84i示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar0.7)]刺激18小时后,骨髓细胞上的hla-dr表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图85a示出了由利妥昔单抗生物仿制药(lgmpharma)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。所计算的dar为1.6。图85b示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图85c示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(lgmpharma)的液相色谱-质谱分析。图85d示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(lgmpharma)的液相色谱-质谱分析。图85e示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar1.6)]刺激18小时后,骨髓细胞上的cd14表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图85f示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar1.6)]刺激18小时后,骨髓细胞上的cd16表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图85g示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar1.6)]刺激18小时后,骨髓细胞上的cd40表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图85h示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar1.6)]刺激18小时后,骨髓细胞上的cd86表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图85i示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar1.6)]刺激18小时后,骨髓细胞上的cd123表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图85j示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar1.6)]刺激18小时后,骨髓细胞上的hla-dr表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图86a示出了由利妥昔单抗生物仿制药(lgmpharma)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。所计算的dar为2.5。图86b示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图86c示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗(lgmpharma)的液相色谱-质谱分析。图86d示出了由利妥昔单抗生物仿制药(lgmpharma)根据bb-01缀合方法制备的利妥昔单抗免疫缀合物的液相色谱-质谱分析。所计算的dar为2.5。图86e示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar2.5)]刺激18小时后,骨髓细胞上的cd14表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图86f示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar2.5)]刺激18小时后,骨髓细胞上的cd16表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图86g示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar2.5)]刺激18小时后,骨髓细胞上的cd40表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图86h示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar2.5)]刺激18小时后,骨髓细胞上的cd86表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图86i示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar1.6)]刺激18小时后,骨髓细胞上的cd123表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图86j示出了用根据bb-01方法制备的利妥昔单抗免疫缀合物[bb-01(dar1.6)]刺激18小时后,骨髓细胞上的hla-dr表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图87a示出了在刺激18小时后,全部由利妥昔单抗生物仿制药(lgmpharma)根据bb-01方法制备的具有不同dar的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd14下调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图87b示出了在刺激18小时后,全部由利妥昔单抗生物仿制药(lgmpharma)根据bb-01方法制备的具有不同dar的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd16下调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图87c示出了在刺激18小时后,全部由利妥昔单抗生物仿制药(lgmpharma)根据bb-01方法制备的具有不同dar的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd40上调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图87d示出了在刺激18小时后,全部由利妥昔单抗生物仿制药(lgmpharma)根据bb-01方法制备的具有不同dar的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd86上调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图87e示出了在刺激18小时后,全部由利妥昔单抗生物仿制药(lgmpharma)根据bb-01方法制备的具有不同dar的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的cd123上调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图87f示出了在刺激18小时后,全部由利妥昔单抗生物仿制药(lgmpharma)根据bb-01方法制备的具有不同dar的利妥昔单抗免疫缀合物引发骨髓细胞上相当大的hla-dr上调。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图88a示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗iga2(invivogen,hcd20-mab7)的液相色谱-质谱分析。图88b示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的利妥昔单抗iga2免疫缀合物的液相色谱-质谱分析。图88c示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20iga2;invivogen,hcd20-mac7)相比,根据bb-01方法制备的利妥昔单抗iga2免疫缀合物(cd20iga2boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图88d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20iga2;invivogen,hcd20-mac7)相比,根据bb-01方法制备的利妥昔单抗iga2免疫缀合物(cd20iga2boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图88e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20iga2;invivogen,hcd20-mac7)相比,根据bb-01方法制备的利妥昔单抗iga2免疫缀合物(cd20iga2boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图88f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20iga2;invivogen,hcd20-mac7)相比,根据bb-01方法制备的利妥昔单抗iga2免疫缀合物(cd20iga2boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图88g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20iga2;invivogen,hcd20-mac7)相比,根据bb-01方法制备的利妥昔单抗iga2免疫缀合物(cd20iga2boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图88h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20iga2;invivogen,hcd20-mac7)相比,根据bb-01方法制备的利妥昔单抗iga2免疫缀合物(cd20iga2boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图89a示出了在刺激36小时后,与等摩尔浓度(0.2μm)的未缀合利妥昔单抗(igg1;invivogen,hcd20-mab1)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(igg1boltbody)引发骨髓细胞分泌更高量的tnfα。图89b示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗igg1(invivogen,hcd20-mab1)的液相色谱-质谱分析。图89c示出了根据bb-01缀合方法制备的利妥昔单抗igg1免疫缀合物的液相色谱-质谱分析。图89d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20igg1;invivogen,hcd20-mac1)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(cd20igg1boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图89e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20igg1;invivogen,hcd20-mac1)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(cd20igg1boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图89f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20igg1;invivogen,hcd20-mac1)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(cd20igg1boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图89g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20igg1;invivogen,hcd20-mac1)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(cd20igg1boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图89h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20igg1;invivogen,hcd20-mac1)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(cd20igg1boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图89i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20igg1;invivogen,hcd20-mac1)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(cd20igg1boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图90a示出了在刺激18小时后,与等摩尔浓度(0.2μm)的未缀合利妥昔单抗(igg1af;invivogen,hcd20-mab13)相比,根据bb-01方法制备的利妥昔单抗非岩藻糖化igg1免疫缀合物(igg1afboltbody)引发骨髓细胞分泌更高量的tnfα。图90b示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗igg1(invivogen,hcd20-mab13)的液相色谱-质谱分析。图90c示出了根据bb-01缀合方法制备的利妥昔单抗igg1免疫缀合物的液相色谱-质谱分析。图90d示出了在刺激18小时后,与未缀合的利妥昔单抗(igg1af;invivogen,hcd20-mab13)相比,根据bb-01方法制备的利妥昔单抗igg1af免疫缀合物(igg1afboltbody)在引发骨髓细胞上的cd14下调方面更为优越。图90e示出了在刺激18小时后,与未缀合的利妥昔单抗(igg1af;invivogen,hcd20-mab13)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(igg1afboltbody)在引发骨髓细胞上的cd16下调方面更为优越。图90f示出了在刺激18小时后,与未缀合的利妥昔单抗(igg1af;invivogen,hcd20-mab13)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(igg1afboltbody)在引发骨髓细胞上的cd40上调方面更为优越。图90g示出了在刺激18小时后,与未缀合的利妥昔单抗(igg1af;invivogen,hcd20-mab13)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(igg1afboltbody)在引发骨髓细胞上的cd86上调方面更为优越。图90h示出了在刺激18小时后,与未缀合的利妥昔单抗(igg1af;invivogen,hcd20-mab13)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(igg1afboltbody)在引发骨髓细胞上的cd123上调方面更为优越。图90i示出了在刺激18小时后,与未缀合的利妥昔单抗(igg1af;invivogen,hcd20-mab13)相比,根据bb-01方法制备的利妥昔单抗igg1免疫缀合物(igg1afboltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图91a示出了在刺激36小时后,与等摩尔浓度(0.2μm)的未缀合利妥昔单抗(igg1nq;invivogen,hcd20-mab12)相比,根据bb-01方法制备的利妥昔单抗n297q突变体igg1免疫缀合物(igg1nqboltbody)引发骨髓细胞分泌更高量的tnfα。图91b示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗igg1(invivogen,hcd20-mab12)的液相色谱-质谱分析。图91c示出了根据bb-01缀合方法制备的利妥昔单抗igg1免疫缀合物的液相色谱-质谱分析。图91d示出了与未缀合的利妥昔单抗igg1(invivogen,hcd20-mab12)相比,用根据bb-01方法制备的利妥昔单抗n297q突变体igg1免疫缀合物(igg1nqboltbody)刺激18小时后,骨髓细胞上的cd14表达。图91e示出了与未缀合的利妥昔单抗igg1(invivogen,hcd20-mab12)相比,用根据bb-01方法制备的利妥昔单抗n297q突变体igg1免疫缀合物(igg1nqboltbody)刺激18小时后,骨髓细胞上的cd16表达。图91f示出了与未缀合的利妥昔单抗igg1(invivogen,hcd20-mab12)相比,用根据bb-01方法制备的利妥昔单抗n297q突变体igg1免疫缀合物(igg1nqboltbody)刺激18小时后,骨髓细胞上的cd40表达。图91g示出了与未缀合的利妥昔单抗igg1(invivogen,hcd20-mab12)相比,用根据bb-01方法制备的利妥昔单抗n297q突变体igg1免疫缀合物(igg1nqboltbody)刺激18小时后,骨髓细胞上的cd86表达。图91h示出了与未缀合的利妥昔单抗igg1(invivogen,hcd20-mab12)相比,用根据bb-01方法制备的利妥昔单抗n297q突变体igg1免疫缀合物(igg1nqboltbody)刺激18小时后,骨髓细胞上的cd123表达。图91i示出了与未缀合的利妥昔单抗igg1(invivogen,hcd20-mab12)相比,用根据bb-01方法制备的利妥昔单抗n297q突变体igg1免疫缀合物(igg1nqboltbody)刺激18小时后,骨髓细胞上的hla-dr表达。图92a示出了在刺激18小时后,与等摩尔浓度(0.2μm)的未缀合利妥昔单抗(igg2;invivogen,hcd20-mab2)相比,根据bb-01方法制备的利妥昔单抗igg2免疫缀合物(igg2boltbody)引发骨髓细胞分泌更高量的tnfα。图92b示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗igg2(invivogen,hcd20-mab2)的液相色谱-质谱分析。图92c示出了根据bb-01缀合方法制备的利妥昔单抗igg2免疫缀合物的液相色谱-质谱分析。图92d示出了在刺激18小时后,与未缀合的利妥昔单抗(igg2;invivogen,hcd20-mab2)相比,根据bb-01方法制备的利妥昔单抗igg2免疫缀合物(igg2boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图92e示出了在刺激18小时后,与未缀合的利妥昔单抗(igg2;invivogen,hcd20-mab2)相比,根据bb-01方法制备的利妥昔单抗igg2免疫缀合物(igg2boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图92f示出了在刺激18小时后,与未缀合的利妥昔单抗(igg2;invivogen,hcd20-mab2)相比,根据bb-01方法制备的利妥昔单抗igg2免疫缀合物(igg2boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图92g示出了在刺激18小时后,与未缀合的利妥昔单抗(igg2;invivogen,hcd20-mab2)相比,根据bb-01方法制备的利妥昔单抗igg2免疫缀合物(igg2boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图92h示出了在刺激18小时后,与未缀合的利妥昔单抗(igg2;invivogen,hcd20-mab2)相比,根据bb-01方法制备的利妥昔单抗igg2免疫缀合物(igg2boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图92i示出了在刺激18小时后,与未缀合的利妥昔单抗(igg2;invivogen,hcd20-mab2)相比,根据bb-01方法制备的利妥昔单抗igg2免疫缀合物(igg2boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图93a示出了在刺激18小时后,与等摩尔浓度(0.2μm)的未缀合利妥昔单抗(igg3;invivogen,hcd20-mab3)相比,根据bb-01方法制备的利妥昔单抗igg3免疫缀合物(igg3boltbody)引发骨髓细胞分泌更高量的tnfα。图93b示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗igg3(invivogen,hcd20-mab3)的液相色谱-质谱分析。图93c示出了根据bb-01缀合方法制备的利妥昔单抗igg3免疫缀合物的液相色谱-质谱分析。图93d示出了在刺激18小时后,与未缀合的利妥昔单抗(igg3;invivogen,hcd20-mab3)相比,根据bb-01方法制备的利妥昔单抗igg3免疫缀合物(igg3boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图93e示出了在刺激18小时后,与未缀合的利妥昔单抗(igg3;invivogen,hcd20-mab3)相比,根据bb-01方法制备的利妥昔单抗igg3免疫缀合物(igg3boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图93f示出了在刺激18小时后,与未缀合的利妥昔单抗(igg3;invivogen,hcd20-mab3)相比,根据bb-01方法制备的利妥昔单抗igg3免疫缀合物(igg3boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图93g示出了在刺激18小时后,与未缀合的利妥昔单抗(igg3;invivogen,hcd20-mab3)相比,根据bb-01方法制备的利妥昔单抗igg3免疫缀合物(igg3boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图93h示出了在刺激18小时后,与未缀合的利妥昔单抗(igg3;invivogen,hcd20-mab3)相比,根据bb-01方法制备的利妥昔单抗igg3免疫缀合物(igg3boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图93i示出了在刺激18小时后,与未缀合的利妥昔单抗(igg3;invivogen,hcd20-mab3)相比,根据bb-01方法制备的利妥昔单抗igg3免疫缀合物(igg3boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图94a示出了在刺激18小时后,与等摩尔浓度(0.2μm)的未缀合利妥昔单抗(igg4;invivogen,hcd20-mab4)相比,根据bb-01方法制备的利妥昔单抗igg4免疫缀合物(igg4boltbody)引发骨髓细胞分泌更高量的tnfα。图94b示出了用于根据bb-01缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗igg4(invivogen,hcd20-mab4)的液相色谱-质谱分析。图94c示出了根据bb-01缀合方法制备的利妥昔单抗igg4免疫缀合物的液相色谱-质谱分析。图94d示出了在刺激18小时后,与未缀合的利妥昔单抗(igg4;invivogen,hcd20-mab4)相比,根据bb-01方法制备的利妥昔单抗igg4免疫缀合物(igg4boltbody)在引发骨髓细胞上的cd14下调方面更为优越。图94e示出了在刺激18小时后,与未缀合的利妥昔单抗(igg4;invivogen,hcd20-mab4)相比,根据bb-01方法制备的利妥昔单抗igg4免疫缀合物(igg4boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图94f示出了在刺激18小时后,与未缀合的利妥昔单抗(igg4;invivogen,hcd20-mab4)相比,根据bb-01方法制备的利妥昔单抗igg4免疫缀合物(igg4boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图94g示出了在刺激18小时后,与未缀合的利妥昔单抗(igg4;invivogen,hcd20-mab4)相比,根据bb-01方法制备的利妥昔单抗igg4免疫缀合物(igg4boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图94h示出了在刺激18小时后,与未缀合的利妥昔单抗(igg4;invivogen,hcd20-mab4)相比,根据bb-01方法制备的利妥昔单抗igg4免疫缀合物(igg4boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图94i示出了在刺激18小时后,与未缀合的利妥昔单抗(igg4;invivogen,hcd20-mab4)相比,根据bb-01方法制备的利妥昔单抗igg4免疫缀合物(igg4boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图95是列出分别在图89、90、92、93和94中提及的igg1boltbody(bb-igg1)、igg1afboltbody(bb-igg1af)、igg2boltbody(bb-igg2)、igg3boltbody(bb-igg3)和igg4boltbody(bb-igg4)的ec50值以及cd14、cd40和cd86表达的倍数变化的表。基于由5倍系列稀释产生的剂量-响应曲线计算ec50值。相对于指定浓度的相应裸抗体计算所有倍数变化。图96a示出了用于根据bb-01缀合方法制备阿特珠单抗免疫缀合物的未缀合阿特珠单抗igg1同型变体(invivogen,hpdl1-mab1)的液相色谱-质谱分析。图96b示出了根据bb-01缀合方法制备的阿特珠单抗igg1同型变体免疫缀合物的液相色谱-质谱分析。图96c示出了与未缀合的阿特珠单抗(阿特珠单抗-igg1;invivogen,hpdl1-mab1)相比,用根据bb-01方法制备的阿特珠单抗igg1同型变体免疫缀合物(阿特珠单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd14表达。图96d示出了与未缀合的阿特珠单抗(阿特珠单抗-igg1;invivogen,hpdl1-mab1)相比,用根据bb-01方法制备的阿特珠单抗igg1同型变体免疫缀合物(阿特珠单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd16表达。图96e示出了与未缀合的阿特珠单抗(阿特珠单抗-igg1;invivogen,hpdl1-mab1)相比,用根据bb-01方法制备的阿特珠单抗igg1同型变体免疫缀合物(阿特珠单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd40表达。图96f示出了与未缀合的阿特珠单抗(阿特珠单抗-igg1;invivogen,hpdl1-mab1)相比,用根据bb-01方法制备的阿特珠单抗igg1同型变体免疫缀合物(阿特珠单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd86表达。图96g示出了与未缀合的阿特珠单抗(阿特珠单抗-igg1;invivogen,hpdl1-mab1)相比,用根据bb-01方法制备的阿特珠单抗igg1同型变体免疫缀合物(阿特珠单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd123表达。图96h示出了与未缀合的阿特珠单抗(阿特珠单抗-igg1;invivogen,hpdl1-mab1)相比,用根据bb-01方法制备的阿特珠单抗igg1同型变体免疫缀合物(阿特珠单抗-igg1boltbody)刺激18小时后,骨髓细胞上的hla-dr表达。图97a示出了用于根据bb-01缀合方法制备纳武单抗免疫缀合物的未缀合纳武单抗igg1同型变体(invivogen,hpd1ni-mab1)的液相色谱-质谱分析。图97b示出了根据bb-01缀合方法制备的纳武单抗igg1同型变体免疫缀合物的液相色谱-质谱分析。图97c示出了与未缀合的纳武单抗(纳武单抗-igg1;invivogen,hpd1ni-mab1)相比,用根据bb-01方法制备的纳武单抗igg1同型变体免疫缀合物(纳武单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd14表达。图97d示出了与未缀合的纳武单抗(纳武单抗-igg1;invivogen,hpd1ni-mab1)相比,用根据bb-01方法制备的纳武单抗igg1同型变体免疫缀合物(纳武单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd16表达。图97e示出了与未缀合的纳武单抗(纳武单抗-igg1;invivogen,hpd1ni-mab1)相比,用根据bb-01方法制备的纳武单抗igg1同型变体免疫缀合物(纳武单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd40表达。图97f示出了与未缀合的纳武单抗(纳武单抗-igg1;invivogen,hpd1ni-mab1)相比,用根据bb-01方法制备的纳武单抗igg1同型变体免疫缀合物(纳武单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd86表达。图97g示出了与未缀合的纳武单抗(纳武单抗-igg1;invivogen,hpd1ni-mab1)相比,用根据bb-01方法制备的纳武单抗igg1同型变体免疫缀合物(纳武单抗-igg1boltbody)刺激18小时后,骨髓细胞上的cd123表达。图97h示出了与未缀合的纳武单抗(纳武单抗-igg1;invivogen,hpd1ni-mab1)相比,用根据bb-01方法制备的纳武单抗igg1同型变体免疫缀合物(纳武单抗-igg1boltbody)刺激18小时后,骨髓细胞上的hla-dr表达。图98a示出了用于在用pngasef过夜去糖基化后根据bb-01缀合方法制备抗gp75mab免疫缀合物的未缀合抗gp75mab(bioxcell,ta99-be0151)的液相色谱-质谱分析。图98b示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的抗gp75mab免疫缀合物的液相色谱-质谱分析。图98c示出了用根据bb-01方法制备的抗gp75mab免疫缀合物(gp75boltbody)刺激18小时后,骨髓细胞上的cd14表达。图98d示出了用根据bb-01方法制备的抗gp75mab免疫缀合物(gp75boltbody)刺激18小时后,骨髓细胞上的cd16表达。图98e示出了用根据bb-01方法制备的抗gp75mab免疫缀合物(gp75boltbody)刺激18小时后,骨髓细胞上的cd40表达。图98f示出了用根据bb-01方法制备的抗gp75mab免疫缀合物(gp75boltbody)刺激18小时后,骨髓细胞上的cd86表达。图98g示出了用根据bb-01方法制备的抗gp75mab免疫缀合物(gp75boltbody)刺激18小时后,骨髓细胞上的hla-dr表达。图99a示出了用于在用pngasef过夜去糖基化后根据bb-03缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图99b示出了用于根据bb-03缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图99c示出了根据bb-03缀合方法制备的bb-03免疫缀合物的液相色谱-质谱分析。图99d示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-03方法制备的bb-03免疫缀合物(bb-03)在引发骨髓细胞上的cd123上调方面更为优越。图99e示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-03方法制备的bb-03免疫缀合物(bb-03)在引发骨髓细胞上的hla-dr上调方面更为优越。图99f示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-03方法制备的bb-03免疫缀合物(bb-03)在引发骨髓细胞上的cd14下调方面更为优越。图99g示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-03方法制备的bb-03免疫缀合物(bb-03)在引发骨髓细胞上的cd16下调方面更为优越。图99h示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-03方法制备的bb-03免疫缀合物(bb-03)在引发骨髓细胞上的cd40上调方面更为优越。图99i示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-03方法制备的bb-03免疫缀合物(bb-03)在引发骨髓细胞上的cd86上调方面更为优越。图100a示出了用于在用pngasef过夜去糖基化后根据bb-05缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图100b示出了在用pngasef过夜去糖基化后根据bb-05缀合方法制备的bb-05免疫缀合物的液相色谱-质谱分析。图100c示出了用于根据bb-05缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图100d示出了用根据bb-05方法制备的bb-05免疫缀合物(bb-05)刺激18小时后,骨髓细胞上的cd123表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图100e示出了用根据bb-05方法制备的bb-05免疫缀合物(bb-05)刺激18小时后,骨髓细胞上的hla-dr表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图100f示出了用根据bb-05方法制备的bb-05免疫缀合物(bb-05)刺激18小时后,骨髓细胞上的cd14表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图100g示出了用根据bb-05方法制备的bb-05免疫缀合物(bb-05)刺激18小时后,骨髓细胞上的cd16表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图100h示出了用根据bb-05方法制备的bb-05免疫缀合物(bb-05)刺激18小时后,骨髓细胞上的cd40表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图100i示出了用根据bb-05方法制备的bb-05免疫缀合物(bb-05)刺激18小时后,骨髓细胞上的cd86表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图101a示出了用于在用pngasef过夜去糖基化后根据bb-06缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图101b示出了用于根据bb-06缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图101c示出了根据bb-06缀合方法制备的bb-06免疫缀合物的液相色谱-质谱分析。图102a示出了在用pngasef过夜去糖基化后根据bb-07缀合方法制备的bb-07免疫缀合物的液相色谱-质谱分析。图102b示出了用于在用pngasef过夜去糖基化后根据bb-07缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图102c示出了用于根据bb-07缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图102d示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd123表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102d还比较了bb-07与根据bb-01缀合方法制备的bb-01免疫缀合物(bb-01)。图102e示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的hla-dr表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102e还比较了bb-07与根据bb-01缀合方法制备的bb-01免疫缀合物(bb-01)。图102f示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd14表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102f还比较了bb-07与根据bb-01缀合方法制备的bb-01免疫缀合物(bb-01)。图102g示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd16表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102g还比较了bb-07与根据bb-01缀合方法制备的bb-01免疫缀合物(bb-01)。图102h示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd40表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102h还比较了bb-07与根据bb-01缀合方法制备的bb-01免疫缀合物(bb-01)。图102i示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd86表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102i还比较了bb-07与根据bb-01缀合方法制备的bb-01免疫缀合物(bb-01)。图102j示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd123表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102k示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd14表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102l示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd16表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102m示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd40表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图102m还比较了bb-07与根据bb-01缀合方法制备的bb-01免疫缀合物(bb-01)。图102n示出了用根据bb-07方法制备的bb-07免疫缀合物(bb-07)刺激18小时后,骨髓细胞上的cd86表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图103a示出了用于在用pngasef过夜去糖基化后根据bb-11缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图103b示出了用于根据bb-11缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图103c示出了在用pngasef过夜去糖基化后根据bb-11缀合方法制备的bb-11免疫缀合物的液相色谱-质谱分析。图103d示出了用根据bb-11方法制备的bb-11免疫缀合物(bb-11)刺激18小时后,骨髓细胞上的cd123表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图103e示出了用根据bb-11方法制备的bb-11免疫缀合物(bb-11)刺激18小时后,骨髓细胞上的hla-dr表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图103f示出了用根据bb-11方法制备的bb-11免疫缀合物(bb-11)刺激18小时后,骨髓细胞上的cd14表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图103g示出了用根据bb-11方法制备的bb-11免疫缀合物(bb-11)刺激18小时后,骨髓细胞上的cd16表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图103h示出了用根据bb-11方法制备的bb-11免疫缀合物(bb-11)刺激18小时后,骨髓细胞上的cd40表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图103i示出了用根据bb-11方法制备的bb-11免疫缀合物(bb-11)刺激18小时后,骨髓细胞上的cd86表达。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图104a示出了用于根据bb-14pfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图104b示出了用于在用pngasef过夜去糖基化后根据bb-14pfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图104c示出了根据bb-14pfp缀合方法制备的bb-14免疫缀合物的液相色谱-质谱分析。图104d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-14pfp缀合方法制备的利妥昔单抗免疫缀合物(bb-14)在引发骨髓细胞上的cd123上调方面更为优越。图104e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-14pfp缀合方法制备的利妥昔单抗免疫缀合物(bb-14)在引发骨髓细胞上的hla-dr上调方面更为优越。图104f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-14pfp缀合方法制备的利妥昔单抗免疫缀合物(bb-14)在引发骨髓细胞上的cd14上调方面更为优越。图104g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-14pfp缀合方法制备的利妥昔单抗免疫缀合物(bb-14)在引发骨髓细胞上的cd16上调方面更为优越。图104h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-14pfp缀合方法制备的利妥昔单抗免疫缀合物(bb-14)在引发骨髓细胞上的cd40上调方面更为优越。图104i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-14pfp缀合方法制备的利妥昔单抗免疫缀合物(bb-14)在引发骨髓细胞上的cd86上调方面更为优越。图105a示出了用于在用pngasef过夜去糖基化后根据bb-15nhs缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图105b示出了用于根据bb-15nhs缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图105c示出了根据bb-15nhs缀合方法制备的bb-15免疫缀合物的液相色谱-质谱分析。图105d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-15nhs缀合方法制备的利妥昔单抗免疫缀合物(bb-15)在引发骨髓细胞上的cd123上调方面更为优越。图105e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-15nhs缀合方法制备的利妥昔单抗免疫缀合物(bb-15)在引发骨髓细胞上的hla-dr上调方面更为优越。图105f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-15nhs缀合方法制备的利妥昔单抗免疫缀合物(bb-15)在引发骨髓细胞上的cd14上调方面更为优越。图105g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-15nhs缀合方法制备的利妥昔单抗免疫缀合物(bb-15)在引发骨髓细胞上的cd16上调方面更为优越。图105h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-15nhs缀合方法制备的利妥昔单抗免疫缀合物(bb-15)在引发骨髓细胞上的cd40上调方面更为优越。图105i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-15nhs缀合方法制备的利妥昔单抗免疫缀合物(bb-15)在引发骨髓细胞上的cd86上调方面更为优越。图106a示出了在用pngasef过夜去糖基化后根据bb-17tfp缀合方法制备的bb-17免疫缀合物的液相色谱-质谱分析。图106b示出了用于在用pngasef过夜去糖基化后根据bb-17tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图106c示出了用于根据bb-17tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图106d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-17tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-17)在引发骨髓细胞上的cd123上调方面更为优越。图106e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-17tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-17)在引发骨髓细胞上的hla-dr上调方面更为优越。图106f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-17tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-17)在引发骨髓细胞上的cd14上调方面更为优越。图106g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-17tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-17)在引发骨髓细胞上的cd16上调方面更为优越。图106h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-17tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-17)在引发骨髓细胞上的cd40上调方面更为优越。图106i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-17tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-17)在引发骨髓细胞上的cd86上调方面更为优越。图107a示出了用于在用pngasef过夜去糖基化后根据bb-22sata缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图107b示出了用于根据bb-22sata缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图107c示出了根据bb-22sata缀合方法制备的bb-22免疫缀合物的液相色谱-质谱分析。图108a示出了根据bb-24tfp缀合方法制备的bb-24免疫缀合物的液相色谱-质谱分析。图108b示出了用于根据bb-24tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,alphamab)的液相色谱-质谱分析。图108c示出了用于在用pngasef过夜去糖基化后根据bb-24tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,alphamab)的液相色谱-质谱分析。图108d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-24tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-24)在引发骨髓细胞上的cd123上调方面更为优越。图108e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-24tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-24)在引发骨髓细胞上的hla-dr上调方面更为优越。图108f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-24tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-24)在引发骨髓细胞上的cd14上调方面更为优越。图108g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-24tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-24)在引发骨髓细胞上的cd16上调方面更为优越。图108h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-24tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-24)在引发骨髓细胞上的cd40上调方面更为优越。图108i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-24tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-24)在引发骨髓细胞上的cd86上调方面更为优越。图109a示出了在用pngasef过夜去糖基化后根据bb-26tfp缀合方法制备的bb-26免疫缀合物的液相色谱-质谱分析。图109b示出了用于在用pngasef过夜去糖基化后根据bb-26tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图109c示出了用于根据bb-26tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图109d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-26tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-26)在引发骨髓细胞上的cd123上调方面更为优越。图109e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-26tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-26)在引发骨髓细胞上的hla-dr上调方面更为优越。图109f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-26tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-26)在引发骨髓细胞上的cd40上调方面更为优越。图109g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-26tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-26)在引发骨髓细胞上的cd86上调方面更为优越。图110a示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-27tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-27)在引发骨髓细胞上的cd123上调方面更为优越。图110b示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-27tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-27)在引发骨髓细胞上的hla-dr上调方面更为优越。图110c示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-27tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-27)在引发骨髓细胞上的cd14上调方面更为优越。图110d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-27tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-27)在引发骨髓细胞上的cd16上调方面更为优越。图110e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-27tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-27)在引发骨髓细胞上的cd40上调方面更为优越。图110f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,lgmpharma)相比,根据bb-27tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-27)在引发骨髓细胞上的cd86上调方面更为优越。图110g示出了在用pngasef过夜去糖基化后根据bb-27tfp缀合方法制备的bb-27免疫缀合物的液相色谱-质谱分析。图110h示出了用于在用pngasef过夜去糖基化后根据bb-27tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图110i示出了用于根据bb-27tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,lgmpharma)的液相色谱-质谱分析。图111a示出了在用pngasef过夜去糖基化后根据bb-36tfp缀合方法制备的bb-36免疫缀合物的液相色谱-质谱分析。图111b示出了用于根据bb-36tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,alphamab)的液相色谱-质谱分析。图111c示出了用于在用pngasef过夜去糖基化后根据bb-36tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,alphamab)的液相色谱-质谱分析。图111d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-36tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-36)在引发骨髓细胞上的cd123上调方面更为优越。图111e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-36tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-36)在引发骨髓细胞上的hla-dr上调方面更为优越。图111f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-36tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-36)在引发骨髓细胞上的cd14上调方面更为优越。图111g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-36tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-36)在引发骨髓细胞上的cd16上调方面更为优越。图111h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-36tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-36)在引发骨髓细胞上的cd40上调方面更为优越。图111i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-36tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-36)在引发骨髓细胞上的cd86上调方面更为优越。图112a示出了根据bb-37tfp缀合方法制备的bb-37免疫缀合物的液相色谱-质谱分析。图112b示出了用于根据bb-37tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,alphamab)的液相色谱-质谱分析。图112c示出了用于在用pngasef过夜去糖基化后根据bb-37tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,alphamab)的液相色谱-质谱分析。图112d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-37tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-37)在引发骨髓细胞上的cd123上调方面更为优越。图112e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-37tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-37)在引发骨髓细胞上的hla-dr上调方面更为优越。图112f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-37tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-37)在引发骨髓细胞上的cd14上调方面更为优越。图112g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-37tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-37)在引发骨髓细胞上的cd16上调方面更为优越。图112h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-37tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-37)在引发骨髓细胞上的cd40上调方面更为优越。图112i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-37tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-37)在引发骨髓细胞上的cd86上调方面更为优越。图113a示出了根据bb-45tfp缀合方法制备的bb-45免疫缀合物的液相色谱-质谱分析。图113b示出了用于根据bb-45tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,alphamab)的液相色谱-质谱分析。图113c示出了用于在用pngasef过夜去糖基化后根据bb-45tfp缀合方法制备利妥昔单抗免疫缀合物的未缀合利妥昔单抗生物仿制药(cd20,alphamab)的液相色谱-质谱分析。图113d示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-45tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-45)在引发骨髓细胞上的cd123上调方面更为优越。图113e示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-45tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-45)在引发骨髓细胞上的hla-dr上调方面更为优越。图113f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-45tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-45)在引发骨髓细胞上的cd14上调方面更为优越。图113g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-45tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-45)在引发骨髓细胞上的cd16上调方面更为优越。图113h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-45tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-45)在引发骨髓细胞上的cd40上调方面更为优越。图113i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20,alphamab)相比,根据bb-45tfp缀合方法制备的利妥昔单抗免疫缀合物(bb-45)在引发骨髓细胞上的cd86上调方面更为优越。图114a示出了未缀合的cd40单克隆抗体(bioxcell,be0016-2)的重链的液相色谱-质谱分析。图114b示出了未缀合的cd40单克隆抗体(bioxcell,be0016-2)的轻链的液相色谱-质谱分析。图114c示出了根据us2017/0158772制备的cd40免疫缀合物的重链的液相色谱-质谱分析。图114d示出了根据us2017/0158772制备的cd40免疫缀合物的轻链的液相色谱-质谱分析。图115a示出了未缀合的cd40单克隆抗体(bioxcell,be0016-2)的液相色谱-质谱分析。图115b示出了根据bb-01缀合方法制备的cd40免疫缀合物的液相色谱-质谱分析。图116a示出了未缀合的clec5a单克隆抗体(r&dsystems,mab1639)的液相色谱-质谱分析。图116b示出了根据bb-01缀合方法制备的clec5a免疫缀合物的液相色谱-质谱分析。图117a示出了根据bb-01缀合方法制备的cl264免疫缀合物的示意图。图117b示出了根据酯合成方法制备的cl264免疫缀合物的示意图。图118a示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-cl307免疫缀合物以剂量依赖性方式上调骨髓细胞上的cd123。虚线表示在培养18小时后未刺激的细胞上的表达水平。图118b示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-cl307免疫缀合物以剂量依赖性方式上调骨髓细胞上的hla-dr。虚线表示在培养18小时后未刺激的细胞上的表达水平。图118c示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-cl307免疫缀合物以剂量依赖性方式下调骨髓细胞上的cd14。虚线表示在培养18小时后未刺激的细胞上的表达水平。图118d示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-cl307免疫缀合物以剂量依赖性方式下调骨髓细胞上的cd16。虚线表示在培养18小时后未刺激的细胞上的表达水平。图118e示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-cl307免疫缀合物以剂量依赖性方式上调骨髓细胞上的cd40。虚线表示在培养18小时后未刺激的细胞上的表达水平。图118f示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-cl307免疫缀合物以剂量依赖性方式上调骨髓细胞上的cd86。虚线表示在培养18小时后未刺激的细胞上的表达水平。图118g示出了用于制备利妥昔单抗-cl307的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图118h示出了用于在用pngasef过夜去糖基化后制备利妥昔单抗-cl307的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图118i示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-cl307免疫缀合物以剂量依赖性方式引发分泌tnfα。图118j示出了根据bb-01缀合方法制备的利妥昔单抗-cl307免疫缀合物的液相色谱-质谱分析。图119a示出了在刺激36小时后,与未缀合的利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗-cl419免疫缀合物(利妥昔单抗-cl419boltbody)引发骨髓细胞分泌更高量的il-1β。图119b示出了在刺激36小时后,与未缀合的利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗-cl419免疫缀合物(利妥昔单抗-cl419boltbody)引发骨髓细胞分泌更高量的tnfα。图119c示出了用于在用pngasef过夜去糖基化后制备利妥昔单抗-cl419的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图119d示出了用于制备利妥昔单抗-cl419的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图119e示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的利妥昔单抗-cl419免疫缀合物的液相色谱-质谱分析。图119f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-cl419免疫缀合物(cl419boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图119g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-cl419免疫缀合物(cl419boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图119h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-cl419免疫缀合物(cl419boltbody)在引发骨髓细胞上的cd86上调方面更为优越。图119i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-cl419免疫缀合物(cl419boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图120a示出了在刺激36小时后,与未缀合的利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗-cl572免疫缀合物(利妥昔单抗-cl572boltbody)引发骨髓细胞分泌更高量的il-1β。图120b示出了在刺激36小时后,与未缀合的利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗-cl572免疫缀合物(利妥昔单抗-cl572boltbody)引发骨髓细胞分泌更高量的tnfα。图120c示出了用于在用pngasef过夜去糖基化后制备利妥昔单抗-cl572的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图120d示出了用于制备利妥昔单抗-cl572的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图120e示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的利妥昔单抗-cl572免疫缀合物的液相色谱-质谱分析。图120f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-cl572免疫缀合物(cl572boltbody)在引发骨髓细胞上的cd123上调方面更为优越。图120g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-cl572免疫缀合物(cl572boltbody)在引发骨髓细胞上的hla-dr上调方面更为优越。图120h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-cl572免疫缀合物(cl572boltbody)在引发骨髓细胞上的cd16下调方面更为优越。图120i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-cl572免疫缀合物(cl572boltbody)在引发骨髓细胞上的cd40上调方面更为优越。图121a示出了在刺激36小时后,与未缀合的利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗-pam2csk4免疫缀合物(利妥昔单抗-pam2csk4boltbody)引发骨髓细胞分泌更高量的il-1β。图121b示出了在刺激36小时后,与未缀合的利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗-pam2csk4免疫缀合物(利妥昔单抗-pam2csk4boltbody)引发骨髓细胞分泌更高量的tnfα。图121c示出了用于在用pngasef过夜去糖基化后制备利妥昔单抗-pam2csk4的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图121d示出了用于制备利妥昔单抗-pam2csk4的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图121e示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的利妥昔单抗-pam2csk4免疫缀合物的液相色谱-质谱分析。图121f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-pam2csk4免疫缀合物(pam2csk4boltbody)在引发骨髓细胞的cd16下调方面更为优越。图121g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-pam2csk4免疫缀合物(pam2csk4boltbody)在引发骨髓细胞的cd40上调方面更为优越。图121h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-pam2csk4免疫缀合物(pam2csk4boltbody)在引发骨髓细胞的cd86上调方面更为优越。图122a示出了在刺激36小时后,与未缀合的利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗-pam3csk4免疫缀合物(利妥昔单抗-pam3csk4boltbody)引发骨髓细胞分泌更高量的il-1β。图122b示出了在刺激36小时后,与未缀合的利妥昔单抗(roche)相比,根据bb-01方法制备的利妥昔单抗-pam3csk4免疫缀合物(利妥昔单抗-pam3csk4boltbody)引发骨髓细胞分泌更高量的tnfα。图122c示出了用于在用pngasef过夜去糖基化后制备利妥昔单抗-pam3csk4的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图122d示出了用于制备利妥昔单抗-pam3csk4的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图122e示出了在用pngasef过夜去糖基化后根据bb-01缀合方法制备的利妥昔单抗-pam3csk4免疫缀合物的液相色谱-质谱分析。图122f示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-pam3csk4免疫缀合物(pam3csk4boltbody)在引发骨髓细胞的cd16下调方面更为优越。图122g示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-pam3csk4免疫缀合物(pam3csk4boltbody)在引发骨髓细胞的cd40上调方面更为优越。图122h示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-pam3csk4免疫缀合物(pam3csk4boltbody)在引发骨髓细胞的cd86上调方面更为优越。图122i示出了在刺激18小时后,与未缀合的利妥昔单抗(cd20;roche)相比,根据bb-01方法制备的利妥昔单抗-pam3csk4免疫缀合物(pam3csk4boltbody)在引发骨髓细胞的cd123上调方面更为优越。图123a示出了根据tfp缀合方法制备的bb-43免疫缀合物的液相色谱-质谱分析。图123b示出了用于在用pngasef过夜去糖基化后制备bb-43的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图123c示出了用于制备bb-43的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图123d示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据tfp方法制备的bb-43免疫缀合物在引发骨髓细胞上的cd123上调方面更为优越。图123e示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据tfp方法制备的bb-43免疫缀合物在引发骨髓细胞上的hla-dr上调方面更为优越。图123f示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据tfp方法制备的bb-43免疫缀合物在引发骨髓细胞上的cd14下调方面更为优越。图123g示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据tfp方法制备的bb-43免疫缀合物在引发骨髓细胞上的cd16下调方面更为优越。图123h示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据tfp方法制备的bb-43免疫缀合物在引发骨髓细胞上的cd40上调方面更为优越。图123i示出了在刺激18小时后,与未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据tfp方法制备的bb-43免疫缀合物在引发骨髓细胞上的cd86上调方面更为优越。图124a示出了在刺激18小时后,根据bb-01方法制备的利妥昔单抗-sata-t782免疫缀合物(利妥昔单抗-sata-t782boltbody)以剂量依赖性方式引发骨髓细胞分泌tnfα。图124b示出了用于在用pngasef过夜去糖基化后制备利妥昔单抗-sata-t782的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图124c示出了用于制备利妥昔单抗-sata-t782的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图124d示出了根据bb-01方法制备的利妥昔单抗-sata-t782的液相色谱-质谱分析。图124e示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-sata-t782免疫缀合物(利妥昔单抗-sata-t782)以剂量依赖性方式上调骨髓细胞上的cd123。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图124f示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-sata-t782免疫缀合物(利妥昔单抗-sata-t782)以剂量依赖性方式上调骨髓细胞上的hla-dr。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图124g示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-sata-t782免疫缀合物(利妥昔单抗-sata-t782)以剂量依赖性方式下调骨髓细胞上的cd14。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图124h示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-sata-t782免疫缀合物(利妥昔单抗-sata-t782)以剂量依赖性方式下调骨髓细胞上的cd16。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图124i示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-sata-t782免疫缀合物(利妥昔单抗-sata-t782)以剂量依赖性方式上调骨髓细胞上的cd40。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图124j示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-sata-t782免疫缀合物(利妥昔单抗-sata-t782)以剂量依赖性方式上调骨髓细胞上的cd86。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图125a示出了在刺激18小时后,根据bb-01方法制备的利妥昔单抗-satp-t782免疫缀合物(利妥昔单抗-satp-t782boltbody)以剂量依赖性方式引发骨髓细胞分泌tnfα。图125b示出了用于在用pngasef过夜去糖基化后制备利妥昔单抗-satp-t782的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图125c示出了用于制备利妥昔单抗-satp-t782的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图125d示出了根据bb-01方法制备的利妥昔单抗-satp-t782的液相色谱-质谱分析。图125e示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-satp-t782免疫缀合物(利妥昔单抗-satp-t782)以剂量依赖性方式上调骨髓细胞上的cd123。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图125f示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-satp-t782免疫缀合物(利妥昔单抗-satp-t782)以剂量依赖性方式上调骨髓细胞上的hla-dr。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图125g示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-satp-t782免疫缀合物(利妥昔单抗-satp-t782)以剂量依赖性方式下调骨髓细胞上的cd14。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图125h示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-satp-t782免疫缀合物(利妥昔单抗-satp-t782)以剂量依赖性方式下调骨髓细胞上的cd16。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图125i示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-satp-t782免疫缀合物(利妥昔单抗-satp-t782)以剂量依赖性方式上调骨髓细胞上的cd40。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图125j示出了在刺激18小时后,根据bb-01缀合方法制备的利妥昔单抗-satp-t782免疫缀合物(利妥昔单抗-satp-t782)以剂量依赖性方式上调骨髓细胞上的cd86。虚线表示在培养18小时后未刺激的骨髓细胞上的表达水平。图126a示出了在用pngasef过夜缀合后根据sata缀合方法制备的bb-12免疫缀合物的液相色谱-质谱分析。图126b示出了用于在用pngasef过夜去糖基化后制备bb-12的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图126c示出了用于制备bb-12的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图126d示出了在刺激18小时后,根据sata方法制备的bb-12免疫缀合物未能引发cd123上调。图126d还示出了与bb-12和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-11免疫缀合物在引发cd123上调方面更为优越。应当注意,bb-11和bb-12以相同的连接子构造而成,但具有不同的佐剂。图126e示出了在刺激18小时后,根据sata方法制备的bb-12免疫缀合物未能引发hla-dr上调。图126e还示出了与bb-12和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-11免疫缀合物在引发hla-dr上调方面更为优越。应当注意,bb-11和bb-12以相同的连接子构造而成,但具有不同的佐剂。图126f示出了在刺激18小时后,与等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-12免疫缀合物未能引发cd14下调。图126f还示出了与bb-12和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-11免疫缀合物在引发cd14下调方面更为优越。应当注意,bb-11和bb-12以相同的连接子构造而成,但具有不同的佐剂。图126g还示出了与bb-12和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-11免疫缀合物在引发cd16下调方面更为优越。应当注意,bb-11和bb-12以相同的连接子构造而成,但具有不同的佐剂。图126h示出了在刺激18小时后,与等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-12免疫缀合物未能引发cd40上调。图126h还示出了与bb-12和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-11免疫缀合物在引发cd40上调方面更为优越。应当注意,bb-11和bb-12以相同的连接子构造而成,但具有不同的佐剂。图126i示出了在刺激18小时后,与等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-12免疫缀合物未能引发cd86上调。图126i还示出了与bb-12和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-11免疫缀合物在引发cd86上调方面更为优越。应当注意,bb-11和bb-12以相同的连接子构造而成,但具有不同的佐剂。图126j示出了用bb-12刺激18小时后的cd123表达。虚线表示在孵育18小时后未刺激的细胞上的cd123表达水平。图126k示出了用bb-12刺激18小时后的hla-dr表达。虚线表示在孵育18小时后未刺激的细胞上的hla-dr表达水平。图126l示出了用bb-12刺激18小时后的cd14表达。虚线表示在孵育18小时后未刺激的细胞上的cd14表达水平。图126m示出了用bb-12刺激18小时后的cd16表达。虚线表示在孵育18小时后未刺激的细胞上的cd16表达水平。图126n示出了用bb-12刺激18小时后的cd40表达。虚线表示在孵育18小时后未刺激的细胞上的cd40表达水平。图126o示出了用bb-12刺激18小时后的cd86表达。虚线表示在孵育18小时后未刺激的细胞上的cd86表达水平。图127a示出了在用pngase过夜去糖基化后根据sata缀合方法制备的bb-10免疫缀合物的液相色谱-质谱分析。图127b示出了用于制备bb-10的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图127c示出了用于在用pngasef过夜去糖基化后制备bb-10的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图127d示出了在刺激18小时后,根据sata方法制备的bb-10免疫缀合物未能引发cd123上调。图127d还示出了与bb-10和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-05免疫缀合物在引发cd123上调方面更为优越。应当注意,bb-05和bb-10以相同的连接子构造而成,但具有不同的佐剂。图127e示出了在刺激18小时后,根据sata方法制备的bb-10免疫缀合物未能引发hla-dr上调。图127e还示出了与bb-10和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-05免疫缀合物在引发hla-dr上调方面更为优越。应当注意,bb-05和bb-10以相同的连接子构造而成,但具有不同的佐剂。图127f示出了在刺激18小时后,与等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-10免疫缀合物未能引发cd14下调。图127f还示出了与bb-10和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-05免疫缀合物在引发cd14下调方面更为优越。应当注意,bb-05和bb-10以相同的连接子构造而成,但具有不同的佐剂。图127g示出了与bb-10和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-05免疫缀合物在引发cd16下调方面更为优越。应当注意,bb-05和bb-10以相同的连接子构造而成,但具有不同的佐剂。图127h示出了在刺激18小时后,与等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-10免疫缀合物未能引发cd40上调。图127h还示出了与bb-10和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-05免疫缀合物在引发cd40上调方面更为优越。应当注意,bb-05和bb-10以相同的连接子构造而成,但具有不同的佐剂。图127i示出了在刺激18小时后,与等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-10免疫缀合物未能引发cd86上调。图127i还示出了与bb-10和等摩尔浓度的混合物(cd20+irm1)相比,根据sata方法制备的bb-05免疫缀合物在引发cd86上调方面更为优越。应当注意,bb-05和bb-10以相同的连接子构造而成,但具有不同的佐剂。图127j示出了用bb-10刺激18小时后的cd123表达。虚线表示在孵育18小时后未刺激的细胞上的cd123表达水平。图127k示出了用bb-10刺激18小时后的hla-dr表达。虚线表示在孵育18小时后未刺激的细胞上的hla-dr表达水平。图127l示出了用bb-10刺激18小时后的cd14表达。虚线表示在孵育18小时后未刺激的细胞上的cd14表达水平。图127m示出了用bb-10刺激18小时后的cd16表达。虚线表示在孵育18小时后未刺激的细胞上的cd16表达水平。图127n示出了用bb-10刺激18小时后的cd40表达。虚线表示在孵育18小时后未刺激的细胞上的cd40表达水平。图127o示出了用bb-10刺激18小时后的cd86表达。虚线表示在孵育18小时后未刺激的细胞上的cd40表达水平。图128a示出了在刺激18小时后,与等摩尔浓度的根据美国专利8,951,528中公开的方法制备的bb-19和未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据bb-01方法制备的bb-01免疫缀合物引发骨髓细胞分泌更高量的il-1β。图128b示出了在刺激18小时后,与等摩尔浓度的根据美国专利8,951,528中公开的方法制备的bb-19和未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据bb-01方法制备的bb-01免疫缀合物引发骨髓细胞分泌更高量的tnfα。图128c示出了在用等摩尔浓度的未缀合利妥昔单抗生物仿制药(lgmpharma)或根据美国专利8,951,528中公开的方法制备的bb-19孵育18小时后骨髓细胞的il-1β分泌。图128d示出了在用等摩尔浓度的未缀合利妥昔单抗生物仿制药(lgmpharma)或根据美国专利8,951,528中公开的方法制备的bb-19孵育18小时后骨髓细胞的tnfα分泌。图128e示出了在用pngasef过夜去糖基化后根据美国专利8,951,528中公开的方法制备的bb-19的液相色谱-质谱分析。图128f示出了用于在用pngase过夜去糖基化后制备bb-19的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图128g示出了用于制备bb-19的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图128h示出了在刺激18小时后,与根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01在引发骨髓细胞上的cd123上调方面更为优越。图128i示出了在刺激18小时后,与根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01在引发骨髓细胞上的hla-dr上调方面更为优越。图128j示出了在刺激18小时后,与根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01在引发骨髓细胞上的cd14下调方面更为优越。图128k示出了在刺激18小时后,与根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01在引发骨髓细胞上的cd16下调方面更为优越。图128l示出了在刺激18小时后,根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物未能引发cd40上调。图128l还示出了与bb-19和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01免疫缀合物在引发cd40上调方面更为优越。图128m示出了在刺激18小时后,与根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01在引发骨髓细胞上的cd86上调方面更为优越。图128n示出了用根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd123表达。图128o示出了用根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的hla-dr表达。图128p示出了用根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd14表达。图128q示出了用根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd16表达。图128r示出了用根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd40表达。图128s示出了用根据美国专利8,951,528中公开的方法制备的bb-19免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd86表达。图129a示出了在刺激18小时后,与等摩尔浓度的根据美国专利8,951,528中公开的方法制备的bb-20和未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据bb-01方法制备的bb-01免疫缀合物引发骨髓细胞分泌更高量的il-1β。图129b示出了在刺激18小时后,与等摩尔浓度的根据美国专利8,951,528中公开的方法制备的bb-20和未缀合的利妥昔单抗生物仿制药(lgmpharma)相比,根据bb-01方法制备的bb-01免疫缀合物引发骨髓细胞分泌更高量的tnfα。图129c示出了在用等摩尔浓度的未缀合利妥昔单抗生物仿制药(lgmpharma)或根据美国专利8,951,528中公开的方法制备的bb-20孵育18小时后骨髓细胞的il-1β分泌。图129d示出了在用等摩尔浓度的未缀合利妥昔单抗生物仿制药(lgmpharma)或根据美国专利8,951,528中公开的方法制备的bb-20孵育18小时后骨髓细胞的tnfα分泌。图129e示出了在用pngasef过夜去糖基化后根据美国专利8,951,528中公开的方法制备的bb-20的液相色谱-质谱分析。图129f示出了用于在用pngase过夜去糖基化后制备bb-20的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图129g示出了用于制备bb-20的未缀合利妥昔单抗生物仿制药(lgmpharma)的液相色谱-质谱分析。图129h示出了在刺激18小时后,与根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01在引发骨髓细胞上的cd123上调方面更为优越。图129i示出了在刺激18小时后,与根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01在引发骨髓细胞上的hla-dr上调方面更为优越。图129j示出了在刺激18小时后,与根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01在引发骨髓细胞上的cd14下调方面更为优越。图129k示出了在刺激18小时后,与根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01在引发骨髓细胞上的cd16下调方面更为优越。图129l示出了在刺激18小时后,根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物未能引发cd40上调。图129l还示出了与bb-20和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01免疫缀合物在引发cd40上调方面更为优越。图129m示出了在刺激18小时后,根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物未能引发cd86上调。图129m还示出了与bb-20和未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)相比,根据bb-01方法制备的bb-01免疫缀合物在引发cd86上调方面更为优越。图129n示出了用根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd123表达。图129o示出了用根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的hla-dr表达。图129p示出了用根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd14表达。图129q示出了用根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd16表达。图129r示出了用根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd40表达。图129s示出了用根据美国专利8,951,528中公开的方法制备的bb-20免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;lgmpharma)刺激18小时后骨髓细胞上的cd86表达。图130a示出了用等摩尔浓度的牛血清蛋白(bsa)或根据bb-37tfp方法制备的bsa免疫缀合物(bsa-化合物1)刺激18小时后骨髓细胞上的cd14表达。图130b示出了用等摩尔浓度的牛血清蛋白(bsa)或根据bb-37tfp方法制备的bsa免疫缀合物(bsa-化合物1)刺激18小时后骨髓细胞上的cd16表达。图130c示出了用等摩尔浓度的牛血清蛋白(bsa)或根据bb-37tfp方法制备的bsa免疫缀合物(bsa-化合物1)刺激18小时后骨髓细胞上的cd123表达。图130d示出了用等摩尔浓度的牛血清蛋白(bsa)或根据bb-37tfp方法制备的bsa免疫缀合物(bsa-化合物1)刺激18小时后骨髓细胞上的cd40表达。图130e示出了用等摩尔浓度的牛血清蛋白(bsa)或根据bb-37tfp方法制备的bsa免疫缀合物(bsa-化合物1)刺激18小时后骨髓细胞上的cd86表达。图130f示出了用等摩尔浓度的牛血清蛋白(bsa)或根据bb-37tfp方法制备的bsa免疫缀合物(bsa-化合物1)刺激18小时后骨髓细胞上的hlr-dr表达。图130g示出了用等摩尔浓度的牛血清蛋白(bsa)或根据bb-37tfp方法制备的bsa免疫缀合物(bsa-化合物1)刺激18小时后骨髓细胞上的hla-dr表达。图130h示出了裸bsa-m的lc-ms。图131a示出了用等摩尔浓度的血蓝蛋白(klh)或根据bb-17tfp方法制备的klh免疫缀合物(klh-化合物1)刺激18小时后骨髓细胞上的cd14表达。图131b示出了用等摩尔浓度的血蓝蛋白(klh)或根据bb-17tfp方法制备的klh免疫缀合物(klh-化合物1)刺激18小时后骨髓细胞上的cd16表达。图131c示出了用等摩尔浓度的血蓝蛋白(klh)或根据bb-17tfp方法制备的klh免疫缀合物(klh-化合物1)刺激18小时后骨髓细胞上的cd123表达。图131d示出了用等摩尔浓度的血蓝蛋白(klh)或根据bb-17tfp方法制备的klh免疫缀合物(klh-化合物1)刺激18小时后骨髓细胞上的cd40表达。图131e示出了用等摩尔浓度的血蓝蛋白(klh)或根据bb-17tfp方法制备的klh免疫缀合物(klh-化合物1)刺激18小时后骨髓细胞上的cd86表达。图131f示出了用等摩尔浓度的血蓝蛋白(klh)或根据bb-17tfp方法制备的klh免疫缀合物(klh-化合物1)刺激18小时后骨髓细胞上的hla-dr表达。图132a示出了当在抗人igg涂覆的elisa板上捕获时,enbrel(amgen)和使用bb-01缀合方法制备的enbrel免疫缀合物(bb-01enbrel)表现出相当的与抗人igg检测抗体的反应性。图132b示出了在抗人igg涂覆的elisa板上捕获后,使用bb-01缀合方法制备的enbrel免疫缀合物(bb-01enbrel)表现出与抗化合物1抗体的强反应性,而enbrel(amgen)则不然。图132c示出了当在抗人igg涂覆的elisa板上捕获时,西妥昔单抗(imclone/lilly)和使用bb-01缀合方法制备的西妥昔单抗免疫缀合物(bb-01西妥昔单抗)表现出相当的与抗人igg检测抗体的反应性。图132d示出了在抗人igg涂覆的elisa板上捕获后,使用bb-01缀合方法制备的西妥昔单抗免疫缀合物(bb-01西妥昔单抗)表现出与抗化合物1抗体的强反应性,而西妥昔单抗(imclone/lilly)则不然。图132e示出了当在抗人igg涂覆的elisa板上捕获时,伊匹单抗(bms)和使用bb-01缀合方法制备的伊匹单抗免疫缀合物(bb-01伊匹单抗)表现出相当的与抗人igg检测抗体的反应性。图132f示出了在抗人igg涂覆的elisa板上捕获后,使用bb-01缀合方法制备的伊匹单抗免疫缀合物(bb-01伊匹单抗)表现出与抗化合物1抗体的强反应性,而伊匹单抗(bms)则不然。图132g示出了当在抗人igg涂覆的elisa板上捕获时,奥滨尤妥珠单抗(roche)和使用bb-01缀合方法制备的奥滨尤妥珠单抗免疫缀合物(bb-01奥滨尤妥珠单抗)表现出相当的与抗人igg检测抗体的反应性。图132h示出了在抗人igg涂覆的elisa板上捕获后,使用bb-01缀合方法制备的奥滨尤妥珠单抗免疫缀合物(bb-01奥滨尤妥珠单抗)表现出与抗化合物1抗体的强反应性,而奥滨尤妥珠单抗(roche)则不然。图132i示出了当在抗人igg涂覆的elisa板上捕获时,利妥昔单抗(roche)和使用bb-01缀合方法制备的利妥昔单抗免疫缀合物(bb-01利妥昔单抗)表现出相当的与抗人igg检测抗体的反应性。图132j示出了在抗人igg涂覆的elisa板上捕获后,使用bb-01缀合方法制备的利妥昔单抗免疫缀合物(bb-01利妥昔单抗)表现出与抗化合物1抗体的强反应性,而利妥昔单抗(roche)则不然。图132k示出了当涂覆在elisa板上时,抗dectin2抗体(bioradmca2415)和使用bb-01缀合方法制备的抗dectin2免疫缀合物(bb-01抗dectin2)表现出相当的与igg检测抗体的反应性。图132l示出了使用bb-01缀合方法制备的抗dectin2免疫缀合物(bb-01抗dectin2)在elisa测定中表现出与抗化合物1抗体的强反应性,而抗dectin2抗体(bioradmca2415)则不然。图133a示出了利妥昔单抗免疫缀合物(利妥昔单抗bb-01)保留对cd16a的结合活性。如实施例29中所述,通过elisa测定结合力。所示的化合物为利妥昔单抗、无糖基利妥昔单抗(invivogenhcd20-mab12)或利妥昔单抗免疫缀合物(利妥昔单抗bb-01)。利妥昔单抗缀合物的dar水平如下:bb-01,1.1;bb-14,2.0;bb-36低dar,1.4;bb-36高dar,2.8,bb-37低dar,1.7;bb-37高dar,2.6。y轴示出了每个样品在最高浓度下的最大od信号的分数。利妥昔单抗的无糖基突变体表现出结合力减弱,与效应子功能中糖基化的作用一致。图133b示出了利妥昔单抗(roche)和使用bb-01缀合方法制备的利妥昔单抗免疫缀合物(bb-01利妥昔单抗)表现出相当的与固定在elisa板上的cd64的结合力。已使用pngasef去糖基化的利妥昔单抗表现出与cd64的结合力受损。图133c示出了利妥昔单抗和利妥昔单抗免疫缀合物(利妥昔单抗bb-37)与蛋白质a结合。使用蛋白质a琼脂糖对一式两份样品进行拉下实验。在拉下实验的上清液中未检测到未结合的利妥昔单抗或利妥昔单抗bb-37。igg上的蛋白质a和fcrn结合位点存在相当大的重叠。因此,利妥昔单抗bb-37中保留有蛋白质a结合表明保留有fcrn结合。图134a示出了用根据bb-48方法制备的bb-48免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd123表达。图134b示出了用根据bb-48方法制备的bb-48免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的hla-dr表达。图134c示出了用根据bb-48方法制备的bb-48免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd14表达。图134d示出了用根据bb-48方法制备的bb-48免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd16表达。图134e示出了用根据bb-48方法制备的bb-48免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd40表达。图134f示出了用根据bb-48方法制备的bb-48免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd86表达。图134g示出了根据bb-48方法制备的bb-48免疫缀合物的lc-ms。图135a示出了用根据bb-49方法制备的bb-49免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd123表达。图135b示出了用根据bb-49方法制备的bb-49免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的hla-dr表达。图135c示出了用根据bb-49方法制备的bb-49免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd14表达。图135d示出了用根据bb-49方法制备的bb-49免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd16表达。图135e示出了用根据bb-49方法制备的bb-49免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd40表达。图135f示出了用根据bb-49方法制备的bb-49免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd86表达。图135g示出了根据bb-49方法制备的bb-49免疫缀合物的lc-ms。图136a示出了用根据bb-50方法制备的bb-50免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd123表达。图136b示出了用根据bb-50方法制备的bb-50免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的hla-dr表达。图136c示出了用根据bb-50方法制备的bb-50免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd14表达。图136d示出了用根据bb-50方法制备的bb-50免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd16表达。图136e示出了用根据bb-50方法制备的bb-50免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd40表达。图136f示出了用根据bb-50方法制备的bb-50免疫缀合物或未缀合的利妥昔单抗生物仿制药(cd20;alphamab)刺激18小时后骨髓细胞上的cd86表达。图136g示出了根据bb-50方法制备的bb-50免疫缀合物的lc-ms。图137a示出了经由smcc-cmpd1(利妥昔单抗-cys-cmpd1)进行tcep还原后,与通过链间二硫化物残基缀合的利妥昔单抗免疫缀合物相比,根据bb-01sata方法制备的bb-01免疫缀合物(利妥昔单抗boltbody)在引发骨髓细胞上的cd14下调方面更为优越。在用利妥昔单抗boltbody或利妥昔单抗-cys-cmpd1孵育18小时后获得数据。图137b示出了经由smcc-cmpd1(利妥昔单抗-cys-cmpd1)进行tcep还原后,与通过链间二硫化物残基缀合的利妥昔单抗免疫缀合物相比,根据bb-01sata方法制备的bb-01免疫缀合物(利妥昔单抗boltbody)在引发骨髓细胞上的cd16下调方面更为优越。在用利妥昔单抗boltbody或利妥昔单抗-cys-cmpd1孵育18小时后获得数据。图137c示出了经由smcc-cmpd1(利妥昔单抗-cys-cmpd1)进行tcep还原后,与通过链间二硫化物残基缀合的利妥昔单抗免疫缀合物相比,根据bb-01sata方法制备的bb-01免疫缀合物(利妥昔单抗boltbody)在引发骨髓细胞上的cd40上调方面更为优越。在用利妥昔单抗boltbody或利妥昔单抗-cys-cmpd1孵育18小时后获得数据。图137d示出了经由smcc-cmpd1(利妥昔单抗-cys-cmpd1)进行tcep还原后,与通过链间二硫化物残基缀合的利妥昔单抗免疫缀合物相比,根据bb-01sata方法制备的bb-01免疫缀合物(利妥昔单抗boltbody)在引发骨髓细胞上的cd86上调方面更为优越。在用利妥昔单抗boltbody或利妥昔单抗-cys-cmpd1孵育18小时后获得数据。图137e示出了经由smcc-cmpd1(利妥昔单抗-cys-cmpd1)进行tcep还原后,与通过链间二硫化物残基缀合的利妥昔单抗免疫缀合物相比,根据bb-01sata方法制备的bb-01免疫缀合物(利妥昔单抗boltbody)在引发骨髓细胞上的cd123上调方面更为优越。在用利妥昔单抗boltbody或利妥昔单抗-cys-cmpd1孵育18小时后获得数据。图137f示出了用于在用tcep还原后制备利妥昔单抗-cys-cmpd1免疫缀合物的未缀合利妥昔单抗(roche)的液相色谱-质谱分析。图137g示出了用于在用tcep还原后制备利妥昔单抗-cys-cmpd1免疫缀合物的未缀合利妥昔单抗(roche)的轻链的液相色谱-质谱分析。图137h示出了利妥昔单抗-cys-cmpd1免疫缀合物的重链的液相色谱-质谱分析。图137i示出了利妥昔单抗-cys-cmpd1免疫缀合物的重链的液相色谱-质谱分析。图138a示出了编码野生型利妥昔单抗重链的载体的dna序列。图138b示出了编码具有v205c突变(用kabat编号表示)的利妥昔单抗的κ轻链的载体的dna序列。图138c示出了编码野生型利妥昔单抗igg1重链的pfuse-chig-hg1克隆质粒(invivogen,pfuse-hchg1)的载体图谱。图138d示出了经工程改造以编码利妥昔单抗igκ轻链恒定区中的v205c突变的pfuse2-clig-hk克隆质粒(invivogen,pfuse2-hclk)的载体图谱。图138e示出了通过将化合物1-smcc直接连接到如图138d所示的经工程改造的半胱氨酸残基而产生的利妥昔单抗-v205c免疫缀合物的结构。图138f示出了用于制备利妥昔单抗-v205c免疫缀合物的含有v205c突变的未缀合利妥昔单抗的液相色谱-质谱分析。图138g示出了通过将化合物1-smcc直接连接到如图138d所示的经工程改造的半胱氨酸残基而产生的利妥昔单抗-v205c免疫缀合物的液相色谱-质谱分析。具体实施方式总述本发明提供了具有许多优点的抗体-佐剂免疫缀合物,所述抗体-佐剂免疫缀合物包括:促进抗体依赖性细胞毒作用、促进抗体依赖性细胞吞噬作用的抗体和阻断癌症产生充当免疫检查点分子的蛋白质的作用的抗体、促进树突细胞活化和t细胞增殖的佐剂,以及促进抗肿瘤功效的抗体和佐剂之间的共价连接。例如,在一些情况下,人单核细胞在用本发明的免疫缀合物过夜刺激后发生dc分化,而具有已知刺激物(例如,gm-csf和il-4)的dc分化方案需要更长的周期。与用已知刺激物可达到的效果相比,免疫缀合物活化的细胞表达更高量(例如,在一些情况下,高出几倍量)的共刺激分子和炎性细胞因子。如本文所证实,免疫缀合物在引发免疫活化方面比非共价附接的抗体-佐剂混合物在数量上和质量上更有效。此外,如本文所证实,根据本发明连接的抗体-佐剂免疫缀合物比其他已知的免疫缀合物更有效。例如,美国专利8,951,528中公开了免疫缀合物。然而,这些免疫缀合物不能有效地活化骨髓细胞(例如,参见图128a-129s)。另一出版物即美国专利公布2017/0159772也公开了免疫缀合物。其中公开的免疫缀合物也不能有效地活化骨髓细胞,如图67a-68p所示。国际专利申请公布wo2015/103987a1在权利要求1中表明了在通过实验使佐剂失活并引起可忽略的骨髓活化的位置中存在佐剂(瑞喹莫德)的免疫缀合物附接位点。该公布还指出,在用过量dtt还原抗体后,通过半胱氨酸铰链残基(硫醚键)产生了连接子-佐剂与抗体的缀合(wo2015/103987,第0273-0273段)。通过实验,这种缀合模式阻止了免疫缀合物有效地活化骨髓细胞(参见图67a-68p和137a-137i)。相反,本发明的免疫缀合物提供了更优越的生物活性,如例如图67g-k、128a-12m、129e-129和137a-137i所示。最后,全身施用佐剂-抗体缀合物允许同时靶向原发性肿瘤和相关转移瘤,而无需瘤内注射和手术切除。如图1-138g所证实,根据本发明和其他来源产生并测定了多种免疫缀合物。定义如本文所用,术语“免疫缀合物”是指与如本文所述的非天然存在的化学部分共价结合的抗体构建体或抗体。术语“免疫缀合物”、“抗体-佐剂免疫缀合物”、“aac”和“boltbody”在本文中可互换使用。如本文所用,短语“抗体构建体”是指包含抗原结合结构域和fc结构域的多肽。抗体构建体可包含抗体。如本文所用,短语“抗原结合结构域”是指特异性结合特定抗原(例如,互补位)的蛋白质或蛋白质的一部分。例如,抗原结合蛋白质的该部分含有与抗原相互作用的氨基酸残基,并且赋予抗原结合蛋白质对抗原的特异性和亲和力。如本文所用,短语“fc结构域”是指抗体的片段可结晶区域或尾区。fc结构域与细胞表面上的fc受体相互作用。如本文所用,短语“靶向结合结构域”是指特异性结合第二抗原的蛋白质或蛋白质的一部分,该第二抗原不同于免疫缀合物的抗原结合结构域所结合的抗原。靶向结合结构域可在fc结构域的c末端与抗体构建体缀合。如本文所用,术语“抗体”是指特异性结合并识别抗原的包含来自免疫球蛋白基因或其片段的抗原结合区(包括互补决定区(cdr))的多肽。公认的免疫球蛋白基因包括κ、λ、α、γ、δ、ε和μ恒定区基因以及许多免疫球蛋白可变区基因。典型的免疫球蛋白(抗体)结构单元包含四聚体。每个四聚体由两对相同的多肽链组成,每对具有一个“轻”链(约25kd)和一个“重”链(约50-70kd)。每条链的n-末端限定约100至110个或更多个氨基酸的可变区,主要负责抗原识别。术语“轻链”可变区(vl)和重链可变区(vh)分别指这些轻链和重链。轻链分为κ或λ。重链分为γ、μ、α、δ或ε,它们又分别定义免疫球蛋白类别igg、igm、iga、igd和ige。igg抗体是由四条肽链组成的约150kda的大分子。igg抗体含有两个相同的约50kda的γ重链和两个相同的约25kda的轻链,因此是四聚体四元结构。两条重链通过二硫键彼此连接并与轻链连接。得到的四聚体具有两个相同的半部分,它们一起形成y形。叉状结构的每个端部含有相同的抗原结合位点。人类中有四种igg亚类(igg1、2、3和4),按它们在血清中的丰度顺序命名(igg1是最丰富的)。通常,抗体的抗原结合区在结合的特异性和亲和力方面是最关键的。二聚体iga抗体为约320kda。iga具有两个亚类(iga1和iga2),并且可以单体形式和二聚体形式产生。iga二聚体形式(分泌型或siga)是最丰富的。例如,抗体可作为完整的免疫球蛋白或作为通过用各种肽酶消化产生的许多充分表征的片段存在。因此,例如,胃蛋白酶消化铰链区中二硫键以下的抗体以产生f(ab)′2,其为fab的二聚体,本身是通过二硫键与vh-ch1连接的轻链。可在温和条件下还原f(ab)′2以破坏铰链区中的二硫键,从而将f(ab)′2二聚体转化为fab′单体。fab′单体本质上是具有部分铰链区的fab(参见fundamentalimmunology,paul编辑,7eed,2012年)。虽然就完整抗体的消化而言定义了各种抗体片段,但是技术人员将理解,这些片段可通过化学方法或通过使用重组dna方法从头合成。因此,如本文所用的术语“抗体”还包括通过修饰整个抗体产生的抗体片段,或使用重组dna方法从头合成的抗体片段(例如,单链fv),或使用噬菌体展示文库鉴定的抗体片段(参见例如mccafferty等人,nature,第348卷:第552-554页,1990年)。术语“抗体”以最广泛的含义使用,并且具体涵盖单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体(例如,双特异性抗体)和抗体片段,只要它们表现出所需的生物学活性即可。如本文所用的“抗体片段”及其所有语法变体被定义为完整抗体的包含完整抗体的抗原结合位点或可变区的一部分,其中该部分不含完整抗体fc区的恒定重链结构域(即,ch2、ch3和ch4,取决于抗体同型)。抗体片段的示例包括fab、fab′、fab′-sh、f(ab′)2和fv片段;双体;为具有由连续氨基酸残基的一个不间断序列组成的一级结构的多肽的任何抗体片段(在本文中称为“单链抗体片段”或“单链多肽”),包括但不限于(1)单链fv(scfv)分子;(2)仅含有一个轻链可变结构域的单链多肽,或其含有轻链可变结构域的三个cdr的片段,不含相关的重链部分;(3)仅含有一个重链可变区的单链多肽,或其含有重链可变区的三个cdr的片段,不含相关的轻链部分;(4)包含来自非人物种的单个ig结构域或其他特定的单结构域结合模块的纳米抗体;以及(5)由抗体片段形成的多特异性或多价结构。在包含一条或多条重链的抗体片段中,重链可含有在完整抗体的非fc区中发现的任何恒定结构域序列(例如,igg同型中的ch1),并且/或者可含有在完整抗体中发现的任何铰链区序列,并且/或者可含有融合到或位于铰链区序列或重链的恒定结构域序列中的亮氨酸拉链序列。如本文所用,关于生物制品的术语“生物仿制药”是指生物制品与参考制品高度相似,但是临床上无活性的组分存在微小差异,并且在制品的安全性、纯度和效力上生物制品和参考制品之间没有临床上有意义的差异。如本文所用,术语“表位”是指抗体的抗原结合位点(也称为互补位)结合的位于抗原上的任何抗原决定簇。表位决定簇通常由分子诸如氨基酸或糖侧链的化学活性表面基团组成,并且通常具有特定的三维结构特征以及特定的电荷特征。术语“多肽”、“肽”和“蛋白质”在本文中可互换使用,是指氨基酸残基的聚合物。该术语也适用于其中一个或多个氨基酸残基是相应的天然存在的氨基酸的人工化学模拟物的氨基酸聚合物,以及适用于天然存在的氨基酸聚合物和非天然存在的氨基酸聚合物。如本文所用,术语“佐剂”是指能够在暴露于佐剂的受试者中引发免疫应答的物质。如本文所用,术语“佐剂部分”是指与本文所述的抗体共价结合的佐剂。佐剂部分可在与抗体结合时或在向受试者施用免疫缀合物后从抗体裂解(例如,酶促裂解)后引发免疫应答。如本文所用,术语“模式识别受体”和“prr”是指识别病原体相关分子模式(pamp)或损伤相关分子模式(damp)并且充当先天免疫中的关键信号传导元件的一类保守哺乳动物蛋白的任何成员。模式识别受体分为膜结合的prr、细胞质prr和分泌的prr。膜结合的prr的示例包括toll样受体(tlr)和c型凝集素受体(clr)。细胞质prr的示例包括nod样受体(nlr)和rig-i样受体(rlr)。如本文所用,术语“toll样受体”和“tlr”是指识别病原体相关分子模式并且充当先天免疫中的关键信号传导元件的高度保守的哺乳动物蛋白家族的任何成员。tlr多肽都具有一个特征结构,其包括具有富含亮氨酸重复序列的细胞外结构域、跨膜结构域和参与tlr信号传导的细胞内结构域。术语“toll样受体1”和“tlr1”是指与公开可用的tlr1序列(例如,genbank登录号为aay85643的人tlr1多肽,或genbank登录号为aag37302的鼠tlr1多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体2”和“tlr2”是指与公开可用的tlr2序列(例如,genbank登录号为aay85648的人tlr2多肽,或genbank登录号为aad49335的鼠tlr2多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体3”和“tlr3”是指与公开可用的tlr3序列(例如,genbank登录号为aac34134的人tlr3多肽,或genbank登录号为aak26117的鼠tlr3多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体4”和“tlr4”是指与公开可用的tlr4序列(例如,genbank登录号为aay82270的人tlr4多肽,或genbank登录号为aad29272的鼠tlr4多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体5”和“tlr5”是指与公开可用的tlr5序列(例如,genbank登录号为acm69034的人tlr5多肽,或genbank登录号为aaf65625的鼠tlr5多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体6”和“tlr6”是指与公开可用的tlr6序列(例如,genbank登录号为aby67133的人tlr6多肽,或genbank登录号为aag38563的鼠tlr6多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体7”和“tlr7”是指与公开可用的tlr7序列(例如,genbank登录号为aaz99026的人tlr7多肽,或genbank登录号为aak62676的鼠tlr7多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体8”和“tlr8”是指与公开可用的tlr8序列(例如,genbank登录号为aaz95441的人tlr8多肽,或genbank登录号为aak62677的鼠tlr8多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体7/8”和“tlr7/8”是指同时为tlr7激动剂和tlr8激动剂的核酸或多肽。术语“toll样受体9”和“tlr9”是指与公开可用的tlr9序列(例如,genbank登录号为aaf78037的人tlr9多肽,或genbank登录号为aak28488的鼠tlr9多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体10”和“tlr10”是指与公开可用的tlr10序列(例如,genbank登录号为aak26744的人tlr10多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。术语“toll样受体11”和“tlr11”是指与公开可用的tlr11序列(例如,genbank登录号为aas83531的鼠tlr11多肽)具有至少70%、80%、90%、95%、96%、97%、98%、99%或更多序列同一性的核酸或多肽。“tlr激动剂”是直接或间接结合tlr(例如,tlr7和/或tlr8)以诱导tlr信号传导的物质。tlr信号传导中的任何可检测的差异可指示激动剂刺激或活化tlr。信号差异可表现为例如以下各项的变化:靶基因的表达、信号转导组分的磷酸化、下游元件诸如nk-κb的细胞内定位、某些组分(诸如irak)与其他蛋白质或细胞内结构的关联或者组分诸如激酶(诸如mapk)的生物化学活性。如本文所用,术语“氨基酸”是指可结合到肽、多肽或蛋白质中的任何单体单元。氨基酸包括天然存在的α-氨基酸及其立体异构体,以及非天然(非天然存在的)氨基酸及其立体异构体。给定氨基酸的“立体异构体”是指具有相同的分子式和分子内键但具有不同的键和原子三维排列的异构体(例如,l-氨基酸和相应的d-氨基酸)。天然存在的氨基酸是由遗传密码编码的那些氨基酸,以及随后被修饰的那些氨基酸,例如羟脯氨酸、γ-羧基谷氨酸和o-磷酸丝氨酸。天然存在的α-氨基酸包括但不限于丙氨酸(ala)、半胱氨酸(cys)、天冬氨酸(asp)、谷氨酸(glu)、苯丙氨酸(phe)、甘氨酸(gly)、组氨酸(his)、异亮氨酸(ile)、精氨酸(arg)、赖氨酸(lys)、亮氨酸(leu)、蛋氨酸(met)、天冬酰胺(asn)、脯氨酸(pro)、谷氨酰胺(gln)、丝氨酸(ser)、苏氨酸(thr)、缬氨酸(val)、色氨酸(trp)、酪氨酸(tyr)及其组合。天然存在的α-氨基酸的立体异构体包括但不限于d-丙氨酸(d-ala)、d-半胱氨酸(d-cys)、d-天冬氨酸(d-asp)、d-谷氨酸(d-glu)、d-苯丙氨酸(d-phe)、d-组氨酸(d-his)、d-异亮氨酸(d-ile)、d-精氨酸(d-arg)、d-赖氨酸(d-lys)、d-亮氨酸(d-leu)、d-蛋氨酸(d-met)、d-天冬酰胺(d-asn)、d-脯氨酸(d-pro)、d-谷氨酰胺(d-gln)、d-丝氨酸(d-ser)、d-苏氨酸(d-thr)、d-缬氨酸(d-val)、d-色氨酸(d-trp)、d-酪氨酸(d-tyr)及其组合。非天然(非天然存在的)氨基酸包括但不限于作用方式与天然存在的氨基酸相似的l-或d-构型的氨基酸类似物、氨基酸模拟物、合成氨基酸、n-取代的甘氨酸和n-甲基氨基酸。例如,“氨基酸类似物”可以是具有与天然存在的氨基酸相同的基本化学结构(即,键合到氢、羧基基团、氨基基团的碳)但具有经修饰的侧链基团或经修饰的肽主链的非天然氨基酸,例如高丝氨酸、正亮氨酸、蛋氨酸亚砜、甲硫氨酸甲基锍。“氨基酸模拟物”是指具有与氨基酸的一般化学结构不同的结构但作用方式与天然存在的氨基酸相似的化学化合物。氨基酸在本文可通过公知的三字母符号或通过iupac-iub生物化学命名委员会推荐的单字母符号表示。如本文所用,术语“免疫检查点抑制剂”是指抑制免疫检查点分子活性的任何调节剂。免疫检查点抑制剂可包括但不限于免疫检查点分子结合蛋白、小分子抑制剂、抗体、抗体衍生物(包括fc融合体、fab片段和scfv)、抗体-药物缀合物、反义寡核苷酸、sirna、适配体、肽和肽模拟物。如本文所用,术语“连接部分”是指在化合物或材料中共价结合两个或更多个部分的官能团。例如,连接部分可用于将免疫缀合物中的佐剂部分与抗体共价结合。用于将连接部分连接到蛋白质和其他材料的可用键包括但不限于酰胺、胺、酯、氨基甲酸酯、脲、硫醚、硫代氨基甲酸酯、硫代碳酸酯和硫脲。“二价”连接部分含有用于连接两个官能团的两个附接点;多价连接部分可具有用于连接其他官能团的额外附接点。例如,二价连接部分包括二价聚合物部分,诸如二价聚(乙二醇)、二价聚(丙二醇)和二价聚(乙烯醇)。如本文所用,当术语“任选地存在”用于表示化学结构(例如,“r”或“q”)时,如果不存在该化学结构,则最初对该化学结构形成的键直接对相邻原子形成。如本文所用,术语“连接子”是指在化合物或材料中共价结合两个或更多个部分的官能团。例如,连接子可用于将免疫缀合物中的佐剂部分与抗体共价结合。如本文所用,术语“烷基”是指具有所示碳原子数的直链或支链饱和脂族基。烷基可包括任何数量的碳,诸如c1-2、c1-3、c1-4、c1-5、c1-6、c1-7、c1-8、c1-9、c1-10、c2-3、c2-4、c2-5、c2-6、c3-4、c3-5、c3-6、c4-5、c4-6和c5-6。例如,c1-6烷基包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、己基等。烷基还可指具有最多30个碳原子的烷基基团,诸如但不限于庚基、辛基、壬基、癸基等。烷基基团可以是取代的或未取代的。“取代的烷基”基团可被一个或多个选自卤素、羟基、氨基、氧代基(=o)、烷基氨基、酰氨基、酰基、硝基、氰基和烷氧基的基团取代。术语“亚烷基”是指二价烷基。如本文所用,术语“杂烷基”是指如本文所述的烷基基团,其中一个或多个碳原子任选且独立地被选自n、o和s的杂原子替代。术语“杂亚烷基”是指二价杂烷基。如本文所用,术语“碳环”是指含有3至12个环原子或所示原子数的饱和或部分不饱和的单环、稠合双环或桥连多环的环组合。碳环可包括任何数量的碳,诸如c3-6、c4-6、c5-6、c3-8、c4-8、c5-8、c6-8、c3-9、c3-10、c3-11和c3-12。饱和单环碳环包括例如环丙基、环丁基、环戊基、环己基和环辛基。饱和双环和多环碳环包括例如降冰片烷、[2.2.2]二环辛烷、十氢化萘和金刚烷。碳环基团也可以是部分不饱和的,在环中具有一个或多个双键或三键。部分不饱和的代表性碳环基团包括但不限于环丁烯、环戊烯、环己烯、环己二烯(1,3-和1,4-异构体)、环庚烯、环庚二烯、环辛烯、环辛二烯(1,3-、1,4-和1,5-异构体)、降冰片烯和降冰片二烯。不饱和碳环基团还包括芳基基团。术语“芳基”是指具有任何合适数量的环原子和任何合适数量的环的芳环系统。芳基基团可包括任何合适数量的环原子,诸如6、7、8、9、10、11、12、13、14、15或16个环原子,以及6至10、6至12或6至14个环原子。芳基基团可以是单环,稠合形成双环或三环基团,或通过键连接形成二芳基基团。代表性芳基基团包括苯基、萘基和联苯基。其他芳基基团包括具有亚甲基连接基团的苄基。一些芳基基团具有6至12个环原子,诸如苯基、萘基或联苯基。其他芳基基团具有6至10个环成员,诸如苯基或萘基。“二价”碳环是指具有用于在分子或材料中共价连接两个部分的两个附接点的碳环基团。碳环可以是取代的或未取代的。“取代的碳环”基团可被一个或多个选自卤素、羟基、氨基、烷基氨基、酰氨基、酰基、硝基、氰基和烷氧基的基团取代。如本文所用,术语“杂环”是指杂环烷基基团和杂芳基基团。“杂芳基”本身或作为另一取代基的一部分,是指含有5至16个环原子的单环或稠合双环或三环芳环组合,其中1至5个环原子是杂原子,诸如n、o或s。另外的杂原子也可以是有用的,包括但不限于b、al、si和p。这些杂原子可被氧化形成诸如但不限于-s(o)-和-s(o)2-的部分。杂芳基基团可包括任意数量的环原子,诸如3至6、4至6、5至6、3至8、4至8、5至8、6至8、3至9、3至10、3至11或3至12个环原子。杂芳基基团中可包括任何合适数量的杂原子,诸如1、2、3、4或5,或1至2、1至3、1至4、1至5、2至3、2至4、2至5、3至4或3至5个杂原子。杂芳基基团可包括诸如吡咯、吡啶、咪唑、吡唑、三唑、四唑、吡嗪、嘧啶、哒嗪、三嗪(1,2,3-、1,2,4-和1,3,5-异构体)、噻吩、呋喃、噻唑、异噻唑、噁唑和异噁唑的基团。杂芳基基团也可稠合到芳环系统诸如苯环,以形成包括但不限于苯并吡咯(诸如吲哚和异吲哚)、苯并吡啶(诸如喹啉和异喹啉)、苯并吡嗪(喹喔啉)、苯并嘧啶(喹唑啉)、苯并哒嗪(诸如酞嗪和噌啉)、苯并噻吩和苯并呋喃的成员。其他杂芳基基团包括通过键连接的杂芳基环,诸如二吡啶。杂芳基基团可以是取代的或未取代的。“取代的杂芳基”基团可被一个或多个选自卤素、羟基、氨基、氧代基(=o)、烷基氨基、酰氨基、酰基、硝基、氰基和烷氧基的基团取代。杂芳基基团可经由环上的任何位置连接。例如,吡咯包括1-、2-和3-吡咯,吡啶包括2-、3-和4-吡啶,咪唑包括1-、2-、4-和5-咪唑,吡唑包括1-、3-、4-和5-吡唑,三唑包括1-、4-和5-三唑,四唑包括1-和5-四唑,嘧啶包括2-、4-、5-和6-嘧啶,哒嗪包括3-和4-哒嗪,1,2,3-三嗪包括4-和5-三嗪,1,2,4-三嗪包括3-、5-和6-三嗪,1,3,5-三嗪包括2-三嗪,噻吩包括2-和3-噻吩,呋喃包括2-和3-呋喃,噻唑包括2-、4-和5-噻唑,异噻唑包括3-、4-和5-异噻唑,噁唑包括2-、4-和5-噁唑,异噁唑包括3-、4-和5-异噁唑,吲哚包括1-、2-和3-吲哚,异吲哚包括1-和2-异吲哚,喹啉包括2-、3-和4-喹啉,异喹啉包括1-、3-和4-异喹啉,喹唑啉包括2-和4-喹唑啉,噌啉包括3-和4-喹啉,苯并噻吩包括2-和3-苯并噻吩,并且苯并呋喃包括2-和3-苯并呋喃。“杂环基”本身或作为另一取代基的一部分,是指具有3至12个环成员和1至4个n、o和s杂原子的饱和环系统。另外的杂原子也可以是有用的,包括但不限于b、al、si和p。这些杂原子可被氧化形成诸如但不限于-s(o)-和-s(o)2-的部分。杂环基基团可包括任意数量的环原子,诸如3至6、4至6、5至6、3至8、4至8、5至8、6至8、3至9、3至10、3至11或3至12个环原子。杂环基基团中可包括任何合适数量的杂原子,诸如1、2、3或4,或1至2、1至3、1至4、2至3、2至4或3至4个杂原子。杂环基基团可包括诸如氮丙啶、氮杂环丁烷、吡咯烷、哌啶、氮杂环庚烷、偶氮烷、奎宁环、吡唑烷、咪唑烷、哌嗪(1,2-、1,3-和1,4-异构体)、环氧乙烷、氧杂环丁烷、四氢呋喃、氧杂环己烷(四氢吡喃)、氧杂环庚烷、硫杂丙环、硫杂环丁烷、硫杂环戊烷(四氢噻吩)、噻吩(四氢噻喃)、噁唑烷、异噁唑烷、噻唑烷、异噻唑烷、二氧戊环、二硫戊环、吗啉、硫代吗啉、二氧杂环己烷或二噻烷的基团。杂环基基团也可稠合到芳环或非芳环系统,以形成包括但不限于二氢吲哚的成员。杂环基基团可以是未取代的或取代的。“取代的杂环基”基团可被一个或多个选自卤素、羟基、氨基、氧代基(=o)、烷基氨基、酰氨基、酰基、硝基、氰基和烷氧基的基团取代。杂环基基团可经由环上的任何位置连接。例如,氮丙啶可以是1-或2-氮丙啶,氮杂环丁烷可以是1-或2-氮杂环丁烷,吡咯烷可以是1-、2-或3-吡咯烷,哌啶可以是1-、2-、3-或4-哌啶,吡唑烷可以是1-、2-、3-或4-吡唑烷,咪唑烷可以是1-、2-、3-或4-咪唑烷,哌嗪可以是1-、2-、3-或4-哌嗪,四氢呋喃可以是1-或2-四氢呋喃,噁唑烷可以是2-、3-、4-或5-噁唑烷,异噁唑烷可以是2-、3-、4-或5-异噁唑烷,噻唑烷可以是2-、3-、4-或5-噻唑烷,异噻唑烷可以是2-、3-、4-或5-异噻唑烷,并且吗啉可以是2-、3-或4-吗啉。如本文所用,术语“卤代”和“卤素”本身或作为另一取代基的一部分,是指氟、氯、溴或碘原子。如本文所用,术语“羰基”本身或作为另一取代基的一部分,是指-c(o)-,即与氧形成双键并与具有羰基的部分中的两个其他基团键合的碳原子。如本文所用,术语“氨基”是指-nr3部分,其中每个r基团是h或烷基。氨基部分可被电离以形成相应的铵阳离子。如本文所用,术语“羟基”是指-oh部分。如本文所用,术语“氰基”是指与氮原子形成三键的碳原子(即-c≡n部分)。如本文所用,术语“羧基”是指-c(o)oh部分。羧基部分可被电离以形成相应的羧酸根阴离子。如本文所用,术语“酰氨基”是指-nrc(o)r或-c(o)nr2部分,其中每个r基团是h或烷基。如本文所用,术语“硝基”是指-no2部分。如本文所用,术语“氧代基”是指与化合物形成双键的氧原子(即o=)。如本文所用,术语“治疗”是指治疗或改善损伤、病理、病症或症状(例如认知障碍)的任何成功标志,包括任何客观或主观参数,诸如缓和;缓解;减轻症状或使症状、损伤、病理或病症对患者来说更能忍受;降低症状发展率;减少症状或病症的频率或持续时间;或者在一些情况下,预防症状的发作。症状的治疗或改善可基于任何客观或主观参数;包括例如身体检查的结果。如本文所用,术语“癌症”是指包括实体癌、淋巴瘤和白血病在内的病症。不同类型的癌症的示例包括但不限于肺癌(例如非小细胞肺癌或nsclc)、卵巢癌、前列腺癌、结肠直肠癌、肝癌(即肝癌)、肾癌(即肾细胞癌)、膀胱癌、乳腺癌、甲状腺癌、胸膜癌、胰腺癌、子宫癌、宫颈癌、睾丸癌、肛门癌、胆管癌、胃肠道类癌、食道癌、胆囊癌、阑尾癌、小肠癌、胃癌(胃癌)、中枢神经系统癌、皮肤癌(例如黑色素瘤)、绒毛膜癌、头颈癌、血癌、成骨肉瘤、纤维肉瘤、神经母细胞瘤、胶质瘤、黑色素瘤、b细胞淋巴瘤、非霍奇金淋巴瘤、伯基特淋巴瘤、小细胞淋巴瘤、大细胞淋巴瘤、单核细胞白血病、髓性白血病、急性淋巴细胞白血病、急性髓细胞白血病和多发性骨髓瘤。如本文所用,术语“有效量”和“治疗有效量”是指物质(诸如免疫缀合物)的产生施用其的治疗效果的剂量。确切的剂量将取决于治疗的目的,并且本领域技术人员可使用已知技术来确定(参见例如lieberman,“pharmaceuticaldosageforms”(第1-3卷,1992年);lloyd,“theart,scienceandtechnologyofpharmaceuticalcompounding”(1999年);pickar,“dosagecalculations”(1999年);“goodman&gilman’sthepharmacologicalbasisoftherapeutics”,第11版,2006年,brunton编辑,mcgraw-hill;以及“remington:thescienceandpracticeofpharmacy”,第21s版,2005年,hendrickson编辑,lippincott,williams&wilkins)。如本文所用,术语“受试者”是指动物,诸如哺乳动物,包括但不限于灵长类(例如人)、牛、绵羊、山羊、马、狗、猫、兔、大鼠、小鼠等。在某些实施方案中,受试者为人。如本文所用,术语“施用”是指对受试者进行胃肠外、静脉内、腹膜内、肌肉内、肿瘤内、病灶内、鼻内或皮下施用、口服施用、栓剂施用、局部接触、鞘内施用或植入缓释装置,例如迷你渗透泵。本文用来修约数值的术语“约”和“大约”表示该确切值附近的密切范围。如果“x”为该值,则“约x”或“大约x”表示0.9x至1.1x(例如0.95x至1.05x或0.99x至1.01x)的值。对“约x”或“大约x”的任何提及具体表示至少x、0.95x、0.96x、0.97x、0.98x、0.99x、1.01x、1.02x、1.03x、1.04x和1.05x的值。因此,“约x”和“大约x”旨在教导并提供对例如“0.98x”的权利要求限制的书面描述支持。抗体佐剂免疫缀合物本发明提供了免疫缀合物,所述免疫缀合物含有:抗体构建体,所述抗体构建体包含抗原结合结构域和fc结构域;佐剂部分;以及连接子,其中每个佐剂部分经由连接子与抗体共价结合。如本文所述的免疫缀合物可出乎意料地增加抗原呈递细胞(apc)的活化响应。可在体外或体内检测这种增加的活化。在一些情况下,可以缩短的时间的形式检测增加的apc活化,以实现指定水平的apc活化。例如,体外测定中,%apc活化可使用相同剂量的免疫缀合物在用未缀合的抗体和tlr激动剂的混合物得到相同或相似百分比的apc活化所需的时间的1%、10%或50%内实现。在一些情况下,免疫缀合物可在缩短的时间量内活化apc(例如,树突细胞)和/或nk细胞。例如,在一些情况下,抗体tlr激动剂混合物可在用混合物孵育2、3、4、5、1-5、2-5、3-5或4-7天后活化apc(例如树突细胞)和/或nk细胞并且/或者诱导树突细胞分化;而相反,本文所述的免疫缀合物可在4小时、8小时、12小时、16小时或1天内活化并且/或者诱导分化。或者,可以达到apc活化的量(例如,apc百分比)、水平(例如,通过合适标记物的上调水平测量)或速率(例如,通过活化所需的孵育时间检测)所需的降低的免疫缀合物浓度的形式检测增加的apc活化。本发明的免疫缀合物必须包括fc区。如图130a-131e所示,非fcr结合蛋白在与化合物1缀合时不活化骨髓细胞。在一个实施方案中,与现有技术的免疫缀合物(例如,‘528专利中公开的免疫缀合物)相比,本发明的免疫缀合物提供了超过5%的活性增加。在另一个实施方案中,与现有技术的免疫缀合物相比,本发明的免疫缀合物提供了超过10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%或70%的活性增加。活性增加可通过本领域技术人员已知的任何方式进行评估,并且可包括骨髓活化或细胞因子分泌评估。在一个实施方案中,本发明的免疫缀合物提供了改进的药物与佐剂比率。在一些实施方案中,每个免疫缀合物的佐剂部分的平均数量范围为约1至约10。理想的药物与佐剂比率可由本领域技术人员根据所需的治疗效果确定。例如,可能需要大于1.2的药物与佐剂比率。在一个实施方案中,可能需要大于0.2、0.4、0.6、0.8、1、1.2、1.4、1.6、1.8、2.0、2.2、2.4、2.6、2.8、3.0、3.2、3.4、3.6、3.8、4.0、5.0、6.0、7.0、8.0或9.0的药物与佐剂比率。在另一个实施方案中,可能需要小于10.0、9.0、8.0、7.0、6.0、5.0、4.0、3.8、3.6、3.4、3.2、3.0、2.8、2.6、2.4、2.2、2.0、1.8、1.6、1.4、1.2、0.8、0.6、0.4或0.2的药物与佐剂比率。药物与佐剂比率可通过本领域技术人员已知的任何方式进行评估。本发明的免疫缀合物含有将佐剂部分与抗体共价结合的连接部分。在一些实施方案中,该免疫缀合物具有根据式i的结构:或其药学上可接受的盐,其中ab为抗体;a为抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链;z为连接部分;adj为佐剂部分;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在一些实施方案中,该免疫缀合物具有根据式ia的结构:或其药学上可接受的盐,其中ab为抗体;a为抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链;z为连接部分;r1选自h和c1-4烷基;或者z、r1和它们所附接的氮原子形成包含5-至8-元杂环的连接部分;每个y独立地为chr2,其中r2选自h、oh和nh2,r3选自c1-6烷基和2-至6-元杂烷基,它们各自任选地被一个或多个选自卤素、羟基、氨基、氧代基(=o)、烷基氨基、酰氨基、酰基、硝基、氰基和烷氧基的成员取代;x选自o和ch2;下标n为1至12(即,1、2、3、4、5、6、7、8、9、10、11或12)的整数;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在式ia的免疫缀合物的某些实施方案中,下标n为1至6(即,1、2、3、4、5或6)的整数。在一些实施方案中,该免疫缀合物具有根据式ib的结构:或其药学上可接受的盐,其中ab为抗体;a为抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链;z为连接部分;r1选自h和c1-4烷基;或者z、r1和它们所附接的氮原子形成包含5-至8-元杂环的连接部分;每个y独立地为chr2,其中r2选自h、oh和nh2;x选自o和ch2;下标n为1至12(即,1、2、3、4、5、6、7、8、9、10、11或12)的整数;并且w选自o和ch2。在一些实施方案中,该免疫缀合物具有根据式ic的结构:或其药学上可接受的盐,其中ab为抗体;下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数;a为抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链;z为连接部分;并且r1选自h和c1-4烷基;或者z、r1和它们所附接的氮原子形成包含5-至8-元杂环的连接部分;并且r2选自h、oh和nh2。在一些实施方案中,该免疫缀合物具有根据式id的结构:或其药学上可接受的盐,其中ab为抗体;a为抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链;r2选自h、oh和nh2;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在某些实施方案中,下标r为1至4(即,1、2、3或4)的整数。在式i和式ia-id的免疫缀合物的某些实施方案中,a为硫醇修饰的赖氨酸侧链。在式i和式ia-id的免疫缀合物的一些实施方案中,a为半胱氨酸侧链。在一些实施方案中,z选自:其中下标x为1至12(即,1、2、3、4、5、6、7、8、9、10、11或12)的整数;下标y为1至30(即1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30)的整数;虚线表示佐剂部分的附接点;并且波浪线表示抗体中氨基酸侧链的附接点。在一些实施方案中,该免疫缀合物具有根据式ii的结构:或其药学上可接受的盐,其中ab为抗体;其中a为抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链;其中adj为佐剂部分;其中下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数;并且其中:z1选自-c(o)-、-c(o)nh-、-ch2-;z2和z4独立地选自键、c1-30亚烷基和3-至30-元杂亚烷基,其中:c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被-c(o)-、-nrac(o)-或-c(o)nra-替代,c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被4-至8-元二价碳环替代,c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被具有1至4个选自o、s和n的杂原子的4-至8-元二价杂环替代,并且每个ra独立地选自h和c1-6烷基;z3选自键、二价肽部分和二价聚合物部分;并且z5与抗体中氨基酸侧链侧链键合。在一些实施方案中,该免疫缀合物具有根据式iia的结构:或其药学上可接受的盐,其中z1选自-c(o)-、-c(o)nh-、-ch2-;z2和z4独立地选自键、c1-30亚烷基和3-至30-元杂亚烷基,其中:c1-30烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被-c(o)-、-nrac(o)-或-c(o)nra-替代;c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被4-至8-元二价碳环替代,c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被具有1至4个选自o、s和n的杂原子的4-至8-元二价杂环替代,并且每个ra独立地选自h和c1-6烷基;z3选自键、二价肽部分和二价聚合物部分;并且z5选自胺键合的部分和硫醇键合的部分。在式ii和式iia的免疫缀合物的某些实施方案中,z5为硫醇键合的部分。在式ii和式iia的免疫缀合物的某些实施方案中,z5为硫醇键合的部分,并且a为硫醇修饰的赖氨酸侧链。在式ii和式iia的免疫缀合物的某些实施方案中,z5为硫醇键合的部分,并且a为半胱氨酸侧链。在式ii和式iia的免疫缀合物的某些实施方案中,连接部分(即佐剂(“adj”)和氨基酸(“a”)之间的结构组分)包括选自以下的结构:其中z1、z2、z3和z4如上所述;虚线表示佐剂部分的附接点;并且波浪线表示抗体中氨基酸侧链的附接点。在一些实施方案中,z3为二价肽部分。在一些实施方案中,肽包括选自丙氨酸残基、缬氨酸残基、亮氨酸残基、异亮氨酸残基、苯基丙氨酸残基、色氨酸残基和脯氨酸残基的第一残基。在一些此类实施方案中,肽包括选自未受保护的赖氨酸残基、受保护的赖氨酸残基、未受保护的精氨酸残基、受保护的精氨酸残基、组氨酸残基、未受保护的鸟氨酸残基、受保护的鸟氨酸残基、赖氨酸残基和瓜氨酸的第二氨基酸。在一些实施方案中,肽包括选自苯丙氨酸残基和缬氨酸残基的第一残基。在一些此类实施方案中,肽包括选自赖氨酸残基和瓜氨酸残基的第二残基。通常,肽部分将含有约2-12个氨基酸残基。例如,肽可含有2至8个氨基酸残基,或2至4个氨基酸残基。在一些实施方案中,肽为二肽。在一些实施方案中,肽为四肽。在一些实施方案中,肽选自phe-lys、val-lys、phe-phe-lys、d-phe-phe-lys、gly-phe-lys、ala-lys、val-cit、val-ala、phe-cit、leu-cit、ile-cit、trp-cit、phe-ala、gly-phe-leu-gly、ala-leu-ala-leu、phe-n9-甲苯磺酰基-arg和phe-n9-硝基-arg。在一些实施方案中,肽可被蛋白酶诸如组织蛋白酶b、组织蛋白酶c或组织蛋白酶d裂解。组织蛋白酶b敏感肽可特别用作连接子组分,因为组织蛋白酶b涉及许多病理和致癌过程。虽然组织蛋白酶b的表达和活化在健康组织和器官中受到严格调控,但在肿瘤和其他恶性肿瘤中可在多个水平上改变调控。已在各种癌症中观察到了组织蛋白酶b的过表达,包括脑癌、肺癌、前列腺癌、乳腺癌和结肠直肠癌。参见例如gondi等人,expertopin.ther.targets,2013年,第17卷(第3期):第281-291页。因此,当免疫缀合物到达恶性靶标诸如受试者的肿瘤时,可裂解含有组织蛋白酶b敏感肽组分(诸如phe-lys和val-cit二肽)的连接子。因为这些肽组分通常对循环系统和健康组织中的酶不敏感,所以在免疫缀合物到达受试者的靶标之前不释放佐剂部分。在一些实施方案中,z2选自c1-30亚烷基和3-至30-元杂亚烷基,其中相邻原子的一个或多个基团任选且独立地被-c(o)-、-nhc(o)-或-c(o)nh-替代;并且相邻原子的一个或多个基团任选且独立地被4-至8-元二价碳环替代。在一些实施方案中,z2选自:其中虚线表示z1的附接点,并且波浪线表示z3的附接点。在某些实施方案中,-z1-z2-为:其中虚线表示佐剂部分的附接点,并且波浪线表示z3的附接点。在一些此类实施方案中,z3为选自phe-lys和val-cit的二价肽部分。在一些实施方案中,z4为c1-30亚烷基,其中相邻原子的一个或多个基团任选且独立地被-c(o)-、-nhc(o)-或-c(o)nh-替代;并且相邻原子的一个或多个基团任选且独立地被4-至8-元二价碳环替代。在一些实施方案中,z4选自:其中虚线表示z3的附接点,并且波浪线表示z5的附接点。在一些此类实施方案中,z3为选自phe-lys和val-cit的二价肽部分。本领域技术人员将理解,可使用用于蛋白质修饰的各种化学方法将缀合物中的佐剂部分与抗体共价结合,并且上述连接部分由蛋白质官能团(即氨基酸侧链)与具有反应性连接子基团的试剂进行反应产生。多种此类试剂是本领域已知的。此类试剂的示例包括但不限于n-羟基琥珀酰亚胺基(nhs)酯和n-羟基磺基琥珀酰亚胺基(磺基-nhs)酯(胺反应性);碳二亚胺(胺和羧基反应性);羟甲基膦(胺反应性);马来酰亚胺(硫醇反应性);卤代乙酰胺,如n-碘乙酰胺(硫醇反应性);芳基叠氮化物(伯胺反应性);氟化芳基叠氮化物(经由碳-氢(c-h)插入反应);五氟苯(pfp)酯(胺反应性);四氟苯基(tfp)酯(胺反应性);亚胺酸酯(胺反应性);异氰酸酯(羟基反应性);乙烯基砜(硫醇,胺和羟基反应性);吡啶基二硫化物(硫醇反应性);以及二苯甲酮衍生物(通过c-h键插入反应)。其他试剂包括但不限于hermanson,bioconjugatetechniques第2版,academicpress,2008年中描述的那些试剂。含有马来酰亚胺基团、乙烯基砜基团、吡啶基二硫化物基团和卤代乙酰胺基团的连接子特别适用于与抗体中的硫醇基团共价结合。抗体中的硫醇基团通常位于半胱氨酸侧链中。游离硫醇基团可存在于抗体中天然存在的、溶剂可及的半胱氨酸残基中。如下所述,游离硫醇也可存在于经工程改造的半胱氨酸残基中。另外,硫醇基团可经由完全或部分还原抗体中半胱氨酸侧链之间的二硫键来产生。也可使用已知方法将硫醇基团附加到赖氨酸侧链上,所用试剂包括但不限于2-亚氨基四氢噻吩(traut试剂)、n-琥珀酰亚胺基-s-乙酰硫代乙酸酯(sata)和satp(n-琥珀酰亚胺基-s-乙酰硫代丙酸酯)。当用乙酰化试剂如sata和satp修饰抗体时,可经由用羟胺或类似试剂水解除去乙酰基基团,以产生游离硫醇基团用于进一步缀合。参见例如traut等人(biochem.,第12卷(第17期):第3266-3273页(1973年))和duncan等人(anal.biochem.,第132卷(第1期):第68-73页(1983年))。连接子可具有任何合适的长度,使得当连接子与抗体构建体和佐剂部分共价结合时,保持抗体构建体和佐剂部分的功能。连接子的长度可为约或更长,例如约或更长、约或更长、约或更长、约或更长、约或更长、约或更长或者约或更长。或者,或除此之外,连接子的长度可为约或更短,例如约或更短、约或更短、约或更短、约或更短、约或更短、约或更短或者约或更短。因此,连接子可具有由前述任何两个端点限定的长度。连接子的长度可为约至约例如约至约约至约约至约约至约约至约约至约约至约约至约约至约约至约约至约约至约约至约约至约或约至约在优选实施方案中,连接子的长度为约至约因此,本发明提供了使用选自以下的试剂(或共价结合试剂(“cbr”))将佐剂部分与抗体共价结合的实施方案:其中x为卤素(例如碘、溴或氯);r′为h或磺基;r″为任选地被取代的芳基(例如3-羧基-4-硝基苯基)或任选地被取代的杂芳基(例如,吡啶-2-基);r″′为任选地被取代的烷基(例如甲氧基);z1、z2、z3和z4如上所述;并且虚线表示佐剂部分的附接点。在一些实施方案中,连接子部分-z1-z2-z3-z4-z5-为:其中虚线表示佐剂部分的附接点,并且波浪线表示抗体中氨基酸侧链的附接点。在一些此类实施方案中,氨基酸侧链为半胱氨酸侧链或含有硫醇基团的经修饰赖氨酸侧链。在一些实施方案中,该免疫缀合物具有根据式iii的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体,adj为佐剂,g为ch2、c=o或键,l为连接子,并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在式iii的免疫缀合物的某些实施方案中,该抗体不含硫醇修饰的赖氨酸侧链。在一些实施方案中,l选自:其中r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;a为1至40的整数;每个a独立地选自任何氨基酸;下标c为1至20的整数;虚线表示的附接点;并且波浪线表示的附接点。在一些实施方案中,该免疫缀合物具有根据式iiia的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;g为ch2、c=o或键;r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;下标a为1至40的整数;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在一些实施方案中,该免疫缀合物具有根据式iiib的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;g为ch2、c=o或键;下标a为1至40的整数;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在一些实施方案中,该免疫缀合物具有根据式iiic的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;g为ch2、c=o或键;r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;每个a独立地选自任何氨基酸;下标c为1至20的整数;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在一些实施方案中,该免疫缀合物具有根据式iiid的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;g为ch2、c=o或键;r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;下标c为1至20的整数;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在一些实施方案中,该免疫缀合物具有根据式iiie的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;g为ch2、c=o或键;r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在一些实施方案中,该免疫缀合物具有根据式iiif的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;g为ch2、c=o或键;r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在一些实施方案中,该免疫缀合物具有根据式iiig的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;g为ch2、c=o或键;r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。因此,该免疫缀合物可具有根据式iva-式ivk的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在某些实施方案中,下标r为1至4(即,1、2、3或4)的整数。在某些实施方案中,该免疫缀合物具有选自以下的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在某些实施方案中,下标r为1至4(即,1、2、3或4)的整数。在某些实施方案中,该免疫缀合物具有选自以下的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在某些实施方案中,下标r为1至4(即,1、2、3或4)的整数。在第二方面,本发明提供了一种由式v的一种或多种化合物和式vi的抗体制备式iii的免疫缀合物的改进方法,该方法包括以下步骤:其中adj为佐剂;g为ch2、c=o或键;l为连接子;e为酯;式vi为具有至少一个赖氨酸侧链的抗体;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在某些实施方案中,佐剂(“adj”)为tlr激动剂。可以使用任何合适的连接子,条件是它可通过酯与抗体(式vi的化合物)结合。例如,连接子(“l”)可具有下式其中r任选地存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;下标a为1至40的整数;虚线表示的附接点;并且波浪线表示e的附接点。在一些实施方案中,下标a为1至20的整数。在一些实施方案中,下标a为1至10的整数。在一些实施方案中,下标a为1至5的整数。在一些实施方案中,下标a为1至3的整数。在某些实施方案中,r存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链。连接子(“l”)可具有下式其中下标a为1至40的整数;虚线表示的附接点;并且波浪线表示e的附接点。在一些实施方案中,下标a为1至20的整数。在一些实施方案中,下标a为1至10的整数。在一些实施方案中,下标a为1至5的整数。在一些实施方案中,下标a为1至3的整数。连接子(“l”)也可具有下式其中r任选地存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;每个a独立地选自任何氨基酸;下标c为1至20的整数;虚线表示的附接点;并且波浪线表示e的附接点。在一些实施方案中,下标c为1至10的整数。在一些实施方案中,下标c为1至5的整数。在一些实施方案中,下标c为1至2的整数。在某些实施方案中,r存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链。连接子(“l”)也可具有下式其中r任选地存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;下标c为1至20的整数;虚线表示的附接点;并且波浪线表示e的附接点。在一些实施方案中,下标c为1至10的整数。在一些实施方案中,c为1至5的整数。在某些实施方案中,r存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链。连接子(“l”)也可具有下式其中r任选地存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;虚线表示的附接点;并且波浪线表示e的附接点。在某些实施方案中,r存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链。连接子(“l”)也可具有下式其中r任选地存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;虚线表示的附接点;并且波浪线表示e的附接点。在某些实施方案中,r存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链。连接子(“l”)也可具有下式其中r任选地存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;虚线表示的附接点;并且波浪线表示e的附接点。在某些实施方案中,r存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链。在一些实施方案中,式v的化合物选自:其中g为ch2、c=o或键;r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;下标a为1至40的整数;每个a独立地选自任何氨基酸;下标c为1至20的整数;并且e为酯。如前所述,有多种形成免疫缀合物的方法。每一种现有技术方法都有缺点。本发明的方法包括将经修饰以包括连接子的佐剂与抗体(式vi的化合物)的赖氨酸侧链缀合的一步过程。通过使用酯可实现该过程。酯可以是能够将式v的化合物与抗体(式vi的化合物)的赖氨酸侧链连接的任何合适的酯。例如,式v的酯可以是下式的n-羟基琥珀酰亚胺(“nhs”)酯:其中波浪线表示连接子(“l”)的附接点。式v的酯也可以是下式的磺基-n-羟基琥珀酰亚胺酯:其中m为任何阳离子,并且波浪线表示连接子(“l”)的附接点。例如,阳离子抗衡离子(“m”)可以是质子、铵、季胺、碱金属阳离子、碱土金属阳离子、过渡金属阳离子、稀土金属阳离子、主族元素阳离子或其组合。式v的酯也可以是下式的苯酚酯:其中每个r2独立地选自氢或氟,并且波浪线表示连接子(“l”)的附接点。式v的酯也可以是下式的苯酚酯:其中波浪线表示连接子(“l”)的附接点。在一些实施方案中,在任何合适的水性缓冲液中组合式vi的抗体和式v的酯。合适的水性缓冲液的示例性列表为磷酸盐缓冲液、硼酸盐缓冲液和tris缓冲液。使用四氟苯酚(“tfp”)或五氟苯酚(“pfp”)在合成本发明的免疫缀合物中特别有效。因此,式v的化合物的示例性但非限制性列表为:其中adj为佐剂,并且m为任何阳离子。例如,阳离子抗衡离子(“m”)可以是质子、铵、季胺、碱金属阳离子、碱土金属阳离子、过渡金属阳离子、稀土金属阳离子、主族元素阳离子或其组合。因此,可组合式v的一种或多种化合物和式vi的抗体以形成式iii的免疫缀合物。式iii的免疫缀合物的示例性但非限制性列表为:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;g为ch2、c=o或键;r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;下标a为1至40的整数;每个a独立地选自任何氨基酸;下标c为1至20的整数;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在第三方面,本发明提供了一种免疫缀合物,该免疫缀合物含有将包含寡核苷酸的佐剂部分与抗体共价结合的连接部分。在某些实施方案中,该免疫缀合物为选自式viia的免疫缀合物的a型cpg寡核苷酸免疫缀合物:或其药学上可接受的盐,其中ab为在抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链处结合的抗体;z为连接部分;下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数;小写核苷酸表示硫代磷酸酯键;并且大写核苷酸表示磷酸二酯键。在某些实施方案中,连接部分(“z”)如上文和本文定义。在某些实施方案中,免疫缀合物为选自式viib的免疫缀合物的b型cpg寡核苷酸免疫缀合物:或其药学上可接受的盐,其中ab为在抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链处结合的抗体;z为连接部分;下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数;并且大写核苷酸表示硫代磷酸酯键。在某些实施方案中,连接部分(“z”)如上文和本文定义。在某些实施方案中,免疫缀合物为选自式viic的免疫缀合物的c型cpg寡核苷酸免疫缀合物:或其药学上可接受的盐,其中ab为在抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链处结合的抗体;z为连接部分;下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数;并且大写核苷酸表示硫代磷酸酯键。在某些实施方案中,连接部分(“z”)如上文和本文定义。在某些实施方案中,免疫缀合物为选自式viid的免疫缀合物的polyi:c寡核苷酸免疫缀合物:或其药学上可接受的盐,其中ab为在抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链处结合的抗体;z为连接部分;并且下标r为1至10(即,1、2、3、4、5、6、7、8、9或10)的整数。在某些实施方案中,连接部分(“z”)如上文和本文定义。佐剂在一些实施方案中,佐剂部分是引发免疫应答的化合物。在一些实施方案中,佐剂部分是模式识别受体(“prr”)激动剂。能够活化模式识别受体(prr)的任何佐剂都可安置在本发明的免疫缀合物中。如本文所用,术语“模式识别受体”和“prr”是指识别病原体相关分子模式(“pamp”)或损伤相关分子模式(“damp”)并且充当先天免疫中的关键信号传导元件的一类保守哺乳动物蛋白的任何成员。模式识别受体分为膜结合的prr、细胞质prr和分泌的prr。膜结合的prr的示例包括toll样受体(“tlr”)和c型凝集素受体(“clr”)。细胞质prr的示例包括nod样受体(“nlr”)和rig-i样受体(“rlr”)。在一些实施方案中,该免疫缀合物可具有一种以上不同的prr佐剂部分。在某些实施方案中,本发明的免疫缀合物中的佐剂部分是toll样受体(tlr)激动剂。合适的tlr激动剂包括tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、tlr11或其任何组合(例如,tlr7/8激动剂)。能够活化toll样受体(tlr)的任何佐剂都可安置在本发明的免疫缀合物中。toll样受体(tlr)是i型跨膜蛋白,负责在脊椎动物中启动先天免疫应答。tlr识别来自细菌、病毒和真菌的各种病原体相关分子模式,并作为抵御入侵病原体的第一道防线。由于细胞表达以及它们启动的信号传导途径存在差异,tlr引发重叠但不同的生物反应。一旦参与(例如,通过天然刺激物或合成tlr激动剂),tlr便启动信号转导级联,从而导致经由衔接蛋白骨髓分化初级应答基因88(myd88)活化nf-κb并募集il-1受体相关激酶(irak)。之后,irak的磷酸化导致tnf-受体相关因子6(traf6)的募集,这导致nf-κb抑制剂i-κb的磷酸化。结果,nf-κb进入细胞核,并启动其启动子含有nf-κb结合位点的基因诸如细胞因子的转录。tlr信号传导的其他调控模式包括依赖诱导traf6的β干扰素tir结构域衔接蛋白(trif)和经由trif和traf3活化的myd88非依赖途径,从而导致干扰素应答因子3(irf3)的磷酸化。类似地,myd88依赖性途径也活化若干irf家族成员,包括irf5和irf7,而trif依赖性途径也活化nf-κb途径。tlr3激动剂的示例包括聚赖氨酸-聚胞苷酸(聚(i:c))、聚腺苷酸-聚尿苷酸(聚(a:u))和聚(i)-聚(c12u)。tlr4激动剂的示例包括脂多糖(lps)和单磷酰脂质a(mpla)。tlr5激动剂的示例包括鞭毛蛋白。tlr9激动剂的示例包括单链cpg寡脱氧核苷酸(cpgodn)。基于人外周血单核细胞(pbmc)、特别是b细胞和浆细胞样树突细胞(pdc)上的结构特征和活性,已经鉴定了三类主要的刺激性cpgodn。这三类是a类(d型)、b类(k型)和c类。nod样受体(nlr)激动剂的示例包括ie-dap的酰化衍生物、d-γ-glu-mdap、l-ala-γ-d-glu-mdap、具有c18脂肪酸链的胞壁酰二肽、胞壁酰二肽、胞壁酰基三肽和n-羟乙酰化的胞壁酰二肽。rig-i样受体(rlr)激动剂的示例包括5′ppp-dsrna(5′-pppgcaugcgaccucuguuuga-3′:3′-cguacgcuggagacaaacu-5′)和聚(脱氧腺苷酸脱氧胸苷)酸(聚(da:dt))。其他免疫刺激化合物,诸如细胞溶质dna和称为环状二核苷酸的独特细菌核酸,可被干扰素基因刺激物(“sting”)识别,其可作为细胞溶质dna传感器。adu-sioo可以是sting激动剂。sting激动剂的非限制性示例包括:环[g(2′,5′)pa(2′,5′)p](2′2′-cgamp)、环[g(2′,5′)pa(3′,5′)p](2′3′-cgamp)、环[g(3′,5′)pa(3′,5′)p](3′3’-cgamp)、环二腺苷酸一磷酸(c-di-amp)、2′,5′-3′,5′-c-diamp(2′3′-c-di-amp)、环二鸟苷酸一磷酸(c-di-gmp)、2′,5′-3′,5′-c-digmp(2′3′-c-di-gmp)、环二肌苷一磷酸(c-di-imp)、环二尿苷一磷酸(c-di-ump)、kin700、kin1148、kin600、kin500、kinioo、kin101、kin400、kin2000或sb-9200。能够激活tlr7和/或tlr8的任何佐剂都可安置在本发明的免疫缀合物中。tlr7激动剂和tlr8激动剂的示例通过例如vacchelli等人(oncoimmunology,第2卷:第8期,第e25238页,doi:10.4161/onci.25238(2013年))和carson等人(美国专利申请公布2013/0165455,其全文据此以引用方式并入)有所描述。tlr7和tlr8均在单核细胞和树突细胞中表达。在人类中,tlr7也在浆细胞样树突细胞(pdc)和b细胞中表达。tlr8主要在骨髓来源的细胞(即单核细胞、粒细胞和骨髓树突细胞)中表达。tlr7和tlr8能够检测细胞内“外源”单链rna的存在,作为应对病毒入侵的手段。用tlr8激动剂治疗表达tlr8的细胞可导致产生高水平的il-12、ifn-γ、il-1、tnf-α、il-6和其他炎性细胞因子。类似地,用tlr7激动剂刺激表达tlr7的细胞诸如pdc,可导致产生高水平的ifn-α和其他炎性细胞因子。tlr7/tlr8参与和产生的细胞因子产生可活化树突细胞和其他抗原呈递细胞,驱动不同的先天和获得性免疫应答机制,从而导致肿瘤破坏。tlr7、tlr8或tlr7/8激动剂的示例包括但不限于:地喹莫德(1-(4-氨基-2-乙基氨基甲基咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇)、咪喹莫特(r837)(tlr7激动剂)、洛索立宾(tlr7激动剂)、irm1(1-(2-氨基-2-甲基丙基)-2-(乙氧基甲基)-1h-咪唑并[4,5-c]喹啉-4-胺)、irm2(2-甲基-1-[2]-(3-吡啶-3-基丙氧基)乙基]-1h-咪唑并[4,5-c]喹啉-4-胺)(tlr8激动剂)、irm3(n-(2-[2-[4-氨基]-2-(2-甲氧基乙基)-1h-咪唑并[4,5-c]喹啉-1-基]乙氧基]乙基)-n-甲基环己烷甲酰胺)(tlr8激动剂)、cl097(2-(乙氧基甲基)-1h-咪唑[4,5-c]喹啉-4-胺)(tlr7/8激动剂)、cl307(tlr7激动剂)、cl264(tlr7激动剂)、瑞喹莫德(tlr7/8激动剂)、3m-052/medi9197(tlr7/8激动剂)、sd-101(n-[(4s)-2,5-二氧代-4-咪唑烷基]-脲)(tlr7/8激动剂)、motolimod(2-氨基-n,n-二丙基-8-[4-(吡咯烷-1-羰基)苯基]-3h-1-苯并氮杂-4-甲酰胺)(tlr8激动剂)、cl075(3m002,2-丙基噻唑并[4,5-c]喹啉-4-胺)(tlr7/8激动剂)和tl8-506(3h-1-苯并氮杂-4-羧酸,2-氨基-8-(3-氰基苯基)-乙酯)(tlr8激动剂)。tlr2激动剂的示例包括但不限于包含n-α-棕榈酰-s-[2,3-双(棕榈酰氧基)-(2rs)-丙基]-l-半胱氨酸、棕榈酰-半胱氨酸((rs)-2,3-二(棕榈酰氧基)-丙基)(“pam3cys”)的试剂,例如pam3cys、pam3cys-ser-(lys)4(也称为“pam3cys-skkkk”和“pam3csk4”)、三酰基脂质a(“om-174”)、脂磷壁酸(“lta”)、肽聚糖和cl419(s-(2,3-双(棕榈酰氧基)-(2rs)丙基)-(r)-半胱氨酰精胺)。tlr2/6激动剂的示例是pam2csk4(s-[2,3-双(棕榈酰氧基)-(2rs)-丙基]-[r]-半胱氨酰-[s]-丝氨酰-[s]-赖氨酰-[s]-赖氨酰-[s]-赖氨酰-[s]-赖氨酸×3cf3cooh)。tlr2/7激动剂的示例包括cl572(s-(2-肉豆蔻酰氧基乙基)-(r)-半胱氨酰4-((6-氨基-2-(丁基氨基)-8-羟基-9h-嘌呤-9-基)甲基)苯胺)、cl413(s-(2,3-双(棕榈酰氧基)-(2rs)-丙基)-(r)-半胱氨酰-(s)-丝氨酰-(s)-赖氨酰-(s)-赖氨酰-(s)-赖氨酰-(s)-4-((6-氨基-2-(丁基氨基)-8-羟基-9h-嘌呤-9-基)甲基)苯胺)和cl401(s-(2,3-双(棕榈酰氧基)-(2rs)丙基)-(r)-半胱氨酰4-((6-氨基-2(丁基氨基)-8-羟基-9h-嘌呤-9-基)甲基)苯胺)。图22a-22x示出了tlr激动剂cl264、cl401、cl413、cl419、cl553、cl572、pam3csk4和pam2csk4可与本发明的免疫缀合物连接同时保持其佐剂活性。具体地讲,用圆圈表示出连接子应与佐剂附接的位置。在一些实施方案中,佐剂部分是咪唑喹啉化合物。可用的咪唑喹啉化合物的示例包括美国专利5,389,640、6,069,149和7,968,562(这些专利全文据此以引用方式并入)中描述的那些。在一些实施方案中,佐剂(“adj”)具有下式:其中每个j独立地为氢、or4或r4;每个r4独立地为氢或者包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;q任选地存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。在某些实施方案中,q存在。在某些实施方案中,佐剂(“adj”)具有下式:其中每个r4独立地选自氢或者包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。在一些实施方案中,佐剂(“adj”)具有下式:其中j为氢、or4或r4;每个r4独立地为氢或者包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;q选自包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、或杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。在某些实施方案中,佐剂(“adj”)具有下式:其中每个r4独立地选自氢或者包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。在一些实施方案中,佐剂(“adj”)具有下式:其中每个r4独立地为氢或者包含1-8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;q为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。在一些实施方案中,佐剂(“adj”)具有下式:其中每个j独立地为氢、or4或r4;每个r4独立地为氢或者包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;每个u独立地为ch或n,其中至少一个u为n;每个下标t独立地为1至3(即,1、2或3)的整数;q任选地存在并且为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。在某些实施方案中,q存在。在某些实施方案中,佐剂(“adj”)具有下式:其中r4选自氢或者包含1-8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基和杂芳烷基基团;q为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。在一些实施方案中,佐剂(“adj”)具有下式:其中j为氢、or4或r4;每个r4独立地为氢或者包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;r5为氢或者包含1至10(即,1、2、3、4、5、6、7、8、9或10)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;q为包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。在某些实施方案中,佐剂(“adj”)具有下式:其中j为氢、or4或r4;每个r4独立地选自氢或者包含1至8(即,1、2、3、4、5、6、7或8)个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;u为ch或n;v为ch2、o或nh;每个下标t独立地为1至3(即,1、2或3)的整数;并且虚线表示佐剂的附接点。在一些实施方案中,佐剂(“adj”)具有下式:其中r1选自h和c1-4烷基;r3选自c1-6烷基和2-至6-元杂烷基,它们各自任选地被一个或多个选自卤素、羟基、氨基、氧代基(=o)、烷基氨基、酰氨基、酰基、硝基、氰基和烷氧基的成员取代;x选自o和ch2;每个y独立地为chr2,其中r2选自h、oh和nh2;下标n为1至12(即,1、2、3、4、5、6、7、8、9、10、11或12)的整数;并且虚线表示佐剂的附接点。或者,r1和其所附接的氮原子可形成包含5-至8-元杂环的连接部分。在一些实施方案中,下标n为1至6(即,1、2、3、4、5或6)的整数。在某些实施方案中,下标n为1至3(即1、2或3)的整数。在一些实施方案中,佐剂(“adj”)具有下式:其中w选自o和ch2;r1选自h和c1-4烷基;每个y独立地为chr2,其中r2选自h、oh和nh2;下标n为1至12(即,1、2、3、4、5、6、7、8、9、10、11或12)的整数;并且虚线表示佐剂的附接点。或者,r1和其所附接的氮原子可形成包含5-至8-元杂环的连接部分。在一些实施方案中,下标n为1至6(即,1、2、3、4、5或6)的整数。在某些实施方案中,下标n为1至3(即1、2或3)的整数。在一些实施方案中,佐剂(“adj”)具有下式:其中w选自o和ch2;r1选自h和c1-4烷基;每个y独立地为chr2,其中r2选自h、oh和nh2;下标n为1至12(即,1、2、3、4、5、6、7、8、9、10、11或12)的整数;并且虚线表示佐剂的附接点。或者,r1和其所附接的氮原子可形成包含5-至8-元杂环的连接部分。在一些实施方案中,下标n为1至6(即,1、2、3、4、5或6)的整数。在某些实施方案中,下标n为1至3(即1、2或3)的整数。在一些实施方案中,佐剂(“adj”)具有下式:其中w选自o和ch2;x选自o和ch2;每个y独立地为chr2,其中r2选自h、oh和nh2;下标n为1至12(即,1、2、3、4、5、6、7、8、9、10、11或12)的整数;并且虚线表示佐剂的附接点。在一些实施方案中,下标n为1至6(即,1、2、3、4、5或6)的整数。在某些实施方案中,下标n为1至3(即1、2或3)的整数。在一些实施方案中,佐剂(“adj”)具有下式:其中r1选自h和c1-4烷基;r2选自h、oh和nh2;并且虚线表示佐剂的附接点。在一些实施方案中,佐剂(“adj”)具有下式:其中r1选自h和c1-4烷基;r2选自h、oh和nh2;并且虚线表示佐剂的附接点。在某些实施方案中,佐剂(“adj”)为:其中虚线表示佐剂的附接点。在一些实施方案中,佐剂不是荧光团。在一些实施方案中,佐剂不是放射性诊断化合物。在一些实施方案中,佐剂不是放射性治疗化合物。在一些实施方案中,佐剂不是微管蛋白抑制剂。在一些实施方案中,佐剂不是dna交联剂/烷化剂。在一些实施方案中,佐剂不是拓扑异构酶抑制剂。抗体免疫缀合物中的抗体可以是同种异体抗体。术语“同种异体抗体”或“同种抗体”是指并非来源于所讨论的个体(例如,具有肿瘤和寻求治疗的个体),但来源于相同物种或来源于不同物种,但是经工程改造为减少、减轻或避免识别为异种抗体(例如,非自身)的抗体。例如,“同种异体抗体”可以是人源化抗体。除非另外特别说明,否则本文所用的“抗体”和“同种异体抗体”是指免疫球蛋白g(igg)或免疫球蛋白a(iga)。如果人类个体的癌细胞与并非由同一个人产生的抗体接触(例如,抗体是由第二个人类个体产生的,抗体是由另一个物种诸如小鼠产生的,抗体是由另一个物种产生的人源化抗体等),则抗体被认为是同种异体的(相对于第一个体)。识别人类抗原(例如,癌症特异性抗原、癌细胞中和/或上富含的抗原等)的人源化小鼠单克隆抗体被认为是“同种抗体”(同种异体抗体)。在一些实施方案中,抗体是多克隆同种异体igg抗体。在一些实施方案中,抗体存在于具有多种结合特异性的多克隆igg抗体的混合物中。在一些情况下,混合物的抗体特异性结合不同的靶分子,而在一些情况下,混合物的抗体特异性结合相同靶分子的不同表位。因此,在一些情况下,抗体的混合物可包括一种以上本发明的免疫缀合物(例如,佐剂部分可与混合物(例如,多克隆igg抗体的混合物)的抗体共价结合,从而产生本发明的抗体-佐剂缀合物的混合物)。抗体的混合物可从2个或更多个个体(例如,3个或更多个个体、4个或更多个个体、5个或更多个个体、6个或更多个个体、7个或更多个个体、8个或更多个个体、9个或更多个个体、10个或更多个个体等)合并而来。在一些情况下,合并的血清用作同种异体抗体的来源,其中血清可来自任何数量的个体,没有一个个体是第一个个体(例如,血清可从2个或更多个个体、3个或更多个个体、4个或更多个个体、5个或更多个个体、6个或更多个个体、7个或更多个个体、8个或更多个个体、9个或更多个个体、10个或更多个个体等合并而来)。在一些情况下,在使用前从血清中分离或纯化抗体。可在从不同个体合并抗体之前或之后进行纯化。在免疫缀合物中的抗体包含来自血清的igg的一些情况下,一些(例如,大于0%但小于50%)、一半、大多数(大于50%但小于100%)或甚至所有抗体(即来自血清的igg)的靶抗原将是未知的。然而,混合物中至少一种抗体识别感兴趣的靶抗原的可能性很高,因为这种混合物含有多种对多种靶抗原特异的抗体。在一些实施方案中,抗体是多克隆同种异体iga抗体。在一些实施方案中,抗体存在于具有多种结合特异性的多克隆iga抗体的混合物中。在一些情况下,混合物的抗体特异性结合不同的靶分子,而在一些情况下,混合物的抗体特异性结合相同靶分子的不同表位。因此,在一些情况下,抗体的混合物可包括一种以上本发明的免疫缀合物(例如,佐剂部分可与混合物(例如,多克隆iga抗体的混合物)的抗体共价结合,从而产生本发明的抗体-佐剂缀合物的混合物)。抗体的混合物可从2个或更多个个体(例如,3个或更多个个体、4个或更多个个体、5个或更多个个体、6个或更多个个体、7个或更多个个体、8个或更多个个体、9个或更多个个体、10个或更多个个体等)合并而来。在一些情况下,合并的血清用作同种异体抗体的来源,其中血清可来自任何数量的个体,没有一个个体是第一个个体(例如,血清可从2个或更多个个体、3个或更多个个体、4个或更多个个体、5个或更多个个体、6个或更多个个体、7个或更多个个体、8个或更多个个体、9个或更多个个体、10个或更多个个体等合并而来)。在一些情况下,在使用前从血清中分离或纯化抗体。可在从不同个体合并抗体之前或之后进行纯化。在免疫缀合物中的抗体包含来自血清的iga的一些情况下,一些(例如,大于0%但小于50%)、一半、大多数(大于50%但小于100%)或甚至所有抗体(即来自血清的iga)的靶抗原将是未知的。然而,混合物中至少一种抗体识别感兴趣的靶抗原的可能性很高,因为这种混合物含有多种对多种靶抗原特异的抗体。在一些情况下,免疫缀合物中的抗体包括静脉内免疫球蛋白(ivig)和/或来自ivig(例如,从其富集、纯化,例如从其亲和纯化)的抗体。ivig是一种血液制品,其含有从许多(例如,有时超过1,000至60,000个)正常且健康献血者的血浆(例如,在一些情况下没有任何其他蛋白质)合并的igg(免疫球蛋白g)。ivig可商购获得。ivig含有高百分比的天然人单体ivig,并且具有低iga含量。在经静脉施用时,ivig可改善多种疾病病症。因此,美国食品和药物管理局(fda)已批准将ivig用于许多疾病,包括(1)川崎病;(2)免疫介导的血小板减少症;(3)原发性免疫缺陷;(4)造血干细胞移植(年龄超过20岁);(5)慢性b细胞淋巴细胞白血病;以及(6)小儿hiv1型感染。2004年,fda批准了cedars-sinaiivigprotocol用于肾移植受者,以便这些受者可以接受来自任何健康供体的活体供肾,而无论血型(abo不相容)或组织是否匹配。ivig的这些和其他方面在例如美国专利申请公布2010/0150942、2004/0101909、2013/0177574、2013/0108619和2013/0011388(这些专利全文据此以引用方式并入)中有所描述。在一些情况下,抗体是确定亚类(例如,igg1、igg2、igg3、igg4、iga1或iga2)的单克隆抗体。如果使用抗体组合,则抗体可来源于相同的亚类或来源于不同的亚类。例如,抗体可以是igg1抗体。本领域技术人员可获得不同相对比例的不同亚类的各种组合。在一些情况下,特定的亚类或不同亚类的特定组合在癌症治疗或减少肿瘤大小方面特别有效。因此,本发明的一些实施方案提供了其中抗体是单克隆抗体的免疫缀合物。在一些实施方案中,单克隆抗体是人源化的。在一些实施方案中,抗体与癌细胞的抗原结合。例如,抗体可与以至少10、100、1,000、10,000、100,000、1,000,000、2.5×106、5×106或1×107个拷贝或更多个拷贝存在于癌细胞的表面上的靶抗原结合。在一些实施方案中,抗体以比非癌细胞上的相应抗原更高的亲和力与癌细胞或免疫细胞上的抗原结合。例如,与在非癌细胞或非免疫细胞上识别相应的野生型抗原相比,抗体可优先识别含有在癌细胞或免疫细胞上发现的多态性的抗原。在一些情况下,抗体以比非癌细胞或非免疫细胞更高的亲合力与癌细胞或免疫细胞结合。例如,癌细胞或免疫细胞可表达更高密度的抗原,从而提供多价抗体与癌细胞或免疫细胞的更高亲和力结合。在一些情况下,抗体不显著结合非癌抗原(例如,抗体以比靶癌抗原低至少10、100、1,000、10,000、100,000或1,000,000倍的亲和力(更高的kd)与一种或多种非癌抗原结合)。在一些情况下,抗体所结合的靶癌抗原富集在癌细胞上。例如,靶癌抗原可以比相应的非癌细胞高至少2、5、10、100、1,000、10,000、100,000或1,000,000倍的水平存在于癌细胞的表面上。在一些情况下,相应的非癌细胞是相同组织或起源的并非过度增殖或其他癌性的细胞。一般来讲,特异性结合癌细胞的抗原(靶抗原)的受试igg抗体相对于其他可用抗原优先结合该特定抗原。然而,靶抗原不需要对癌细胞或甚至相对于其他细胞富含癌细胞特异(例如,靶抗原可由其他细胞表达)。因此,在短语“特异性结合癌细胞抗原的抗体”中,术语“特异性”是指抗体的特异性,而不是指该特定细胞类型中抗原的独特性。经修饰的fc区在一些实施方案中,免疫缀合物中的抗体含有经修饰的fc区,其中修饰过程修饰了fc区与一种或多种fc受体的结合。术语“fc受体”或“fcr”是指结合抗体fc区的受体。fc受体有三个主要类别:结合igg的fcγr、结合iga的fcαr和结合ige的fcεr。fcγr家族包括几个成员,诸如fcγi(cd64)、fcγriia(cd32a)、fcγriib(cd32b)、fcγriiia(cd16a)、fcγriiib(cd16b)。fcγ受体对igg的亲和力不同,并且对igg亚类(例如,igg1、igg2、igg3、igg4)的亲和力也不同。在一些实施方案中,与在fc区缺乏突变的天然抗体相比,免疫缀合物中的抗体(例如,经由连接子与tlr激动剂缀合的抗体,例如tlr7/8激动剂)在fc区含有一种或多种修饰(例如,氨基酸插入、缺失和/或取代),从而导致对一种或多种fc受体(例如fcγri(cd64)、fcγriia(cd32a)、fcγriib(cd32b)、fcγriiia(cd16a)和/或fcγriiib(cd16b))的结合进行调节(例如,增加结合或降低结合)。在一些实施方案中,免疫缀合物中的抗体在fc区中含有一个或多个修饰(例如,氨基酸插入、缺失和/或取代),从而降低了抗体fc区与fcγriib的结合。在一些实施方案中,与在fc区缺乏突变的天然抗体相比,免疫缀合物中的抗体在抗体的fc区中含有一个或多个修饰(例如,氨基酸插入、缺失和/或取代),从而降低了抗体与fcγriib的结合,同时保持与fcγri(cd64)、fcγriia(cd32a)和/或fcrγiiia(cd16a)的相同结合或增加了结合。在一些实施方案中,免疫缀合物中的抗体在fc区中含有一个或多个修饰,从而增加了抗体fc区与fcγriib的结合。在一些情况下,通过抗体fc区中相对于抗体的天然fc区的突变提供调节的结合。突变可在ch2结构域、ch3结构域或其组合中产生。“天然fc区”与“野生型fc区”同义,并且包含与天然存在的fc区的氨基酸序列相同或与在天然抗体中(例如,利妥昔单抗)所发现的fc区的氨基酸序列相同的氨基酸序列。天然序列人类fc区包括天然序列人类igg1fc区、天然序列人类igg2fc区、天然序列人类igg3fc区和天然序列人类igg4fc区以及其天然存在的变体。天然序列fc包括各种同种异型的fc(参见例如,jefferis等人,mabs,第1卷(第4期):第332-338页(2009年))。在一些实施方案中,fc区中导致与一种或多种fc受体的调节结合的突变可包括以下突变中的一种或多种:sd(s239d)、sdie(s239d/i332e)、se(s267e)、self(s267e/l328f)、sdie(s239d/i332e)、sdieal(s239d/i332e/a330l)、ga(g236a)、alie(a330l/i332e)、gasdalie(g236a/s239d/a330l/i332e)、v9(g237d/p238d/p271g/a330r)和v11(g237d/p238d/h268d/p271g/a330r)以及/或者在以下氨基酸处的一种或多种突变:e233、g237、p238、h268、p271、l328和a330。用于调节fc受体结合的额外fc区修饰在例如美国专利申请公布2016/0145350以及美国专利7,416,726和5,624,821中有所描述。在一些实施方案中,与天然未修饰的fc区相比,免疫缀合物的抗体的fc区被修饰为具有改变的fc区的糖基化模式。人免疫球蛋白在每条重链的cγ2结构域中的asn297残基处被糖基化。该n-连接的寡糖由核心七糖、n-乙酰葡糖胺4甘露糖3(glcnac4man3)组成。已知用内切糖苷酶或pngasef去除七糖会导致抗体fc区的构象变化,这可显著降低对激活fcγr的抗体结合亲和力并导致效应子功能降低。核心七糖通常用半乳糖、平分型glcnac、岩藻糖或唾液酸修饰,其差异地影响fc与活化和抑制性fcγr的结合。此外,已证明α2,6-唾液酸化增强体内抗炎活性,而去糖基化导致改善的fcγriiia结合和抗体依赖性细胞毒性和抗体依赖性吞噬作用增加10倍。因此,特定的糖基化模式可用于控制炎症效应子功能。在一些实施方案中,改变糖基化模式的修饰是突变。例如,在asn297处的置换。在一些实施方案中,asn297突变为谷氨酰胺(n297q)。用调节fcγr调节的信号传导的抗体控制免疫应答的方法在例如美国专利no.7,416,726以及us2007/0014795和us2008/0286819中有所描述。在一些实施方案中,免疫缀合物的抗体被修饰为含有具非天然存在的糖基化模式的工程化fab区。例如,可对杂交瘤进行基因工程改造以分泌非岩藻糖基化的mab、去唾液酸化的mab或去糖基化的fc,其具有能够增加fcrγiiia结合和效应子功能的特定突变。将免疫缀合物的抗体工程改造为非岩藻糖基化的(例如,非岩藻糖化的利妥昔单抗,可从invivogen,hcd20-mab13获得)。在一些实施方案中,免疫缀合物中抗体的完整fc区与不同fc区交换,使抗体的fab区与非天然fc区缀合。例如,利妥昔单抗的fab区(通常包含igg1fc区)可与igg2、igg3、igg4或iga缀合,或纳武单抗的fab区域(通常包含igg4fc区域)可与igg1、igg2、igg3、iga1或igg2缀合。在一些实施方案中,具有非天然fc结构域的fc修饰抗体还包含一个或多个氨基酸修饰,例如igg4fc内的s228p突变,其调节所述fc结构域的稳定性。在一些实施方案中,具非天然fc结构域的fc修饰抗体还包含一种或多种本文所述的调节fc与fcr结合的氨基酸修饰。在一些实施方案中,当与天然未修饰的抗体相比时,调节fc区与fcr的结合的修饰不改变抗体的fab区与其抗原的结合。在其他实施方案中,当与天然未修饰的抗体相比时,调节fc区与fcr的结合的修饰还增加抗体的fab区与其抗原的结合。抗体靶标在一些实施方案中,抗体能够结合一种或多种靶标,其选自(例如,特异性结合靶标,选自)5t4、abl、abcf1、acvr1、acvr1b、acvr2、acvr2b、acvrl1、adora2a、aggrecan、agr2、aicda、aif1、aigi、akap1、akap2、amh、amhr2、angpt1、angpt2、angptl3、angptl4、anpep、apc、apocl、ar,aromatase、atx、ax1、azgp1(zinc-a-糖蛋白)、b7.1、b7.2、b7-h1、bad、baff、bag1、bai1、bcr、bcl2、bcl6、bdnf、blnk、blr1(mdr15)、biys、bmp1、bmp2、bmp3b(gdfio)、bmp4、bmp6、bmp8、bmpr1a、bmpr1b、bmpr2、bpag1(网蛋白)、brca1、c19orflo(il27w)、c3、c4a、c5、c5r1、cant1、caprin-1、casp1、casp4、cav1、ccbp2(d6/jab61)、ccl1(1-309)、ccli1(嗜酸细胞活化趋化因子)、ccl13(mcp-4)、ccl15(mip-id)、ccl16(hcc-4)、ccl17(tarc)、ccl18(parc)、ccl19(mip-3b)、ccl2(mcp-1)、mcaf、ccl20(mip-3a)、ccl21(mep-2)、slc、exodus-2、ccl22(mdc/stc-i)、ccl23(mpif-i)、ccl24(mpif-2/嗜酸细胞活化趋化因子-2)、ccl25(teck)、ccl26(嗜酸细胞活化趋化因子-3)、ccl27(ctack/ilc)、ccl28、ccl3(mip-ia)、ccl4(mipib)、ccl5(rantes)、ccl7(mcp-3)、ccl8(mcp-2)、ccna1、ccna2、ccnd1、ccne1、ccne2、ccr1(ckr1/hm145)、ccr2(mcp-irb/ra)、ccr3(ckr3/cmkbr3)、ccr4、ccr5(cmkbr5/chemr13)、ccr6(cmkbr6/ckr-l3/strl22/dry6)、ccr7(ckr7/ebi1)、ccr8(cmkbr8/teri/ckr-l1)、ccr9(gpr-9-6)、ccrl1(vshk1)、ccrl2(l-ccr)、cd164、cd19、cdic、cd2、cd20、cd21、cd200、cd-22、cd24、cd27、cd28、cd3、cd33、cd35、cd37、cd38、cd3e、cd3g、cd3z、cd4、cd38、cd40、cd40l、cd44、cd45rb、cd47、cd52、cd69、cd72、cd74、cd79a、cd79b、cd8、cd80、cd81、cd83、cd86、cd137、cd152、cd274、cdh1(e-钙粘附素)、cdh1o、cdh12、cdh13、cdh18、cdh19、cdh2o、cdh5、cdh7、cdh8、cdh9、cdk2、cdk3、cdk4、cdk5、cdk6、cdk7、cdk9、cdkn1a(p21wap1/cip1)、cdkn1b(p27kip1)、cdkn1c、cdkn2a(p16ink4a)、cdkn2b、cdkn2c、cdkn3、cebpb、ceri、chga、chgb、chitinase、chst1o、cklfsf2、cklfsf3、cklfsf4、cklfsf5、cklfsf6、cklfsf7、cklfsf8、cldn3、cldn7(封闭蛋白-7)、cln3、clu(凝聚素)、cmklr1、cmkor1(rdc1)、cnr1、col18a1、colia1、col4a3、col6a1、cr2、cripto、crp、csf1(m-csf)、csf2(gm-csf)、csf3(gcsf)、ctl8、ctnnb1(b-连环蛋白)、ctsb(组织蛋白酶b)、cx3cl1(scyd1)、cx3cr1(v28)、cxcl1(gro1)、cxcl1o(ip-io)、cxcli1(1-tac/ip-9)、cxcl12(sdf1)、cxcl13、cxcl14、cxcl16、cxcl2(gro2)、cxcl3(gro3)、cxcl5(ena-78/lix)、cxcl6(gcp-2)、cxcl9(mig)、cxcr3(gpr9/ckr-l2)、cxcr4、cxcr6(tymstr/strl33/bonzo)、cyb5、cyc1、cysltr1、dab2ip、des、dkfzp451j0118、dncl1、dpp4、e2f1、engel、edge、fennel、efna3、efnb2、egf、egfr、elac2、eng、enola、eno2、eno3、epha1、epha2、epha3、epha4、epha5、epha6、epha7、epha8、epha9、epha10、ephb1、ephb2、ephb3、ephb4、ephb5、ephb6、ephrin-a1、ephrin-a2、ephrina3、ephrin-a4、ephrin-a5、ephrin-a6、ephrin-b1、ephrin-b2、ephrin-b3、ephb4、epg、erbb2(her-2)、ereg、erk8、雌激素受体、earl、esr2、f3(tf)、fadd、法尼基转移酶、fasl、fasnf、fcer1a、fcer2、fcgr3a、fgf、fgf1(afgf)、fgf10、fgf11、fgf12、fgf12b、fgf13、fgf14、fgf16、fgf17、fgf18、fgf19、fgf2(bfgf)、fgf20、fgf21、fgf22、fgf23、fgf3(int-2)、fgf4(hst)、fgf5、fgf6(hst-2)、fgf7(kgf)、fgf8、fgf9、fgfr3、figf(vegfd)、fil1(epsilon)、fbl1(zeta)、flj12584、flj25530、flrt1(纤维连接蛋白)、flt1、flt-3、fos、fosl1(fra-1)、fy(darc)、gabrp(gabaa)、gageb1、gagec1、galnac4s-6st、gata3、gd2、gdf5、gfi1、ggt1、gm-csf、gnas1、gnrh1、gpr2(ccr10)、gpr31、gpr44、gpr81(fksg80)、grcc1o(c1o)、grp、gsn(凝溶胶蛋白)、gstp1、havcr2、hdac、hdac4、hdac5、hdac7a、hdac9、hedgehog、hgf、hif1a、hip1、组胺和组胺受体、hla-a、hla-dra、hla-e、hm74、hmoxi、hsp90、humcyt2a、iceberg、icosl、id2、ifn-a、ifna1、ifna2、ifna4、ifna5、efna6、bfna7、ifnb1、ifngamma、ifnw1、igbp1、igf1、igfir、igf2、igfbp2、igfbp3、igfbp6、dl-1、ilio、iliora、iliorb、il-1、il1r1(cd121a)、il1r2(cd121b)、il-ira、il-2、il2ra(cd25)、il2rb(cd122)、il2rg(cd132)、il-4、il-4r(cd123)、il-5、il5ra(cd125)、il3rb(cd131)、il-6、il6ra、(cd126)、ir6rb(cd130)、il-7、il7ra(cd127)、il-8、cxcr1(il8ra)、cxcr2、(il8rb/cd128)、il-9、il9r(cd129)、il-10、il10ra(cd210)、il10rb(cdw210b)、il-11、il11ra、il-12、il-12a、il-12b、il-12rb1、il-12rb2、il-13、il13ra1、il13ra2、il14、il15、il15ra、il16、il17、il17a、il17b、il17c、il17r、il18、il18bp、il18r1、il18rap、il19、ilia、ilib、ilif10、ilif5、il1f6、ilif7、il1f8、dl1f9、ilihyi、ilir1、il1r2、ilirap、ilirapli、ilirapl2、ilirl1、il1rl2、ilirn、il2、il20、il20ra、il21r、il22、il22r、il22ra2、il23、dl24、il25、il26、il27、il28a、il28b、il29、il2ra、il2rb、il2rg、il3、il30、il3ra、il4、1l4、il6st(糖蛋白130)、ilk、inha、inhba、insl3、insl4、irak1、irak2、itga1、itga2、itga3、itga6(α6整合素)、itgav、itgb3、itgb4(β4整合素)、jag1、jak1、jak3、jtb、jun、k6hf、kai1、kdr、kitlg、klf5(gcboxbp)、klf6、klk10、klk12、klk13、klk14、klk15、klk3、klk4、klk5、klk6、klk9、krt1、krt19(角蛋白19)、krt2a、krthb6(hair-specifictypeii角蛋白)、lama5、lep(瘦素)、lingo-p75、lingo-troy、lps、lta(tnf-b)、ltb、ltb4r(gpr16)、ltb4r2、ltbr、macmarcks、mag或omgp、map2k7(c-jun)、mcp-1、mdk、mib1、中期因子、mif、misrii、mjp-2、mk、mki67(ki-67)、mmp2、mmp9、ms4a1、msmb、mt3(金属硫蛋白-ui)、mtor、mtss1、muc1(粘蛋白)、myc、myd88、nck2、神经聚糖、nfkbi、nfkb2、ngfb(ngf)、ngfr、ngr-lingo、ngrnogo66、(nogo)、ngr-p75、ngr-troy、nmei(nm23a)、notch、notch1、nox5、nppb、nrob1、nrob2、nrid1、nr1d2、nr1h2、nr1h3、nr1h4、nr112、nr113、nr2c1、nr2c2、nr2e1、nr2e3、nr2f1、nr2f2、nr2f6、nr3c1、nr3c2、nr4a1、nr4a2、nr4a3、nr5a1、nr5a2、nr6a1、nrp1、nrp2、nt5e、ntn4、odzi、oprdi、p2rx7、pap、part1、pate、pawr、pca3、pcdgf、pcna、pdgfa、pdgfb、pdgfra、pdgfrb、pecami、天冬酰胺酶、pf4(cxcl4)、pgf、pgr、phosphacan、pias2、pi3kinase、pik3cg、plau(upa)、plg、plxdci、pkc、pkc-beta、ppbp(cxcl7)、ppid、pr1、prkcq、prkd1、prl、proc、prok2、psap、psca、ptafr、pten、ptgs2(cox-2)、ptn、rac2(p21rac2)、rank、rank配体、rarb、rgs1、rgs13、rgs3、rnfi1o(znf144)、ron、robo2、rxr、s100a2、scgb1d2(亲脂素b)、scgb2a1(乳腺珠蛋白2)、scgb2a2(乳腺珠蛋白1)、scye1(内皮单核细胞激活细胞因子)、sdf2、serpena1、serpina3、serpinb5(乳腺丝抑蛋白)、serpinei(pai-i)、serpinfi、ship-1、ship-2、shb1、shb2、shbg、sfcaz、slc2a2、slc33a1、slc43a1、slit2、spp1、sprr1b(spr1)、st6gal1、stab1、state、steap、steap2tb4r2、tbx21、tcp1o、tdgf1、tek、tgfa、tgfb1、tgfb1i1、tgfb2、tgfb3、tgfbi、tgfbr1、tgfbr2、tgfbr3、thil、thbs1(血小板反应蛋白-1)、thbs2、thbs4、thpo、tie(tie-1)、timp3、tissuefactor、tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、tlr11、tnf、tnf-a、tnfaip2(b94)、tnfaip3、tnfrsfi1a、tnfrsf1a、tnfrsf1b、tnfrsf21、tnfrsf5、tnfrsf6(fas)、tnfrsf7、tnfrsf8、tnfrsf9、tnfsf1o(trail)、tnfsf11(trance)、tnfsf12(apo3l)、tnfsf13(april)、tnfsf13b、tnfsf14(hvem-l)、tnfrsf14(hvem)、tnfsf15(vegi)、tnfsf18、tnfsf4(ox40配体)、tnfsf5(cd40配体)、tnfsf6(fasl)、tnfsf7(cd27配体)、tnfsf8(cd30配体)、tnfsf9(4-1bb配体)、tollip、toll样受体、top2a(拓扑异构酶iia)、tp53、tpm1、tpm2、tradd、traf1、traf2、traf3、traf4、traf5、traf6、trka、trem1、trem2、trpc6、tslp、tweak、酪氨酸酶、upar、vegf、vegfb、vegfc、多功能蛋白聚糖、vhlc5、vla-4、wnt-1、xcl1(淋巴细胞趋化因子)、xcl2(scm-ib)、xcri(gpr5/ccxcr1)、yy1、zfpm2、clec4c(bdca-2、dlec、cd303、clecsf7)、clec4d(mcl、clecsf8)、clec4e(c型凝集素)、clec6a(dectin-2)、clec5a(mdl-1、clecsf5)、clec1b(clec-2)、clec9a(dngr-1)、clec7a(dectin-1)、pdgfra、slamf7、gp6(gpvi)、lilra1(cd85i)、lilra2(cd85h、ilt1)、lilra4(cd85g、ilt7)、lilra5(cd85f、ilt11)、lilra6(cd85b、ilt8)、ncr1(cd335、ly94、nkp46)、ncr3(cd335、ly94、nkp46)、ncr3(cd337、nkp30)、oscar、tarm1、cd300c、cd300e、cd300lb(cd300b)、cd300ld(cd300d)、kir2dl4(cd158d)、kir2ds、klrc2(cd159c、nkg2c)、klrk1(cd314、nkg2d)、ncr2(cd336、nkp44)、pilrb、siglec1(cd169、sn)、siglec14、siglec15(cd33l3)、siglec16、sirpb1(cd172b)、trem1(cd354)、trem2、和klrf1(nkp80)。在一些实施方案中,抗体结合fcrγ偶联受体。在一些实施方案中,fcrγ偶联受体选自gp6(gpvi)、lilra1(cd85i)、lilra2(cd85h、ilt1)、lilra4(cd85g、ilt7)、lilra5(cd85f、ilt11)、lilra6(cd85b、ilt8)、ncr1(cd335、ly94、nkp46)、ncr3(cd335、ly94、nkp46)、ncr3(cd337、nkp30)、oscar和tarm1。在一些实施方案中,抗体结合dap12偶联的受体。在一些实施方案中,dap12偶联受体选自cd300c、cd300e、cd300lb(cd300b)、cd300ld(cd300d)、kir2dl4(cd158d)、kir2ds、klrc2(cd159c、nkg2c)、klrk1(cd314、nkg2d)、ncr2(cd336、nkp44)、pilrb、siglec1(cd169、sn)、siglec14、siglec15(cd33l3)、siglec16、sirpb1(cd172b)、trem1(cd354)和trem2。在一些实施方案中,抗体结合携带hemitam的受体。在一些实施方案中,携带hemitam的受体是klrf1(nkp80)。在一些实施方案中,抗体能结合选自以下的一种或多种靶标:clec4c(bdca-2、dlec、cd303、clecsf7)、clec4d(mcl、clecsf8)、clec4e(mincle)、clec6a(dectin-2)、clec5a(mdl-1、clecsf5)、clec1b(clec-2)、clec9a(dngr-1)和clec7a(dectin-1)。在一些实施方案中,抗体能够结合clec6a(dectin-2)或clec5a。在一些实施方案中,抗体能够结合clec6a(dectin-2)。在一些实施方案中,抗体能够结合选自以下各项的一种或多种靶标(例如,特异性结合选自以下各项的靶标):atp5i(q06185)、oat(p29758)、aifm1(q9z0x1)、aofa(q64133)、mtdc(p18155)、cmc1(q8bh59)、prep(q8k411)、ymel1(o88967)、lpprc(q6pb66)、lonm(q8cgk3)、acon(q99ki0)、odo1(q60597)、idhp(p54071)、aldh2(p47738)、atpb(p56480)、aatm(p05202)、tmm93(q9cqw0)、ergi3(q9cqe7)、rtn4(q99p72)、cl041(q8bqr4)、erln2(q8bfz9)、tera(q01853)、dad1(p61804)、calx(p35564)、calu(o35887)、vapa(q9wv55)、mogs(q80um7)、ganab(q8bhn3)、ero1a(q8r180)、uggg1(q6p5e4)、p4ha1(q60715)、hyep(q9d379)、calr(p14211)、at2a2(o55143)、pdia4(p08003)、pdia1(p09103)、pdia3(p27773)、pdia6(q922r8)、clh(q68fd5)、ppib(p24369)、tcpg(p80318)、mot4(p57787)、nica(p57716)、basi(p18572)、vapa(q9wv55)、env2(p11370)、vat1(q62465)、4f2(p10852)、enoa(p17182)、ilk(o55222)、gpnmb(q99p91)、env1(p10404)、ero1a(q8r180)、clh(q68fd5)、dsg1a(q61495)、at1a1(q8vdn2)、hyou1(q9jkr6)、trap1(q9cqn1)、grp75(p38647)、enpl(p08113)、ch60(p63038)和ch10(q64433)。在上面的列表中,登录号显示在括号中。在一些实施方案中,抗体结合选自以下各项的抗原:cdh1、cd19、cd20、cd29、cd30、cd38、cd40、cd47、epcam、muc1、muc16、egfr、her2、slamf7和gp75。在一些实施方案中,抗原选自cd19、cd20、cd47、epcam、muc1、muc16、egfr和her2。在一些实施方案中,抗体结合选自tn抗原和thomsen-friedenreich抗原的抗原。在一些实施方案中,抗体或fc融合蛋白选自:阿巴伏单抗、阿巴西普(又名orenciatm)、阿昔单抗(又名reoprotm、c7e3fab)、阿达木单抗(又名humiratm)、阿德木单抗、阿伦单抗(又名campathtm、mabcampath或campath-1h)、阿妥莫单抗、阿非莫单抗、anatumomabmafenatox、anetumumab、anrukizumab、阿泊珠单抗、阿西莫单抗、阿塞珠单抗、atlizumab、阿托木单抗、bapineuzumab、巴利昔单抗(又名simulecttm)、巴维昔单抗、贝妥莫单抗(又名lymphoscantm)、贝利木单抗(又名lympho-stat-btm)、柏替木单抗、贝索单抗、贝伐珠单抗(又名avastintm)、比西单抗brallobarbital、比伐珠单抗mertansine、campath、康纳单抗(又名acz885)、莫坎妥珠单抗mertansine、卡罗单抗(又名prostascinttm)、卡妥索单抗(又名removabtm)、西利珠单抗(又名cimziatm)、赛妥珠单抗pegol、西妥昔单抗(又名erbituxtm)、克立昔单抗、dacetuzumab、达昔单抗、达利珠单抗(又名zenapaxtm)、德尼单抗(又名amg162)、地莫单抗、阿托度单抗aritox、dorlixizumab、duntumumab、durimulumab、durmulumab、ecromeximab、依库丽单抗(又名soliristm)、埃巴单抗、依决洛单抗(又名mab17-1a、panorextm)、依法利珠单抗(又名raptivatm)、依芬古单抗(又名mycograbtm)、伊斯利莫、恩莫单抗pegol、伊匹莫单抗cituxetan、依法利珠单抗、伊匹莫单抗、依帕珠单抗、erlizumab、厄妥索单抗(又名rexomuntm)、依那西普(又名enbreltm)、伊瑞西珠(又名etaratuzumab、vitaxintm、abegrintm)、艾韦单抗、fanolesomab(又名neutrospectm)、法拉莫单抗、非维珠单抗、芳妥珠单抗(又名huzaftm)、galiximab、gantenerumab、gavilimomab(又名abxcbltm)、吉妥珠单抗ozogamicin(又名mylotargtm)、戈利木单抗(又名cnto148)、gomiliximab、ibalizumab(又名tnx-355)、替伊莫单抗tiuxetan(又名zevalintm)、伊戈伏单抗、英西单抗、英利昔单抗(又名remicadetm)、伊诺莫单抗、奥英妥珠单抗ozogamicin、伊匹单抗(又名mdx-010、mdx-101)、iratumumab、凯利昔单抗、拉贝珠单抗、来马索单抗、lebrilizumab、乐地单抗、来沙木单抗(又名、hgs-etr2、etr2-st01)、lexitumumab、利韦单抗、林妥珠单抗、lucatumumab、鲁昔单抗、马帕木单抗(又名hgsetr1、trm-1)、马司莫单抗、马妥珠单抗(又名emd72000)、美泊利单抗(又名bosatriatm)、metelimumab、milatuzumab、明瑞莫单抗、米妥莫单抗、莫罗木单抗、莫维珠单抗(又名numaxtm)、muromonab(又名okt3)、nacolomabtafenatox、naptumomabestafenatox、那他珠单抗(又名tysabritm、antegrentm)、奈巴库单抗、奈瑞莫单抗、尼妥珠单抗(又名theracimhr3tm、thera-cim-hr3tm、theraloctm)、若莫单抗merpentan(又名verlumatm)、ocrelizumab、奥度莫单抗、奥法木单抗、奥马珠单抗(又名xolairtm)、奥戈伏单抗(又名ovarextm)、otelixizumab、帕吉昔单抗、帕利珠单抗(又名synagistm)、帕尼单抗(又名abx-egf、vectibixtm)、pascolizumab、喷突莫单抗(又名theragyntm)、帕妥珠单抗(又名2c4、omnitargtm)、培克珠单抗、喷妥莫单抗、普立昔单抗、普托木单抗、兰尼单抗(又名lucentistm)、瑞西巴库、瑞加韦单抗、瑞利珠单抗、利妥昔单抗(又名rituxantm、mabtheratm)、罗维珠单抗、鲁利单抗、沙妥莫单抗、司韦单抗、西罗珠单抗、siplizumab(又名medi-507)、索土珠单抗、司他莫鲁(又名myo-029)、硫索单抗(又名leukoscantm)、tacatuzumabtetraxetan、他度珠单抗、他利珠单抗、帕他普莫单抗paptox、tefibazumab(又名aurexistm)、阿替莫单抗aritox、替奈昔单抗、teplizumab、ticilimumab、托珠单抗(又名actemratm)、toralizumab、托西莫单抗、曲妥珠单抗(又名herceptintm)、曲美母单抗(又名cp-675、206)、tucotuzumabcelmoleukin、妥韦单抗、乌珠单抗、优特克单抗(又名cnto1275)、伐利昔单抗、维妥珠单抗、维帕莫单抗、维西珠单抗(又名nuviontm)、伏洛昔单抗(又名m200)、伏妥莫单抗(又名humaspecttm)、扎鲁木单抗、zanolimumab(又名humax-cd4)、齐拉木单抗、阿佐莫单抗aritox、达雷木单抗、埃罗妥珠单抗、obintunzumab、奥拉单抗、本妥昔单抗vedotin、afibercept、阿巴西普、贝拉西普、阿柏西普、依那西普、罗米司亭、sbt-040(序列在us2017/0158772中列出)。在一些实施方案中,抗体为利妥昔单抗。检查点抑制剂设想了任何合适的免疫检查点抑制剂与本文公开的免疫缀合物一起使用。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白的表达或活性。在另一个实施方案中,免疫检查点抑制剂减少一种或多种免疫检查点蛋白质与其配体之间的相互作用。降低免疫检查点分子的表达和/或活性的抑制性核酸也可用于本文公开的方法中。本文的数据显示,通常为igg4的免疫检查点抑制剂纳武单抗可被修饰为包含igg1fc,并随后转化为本发明的免疫缀合物。数据表明纳武单抗igg1免疫缀合物仍然非常有效。类似地,当临床级阿特珠单抗上的igg1nqfc被igg1替换时,结果得到改善。(参见图97a-97h)大多数检查点抗体被设计为不具有效应功能,因为它们不是试图杀死细胞,而是阻止信号传导。本发明的免疫偶联物可增加激活骨髓免疫所需的“效应子功能”。因此,对于大多数检查点抗体抑制剂而言,这一发现至关重要。在一些实施方案中,免疫检查点抑制剂是细胞毒性t淋巴细胞抗原4(ctla4,又名cd152)、具有ig和itim结构域的t细胞免疫受体(tigit)、糖皮质激素诱导的tnfr相关蛋白(gitr,又名tnfrsf18)、诱导型t细胞共刺激(icos,也被称为cd278)、cd96、脊髓灰质炎病毒相关受体2(pvrl2,又名cd112r)、程序性细胞死亡蛋白1(pd-1,又名cd279)、程序性细胞死亡1配体1(pd-l1,又名如b7-h3和cd274)、程序性细胞死亡配体2(pd-l2,又名b7-dc和cd273)、淋巴细胞活化基因-3(lag-3,又名cd223)、b7-h4、杀伤免疫球蛋白受体(kir)、肿瘤坏死因子受体超家族成员4(tnfrsf4,又名ox40和cd134)及其配体ox40l(cd252)、吲哚胺2,3-双加氧酶1(ido-1)、吲哚胺2,3-双加氧酶2(ido-2)、癌胚抗原相关细胞粘附分子1(ceacam1)、b和t淋巴细胞衰减剂(btla,又名cd272)、t细胞膜蛋白3(tim3)、腺嘌呤osinea2a受体(a2ar)和t细胞活化的v结构域ig抑制剂(vista蛋白)。在一些实施方案中,免疫检查点抑制剂是ctla4、pd-1或pd-l1的抑制剂。在一些实施方案中,抗体选自:伊匹单抗(也称为)、派姆单抗(也称为)、纳武单抗(也称为)、阿特珠单抗(也称为)、avelumab(也称为)和度伐单抗(也称为imfinzitm)。在一些实施方案中,抗体选自:伊匹单抗(也称为)、派姆单抗(也称为)、纳武单抗(也称为)和阿特珠单抗(也称为)。在一些实施方案中,免疫检查点抑制剂是ctla4的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗ctla4的抗体。在一些实施方案中,免疫检查点抑制剂是抗ctla4的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗ctla4的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如ctla4的表达或活性。在一些实施方案中,免疫检查点抑制剂是pd-1的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗pd-1的抗体。在一些实施方案中,免疫检查点抑制剂是抗pd-1的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗pd-1的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如pd-1的表达或活性。在一些实施方案中,免疫检查点抑制剂是pd-l1的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗pd-l1的抗体。在一些实施方案中,免疫检查点抑制剂是抗pd-l1的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗pd-l1的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如pd-l1的表达或活性。在一些实施方案中,免疫检查点抑制剂减少pd-1和pd-l1之间的相互作用。在一些实施方案中,免疫检查点抑制剂是pd-l2的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗pd-l2的抗体。在一些实施方案中,免疫检查点抑制剂是抗pd-l2的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗pd-l2的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如pd-l2的表达或活性。在一些实施方案中,免疫检查点抑制剂减少pd-1和pd-l2之间的相互作用。在一些实施方案中,免疫检查点抑制剂是lag-3的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗lag-3的抗体。在一些实施方案中,免疫检查点抑制剂是抗lag-3的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗lag-3的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如lag-3的表达或活性。在一些实施方案中,免疫检查点抑制剂是b7-h4的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗b7-h4的抗体。在一些实施方案中,免疫检查点抑制剂是抗b7-h4的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗b7-h4的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如b7-h4的表达或活性。在一些实施方案中,免疫检查点抑制剂是kir的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗kir的抗体。在一些实施方案中,免疫检查点抑制剂是抗kir的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗kir的人或人源抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如kir的表达或活性。在一些实施方案中,免疫检查点抑制剂是tnfrsf4的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗tnfrsf4的抗体。在一些实施方案中,免疫检查点抑制剂是抗tnfrsf4的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗tnfrsf4的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如tnfrsf4的表达或活性。在一些实施方案中,免疫检查点抑制剂是ox40l的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗ox40l的抗体。在一些实施方案中,免疫检查点抑制剂是抗ox40l的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗ox40l的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如ox40l的表达或活性。在一些实施方案中,免疫检查点抑制剂减少tnfrsf4和ox40l之间的相互作用。在一些实施方案中,免疫检查点抑制剂是ido-1的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗ido-1的抗体。在一些实施方案中,免疫检查点抑制剂是抗ido-1的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗ido-1的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如ido-1的表达或活性。在一些实施方案中,免疫检查点抑制剂是ido-2的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗ido-2的抗体。在一些实施方案中,免疫检查点抑制剂是抗ido-2的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗ido-2的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如ido-2的表达或活性。在一些实施方案中,免疫检查点抑制剂是ceacam1的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗ceacam1的抗体。在一些实施方案中,免疫检查点抑制剂是抗ceacam1的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗ceacam1的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如ceacam1的表达或活性。在一些实施方案中,免疫检查点抑制剂是btla的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗btla的抗体。在一些实施方案中,免疫检查点抑制剂是抗btla的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗btla的人或人源抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如btla的表达或活性。在一些实施方案中,免疫检查点抑制剂是tim3的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗tim3的抗体。在一些实施方案中,免疫检查点抑制剂是抗tim3的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗tim3的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如tim3的表达或活性。在一些实施方案中,免疫检查点抑制剂是a2ar的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗a2ar的抗体。在一些实施方案中,免疫检查点抑制剂是抗a2ar的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗a2ar的人或人源化抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如a2ar的表达或活性。在一些实施方案中,免疫检查点抑制剂是vista的抑制剂。在一些实施方案中,免疫检查点抑制剂是抗vista蛋白的抗体。在一些实施方案中,免疫检查点抑制剂是抗vista蛋白的单克隆抗体。在一些实施方案中,免疫检查点抑制剂是抗vista蛋白的人或人源抗体。在一些实施方案中,免疫检查点抑制剂降低一种或多种免疫检查点蛋白诸如vista蛋白的表达或活性。生物仿制药本发明的免疫缀合物对于与市售或“原创药”抗体构建体高度相似或生物相似的抗体构建体也是有效的。例如,西妥昔单抗、利妥昔单抗和曲妥珠单抗的生物仿制抗体用于本发明的几种成功的免疫缀合物中,如图71a-71aq所示。生物仿制免疫缀合物与市售抗体一样有效地引发骨髓活化。从这些研究中,预期生物仿制药免疫缀合物的表现与原创药产品的免疫缀合物相似。dar比率本发明的免疫缀合物提供了令人满意的dar比率。如图84a-87c所示,本发明的免疫缀合物提供了0.7、1.6和2.5的dar比率。显示具有不同dar比率的免疫缀合物均有效激活骨髓细胞并引发细胞因子分泌。数据表明,与用单独的抗体刺激相比,具有不同dar比率的免疫缀合物在引发apc活化方面都是优越的,因为用免疫缀合物刺激的apc中cd40、cd86和hla-dr以更高水平表达。与单独的抗体相比,具有不同dar的免疫缀合物始终诱导cd14和cd16的下调并增加cd123的表达。从这些研究中,预期所有dar比率均将有效引发骨髓细胞活化。同型修饰本文的数据显示(参见图88c-88h),对于所需的应用,当抗体(如利妥昔单抗)的igg1fc区与igg1af、igg1nq、igg2、igg3、igg4或iga2交换,之后形成本发明的免疫缀合物时,免疫缀合物的活性可调节并经常改善。大约30%的人类igg在fab区内被糖基化,并且本发明的免疫缀合物中的抗体可含有具非天然存在的糖基化模式的工程化fab区。例如,可对杂交瘤进行基因工程改造以分泌非岩藻糖基化的mab、去唾液酸化的mab或去糖基化的fc,其具有能够增加fcrγiiia结合和效应子功能的特定突变。用于形成免疫缀合物的抗体可含有工程化的(即,非天然存在的)半胱氨酸残基,其特征在于改变(例如,增强的)对用于将佐剂部分与抗体共价结合的试剂的反应性。在某些实施方案中,工程化的半胱氨酸残基的硫醇反应性值在0.6至1.0的范围内。在许多情况下,工程化抗体比亲本抗体更具反应性。通常,工程化残基是“游离”的半胱氨酸残基,其不是二硫键的一部分。术语“硫醇反应性值”是游离半胱氨酸氨基酸的反应性的定量表征。如本文所用,术语“硫醇反应性值”是指工程化抗体中游离半胱氨酸与硫醇反应性试剂反应,并转化为最大值为1的百分比。例如,工程化抗体中的半胱氨酸残基与硫醇反应性试剂(例如马来酰亚胺)以100%的产率反应以形成修饰的抗体,其硫醇反应性值为1.0。工程化为相同或不同亲本抗体的另一半胱氨酸残基与硫醇反应性试剂以80%的产率反应,硫醇反应性值为0.8。可通过elisa试验、质谱、液相色谱、放射自显影或其他定量分析测试来确定特定半胱氨酸残基的硫醇反应性值。工程化的半胱氨酸残基可位于抗体重链或抗体轻链中。在某些实施方案中,工程化的半胱氨酸残基位于重链的fc区。例如,抗体轻链中l-15、l-43、l-110、l-144、l-168或抗体重链中h-40、h-88、h-119、h-121、h-122、h-175和h-179位置的氨基酸残基可以被半胱氨酸残基取代。在这些位置每侧约5个氨基酸残基内的范围也可用半胱氨酸残基取代,即l-10至l-20;l-38至l-48;l-105至l-115;l-139至l-149;l-163至l-173;h-35至h-45;h-83至h-93;h-114至h-127;和h-170至h-184,以及选自h-268至h-291;h-319至h-344;h-370至h-380;和h-395至h-405的fc区的范围,以提供可用的半胱氨酸改造的抗体,用于形成免疫缀合物。其他工程化抗体在例如美国专利7,855,275、8309300和9,000,130(这些专利据此以引用方式并入)中有所描述。除抗体外,替代蛋白质支架可用作免疫缀合物的一部分。术语“替代蛋白质支架”是指非免疫球蛋白衍生的蛋白质或肽。这些蛋白质和肽通常易于工程化,并可设计成赋予针对给定抗原、双特异性或多特异性的单特异性。可使用几种方法进行替代蛋白质支架的工程化。可使用环移植方法,其中将已知特异性的序列移植到支架的可变环上。序列随机化和诱变可用于开发突变体文库,其可使用各种展示平台(例如噬菌体展示)筛选以鉴定新型粘合剂。特定位点的诱变也可用作类似方法的一部分。替代蛋白质支架以各种尺寸存在,范围从具有最小二级结构的小肽到具有相似大小的大蛋白质到全尺寸抗体。支架的示例包括但不限于胱氨酸扭结小蛋白(又名knottins)、环状胱氨酸扭结小蛋白(又名环状蛋白)、avimers、affibodies、第十人纤连蛋白iii型结构域、darpins(设计的锚蛋白重复序列)和anticalins(也称为脂质运载蛋白)。也可改造具有已知特异性的天然存在的配体以赋予给定靶标的新特异性。可改造的天然存在的配体的示例包括egf配体和vegf配体。工程化蛋白质可作为单体蛋白质或多聚体产生,这取决于所需的结合策略和特异性。蛋白质工程策略可用于将替代蛋白质支架融合至fc结构域。抗体佐剂缀合物的制备用于形成本发明免疫缀合物的反应在足以将佐剂部分与抗体共价结合的条件下进行。通常,通过使抗体与佐剂-连接子化合物接触,使抗体中的氨基酸侧链与佐剂连接子化合物反应来进行反应。在一些实施方案中,当形成免疫缀合物时使用大约等摩尔量的佐剂-连接子化合物和抗体。在一些实施方案中,当形成免疫缀合物时使用过量的佐剂-连接子化合物。例如,用于形成免疫缀合物的反应混合物可含有相对于抗体约1.1至约50摩尔当量的佐剂-连接子化合物。反应可在任何合适的温度下进行。通常,反应在约4℃至约40℃的温度下进行。反应可在如约25℃或约37℃下进行。反应可在任何合适的ph下进行。通常,反应在约4.5至约10的ph下进行。反应可在如约5至约9的ph下进行。在一些实施方案中,反应在接近中性的ph(即,约ph7)下进行。在一些实施方案中,反应在7.2至7.5的ph范围内进行。反应可进行任何合适的时间长度。通常,将反应混合物在合适的条件下孵育约1分钟至几小时。反应可进行如约1分钟、或约5分钟、或约10分钟、或约30分钟、或约1小时、或约2小时、或约4小时、或约8小时、或约12小时、或约24小时、或约48小时、或约72小时。其他反应条件可能用于本发明的方法中,这取决于缀合物中抗体的特性和用于连接佐剂部分的试剂。用于形成抗体佐剂缀合物的反应混合物可含有通常用于生物缀合反应的另外的试剂。例如,在某些实施方案中,反应混合物可含有缓冲液(例如,2-(n吗啉代)乙磺酸(mes)、2-[4-(2-羟乙基)哌嗪-1-基]乙磺酸(hepes)、3-吗啉丙烷-1-磺酸(mops)、磷酸钾、磷酸钠、磷酸盐缓冲液、柠檬酸钠、醋酸钠和硼酸钠)、助溶剂(例如二甲基亚砜、二甲基甲酰胺、乙醇、甲醇、四氢呋喃、丙酮和乙酸)、盐(例如,nacl、kcl、cacl2以及mn2+和mg2+的盐)、去污剂/表面活性剂(例如,非离子表面活性剂,诸如n,n,n-双[3(d葡糖酰胺基)丙基]胆烷、聚氧乙烯(20)十六烷基醚、二甲基癸基氧化膦、支链辛基苯氧基聚(乙烯氧基)乙醇、聚氧乙烯-聚氧丙烯嵌段共聚物、t-辛基苯氧基聚乙氧基乙醇、聚氧乙烯(20)脱水山梨糖醇单油酸酯等);阴离子表面活性剂如胆酸钠、n-月桂酰肌氨酸、十二烷基硫酸钠等;阳离子表面活性剂,如十六烷基三甲基溴化铵、三甲基(十四烷基)溴化铵等;或两性离子表面活性剂如酰胺基磺基甜菜碱、3[(3-胆酰胺丙基)二甲基-铵]-1-丙磺酸盐等)、螯合剂(例如,乙二醇-双(2-氨基乙基醚)-n,n,n′,n′-四乙酸(egta)、2({2[双(羧甲基)氨基]乙基}(羧甲基)氨基)乙酸(edta)和1,2-双(邻氨基苯氧基)乙烷-n,n,n′,n′-四乙酸(bapta)),以及还原剂(例如,二硫苏糖醇(dtt)、β-巯基乙醇(bme)和三(2-羧乙基)膦(tcep))。缓冲液、助溶剂、盐、洗涤剂/表面活性剂、螯合剂和还原剂可以以任何合适的浓度使用,这可由本领域技术人员容易地确定。通常,缓冲液、助溶剂、盐、去污剂/表面活性剂、螯合剂和还原剂包括在反应混合物中,浓度范围为约1μm至约1m。例如,缓冲液、助溶剂、盐、去污剂/表面活性剂、螯合剂或还原剂可以以约1μm或约10μm或约100μm或约1mm或约10mm或约25mm或约50mm或约100mm或约250mm或约500mm或约1m的浓度包含在反应混合物中。免疫缀合物的配制和施用在相关方面,本发明提供了包含如上所述的多个免疫缀合物的组合物。在一些实施方案中,每个免疫缀合物的佐剂部分的平均数量范围为约1至约10。每个免疫缀合物的佐剂部分的平均数量可为例如约1至约10、或约1至约6、或约1至约4。每个免疫缀合物的佐剂部分的平均数量可以是约0.8、1、1.2、1.4、1.6、1.8、2、2.2、2.4、2.6、2.8、3、3.2、3.4、3.6、3.8、4.0或4.2。在一些实施方案中,每个免疫缀合物的佐剂部分的平均数是约4。在一些实施方案中,每个免疫缀合物的佐剂部分的平均数是约2。在一些情况下,抗体与单个佐剂部分共价结合。在一些情况下,抗体与2个或更多个佐剂部分(例如,3个或更多、4个或更多、或5个或更多佐剂部分)共价结合。在一些情况下,抗体与1-10个佐剂部分(例如,1-8、1-5、1-3、2-10、2-8、2-5、2-3或3-8个佐剂部分)共价结合。在一些情况下,抗体与2-10个佐剂部分(例如,2-8、2-5、2-3或3-10或3-8个佐剂部分)共价结合。在抗体与一个以上佐剂部分共价结合的一些情况下,连接的佐剂部分可相同或不同。例如,在一些情况下,两个或更多个佐剂部分可以是相同的(例如,相同佐剂部分的两个不同分子可各自在抗体上的不同位点连接到抗体)。在一些情况下,抗体与2个或更多个不同的佐剂部分(例如,3个或更多、4个或更多、或5个或更多个不同的佐剂部分)共价结合。例如,当产生本发明的免疫缀合物时,可使一种或多种抗体与包含两种或更多种(例如,3种或更多种、4种或更多种、或5种或更多种)不同佐剂-连接体化合物的混合物接触,使一种或多种抗体中的氨基酸侧链与佐剂-连接体化合物反应,从而产生一种或多种免疫缀合物,其各自与两种或更多种不同的佐剂部分共价结合。与由抗体中赖氨酸残基的连接产生的异源缀合产物相比,位点特异性抗体缀合允许佐剂在抗体上的精确连接和均质dar。可通过抗体的各种修饰产生位点特异性免疫缀合物。用于位点特异性缀合的方法包括以下方法,但不限于本文所述的那些方法。用于位点特异性缀合的一种方法涉及掺入随后被酶识别的序列,导致化学修饰。例如,酶fge识别序列cys-x-pro-x-arg。在哺乳动物培养物中共表达的修饰抗体和fge,在工程化位点产生含有醛标签的抗体。可使用识别天然存在的序列或残基的其他酶,以转化为化学反应性基团,从而允许位点特异性缀合。细菌转谷氨酰胺酶(btgs)可催化谷氨酰胺残基和伯胺之间形成键;细菌转态酶a可通过识别基序催化转肽反应。非天然氨基酸也可掺入抗体序列中,之后可使其反应以产生位点特异性缀合物。天然存在的残基,例如氨基酸硒代半胱氨酸,可掺入抗体中,随后与适当的反应基团反应,包括但不限于马来酰亚胺和碘乙酰胺,用于位点特异性缀合。另一种方法是掺入工程化的半胱氨酸残基,其加入抗体构建体的重链或轻链中。修饰编码重链和/或轻链的载体以掺入半胱氨酸残基的密码子序列(图138a-138b中的载体序列和图138c-138d中的载体图谱)。通过首先还原抗体之后再氧化以再生抗体的天然二硫键来进行缀合,导致反应性硫醇的脱帽。一旦与佐剂-连接子反应,所得产物含有同源的免疫缀合物群,其中dar由工程化到抗体中的半胱氨酸残基的数目定义(结构如图138e所示)。例如,在位置205处的轻链中从缬氨酸到半胱氨酸(v205c突变)中的突变的掺入导致具有在限定位点缀合的佐剂的产物(v205c;图138f-138g)。在一些实施方案中,组合物还包含一种或多种药学上可接受的赋形剂。例如,本发明的免疫缀合物可配制用于胃肠外给药,例如静脉内(iv)给药或体腔或器官腔给药。或者,可在肿瘤内注射免疫缀合物。用于注射的制剂通常包含溶解在药学上可接受的载体中的免疫缀合物的溶液。可使用的可接受的溶媒和溶剂是水和林格氏溶液,等渗氯化钠溶液。此外,无菌固定油通常可用作溶剂或悬浮介质。为此目的,可使用任何温和的固定油,包括合成的甘油单酯或甘油二酯。此外,脂肪酸如油酸同样可用于制备注射剂。这些溶液是无菌的且通常没有不合需要的物质。这些制剂可通过常规的熟知的灭菌技术灭菌。制剂可含有接近生理条件所需的药学上可接受的辅料,例如ph调节剂和缓冲液、肌肉弹性调节剂,例如乙酸钠、氯化钠、氯化钾、氯化钙、乳酸钠等。这些制剂中免疫缀合物的浓度可在广泛范围内变化,并将根据所选择的特定给药方式和患者的需要主要从流体体积、粘度、体重等方面选择。在某些实施方案中,注射用溶液制剂中免疫缀合物的浓度范围为约0.1%(w/w)至约10%(w/w)。另一方面,本发明提供了一种用于治疗癌症的方法。该方法包括向对其有需要的受试者施用治疗有效量的免疫缀合物(例如,如上所述的组合物)。例如,该方法可包括施用免疫缀合物以向受试者提供约100ng/kg至约50mg/kg的剂量。免疫缀合物剂量可为约5mg/kg至约50mg/kg、约10μg/kg至约5mg/kg、或约100μg/kg至约1mg/kg。免疫缀合物剂量可为约100、200、300、400或500μg/kg。免疫缀合物剂量可为约1、2、3、4、5、6、7、8、9或10mg/kg。免疫缀合物剂量也可在这些范围之外,这取决于特定的缀合物以及所治疗的癌症的类型和严重程度。给药频率可以是每周单剂量至多剂量,或更频繁。在一些实施方案中,免疫缀合物每月给药约一次至每周给药约五次。在一些实施方案中,免疫缀合物每周给药一次。本发明的一些实施方案提供如上所述的治疗癌症的方法,其中所述癌症是头颈癌。头颈癌(以及头颈部鳞状细胞癌)指多种癌症,其特征是口腔、咽和喉、唾液腺、鼻旁窦、和鼻腔、以及淋巴颈部上部的节点的鳞状细胞癌。头颈部癌症占美国所有癌症的约3%至5%。这些癌症在男性和50岁以上的人群中更为常见。烟草(包括无烟烟草)和酒精使用是头颈癌最重要的危险因素,特别是口腔、口咽、下咽和喉癌。百分之八十五的头颈癌与吸烟有关。在本发明的方法中,免疫缀合物可用于靶向多个恶性细胞。例如,免疫缀合物可用于靶向唇、口腔、咽、喉、鼻腔或鼻旁窦的鳞状上皮细胞。免疫缀合物可用于靶向粘液表皮样癌细胞、腺样囊性癌细胞、腺癌细胞、小细胞未分化癌细胞、成神经细胞瘤细胞、霍奇金淋巴瘤细胞和非霍奇金淋巴瘤细胞。在一些实施方案中,治疗头颈癌的方法包括给予含有能够结合egfr(例如,西妥昔单抗、帕尼单抗、马妥珠单抗和扎鲁木单抗)、pd-1(例如,派姆单抗)和/或muc1的抗体的免疫缀合物。本发明的一些实施方案提供如上所述的治疗癌症的方法,其中所述癌症是乳腺癌。乳腺癌可以源自乳房的不同区域,并已经表征了许多不同类型的乳腺癌。例如,本发明的免疫缀合物可用于原位治疗导管癌;浸润性导管癌(例如,管状癌、骨髓癌、粘液癌、乳头状癌或乳房的纤维状癌);小叶原位癌;浸润性小叶癌;炎性乳腺癌;以及其他形式的乳腺癌。在一些实施方案中,用于治疗乳腺癌的方法包括给予含有能够结合her2(例如曲妥珠单抗、margetuximab)、糖蛋白nmb(例如,glembatumumab)和/或muc1的抗体的免疫缀合物。本公开的非限制性方面的示例本文描述的本发明的方面(包括实施方案),单独或与一个或多个其他方面或实施方案进行组合是有益的。在不限制前述描述的情况下,下面提供了公开编号1-98的的某些非限制性方面。对于本领域技术人员在阅读本公开内容时将显而易见的是,每个单独编号的方面可以与前面或后面的任何单独编号的方面一起使用或组合。这旨在为所有这些方面的组合提供支持,并且不限于以下明确提供的方面的组合:1.一种免疫缀合物,所述免疫缀合物包含:(a)抗体构建体,所述抗体构建体包含(i)抗原结合结构域和(ii)fc结构域,(b)佐剂部分,以及(c)连接子,其中每个佐剂部分经由所述连接子与所述抗体构建体共价结合。2.根据方面1所述的免疫缀合物,其中所述抗体构建体还包含靶向结合结构域。3.根据方面1所述的免疫缀合物,其中所述抗体构建体是抗体。4.根据方面1至3中任一项所述的免疫缀合物,其中所述抗原结合结构域与癌细胞的抗原结合。5.根据方面1至4中任一项所述的免疫缀合物,其中所述抗原结合结构域与选自以下的抗原结合:cdh1、cd19、cd20、cd29、cd30、cd38、cd40、cd47、epcam、muc1、muc16、egfr、vegf、her2、slamf7、pdgfra和gp75。6.根据方面1至5中任一项所述的免疫缀合物,其中所述抗原结合结构域与选自以下的抗原结合:cd19、cd20、cd40、cd47、epcam、muc1、muc16、pdgfra、egfr和her2。7.根据方面1至6中任一项所述的免疫缀合物,其中所述抗原结合结构域与选自tn抗原和thomsen-friedenreich抗原的抗原结合。8.根据方面3至7中任一项所述的免疫缀合物,其中所述抗体是多克隆抗体。9.根据方面3至7中任一项所述的免疫缀合物,其中所述抗体是单克隆抗体。10.根据方面8或9所述的免疫缀合物,其中所述抗体是人源化的。11.根据方面8或9所述的免疫缀合物,其中所述抗体是鼠的。12.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体选自奥拉单抗、奥滨尤妥珠单抗、曲妥珠单抗、西妥昔单抗、利妥昔单抗、帕妥珠单抗、贝伐珠单抗、达雷木单抗、依那西普和埃罗妥珠单抗。13.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是奥拉单抗。14.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是奥滨尤妥珠单抗。15.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是曲妥珠单抗。16.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是西妥昔单抗。17.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是利妥昔单抗。18.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是帕妥珠单抗。19.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是贝伐珠单抗。20.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是达雷木单抗。21.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是埃罗妥珠单抗。22.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是依那西普。23.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体与免疫检查点抑制剂的抗原结合。24.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体与选自以下的抗原结合:ctla4、pd-1、pd-l1、pd-l2、lag-3、b7-h4、kir、tnfrsf4、ox40l、ido-1、ido-2、ceacam1、btla、tim3、a2ar和vista。25.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体与选自ctla4、pd-1和pd-l1的抗原结合。26.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体与pd-1抗原结合。27.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体与pd-l1抗原结合。28.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体与ctla4抗原结合。29.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体选自派姆单抗、纳武单抗、阿特珠单抗和伊匹单抗。30.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是派姆单抗。31.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是纳武单抗。32.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是阿特珠单抗。33.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是伊匹单抗。34.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体与选自以下的抗原结合:clec4c(bdca-2,dlec,cd303,clecsf7)、clec4d(mcl,clecsf8)、clec4e(mincle)、clec6a(dectin-2)、clec5a(mdl-1,clecsf5)、clec1b(clec-2)、clec9a(dngr-1)和clec7a(dectin-1)。35.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体与clec5a抗原结合。36.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体与clec6a(dectin-2)抗原结合。37.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是iga1。38.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是iga2抗体。39.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是igg抗体。40.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是igg1抗体。41.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是igg2抗体。42.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是igg3抗体。43.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是igg4抗体。44.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是选自以下的抗体的生物仿制药:派姆单抗、纳武单抗、阿特珠单抗、伊匹单抗、奥滨尤妥珠单抗、曲妥珠单抗、西妥昔单抗、利妥昔单抗、帕妥珠单抗、贝伐珠单抗、达雷木单抗、依那西普、奥拉单抗和埃罗妥珠单抗。45.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是西妥昔单抗的生物仿制药。46.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是利妥昔单抗的生物仿制药。47.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体是曲妥珠单抗的生物仿制药。48.根据方面3至11中任一项所述的免疫缀合物,其中所述抗体包含经修饰的fc区。49.根据方面48所述的免疫缀合物,其中所述经修饰的fc区含有至少一个氨基酸插入、缺失或取代。50.根据方面48所述的免疫缀合物,与缺乏所述经修饰的fc区的天然抗体相比,其中所述经修饰的fc区导致对选自以下的fc受体的结合的调节:fcγri(cd64)、fcγriia(cd32)、fcγriib(cd32)、fcγriiia(cd16a)和fcγriiib(cd16b)。51.根据方面48所述的免疫缀合物,其中所述经修饰的fc区增加了所述fc区与fc受体fcγriiia(cd16a)的结合。52.根据方面48所述的免疫缀合物,其中所述经修饰的fc区增加了所述fc区与fc受体fcγriiib(cd16b)的结合。53.根据方面1至52中任一项所述的免疫缀合物,其中所述免疫缀合物具有根据式i的结构:或其药学上可接受的盐,其中ab为抗体;a为所述抗体中未修饰的氨基酸侧链或所述抗体中经修饰的氨基酸侧链;z为连接部分;adj为佐剂部分;并且下标r为1至10的整数。54.根据方面53所述的免疫缀合物,其中所述免疫缀合物具有根据式ia的结构:或其药学上可接受的盐,其中ab为抗体;a为抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链;z为连接部分;r1选自h和c1-4烷基;或者z、r1和它们所附接的氮原子形成包含5-至8-元杂环的连接部分;每个y独立地为chr2,其中r2选自h、oh和nh2,r3选自c1-6烷基和2-至6-元杂烷基,它们各自任选地被一个或多个选自卤素、羟基、氨基、氧代基(=o)、烷基氨基、酰氨基、酰基、硝基、氰基和烷氧基的成员取代;x选自o和ch2;下标n为1至12的整数;并且下标r为1至10的整数。55.根据方面54所述的免疫缀合物,其中所述免疫缀合物具有根据式ib的结构:或其药学上可接受的盐,其中ab为抗体;a为抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链;z为连接部分;r1选自h和c1-4烷基;或者z、r1和它们所附接的氮原子形成包含5-至8-元杂环的连接部分;每个y独立地为chr2,其中r2选自h、oh和nh2;x选自o和ch2;下标n为1至12的整数;并且w选自o和ch2。56.根据方面55所述的免疫缀合物,其中所述免疫缀合物具有根据式ic的结构:或其药学上可接受的盐,其中ab为抗体;下标r为1至10的整数;a为抗体中未修饰的氨基酸侧链或抗体中经修饰的氨基酸侧链;z为连接部分;并且r1选自h和c1-4烷基;或者z、r1和它们所附接的氮原子形成包含5-至8-元杂环的连接部分;并且r2选自h、oh和nh2。57.根据方面56所述的免疫缀合物,所述免疫缀合物具有根据式id的结构:或其药学上可接受的盐,其中ab为抗体;a为所述抗体中未修饰的氨基酸侧链或所述抗体中经修饰的氨基酸侧链;r2选自h、oh和nh2;并且下标r为1至10的整数。58.根据方面53至56中任一项所述的免疫缀合物,其中z选自:其中下标x为1至12的整数;下标y为1至30的整数;虚线表示佐剂部分的附接点;并且波浪线表示抗体中氨基酸侧链的附接点。59.根据方面1至52中任一项所述的免疫缀合物,其中所述免疫缀合物具有根据式ii的结构:或其药学上可接受的盐,其中ab为抗体;其中a为所述抗体中未修饰的氨基酸侧链或所述抗体中经修饰的氨基酸侧链;其中adj为佐剂部分;其中下标r为1至10的整数;并且其中:z1选自-c(o)-、-c(o)nh-、-ch2-;z2和z4独立地选自键、c1-30亚烷基和3-至30-元杂亚烷基,其中:c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被-c(o)-、-nrac(o)-或-c(o)nra-替代,c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被4-至8-元二价碳环替代,c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被具有1至4个选自o、s和n的杂原子的4-至8-元二价杂环替代,并且每个ra独立地选自h和c1-6烷基;z3选自键、二价肽部分和二价聚合物部分;并且z5与抗体中氨基酸侧链侧链键合。60.根据方面59所述的免疫缀合物,其中所述免疫缀合物具有根据式iia的结构:或其药学上可接受的盐,其中z1选自-c(o)-、-c(o)nh-、-ch2-;z2和z4独立地选自键、c1-30亚烷基和3-至30-元杂亚烷基,其中:c1-30烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被-c(o)-、-nrac(o)-或-c(o)nra-替代;c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被4-至8-元二价碳环替代,c1-30亚烷基和3-至30-元杂亚烷基中相邻原子的一个或多个基团任选且独立地被具有1至4个选自o、s和n的杂原子的4-至8-元二价杂环替代,并且每个ra独立地选自h和c1-6烷基;z3选自键、二价肽基团和二价聚合物部分;以及z5选自胺键合的部分和硫醇键合的部分。61.根据方面1至52中任一项所述的免疫缀合物,其中所述免疫缀合物具有根据式iii的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体,adj为佐剂,g为ch2、c=o或键,l为连接子,并且下标r为1至10的整数。62.根据方面61所述的免疫缀合物,其中l选自:其中r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;a为1至40的整数;每个a独立地选自任何氨基酸;下标c为1至20的整数;虚线表示的附接点;并且波浪线表示的附接点。63.根据方面61所述的免疫缀合物,其中所述免疫缀合物具有根据式iiia至式iiig的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;g为ch2、c=o或键;r任选地存在并且为包含1至8个碳单元的直链或支链、环状或直链、饱和或不饱和的烷基、杂烷基、芳基或杂芳基链;下标a为1至40的整数;每个a独立地选自任何氨基酸;下标c为1至20的整数;并且下标r为1至10的整数。64.根据方面61至63中任一项所述的免疫缀合物,其中所述免疫缀合物具有根据式iva至式ivk的结构:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体;adj为佐剂;并且下标r为1至10的整数。65.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分是模式识别受体(prr)激动剂。66.根据方面65所述的免疫缀合物,其中所述佐剂部分是toll样受体(tlr)激动剂。67.根据方面65所述的免疫缀合物,其中所述佐剂部分是选自以下的toll样受体(tlr)激动剂:tlr2激动剂、tlr3激动剂、tlr4激动剂、tlr7激动剂、tlr8激动剂、tlr7/tlr8激动剂和tlr9激动剂。68.根据方面65所述的免疫缀合物,其中所述佐剂部分是tlr7激动剂、tlr8激动剂或tlr7/tlr8激动剂。69.根据方面65所述的免疫缀合物,其中所述佐剂部分选自地喹莫德(1-(4-氨基-2-乙基氨基甲基咪唑并[4,5-c]喹啉-1-基)-2-甲基丙-2-醇)、咪喹莫特(r837)、loxoribine、irm1(1-(2-氨基)-2-甲基丙基)-2-(乙氧基甲基)-1h-咪唑并[4,5-c]喹啉-4-胺)、irm2(2-甲基-1-[2-(3-吡啶-3-基丙氧基))乙基]-1h-咪唑并[4,5-c]喹啉-4-胺)、irm3(n-(2-[2-[4-氨基-2-(2-甲氧基乙基)-1h-咪唑并[4,5]-c]喹啉-1-基]乙氧基]乙基)-n-甲基环己烷甲酰胺)、cl097(2-(乙氧基甲基)-1h-咪唑并[4,5-c]喹啉-4-胺)、cl307、cl264、瑞喹莫德、3m-052/medi9197、sd-101(n-[(4s)-2,5-二氧代-4-咪唑烷基]-脲)、motolimod(2-氨基-n,n-二丙基-8-[4-(吡咯烷)-1-羰基)苯基]-3h-1-苯并氮杂-4-甲酰胺)、cl075(2-丙基噻唑并[4,5-c]喹啉-4-胺)和tl8-506(3h-1-苯并吖庚因-4)-羧酸、2-氨基-8-(3-氰基苯基)-乙酯)、n-α-棕榈酰基-s-[2,3-双(棕榈酰氧基)-(2rs)-丙基]-l-半胱氨酸、棕榈酰-cys((rs)-2,3-二(棕榈酰氧基)-丙基)(pam3cys)、三酰基脂质a(om-174)、脂磷壁酸(lta)、肽聚糖n、cl419(s-(2,3-双(棕榈酰氧基)-(2rs)丙基)-(r)-半胱氨酰精胺)、pam2csk4(s-[2,3-双(棕榈酰氧基)-(2rs)-丙基]-[r]-半胱氨酰-[s]-芳基-[s]-赖氨酰-[s]-赖氨酰-[s]-赖氨酰-[s]-赖氨酸×3cf3cooh)、cl572(s-(2-豆蔻酰氧基乙基))-(r)-半胱氨酰4-((6-氨基-2-(丁基氨基)-8-羟基-9h-嘌呤-9-基)甲基)苯胺)、cl413(s-(2,3-双(棕榈酰氧基))-(2rs)丙基0-(r)-半胱氨酰-(s)-芳基-(s)-赖氨酰-(s)-赖氨酰-(s)-赖氨酰-(s)-赖氨酰4-((6-氨基)-2-(丁基氨基)-8-羟基-9h-嘌呤-9-基)甲基)苯胺)和cl401(s-(2,3-双(棕榈酰氧基)-(2rs)丙基)-(r)-半胱氨酰4-((6-氨基-2(丁基氨基)-8-羟基-9h-嘌呤-9-基)甲基)苯胺)。70.根据方面65所述的免疫缀合物,其中所述佐剂是咪唑喹啉化合物。71.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中每个j独立地为氢、or4或r4;每个r4独立地为氢或者包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;q任选地存在并且为包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示所述佐剂的附接点。72.根据方面71所述的免疫缀合物,其中所述佐剂部分具有下式:其中每个r4独立地选自氢或者包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。73.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中j为氢、or4或r4;每个r4独立地为氢或者包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;q选自包含1至8个碳单元的烷基、或杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示所述佐剂的附接点。74.根据方面72所述的免疫缀合物,其中所述佐剂部分具有下式:其中每个r4独立地选自氢或者包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示佐剂的附接点。75.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中每个r4独立地为氢或者包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;q为包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示所述佐剂的附接点。76.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中每个j独立地为氢、or4或r4;每个r4独立地为氢或者包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;每个u独立地为ch或n,其中至少一个u为n;每个下标t独立地为1至3的整数;q任选地存在并且为包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示所述佐剂的附接点。77.根据方面74所述的免疫缀合物,其中所述佐剂部分具有下式:其中r4选自氢或者包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基和杂芳烷基基团;q为包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示所述佐剂的附接点。78.根据方面1至53、59以及61至63中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中j为氢、or4或r4;每个r4独立地为氢或者包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;r5为氢或者包含1至10个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;q为包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;并且虚线表示所述佐剂的附接点。79.根据方面76所述的免疫缀合物,其中所述佐剂部分具有下式:其中j为氢、or4或r4;每个r4独立地选自氢或者包含1至8个碳单元的烷基、杂烷基、环烷基、杂环烷基、芳基、杂芳基、芳烷基或杂芳烷基基团;u为ch或n;v为ch2、o或nh;每个下标t独立地为1至3的整数;并且虚线表示佐剂的附接点。80.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中r1选自h和c1-4烷基;r3选自c1-6烷基和2-至6-元杂烷基,它们各自任选地被一个或多个选自卤素、羟基、氨基、氧代基(=o)、烷基氨基、酰氨基、酰基、硝基、氰基和烷氧基的成员取代;x选自o和ch2;每个y独立地为chr2,其中r2选自h、oh和nh2,下标n为1至12的整数;并且虚线表示所述佐剂的附接点。81.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中w选自基团o和ch2;r1选自h和c1-4烷基;每个y独立地为chr2,其中r2选自h、oh和nh2;下标n为1至12的整数;并且虚线表示佐剂的附接点。82.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中w选自基团o和ch2;r1选自h和c1-4烷基;每个y独立地为chr2,其中r2选自h、oh和nh2;下标n为1至12的整数;并且虚线表示佐剂的附接点。83.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中w选自基团o和ch2;x选自o和ch2;每个y独立地为chr2,其中r2选自h、oh和nh2;下标n为1至12的整数;并且虚线表示佐剂的附接点。84.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中r1选自h和c1-4烷基;r2选自h、oh和nh2;并且虚线表示佐剂的附接点。85.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分具有下式:其中r1选自h和c1-4烷基;r2选自h、oh和nh2;并且虚线表示佐剂的附接点。86.根据方面1至53、59以及61至64中任一项所述的免疫缀合物,其中所述佐剂部分为:其中虚线表示佐剂的附接点。87.一种免疫缀合物,选自:或其药学上可接受的盐,其中ab为具有至少一个赖氨酸侧链的抗体,并且下标r为1至10的整数。88.根据方面87所述的免疫缀合物,其中r为1至4。89.根据方面1至88中任一项所述的免疫缀合物,其中所述连接子为约至约90.根据方面1至88中任一项所述的免疫缀合物,其中所述连接子为约至约91.一种组合物,所述组合物包含根据方面1至90中任一项所述的多个免疫缀合物。92.根据方面91所述的组合物,其中每个免疫缀合物的佐剂部分的平均数量范围为约1至约9。93.根据方面91所述的组合物,其中每个免疫缀合物的佐剂部分的平均数量范围为约0.5至约4。94.根据方面91至93任一项所述的组合物,还包含一种或多种药学上可接受的赋形剂。95.一种治疗癌症的方法,所述方法包括向对其有需要的受试者施用治疗有效量的根据方面1至90中任一项所述的免疫缀合物或根据方面91至94中任一项所述的组合物。96.根据方面95所述的方法,其中所述癌症是乳腺癌。97.根据方面95所述的方法,其中所述癌症是头颈癌。98.根据方面95所述的方法,其中所述癌症是淋巴瘤。实施例实施例1:用于抗体缀合的咪唑喹啉根据方案1合成具有游离胺基团(化合物1)或马来酰亚胺基团(化合物2)的咪唑喹啉化合物,可快速评估连接子技术和抗体-佐剂免疫缀合物功效。为了确定佐剂官能化是否影响化合物2或化合物1引发免疫激活的能力,在经由流式细胞术分析之前。用10倍系列稀释的r848、化合物2、化合物1或对照tlr激动剂、cl307刺激人抗原呈递细胞18小时。数据表明化合物2和化合物1在测定的每个浓度下与r848表现相似(图4;化合物1数据未显示)。之后,直接测定每种官能化tlr激动剂激活人tlr7或tlr8的能力。hek293细胞与人tlr7或tlr8或鼠tlr7和在nf-κb和ap-1结合位点融合的ifn-β最小启动子控制下的诱导型分泌胚胎碱性磷酸酶报告基因共转染。随后将细胞与2倍系列稀释的每个指定佐剂在碱性磷酸酶底物存在下于37℃孵育12小时。通过分光光度测定法(od650nm)测量活性。数据表明化合物1激活人tlr7和tlr8,而化合物2对tlr7活性具有特异性(图2)。类似地,化合物2和化合物1均激活鼠tlr7(图2)。方案1实施例2:抗体佐剂缀合物的制备根据方案2a和方案2b中概述的一般方案,用不可裂解的交联剂(smcc,thermofisherscientific)和可裂解的交联剂(spdp,thermofisherscientific)修饰化合物1,以准备与利妥昔单抗缀合。方案2a和2b通过使化合物以1∶1的摩尔比在ph7-7.5的pbs或其它合适的缓冲液中反应,将具有游离胺(r848,化合物1等)的佐剂与smcc、spdp或其它含nhs的连接子缀合。将所有反应避光,并在室温下孵育30分钟。在可能的情况下,经由反相高效液相色谱(hplc)纯化佐剂-交联剂缀合物。如下所述,在缀合后立即使用佐剂-交联剂缀合物。用zebaspindesaltingcolumns(thermofisherscientific)将佐剂-连接子组合物脱盐并将缓冲液更换为去离子水。随后在shimadzulc/ms-2020单四极杆液相色谱质谱仪上分析样品。使用适合于检测100-1000m/z内的小分子的梯度为0-100%乙腈的方法进行化合物检测。经由lc-ms评估反应效率,并表明大部分游离smcc已与化合物1反应形成化合物1-smcc,其预测分子量为531(图3,右下图)。化合物1-spdp观察到类似的反应效率(数据未显示)。在化合物1与交联剂成功缀合后,用sata交联剂修饰抗体,以将抗体上的游离胺转化为受保护的巯基基团。缀合sata后,用羟胺将巯基基团脱乙酰化,并使暴露的硫醇与佐剂-smcc化合物的马来酰亚胺组分反应,如方案3所示。方案3将抗体以1-5mg/ml重悬于磷酸盐缓冲盐(pbs)中,并在使用前立即将sata交联剂(thermofisherscientific)以70mm重悬于无水dmso中。在室温下使抗体与10倍摩尔过量的sata反应30分钟。根据制造商的说明书(emdmillipore),从过量的试剂和副产物中纯化sata修饰的抗体,用具有ultracel-100膜的平衡的amiconultra离心过滤器在pbs中洗涤3次。通过基质辅助激光解吸/电离质谱(maldi-tof)测定每种抗体的sata交联剂的数量。在室温下pbs的ph为7.2-7.5中与0.05m羟胺和2.5mmedta孵育2小时后,sata修饰的抗体脱乙酰化。随后根据制造商的说明书(emdmillipore),从过量的试剂和副产物中纯化脱乙酰化的sata修饰的抗体,用具有ultracel-100膜的平衡的amiconultra离心过滤器在含有5mmedta的pbs中洗涤3次。随后将纯化的脱乙酰化的sata-修饰的抗体与5至40倍摩尔过量的佐剂-交联剂在室温下反应30分钟至1小时。通过maldi-tof测定,精确的摩尔过量数比每个抗体的sata分子的平均数高10倍。缀合后,根据制造商的说明书(emdmillipore),从过量试剂和副产物中纯化抗体佐剂免疫缀合物,用具有ultracel-100膜的平衡的amiconultra离心过滤器在pbs中洗涤3次。经由maldi-tof测定平均药物与抗体的比率。使用zebaspindesaltingcolumns(thermofisherscientific)将样品脱盐并将缓冲液更换为去离子水。首先将基质(芥子酸)点在maldi样品靶板上并使其干燥。之后,将样品以1∶1的比例与有或没有牛血清白蛋白(bsa)的标准品(0.25-1pmbsa)混合,并用基质样品点在板上。一旦基质和样品层都干燥,就在absciextof/tof5800(stanforduniversity,canarycenter)上分析样品。具有负离子化的高质量检测器(covalx)可在全部完整的igg抗体范围内的蛋白质大小(约150,000kda)下增强灵敏度和分辨率。在成功缀合抗体-佐剂免疫缀合物(方案3中所示的ab-sata-smcc-佐剂)后,经由maldi-tof质谱法测定平均药物与抗体的比率(表1)。利用sata修饰的和未修饰的抗体之间的质量差异来确定每个抗体存在多少个连接子。使用sata修饰的抗体和免疫缀合物之间的质量差异来确定平均药物与抗体的比率(dar)。表1:基于maldi-tofms的药物与抗体比率的测定。样品分子量(da)质量差(da)ab修饰抗体145,772--抗体-sata146,2104383.77连接子/ab抗体-sata-spdp-化合物1146,94411722.07药物/ab抗体-sata-smcc-化合物1147,30915372.07药物/ab实施例3:抗体佐剂缀合物体外活性的评估人抗原呈递细胞的分离:使用含有针对cd2、cd3、cd8、cd19、cd56、cd66b和cd235a的单克隆抗体的rosettesep人单核细胞富集混合物(stemcelltechnologies)通过密度梯度离心从健康献血者(stanfordbloodcenter)获得的人外周血单核细胞中阴性选择人抗原呈递细胞(apc)。随后使用easysep人单核细胞富集试剂盒经由阴性选择将未成熟的apc纯化至>97%纯度,所述试剂盒无cd16损耗,其含有针对cd2、cd3、cd19、cd20、cd56、cd66b、cd123和cd235a的单克隆抗体。肿瘤细胞的制备:将肿瘤细胞重悬于含有0.1%胎牛血清(fbs)的pbs中,浓度为1至10×106细胞/ml。随后将细胞与2μmcfse一起孵育以产生1μm的终浓度。2分钟后,经由加入10ml含10%fbs的完全培养基终止反应,并用完全培养基清洗一次。将细胞固定在2%多聚甲醛中并用pbs清洗三次或保持未固定,之后将细胞在10%dmso、20%fbs和70%培养基中冷冻。apc-肿瘤共培养物:将2×105的apc与或不与6.5×105自体或同种异体cfse标记的肿瘤细胞一起在含有imdm培养基(gibco)的96孔板(corning)中孵育,所述培养基补充有10%胎牛血清、100u/ml青霉素、100μg/ml链霉素、2mml-谷氨酰胺、丙酮酸钠、非必需氨基酸、50μm2-me,并且如果需要,还有各浓度的抗肿瘤抗体和指定的佐剂。18小时后,经由流式细胞术分析细胞和无细胞上清液。结果:为确定免疫缀合物引发免疫激活的能力,将从新鲜血液中获得的人apc(约95%单核细胞)与cfse标记的人b细胞淋巴瘤细胞(toledo,atcc)以3∶1的比例和化合物1、利妥昔单抗(ab)、利妥昔单抗+化合物1(混合物)或利妥昔单抗-sata-smcc-化合物1(缀合的)的2倍系列溶液孵育。在这些实验中,免疫缀合物每个抗体平均具有2.1个化合物1分子,并相应地调整化合物1剂量以确保在所有条件下可比较等摩尔量的化合物1。18小时后,经由流式细胞术分析细胞的活化标记物的表达。数据表明,与单独的ab、单独的化合物1或混合物刺激的apc相比,免疫缀合物在引发apc活化方面更为优越,体现在用免疫缀合物刺激的apc中表达出高数倍水平的cd40、cd86和hla-dr(图4)。鉴于免疫缀合物激活后观察到高水平的活化标记物,研究了pd-l1的表达,pd-l1是一种与apc活化程度高度相关的抑制标记物。令人惊讶的是,与单独的佐剂或混合物相比,免疫缀合物在引发pd-l1表达上调方面的效力要小得多(图5)。值得注意的是,对应于最大生物活性浓度,在0.1μm免疫缀合物中pd-l1表达可忽略不计(图4、图5)。这些数据表明免疫缀合物可激活人apc中不可预见的信号传导途径。为了支持这一假设,经免疫缀合物刺激的细胞出乎意料地发生了树突,并且经历了与单核细胞分化为dc一致的形态变化。这一发现促进了dc相关表面分子的分析。与它们的形态一致,用免疫缀合物而不是混合物刺激的apc以剂量依赖性方式下调cd14、cd16和cd163表达(图6)。这些分子的下调由单核细胞和巨噬细胞表达,但在单核细胞衍生的dc上大大减少,表明暴露于免疫缀合物的人单核细胞迅速分化成dc。与这些数据一致,用免疫缀合物刺激的apc上调cd123的表达,cd123是人炎性单核细胞衍生的dc的标记物(图6)。虽然t细胞刺激分子如cd40、cd86和hla-dr的表达是有效t细胞活化所必需的,但apc也通过细胞因子的分泌影响随后的免疫应答的性质。因此,如上所述研究在免疫缀合物刺激后在人apc中引发细胞因子分泌的能力。数据表明免疫缀合物分化的细胞分泌多倍的il-1β和tnfα,而抗炎细胞因子il-10的分泌较低(图7)。还制备了用可裂解连接子构建的免疫缀合物,并发现其在体外引起apc活化和dc分化(图8)。在cfse标记的肿瘤细胞存在下,用2倍系列稀释的利妥昔单抗-sata-smcc-化合物1(缀合的)、单独的利妥昔单抗(ab)、单独的化合物1或利妥昔单抗+化合物1(混合物)刺激约95%单核细胞的人apc。通过maldi-tof证实,免疫缀合物-可裂解的dar为1.4。18小时后,经由流式细胞术分析cd19-人apc;n=3。实施例4:体内抗体佐剂结合物功效的评估对于肿瘤研究,在c57bl/6小鼠的右侧上方皮下(s.c.)注射2×105个b16f10黑素瘤细胞。10天后,或肿瘤达到25mm2时,给小鼠静脉注射400μg免疫缀合物(抗gp75-sata-smcc-化合物1)(dar=1.74)或瘤内注射400μg免疫缀合物(抗gp75-sata-smcc-化合物1)或1.5μg化合物1和400μg抗gp75(ta99)的混合物。在初始治疗后第2天和第4天给予后续治疗。用卡尺每周2-3次测量肿瘤发展。用免疫复合物处理的小鼠,而不是混合物,减少了它们的肿瘤(图9a)。接下来,在已建立肿瘤的小鼠中肿瘤内或静脉内给予等量剂量的αgp75-免疫缀合物。令人惊讶的是,即使估计仅有少于10%的免疫缀合物到达肿瘤,iv施用也导致了肿瘤消退(图9b)。本文所述的研究表明,与等摩尔量的非共价连接的抗体-佐剂混合物相比,免疫缀合物在引发免疫激活和抗肿瘤免疫方面在数量上和质量上更有效。这些发现不太可能由简单地佐剂抗体缀合后的血清半衰期延长引起,因为在短的体外孵育期间观察到明显的表型改变和新的生物学性质。这些研究表明,来自健康人供体的新鲜分离的外周血单核细胞在用免疫缀合物过夜刺激后经历dc分化,而与gm-csf和il-4的金标准dc分化方案需要6天。此外,与等效剂量的非共价连接的抗体-佐剂混合物相比,免疫缀合物活化的人apc表达高数倍量的共刺激分子和炎性细胞因子。然而,免疫缀合物引起更低水平的阴性共刺激分子,例如pd-l1和相当量的il-10,表明免疫缀合物激活不可预见的信号传导途径。不受任何特定理论的束缚,据信用免疫缀合物刺激非常类似于生理抗体介导的免疫,由此apc以高亲和力识别调节的病原体(与病原体结合的抗体)。实施例5:另外的抗体佐剂缀合物的制备及其体外活性的评估另外的抗体佐剂缀合物的制备:使用实施例1和2中所述的方法制备另外的抗体佐剂缀合物。使用抗体派姆单抗(pd-1)、纳武单抗(pd-1)、阿特珠单抗(pd-l1)和伊匹单抗(ctla4)产生具有sata-smcc连接子的抗体-佐剂缀合物(参见上述方案3)。在成功缀合免疫缀合物后,经由lc-ms测定平均药物与抗体的比率。首先使用pngasef将免疫缀合物去糖基化以从抗体中除去聚糖,之后将免疫复合物的缓冲液更换为去离子水。将抗体佐剂缀合物在c4柱上载样,用乙腈/水洗脱,并于watersxevog2-xsqtof/tof上分析。对原始质谱数据进行解卷积以确定药物与抗体(dar)的比率。lc-ms数据表明缀合的成功和期望的dar比率。人抗原呈递细胞的分离:使用含有针对cd14、cd16、cd40、cd86、cd123和hla-dr的单克隆抗体的rosettesep人单核细胞富集混合物(stemcelltechnologies)通过密度梯度离心从健康献血者(stanfordbloodcenter)获得的人外周血单核细胞中阴性选择人抗原呈递细胞(apc)。随后使用easysep人单核细胞富集试剂盒经由阴性选择将未成熟的apc纯化至>97%纯度,所述试剂盒无cd16损耗,其含有针对cd14、cd16、cd40、cd86、cd123和hla-dr的单克隆抗体。肿瘤细胞的制备:根据以上实施例3制备肿瘤细胞。apc-肿瘤共培养物:将2×105的apc与或不与6.5×105自体或同种异体cfse标记的肿瘤细胞一起在含有imdm培养基(gibco)的96孔板(corning)中孵育,所述培养基补充有10%胎牛血清、100u/ml青霉素、100μg/ml链霉素、2mml-谷氨酰胺、丙酮酸钠、非必需氨基酸、50μm2-me,并且如果需要,还有各浓度抗体。18小时后,经由流式细胞术分析细胞和无细胞上清液。结果:将从新鲜血液中获得的人apc(约95%单核细胞)与cfse标记的人b细胞淋巴瘤细胞(toledo,atcc)以3∶1的比例和单独的抗体或抗体-sata-smcc-化合物1(缀合的)的2倍系列溶液孵育。18小时后,经由流式细胞术分析细胞的活化标记物的表达。数据表明,与单独的抗体相比,免疫缀合物在引发apc活化方面更为优越,体现在用免疫缀合物刺激的apc中表达出高数倍水平的cd40、cd86和hla-dr(参见图10d和10e的伊匹单抗、图11d和11e的派姆单抗、图12d和12e的纳武单抗以及图13d和13e的阿特珠单抗)。与实施例3中观察到的结果一致,免疫缀合物下调cd14(参见图10c的伊匹单抗、图11c的派姆单抗、图12c的纳武单抗以及图13c的阿特珠单抗)。基于实施例3的结果,这些免疫缀合物的结果与cd16和cd123(数据未显示)的预期一致。如上所述实施例3中研究在免疫缀合物刺激后在人apc中引发细胞因子分泌的能力。数据表明免疫缀合物分化的细胞分泌更高量的il-1β和tnfα(参见,图14和14b的阿特珠单抗、图15a和15b的纳武单抗、图16a和16b的派姆单抗以及图20的伊匹单抗)。实施例6:抗dectin-2佐剂缀合物的制备及其体外活性的评估另外的抗体佐剂缀合物的制备:使用实施例1和2中所述的方法制备另外的抗体佐剂缀合物。使用抗dectin-2抗体(clec6a)和同型大鼠igg2a产生具有sata-smcc连接子的抗体-佐剂缀合物(参见上述的方案3)。如上述实施例3中所述研究在该免疫缀合物刺激后在鼠单核细胞衍生的apc中引发细胞因子分泌的能力。具体地讲,对于gm-csf预处理的单核细胞,其用免疫缀合物或等量的未缀合组分刺激18小时,细胞因子产生如图21所示。数据表明免疫缀合物分化的细胞比等量的组分(单独的佐剂、单独的抗体和对照抗体缀合物)分泌更高量的tnfα、il-6和il-12p70(参见图21)。dectin-2和clec5a是c-型凝集素受体,其在受体交联后分别与衔接蛋白fcrγ(fcer1g)和dap12(tyrobp)缔合并通过其发出信号。这些衔接蛋白含有基于免疫受体酪氨酸的活化基序(itam),其通过syk依赖性途径介导下游信号传导,导致免疫细胞活化(即细胞因子产生、共刺激分子表达、抗原呈递等)。如图(图21和图23)所示,针对这些受体的免疫缀合物通过同时接合itam偶联受体(通过抗原结合结构域)和其他信号传导途径(通过佐剂部分,例如tlr7/8)表现出协同的免疫刺激作用。靶向与fcrγ和/或dap12缔合的其他受体的免疫缀合物,或含有相似信号传导结构域(例如hemitam)的免疫缀合物可以以类似的方式制备,并预期显示出类似的效果。实施例7:tlr7/8佐剂的合成采取以下步骤制备tlr7/tlr8佐剂(方案1,化合物1),其适于与抗体缀合以形成本发明的免疫缀合物。在配备有xevoxsqtof光谱仪检测器的uplc系统(watersacquity)上确认了产品的质量数。将溶解在乙腈∶水中的样品载样到beh200c18柱(2.1mm直径×50mm长度)上,用10-90%梯度的乙腈∶水洗脱5分钟。方案4将冷却的(0℃)硝酸(70%,160ml)缓慢加入到在冰浴中搅拌的喹啉-2,4-二醇i(100g,621mmol)的冰醋酸(600ml)溶液中。从冰浴中取出混合物,之后升温至室温。在室温下搅拌30分钟。在80℃下加热1.5小时,之后将混合物冷却至0℃。向混合物中缓慢加入1l水以沉淀出黄色固体。剧烈搅拌15分钟,之后过滤。将固体重悬于水(1l)中并剧烈搅拌15分钟,之后过滤。通过重复缓慢添加固体nahco3的额外步骤以使ph>6,之后过夜抽滤。将固体重悬于乙醚(750ml)中并剧烈搅拌以产生细悬浮液。过滤并重复。过夜抽滤以干燥。产生112gii(88%)黄色固体。方案5在室温下,向pocl3(300ml)中缓慢加入二异丙基乙胺(63ml,47g,0.36mol,2.5当量)。在ar的覆盖下将混合物加热至80℃。在30分钟内缓慢加入2g硝基二醇ii(30g,145mmol,1当量),保持温度低于95℃。添加完成后,将温度升至110℃并加热1小时。将反应冷却至0℃,之后在剧烈搅拌下分次缓慢倒入冰中。加入冷水至最终体积为1.2l,之后剧烈搅拌。倾析含水母液并向深色固体中加入1l水,从烧瓶壁上刮下粘性固体以产生悬浮液。必要时重复以获得过滤的固体。将固体重悬于1l水中,之后缓慢加入固体nahco3直至ph>6。过滤固体,之后溶解在etoac(500ml)中。通过硅藻土过滤etoac溶液以除去不溶的黑色杂质。用饱和nahco3、水、盐水洗涤滤液,之后分离,用na2so4干燥有机层,过滤并真空浓缩。将形成的棕色固体用3∶1己烷/乙醚(500ml)研磨、过滤。棕褐色固体iii(22g,30mmol,62%)原样用于下一反应。方案6在0℃下,在30分钟内向硝基-二氯化合物iii(22g,62mmol,1当量)和固体k2co3(17g,124mmol,2当量)的dmf(250ml)溶液中缓慢加入n-boc-1,4-二氨基丁烷(12.8g,1.1当量)的dmf(60ml)溶液。加完后,将反应温热至室温并再搅拌30分钟。加入水(800ml)并剧烈搅拌混合物。倒出上清液,将湿固体溶于乙酸乙酯(500ml)中。将溶液用水、盐水洗涤、分离、干燥(na2so4)、过滤并真空浓缩。将棕色固体用1∶1己烷/乙醚(400ml)研磨并过滤,得到黄色固体iv(17g,43mmol,69%),将其用于下一反应。方案7在0℃下,向硝基-氨基化合物iv(17g,43mmol,1当量)在甲醇(400ml)和水(60ml)中的溶液中加入nicl2·6h2o(0.51g,2.2mmol,0.05当量)。加入硼氢化钠(粒料,3.2g,86mmol,2当量)并将反应在0℃下搅拌1小时,之后升温至室温并再搅拌15分钟。分次加入冰醋酸以中和任何未反应的nabh4,直至获得约5的ph。将溶液通过硅藻土层过滤以除去黑色不溶物质。真空除去溶剂。将深棕色固体用乙醚研磨,之后过滤,得到褐色固体v(13.3g,37mmol,85%),将其原样用于下一反应。方案8在室温下搅拌下,向二氨基化合物v(13.3g,37mmol,1当量)的含有二异丙基乙胺(7.17g,9.7ml,56mmol,1.5当量)的dmf(250ml)溶液中加入纯的戊酰氯(5.5ml,5.5g,42mmol,1.2当量)。将混合物搅拌30分钟,之后加入冰,之后加入水至终体积为1l。剧烈搅拌混合物直至形成澄清的上清液。倒出上清液,将粗固体溶于乙酸乙酯(400ml)中,并通过硅藻土层过滤。将滤液用水(400ml)、盐水(400ml)洗涤、分离、之后干燥(na2so4)、过滤并浓缩。将固体用乙醚研磨、过滤并抽吸干燥。得到的棕色固体vi(13.9g,31mmol,84%)原样用于下一步反应。方案9在装有dean-stark装置的500ml圆底烧瓶中,将酰胺vi(13.9g,31mmol,1倍等量)和2-氯苯甲酸(2.4g,15.5mmol,0.5当量)的混合物在150ml甲苯(浴温为170℃)中回流4小时。撤去dean-stark装置和冷凝器,直至80-90%的甲苯蒸发。加入2,4-二甲氧基苄胺(25g,150mmol,5当量),并将反应在120℃下连续加热1.25小时。将反应冷却,粗混合物用1∶1meoh/水(1l)稀释并剧烈搅拌。倾析上清液(除去大部分过量的2,4-二甲氧基苄胺),将粗产物在水和乙酸乙酯之间分配。加入乙酸直至水层的ph为5-6。将有机层用水、盐洗涤、干燥(na2so4)、过滤并浓缩。将浓棕色糖浆溶解在乙醚中并过滤除去灰色固体(不是产物)。除去乙醚,得到棕色浆状物(14.4g,26mmol,73%),并原样用于下一步反应。方案10向物质vii(14.4g,26mmol,1当量)中加入水(60ml)并缓慢旋转浓hcl(60ml)。将混合物在室温下剧烈搅拌30分钟,之后加热回流1小时。将反应在冰浴中冷却,并在30分钟内分批加入固体naoh粒料(28g,700mmol),直至达到碱性ph。将溶液温热至室温并剧烈搅拌。加入固体nacl直至达到饱和溶液。将该水层用10%异丙醇/二氯甲烷(400ml)萃取3次。将合并的有机层干燥(na2so4)、过滤并浓缩,得到棕色固体viii(6.8g,22mmol,79%)。实施例8:免疫缀合物的合成方案11本实施例提供了使用tfp酯方法合成免疫缀合物的指导。将化合物viii(311mg,1mmol)溶于10ml二甲基甲酰胺(dmf)中,之后加入2摩尔当量的二异丙基乙胺(dipea)。将smcc连接子(1.5mmol)溶解在10ml二氯甲烷中并一次性加入到viii中。将反应在20℃下搅拌过夜,并经由旋转蒸发浓缩至干。使用装有12g一次性柱的buchi快速色谱系统在硅胶上纯化粗产物ix,并用0-10%甲醇梯度洗脱15分钟。合并纯馏分并蒸发至干,得到160mg淡黄色固体ix。方案12将化合物ix(0.1mmol,53mg)溶解在10ml二氯甲烷中,之后一次加入2当量巯基乙酸。将混合物在真空下浓缩至干,残余物用5ml二乙醚洗涤三次。方案13将化合物x(6.2mg,0.01mmol)溶解在2mlthf中,之后加入5mg四氟苯酚。之后加入5mg二环己基碳二亚胺(dcc)。将混合物在室温下搅拌过夜,之后在真空下浓缩至干。经由快速色谱在硅胶(4g预填充柱),用0-10%甲醇的二氯甲烷溶液洗脱,纯化粗产物xi。合并纯馏分并蒸发,得到3.6mg纯xi(通过lc/ms确认)。之后将tfp酯xi用于下述的抗体缀合步骤。方案14将igg1抗体(具体为抗cd20抗体利妥昔单抗)的缓冲液更换为ph7.2的pbs并稀释至10mg/ml(66μm)。将tfp活化的佐剂xi加入dmso中,并将6摩尔当量(相对于igg)一次性加入1ml抗体溶液(10mg)中。将混合物倒置数次以混合并在20℃下孵育过夜。使用pd10尺寸排阻色谱柱,经由交换到pbs(ph7.2)缓冲液中将所得免疫缀合物(“bb-01”)纯化。合并纯馏分,通过在超微量分光光度计上测量280nm处的吸光度来确定浓度。基于回收的蛋白质,产率为8毫克或约80%。将免疫缀合物产物通过0.2μm注射过滤器无菌过滤,并在4℃下储存直至需要。使用配备有xevoxsqtof质谱检测器的uplc系统(watersaquity),经由液相色谱-质谱(“lc/ms”)分析进行所得免疫缀合物的药物与抗体比值(“dar”)的表征。经由将5μg免疫缀合物载样到beh200c4柱(2.1mm直径×50mm长度)上,用10-90%梯度的乙腈∶水洗脱4分钟,进行分析。分析表明,经由tfp方法合成的免疫缀合物显示出比使用sata方法合成的免疫缀合物更高的dar。此外,与sata合成方法(约20%)相比,tfp方法产生具有更低量的未缀合抗体(仅约5%)的免疫缀合物(比较图1a和1b)。进行bb-01的尺寸排阻色谱(“sec”)分析以确定单体纯度。使用pbs(ph7.2)用0.2ml/min洗脱速度在beh200sec柱上进行分析。使用tfp活性酯方法合成的免疫缀合物bb-01含有少于2%的高分子聚集体(图2b),而使用sata方法时观察到的聚集体大于8%(图2a)。实施例9:用五氟苯酚(“pfp”)酯合成免疫缀合物bb-14方案15本实施例提供了使用pfp酯方法合成免疫缀合物的指导。在上述方案12中显示了佐剂的酯修饰和修饰的佐剂与抗体的缀合。将反式-1,4-二羧酸环己烷(1g)溶于10ml二甲基甲酰胺(“dmf”)中,加入1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶-3-氧化六氟磷酸盐)(“hatu”)(1mmol),之后加入1mln-乙基-n-(丙-2-基)丙-2-胺(“dipea”)。加入化合物1(311mg),将混合物在20℃下搅拌过夜。将反应混合物用50ml二氯甲烷(“dcm”)稀释,并用20ml1n盐酸清洗。将dcm层蒸发至干,并将产物在硅胶上纯化,用含有1%乙酸的0-10%甲醇的dcm溶液洗脱。浓缩纯馏分,得到220mg纯化的酸ii。将化合物ii(100mg)溶解于thf中,加入100mghatu,之后加入200μldipea。加入2当量氨基-peg2-叔丁基-羧酸酯并在20℃下搅拌1小时。将混合物浓缩至干,加入10毫升4nhcl的二氧杂环己烷溶液。将混合物浓缩至干燥,通过制备型hplc纯化粗产物iii,得到40mg化合物iii。如下所述将化合物iii转化为pfp酯iv。将化合物iii(35mg)加入到50mgpfp的5mlthf溶液中,加入5mldmf,之后加入20mgdcc。加入dmap(2-3mg)并将溶液在20℃下搅拌过夜。浓缩反应物并通过快速色谱法纯化(用0-10%甲醇洗脱),从1∶2乙腈水中冷冻干燥后得到17mgpfp酯iv。将pfp酯iv(相对于igg的6摩尔当量)加入到20mgigg抗体(具体为抗cd20抗体利妥昔单抗)(pbs中浓度为10mg/ml)中并在37℃下孵育过夜。将得到的免疫缀合物bb-14的缓冲液更换为pbs(ph7.2)以除去过量的小分子试剂,并在分光光度计上测定浓度。产率为15mg免疫缀合物(75%产率)。将产物储存在4℃。经由lc/ms分析确定dar为2.2。除了期望的dar和高收率之外,产物还具有通过sec分析确定的少量杂质(参见图除了理想的dar和高产率外,通过sec分析测定产物仅具有很少的杂质(参见图3和4)。实施例10:用nhs酯合成免疫缀合物bb-15方案16在上述方案13中显示了佐剂的酯修饰和修饰的佐剂与抗体的缀合。将化合物vii(150mg)溶于20ml四氢呋喃(“thf”)中,并加入10ml饱和碳酸氢钠水溶液。之后,一次性加入50mg琥珀酸酐,并将混合物在室温下搅拌1小时。缓慢加入20毫升1n盐酸,用2×50ml二氯甲烷萃取混合物。将合并的有机萃取液蒸发至干。使用4g硅胶柱,用0-15%甲醇(1%乙酸)洗脱15分钟,纯化粗产物(suc-vii)。合并纯馏分并蒸发,得到190mg纯vii-suc。将化合物vii-suc(150mg)溶于10mldmf中,加入1当量hatu,之后加入2当量dipea。加入1.5当量甘氨酸-otbu并搅拌过夜。蒸发dmf,用5ml1n盐酸的二氧杂环己烷溶液处理残余物30分钟。蒸发溶剂,在4g硅胶柱上对粗制gly-suc-vii快速纯化,用0-10%甲醇洗脱10分钟。蒸发纯馏分,得到110mggly-suc-vii;将纯物质溶于dmf中,重复上述过程,得到60mg纯gly2-suc-vii。将纯gly2-suc-vii(30mg)溶于5mldmf中,加入1.5当量nhs,之后加入5mlthf。加入dcc(1.5当量)并将混合物在室温下搅拌过夜。蒸发溶剂,在硅胶上对粗制nhs酯快速纯化,用0-10%甲醇的dcm溶液洗脱10分钟。将纯馏分(通过tlc测定)合并并蒸发,在乙腈水中冷冻干燥后得到1mg纯nhs-gly2-suc-vii。将纯nhs酯溶解在dmso中以制备20mm溶液,将6当量加入2mligg抗体(具体为抗cd20抗体利妥昔单抗)(pbs中浓度为10mg/ml)中。将缀合反应在室温下孵育过夜,并将缓冲液更换为新制的pbs以除去过量的佐剂。将纯化的免疫缀合物bb-15无菌过滤并储存在4℃下。产量约为约16mg。除具有高产率之外,lc/ms分析显示出高纯度水平、低聚集水平和理想的dar比(参见图5和6)。实施例11:用tfp酯合成免疫缀合物方案17本实施例提供了使用tfp酯方法合成具有不同连接子的免疫缀合物的指导。在上述方案14中显示了佐剂的酯修饰和修饰的佐剂与抗体的缀合。将化合物vii(311mg,1mmol)溶于10mldmf中,之后加入0.3mldipea。将nhs-peg5-酸(1.2当量)溶解在5ml二氯甲烷中并一次性加入到化合物vii中。将混合物在室温下搅拌过夜,之后浓缩至干。在纯馏分浓缩后,经由硅胶色谱法在4g柱上纯化粗残余物,用含有1%乙酸的0-10%甲醇的dcm溶液洗脱10分钟,得到260mg(57%产率)的peg5-vii。将peg5-vii(50mg)溶于10mldmf中,加入1.5当量tfp,之后加入1.2当量dcc和5mgdmap。将反应物搅拌过夜,浓缩至干燥并使用4g硅胶柱纯化,用0-10%甲醇的dcm溶液洗脱,在1∶2乙腈水中冷冻干燥后得到35mg纯tfp-peg5-vii。将tfp酯(tfp-peg5-vii)溶解在dmso中以制备20mm储备溶液,并添加到pbs中浓度为10mg/ml的20mgigg抗体(具体为抗cd20抗体利妥昔单抗)。使缀合反应在室温下过夜进行。将得到的免疫缀合物的缓冲液更换为(ge,pd10脱盐柱)ph7.4的pbs。使用2μm注射过滤器对纯化的免疫缀合物进行无菌过滤,并在4℃下储存。lc/ms分析证实该处理方法为每个抗体提供了2.9个佐剂的dar(参见图7)。sec分析显示最小量的聚集体(即小于2%)(参见图8)。实施例12:另一种tlr7/tlr8佐剂的合成本实施例提供了关于如何合成另一种tlr7/8佐剂的指导。从实施例3的方案8的化合物vi开始合成化合物xiv。方案18将化合物vi(2g)溶于含20%干乙酸的甲苯中,并加热至75℃过夜。真空除去溶剂,得到2g粗化合物xi。使用化合物xi而无需进一步纯化。将化合物xi(2g)溶解在20mldmf中,缓慢加入1.2当量nah(50%分散体),并将混合物在室温下搅拌30分钟。一次性加入甲基碘(2当量),并将反应混合物在室温下搅拌过夜。将反应浓缩至干燥,并经由快速色谱纯化产物。产物用0-10%甲醇的二氯甲烷溶液梯度洗脱15分钟。合并纯馏分并浓缩,得到1g化合物xii(2步收率50%)。方案19将化合物xii(10g)溶于10ml纯二甲氧基苄胺(“dmba”)中并加热至120℃保持3小时。冷却反应混合物并用100ml乙酸乙酯稀释。将所得溶液用10%柠檬酸水溶液清洗两次、用水清洗一次以除去过量的dmba。将有机层用mgso4干燥并真空浓缩,得到粗化合物xiii,为棕色油状物。将dmb衍生的粗品,化合物xiii,溶于二氯甲烷中,加入2ml4n盐酸的二氧杂环己烷溶液。2小时后,将反应混合物浓缩至干,将粗盐酸盐化合物xiv溶于3ml甲醇中。在搅拌下将乙醚(20ml)缓慢加入粗溶液中,形成白色沉淀。过滤反应物,用10ml乙醚清洗白色固体产物两次,真空干燥,得到4g盐酸盐化合物xiv。lc/ms分析确认准确的分子量(m/z=326.5)和大于95%的纯度。实施例13:用tfp酯合成免疫缀合物bb-26方案20本实施例提供了使用tfp酯方法合成含有芳基叔胺连接子的免疫缀合物的指导。将实施方案12的化合物xiv(300mg)溶于thf(10ml)中,加入1.2当量nah(50%分散体)。将混合物搅拌15分钟并加入2当量4-溴甲基苯基乙酸。将反应在室温下搅拌过夜并浓缩至干。加入1ml乙酸,产物通过制备型hplc在c-18柱上纯化,用10-90%乙腈水溶液(0.1%tfa)梯度洗脱20分钟,得到165mg纯化的苯乙酸化合物xv。将化合物xv(50mg)溶于二氯甲烷/二甲基甲酰胺(5ml,1∶1)中,加入2当量tfp,之后加入1.5当量1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(“edci”)。将反应物在室温下搅拌过夜,产物经由快速色谱法在4g硅胶柱上纯化,用0-10%异丙醇洗脱10分钟。将纯馏分浓缩并在30%乙腈水中冻干,得到21mg纯化的tfp酯化合物xvi,为浅黄色固体。通过lc/ms(m/z=621.7)确认分子量和纯度。与抗体的缀合:将tfp酯xvi溶解在无水dmso中以制备20mm储备溶液,将6摩尔当量(相对于抗体)加入20mgigg抗体(具体为抗cd20抗体利妥昔单抗)(pbs中浓度为10mg/ml)中。将缀合反应在4℃下孵育过夜。将得到的免疫缀合物bb-26的缓冲液更换为pbs(ph7.2)以除去过量的小分子量试剂。通过在nanodrop1000分光光度计上测量280nm处的抗体来确定最终浓度。产率为15mg的bb-26,或基于回收蛋白的75%。如图12a所示,通过sec分析检测到最小聚集体(小于1%)。如图12b所示,经由lc/ms分析测定,产物的dar比为2.8。将纯化的免疫缀合物bb-26通过0.2μm无菌过滤器过滤并储存在-20℃下。实施例14:用tfp酯合成免疫缀合物bb-27方案21本实施例提供了使用tfp酯方法合成含有烷基叔胺连接子的免疫缀合物的指导。将化合物xiv(200mg)溶解在甲醇(20ml)中,加入3当量1-甲酰基-7-叔丁基庚酸酯,之后加入1.1当量的nacnbh4。将混合物在室温下搅拌1.5小时并浓缩至干。加入tfa(5ml)并将混合物在室温下搅拌过夜。真空蒸发tfa,粗产物通过制备型hplc在c-18柱上纯化。产物用10-90%乙腈水溶液(0.1%tfa)梯度洗脱20分钟,得到110mg纯化的酸化合物xvii(通过lc/ms确认)。将化合物xvii(50mg)溶于二氯甲烷/二甲基甲酰胺(5ml,1∶1)中,加入2当量tfp,之后加入1.5当量edci。将反应在室温下搅拌过夜。粗制tfp酯产物xviii经由快速色谱法在4g硅胶柱上纯化,用0-10%异丙醇洗脱10分钟。浓缩纯馏分,将残余物在30%乙腈水中冻干,得到14mg纯化的tfp酯化合物xviii,为白色固体。通过lc/ms(m/z=601.7)确认分子量和纯度。与抗体的缀合:将tfp酯xviii溶解在无水dmso中以制备20mm储备溶液,将8摩尔当量(相对于抗体)加入20mgigg抗体(具体为抗cd20抗体利妥昔单抗)(pbs中浓度为10mg/ml)。将缀合反应在4℃下孵育过夜。将得到的免疫缀合物bb-27的缓冲液更换为pbs(ph7.2)以除去过量的小分子量试剂。通过在nanodrop1000分光光度计上测量280nm处的抗体来确定最终浓度。产率为16mg免疫缀合物bb-27(80%)。通过sec分析检测到的最小聚集体(小于1%)。经由lc/ms分析测定,产物的dar比率为2.5。将纯化的bb-27通过0.2μm无菌过滤器过滤并储存在-20℃下。实施例15:用tfp酯合成免疫缀合物bb-36方案22本实施例提供了使用tfp方法合成含有peg叔胺连接子的免疫缀合物的指导。将化合物xiv(200mg)溶于甲醇(20ml)中,加入3当量醛xix,之后加入1.1当量nacnbh4。将混合物在室温下搅拌3小时并浓缩至干。加入三氟乙酸(tfa,10ml)并将反应在室温下搅拌2小时。真空蒸发tfa,粗产物通过制备型hplc在c-18柱上纯化。冷冻干燥合并的纯馏分后(通过lc/ms确认),产物用10-90%乙腈水溶液(0.1%tfa)梯度洗脱20分钟,得到85mg纯化的酸xx。将化合物xx(80mg)溶于二氯甲烷/二甲基甲酰胺(5ml,1∶1)中,加入2当量tfp,之后加入1.2当量edci。将反应在室温下搅拌过夜。粗制tfp酯产物xxi经由快速色谱法在4g硅胶柱上纯化,用0-10%异丙醇洗脱10分钟。浓缩纯馏分,将残余物在30%乙腈水中冻干,得到45mg纯化的tfp酯化合物xxi,为米色固体。通过lc/ms(m/z=647.7)确认分子量和纯度。与抗体的缀合:将tfp酯化合物xxi溶解在无水dmso中以制备20mm储备溶液,将8摩尔当量(相对于抗体)加入igg1抗体(具体为抗cd20抗体利妥昔单抗)(pbs中浓度为10mg/ml)。将缀合反应在4℃下孵育过夜。将得到的免疫缀合物bb-36的缓冲液更换为pbs(ph7.2)以除去过量的小分子量试剂。通过在nanodrop1000分光光度计上测量280nm处的抗体来确定最终浓度。产率为15mg免疫缀合物bb-36(75%),将其储存在4℃下直至使用。通过sec分析检测到的最小聚集体(小于1%)。经由lc/ms分析测定,产物的dar比率为2.2。将纯化的免疫缀合物bb-36通过0.2μm无菌过滤器过滤并储存在-20℃下。实施例16:用tfp酯合成免疫缀合物bb-45方案23本实施例提供了使用tfp酯方法合成具有不同连接子的免疫缀合物的指导。将化合物vii(311mg,1mmol)溶于10mldmf中,并加入0.3mldipea。在单独的容器中,将1.2当量7-甲氧基-7-氧代庚酸溶解在5ml的dmf中,并加入1.5当量dipea,之后加入hatu(1.2当量)。将混合物加入到vii中并在室温下搅拌过夜。将反应混合物在真空下浓缩至干,将残余物溶于10ml四氢呋喃∶水(1∶1)中。加入1ml2m氢氧化锂水溶液,并将反应在室温下搅拌2小时。经由旋转蒸发除去thf,并通过加入10ml1m盐酸酸化水溶液。将水溶液用二氯甲烷(20ml)萃取2次,合并有机层,用硫酸镁干燥。过滤溶液,将滤液浓缩至干。粗产物22经由硅胶色谱法在4g柱上纯化,用0-10%异丙醇的dcm溶液(w/1%乙酸)洗脱10分钟。合并纯馏分并浓缩,得到220mg纯的22,为浅黄色固体。将化合物22(50mg)溶于二氯甲烷/二甲基甲酰胺(5ml,1∶1)中,加入2当量tfp,之后加入1.5当量edci。将反应在22℃下搅拌过夜,将粗反应浓缩至干。产物经由快速色谱法在4g硅胶柱上纯化,用0-10%异丙醇洗脱10分钟。浓缩纯馏分,将残余物在30%乙腈水溶液中冻干,得到21mg纯化的tfp酯23,为浅黄色固体。通过lc/ms确认分子量和纯度。与抗体的缀合:将tfp酯23溶解在无水dmso中以制备20mm储备溶液,将6摩尔当量(相对于抗体)加入20mgigg抗体(具体为抗cd20抗体利妥昔单抗)(pbs中浓度为10mg/ml)。将缀合反应在4℃下孵育过夜。将得到的免疫缀合物bb-45的缓冲液更换为pbs(ph7.2)以除去过量的小分子量杂质。通过在thermonanodrop1000分光光度计上测量280nm处的吸光度来确定最终浓度。产率为14mg的bb-45,或基于回收蛋白的70%。通过sec分析检测到最小聚集体(小于1%),并经由lc/ms分析确定2.8的dar。将纯化的免疫缀合物通过0.2μm无菌过滤器过滤并储存在-20℃下。实施例17:用tfp酯合成免疫缀合物bb-24方案24本实施例提供了使用tfp酯方法合成具有不同连接子的免疫缀合物的指导。将化合物vii(150mg)溶于20mlthf中,并加入10ml饱和碳酸氢钠水溶液。一次性加入琥珀酸酐(50mg),将混合物在室温下搅拌1小时。缓慢加入20ml1n盐酸,用2×50ml二氯甲烷萃取混合物,蒸发合并的有机萃取物至干。使用4g硅胶柱,用0-15%甲醇(1%乙酸)洗脱15分钟,纯化粗产物(24)。合并纯馏分并蒸发,得到180mg纯24。将150mg24溶于dmf(10ml)中,加入1当量hatu,之后加入2当量dipea。加入1.5当量甘氨酸-otbu并搅拌过夜。蒸发dmf,并在搅拌下用5ml1n盐酸的二氧杂环己烷溶液处理残余物30分钟。蒸发溶剂,在4g硅胶柱上对粗制残余物快速纯化,用0-10%异丙醇洗脱15分钟。蒸发纯馏分,得到110mg纯25。将化合物25(50mg)溶于10mldmf,加入1.5当量tfp,之后加入1.2当量dcc和2mgdmap。将反应物搅拌过夜,浓缩至干燥并在硅胶(4g柱)上纯化,用0-10%ipa的dcm溶液洗脱,在1∶3乙腈水中冷冻干燥后,得到32mg纯tfp酯,化合物26。与抗体的缀合:将tfp酯(化合物26)溶解在无水dmso中以制备20mm储备溶液,并将5倍摩尔当量(相对于抗体)加入20mg抗体(pbs中浓度为10mg/ml)。将缀合反应在4℃下孵育6小时。将得到的免疫缀合物bb-24的缓冲液更换为pbs(ph7.4)以除去过量的小分子量杂质。通过在nanodrop1000分光光度计上测量280nm处的吸光度来确定最终蛋白浓度。产率为15mg(基于回收蛋白75%)sec分析检测到最小聚集体小于1%,并经由lc/ms分析确定dar为每个抗体2.8个佐剂。将纯化的免疫缀合物通过0.2μm无菌过滤器过滤并储存在-20℃下直至需要。实施例18:用tfp酯合成免疫缀合物bb-37方案25本实施例提供了使用tfp方法合成具有不同连接子的免疫缀合物的指导。将化合物vii(155mg,0.5mmol)溶于10mldmf中,并加入0.2mldipea。在单独的容器中,将1.2当量peg2-二羧酸单甲酯溶解在5ml的dmf中,并加入2当量dipea,之后加入hatu(1.2当量)。将混合物加入到vii中并在室温下搅拌1小时。将反应混合物真空浓缩至干,将残余物溶于thf(5ml)中。加入等体积的水,之后加入2ml1mlioh水溶液。将混合物搅拌过夜,之后加入10ml1n盐酸。将酸化的混合物用二氯甲烷萃取2次,经硫酸钠干燥,浓缩至干燥并经由硅胶色谱法纯化。产物用0-10%甲醇洗脱10分钟。合并纯馏分并浓缩,得到110mg纯的化合物27,为浅黄色固体。将化合物27(50mg)溶于二氯甲烷/二甲基甲酰胺(5ml,1∶1)中,加入2当量tfp,之后加入1.5当量edci。将反应在环境温度下搅拌过夜,并将反应浓缩至干。粗制tfp酯28经由快速色谱法在4g硅胶柱上纯化,用0-10%异丙醇洗脱10分钟。浓缩纯馏分,将残余物在30%乙腈水溶液中冻干,得到41mg纯化的tfp酯23,为白色固体。通过lc/ms确认分子量和纯度。与抗体的缀合:将tfp酯28溶解在无水dmso中以制备20mm储备溶液,将8摩尔当量(相对于抗体)加入20mligg抗体(具体为抗cd20抗体利妥昔单抗)(pbs中浓度为10mg/ml)。将缀合反应在4℃下孵育过夜。将得到的免疫缀合物bb-37的缓冲液更换为pbs(ph7.2)以除去过量的小分子量杂质。通过在thermonanodrop1000分光光度计上测量280nm处的吸光度来确定最终浓度。产率为16mg缀合的免疫缀合物bb-37,或基于回收蛋白的70%。通过sec分析检测到最小聚集体(小于1%),并经由lc/ms分析确定2.3的dar。将纯化的免疫缀合物通过0.2μm无菌过滤器过滤并储存在-20℃下。实施例19:另一种tlr7/8佐剂的合成方案26本实施例提供了另一种tlr激动剂合成的指导。化合物29是化合物vii类似物,其含有用于连接子附接的哌嗪侧链。使用先前描述的用于合成化合物vii的方法合成它,不同之处在于用boc保护的哌嗪类似物代替合成步骤3中使用的boc-二氨基丁烷。化合物29的一般合成路线在方案23中概述。哌嗪侧链的添加使得能够合成由于不稳定性而先前不可获得的免疫缀合物。含有琥珀酸酯连接子的类似化合物vii类似物在tfp活化时易于环化,而哌嗪防止环化。此外,哌嗪基团内的叔氨基基团在连接子连接和缀合后保持正电荷在该位置的正电荷对于改善tlr8效力十分重要。随后将化合物29用于合成免疫缀合物,如下述实施例19-21中所述。实施例20:用tfp酯合成免疫缀合物bb-42方案27本实施例提供了使用tfp酯方法合成具有不同连接子的免疫缀合物的指导。将化合物29(100mg)溶解在10mlthf中,加入2ml饱和碳酸氢钠水溶液,之后加入10ml水。一次性加入琥珀酸酐(50mg),并将混合物在室温下搅拌。1小时后,缓慢加入20ml1n盐酸,用2×50ml二氯甲烷(“dcm”)萃取反应混合物。将合并的有机萃取液蒸发至干。使用4g硅胶柱,用0-15%异丙醇的dcm溶液(1%乙酸)洗脱15分钟,纯化粗产物30。合并纯馏分并蒸发至干,得到80mg纯酸30。将化合物30(50mg)溶于二氯甲烷/二甲基甲酰胺(5ml,1∶1)中,加入2当量tfp,之后加入1.5当量edci。将反应在环境温度下搅拌过夜,并将反应浓缩至干。经由快速色谱法纯化粗tfp酯31,并用0-10%异丙醇洗脱10分钟。浓缩纯馏分,将残余物在30%乙腈水溶液中冻干,得到41mg纯化的tfp酯31,为白色固体。通过lc/ms确认分子量和纯度。如先前针对bb-24所述,将tfp酯31缀合至igg1抗体(具体为抗cd20抗体利妥昔单抗)以产生bb-42。bb-42的sec和lc/ms分析确认了分子量、高单体纯度、聚集体小于2%、dar为1.7(见图20a-b)。实施例21:用tfp酯合成免疫缀合物bb-43和bb-44方案28本实施例提供了使用tfp酯方法合成具有不同连接子的免疫缀合物的指导。将化合物30(方案25)与含有2或8个peg单位的聚乙二醇(peg)连接子偶联,以延长佐剂和抗体之间的距离。使用先前描述的用于连接子连接和tfp活化的方案进行peg连接子延伸的连接。简言之,将100mg化合物30溶于10mldmf中,加入0.2mldipea,之后加入hatu(1.2当量)。1小时后,加入合适的氨基peg连接子(n=2或8)并在室温下再搅拌2小时。将反应混合物在真空下浓缩至干,残余物经由制备型hplc在c-18柱上纯化,用10-90%乙腈水溶液洗脱30分钟。合并纯馏分并冻干,得到65mg和45mg中间体31或32,为透明玻璃状物质。使用先前描述的方案将化合物31和32转化为相应的tfp酯33和34。简言之,将游离酸31或32(50mg)溶解在二氯甲烷/二甲基甲酰胺(5ml,1∶1)中,加入2当量tfp,之后加入1.5当量edci。将混合物在室温下搅拌过夜,并浓缩至干,得到粗tfp酯33和34。经由硅胶快速色谱法纯化粗tfp酯,用0-10%异丙醇洗脱10分钟。浓缩纯馏分,将残余物在30%乙腈水溶液中冻干,得到纯化的tfp酯33和34,为透明固体。通过lc/ms确认该纯化合物的分子量和纯度。与抗体的缀合:使用先前描述的方案将tfp酯33和34缀合至igg1抗体(具体为抗cd20抗体利妥昔单抗)。将tfp酯溶解在无水dmso中以制备20mm储备溶液,并将8倍摩尔当量(相对于抗体)加入20mgigg抗体(pbs中浓度为10mg/ml)。将缀合反应在4℃下孵育12小时。将得到的免疫缀合物bb-43和bb-44的缓冲液更换为pbs(ph7.4)以除去过量的小分子量杂质。通过在nanodrop1000分光光度计上测量280nm处的吸光度来确定最终蛋白浓度。产率基于回收蛋白为75%。sec分析检测到存在最小聚集体,并经由lc/ms分析确认每个抗体有1.0和1.7个佐剂的dar。将纯化的免疫缀合物通过0.2μm无菌过滤器过滤并储存在-20℃下直至需要。实施例22:免疫缀合物体外活性的评估人抗原呈递细胞的分离:使用含有针对cd14、cd16、cd40、cd86、cd123和hla-dr的单克隆抗体的rosettesep人单核细胞富集混合物(stemcelltechnologies)通过密度梯度离心从健康献血者(stanfordbloodcenter)获得的人外周血单核细胞中阴性选择人抗原呈递细胞(apc)。随后使用easysep人单核细胞富集试剂盒经由阴性选择将未成熟的apc纯化至>97%纯度,所述试剂盒无cd16损耗,其含有针对cd14、cd16、cd40、cd86、cd123和hla-dr的单克隆抗体。肿瘤细胞的制备:将肿瘤细胞重悬于含有0.1%胎牛血清(fbs)的pbs中,浓度为1至10×106细胞/ml。随后将细胞与2μmcfse一起孵育以产生1μm的终浓度。2分钟后,经由加入10ml含10%fbs的完全培养基终止反应,并用完全培养基清洗一次。将细胞固定在2%多聚甲醛中并用pbs清洗三次或保持未固定,之后将细胞在10%dmso、20%fbs和70%培养基中冷冻。apc-肿瘤共培养物:将2×105个apc与或不与6.5×105个同种异体cfse标记的肿瘤细胞一起在含有imdm培养基(gibco)的96孔板(corning)中孵育,所述培养基补充有10%胎牛血清、100u/ml青霉素、100μg/ml链霉素、2mml-谷氨酰胺、丙酮酸钠、非必需氨基酸,并且如果需要,还有根据上述实施例制备各种浓度的未缀合的cd20抗体和本发明的免疫缀合物。18小时后,经由流式细胞术或elisa分析细胞和无细胞上清液。该测定的结果显示在图9a-9f的bb-17和bb-01中。具体地将,这些图显示根据方案11和14制备的bb-17和bb-01引发骨髓激活,而作为对照的未缀合的cd20抗体则不引发骨髓激活。此外,图23a-d显示bb-14引发骨髓激活,如cd14、cd20、cd86和hla-dr所示,而对照则不引发骨髓激活。图24a-d显示bb-15引发骨髓激活,如cd14、cd20、cd86和hla-dr所示,而对照则不引发骨髓激活。图25a-d显示bb-27引发骨髓激活,如cd14、cd20、cd86和hla-dr所示,而对照则不引发骨髓激活。图26a-d显示bb-45引发骨髓激活,如cd14、cd20、cd86和hla-dr所示,而对照则不引发骨髓激活。图27a-d显示bb-24引发骨髓激活,如cd14、cd20、cd86和hla-dr所示,而对照则不引发骨髓激活。实施例23:bb-01与比较性缀合物irm1和比较性缀合物irm2的比较如前所述,免疫缀合物描述于美国专利8,951,528(“′528专利”)中。本实施例表明,本发明的免疫缀合物优于′528专利所公开的免疫缀合物。bb-01是根据方案15合成的。比较性缀合物irm1和irm2使用′528专利中描述的佐剂作为irm1和irm2佐剂制备。具体地讲,irm1和irm2与酰胺连接子缀合至igg抗体(具体为抗cd20抗体利妥昔单抗)。使用实施例9的测定法分析bb-01和比较性缀合物irm1和irm2。结果如图10a-10f和11a-11c所示。具体地讲,图10a-10f显示根据方案11制备的bb-01引发骨髓激活,而比较性缀合物irm1和irm2,和作为对照的未缀合的cd20抗体则不能。此外,图11a-11c显示根据方案11制备的bb-01引发细胞因子分泌,而比较性缀合物irm1和irm2,和作为对照的未缀合的cd20抗体则不能。通过lc/ms测定,比较性缀合物irm1和irm2具有过多的聚集体。图15a-c显示用0.2μm过滤器过滤后的尺寸排阻色谱的结果。比较性缀合物irm1具有4%的聚集体,并显示在4.5分钟时的第一个峰。比较缀性合物irm2具有9.5%的聚集体,并显示在4.5分钟时的第一峰。相反,bb-01仅有少量聚集体。这种差异部分是由于irm1和irm2具有的硫醇化中间体,其对于bb-01的合成不是必需的。还测试了bb-01和比较性缀合物irm1和irm2的储存稳定性。合成后,将缀合物储存在15ml锥形管中数小时。储存后,含有比较性缀合物irm2的管在管底部具有大的白色固体聚集体。含有bb-01和比较性缀合物irm1的试管仅含有透明液体,并且没有任何沉淀物。实施例24:抗化合物1抗体的产生使用胺反应性化学过程将klh(thermofisher,产品号77600)或牛血清白蛋白(thermofisher,产品号29130)与化合物1缀合。为产生兔抗体,通过向足垫注射200μg的klh-化合物1缀合物使兔子免疫,所述缀合物配制在弗氏完全佐剂中。在第一次给药后14、28和42天用另外的100μg免疫原缀合物加强动物免疫。在第35和49天收集血液、分离血清并通过elisa筛选抗化合物1抗体。用bsa-化合物1缀合物涂覆elisa板,并用过氧化物酶缀合的抗兔igg(jacksonimmunoresearch,产品号111-035-144)检测抗体。为产生鼠抗体,向c57bl/6小鼠静脉内注射100μg化合物1缀合物,之后在第一次给药后第6、12和24天重复给药。在给药后12和24天收集血液,并通过elisa筛选血清中的抗化合物1抗体。在充分检测抗体后,获取血液、脾脏和淋巴结并收集到单细胞悬浮液中。随后通过阴性选择分离b细胞并使用facs分选。如使用bsa-化合物1缀合物和荧光标记的链霉抗生物素蛋白所测量的,收集的b细胞为igg染色阳性、igm和igd染色阴性,和化合物1接合染色阳性。将分离的b细胞在完全培养基中清洗两次,之后根据制造商的说明书使用聚乙二醇1500(roche,产品号10783641001)与sp2o骨髓瘤细胞融合。在融合之前,sp2o骨髓瘤细胞维持在补充有10%fbs、谷氨酰胺和青霉素、链霉素的dmem中。将融合细胞以每孔约100,000个细胞接种在平的96孔板中。孵育1-2天后,将hat补充物和il-6加入培养基中(thermofisher,产品号21060017和gibco,产品号phc0065)。培养基在10-14天后取样,如前所述通过elisa筛选以测量抗化合物1抗体。通过限制稀释,将阳性克隆扩增、亚克隆,并进一步筛选以确认抗体产生,随后冷冻保存杂交瘤。在37℃和5%co2条件下,杂交瘤在细胞培养瓶内用10%完全培养基和90%杂交瘤-sfm(gibco,产品号12045076)培养生长。用100%杂交瘤-sfm替换培养基,并将细胞再培养3-6天。收集培养基并通过0.22μm过滤器过滤。使用hi-trapmabselectcolumns(gelifesciences,产品号28-4082-53)纯化抗体,并通过透析或脱盐柱将缓冲液更换为无菌pbs。实施例25:经由elisa检测缀合在五个案例中,由于产物异质性,抗体构建体的缀合状态不能通过lc/ms解析。为了确定缀合是否成功,使用elisa测定。用于检测抗体上佐剂存在的抗体是实施例18中描述的抗化合物1抗体。图x表明西妥昔单抗免疫缀合物、依那西普裸抗体、依那西普免疫缀合物、伊匹单抗免疫缀合物和奥滨尤妥珠单抗免疫缀合物的缀合是成功的。实施例26:与人ig-fc的人igg偶联的化合物1的elisa检测将maxysorpelisa板(fisher44-2404-21)用1μg/ml山羊抗人igg(jacksonimmunoresearch)涂覆过夜。用含有1%bsa(sigmaa7030)的pbs密封板,并用滴定的指定抗体或相应的boltbody(bb-01)缀合物孵育。用过氧化物酶缀合的山羊抗人igg(jackson)或抗化合物1的小鼠单克隆抗体,之后用过氧化物酶缀合的山羊抗小鼠igg(fc片段特异性的)检测结合的抗体。将tmb加入孔中,在用tmb终止溶液(fishernc1291012)停止反应后测量450nm的吸光度。实施例27:与大鼠抗dectin2偶联的化合物1的elisa检测将maxisorpelisa板(fisher44-2404-21)用1ug/ml大鼠抗dectin-2(invivogen)或bb-01大鼠抗dectin-2涂覆过夜。用含有1%bsa(sigmaa7030)的pbs密封板,并与滴定量的过氧化物酶缀合的山羊抗小鼠igg、重链和轻链特异性的(jackson115-035-003)共同孵育用于总igg检测,或与滴定量的兔抗化合物1抗血清共同孵育用于boltbody检测。用过氧化物酶缀合的山羊抗兔igg检测兔抗化合物1,与人、小鼠和大鼠血清蛋白的最小交叉反应性(jackson111-035-144)。将tmb加入孔中,在用tmb终止溶液(fishernc1291012)停止反应后测量450nm的吸光度。尽管为了清楚和理解的目的已通过说明和实施例详细地描述了前述内容,但是本领域技术人员将理解,可在所附权利要求的范围内实施某些改变和修改。另外,将本文提供的每篇参考文献的全部内容并入本文作为参考,其程度如同将每篇参考文献单独并入作为参考。实施例28:测定蛋白质a结合活性的方法将重复样本的利妥昔单抗或利妥昔单抗bb-37(100μl,pbs中浓度为50μg/ml)与12.5μl蛋白质a琼脂糖珠(thermofisher22810)一起孵育,旋转过夜。通过离心沉淀珠粒,除去上清液,并使用细的移液器尖端从珠粒中除去残留液体。将非还原性laemmli样品缓冲液(100μl)加入到珠粒中。将珠粒和上清液加热至90℃保持5分钟,通过sds-page(4-12%nupage凝胶,mops缓冲液)分析相等的馏分,之后用考马斯(gelcodetmblue,thermofisher)染色。分子量标准是plus2标志物(thermofisherlc5925)。如图133c所示,在利妥昔单抗bb-37中蛋白质a结合的保留表明fcrn结合的保留。实施例29:对cd16a的结合活性的测定方法将maxysorpelisa板用1.5ug/ml重组人cd16a蛋白(r&dsystems4325-fc-050)涂覆过夜。用含有1%bsa的pbs密封板,并用滴定的抗体或抗体免疫缀合物孵育。用过氧化物酶缀合的affinipuref(ab′)2片段山羊抗人igg(jackson109-036-003)检测结合的抗体。将tmb(fisherpi34028)加入孔中,在用tmb终止溶液(fishernc1291012)停止反应后测量450nm的吸光度。如图133a所示,利妥昔单抗的糖基化突变体显示出结合减弱,与效应子功能中糖基化的作用一致。实施例30:对cd64的结合活性的测定方法将maxysorpelisa板用1.5ug/ml重组人cd64蛋白(r&dsystems)涂覆过夜。用含有1%bsa的pbs密封板,并用滴定的利妥昔单抗或利妥昔单抗免疫缀合物(利妥昔单抗bb-01)孵育。使用tmb显色,用过氧化物酶缀合的affinipuref(ab′)2片段山羊抗人igg(jackson)检测结合的抗体,并在停止反应后测量450nm的吸光度。如图133b所示,利妥昔单抗已使用pngasef去糖基化,显示与cd64的结合受损。将本文引用的所有参考文献,包括出版物、专利申请和专利并入本文作为参考,其程度如同将每篇参考文献单独且具体地并入本文作为参考,并且在本文中完整地阐述。在描述本发明的上下文中(特别是在以下权利要求的上下文中)使用术语“一个”和“一个”和“该”和“至少一个”以及类似的指代应被解释为均涵盖单数和复数,除非本文另有说明或明确与上下文相矛盾。使用术语“至少一个”后跟一个或多个项目的列表(例如,“a和b中的至少一个”)应被解释为表示从列出的项目(a或b)中选择的一个项目,或所列项目(a和b)中的两个或更多个的任何组合,除非本文另有说明或明确与上下文相矛盾。除非另有说明,否则术语“包含”、“具有”、“包括”和“含有”应被解释为开放式术语(即,意味着“包括但不限于”)。除非本文另有说明,否则本文中对数值范围的描述仅旨在用作单独提及落入该范围内的每个单独值的简写方法,并且每个单独的值并入本说明书中,如同其在本文中单独引用一样。除非本文另有说明或上下文明显矛盾,否则本文所述的所有方法均可按任何合适的顺序进行。除非另外声明,否则本文提供的任何和所有示例或示例性语言(例如,“诸如”)的使用仅旨在更好地说明本发明,而不是对本发明的范围进行限制。说明书中的任何语言都不应被解释为表明任何未要求保护的要素对于本发明的实践是必不可少的。本文描述了本发明的优选实施方案,包括发明人已知的实施本发明的最佳方式。在阅读前面的描述后,那些优选实施方案的变型对于本领域普通技术人员来说可以变得显而易见。发明人期望熟练的技术人员适当地采用这些变化变型,并且发明人希望本发明以不同于本文具体描述的方式实施。因此,本发明包括适用法律允许的所附权利要求中所述主题的所有修改和等同物。此外,除非本文另有说明或上下文明显矛盾,否则本发明涵盖上述要素的所有可能变型的任何组合。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1