癌症治疗的制作方法
本发明涉及用于靶向癌症干细胞,特别是用于预防或治疗癌症的医疗用途和方法。本发明还涉及用于治疗人类患者中复发性或难治性癌症的医疗用途和方法。本发明提供了选择这样的患者的方法,所述患者将受益于通过本发明的医疗用途或治疗方法进行的癌症的预防或治疗。
背景技术:
在包括白血病和实体瘤在内的许多人类癌症中已经提出假定存在癌症干细胞。癌症干细胞假说认为只有一小部分肿瘤细胞负责肿瘤主体的形成和维持。这个概念的出现可以追溯到lapidot等人(1994)的工作,他们证明只有一小部分急性骨髓性白血病细胞有能力在小鼠中引发(initiate)白血病。这些细胞表达与正常造血干细胞相似的细胞表面标记(cd34+/cd38-),这意味着在肿瘤中可能出现了类似的分层组织(hierarchicalorganisation)。随后,在大范围的实体瘤包括乳腺癌、肺癌、结肠癌、前列腺癌、卵巢癌、皮肤癌和胰腺癌中鉴定出了癌症干细胞。
传统的抗癌方法主要针对大部分肿瘤群体。由于内在的或获得性的药物抗性和/或对电离辐射(ionizingradiation)的抗性,这种策略的功效通常有限,因此复发和耐药性的出现是许多癌症的共同特征。治疗抗性的机制包括对治疗诱导的dna损伤的识别和修复增加、细胞周期检查点控制改变、凋亡途径的功能受损以及由于外排药物的abc转运蛋白表达增加导致的药物积累减少。有证据表明,癌症干细胞增加了对化疗和放疗的抗性,并且通常在复发患者中富集。已经报道,在人类白血病、恶性黑色素瘤以及包括乳腺癌、胰腺癌和结肠直肠癌在内的多种实体瘤中存在明显的癌症干细胞化疗抗性。
癌症干细胞特异性表型和功能已被证明有助于致肿瘤性(tumourigenicity)、癌症进展和治疗抗性。癌症干细胞的持续存在也可能导致治疗失败。因此,癌症干细胞代表新型的、翻译相关的(translationallyrelevant)癌症治疗靶标。
技术实现要素:
本发明提供了如本文所定义的磷酰胺酯前药(protide)化合物,其用于靶向癌症干细胞。
本发明提供了如本文所定义的磷酰胺酯前药化合物在制备用于靶向癌症干细胞的药物中的用途。
本发明提供了靶向癌症干细胞的方法,所述方法包括向癌症干细胞群提供足以靶向这些癌症干细胞的量的如本文所定义的磷酰胺酯前药化合物。
本发明中提及的癌症干细胞的靶向可用于预防或治疗癌症。在这种实施方案中,癌症干细胞群可能在需要这种靶向的患者的癌症或癌前病况中,并且所述方法可包括向患者施用治疗有效量的如本文所定义的磷酰胺酯前药化合物。
本发明提供了如本文所定义的磷酰胺酯前药化合物,其用作抗癌症干细胞药物。如本文所定义的磷酰胺酯前药化合物的这种用途也可用于预防或治疗癌症。
本发明提供了一种确定具有癌症或癌前病况的患者是否将受益于用本发明的化合物预防或治疗癌症的方法,所述方法包括:
测定患者中代表癌症或癌前病况的生物样品中是否存在癌症干细胞;其中生物样品中存在癌症干细胞表明患者将受益于用本发明的化合物治疗。
本发明提供了一种为具有癌症或癌前病况的患者确定合适的治疗方案的方法,所述方法包括:
测定患者中代表癌症或癌前病况的生物样品中是否存在癌症干细胞;其中生物样品中存在癌症干细胞表明合适的治疗方案将包括用本发明的化合物治疗患者。
本发明提供了如本文定义的磷酰胺酯前药化合物,其用于在为这种治疗而选择的患者中预防或治疗癌症,患者的选择通过包括如下的方法进行:
测定患者中代表癌症或癌前病况的生物样品中是否存在癌症干细胞;其中生物样品中存在癌症干细胞表明患者适合用本发明的化合物治疗。
上述方法可以进一步包括使用本发明的化合物预防或治疗癌症或癌前病况的步骤。
在本发明方法的合适实施方案中,癌症是复发性或难治性癌症。如本文所定义的磷酰胺酯前药化合物可用于治疗这种复发性或难治性癌症。
本发明提供了如本文所定义的磷酰胺酯前药化合物,其用于治疗受试者的难治性癌症。本发明提供如了本文所定义的磷酰胺酯前药化合物,其用于治疗受试者的复发性癌症。受试者可以是人类患者。
本发明提供了如本文所定义的磷酰胺酯前药化合物在制备用于治疗人类患者的复发性或难治性癌症的药物中的用途。
本发明提供了治疗受试者的复发性或难治性癌症的方法,所述方法包括向需要这种治疗的受试者提供治疗有效量的如本文所定义的磷酰胺酯前药化合物。
本发明提供了如本文所定义的磷酰胺酯前药化合物,其用于治疗癌症,其中所述磷酰胺酯前药化合物在至少一个初始治疗周期中以约500mg/m2至1000mg/m2每周的剂量使用,然后在至少一个另外的治疗周期中以较低的每周剂量使用。所述癌症可以是复发性或难治性癌症。
本发明还提供了选自以下的磷酰胺酯前药:cpf447、cpf727、cpf544、cpf680、cpf545和cpf682以及cpf792,或其药学上可接受的盐。本发明还提供了药物制剂,其包含选自以下的磷酰胺酯前药:cpf447、cpf727、cpf544、cpf680、cpf545和cpf682以及cpf792,或其药学上可接受的盐,和药学上可接受的赋形剂。磷酰胺酯前药可选自cpf680、cpf544、cpf682和cpf792,或其药学上可接受的盐。磷酰胺酯前药可以选自:cpf447、cpf727、cpf544、cpf680、cpf545和cpf682以及cpf792。磷酰胺酯前药可选自cpf680、cpf544、cpf682和cpf792。这些磷酰胺酯前药中的每一种都可以用于靶向癌症干细胞,因此这些磷酰胺酯前药代表根据上述本发明的各个方面和实施方案使用的合适的磷酰胺酯前药。
具体实施方式
本发明的各个方面基于以下发现:如本文所定义的磷酰胺酯前药化合物能够优先减少癌症干细胞数量。该发现是出人意料的,因为已知癌症干细胞对许多化学治疗剂具有耐药性,并且以前没有暗示磷酰胺酯前药化合物(本发明的主题)能够靶向癌症干细胞。因此,如本文所定义的磷酰胺酯前药化合物能够靶向癌症干细胞并因此减少其数量这一发现(发明人已经证实该发现适用于大范围的癌症)代表了出人意料的突破性进展,这使得本发明化合物的一系列新治疗应用成为可能。
本发明化合物所发挥的生物活性(在本说明书中别处描述并且之前未报道)表明,这些化合物能够提供可能对患有复发性或难治性癌症的患者有效的治疗。使用本发明化合物的这种治疗可以导致肿瘤尺寸的减小和/或临床相关生物标志物的减少,其中任一种都可能与更有利的预后相关。此外,用如本文所定义的磷酰胺酯前药化合物治疗可有助于维持患有复发性或难治性癌症的患者的肿瘤尺寸的减小。因此,使用如本文所定义的磷酰胺酯前药化合物的治疗可以在患有复发性或难治性癌症的患者中实现高的、持久的疾病控制率(dcr)。
不希望受任何假设束缚,发明人相信本发明的化合物靶向癌症干细胞的能力有助于这些化合物在治疗复发性或难治性癌症中的治疗效用。
除了上下文另有要求外,在本公开中提及根据本发明的如本文所定义的磷酰胺酯前药化合物的“用途”可视为适用于本文所述的本发明的化合物的医药用途中的任意一种。类似地,提及使用如本文所定义的磷酰胺酯前药化合物的本发明的“方法”应视为适用于本文所述的本发明的方法中的任意一种。
如本文所定义的磷酰胺酯前药化合物靶向癌症干细胞的能力针对那些被认为是最难治疗的、并被认为在限制许多现有癌症疗法有效性的抗性中起主要作用的癌细胞,提供了新的疗法。这种能力也提供了一种靶向被认为与癌症的发展、进展、复发和传播(propagation)有关的细胞的方法。因此,将认识到,如本文所定义的磷酰胺酯前药化合物的这种抗癌症干细胞活性在长期寻求新的和有效的疗法的背景下产生益处。
本发明在很大程度上基于发明人关于由一组磷酰胺酯前药化合物发挥的生物活性的发现。如下文进一步描述的,这些磷酰胺酯前药化合物的生物活性清楚地表明它们将在本文考虑的多种临床背景中具有治疗活性。根据本发明的多个方面的磷酰胺酯前药化合物的用途特别用于预防或治疗癌症,甚至是复发性或难治性癌症。
本发明人发现,‘磷酰胺酯前药'化合物吉西他滨-[苯基-苯氧基-l-丙氨酰基)]-磷酸酯(也称为nuc-1031,或商品名为acelarin),是化学治疗剂吉西他滨的磷酰胺酯前药衍生物,它在临床研究中能够提供癌症的有效治疗,包括复发性或难治性癌症的有效治疗。以这种方式治疗癌症的nuc-1031的有效性似乎源于该化合物在癌症治疗中靶向癌症干细胞的能力。磷酰胺酯前药nuc-1031提供的癌症的有效治疗可以导致癌症干细胞数量减少、疾病进展减慢、肿瘤尺寸减小和癌症生物标志物水平降低,所述癌症生物标志物例如癌胚抗原(cea)、癌抗原(ca)19.9、ca125和抑制素b。证明nuc-1031的治疗效用的临床研究的细节在本申请的比较实施例2中列出。
nuc-1031的这种治疗效用源于该化合物的生物活性。nuc-1031在体外对癌症干细胞具有细胞毒性。此外,发现这种效应是选择性的—也就是说,虽然nuc-1031对癌症干细胞和非干细胞癌细胞都具有细胞毒性,但它对癌症干细胞的效应更大。因此,在癌症干细胞和非干细胞癌细胞的混合群体中,用nuc-1031处理可降低所存在的癌症干细胞的比例,使其低于治疗前发现的水平。nuc-1031和母体化合物吉西他滨对癌症干细胞和非干细胞癌细胞的混合群体的效应的比较表明,nuc-1031所表现的选择性在统计学上显著大于母体化合物的靶向。发明人认为,nuc-1031的这些体外活性等同于在体内提供该化合物时观察到的癌症的治疗。
如本说明书中别处所述,适用于本发明的磷酰胺酯前药化合物的定义不包括nuc-1031,也可以视为不包括基于抗癌剂虫草素(cordycepin)和8-氯腺苷的磷酰胺酯前药化合物。因此,根据本发明的磷酰胺酯前药化合物可以是除选自由以下组成的组的磷酰胺酯前药化合物之外的磷酰胺酯前药化合物:nuc-1031;衍生自虫草素的磷酰胺酯前药;和衍生自8-氯腺苷的磷酰胺酯前药。
如在本说明书中别处所述的结果中所证明的,本发明人已经表明,除nuc-1031之外的磷酰胺酯前药化合物能够靶向癌症干细胞,从而降低用磷酰胺酯前药处理的细胞群体中这种细胞的比例。显示适用于这种用途的磷酰胺酯前药化合物的实例包括选自由以下组成的组的那些:衍生自fudr的磷酰胺酯前药化合物,特别是选自由以下组成的组的磷酰胺酯前药化合物:cpf-373(无论是异构体a,还是异构体b)、cpf-381、cpf-581和cpf-585;衍生自硫鸟嘌呤(thioguanosine)的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-775或cpf-782;衍生自克拉屈滨(cladribine)的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-793和cpf-791;衍生自硫代肌苷(thioinosine)的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-761和cpf-762;衍生自氟达拉滨(fludarabine)的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-544和cpf-682;和衍生自氯法拉滨(clofarabine)的磷酰胺酯前药化合物,特别是选自由以下组成的组的磷酰胺酯前药化合物:cpf-720、cpf-727和cpf-448。
此外,本发明人已经表明,除nuc-1031之外的某些磷酰胺酯前药化合物能够比衍生它们的母体抗癌化合物更有效地靶向癌症干细胞。这种磷酰胺酯前药化合物代表了用于本文所述治疗用途的非常有前景的药剂,并且包括选自由以下组成的组的那些:衍生自fudr的磷酰胺酯前药化合物,特别是选自下组的磷酰胺酯前药化合物:cpf-373(无论是异构体a,还是异构体b)、cpf-381和cpf-581;衍生自硫鸟嘌呤的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-775或cpf-782;衍生自克拉屈滨的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-793;和衍生自硫代肌苷的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-761。
发明人还表明,除nuc-1031之外的某些磷酰胺酯前药化合物不仅能够比衍生它们的母体抗癌化合物更有效地靶向癌症干细胞,而且还表现出比衍生它们的母体化合物更强的抗癌效力。nuc-1031在体外显示了这种活性组合,如本文所定义的这些磷酰胺酯前药化合物在体外实现相同的活性概况的能力使这些化合物成为能实现与nuc-1031相同的显著临床效果的特别有前景的药剂。这种磷酰胺酯前药化合物包括选自由以下组成的组的化合物:衍生自fudr的磷酰胺酯前药化合物,特别是选自由以下组成的组的磷酰胺酯前药化合物:cpf-373(无论是异构体a,还是异构体b)、cpf-381和cpf-581。
如本文所述,发明人发现,磷酰胺酯前药,包括选自由cpf-373(异构体a)、cpf-373(异构体b)、cpf-381、cpf-581、cpf-782、cpf-775、cpf-544、cpf-682、cpf-793、cpf-448、cpf-585、cpf-791、cpf-720、cpf-727、cpf-761和cpf-762组成的组的那些,选择性地靶向癌症干细胞,而不是非干细胞癌细胞。
磷酰胺酯前药,包括选自由cpf-373(异构体a)、cpf-373(异构体b)、cpf-381、cpf-581、cpf-782、cpf-775、cpf-544、cpf-682、cpf-793和cpf-448组成的组的那些,对癌症干细胞显示出高选择性。
最后,磷酰胺酯前药,包括选自由cpf-373(异构体a)、cpf-373(异构体b)、cpf-381、cpf-581和cpf-782组成的组的那些,显示出对癌症干细胞的高选择性,并且令人惊讶地,与衍生它们的各个母体化合物相比,还具有更高的效力。
这些尚未报道过的发现表明,除nuc-1031之外的磷酰胺酯前药能够在靶向癌症干细胞中发挥相同的效用,用于治疗或预防癌症。因此,这些其他磷酰胺酯前药化合物可以通过在癌症的治疗中靶向癌症干细胞来提供已经显示对nuc-1031有效的相同优点。
定义
磷酰胺酯前药化合物
术语“磷酰胺酯前药”在本领域是容易理解的,指核苷或核苷类似物的芳氧基氨基磷酸酯衍生物。因此,磷酰胺酯前药可以是具有式(i)结构的化合物:
(i)其中
r1是芳基;
r2是c1-c24烷基,c3-c24烯基,c3-c24炔基,c0-c4亚烷基-c3-c6环烷基或c0-c4亚烷基-芳基;
r3和r4各自独立地选自h,c1-c6烷基和c1-c3亚烷基-r6;或者其中r3和r4与它们所连接的原子一起形成3元至6元环烷基或杂环烷基;
r5是核苷或核苷类似物;
r6独立地选自芳基(例如苯基),咪唑,吲哚,sra,ora,co2ra,co2nrara,nrarb和nh(=nh)nh2;
其中任意芳基是苯基或萘基,并且其中任意苯基或萘基任选地被1至4个选自以下的取代基取代:卤素,硝基,氰基,nrara,nras(o)2ra,nrac(o)ra,nraconrara,nraco2ra,ora;sra,sora,so3ra,so2ra,so2nrara,co2rac(o)ra,conrara,craranrara,c1-c4烷基,c2-c4烯基,c2-c4炔基和c1-c4卤代烷基;
其中在每次出现时ra独立地选自:h和c1-c4烷基;并且在每次出现时rb独立地选自:h,和c1-c4烷基和c(o)-c1-c4烷基。
然而,nuc-1031(吉西他滨-[苯基-苄氧基-l-丙氨酰基)]-磷酸酯,其化学全称:2'-脱氧-2',2'-二氟-d-胞苷-5'-o-[苯基(苄氧基-l-丙氨酰基)]磷酸酯),明确地排除在本申请的范围之外。
式(ii)化合物也明确地排除在本申请的范围之外:
其中:
w1和w2各自独立地选自由-p(=o)(u)(v)和h组成的组,条件是w1和w2中至少有一个是-p(=o)(u)(v),
其中对于w1和w2中的每一个而言,u和v独立地选自由以下组成的组:
(a)u是-oar并且v是–nrd-crarb-c(=o)orc,
其中ar选自由c6-30芳基和5-30杂芳基(其中每个都是任选取代的)组成的组;ra和rb中的每一个独立地选自h和由c1-20烷基、c6-30芳基c1-6烷基、c2-20烯基、c1-20烷氧基、c1-20烷氧基c1-20烷基、c1-20烷氧基c6-30芳基、c2-20炔基、c3-20环烷基c6-30芳基、c6-30芳氧基和5-20杂环基(其中任意一个都是任选取代的)组成的组;
rc选自h和由c1-20烷基、c6-30芳基c1-20烷基、c2-20烯基、c1-20烷氧基c1-20烷基、c1-20烷氧基c6-30芳基、c2-20炔基、c3-20环烷基c6-30芳基、和5-20杂环基(其中每个都是任选取代的)组成的组;
rd选自h和由c1-20烷基、c6-30芳基c1-20烷基、c2-20烯基、c1-20烷氧基、c1-20烷氧基c1-20烷基、c1-20烷氧基c6-30芳基、c2-20炔基、c3-20环烷基c6-30芳基、c6-30芳氧基和5-20杂环基(其中任意一个都是任选取代的)组成的组;
并且
(b)u和v中的每一个独立地选自–nrerf,
其中re选自由h和c1-6烷基组成的组并且rf是–crgrhco2ri,其中rg和rh独立地选自由以下组成的组:天然存在的α氨基酸的侧链,包括h,并且ri选自h和由c1-20烷基、c6-30芳基c1-20烷基-、c2-20烯基、c1-20烷氧基c1-20烷基、c1-20烷氧基c6-30芳基、c2-20炔基、c3-20环烷基c6-30芳基和5-20杂环基(其中任意一个都是任选取代的)组成的组;或者
re和rf与它们所连接的n原子一起形成包含5-8个环原子的环部分;
q选自由o、s和crjrk组成的组,其中rj和rk独立地选自h、f和c1-6烷基;x和z中的每一个独立地选自由h、oh、f、cl、br、i、c1-6烷基、-nrlrm(其中rl和rm中的每一个独立地选自h和c1-6烷基)和-srn(其中rn选自由h和c1-6烷基组成的组)组成的组;并且
y选自由h、oh、f、cl、br、i、-oc1-6烷基、c1-6烷基、c2-8炔基、-nrorp(其中ro和rp中的每一个独立地选自h和c1-6烷基)和–srq(其中rq选自由h和c1-6烷基组成的组)组成的组,
或式(ii)化合物的药学上可接受的盐、酯、酯的盐、溶剂化物或前药。
核苷或核苷类似物可具有以下结构:
其中:
q独立地选自o,nra和ch2;
r7独立地选自:ora,sra,nrarb;卤素(例如f),氰基,c1-c4烷基,c2-c4烯基和c2-c4炔基;
r8和r9与它们所连接的氮一起形成取代的嘧啶或取代的嘌呤;其中嘌呤或嘧啶被1至5个选自以下的基团取代:ora,sra,nrarb;卤素,氰基,c1-c4烷基,c2-c4烯基和c2-c4炔基。
n通常为自0至4的整数。n可以为自1至3的整数。如本领域技术人员将容易理解的,当嘧啶或嘌呤被oh基团取代,oh基团连接至与嘧啶或嘌呤核心中的一个氮原子相邻的碳原子时,嘧啶或嘌呤通常主要以互变异构形式存在,即在该互变异构形式中,在氮原子和相邻碳之间不存在双键,但在相邻碳和oh基团的氧之间存在双键。所述氮本身可以被,例如c1-c4烷基取代。
磷酰胺酯前药可以是具有式(iii)结构的化合物:
(iii)其中
r1、r2、r3和r4如上对式(i)化合物所述。nuc-1031不包括在本申请的范围内,因此,毫无疑问,当磷酰胺酯前药是式(iii)的化合物时,不能是以下情况:r1是未取代的苯基,r2是未取代的苄基,r3是me并且r4为h。式(iii)的磷酰胺酯前药是吉西他滨的衍生物。
磷酰胺酯前药可以是具有式(iv)结构的化合物:
r1、r2、r3和r4如上对式(i)化合物所述。式(iv)的磷酰胺酯前药是fudr的衍生物。
磷酰胺酯前药可以是具有式(v)结构的化合物:
r1、r2、r3和r4如上对式(i)化合物所述。式(v)的磷酰胺酯前药是氯法拉滨的衍生物。
磷酰胺酯前药可以是具有式(vi)结构的化合物:
r1、r2、r3和r4如上对式(i)化合物所述。式(vi)的磷酰胺酯前药是氟达拉滨的衍生物。
磷酰胺酯前药可以是具有式(vii)结构的化合物:
r1、r2、r3和r4如上对式(i)化合物所述。式(vii)的磷酰胺酯前药是克拉屈滨的衍生物。
以下陈述适用于式(i)和(iii)至(vii)中任意的磷酰胺酯前药。这些陈述是独立且可互换的。换句话说,以下陈述中任意一个所描述的任意特征可以(在化学上允许的情况下)与一个或多个以下其他陈述所描述的特征组合。特别地,当本说明书中举例说明或解释一种化合物时,以任意一般性水平表示的描述该化合物特征的以下陈述中的任意两个或更多个,可以组合以便表示在本说明书中构成本发明公开内容的一部分的主题。
r1可以是取代或未取代的苯基。r1可以是取代或未取代的萘基(例如1-萘基)。优选地,r1是未取代的苯基或未取代的萘基(例如1-萘基)。因此,r1可以是未取代的苯基。或者,r1可以是或未取代的萘基(例如1-萘基)。
优选这样选择r2,使得其包含五个或更多个碳原子。因此可以这样选择r2,使得其包含六个或更多个碳原子。优选这样选择r2,使得其仅包含碳原子和氢原子。r2可以选自c5-c7环烷基,c5-c8烷基和苄基,任选地其中所述基团是未取代的。
r4可以是h。r3可以选自c1-c6烷基和c1-c3亚烷基-r6。r3可以是c1-c4烷基。r3可以是甲基。
q优选为o。
式(iii)的示例性磷酰胺酯前药包括wo2005/012327(通过引用并入本文)中描述的化合物。
式(iv)的示例性磷酰胺酯前药包括wo2012/117246(通过引用并入本文)中描述的化合物。式(iv)的示例性磷酰胺酯前药包括:
式(v)、(vi)和(vii)的示例性磷酰胺酯前药包括wo2006/100439中描述的化合物。式(v)的示例性磷酰胺酯前药包括:
式(vi)的示例性磷酰胺酯前药包括:
式(vii)的示例性磷酰胺酯前药包括:
本文描述的其他示例性磷酰胺酯前药包括:
“癌症干细胞的靶向”
本发明提供了本发明的化合物可用于靶向癌症干细胞的第一个指征。研究用不同浓度的磷酰胺酯前药化合物处理后存活的cd34+/cd38-/cd123+细胞的比例的研究说明了本发明化合物靶向癌症干细胞的能力,这些研究在本说明书中其他地方公开的实施例中列出。
从实施例中报道的结果可以看出,当将如本文定义的磷酰胺酯前药化合物(衍生自fudr的磷酰胺酯前药化合物,特别是选自由以下组成的组的磷酰胺酯前药化合物:cpf-373(无论是异构体a,还是异构体b)、cpf-381、cpf-581和cpf-585;衍生自硫鸟嘌呤的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-775或cpf-782;衍生自克拉屈滨的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-793和cpf-791;衍生自硫代肌苷的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-761和cpf-762;衍生自氟达拉滨的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-544和cpf-682;和衍生自氯法拉滨的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-720、cpf-727和cpf-448)提供给含有癌症干细胞的癌细胞群时,其靶向存在的癌症干细胞,导致癌细胞总数减少以及表现出癌症干细胞的表型标志物的总癌细胞的比例减少。
某些磷酰胺酯前药化合物表现出靶向癌症干细胞的能力,与衍生它们的母体化合物相比,该能力显著增加。这些包括选自由以下组成的组的磷酰胺酯前药:衍生自fudr的磷酰胺酯前药化合物,特别是选自由以下组成的组的磷酰胺酯前药化合物:cpf-373(无论是异构体a,还是异构体b)、cpf-381和cpf-581;衍生自硫鸟嘌呤的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-775或cpf-782;衍生自克拉屈滨的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-793;和衍生自硫代肌苷的磷酰胺酯前药化合物,特别是磷酰胺酯前药化合物cpf-761。
不希望受任何假设束缚,本发明人相信癌症干细胞数量的减少是由于靶向杀死癌细胞群体中的癌症干细胞引起的。也就是说,与杀死非干细胞癌细胞相比,本发明的化合物似乎优先杀死癌症干细胞,从而导致癌症干细胞死亡,以及总癌细胞群中癌症干细胞的比例降低。
虽然发明人相信与非干细胞癌细胞相比,本发明的化合物优先杀死癌症干细胞,但是其他机制也可能导致由本发明的化合物靶向这些细胞引起的癌症干细胞比例降低。
仅举例来说,用如本文定义的磷酰胺酯前药化合物治疗可以引起癌症干细胞分化的增加,由此减少癌症干细胞数量以及由癌症干细胞代表的总癌细胞的比例。或者,如本文定义的磷酰胺酯前药化合物可能导致癌症干细胞丧失其干细胞表型,例如丧失它们的自我更新能力,从而减少癌症干细胞数量。
应该相应地解释本公开中提及的癌症干细胞的靶向。对于本公开的目的,癌症干细胞的“靶向”可以被视为涵盖如本文定义的磷酰胺酯前药化合物降低细胞群体中存在的癌症干细胞比例的任意机制,无论是体外还是体内。特别地,癌症干细胞的靶向可以被视为涵盖与其他细胞类型相比,特别是与非干细胞癌细胞相比,癌症干细胞的优先杀死。
“癌症干细胞”
癌症干细胞(有时被称为“肿瘤起始细胞”)是本领域技术人员所熟知的。如本文所用,术语“癌症干细胞”将根据其广泛接受的含义进行解释,所述含义是具有通过不对称分裂而自我更新,引发肿瘤形成,并通过分化产生更成熟的非干细胞癌后代的能力的细胞。
癌症干细胞在癌症的发展、进展、复发和传播中起主要作用。因此,本发明的化合物能够靶向癌症干细胞并由此减少其数量这一发现,提供了预防或治疗这些活性的治疗可能性。
正如在说明书的其他地方更详细讨论的,癌前病况中发现有癌症干细胞,在那里它们的存在被认为有助于这种病况发展成癌症。因此,其中使用如本文定义的磷酰胺酯前药化合物来靶向癌症干细胞的本发明的治疗方法和医疗用途可以用于减少癌前病况(例如骨髓增生异常综合征,或本说明书中其他地方考虑的其他病况)中的癌症干细胞数量,并因此预防这种癌前病况进展成癌症。
如上所述,癌症干细胞的不对称细胞分裂产生分化的非干细胞癌细胞。因此,癌症干细胞负责肿瘤的大部分的形成和维持。
这种非干细胞癌细胞的积累在癌症的进展中起主要作用。通过如本文定义的磷酰胺酯前药化合物靶向癌症干细胞能够减少癌症干细胞数量,这又减少了非干细胞癌细胞后代的数量。因此,根据本发明的如本文定义的磷酰胺酯前药化合物的治疗方法和医疗用途通过预防癌症进展而有益于治疗癌症。在本说明书的其他地方更详细地描述了这样的实施方案。
癌症干细胞还能够充当癌细胞的储库,它们可能在缓解后导致癌症复发。即使在大部分患者的癌细胞已被去除(例如通过单独或联合使用手术、放疗或化疗),以至于无可察癌症迹象的情况下,癌症干细胞的持续存在可能随着时间的推移促使(nucleate)癌症复发。通过如本文定义的磷酰胺酯前药化合物靶向癌症干细胞提供了一种新的模式,通过该模式癌症干细胞数量可以被减少且癌症干细胞被杀死。因此,如本说明书别处更详细讨论的,在合适的实施方案中,本发明提供了如本文定义的磷酰胺酯前药化合物预防或延误癌症复发的方法和医疗用途。
此外,癌症干细胞从癌症部位向身体内另一个位置的移动可能导致癌症的传播,例如通过引起转移。因此,如本文定义的磷酰胺酯前药化合物靶向癌症干细胞的能力提供了用于预防或治疗癌症传播的新的治疗方法和医疗用途。
除了它们的生物活性之外,还可以通过它们的某些特征性细胞表面标记物的表达来鉴定癌症干细胞。在血液恶性肿瘤中鉴定的癌症干细胞通常是cd34+,而在实体瘤中,cd44+、cd133+和cd90+已经被鉴定为癌症干细胞标记物。下表总结了已知的癌症干细胞表面表型的实例。预期这些癌症干细胞形式的每一种均可以使用根据本发明的如本文定义的磷酰胺酯前药化合物进行靶向,因此使用这些磷酰胺酯前药化合物的方法或用途可用于预防或治疗与表达任意这些标记物组的癌症干细胞相关的癌症。
实例中提供的数据表明,如本文定义的磷酰胺酯前药化合物能够靶向白血病干细胞系的癌症干细胞,特别是存在于急性髓性白血病细胞系kg1a中的癌症干细胞。该细胞系表现出具有独特的免疫表型(lin-/cd34+/cd38-/cd123+)的小干细胞样室(aminorstemcell-likecompartment),其由如本文定义的磷酰胺酯前药化合物靶向。因此,根据本发明的如本文定义的磷酰胺酯前药化合物的治疗方法或医疗用途可用于预防或治疗与表达这些特征性标记物的癌症干细胞相关的白血病或其他癌症。
本发明还提供了这样的方法和医疗用途,其中,基于代表患者的癌症或癌前病况的生物样品中癌症干细胞的存在的鉴定,而选择患者以使用本发明的化合物进行癌症的预防或治疗。上面列出的标记物提供了合适的实例,这些实例可用于根据本发明的这类实施方案鉴定癌症干细胞的存在。在本说明书的其他地方进一步考虑了可以在生物样品中研究表达这些标记的合适技术。
“癌症的预防或治疗”
本发明提供了这样的医疗用途和治疗方法,其中如本文定义的磷酰胺酯前药化合物用于预防或治疗癌症。在本发明的背景中,癌症的“预防”被认为涉及在癌症发展之前使用的,并且目的是阻止癌症发展的如本文定义的磷酰胺酯前药化合物的预防性应用。另一方面,癌症的“治疗”被认为是涉及在癌症发生后使用,并且着眼于通过减缓或停止癌细胞增殖和肿瘤生长来改善癌症的如本文定义的磷酰胺酯前药化合物的使用。有利地是,癌症的治疗可以引起癌细胞数量和肿瘤尺寸的部分或全部减少。按照recist(实体肿瘤疗效评估标准)规则,癌症的有效治疗可能会带来“稳定(stabilize)”或“缓解(respond)”的病情。
如下面更详细地描述的,根据本发明的癌症的预防可能特别有益于具有癌前病况的患者,所述癌前病况增加其发展癌症的可能性。
“癌症的预防”
根据本发明的癌症的预防可能受到根据本文描述的发明的多个方面或实施方案而使用如本文定义的磷酰胺酯前药化合物治疗癌前病况的影响。
特别地,在本发明的背景中,癌症的预防可以通过本发明的方法或医疗用途来实现,在其中如本文定义的磷酰胺酯前药化合物被提供给具有癌前病况的患者。根据该实施方案的治疗方法或医疗用途可以防止所治疗的癌前病况发展成癌症,从而提供有效的癌症预防。
在本发明的背景中提及的癌症的预防还可以涵盖本发明化合物的其它预防性应用。例如,如本文定义的磷酰胺酯前药化合物靶向癌症干细胞并由此预防癌症发展、和/或预防癌症进展、和/或预防癌症复发和/或预防癌症传播的能力。
“癌前病况”
癌症通常是在癌前病况发展的前提下发生的,所述癌前病况本身并不是癌性的,但与癌症风险增加有关。遗传或表观遗传变化的累积可能会导致先前正常的细胞发展癌症干细胞表型。因此,癌症干细胞也可以存在于这样的癌前病况以及癌性病况中。
人们相信,癌症干细胞在癌前病况中的存在有助于这些病况发展成癌症。可以使用本发明的方法和医疗用途来靶向存在于癌前病况中的癌症干细胞,并由此治疗这种病况。要理解的是,本发明的化合物靶向癌症干细胞这一新的且出乎意料的发现意味着用这种化合物治疗癌前病况可用来预防被治疗的病况发展成癌症。如本说明书其他地方所考虑的,这代表了如本文定义的磷酰胺酯前药化合物可以在医学上用于预防癌症的方式。
根据本发明可以治疗的癌前病况的实例包括但不限于选自由以下组成的组的那些:光化性角化病,巴雷特食管(barrett’soesophagus),萎缩性胃炎,先天性角化不良症,缺铁性吞咽困难,扁平苔癣,口腔黏膜下纤维化,日光性弹性组织变性,宫颈非典型增生,黏膜白斑病,黏膜红斑病,意义不明的单克隆丙种球蛋白病(mgus),单克隆b细胞淋巴球增多(mbl),骨髓增生异常综合征,以及胃的癌前病况如萎缩性胃炎,胃溃疡,恶性贫血,胃残端(gastricstump),胃息肉和梅内特氏病(ménétrier’sdisease)。在列出的胃的癌前病况中,萎缩性胃炎,恶性贫血,胃残端和某些类型的胃息肉发展成癌症的风险可能特别高。
癌前病况通常呈这样的病变形式,其包含发育异常的(dysplastic)细胞或增生性(hyperplastic)细胞。因此,作为对具有癌症干细胞特有的表达标记或表型的细胞的存在的替代或补充,可以使用发育异常或增生的存在,来鉴定癌前病况。
发育异常的严重程度可以在不同的癌前病况之间变化,或者随着时间的推移随单一癌前病况的发展变化。一般来说,与癌前病况相关的发育异常越晚期,癌前病况越可能发展成癌症。发育异常通常分为轻度、中度或重度。如果不治疗,严重的发育异常通常会发展成癌症。因此,合适地,使用如本文定义的磷酰胺酯前药化合物的治疗方法或医疗用途可以用于治疗患有与严重发育异常相关的癌前病况的患者。
在本发明的一个合适的实施方案中,如本文定义的磷酰胺酯前药化合物用于治疗患有严重宫颈发育异常的患者。严重宫颈发育异常可以通过涂片检查的方法来诊断。在本发明的另一个实施方案中,如本文定义的磷酰胺酯前药化合物用于治疗严重食管发育异常(“巴雷特食管”)。严重食管发育异常可以在组织活检后进行诊断。
最近有报道指出,在未知患有癌症的个体中通过检测细胞中的体细胞突变也可以鉴定出恶变前兆(pre-malignancy)。特别地,据报道,与年龄有关的克隆性造血是一种常见的恶变前(pre-malignant)病况,其与总体死亡率的增加和心脏代谢疾病风险的增加相关。血细胞中检测到的大多数突变发生在三个基因:dnmt3a、tet2和asxl1中。因此,可以通过测定包含血细胞的样品,来鉴定将从使用如本文定义的磷酰胺酯前药化合物靶向癌症干细胞并由此治疗癌前病况中受益的患者的dnmt3a和/或tet2和/或asxl1中的至少一个,是否存在指示癌前病况的基因突变。
可能受益于用根据本发明的如本文定义的磷酰胺酯前药化合物靶向癌症干细胞的治疗的癌前病况也可以通过参考任意基于癌症干细胞的特征性标记或癌症干细胞表型的表达(在说明书的其他地方讨论)的技术而确定癌症干细胞的存在来鉴定。
“癌症的治疗”
技术人员将会理解,有许多测量可以评估癌症的“治疗”。仅举例而言,癌症发展、癌症进展、癌症复发或癌症传播的任何降低或预防可被认为是指示癌症的有效治疗。
在某些实施方案中,如本文定义的磷酰胺酯前药化合物可用于:降低癌细胞群中癌症干细胞的比例;和/或抑制肿瘤生长;和/或降低致肿瘤性;和/或预防或治疗原发性癌症;和/或预防或治疗复发性癌症;和/或预防或治疗转移性或继发性癌症;和/或治疗、预防或抑制转移或复发;和/或治疗或预防难治性癌症。
在施用治疗期间/之后,使用了如本文定义的磷酰胺酯前药化合物的癌症治疗造成肿瘤尺寸减小、还有维持肿瘤尺寸减小的能力,代表有效癌症治疗的特别相关的指征。如实施例中所述,已证明本发明的治疗或医疗用途在这方面出人意料地有效,即使在使用代表先前对其他疗法的治疗有抗性的复发性或难治性癌症的细胞的模型中。
实施例中给出的数据说明,用如本文定义的磷酰胺酯前药化合物治疗可降低癌细胞群中癌症干细胞的比例。本说明书中的其他地方描述了可以鉴定癌症干细胞的特征性生物活性或细胞表面标记物。在一个合适的实施方案中,根据本发明的癌症的治疗可以导致存在于患者癌症中的癌症干细胞的比例降低至少10%,至少20%,至少30%或至少40%。在合适的实施方案中,根据本发明的癌症的治疗可以导致存在于患者癌症中的癌症干细胞的比例降低至少50%,至少60%,至少70%或至少80%。根据本发明的癌症的治疗可以导致存在于患者癌症中的癌症干细胞的比例降低至少85%,至少90%或至少95%。实际上,根据本发明的癌症的治疗可以导致存在于患者癌症中的癌症干细胞的比例降低至少96%,至少97%,至少98%,至少99%或甚至100%(如此基本上不存在癌症干细胞)。
癌症干细胞的不对称分裂有助于肿瘤的生长。根据本发明用如本文定义的磷酰胺酯前药化合物治疗癌症可以引起肿瘤生长抑制至少10%,至少20%,至少30%或至少40%。合适地,根据本发明的癌症的治疗可以引起肿瘤生长抑制至少50%,至少60%,至少70%或至少80%。根据本发明的癌症的治疗可以引起按此治疗的患者中肿瘤生长抑制至少85%,至少90%或至少95%。实际上,根据本发明的癌症的治疗可以引起受治疗的癌症中肿瘤生长抑制至少96%,至少97%,至少98%,至少99%或甚至100%。
肿瘤生长可以通过任意合适的方法来评估,在其中随时间评估肿瘤尺寸的变化。合适地,肿瘤在癌症治疗之前的尺寸可以和同一肿瘤在癌症治疗期间或之后的尺寸进行比较。多种可以评估肿瘤尺寸的方法是已知的。例如,肿瘤的尺寸可以通过在患者体内进行原位肿瘤成像来评估。合适的技术,例如成像技术,能够确定肿瘤的体积,并且评估肿瘤体积的变化。
如本说明书实施例中列出的结果所示,本发明的如本文定义的磷酰胺酯前药化合物的治疗方法和医疗用途不仅能够阻止肿瘤生长,而且实际上能够使癌症患者(包括患有复发性或难治性癌症的患者)的肿瘤体积减小。合适地,根据本发明的癌症的治疗可以使肿瘤体积减小至少10%,至少20%,至少30%或至少40%。在合适的实施方案中,根据本发明的癌症的治疗可以使肿瘤体积减小至少50%,至少60%,至少70%或至少80%。根据本发明的癌症的治疗可以使肿瘤体积减小至少85%,至少90%或至少95%。实际上,根据本发明的癌症的治疗可以使肿瘤体积减小至少96%,至少97%,至少98%,至少99%或甚至100%。
参照合适的对照可以计算上述那样的肿瘤体积减小。例如,在合适的动物模型体外或体内进行的研究中,肿瘤体积的减小可以通过直接比较用如本文定义的磷酰胺酯前药化合物治疗的肿瘤的体积和对照肿瘤(其可以是未经治疗的,或者可能是接受了本发明的化合物以外的治疗)的体积来确定。可以理解的是,在临床试验或患者的治疗管理的背景下,这种需要缺乏肿瘤治疗的模型可能不是伦理上可接受的,并且在这种情况下,肿瘤体积的减小可以通过比较经治疗的肿瘤的体积与同一肿瘤治疗前的体积,或者在不施加治疗的情况下肿瘤将达到的预期体积来进行评估。
如本文定义的磷酰胺酯前药化合物的治疗方法和医疗用途可能导致指示癌症的生物标记物减少。这种生物标记物的减少提供了进一步的评估,通过该评估可以证明癌症的有效治疗。这种生物标记物的合适的实例可以基于待治疗癌症的类型来选择:在妇科癌症的情况下,ca125代表生物标记物的合适的实例,而在胰腺癌或胆管癌的情况下,ca19.9代表生物标记物的合适的实例,并且在结肠直肠癌的情况下,cea可能是合适的生物标记物。
合适地,根据本发明的癌症的治疗可以引起癌症生物标记物减少至少10%,至少20%,至少30%或至少40%。在合适的实施方案中,根据本发明的癌症的治疗可以引起癌症生物标记物减少至少50%,至少60%,至少70%或至少80%。根据本发明的癌症的治疗可以引起癌症生物标记物减少至少85%,至少90%或至少95%。实际上,根据本发明的癌症的治疗可以引起癌症生物标记物减少至少96%,至少97%,至少98%,至少99%或甚至100%。
在根据本发明的癌症的治疗中观察到的有益效果,例如癌症干细胞比例的减少、肿瘤生长的减少、或肿瘤体积或癌症生物标记物的减少可以维持至少一个月。合适地,这种有益效果可以维持至少两个月,至少三个月,至少四个月,至少五个月或至少六个月。实际上,这种有益效果可以维持至少12个月,至少18个月或至少24个月。合适地,这种有益效果可以维持至少三年,至少四年,至少五年,至少六年,至少七年,至少八年,至少九年,或十年或更长时间。
在本发明的一个合适的实施方案中,通过靶向癌症干细胞,将如本文定义的磷酰胺酯前药化合物用于预防或治疗癌症或恶变前病况的方法中。在一个合适的实施方案中,本发明提供了如本文定义的磷酰胺酯前药化合物在预防或治疗癌症或恶变前病况的方法中的用途,其中所述方法降低了一种或多种癌症干细胞的致肿瘤性。合适地,这种方法可以预防癌症的进展或者抑制肿瘤生长。
当如本文定义的磷酰胺酯前药化合物用于本发明的方法或医疗用途中以预防或治疗癌症的进展时,这种预防或治疗可以导致癌症进展放慢、延迟或完全停止。
癌症的进展通常通过对癌症进行分期来确定。分期通常通过将癌症分为i至iv期来进行,其中i是孤立的癌症,iv是已经蔓延至评估措施的极限的癌症。分期细节在癌症之间有所不同,但是分期通常考虑到肿瘤的尺寸、是否已经侵入邻近器官、已经扩散到多少局部(附近)的淋巴结(如果有的话)以及其是否已经出现在更远的位置(转移的)。
通常,i期局限于身体的一部分,可以通过手术切除(对于足够小的实体瘤)治疗。ii期是局部晚期,可通过化疗、放疗、手术或其组合治疗。iii期也是局部晚期,ii期或iii期的指定取决于癌症的具体类型,尽管iii期通常被认为是“晚的(late)”局部晚期。iv期癌症经常转移到第二器官。本发明的方法或医疗用途中使用如本文定义的磷酰胺酯前药化合物的癌症的治疗可以用于通过靶向癌症干细胞来治疗i、ii、iii或iv期癌症。用如本文定义的磷酰胺酯前药化合物治疗可以被用来预防癌症从一个时期进展到下一个时期。在一个实施方案中,用如本文定义的磷酰胺酯前药化合物治疗被用来预防从i期进展到ii期。在另一个实施方案中,用如本文定义的磷酰胺酯前药化合物治疗被用来预防从ii期进展到iii期。在又一个实施方案中,用如本文定义的磷酰胺酯前药化合物治疗被用来预防从iii期进展到iv期。
预防或抑制癌症进展对于预防癌症的扩散尤其重要,例如从i期进展到ii期,其中癌症局部扩散,或从iii期进展到iv期,其中癌症转移到其他器官。癌症干细胞是致肿瘤的,因此被认为在癌症的扩散中起着关键作用,无论是局部的还是转移性的。因此,使用如本文定义的磷酰胺酯前药化合物的本发明的治疗方法或医疗用途可以用于通过靶向致瘤的癌症干细胞并由此减少它们的数量来预防癌症的扩散。
“癌症”
作为本发明主题的磷酰胺酯前药化合物显示出有益的抗癌活性,并且一些化合物与衍生它们的化合物相比表现出增加的抗癌活性。这些磷酰胺酯前药化合物显示的抗癌活性包括在癌症干细胞和非干细胞癌细胞中观察到的活性。
癌症干细胞在各种癌症的生物活性中发挥作用。因此,根据本发明可以预防或治疗的癌症范围很广。
如本文其他地方所讨论的,已知癌症干细胞存在于许多肿瘤类型中,包括液体肿瘤(包括血液肿瘤,例如白血病和淋巴瘤)和实体瘤(例如乳腺肿瘤,肺肿瘤,结肠肿瘤,前列腺肿瘤,卵巢肿瘤,皮肤肿瘤,膀胱肿瘤,胆管肿瘤和胰腺肿瘤)。因此,预计如本文定义的磷酰胺酯前药化合物靶向癌症干细胞的治疗方法和医疗用途可用于预防或治疗这些癌症。
合适地,如本文定义的磷酰胺酯前药化合物可用于预防或治疗选自以下的癌症:白血病,淋巴瘤,多发性骨髓瘤,肺癌,肝癌,乳腺癌,头颈癌,神经母细胞瘤,甲状腺癌,皮肤癌(包括黑素瘤),口腔鳞状细胞癌,膀胱癌(urinarybladdercancer),莱迪希细胞瘤(leydigcelltumor),胆管癌如肝胆管型肝癌或胆道癌(bileductcancer),胰腺癌,结肠癌,结肠直肠癌和妇科癌包括卵巢癌、子宫内膜癌、输卵管癌、子宫癌和宫颈癌包括上皮宫颈癌。在合适的实施方案中,癌症是白血病并且可以选自由急性淋巴细胞性白血病,急性骨髓性白血病(也称为急性髓性白血病或急性非淋巴细胞性白血病),急性早幼粒细胞白血病,急性淋巴细胞性白血病,慢性骨髓性白血病(也称为慢性髓性白血病,慢性髓细胞性白血病或慢性粒细胞白血病),慢性淋巴细胞性白血病,单核细胞白血病和毛细胞白血病组成的组。在进一步优选的实施方案中,癌症是急性淋巴细胞性白血病。在一个合适的实施方案中,癌症是淋巴瘤,其可以选自由以下组成的组:霍奇金淋巴瘤(hodgkin’slymphoma);非霍奇金淋巴瘤(non-hodgkinlymphoma);伯基特淋巴瘤(burkitt’slymphoma);和小淋巴细胞性淋巴瘤。
合适地,在这些癌症中靶向癌症干细胞可以通过预防或治疗癌症的发展、通过预防或治疗癌症的进展、通过预防或治疗癌症的复发、或通过预防或治疗癌症的传播,来实现癌症的有效治疗。
在一个合适的实施方案中,本发明提供了用于靶向癌症干细胞来预防或治疗转移性癌症的如本文定义的磷酰胺酯前药化合物。
在一个合适的实施方案中,本发明提供了用于靶向癌症干细胞来治疗复发性或难治性癌症的如本文定义的磷酰胺酯前药化合物。
在一个合适的实施方案中,本发明提供了用于靶向癌症干细胞来治疗原发性癌症的如本文定义的磷酰胺酯前药化合物。合适地,所治疗的原发性癌症可以是第二原发性癌症。
本发明提供了用于靶向癌症干细胞来治疗继发性癌症的如本文定义的磷酰胺酯前药化合物。在合适的实施方案中,继发性癌症是转移性癌症。
在合适的实施方案中,本发明提供了用于靶向癌症干细胞的如本文定义的磷酰胺酯前药化合物,其中癌症干细胞的靶向预防或抑制:(i)癌症的复发;(ii)第二原发性癌症的发生;或(iii)癌症的转移。
基于如本文定义的磷酰胺酯前药化合物的靶向癌症干细胞的能力而使用其的治疗方法或医疗用途可用于治疗复发性或难治性癌症。除了上下文另有要求之外,在这些实施方案中关于复发性或难治性癌症的考虑因素和关于本发明其它方面或实施方案的用于治疗复发性或难治性癌症的考虑因素相同。
“复发性或难治性癌症”
如上所述,本发明的某些方面和实施方案特别涉及如本文定义的磷酰胺酯前药化合物在治疗复发性或难治性癌症中的用途。
对于本发明的目的,难治性癌症可以被视为对除使用本发明化合物的疗法以外的抗癌疗法的治疗表现出抗性的癌症。例如,如本文定义的磷酰胺酯前药化合物可用于治疗对用放射疗法治疗有抗性的难治性癌症。可选地或另外地,如本文定义的磷酰胺酯前药化合物可用于治疗对治疗癌症中使用的生物制剂有抗性的难治性癌症。在一个合适的实施方案中,如本文定义的磷酰胺酯前药化合物可以用于治疗对用除本发明化合物以外的化疗剂的治疗有抗性的难治性癌症。
特别地,可能受益于使用如本文定义的磷酰胺酯前药化合物的本发明的治疗方法或医疗用途的难治性癌症包括对衍生多种磷酰胺酯前药的母体化合物具有抗性的那些癌症(例如对fudr、硫鸟嘌呤、克拉屈滨、硫代肌苷、氟达拉滨或氯法拉滨有抗性的癌症)。
复发性癌症是在缓解期之后返回的癌症,在缓解期癌症不能被检测到。癌症复发可能发生在原癌症部位(局部(local)癌症复发)、与原癌症接近的部位(区域(regional)癌症复发)或远离原癌症的部位(远端(distal)癌症复发)。癌症干细胞被认为在癌症的复发中发挥作用,提供了复发性癌症细胞的产生来源。因此,在复发性癌症的背景下,能够靶向癌症干细胞的根据本发明的如本文定义的磷酰胺酯前药化合物的治疗方法和医疗用途可能是非常有益的。如本文定义的磷酰胺酯前药化合物靶向癌症干细胞的能力可用于去除这种能够引起复发的细胞群体,从而预防复发性癌症的发生。如本文定义的磷酰胺酯前药化合物的抗癌症干细胞活性还可以用于靶向已经复发的癌症中的癌症干细胞,以及潜在地对非干细胞癌细胞发挥细胞毒性作用,由此提供复发性癌症的治疗。
鉴于以上所述,可以理解的是,如本文定义的磷酰胺酯前药化合物可用于本发明的方法或用途来预防或治疗复发性癌症。如本文定义的磷酰胺酯前药化合物可用于本发明的方法或用途来预防或治疗局部、区域或远端复发性癌症。
如本文定义的磷酰胺酯前药化合物可用于本发明的方法或用途中,从而通过提供至少2个月,至少6个月,至少12个月,至少18个月,至少24个月或至少30个月的缓解期,来预防癌症的复发。事实上,如本文定义的磷酰胺酯前药化合物可以用于通过提供至少4年,至少5年,至少6年,至少7年,至少8年,至少9年或至少10年的缓解期,来预防癌症的复发。
如本文定义的磷酰胺酯前药化合物可以用于本发明的方法或用途中,以治疗在至少2个月,至少6个月,至少12个月,至少18个月,至少24个月或至少30个月的缓解期后复发的复发性癌症。事实上,如本文定义的磷酰胺酯前药化合物可用于治疗在至少4年,至少5年,至少6年,至少7年,至少8年,至少9年或至少10年的缓解期后复发的复发性癌症。
如本文定义的磷酰胺酯前药化合物靶向癌症干细胞的能力使得这些化合物能够根据本发明的医疗用途或治疗方法预防或治疗癌症。然而,应该指出的是,本发明化合物也对构成肿瘤大部分的非干细胞癌细胞发挥直接的细胞毒性作用。虽然癌症干细胞的活性可能是使得复发性或难治性癌症如此难以治疗的大部分抗性的基础,但非干细胞癌细胞也是这种复发性或难治性癌症的主要因素。
与衍生本发明化合物的化学治疗分子相比,本发明的化合物对非干细胞癌细胞可产生更大的细胞毒性作用。因此,如本文定义的磷酰胺酯前药化合物在治疗复发性或难治性癌症中的作用机制可能不仅限于该化合物的抗癌症干细胞活性,也可能利用如本文定义的磷酰胺酯前药化合物对非干细胞癌细胞的作用。在这种用途中,用如本文定义的磷酰胺酯前药化合物治疗将减少癌症干细胞和非干细胞癌细胞的总数,但将优先降低治疗后残留的癌症干细胞的比例。
治疗有效剂量的本发明化合物
治疗有效量的如本文定义的磷酰胺酯前药化合物可以是足以诱导癌细胞死亡的量。治疗有效量的如本文定义的磷酰胺酯前药化合物可以是足以诱导癌症干细胞死亡的量。在一些实施方案中,特别是涉及治疗复发性或难治性癌症的那些实施方案中,治疗有效量的如本文定义的磷酰胺酯前药化合物可以是足以诱导癌症干细胞死亡并且还诱导非干细胞癌细胞死亡的量。
有多种不同的方式可以计算和表达要向患者施用的化合物(如,如本文定义的磷酰胺酯前药化合物)的治疗有效量。被认为与用于预防或治疗癌症的药剂的剂量特别相关的一种这样的方式是每单位患者体表面积要施用的药剂的量。这样的剂量通常以每平方米(m2)表面积的药剂的量(其可以通过质量确定)表示。
如本文定义的磷酰胺酯前药化合物用于预防或治疗癌症的用途可以利用250mg/m2至1000mg/m2的每周剂量。例如,这种治疗可以使用375mg/m2至900mg/m2的每周剂量。例如,当向患者提供范围在约500mg/m2至825mg/m2的每周剂量的如本文定义的磷酰胺酯前药化合物时,可提供复发性或难治性癌症的有效治疗。
不希望被任何假设束缚,本发明人相信如本文定义的磷酰胺酯前药化合物靶向癌症干细胞的能力使得能够使用比预期要低的剂量的该化合物实现治疗效果。仅举例来说,证明低至825mg/m2、750mg/m2、600mg/m2或500mg/m2的每周剂量的如本文定义的磷酰胺酯前药化合物在本发明的用途和方法中是治疗有效的。
所选择的每周剂量的如本文定义的磷酰胺酯前药化合物可以以单次施用被提供,或者以一周内多次施用被提供。例如,每周剂量的如本文定义的磷酰胺酯前药化合物可以以两次施用,三次施用或更多次施用被提供。因此,在每周剂量为750mg/m2的情况下,这可以通过在一周的过程中三次施用250mg/m2,或者在一周内两次施用375mg/m2来实现。类似地,在每周剂量为600mg/m2的情况,这可以通过在一周的过程中三次施用200mg/m2,或在一周内两次施用300mg/m2来实现。
为了在一周的过程中提供所需剂量的该化合物,在单次治疗中施用的合适量的如本文定义的磷酰胺酯前药化合物可以在约100mg/m2和300mg/m2之间。
所提供的如本文定义的磷酰胺酯前药化合物的每周剂量可能在治疗过程中减少。例如,治疗可以以约1000mg/m2,900mg/m2,825mg/m2,750mg/m2或725mg/m2的每周剂量开始,并且在治疗过程中,所需剂量可降至约750mg/m2(在初始剂量高于此量的情况下),约650mg/m2,约625mg/m2,或甚至约500mg/m2或约375mg/m2。
当然,如本文所定义的磷酰胺酯前药化合物的剂量可以以其他方式呈现。其中最常见的是每单位体重要提供的活性药剂的量。已经计算出,平均起来,对于人类患者,1mg/m2的剂量相当于约0.025mg/kg体重。因此,数据表明,范围为约6.25mg/kg至约25mg/kg的剂量的如本文定义的磷酰胺酯前药化合物能有效治疗复发性或难治性癌症。合适的剂量可以例如为约9.5mg/kg至22.5mg/kg。在合适的实施方案中,当向患者提供范围为约12.5mg/kg至20.5mg/kg的每周剂量时,如本文定义的磷酰胺酯前药化合物实现复发性或难治性癌症的有效治疗。
关于适用于本发明的预防或治疗方法和医疗用途的如本文定义的磷酰胺酯前药化合物制剂的考虑因素在本公开其他地方有描述。在本发明化合物的可注射制剂的情况下,这些可以静脉内施用。可以在任意合适的时间范围内实现静脉内施用,例如十分钟注射等。
治疗类型
在合适的实施方案中,如本文定义的磷酰胺酯前药化合物可以用于靶向癌症干细胞,作为癌症的一线治疗。
然而,本发明化合物能够靶向癌症干细胞从而治疗复发性或难治性癌症这一发现说明如本文定义的磷酰胺酯前药化合物能够在其他治疗已被证明无效的情况下提供有效的癌症治疗。因此,在合适的实施方案中,本发明提供了用于靶向癌症干细胞、作为癌症的二线治疗的如本文定义的磷酰胺酯前药化合物。事实上,在合适的实施方案中,本发明提供了用于靶向癌症干细胞、作为癌症的三线或其他线治疗的如本文定义的磷酰胺酯前药化合物。
在一个合适的实施方案中,提供了在癌症治疗中用作新辅药(neooadjuvant)的如本文定义的磷酰胺酯前药化合物。新辅药是为了在“主要”抗癌治疗(例如手术去除癌症)之前减小肿瘤尺寸而向患者提供的药剂。对于随后将接受癌症的手术治疗和/或癌症放疗的患者,如本文定义的磷酰胺酯前药化合物可以用作新辅药治疗。
可选地或另外地,本发明提供了在癌症治疗中用作辅药的如本文定义的磷酰胺酯前药化合物。辅药是在“主要”抗癌治疗(例如手术去除癌症)之后,向给患者提供以预防主要治疗之后癌症复发的药剂。对于已经接受了癌症的手术治疗和/或癌症放疗的患者,如本文定义的磷酰胺酯前药化合物可以用作辅药。
如本文定义的磷酰胺酯前药化合物可以以单一疗法用于本发明的方法或用途中,也就是说用于这样的预防或治疗,其中如本文定义的磷酰胺酯前药化合物基本上提供预防或治疗中所使用的所有治疗活性。
或者,本发明的方法或用途可以以组合疗法使用如本文定义的磷酰胺酯前药化合物。在这样的实施方案中,如本文定义的磷酰胺酯前药化合物与至少一种另外的癌症疗法联合使用。另外的癌症疗法可以包括手术和/或放疗。另外地或可选地,另外的癌症疗法可以包括使用至少一种其他治疗剂,所述其他治疗剂有助于待实现的癌症的预防或治疗。合适地,这种药剂可以是癌症的预防或治疗中使用的化疗剂或生物药剂。
在组合疗法的一个合适的实施方案中,可以同时向患者提供如本文定义的磷酰胺酯前药化合物和其他治疗剂。在合适的实例中,如本文定义的磷酰胺酯前药化合物和其他治疗剂可以配制成同一药物组合物的一部分。或者,如本文定义的磷酰胺酯前药化合物和其他治疗剂可以分别配制用于基本上同时向患者提供。
在组合疗法的另一个合适的实施方案中,可以在不同时间向患者提供如本文定义的磷酰胺酯前药化合物和其他治疗剂。可以依次向患者提供如本文定义的磷酰胺酯前药化合物和其他治疗剂。例如,可以在提供其他治疗剂之前,向患者提供如本文定义的磷酰胺酯前药化合物。或者,可以在提供其他治疗剂之后,向患者提供如本文定义的磷酰胺酯前药化合物。
“其他治疗剂”
如本文定义的磷酰胺酯前药化合物可以与广泛的其他治疗剂联合用于预防或治疗癌症。这些包括可用于癌症的预防或治疗的生物制剂、免疫治疗剂和化疗剂。
虽然在下面的段落中考虑了合适的其他药剂的具体实例,但是这些不应视为对适合与本发明的化合物一起使用的其他治疗剂的范围的限制。实际上,如本文定义的磷酰胺酯前药化合物靶向癌症干细胞的能力表明,它与用于预防或治疗癌症的任意其他治疗剂联合使用可能都是有益的,不管这种其他治疗剂是否靶向癌症干细胞、非干细胞癌细胞或涉及癌症发展、维持、复发、传播的其他细胞或成分。
可以与如本文定义的磷酰胺酯前药化合物联合使用的其他治疗剂的实例包括:
(a)抗血管生成剂,任选地其中抗血管生成剂是:(i)vegf途径抑制剂,任选地是贝伐单抗(bevacizumab);(ii)酪氨酸激酶抑制剂,任选地是索拉非尼(sorafenib)、舒尼替尼(sunitinib)或帕唑帕尼(pazopanib);或(iii)mtor抑制剂,任选地是依维莫司(everolimus);
(b)烷化剂;
(c)抗代谢物;
(d)抗肿瘤抗生素;
(e)拓扑异构酶;
(f)有丝分裂抑制剂;
(g)单克隆抗体;
(h)金属药剂;或者
(i)主动或被动免疫疗法。
除上下文另有要求外,前面列举的其他治疗剂应全部被认为适合用于与上述如本文定义的磷酰胺酯前药化合物联合治疗的任意实施方案中。
患者的选择
如本文定义的磷酰胺酯前药化合物能够靶向癌症干细胞这一发明人的发现,使得可能有许多方法可以确定特定患者是否可能受益于在预防或治疗癌症例如复发性或难治性癌症中接受如本文定义的磷酰胺酯前药化合物。
因此,本发明提供了一种确定具有癌症或癌前病况的患者是否受益于用本发明的化合物预防或治疗癌症的方法,所述方法包括:测定患者的代表癌症或癌前病况的生物样品中是否存在癌症干细胞;其中生物样品中存在癌症干细胞表明患者将受益于用本发明的化合物治疗。
本发明还提供了为具有癌症或癌前病况的患者确定合适的治疗方案的方法,所述方法包括:测定患者的代表癌症或癌前病况的生物样品中是否存在癌症干细胞;其中生物样品中存在癌症干细胞表明合适的治疗方案将包括用本发明的化合物治疗患者。
本发明还提供了用于在为这种治疗而选择的患者中预防或治疗癌症的如本文定义的磷酰胺酯前药化合物,患者的选择通过包括如下的方法进行:测定患者的代表癌症或癌前病况的生物样品中是否存在癌症干细胞;其中生物样品中存在癌症干细胞表明患者适合用本发明的化合物治疗。
在合适的实施方案中,生物样品中的癌症干细胞可以通过本申请中先前讨论的它们的特征性模式的标记物的表达来鉴定。
本领域技术人员将会理解,存在许多可以在本发明的实施方案中使用的生物样品的合适实例,例如上面列出的那些。合适地,这种样品可以包括来自癌症或癌前病况的细胞。合适的生物样品可以是组织样品,例如用于组织学的样品。这种样品中的细胞可以直接评估它们的癌症干细胞标记物的表达,例如上面列出的那些。
可选地或另外地,合适的生物样品可以包含代表癌症或癌前病况细胞的基因表达的靶分子。这种靶分子的实例包括由所表达的基因编码的蛋白质或代表基因表达的核酸(例如mrna)。
可参照样品类型来选择可以评估癌症干细胞标记物表达的技术的合适的实例。在临床评估的背景下(例如用于诊断或预后目的),经常用到用于调查表达的标记物的技术,并且它们的使用对于需要在本发明的背景下实践它们的人而言是熟知的。仅举例而言,在含有蛋白质的样品中,癌症干细胞标记物的存在可以通过合适的技术、使用与所讨论的癌症干细胞标记物反应的抗体来评估。含有蛋白质癌症干细胞标记物的这种样品的实例包括组织学样品(其中标记物的存在可以通过合适的免疫细胞化学技术来观察)或来自循环的样品。这里可以使用诸如流式细胞术的技术来评估循环癌症干细胞(其被认为有助于通过转移使癌症传播)的存在。
在含有代表癌症干细胞标记物表达的核酸的样品中,这种表达可以通过合适的分子生物学技术来评估,例如通过使用合适引物的聚合酶链式反应(pcr)扩增。
合成
本文讨论的磷酰胺酯前药可以根据或类似于wo2005/012327、wo2012/117246和wo2006/100439中描述的方法合成。
现在将参考以下实施例和附图进一步描述本发明,其中:
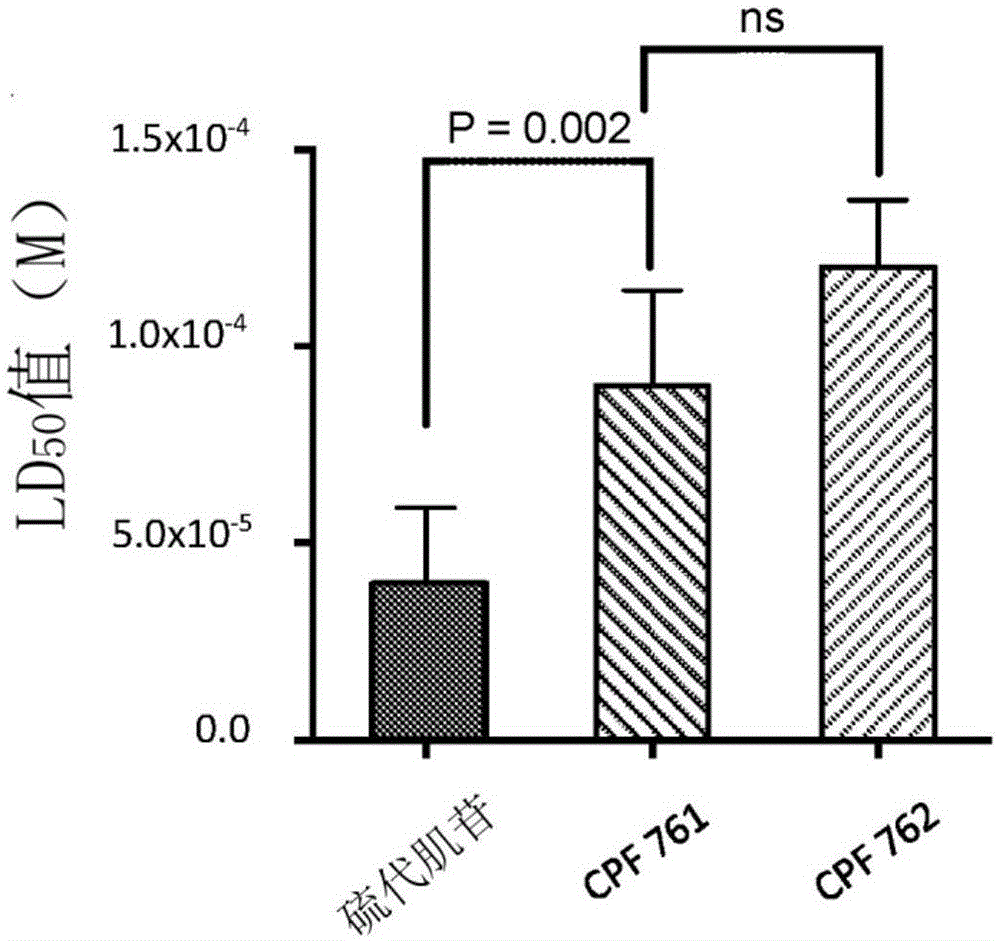
图1a显示了研究抗癌剂硫代肌苷和衍生自该剂的磷酰胺酯前药化合物的效力的结果。图1a比较了硫代肌苷、cpf761和cpf762的ld50值。所有测定均使用kg1a细胞进行,数据表示为五次独立实验的平均值(±sd)。图1b显示了研究这些化合物靶向癌症干细胞的能力的研究结果。图1b提供了硫代肌苷和磷酰胺酯前药cpf761和cpf762的白血病干细胞靶向能力的分析。所有数据均为三次独立实验的平均值(±sd)。
图2a显示了研究抗癌剂氯法拉滨和衍生自该剂的磷酰胺酯前药化合物的效力的结果。图2a比较了氯法拉滨、cpf448、cpf720和cpf727的ld50值。所有测定均使用kg1a细胞进行,数据表示为五次独立实验的平均值(±sd)。
图2b显示了研究这些化合物靶向癌症干细胞的能力的研究结果。
图3a显示了研究抗癌剂氯法拉滨,和衍生自该剂的磷酰胺酯前药化合物cpf727和磷酰胺酯前药化合物cpf448的异构体a和b的效力的结果,并且
图3b显示了研究这些化合物靶向癌症干细胞的能力的研究结果。
图4a显示了研究抗癌剂克拉屈滨和衍生自该剂的磷酰胺酯前药化合物的效力的结果。图4a比较了克拉屈滨、cpf791和cpf793的ld50值。所有测定均使用kg1a细胞进行,数据表示为五次独立实验的平均值(±sd)。图4b显示了研究这些化合物靶向癌症干细胞的能力的研究结果。图4b提供了克拉屈滨和磷酰胺酯前药cpf791和cpf793的白血病干细胞靶向能力的分析。所有数据均为三次独立实验的平均值(±sd)。
图5a显示了研究抗癌剂氟达拉滨和衍生自该剂的磷酰胺酯前药化合物的效力的结果。图5a比较了氟达拉滨、cpf682和cpf544的ld50值。所有测定均使用kg1a细胞进行,数据表示为五次独立实验的平均值(±sd)。图5b显示了研究这些化合物靶向癌症干细胞的能力的研究结果。图5b提供了氟达拉滨、cpf682和cpf544的白血病干细胞靶向能力的分析。所有数据均为三次独立实验的平均值(±sd)。
图6a显示了研究抗癌剂硫鸟嘌呤和衍生自该剂的磷酰胺酯前药化合物的效力的结果。图6a比较了硫鸟嘌呤和磷酰胺酯前药cpf775和cpf782的ld50值。所有测定均使用kg1a细胞进行,数据表示为五次独立实验的平均值(±sd)。图6b显示了研究这些化合物靶向癌症干细胞的能力的研究结果。图6b提供了硫鸟嘌呤和磷酰胺酯前药cpf775和cpf782的白血病干细胞靶向能力的分析。所有数据均为三次独立实验的平均值(±sd)。
图7a显示了研究抗癌剂fudr和衍生自该剂的磷酰胺酯前药化合物的效力的结果。图7a比较了5-fu、fudr和磷酰胺酯前药cpf373(混合物)及其纯化的异构体、cpf585、cpf381和cpf581的ld50值。所有测定均使用kg1a细胞进行,数据表示为五次独立实验的平均值(±sd)。图7b显示了研究这些化合物靶向癌症干细胞的能力的研究结果。图7b提供了5-fu、fudr和磷酰胺酯前药cpf373(混合物)及其纯化的异构体、cpf585、cpf381和cpf581的白血病干细胞靶向能力的分析。所有数据均为三次独立实验的平均值(±sd)。
图8a显示了研究抗癌剂吉西他滨和衍生自该剂的比较物磷酰胺酯前药化合物nuc-1031的效力的结果。图8a比较了吉西他滨、磷酰胺酯前药nuc-1031和纯化的rp-和sp-异构体的ld50值。图8b显示了研究这些化合物靶向癌症干细胞的能力的研究结果。图8b提供了吉西他滨和nuc-1031磷酰胺酯前药的白血病干细胞靶向能力的分析。所有数据均为三次独立实验的平均值(±sd)。
实施例和比较实施例
1磷酰胺酯前药化合物优先靶向癌症干细胞
以下研究说明了如本文所定义的磷酰胺酯前药化合物在体外优先靶向csc的能力,从而降低存在于癌细胞群中的csc的比例。将本发明所包括的磷酰胺酯前药化合物的癌症干细胞靶向能力与比较物磷酰胺酯前药化合物nuc-1031的癌症干细胞靶向能力进行比较。
1.1磷酰胺酯前药化合物和衍生它们的母体化合物在原发性急性髓性白血病原始细胞(blast)中的ld50值的比较
测定了如本文所定义的磷酰胺酯前药化合物和比较物磷酰胺酯前药化合物nuc-1031对急性髓性白血病(aml)原始细胞的原代培养物的细胞毒性作用。计算关于本发明的磷酰胺酯前药化合物和衍生它们的母体化合物的ld50值(杀死培养物中50%的肿瘤细胞所需的浓度)。可以看出(如下所示),某些磷酰胺酯前药化合物表现出比衍生它们的母体化合物更大的效力。将如本文所定义的磷酰胺酯前药化合物(及其母体化合物)的ld50值与比较物磷酰胺酯前药nuc-1031及其母体化合物吉西他滨进行比较。
在原代急性髓性白血病细胞中的体外细胞毒性测定
从新诊断的、以前未经治疗的、急性髓性白血病(aml)患者收集骨髓样品于乙二胺四乙酸(edta)中。通过使用histopaque(sigma,poole,uk)的密度梯度离心来富集aml原始细胞,随后保存在补充有10%胎牛血清(fbs)的roswellparkmemorialinstitute培养基(rpmi)中。用一系列实验浓度的磷酰胺酯前药化合物(如本发明所涵盖的,或比较物磷酰胺酯前药nuc-1031)或磷酰胺酯前药的母体化合物处理细胞,并孵育48小时。将所有培养物维持在37℃下、5%co2湿润氛围中。
原代aml细胞中体外细胞凋亡的测量
收集细胞并用cd34-异硫氰酸荧光素(fitc)(bdbiosciences,buckingham,uk)标记,然后将细胞重悬于200μl含有4μl膜联蛋白v的结合缓冲液(ebioscienceltd,hatfield,英国)中,其中膜联蛋白v用别藻蓝蛋白(apc)标记。使用accuric6流式细胞仪(bectondickinson,ca,usa)定量cd34+aml细胞中的细胞凋亡。获得至少10,000个事件,并随后使用flowjo软件(treestarinc.,ashland,or,usa)分析数据。所有ld50值(杀死50%细胞所需的药物浓度)均来自剂量-反应曲线。
原代aml细胞中cd34+/cd123+亚群的鉴定和定量
通过cd34和cd123的双重表达鉴定了推定的白血病干细胞。评估了这些细胞对磷酰胺酯前药和它们的母体化合物作用的相对敏感性,作为在暴露于摩尔当量的每种试剂后仍然存活的这些细胞的百分比的函数。
该研究的结果允许计算关于磷酰胺酯前药化合物和衍生它们的母体抗癌剂所获得的平均ld50值。ld50值低于其母体化合物的ld50值表明磷酰胺酯前药衍生物的效力增加,并且在该研究中获得的结果将在下面进一步讨论。
还研究了磷酰胺酯前药化合物及其母体抗癌剂在一系列实验浓度下消耗aml原始细胞培养物中的csc的能力,并且结果报告如下。磷酰胺酯前药或母体化合物靶向干细胞的能力由处理后的细胞群中存在的癌症干细胞的比例降低来证明。
1.2nuc-1031优先靶向csc
在aml细胞系kg1a中研究了nuc-1031和吉西他滨各自靶向csc的能力。kg1a细胞系被特别选择用于该研究,因为该群体内的csc呈现出使得它们易于与该群体内的非干细胞癌细胞(也称为“本体”癌细胞)区分的lin-/cd34+/cd38-/cd123+免疫表型。
1.3kg1a细胞培养条件
将急性髓性白血病(aml)kg1a细胞系维持在补充有100单位/ml青霉素、100μg/ml链霉素和20%胎牛血清的rpmi培养基(invitrogen,paisley,uk)中。随后将细胞等分(105个细胞/100μl)到96孔板中,并且在nuc-1031或吉西他滨的存在下,在湿润的、5%的二氧化碳氛围中在37℃下孵育72小时,其中nuc-1031或吉西他滨的浓度是为每种化合物实验确定的浓度。另外,进行不添加药物的对照培养。随后通过离心收获细胞,并使用膜联蛋白v测定法通过流式细胞术进行分析。
1.4体外细胞凋亡的测量
通过离心收获培养的细胞,然后将其重悬于195μl的富钙缓冲液中。随后,向细胞悬液中加入5μl膜联蛋白v(caltagmedsystems,botolphclaydon,uk),细胞在黑暗中孵育10分钟,然后洗涤。最后将细胞与10μl碘化丙锭一起重悬于190μl的富钙缓冲液中。如前所述,通过双色免疫荧光流式细胞术评估细胞凋亡。随后计算每种核苷类似物和磷酰胺酯前药的ld50值(杀死培养基中50%细胞所需的剂量)。
1.5白血病干细胞室的免疫表型鉴定
在许多各种不同浓度的每种核苷类似物及其各自的磷酰胺酯前药的存在下,将kg1a细胞培养72小时。然后收集细胞并用抗谱系抗体(pe-cy7)、抗cd34(fitc)、抗cd38(pe)和抗cd123(percpcy5)的混合物标记。随后鉴定表达白血病干细胞(lsc)表型的亚群,并用培养基中剩余所有活细胞的百分比表示。然后将剩余的干细胞的百分比绘制在剂量-反应图上,并且比较多种浓度的磷酰胺酯前药及其各自的母体化合物处理下的癌症干细胞的比例,以确定它们是否优先靶向癌症干细胞。
1.6统计学分析
使用单因素anova评估在这些实验中获得的数据。所有数据使用综合k2检验(omnibusk2test)被证实为高斯或高斯近似。由非线性回归和s形剂量-反应曲线的最佳拟合线分析计算ld50值。所有统计分析使用graphpadprism6.0软件(graphpadsoftwareinc.,sandiego,ca)来进行。
1.7硫代肌苷和硫代肌苷的磷酰胺酯前药衍生物
与母体化合物相比,硫代肌苷的磷酰胺酯前药衍生物表现出降低的效力(图1a)。
在kg1a细胞中,与非干细胞癌细胞相比,用硫代肌苷、cpf-761或cpf-762处理导致癌症干细胞比例降低(图1b),表明硫代肌苷、cpf-761和cpf-762优先靶向癌症干细胞。
此外,cpf-761和cpf-762对癌症干细胞的选择性高于硫代肌苷。在这三种化合物中,cpf-761似乎是对癌症干细胞最具选择性的,并且与母体化合物相比,选择性的增加是统计学显著的。
1.8氯法拉滨和氯法拉滨的磷酰胺酯前药衍生物
cpf-727(氯法拉滨的磷酰胺酯前药衍生物)显示出的效力与母体化合物的效力没有显著差异,而磷酰胺酯前药cpf-448和cpf-720与母体化合物相比均表现出降低的效力(图2a)。对cpf-448的异构体a和b的性质的进一步研究表明,这两者的效力均显著低于母体化合物,但是异构体a比异构体b显著更有效。
在kg1a细胞中,与非干细胞癌细胞相比,用氯法拉滨、cpf-448、cpf-720或cpf-727处理显示癌症干细胞的比例降低(图2a)。这表明氯法拉滨、cpf-448、cpf-720和cpf-727也优先靶向癌症干细胞。即使在约6×10-8m的非常低的浓度下也观察到了这种选择性效果。还应注意,cpf-448对癌症干细胞的选择性高于氯法拉滨本身。
当研究cpf-448的不同异构体选择性靶向癌症干细胞的能力时,异构体a被证明比异构体b更具选择性,并且在选择性方面,仅异构体a显示出统计学上显著的增加。与母体化合物和磷酰胺酯前药化合物cpf-727相比,均注意到了这种选择性的增加(图3b)。
1.9克拉屈滨和克拉屈滨的磷酰胺酯前药衍生物
与母体化合物相比,克拉屈滨的磷酰胺酯前药衍生物表现出降低的效力(图4a)。
在kg1a细胞中,与非干细胞癌细胞相比,用克拉屈滨、cpf-791或cpf-793处理导致癌症干细胞比例降低(图4b),表明这三种化合物也优先靶向癌症干细胞。在用cpf-793处理的细胞中,癌症干细胞比例的降低尤其显著。即使在非常低的浓度(约6×10-8m)下也观察到了该化合物的选择性。
此外,磷酰胺酯前药衍生物(cpf-791和cpf-793)均显示出比母体化合物—克拉屈滨更高的对癌症干细胞的选择性。对于磷酰胺酯前药cpf-793,这种选择性的增加在统计学上是显著的。
1.10氟达拉滨和氟达拉滨的磷酰胺酯前药衍生物
与母体化合物相比,氟达拉滨的磷酰胺酯前药衍生物表现出降低的效力(图5a)。
在kg1a细胞中,与非干细胞癌细胞相比,用氟达拉滨、cpf-544或cpf-682处理导致癌症干细胞比例显著降低(图5b)。这表明氟达拉滨、cpf-544或cpf-682优先靶向癌症干细胞。发现磷酰胺酯前药衍生物(cpf-544和cpf-682)对癌症干细胞的选择性与氟达拉滨相当。
1.11硫鸟嘌呤和硫鸟嘌呤的磷酰胺酯前药衍生物
与母体化合物相比,硫鸟嘌呤的磷酰胺酯前药衍生物表现出降低的效力(图6a)。
在kg1a细胞中,与非干细胞癌细胞相比,用硫鸟嘌呤、cpf-782或cpf-775处理显示癌症干细胞比例大幅降低(图6b)。这表明所有这三种化合物均优先靶向癌症干细胞。在这些化合物中,cpf-782是最具选择性的,但cpf-782和cpf-775在某些浓度下均显示出选择性的统计学上显著的增加。
1.12fudr和fudr的磷酰胺酯前药衍生物
当研究fudr和磷酰胺酯前药cpf-585、cpf-373(异构体a)、cpf-373(异构体b)、cpf-381或cpf-581(均衍生自fudr)的体外效力时,发现除cpf-585之外的所有磷酰胺酯前药衍生物都具有比fudr显著更高的效力(图7a)。例如,发现cpf-581的ld50值为0.027μm,相比之下,fudr的ld50值等于1.18μm,表明cpf-581的效力比fudr高50倍。
在kg1a细胞中,与非干细胞癌细胞相比,用fudr、cpf-585、cpf-373(异构体a)、cpf-373(异构体b)、cpf-381或cpf-581处理显示癌症干细胞的比例降低,表明这些处理优先靶向癌症干细胞(图7b)。在用cpf-373(异构体a)、cpf-373(异构体b)、cpf-381或cpf-581处理的细胞中,癌症干细胞的减少尤其显著,其中甚至在以约为8×10-8m的非常低的浓度处理的细胞中,癌症干细胞数量的比例也降低。还应注意的是,所有上述fudr的磷酰胺酯前药衍生物均显示出比fudr更高的对癌症干细胞的选择性,在cpf-373的异构体的情况下选择性的增加是统计学显著的。
1.13比较实施例:nuc-1031优先靶向癌症干细胞
在kg1a细胞中,与吉西他滨相比,nuc-1031(及其纯化异构体)显示出增加的体外效力(图8a)。然而,未分离的混合物与nuc-1031的纯化异构体之间的效力没有显著差异。
与吉西他滨相比,nuc-1031显示出优先靶向csc。在亚微摩尔浓度的磷酰胺酯前药中,仍然能观察到这一点(图8b)。同样,在我们的实验系统中,nuc-1031的两种纯化异构体在它们靶向csc的能力方面没有显示出显著差异。
可以看出,nuc-1031在体外的生物活性非常类似于上面提到的许多其他磷酰胺酯前药化合物所观察到的生物活性。因此,发明人有充分的理由相信这些磷酰胺酯前药化合物也将具有(share)nuc-1031的临床功效,这将在下面的对比实施例中进一步讨论。
2临床比较实施例:nuc-1031能够治疗人类患者的复发性或难治性癌症
以下数据是nuc-1031在患有晚期进展性癌症(advanceprogressivecancer)的人类患者的临床研究中生成的,所述晚期进展性癌症对于迄今为止使用的所有常规疗法均是难治性或复发性的。结果清楚地说明了nuc-1031成功治疗难治性癌症的能力。
虽然该研究的剂量递增部分的主要目标是确定ii期推荐剂量(rp2d)和安全性特征,次要目标包括确定pk特征,但是作为该研究的一部分,也观察到了对患有一系列难治性癌症的患者的有效治疗。
共有68名患者进入该剂量递增研究,其中49名可评估临床应答,因为他们已经接受了至少2个周期的nuc-1031,因此有资格进行recist1.1评估。
表1:progem1研究中的最佳总疗效(bestoverallresponse)
nuc-1031在5至30分钟的时间内静脉内缓慢团注施用。
·方案a:在4周周期的第1、8、15天施用nuc-1031。
·方案b:在4周周期的第1、5、8、12、15、19天施用nuc-1031。
可评估的患者[n=49]
可评估的患者是接受≥2个周期的nuc-1031的患者和因此有资格在第2个周期结束时进行recist1.1评估。如果疾病响应持续时间(以月为单位计)后面跟着“+”,则表明截至最近的截止日期正在进行疾病控制。
患者004乳腺癌:病情稳定
女性(67岁)
2002年被诊断为患有乳腺2级浸润性导管癌(er+ve,her2-ve)。作为一线治疗,她被给予手术并接受了辅药表柔比星+多西他赛、放疗并用他莫昔芬(tamoxifen)然后用阿那曲唑(anastrozole)的激素维持治疗至2010年。在2010年,在患者的骨中诊断出病情转移,患者接受姑息性放疗并开始用伊本膦酸钠(ibondronate)和氟维司群(fulvestrant)作为二线治疗。
2012年注意到了病情进展,她被给予使用卡培他滨(capecitabine)和诺维本(navelbine)的三线化疗4个月,但在治疗过程中,她的病情进展,有新的肝脏和肺转移。患者于2012年9月开始使用pi3k抑制剂(1期研究),接受了2个周期(2个月),但在治疗过程中病情进展,肝转移瘤尺寸增加。
于2012年12月3日开始以每周500mg/m2使用nuc-1031。完成了6个周期,对治疗的耐受性良好。在研究结束时患者病情稳定,并要求慈善性(compassionate)继续第七个周期的nuc-1031,然后在第七周期后选择“休药期”。在病情进展之前,在没有进一步的治疗的情况下,又保持了5个月的稳定。
按照recist,病情稳定(12个月)。
患者005卵巢癌:病情稳定
女性(58岁)
2009年被诊断为患有3c期(3级)双侧浆液性卵巢癌。2009年6月23日,患者进行了经腹全子宫切除术和输卵管卵巢切除术,但不能切除的网膜沉积物留在原位。
作为一线化疗,2009年10月,患者接受了6个周期的卡铂+紫杉醇,但在最终治疗周期对卡铂产生了过敏反应。
首次复发是8个月后,在2010年12月,患者开始接受6个周期的caelyx加vegfr-2抑制剂(ii期临床研究),保持vegfr-2单一疗法作为维持。第二次复发是9个月后,ca125上升且ct证实左侧盆腔肿块,测量长度为3.2cm。开始接受三线化疗,并接受6个周期的每周紫杉醇,最初有中度响应,ca125下降,肿瘤体积减小。5个月后,随着ca125水平升高和肿瘤尺寸增加证实了病情进展。患者在2012年3月接受了最后一剂紫杉醇。
2013年1月7日开始以每周500mg/m2使用nuc-1031。按照研究方案完成6个周期,病情稳定,然后再进行6个月的nuc-1031,导致12个月的治疗。病人对治疗耐受性良好。ca125水平从研究开始时的208下降到第6个周期结束时的140。患者选择在12个月后停止治疗,在停止治疗后3个月复发。
按照recist,病情稳定(15个月)。
患者006肝胆管型肝癌:病情稳定
男性(43岁)
2009年被诊断为患有原发性肝胆管型肝癌。进行了whipple手术,对患者给予了6个周期的辅药吉西他滨。在2012年2月疾病复发时,患者开始使用capeox直至2012年7月。当年晚些时候,ct扫描显示骨转移,并用一疗程的下背部放疗对其进行了治疗。
于2013年1月31日开始以每周两次375mg/m2使用nuc-1031,并完成2个周期。更改为500mg/m2的方案a,并接收1个另外的剂量。仅两次剂量的nuc-1031后,ca19.9从125,002降至59,285。ct扫描显示转移性肺部病灶和淋巴结从基线减少。
按照recist,病情稳定(3个月)。
患者007结肠直肠癌:病情稳定
男性(73岁)
2008年被诊断为患有结肠直肠癌。在6个周期的folfox后,于2009年4月去除原发性肿瘤。2009年8月进一步手术,进行肝切除术和回肠造口术。2010年7月被纳入piccolo试验(帕尼单抗+伊立替康)。六个月后接受射频消融(rfa)加胆管支架治疗,以治疗其他并发症。2011年12月,他接受了7个周期的西妥昔单抗+伊立替康+5-fu,但随后病情进展。
于2013年2月11日开始以每周两次375mg/m2使用nuc-1031,并完成0.5个周期。
在治疗延误之后,为了方便起见,病人要求改为每周500mg/m2的方案,并完成2个周期。在治疗期间,他发生血小板减少症(g3)(可能与基线时发现的脾肿大有关)。2013年2月25日的超声扫描显示门静脉受压迫(由于脾肿大),伴有可能的血栓形成。cea从361降至286,ca19.9由3,151降至2,957。
按照recist,病情稳定(3个月)。
患者008不明原发性癌:病情稳定
女性(37岁)
2012年被诊断为患有不明原发性腹膜后肿块和转移性病情。自2012年8月起,在4个周期的吉西他滨+顺铂后,肿瘤快速进展。
于2013年2月12日开始以每周两次375mg/m2使用nuc-1031,并完成2个周期。在第1个周期期间,患者在治疗时症状缓解,并且情绪和健康得到普遍改善。发生短暂性(g3)转氨酶升高(alt和ast)。基线时出现的淋巴水肿在第2周期期间进展。
同时还发生了一种被评估为不太可能与研究药物有关的胸腔积液(g3)。
按照recist,病情稳定(3个月)。
患者010子宫内膜癌:病情稳定
女性(60岁)
2012年被诊断为患有子宫内膜癌(iv期,3级)。2012年2月,患者接受了对盆腔肿块的放疗和6个周期的卡铂+紫杉醇。在2012年11月病情进展时,接受3个周期的紫杉醇,然后在2013年1月经一个周期的美可治(megace)后快速进展。
2013年3月19日开始以每周750mg/m2使用nuc-1031,并完成1个周期。在第1个周期期间,发生中性粒细胞减少症(g3),其在gcsf干预后数天后消退。第2个周期的剂量降低至500mg/m2,并在该剂量下完成5个周期。病人有短暂的3级贫血。ca125从727降低至488。患者在研究中病情稳定,并在停止nuc-1031后又维持了3个月。
按照recist,病情稳定(9个月)。
患者011子宫癌肉瘤:病情稳定
女性(67岁)
被诊断为患有子宫癌肉瘤(子宫复发性mmmt)和肝、肺和主动脉旁淋巴结转移。在2011年6月进行手术,彻底子宫切除术和双侧输卵管卵巢切除术。从2011年6月至2012年11月,患者接受了辅药顺铂和多柔比星,完成6个周期(对治疗响应良好,几乎完全缓解)。
2012年6月接受进一步手术,行前脏器切除(ananteriorexenteration),切开直肠,并且修复和形成端对端吻合的回肠管道。2012年6月进行了进一步的手术,当时她接受了将输尿管植入回肠管道的剖腹手术以及hartman的直肠瘘手术。2013年3月完成6个周期的每周紫杉醇,但在该疗程的治疗中肿瘤进展。
于2013年4月15日开始以每周两次375mg/m2使用nuc-1031,并完成2.6个周期。按照recist,患者病情稳定,肿瘤体积减小26%。治疗期间有短暂的中性粒细胞减少症(g3)和低血红蛋白(g2)。根据患者的要求,在第4个周期改为每周625mg/m2的方案,并又完成了1个周期。2013年8月第4个周期结束时(第四个月末),ct扫描显示病情进展。出现了三个新的病灶:肺中2个,后腔静脉(retrocava)淋巴结中1个。肝脏的原始病灶尺寸继续减小,肺中其他靶病灶保持稳定。病人从研究中退出。
按照recist,病情稳定(4个月)。
患者012肝胆管型肝癌:病情稳定
女性(48岁)
2013年在调查右侧腹痛后,被诊断为患有iv期,3级肝胆管型肝癌。ct扫描显示有肝、肺和腹膜转移。2013年1月至4月,患者接受3个周期的顺铂+吉西他滨,伴随快速病情进展。
于2013年5月16日开始以每周两次375mg/m2使用nuc-1031,并完成3个周期。根据患者的要求,第4个周期改为每周625mg/m2的方案,又完成了3个周期,且对治疗的耐受良好。在研究结束时患者病情稳定,并又接受两个周期,总共8个周期。
按照recist,病情稳定(8个月)。
患者013宫颈癌:部分缓解
女性(51岁)
2011年9月被诊断为患有不能手术的、分化不良的鳞状细胞宫颈癌(2b期,g2/3)。用顺铂(4个周期)加放疗对其进行治疗,临床医生述有“良好的缓解”。
2012年7月,患者发生病情进展,2012年7月至2012年11月期间给予6剂卡铂+紫杉醇加西地尼布(cediranib)(circca试验),达到病情稳定。2013年4月,mri扫描显示病情进展,髂淋巴结累及增加。
2013年5月28日开始以每周750mg/m2使用nuc-1031,并完成2个周期。剂量降低至625mg/m2,并又完成了4个周期。在研究之前有较低的骨盆疼痛,但治疗时该疼痛缓解,阿片类药物使用显著减少。
由于双侧金属输尿管支架,在开始nuc-1031之前以及在治疗期间,患者有复发性尿路感染的问题。
在完成progem1研究后,患者部分缓解,然后以每周500mg/m2的降低剂量又完成了3个周期,总计9个周期的nuc-1031。病人的肿瘤已经缩小至一定程度,以至于她正在被重新评估是否进行进一步的减积手术(debulkingsurgery)。
按照recist,部分缓解(9个月,pfs11个月)。
患者014间皮瘤:病情进展
女性(51岁)
患者在2012年被诊断为在右侧半胸部患有复发性上皮间皮瘤。接受了4个周期的培美曲塞(permetrexed)+卡铂。在2012年12月进展时,进入临床研究以接受达沙替尼,但没有缓解,并且病情进展。
于2013年6月20日开始以每周750mg/m2使用nuc-1031,并完成1个周期。剂量降低至625mg/m2,并又完成了1个周期。退出研究。
病情进展。
患者015癌症(不明原发性):部分缓解
男性(54岁)
在2012年9月被诊断为患有不明原发性癌症,已调查了腹痛症状。
当时他注意到具有肝和肺转移。肝活检显示分化不良的癌症,伴有局灶性腺体分化。在“cup”临床研究中,从2012年10月直至2013年4月接受了8个周期的表柔比星+顺铂+卡培他滨,但是发展为伴有水肿、胸腔积液和腹水的病情进展,并且体重增加了20kg。在这一方案中,患者经历了严重的恶心、呕吐和疲劳。
在2013年6月20日开始以每周750mg/m2使用nuc-1031,并接受了2次剂量。剂量降低至625mg/m2完成第1个周期,并在较低剂量下又接受了5个周期。研究入组患者有明显的下肢水肿和腹部腹水(约20kg)。第1个周期过后,据报道,水肿和腹水已经消失,患者感觉好很多。在第1个周期期间,第8天发生血小板减少症(g3),淋巴细胞减少症(g3)和中性粒细胞减少症(g2),这造成了两周的治疗延误。第2个周期结束,扫描显示所有靶病灶减少,recist评估为病情稳定。第4个周期结束,扫描显示所有靶病灶进一步减少,recist评估为部分缓解,持续至研究结束。要求慈善性继续,并在这个剂量下又完成了3个周期。在每个周期的第8天后,开始显示血球计数持续下降。
从第10个周期开始,剂量进一步降低至500mg/m2,具有期望的效果,并又完成了10个周期(共19个)。
2015年1月9日的最新ct扫描显示持续的部分缓解(肿瘤尺寸减小约58%),靶肠系膜淋巴结不再可见。在第10个周期期间在两条腿中均有液体积聚,但对螺内酯的响应良好并完全消退。在19个月后,于2014年12月12日原位更换了希克曼线(hickmanline),没有副作用。病人临床表现非常好。与ci讨论后,患者很高兴有一个治疗休息期,将被转回到肿瘤科医生来商讨选择。
按照recist,部分缓解(20+个月;pfs24+个月)正在进行。
患者017肺癌:部分缓解
女性(60岁)
2011年9月被诊断为患有肺腺癌,伴有肺、肝和肾上腺转移。纵隔、腹内和颈部淋巴结也有疾病。患者于2011年12月进行了胸膜固定术,随后接受了3个周期的顺铂+培美曲塞,她在2012年3月完成这3个周期并实现部分缓解。2012年3月至9月,她共接受了6个周期的多西他赛,部分缓解。2013年4月,她出现病情进展,重新接受多西他赛治疗,但是经过2个周期的多西他赛治疗,病情仍然进展。
在2013年7月开始以每周750mg/m2使用nuc-1031,并接受了1剂。剂量降低至625mg/m2,她接受了2剂以完成第1个周期,并又完成了5个周期。由于肺部感染和低血小板导致4周的治疗延误。在患病的淋巴结,特别是颈部,有显著缓解。
靶病灶持续缩小,这由第2个周期和第4个周期后的ct扫描可见一斑。在这个时期,recist评估将该疗效分类为病情稳定。
在第6个周期结束时,ct扫描显示研究结束时所有靶病灶进一步减少,且recist评估变为部分缓解。要求在慈善使用的基础上继续,并又完成了3个周期。患者对nuc-1031耐受性良好,声音嘶哑和吞咽困难得到改善。2014年4月17日第9个周期结束时扫描显示病情进展,靶病灶和新的肝病灶生长。退出研究。
按照recist,部分缓解(3个月;pfs10个月)。
患者018肺癌:病情稳定
女性(65岁)
2011年5月被诊断为患有鳞状细胞肺癌。在squire试验中,从2011年6月至10月接受6个周期的吉西他滨+顺铂。2012年4月病情复发,她从2012年5月至9月接受了对右侧肺门的单次分割姑息性放疗(singlefractionpalliativeradiotherapy)和6个周期的多西他赛。
2012年10月病情进展。2012年12月开始厄洛替尼(erlotinib)治疗3个月,但2013年3月发现右侧肺门有病情进展。
于2013年7月25日开始以每周625mg/m2使用nuc-1031,并完成了4个周期。按照recist,病情稳定(4个月)。患者由于腔静脉阻塞引起的症状恶化而退出研究。接受低剂量放疗,试图解决阻塞问题,在慈善介入项目中重新开始使用nuc-1031。又接受一次剂量的nuc-1031后,同意将患者从慈善介入项目中撤出。撤出时病人的大部分病情稳定。
按照recist,病情稳定(4个月)。
患者021输卵管癌:部分缓解
女性(61岁)
2008年被诊断为患有卵巢复发性2a期、2级子宫内膜样腺癌。她接受了6个周期的卡铂+紫杉醇,于2008年10月完成。2011年6月,她复发,并注意到有胸膜、包膜下肝、网膜和肠系膜肿瘤结节,并被纳入icon6研究,接受6个周期的卡铂加紫杉醇+/-西地尼布。她对治疗取得了部分缓解。持续维持西地尼布至2012年3月,此时由于ca125升高和腹膜病情进展导致治疗中断。
从2012年3月到7月,她接受了6个周期的每周紫杉醇,腹膜疾病初期有良好的放射疗效。2013年2月,她被发现有新的积液且腹膜病情加重。她在aktres研究中开始使用卡铂+紫杉醇且每日使用akt抑制剂,但在3个周期后于2013年5月出现病情进展(新的盆腔肿块)。
于2013年8月28日开始以每周625mg/m2使用nuc-1031,并完成了6个周期。注意到腹部腹水显著减少;开始研究前,每两周需要排水一次,自从开始使用nuc-1031后,没有再要求排水。患者对nuc-1031耐受良好。在研究结束时,按照recist,病情稳定。要求在慈善使用的基础上继续,并又完成了一个周期。2014年2月26日第7个周期结束时ct扫描显示,肿瘤体积进一步减小,这确认了按照recist,为部分缓解。ca125显著缓解:从基线(372)至第6个周期结束时(35),减少91%。
按照recist,目前最佳总疗效是部分缓解(3个月),或者按照gcig标准,最佳总疗效是部分缓解(9个月)。
部分缓解。
患者024不明原发性癌症:病情进展
女性(51岁)
2012年4月被诊断为患有不明原发性癌症。2012年4月至10月,接受capox,8个周期。2012年10月接受伊立替康,2012年11月加上贝伐单抗,但没有缓解。
于2013年9月26日开始以每周675mg/m2使用nuc-1031,并完成了2个周期。第2个周期结束时,ct扫描显示病情进展。
病情进展。
患者025间皮瘤:病情稳定
男性(54岁)
2013年3月被诊断患有右肺的t4n3m0上皮样间皮瘤。2013年5月至8月,接受了4个周期的培美曲塞+顺铂。
2013年10月23日开始以每周725mg/m2使用nuc-1031,并完成了4个周期。c4结束时ct扫描显示病情进展。退出研究。
按照recist,病情稳定(4个月)。
患者026结肠直肠癌:病情稳定
女性(63岁)
2007年2月被诊断为患有结肠直肠癌,t4n2,伴有肺和膀胱转移。2007年11月,接受辅药folfox,12个周期。发展为盆腔复发性疾病并于2009年接受卡培他滨。
2012年复发,2012年9月接受folfiri,并接受卡培他滨+伊立替康直至2013年1月。2013年7月ct显示病情进展,骶前肿瘤复发,其造成骶骨破坏,并出现肺结节。
于2013年10月17日开始以每周725mg/m2使用nuc-1031,并完成了4个周期。疼痛显著改善,阿片类止痛药的使用量急剧下降。第4个周期结束时,ct扫描显示病情进展。
按照recist,病情稳定(4个月)。
患者027卵巢癌:病情稳定
女性(46岁)
2009年12月被诊断为两个卵巢患有浆液性腺癌。全子宫切除术、双侧输卵管卵巢切除术和网膜切除术(omentectomy)后,她接受了6个周期的卡铂+紫杉醇,于2010年5月实现了完全缓解。患者于2011年6月复发,并接受了卡铂+紫杉醇,6个周期(icon6研究)。2012年12月,又给予患者3个周期的吉西他滨+卡铂,但对卡铂有过敏反应,将卡帕转为顺铂。她在2013年4月共完成了6个周期,并实现了部分缓解。之后是6个月的他莫昔芬,但2013年7月ct扫描显示新的纵隔淋巴结累及,且ca125水平升高。2013年10月ct扫描显示腹膜沉积物的尺寸增加。
于2013年10月30日开始以每周725mg/m2使用nuc-1031。第1个周期第1天后出现alt升高(g3),该队列(cohort)的dlt从基线的96上升到第7天的256。几天后,alt恢复到g2,从而允许患者以675mg/m2的降低剂量接受第1个周期的第8天治疗。以降低剂量完成了第1个周期,并继续又接受了3个周期。按照recist,患者实现病情稳定,肿瘤体积减小23%。ca125从基线时的188下降到第6个周期结束时的99。由于轻微的中性粒细胞减少,第5个周期的剂量进一步降低至625mg/m2。以这个剂量完成研究,没有其他问题。要求慈善性继续,并又接受了1个周期。
按照recist,病情稳定(8个月)。
患者029乳腺癌:病情稳定
女性(53岁)
2002年被诊断为患有转移性乳腺癌(er和pgr阳性),伴有多发性骨和肝转移。接受6个周期的fec、辅助放疗和他莫昔芬与戈舍瑞林。2010年,检测到新的骨转移并用诺雷得(zoladex)、来曲唑和帕米膦酸二钠(pamidronate)治疗。2011年7月,改用诺雷得和依西美坦(exemestane),其在11月份用氟维司群(faslodex)增强。2012年进一步进展时,接受了卡培他滨+泽泰(zometa),然后是紫杉醇,仅3个周期。2013年5月开始用rucaparib治疗。2013年7月出现进行性肝疾病,并接受3个周期的吉西他滨+卡铂。
于2013年11月14日开始以每周725mg/m2使用nuc-1031。完成3个周期。不幸的是,在家里遭受致命的心脏骤停,与研究不相关。
按照recist,病情稳定(4个月)。
患者030卵巢癌:病情稳定
女性(62岁)
2012年被诊断为患有卵巢浆液性腺癌。接受6个周期的辅药卡铂+紫杉醇至2012年7月,实现完全缓解。于2013年8月病情进展,开始使用卡铂+楷莱(caelyx),3个周期后进展。
于2013年11月21日开始以每周725mg/m2使用nuc-1031。完成3个周期,且对研究药物耐受良好。按照recist,第2个周期结束时ct扫描显示病情稳定。不稳定的饮食问题导致脱水和营养不良,这导致治疗延误时间过长。退出研究。
按照recist,病情稳定(3个月)。
患者031肝胆管型肝癌:病情进展
女性(76岁)
2013年7月被诊断为患有肝胆管型肝癌。7月27日,她接受了改良的whipple手术。在手术时,她被指出有多个肝转移。2013年8月,她开始被每两周一次给予吉西他滨+奥沙利铂,持续6个周期。
于2013年12月9日开始以每周750mg/m2使用nuc-1031,并完成2个周期。第2个周期结束时ct扫描显示病情进展。
退出研究。
患者032食管癌:病情稳定
男性(56岁)
2013年6月被诊断为患有食管鳞状细胞癌。2013年7月至9月期间接受了3个周期的顺铂+卡培他滨。病情进展,伴有腹膜和肺转移。2013年10月插入食管支架以控制吞咽困难的症状。
于2013年12月16日开始以每周750mg/m2使用nuc-1031,并完成了2个周期。按照recist,第2个周期结束时ct扫描显示病情稳定。患者遇到肺/气管瘘困难。由于临床进展而退出研究。
按照recist,病情稳定(2个月)。
患者033肝胆管型肝癌:病情稳定
女性(37岁)
2013年6月被诊断为患有晚期肝胆管型肝癌,伴有肝、腹膜、主动脉旁淋巴结转移及肺小结节。6月份,她进行了肝活检,显示可能有分化不良的肝胆管型肝癌,有一些特征提示肝脏原发性。2013年7月,她开始了吉西他滨和顺铂的化疗,接受了6个周期,由于中性粒细胞减少性败血症而入院,因此省略了第5个周期中的一部分。
不幸的是,虽然她的间隔扫描显示部分缓解,但在2013年11月28日进行的治疗后ct扫描显示病情进展,伴有稳定性肝病灶,但其肺部转移瘤尺寸增加并出现一些新的腹膜沉积物。她也被认为患有胸骨溶解性病灶(lyticsternallesion)。
于2014年1月3日开始以每周750mg/m2使用nuc-1031,并完成了4个周期。按照recist,第2个周期结束时ct扫描显示病情稳定。第4个周期结束时扫描显示病情进展,患者退出研究。
按照recist,病情稳定(3个月)。
患者036肾癌:病情稳定
男性(20岁)
2012年12月被诊断为患有髓质细胞肾癌。从2013年1月至7月,接受5个周期的吉西他滨+紫杉醇+卡铂,在治疗期间病情稳定。患者由于血小板减少症和中性粒细胞减少症(其需要g-csf干预),因而治疗延误。2013年7月复发后开始使用吉西他滨+多柔比星,但在2013年9月,经过2个周期治疗后,病情进展。
2014年1月28日开始以每周825mg/m2使用nuc-1031,并完成了4个周期。在第1个周期期间患者经历了疲劳和疲倦。停止使用劳拉西泮(lorazepam),他变得更加警觉(alert)。他主诉他对nuc-1031的耐受性比先前的方案好得多。第4个周期结束时ct扫描显示持续病情稳定,肿瘤体积减少7%。第5个周期的第1天后发生血小板减少症(g3),剂量降低至750mg/m2。第5个周期第8天后出现疲劳、食欲不振,没有进一步的治疗。由于临床进展退出研究。
按照recist,病情稳定(5个月)。
患者037胰腺癌:部分缓解
女性(70岁)
2013年3月被诊断为患有胰腺癌。计划于2013年3月26日进行whipple手术,但由于大量粘连,癌症不可切除,但采取了活检。肝楔形切除证实为转移性疾病。组织学显示为中度分化的腺癌。患者从2013年5月至10月接受了6个周期的吉西他滨治疗。2013年11月的ct扫描提示胰腺肿瘤部分缓解,但在肝脏左叶外侧有新的转移。
2014年2月4日开始以每周1,000mg/m2使用nuc-1031,并以这一剂量接受了1个周期的治疗。在这个时候,由于这一队列中一名患者(患者039)的dlt,dsmc决定将该队列中所有患者的剂量降低至900mg/m2。患者以新剂量又接受了一个周期的治疗。按照recist,第2个周期结束时ct扫描显示病情稳定,肿瘤体积减少18.4%。
腹部和背部疼痛有显著改善;患者正在服用奥施康定(oxycontin)80mgbd,且现已停止使用所有吗啡。肿瘤标记物也有非常显著下降:ca19.9从基线时的15,000降至4,000,cea从基线时的536降至42。疲劳成为每个周期后的主要问题。2014年4月29日的ct扫描显示肿瘤体积进一步减小至30%,从而按照recist,实现了部分缓解。患者食欲不振、严重疲劳,并撤出研究。
按照recist,部分缓解(1个月;pfs4个月)。
患者038卵巢癌:病情进展
女性(65岁)
2000年被诊断为患有卵巢的复发性3c期3级浆液性腺癌。2000年11月,她接受了经腹全子宫切除术、双侧输卵管卵巢切除术和减积手术,剩下微小残留病灶。接受6个周期的每周3次卡铂+紫杉醇治疗,直至2001年3月。2002年复发后接受了6个周期的卡铂加依托泊苷,至2003年3月完全缓解。2005年又复发,再次进行减积手术,然后为卡铂+吉西他滨×6个周期,2006年7月完成并完全缓解。在2009年复发后,需要进一步的减积手术,包括脾切除术。随后是6个周期的卡铂+楷莱,并实现了完全缓解。2010年发现右侧髂外血管附近出现右侧盆腔复发,被认为无法手术。患者接受了6个周期的卡铂和紫杉醇治疗,于2011年4月完成,部分缓解。2011年10月,她显示出进展的证据,接受了6个周期的拓扑替康直至2012年3月,病情稳定。此时,她由于肾积水植入了右输尿管支架。2012年6月,在伴有新的双侧肺转移的进一步病情进展之后,她开始每周使用卡铂+紫杉醇+贝伐单抗至2013年3月,然后是贝伐单抗+来曲唑维持至2013年9月。随后是3个周期的环磷酰胺+贝伐单抗,但间隔扫描显示病情进展,于2013年11月11日停止治疗。
2014年1月更换右输尿管支架。
于2014年3月4日开始以每周900mg/m2使用nuc-1031,并完成了2个周期。主要毒性为迟发性疲劳,出现在第3天至第4天。第2个周期结束时扫描显示病情进展,肿瘤体积增加25%。退出研究。
病情进展。
患者040肝胆管型肝癌:病情稳定
女性(69岁)
2013年5月被诊断为患有肝内2级肝胆管型肝癌,伴有11cm的肝脏肿块阻塞总胆管,引起黄疸。插入胆管支架。8月至12月接受了7个周期的吉西他滨+顺铂。
于2014年2月20日开始以每周1,000mg/m2使用nuc-1031,并接受了1剂。2月27日,第1个周期的第8天出现发热、寒颤和胆红素升高。入院,感染源(g3)是被肿瘤和胆道囊肿阻塞的支架。两个新的支架运作良好。由于该队列中的dlt,第1个周期以900mg/m2完成。完成3个周期。5月23日,第2个周期结束时ct扫描显示按照recist病情稳定,肿瘤体积从基线时的85略微下降至82.1。ca19.9从基线时的664下降至6月4日的155。2014年6月因神志失常入院,被诊断为患有尿路感染。进一步的调查还显示肝脏中有病情进展。退出研究。
按照recist,病情稳定(4个月)。
患者041乳腺癌:病情稳定
女性(54岁)
诊断为患有转移性浸润性导管性乳腺癌(er和pr+ve),伴有双侧腋窝淋巴结、肺和肝转移。接受fec×3个周期,紫杉醇×9个周期,卡培他滨×8个周期,euribulin×3个周期和吉西他滨+卡铂×1剂。她最后一剂化疗为2013年12月19日,入选前的最后一次ct扫描显示病情进展。
2014年3月18日开始以每周900mg/m2使用nuc-1031,并完成了3个周期。由于中性粒细胞减少症,第1个周期的第8天和第15天之后,有2次治疗延误,中性粒细胞减少症在一周内自发缓解。第2个周期结束时ct扫描显示按照recist,病情稳定。ca15.3肿瘤标记物在基线时为726,在c2时为845,并且在2014年5月19日为824(这种肿瘤标记物过去一直是可靠的响应指标)。在第3个周期期间出现疲劳(g3),但已经设法显著减少阿片类药物。第4个周期的nuc-1031剂量降低至825mg/m2。第4个周期结束时扫描显示病情进展,在靶部位和新的骨病灶增加。退出研究。
按照recist,病情稳定(4个月)
患者042肝胆管型肝癌:病情进展
男性(48岁)
2013年1月诊断为患有转移性肝胆管型肝癌。2013年2月部分肝切除。开始bilcap试验观察组(比较卡培他滨与胆管癌手术后的观察)。在进展时,开始使用吉西他滨和顺铂×6个周期。在2013年11月进一步进展时,他开始使用卡培他滨。然而,因为他发生了心绞痛,因此卡培他滨在两个月后就停止了。在进一步进展时,他开始使用5fu×6周,但是病情进展,伴有肺、肝和骨转移。
最后一次治疗是在2014年1月。由于右肩骨转移疼痛,在2014年1月20日接受了姑息性放疗。
2014年3月18日开始以每周900mg/m2使用nuc-1031,完成了2个周期。在研究药物后3-5天经历了迟发性疲劳(g2)。第2个周期结束时ct扫描显示原发性靶病灶的肿瘤体积减少9%,但显示出新的肺部和骨病灶。退出研究。病情进展。
患者043卵巢癌:病情稳定
女性(54岁)
被诊断为患有4期3级腹膜乳头状浆液性癌。2007年9月进行了腹腔全子宫切除术、双侧输卵管卵巢切除术和网膜切除术。由于神经病变,接受了卡铂+紫杉醇×4个周期,然后单独使用卡铂2个周期,并于2008年1月完成疗程。因为复发盆腔肿块,2011年4月接受了二次减积手术。患者不希望进行辅助化疗或放疗。2012年7月病情进一步复发并由于肾积水而插入了支架。2012年8月病情复发,并开始使用卡铂+吉西他滨。2013年3月的ct扫描显示病情进展;患者于2013年10月完成了6个周期的楷莱。2014年初病情进展伴有胸腔积液,需要非常常规的引流。
2014年3月20日开始以每周900mg/m2使用nuc-1031,并完成了6个周期。2014年4月7日接受了pet扫描,扫描显示病情稳定,在一些目标肿瘤中suv下降。ca125从基线时的1.099降低至第2个周期开始时的783。来自胸腔积液的液体量也减少(每周排出300ml,现在每周排出150ml)。第4天和第5天出现迟发性疲劳(g2),其他时间出现g1。第6个周期结束时的ct扫描显示按照recist,病情稳定,肿瘤体积从基线时总体减少10%。7月15日,ca125从基线时的1,099降至910。完成研究,并要求慈善性继续治疗。第7个周期的剂量降低至750mg/m2,并又进行了一个周期。腿部水肿发展至g3,无病情进展,但寻求了新的治疗选择,并撤出研究。
按照recist,病情稳定(13个月)。
患者044肺癌:病情稳定
女性(64岁)
咳嗽持续7个月未解决,2010年2月被诊断为患有肺(左下叶)腺癌。2011年1月至2012年4月,患者接受了吉非替尼250m,但有病情进展。2012年4月至2012年11月接受了阿法替尼(但由于皮肤毒性,剂量降低),但又有病情进展。从2012年11月到2013年6月,在咳嗽恶化和原发病灶进展后,患者被给予了厄洛替尼。2013年6月在左眼发生异常视力和黑影,发现脉络膜转移,因此她接受了对双眼的放疗,视力有所改善。2013年6月,开始6个周期的培美曲塞+卡铂,然后培美曲塞维持,直至2014年2月6日,此时被确诊为病情进展。
2014年3月27日开始以每周900mg/m2使用nuc-1031,并完成了2个周期。4月19日发生g3肺部感染,其对抗生素反应良好。以降低的剂量825mg/m2开始第2个周期,并又完成了2个周期。第2个周期结束时ct扫描显示:按照recist,病情稳定,肿瘤体积减小10%。由于腹水引流,有2次治疗延误,由于血小板减少症,又有两次延误。第4个周期结束时扫描显示肺和新的肝转移灶中有病情进展。退出研究。
按照recist,病情稳定(5个月)。
患者046肾上腺癌:病情稳定
男性(36岁)
2011年8月被诊断为患有大的20×19×9cm的肾上腺皮质癌。ki6735-40%有丝分裂计数为25/50hpf,weiss评分6,肿瘤扩展至外缘0.3mm,但无肾脏累及。接受了辅药米托坦直至2012年1月,此时因为恶心和腹泻而停止。2012年6月重新开始使用米托坦。2013年6月复发,伴有新的肝转移,并开始使用依托泊苷+卡铂。
2013年9月分期ct扫描显示出不同疗效,但总体病情稳定,又接受了3个周期并保持稳定,于2013年11月完成。2014年1月肝脏中显示病情进展。
于2014年4月16日开始以每周1,000mg/m2使用nuc-1031,并完成了1个周期。在第1个周期期间经历了迟发性疲劳、恶心和呕吐(全部为g3)。第2个周期的剂量降低至900mg/m2,并且以这一剂量又接受了5个周期至完成研究。第6个周期结束时ct扫描显示肿瘤体积从基线时降低12.6%。要求慈善性继续治疗,并又完成了3个周期。在第8个周期的第1天后出现疲劳(g3)和中性粒细胞减少症(g2),第8个周期的剂量降低至750mg/m2,并又接受了2个周期。虽然改善至g1,但疲劳持续,也出现恶心呕吐,第11个周期的剂量进一步降至625mg/m2。又接受了2个剂量。退出研究。
按照recist,病情稳定(11个月)
病情048卵巢癌:病情稳定
女性(63岁)
2000年被诊断为患有1a期卵巢颗粒细胞瘤,行经腹全子宫切除术和双侧输卵管卵巢切除术+网膜切除术。2004年2月复发时开始使用3个周期的bep(博来霉素+依托泊苷+顺铂)至病情进展。2004年7月二次减积。
2006年6月行部分肝切除术、脾切除术、胃和腹膜沉积物切除术。随后针对肝脏沉积物进行射频消融。2008年9月接受了剖腹手术和4例进一步的转移性沉积物切除术。2009年3月开始每周3次使用卡铂+紫杉醇,疗效喜忧参半(amixedresponse)。2009年5月12日改为每周一次使用卡铂+低剂量紫杉醇。2009年10月完成,伴有pr和ca-125阴性。2011年10月又进行减积手术,伴有并发症,需要在itu长时间停留。2014年4月ct扫描显示,肝段8的病灶尺寸增大,胃-肝韧带出现新的小的腹膜转移灶,小肠系膜出现一些新的小体积淋巴结肿大,直肠-乙状结肠交汇处周围的盆腔还有小的腹膜沉积物。
于2014年4月29日开始以每周1,000mg/m2使用nuc-1031,并接受了1次剂量。第1个周期的第1天后发生;alt,(g3,dlt);ast和中性粒细胞减少症(g2);alp(g1)。第1个周期的第8天剂量降低至900mg/m2。第8天和第15天后alt恢复到g3。第2个周期的剂量降低至825mg/m2。在第1个周期结束时pet扫描的结果显示病情稳定,并且靶部位suv减少。2014年1月,抑制素b为430,在进入研究前增至1,038。2014年7月,抑制素b已经稳定在1,106,8月1148,9月1053。尽管用g-csf干扰,但仍有中性粒细胞减少症(g3),因此第4个周期的第15天的剂量降低至750mg/m2。以这个剂量完成了研究。11月11日,第6个周期结束时,ct扫描证实:按照recist,病情稳定。要求慈善性继续治疗。由于每次剂量后的腹泻,以降低的剂量625mg/m2开始第7个周期。在希克曼线附近发生栓塞,虽然这对克赛(clexane)有响应,但患者退出研究。
按照recist,病情稳定(8个月)。
患者050(202)食管癌:病情进展
女性(41岁)
2013年11月被诊断为患有4期食管鳞状细胞癌,伴有肝转移。从2013年12月直至2014年4月,患者接受了6个周期的顺铂+卡培他滨。其治疗后扫描显示病情进展和新的肺沉积物。
于2014年5月21日开始以每周900mg/m2使用nuc-1031,并接受了3个周期。第1个周期的第1天后发生alt和疲劳,均为g3,第1个周期第8天的剂量降低。第2个周期结束时扫描似乎显示病情进展,但对于某些基线病灶不确定。
因为患者从吞咽困难的改善中获得了临床益处,决定允许多一个周期。第3个周期结束时扫描证实病情进展,患者退出研究。
病情进展。
患者051(203)肛门癌:病情进展
女性(51岁)
2013年10月被诊断患有肛门转移性鳞状细胞癌。从2013年10月直至2014年3月,进行6个周期的顺铂+5fu后,病情进展。
2014年6月3日开始以每周900mg/m2使用nuc-1031,并接受了2个周期。在第2个周期期间需要输血,但对治疗耐受性良好。第2个周期结束时扫描显示病情进展。
病情进展。
患者052(204)食管癌:病情稳定
男性(66岁)
2012年12月被诊断为患有iv期食管癌。从2013年1月至2013年7月接受了fox,部分缓解。2014年4月显示病情进展。插入食管支架。
于2014年6月10日开始以每周900mg/m2使用nuc-1031,并完成了1个周期。由于疲劳,第2个周期的剂量降低至825mg/m2,效果良好。在这个剂量下又完成了2个周期。第2个周期结束时ct扫描显示:按照recist,病情稳定。继续有骨痛,但扫描显示,这不是疾病相关的。吞咽困难正在恶化。11月10日,第4个周期结束时,ct扫描显示病情进展。
按照recist,病情稳定(5个月)。
患者053(205)结肠癌:病情进展
女性(31岁)
2008年被诊断为患有结肠t3n1m0腺癌。切除,并接受了12个周期的folfox,于2009年完成。2011年进展时,接受了13个周期的folfiri(6个周期包括阿瓦斯汀(avastin))。2012年进一步进展,接受了12个周期的folfox(6个周期包括阿瓦斯汀)。2014年1月病情进一步进展,伴有至肺和椎骨的转移。接受脊椎放疗。
于2014年6月12日开始以每周900mg/m2使用nuc-1031,并完成了1个周期。已经发生了一系列的感染,并且需要预防性回肠造口术(ade-functioningileostomy)。在许多次治疗延误之后,接受了第2个周期第15天的治疗,第2个周期结束时ct扫描显示病情进展,肺和肝中有新的病灶。
病情进展。
患者055(207)卵巢癌:病情稳定
女性(42岁)
2002年1月被诊断为患有卵巢2c期1级乳头状浆液性腺癌。进行了经腹全子宫切除术、双侧输卵管卵巢切除术和网膜切除术,伴随6个周期的辅药卡铂+紫杉醇,于2002年6月完成治疗。
2012年1月发生新的3级3c期原发性腹膜癌,累及直肠乙状结肠交界处。进行后脏器切除术(posteriorexenteration),包括切除盲肠、直肠和乙状结肠,加网膜切除术和腹膜剥离术。2012年3月至8月接受了6个周期的辅药卡铂+紫杉醇。
在2013年1月病情复发时,接受了6个周期的每周一次紫杉醇直至2013年5月。在2013年10月进一步进展之后,在aktres研究中开始每周3次使用紫杉醇+卡铂+每日akt抑制剂。2014年5月ct显示新的病灶和病情进展。
2014年7月2日开始以每周900mg/m2使用nuc-1031,并接受了1个周期。由于疲劳,第2个周期的剂量降低至825mg/m2,并又完成了4个周期。经历了化疗后的恶心和呕吐,第6个周期的剂量降低至625mg/m2,并且又完成了一个周期。2014年12月16日,第6个周期结束时,ct扫描显示:按照recist,病情持续稳定,肿瘤体积从基线时减少18%。患者ca125在基线时为36,2015年1月为24。完成研究,并要求慈善性继续治疗。在慈善介入项目下又接受了2个周期,没有其他问题。因为患者要远行并要求休息,因此她选择脱离研究。
按照recist,病情稳定(10个月以上)。
患者057(209)卵巢癌:病情稳定
女性(58岁)
2011年10月被诊断为患有3c期3级浆液性卵巢癌。接受了3个周期的新辅药卡铂+紫杉酚,但在第3个周期发生紫杉酚过敏。在2011年12月21日进行了后脏器切除术、卵巢减积、前切除与原发性吻合术和网膜切除术。2012年3月完成了3个周期的卡铂+多西他赛。2013年6月复发,接受了6个周期的卡铂+楷莱,直至2013年11月。2014年2月ct证明病情复发,并从2014年3月至6月接受了3个周期的卡铂+吉西他滨。
2014年7月9日开始以每周900mg/m2使用nuc-1031,并接受了2个剂量。7月30日,第1个周期的第15天出现贫血和腹水,均为g3。
第2个周期的剂量降低至825,并又接受了2个周期。第4个周期结束时,ct扫描显示:按照recist,病情持续稳定,肿瘤体积从基线时减少10%。
进行胸膜引流,并每隔一周抽取大约1,000ml的非常血性的液体。由于疲劳,从第4个周期的第1天进一步降低剂量至750mg/m2,又接受了一个周期。腹水在增加。由于临床进展退出研究。
按照recist,病情稳定(5个月)。
患者058(210)肺癌:病情稳定
男性(54岁)
2014年1月被诊断为患有转移性非小细胞肺腺癌,伴有淋巴结转移和骨转移。
开始3个周期的顺铂和培美曲塞,具有病情稳定的响应。2014年3月开始培美曲塞维持,接受了4个周期直至2014年4月。2014年5月显示病情进展,伴有双侧肺转移,又接受了1个剂量的培美曲塞。
2014年7月14日开始以每周825mg/m2使用nuc-1031,并接受了1个周期。由于g3转氨酶升高(alt)(一种dlt),第1个周期第15天延误了一周,并且剂量降低至750mg/m2。然而,一些肝酶升高可能是由于先天性肝脏病况。以750mg/m2又接受了1个周期。第4个周期结束时ct扫描显示病情进展,在骨中有新的病灶。
按照recist,病情稳定(4个月)
患者059(211)子宫颈癌:病情稳定
女性(52岁)
2012年12月被诊断为患有宫颈iv期鳞状细胞癌。开始使用卡铂+紫杉酚化疗,由于毒性,尤其是来自紫杉酚的毒性(皮疹、瘙痒),于2013年2月停止化疗。2013年3月至2013年7月开始使用6个周期的顺铂+托泊替康(topotecan),实现病情稳定。2013年10月的ct扫描显示病情进展。她接受了30gy的10次分割盆腔放疗,于2013年11月完成。2013年12月开始使用吉西他滨+卡铂,接受了3个周期。然而,2014年2月间隔性ct扫描显示病情进展。
2014年7月24日开始以每周825mg/m2使用nuc-1031,并完成了1个周期。由于血小板减少症(g3),第1个周期第15天延误1周。第2个周期的剂量降低至750mg/m2,并又完成了2个周期。第4个周期结束时ct扫描显示:按照recist,病情持续稳定。由于第3个周期期间经历了疲劳(g3),第4个周期的剂量降低至625mg/m2,效果良好。在这一剂量下又完成了2个周期。尿道支架使患者非常不舒服,于2015年1月更换。在第6个周期期间,患者报告非常疲劳并选择退出研究。
按照recist,病情稳定(7个月)。
患者060(212)胰腺癌:病情进展
男性(83岁)
2014年1月被诊断为患有转移性胰腺癌(中度分化腺癌),伴有多发性肝转移。2014年1月至6月,在maestro研究中选择姑息性化疗(第1、8、15天吉西他滨和缺氧激活的th302),但有病情进展。
于2014年8月5日开始以每周825mg/m2使用nuc-1031,并完成了1个周期。9月10日出现alp、ast、alt,全部为g3。需要新的支架。治疗延误后于在10月1日完成了第2个周期。ct扫描显示病情进展,伴有新的肝病灶。
病情进展。
病灶061(213)结肠直肠癌:病情稳定
女性(53岁)
2012年被诊断为患有结肠癌。手术,包括双侧输卵管卵巢切除术、网膜切除术和袢式回肠造口术(aloopileostomy)。2013年1月至7月开始12个周期的folfox。2014年4月病情复发后,她于2014年4月至7月接受了8个周期的folfiri和西妥昔单抗。对所有化疗均有严重的恶心和呕吐。
2014年8月11日开始以每周825mg/m2使用nuc-1031,并完成了4个周期。治疗期间没有恶心或呕吐。第2个周期结束时,ct扫描显示,按照recist病情稳定,肿瘤体积减小2%。第4个周期结束时,ct扫描显示病情进展,脾脏和肝脏有新的病灶。
按照recist,病情稳定(3个月)。
患者063(215)卵巢癌:病情稳定
女性(78岁)
2011年5月被诊断为患有并发性外阴黑色素瘤(clark4级)和3b期卵巢癌。2011年8月至9月开始了3个周期的卡铂+紫杉醇,随后进行间歇性减积手术,包括经腹全子宫切除术、双侧输卵管卵巢切除术和网膜切除术。随后她又接受了3个周期的卡铂+紫杉醇,于2011年11月完成治疗。在病情进展时,2013年9月至2014年2月开始了6个周期的吉西他滨+卡铂+阿瓦斯汀。随后是2014年4月至6月接受了2个周期的caelix。
于2014年8月27日开始以每周825mg/m2使用nuc-1031,并接受了1个周期。由于贫血和中性粒细胞减少症,第2个周期第15天的剂量降低至750mg/m2,并且又接受了2个周期。第2个周期结束时,ct扫描显示,按照recist病情稳定。由于第3个周期经历的疲劳(g3),第4个周期第1天的剂量降低至625mg/m2。发生持续性呼吸短促。从研究中去除。
按照recist,病情稳定(3个月)。
患者064(216)滋养细胞癌(trophoblasticcancer):病情进展
女性(38岁)
2011年6月被诊断为患有复发性3期混合型胎盘部位和上皮样滋养细胞肿瘤(pstt/ett)。从2011年6月至10月,在根治性子宫切除术和淋巴结取样术后,接受了用紫杉醇+顺铂、最后使用紫杉醇+依托泊苷的辅助化疗,随后于2011年11月手术治疗淋巴渗漏,并于2012年2月进行双侧输尿管植入术。
对于复发病情,2013年2月进行了左侧卵巢切除术和膀胱浆膜切除术,并从2013年3月至7月给予了高剂量依托泊苷的辅助化疗,随后进行自体干细胞移植。2014年1月进行后脏器切除术,包括上部阴道、直肠和膀胱的切除术,左侧卵巢、前阴道、肠系膜结节和右侧输尿管的去除。2014年2月至5月接受了5个周期的培美曲塞+卡铂。由于hcg水平升高,转为吉西他滨+卡铂。接受了2个周期,但间隔性ct扫描显示左下叶肺部病灶,无法手术。
于2014年9月3日开始以每周825mg/m2使用nuc-1031,并接受了2个周期。第2个周期结束时,ct扫描显示病情进展,肺和腹膜中的既有病灶生长。
病情进展。
患者066(218)结肠直肠癌:病情稳定
男性(65岁)
2011年5月首次被诊断为患有乙状结肠pt4bpn0中度分化腺癌。2011年11月进行了前脏器切除术,并于2012年1月开始folfox化疗。3个周期后发展为周围神经病变,转为5fu单一疗法。还因腹泻和不适有延误困扰。使用5fu3个月后,2012年7月ct扫描显示出标记物稳定,但是疗效喜忧参半。保持稳定至2013年5月停止治疗,其ct扫描显示出病情进展,肿瘤标记物水平翻倍。重新开始使用5fu+阿瓦斯汀,于2013年10月完成。由于胸部感染和胸痛多次入院而使治疗复杂化。2014年3月至7月接受了8个周期的西妥昔单抗。ct扫描显示病情进展,转为5fu+阿瓦斯汀。2014年6月,由于腹膜内转移性沉积物的粘连,进行了剖腹手术和粘连松解术。又接受了一个周期的阿瓦斯汀,但随着cea的上升,已停止。有许多合并症,copd,缺血性心脏病和充血性心力衰竭。
2014年9月16日开始以每周825mg/m2使用nuc-1031,并接受了2个周期。由于疲劳,第3个周期的剂量降低至750mg/m2,并又接受了1个周期。第2个周期结束时,ct扫描显示,按照recist,病情稳定。
由于疝气引起并发症,有两次近期入院,导致治疗延误。12月30日非计划性ct扫描显示病情持续稳定,肿瘤体积从基线时减少16%。由于疲劳,第4个周期的剂量进一步降低至625mg/m2。在这个剂量下已经又接受了1个周期,没有其他问题。第5个周期期间出现急性背痛而入院,发现老年性骨折(与研究无关)。在手术评估下继续。由于治疗延误撤出研究。
按照recist,病情稳定(8个月以上)。
患者067(219)骨肉瘤:病情稳定
男性(38岁)
2011年5月,2012年2月24日被诊断为患有右胫骨近端骨肉瘤。
2012年2月至11月接受了6个周期的顺铂+阿霉素+甲氨蝶呤。2012年11月进行了胫骨近端置换术,并在化疗后接受了6个月的米伐木肽(mifamurtide)。2014年8月的ct扫描显示转移性复发,伴有新的肺内和心包病灶,低于ivc且邻近右心房。
于2014年9月30日开始以每周825mg/m2使用nuc-1031,并接受了5个周期。第4个周期结束时ct扫描显示,按照recist,病情稳定。在每个周期即将结束时趋于发展为中性粒细胞减少症g2,但计数迅速反弹回来。在2015年3月3日完成研究。对研究药物耐受性良好。eosct扫描显示,按照recist病情稳定,从基线时增加1%。扫描也显示出肿瘤明显钙化。患者要求慈善性继续使用研究药物,并将以750mg/m2的降低的剂量于2015年4月2日完成c7。由胸外科医师评估,该医师将于2015年4月26日在左肺上作手术来去除下叶上的靶病灶。2015年4月26日,胸外科医生去除了下叶中的钙化的靶病灶。病灶被完全去除,正常周围组织的边缘清晰。病人从手术中恢复得很好。
按照recist,病情稳定(7个月以上)。
患者068(220)肺癌
男性(60岁)
2011年5月被诊断患有右肺t3n3m1b非小细胞癌(腺癌),egfr野生型,在2013年2月。2013年2月至12月期间接受了10个周期的培美曲塞和顺铂,随后进行胸部姑息性放疗。2014年1月至5月参加了poplar研究的多西他赛组。
2014年10月3日开始以每周825mg/m2使用nuc-1031,并接受了2个周期。第2个周期结束时ct扫描显示病情进展。从研究中去除。
病情进展。
患者069(221)结肠直肠癌
女性(45岁)
2011年5月被诊断为结肠直肠癌。2011年8月接受了新辅药卡培他滨和放疗,然后于2011年12月初次接受减积手术。2012年1月至7月期间接受了辅药folfox。2013年4月发生孤立性肺部复发,切除。2013年7月,发现右侧顶枕复发并去除,以及一些皮肤和皮下癌症沉积物。从2013年9月开始使用西妥昔单抗和folfiri,并一直维持西妥昔单抗直至2014年9月。2014年9月伽玛刀治疗脑转移瘤。对于神经症状无症状。
2014年10月9日开始以每周825mg/m2使用nuc-1031,并接受了3个周期。30/10的pet扫描显示部分缓解。在c2前期检查中,皮肤和皮下转移瘤大大减少或几乎消失,并且没有新的出现。c2结束时ct扫描显示,按照recist病情稳定,肿瘤体积从基线时减少11%。在第3个周期期间发展了中性粒细胞减少症(g4)和白细胞减少症(g3),并且第4个周期的剂量降低至750mg/m2。c4结束时ct扫描显示,按照recist病情稳定,肿瘤体积从基线时减少26%。第4个周期第1天后发展了中性粒细胞减少症和白细胞减少症g3,第4个周期第8天的剂量降低至675mg/m2。由于中性粒细胞减少症和白细胞减少症g2,c5第8天的剂量降低至625mg/m2。经历视觉障碍,ct扫描显示脑中病灶增加。这已经被射波刀(cyberknife)去除。她将于2015年4月29日,c7的第1天,以降低的剂量500mg/m2重新开始使用研究药物。
按照recist,病情稳定(7个月以上)。
- 还没有人留言评论。精彩留言会获得点赞!