携带双特异性T细胞衔接器(BiTE)的腺病毒的制作方法
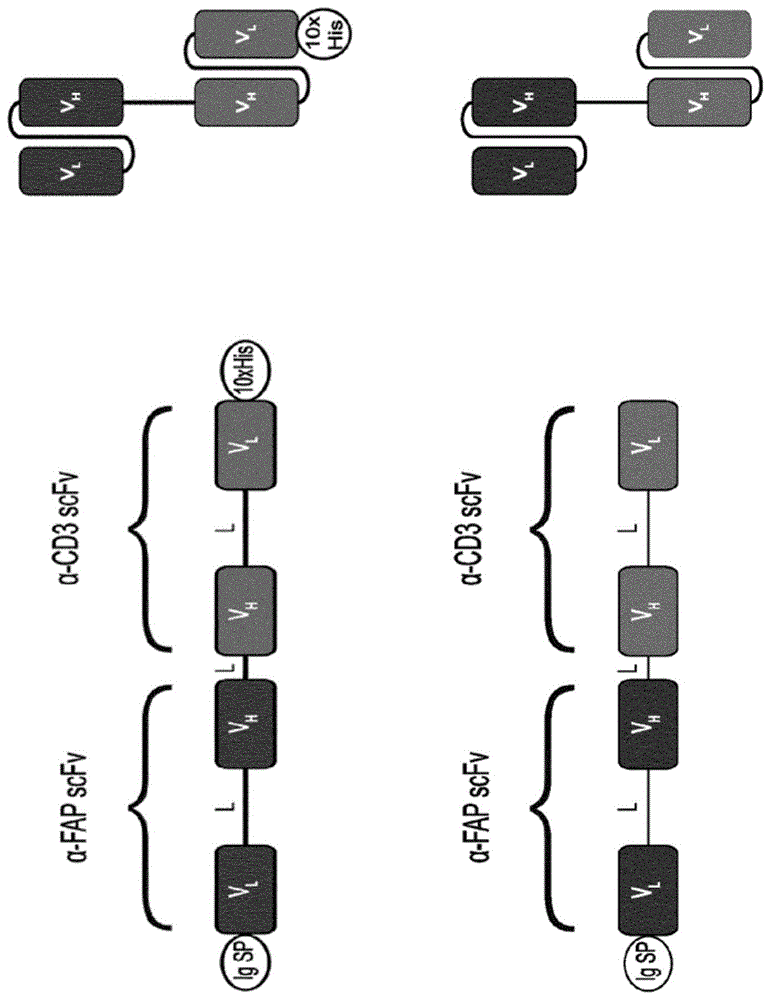
背景技术:
:就患者及其亲人的困难和痛苦,以及治疗、照顾和支持患者的高昂经济成本而言,癌症仍然是社会的巨大负担。已经开发了多种用于治疗癌症的疗法,包含化学治疗剂、放射疗法和最近的如抗体等生物制剂。在过去的15年中,基于抗体的癌症治疗已经建立,并且目前是用于治疗血液学恶性肿瘤和实体瘤患者最成功和最重要的策略之一。目前临床使用的基于单克隆抗体的抗癌疗法的实例包含靶向cd20的利妥昔单抗、靶向vegf的贝伐单抗、靶向egfr的西妥昔单抗和靶向cea的拉贝珠单抗。在开发的各种抗体形式中,双特异性t细胞衔接器(bite)显示出很大的希望。这些是相对简单的双特异性分子,其特异于t细胞的tcr复合物的cd3ε亚基,并且还靶向如癌抗原等感兴趣的抗原。由于bite对tcr复合物具有特异性,这使得bite能够活化驻留的t细胞以杀死在其细胞表面上表达特定靶抗原的细胞,例如癌细胞。bite的重要性质是其能够制造cd4+和未活化的cd8+t细胞靶向癌细胞。换句话说,可以使由bite活化的t细胞杀死不依赖于细胞表面上的mhc表达的细胞。因为一些肿瘤细胞下调mhc,这使得其对如car-t细胞和immtac等试剂具有抗性,这很重要。不幸的是,相对于全长抗体,bite具有差的循环动力学。这意味着当向患者施用时,大部分bite不能到达其靶细胞。此外,使用高亲和力抗cd3scfv作为bite的一部分可能导致与血液中t细胞的强烈结合,这也干扰向肿瘤的递送。结果,bite不能充分发挥其作为抗癌疗法的潜力,因为其不能有效地递送给肿瘤细胞。将如bite等治疗剂有效递送到肿瘤细胞的要求已经变得越来越重要,因为实体肿瘤在体内以多种方式保护自身变得越来越明显,例如通过在肿瘤周围形成基质。癌症的进展与上皮细胞(有丝分裂细胞)的增殖以及活化的肿瘤基质的发展有关。在这种情况下,由于周转增加,如胶原束等细胞外基质(ecm)组分被降解。炎性细胞的数量增加并且成纤维细胞分化成肌成纤维细胞,导致其表达生长因子、基质组分和降解的蛋白酶。维持血管生成,导致大量渗漏的肿瘤血管。在活化具有持续血管生成的肿瘤基质后,肿瘤细胞的侵入通过降解的基底膜开始,并且血管渗入肿瘤组织。这种基质是物理保护,因为其可能具有诱捕免疫细胞以对抗肿瘤的功能。此外,基质屏蔽了肿瘤的缺氧微环境,这对于肿瘤的生长是允许的和最佳的。存在一些理论认为基质中的细胞是肿瘤中的能量来源。肿瘤基质的一个大组分是成纤维细胞,所述成纤维细胞已经被破坏以起到引发癌症的作用。渗入基质的其它细胞是肿瘤相关巨噬细胞(tam),其是2型(m2)巨噬细胞,所述巨噬细胞可以通过分泌如抑制免疫应答的il-10等细胞因子和趋化因子来促进肿瘤生长。因为产生环境的细胞是遍布全身的“天然的”免疫细胞或结缔组织细胞,所以靶向肿瘤基质特别困难。因此,用治疗剂靶向这些细胞可能导致严重的脱靶效应。因此,需要一种将bite直接递送到肿瘤细胞的改进方法,其中它可以提供最大的治疗益处,具体的说递送到由基质成纤维细胞包围的肿瘤细胞。技术实现要素:诸位发明人认为,将治疗剂直接递送到肿瘤的最有效方式之一是使用经过工程化以表达例如活化如在基质中的t细胞并且靶向抗原的试剂的溶瘤腺病毒。因此,本公开提供了一种包括式(i)的序列的腺病毒:5'itr-b1-ba-b2-bx-bb-by-b3-3'itr(i)其中:b1是键或包括:e1a、e1b或e1a-e1b;ba包括-e2b-l1-l2-l3-e2a-l4;b2是键或包括:e3;bx是键或包括以下的dna序列:限制性位点、一个或多个转基因或两者;bb包括l5;by是键或包括以下的dna序列:限制性位点、一个或多个转基因或两者;b3是键或包括:e4;其中所述腺病毒编码双特异性t细胞衔接器(bite),所述bite包括至少两个结合结构域,其中所述结构域中的至少一个对如感兴趣的t细胞等感兴趣的免疫细胞上的表面抗原具有特异性;并且其中所述腺病毒是enad或ad11。根据本公开的一个或多个bite不包括跨膜结构域,并且因此不在癌细胞表面上表达,而是包括促进bite分子从癌细胞中释放的信号序列。以下段落是本公开的概述:1.一种包括式(i)的序列的腺病毒:5'itr-b1-ba-b2-bx-bb-by-b3-3'itr(i)其中:b1是键或包括:e1a、e1b或e1a-e1b;ba包括-e2b-l1-l2-l3-e2a-l4;b2是键或包括:e3;bx是键或包括以下的dna序列:限制性位点、一个或多个转基因或两者;bb包括l5;by是键或包括以下的dna序列:限制性位点、一个或多个转基因或两者;b3是键或包括:e4;其中所述腺病毒编码双特异性t细胞衔接器(bite),所述bite包括至少两个结合结构域,其中所述结构域中的至少一个对如感兴趣的t细胞等感兴趣的免疫细胞上的表面抗原具有特异性;并且其中所述腺病毒是enad或ad11。2.根据段落1所述的腺病毒,其中所述腺病毒是enad。3.根据段落1或2所述的腺病毒,其中所述表面抗原是t细胞受体复合物(tcr)的组分,所述组分如cd3、tcr-α和tcr-β。4.根据段落3所述的腺病毒,其中所述表面抗原是cd3,如cd3ε、cd3γ和cd3δ,具体的说cd3ε。5.根据段落1到4中任一项所述的腺病毒,其中所述结合结构域之一对肿瘤抗原具有特异性,所述肿瘤抗原如cea;muc-1;epcam;her受体her1、her2、her3、her4;pem;a33;g250;碳水化合物抗原ley、lex、leb;psma;tag-72;steap1;cd166;cd24;cd44;e-钙粘蛋白;sparc;erbb2和erbb3。6.根据段落5所述的腺病毒,其中所述结合结构域之一对epcam具有特异性,例如包括seqidno:28所阐述的氨基酸序列的epcam。7.根据段落1到4中任一项所述的腺病毒,其中所述结合结构域之一对肿瘤基质抗原具有特异性,所述肿瘤基质抗原例如成纤维细胞活化蛋白(fap)、trem1、igfbp7、fsp-1、血小板源性生长因子-α受体(pdgfr-α)、血小板源性生长因子-β受体(pdgfr-β)和波形蛋白。8.根据段落7所述的腺病毒,其中所述结合结构域之一对fap具有特异性,例如包括seqidno:30所阐述的氨基酸序列的fap。9.根据段落7或8所述的腺病毒,其中所述基质抗原是选自髓源性抑制细胞抗原、肿瘤相关巨噬细胞和其组合的抗原。10.根据段落9所述的腺病毒,其中所述抗原是选自cd163、cd206、cd68、cd11c、cd11b、cd14、csf1受体、cd15、cd33、cd66b和其中两种或更多种的组合。11.根据段落1到3和5到10中任一项所述的腺病毒,其中所述bite中的所述结合结构域之一对如cd31、cd2和cd277等非tcr活化蛋白具有特异性。12.根据段落1到11中任一项所述的腺病毒,其中bx或by中的至少一个不是键。13.根据段落1到12中任一项所述的腺病毒,其中所述腺病毒是嵌合的。14.根据段落1到13中任一项所述的腺病毒,其中所述腺病毒是溶瘤的。15.根据段落1到14中任一项所述的腺病毒,其中所述腺病毒能够进行复制。16.根据段落13所述的腺病毒,其中所述腺病毒具有复制能力。17.根据段落1到14中任一项所述的腺病毒,其中所述腺病毒具有复制缺陷。18.根据段落1到17中任一项所述的腺病毒,其中bx包括一个或多个转基因或转基因盒。19.根据段落1到16中任一项所述的腺病毒,其中by包括一个或多个转基因或转基因盒。20.根据段落1到19中任一项所述的腺病毒,其中所述一个或多个转基因或转基因盒受内源或外源启动子,如内源启动子的控制。21.根据段落20所述的腺病毒,其中所述转基因或转基因盒受选自由以下组成的组的内源启动子的控制:e4启动子和主要晚期启动子,具体的说所述主要晚期启动子。22.根据段落19所述的腺病毒,其中转基因或转基因盒受如cmv等外源启动子的控制。23.根据段落1到22中任一项所述的腺病毒,其中转基因盒进一步包括独立地选自以下的调节元件:a.剪接受体序列b.内部核糖体进入序列或高自切割效率a肽,c.kozak序列及d.其组合。24.根据段落23所述的腺病毒,其中转基因盒包括位于蛋白质编码序列起始处的kozak序列。25.根据权利要求1到24中任一项所述的腺病毒,其中所述转基因盒编码高自切割效率a肽。26.根据段落1到25中任一项所述的腺病毒,其中所述转基因盒进一步包括多腺苷酸化序列。27.根据段落1到26中任一项所述的腺病毒,其中所述转基因盒进一步包括位于dna序列末端处和/或dna序列末端处的限制性位点。28.根据段落1到27中任一项所述的腺病毒,其中至少一个转基因盒编码单顺反子mrna。29.根据段落1到28中任一项所述的腺病毒,其中所述bite半衰期短,例如48小时或更少。30.根据段落1到29中任一项所述的腺病毒,其中所述bite编码在选自e1、e3、bx、by和其组合的区域中。31.根据段落30所述的腺病毒,其中bite例如在所述主要晚期启动子的控制下至少编码在位置bx中。32.根据段落1到29中任一项所述的腺病毒,其中所述腺病毒进一步编码第二bite。33.根据段落32所述的腺病毒,其中所述第一bite分子对肿瘤抗原具有特异性,例如肿瘤抗原(例如本文所列),并且所述第二bite分子对肿瘤基质抗原具有特异性,例如基质抗原(例如本文所列)。34.根据段落1到33中任一项所述的腺病毒,其中所述腺病毒进一步包括细胞因子或趋化因子或免疫调节因子(如细胞因子或趋化因子)。35.根据段落34所述的腺病毒,其中细胞因子或趋化因子选自mip1α、il-1α、il-1β、il-6、il-9、il-12、il-13、il-17、il-18、il-22、il-23、il-24、il-25、il-26、il-27、il-33、il-35、il-2、il-4、il-5、il-7、il-10、il-15、il-21、il-25、il-1ra、ifnα、ifnβ、ifnγ、tnfα、淋巴毒素α(lta)、flt3l、gm-csf、il-8、ccl2、ccl3、ccl5、ccl17、ccl20、ccl22、cxcl9、cxcl10、cxcl11、cxcl13、cxcl12、ccl2、ccl19、ccl21、(例如il-1α、il-1β、il-6、il-9、il-12、il-13、il-17、il-18、il-22、il-23、il-24、il-25、il-26、il-27、il-33、il-35、il-2、il-4、il-5、il-7、il-10、il-15、il-21、il-25、il-1ra、ifnα、ifnβ、ifnγ、tnfα、淋巴毒素α(lta)、gm-csf、il-8、ccl2、ccl3、ccl5、ccl17、ccl20、ccl22、cxcl9、cxcl10、cxcl11、cxcl13、cxcl12、ccl2、ccl19、ccl21),如il-12、il-18、il-22、il-7、il-15、il-21、ifnγ、tnfα、淋巴毒素α(lta)、ccl3、ccl5、cxcl9、cxcl10、cxcl12、ccl2、ccl19和ccl21。36.根据段落1到35中任一项所述的腺病毒,其中所述腺病毒进一步包括免疫调节因子,如抗体或抗体片段,或蛋白质或肽配体,对检查点蛋白如ctla-4、pd-1、pd-l1、pd-l2、vista、b7-h3、b7-h4、hvem、ilt-2、ilt-3、ilt-4、tim-3、lag-3、btla、light或cd160具有特异性,例如ctla-4、pd-1、pd-l1和pd-l2或对共刺激分子如cd28、cd80、cd86、cd83、icos、b7h2、tl1a和4-1bb具有特异性。37.根据段落1到36中任一项所述的腺病毒,其中所述bite包括:vh结构域,其包括seqidno:8、13或18中任一项所阐述的氨基酸序列或与其至少95%相同的氨基酸序列。38.根据段落1到37中任一项所述的腺病毒,其中所述bite包括:vl结构域,其包括seqidno:9、12或17中任一项所阐述的氨基酸序列或与其至少95%相同的氨基酸序列。39.根据段落1到36中任一项所述的腺病毒,其中所述bite包括scfv,所述scfv包括seqidno:7、11或16中任一项所阐述的氨基酸序列或与其至少95%相同的氨基酸序列。40.根据段落1到39中任一项所述的腺病毒,其中所述bite包括seqidno:2或4中所阐述的氨基酸序列或与其至少95%相同的氨基酸序列,例如seqidno:73或75中所阐述的氨基酸序列。41.根据段落1到40中任一项所述的腺病毒,其中所述腺病毒包括seqidno:34到37中任一项所阐述的dna序列或与其至少95%相同的dna酸序列,例如seqidno:79到82中任一项所阐述的dna序列。42.一种组合物,其包括根据段落1到41中任一项所述的腺病毒以及稀释剂或载剂。43.一种治疗患者的方法,其包括施用治疗有效量的根据段落1到41中任一项所述的腺病毒或根据段落42所述的组合物。44.根据段落43所述的方法,其用于治疗癌症,具体的说实体瘤。在一个实施例中,根据本公开的腺病毒编码至少一个另外的转基因,例如1个、2个、3个或4个另外的转基因。在一个实施例中,在每个基因之间编码不同的切割肽。在一个实施例中,所有转基因都位于病毒的一个位置,例如位于by位置。有利地,诸位发明人已经发现,用bite分子携带腺病毒允许双特异性抗体片段分子“背负”腺病毒选择性感染癌细胞的能力,由此能够将bite靶向递送到肿瘤细胞。有利地,bite很小并且可以在哺乳动物细胞中制备。因此,一旦被本公开的腺病毒感染,bite分子由肿瘤细胞合成、分泌并且可以局部起作用,从而扩散到病毒的直接足迹之外。因此,这允许bite扩散到感染的直接位点之外,但同时限制病毒的传播范围远远超过感染的肿瘤细胞巢。这最大限度地降低了不希望的脱靶效应的风险。在一个实施例中,腺病毒是enad。与现有技术的腺病毒相比,enad已经示出了具有增强的溶瘤活性。enad还已经示出了对人类上皮来源的癌细胞具有高选择性,如结肠癌、肺癌、膀胱癌和肾癌细胞。这使其成为bite分子的理想递送媒剂,因为t细胞可以被bite分子活化以攻击靶细胞,而enad同时感染和溶解癌细胞。这导致对肿瘤的双管齐下的攻击,其具有协同的溶瘤作用。在一个实施例中,所述表面抗原是t细胞受体复合物(tcr)的组分,所述组分如cd3、tcr-α和tcr-β。在一个实施例中,所述表面抗原是cd3,如cd3ε、cd3γ和cd3δ,具体的说cd3ε。在一个实施例中,所述结合结构域之一对肿瘤抗原具有特异性,所述肿瘤抗原如cea;muc-1;epcam;her受体(如her1、her2、her3、her4);pem;a33;g250;碳水化合物抗原ley、lex、leb;psma;tag-72;steap1;cd166;cd24;cd44;e-钙粘蛋白;sparc;erbb2和erbb3,具体的说epcam。在一个实施例中,结合结构域之一对epcam具有特异性,例如包括seqidno:28所阐述的氨基酸序列的epcam或与其至少95%相同的序列。在一个实施例中,所述结合结构域之一对肿瘤基质抗原具有特异性,所述肿瘤基质抗原例如成纤维细胞活化蛋白(fap)、trem1、igfbp7、fsp-1、血小板源性生长因子-α受体(pdgfr-α)、血小板源性生长因子-β受体(pdgfr-β)和波形蛋白。有利地,表达这些抗原的基质细胞(非转化细胞)不经历与转化细胞相同水平的突变抗性选择过程。因此,这些细胞更容易靶向癌症疗法,因为它们不是“移动靶”。此外,在基质细胞中发现的受体类型通常在不同类型的癌症中是常见的。因此,靶向上述抗原之一可能对多种癌症类型有效。在一个实施例中,结合结构域之一对fap具有特异性,例如包括seqidno:30所阐述的氨基酸序列的fap或与其至少95%相同的序列。有利地,fap在肿瘤相关成纤维细胞上被上调。成纤维细胞是固体癌的重要组分,支持干预的生长、侵袭和恢复。它们通常占晚期癌症中40%到60%的细胞。有利地,成纤维细胞是遗传上稳定的细胞,其比癌细胞更不可能逃避治疗。活化的成纤维细胞在各种肿瘤类型中也相对相似。因此,通过活化t细胞以靶向并且杀死表达fap的肿瘤相关成纤维细胞,本公开的腺病毒可以帮助减少免疫抑制途径的谱,如由il-10、tgfβ和ido介导的途径。其它基质靶,其包含肿瘤相关巨噬细胞和髓源性抑制细胞抗原,例如cd163、cd206、cd68、cd11c、cd11b、cd14、csf1受体、cd15、cd33、cd66b和其中两种或更多种的组合。在一个实施例中,所述bite中的所述结合结构域之一对如cd31、cd2和cd277等非tcr活化蛋白具有特异性。在一个实施例中,结合结构域之一对感兴趣的t细胞上的表面抗原具有特异性,如选自cd3(如cd3δ、cd3ε或cd3γ)、tcr-α链和tcr-β链,并且一个结合结构域对肿瘤抗原具有特异性。在一个实施例中,结合结构域之一对cd3具有特异性,并且另一个结合结构域对肿瘤抗原具有特异性,例如选自由以下组成的组:cea、muc-1、epcam、her受体her1、her2、her3、her4、pem、a33、g250、碳水化合物抗原ley、lex、leb、psma、tag-72、steap1、cd166、cd24、cd44、e-钙粘蛋白、sparc、erbb2和erbb3。在一个实施例中,结合结构域之一对cd3具有特异性(如cd3δ、cd3ε或cd3γ),并且另一个结合结构域对epcam具有特异性。在一个实施例中,结合结构域之一对cd3ε具有特异性,并且另一个结合结构域对epcam具有特异性。在一个实施例中,结合结构域之一对感兴趣的t细胞上的表面抗原具有特异性,如选自cd3(如cd3δ、cd3ε或cd3γ)、tcr-α和tcr-β,并且另一个结合结构域对肿瘤基质抗原具有特异性。在一个实施例中,结合结构域之一对cd3具有特异性(如cd3δ、cd3ε或cd3γ),并且另一个结合结构域对肿瘤基质抗原具有特异性,例如选自由以下组成的组:成纤维细胞活化蛋白(fap)、trem1、igfbp7、fsp-1、血小板源性生长因子-α受体(pdgfr-α)、血小板源性生长因子-β受体(pdgfr-β)和波形蛋白。在一个实施例中,结合结构域之一对cd3具有特异性(如cd3δ、cd3ε或cd3γ),并且另一个结合结构域对fap具有特异性。在一个实施例中,结合结构域之一对cd3ε具有特异性,并且另一个结合结构域对fap具有特异性。在一个实施例中,结合结构域之一对感兴趣的t细胞上的表面抗原具有特异性,如cd3、tcr-α和tcr-β,并且另一个结合结构域对非tcr活化蛋白具有特异性。在一个实施例中,结合结构域之一对cd3具有特异性(如cd3δ、cd3ε或cd3γ),并且另一个结合结构域对选自由以下组成的组的非tcr活化蛋白具有特异性:cd31、cd2和cd277。在一个实施例中,结合结构域之一对cd3ε具有特异性,并且另一个结合结构域对选自由以下组成的组的非tcr活化蛋白具有特异性:cd31、cd2和cd277。在一个实施例中,bx或by中的至少一个不是键。在一个实施例中,bx不是键。在一个实施例中,by不是键。在一个实施例中,bx和by均不是键。在一个实施例中,所述腺病毒是嵌合的。在一个实施例中,所述腺病毒是溶瘤的。在一个实施例中,所述腺病毒是嵌合的和溶瘤的。在一个实施例中,所述腺病毒能够进行复制。在一个实施例中,所述腺病毒是嵌合的、溶瘤的和能够进行复制的。在一个实施例中,所述腺病毒是复制型的。在另一个实施例中,所述腺病毒是嵌合的、溶瘤的和复制型的。在一个实施例中,所述腺病毒具有复制缺陷,即是载体。在一个实施例中,bx包括转基因或转基因盒,具体的说编码根据本公开的bite的转基因盒。在一个实施例中,by包括转基因或转基因盒,具体的说编码根据本公开的bite的转基因盒。在一个实施例中,by包括转基因或转基因盒,具体的说编码根据本公开的bite的转基因盒并且bx代表键。在一个实施例中,bx和by均包括转基因或转基因盒。在一个实施例中,所述一个或多个转基因或转基因盒受内源或外源启动子,如内源启动子的控制。有利地,当在这些启动子的控制下,病毒保持复制能力并且还能够表达bite和/或其它蛋白质。因此,选择的bite将由癌细胞表达。在一些实施例中采用外源启动子可能是有利的,因为所述外源启动子可以强烈地和组成性地表达抗体或片段,这在某些情况下可能特别有用,例如在患者具有严重弥漫性癌症的情况下。采用内源启动子可能是有利的,因为所述内源启动子减少了需要掺入以表达bite的转基因盒的大小,即因为不需要包含外源启动子,所述盒可以更小。因此,在一个实施例中,所述转基因或转基因盒受选自由以下组成的组的内源启动子的控制:e4启动子和主要晚期启动子,具体的说所述主要晚期启动子。在病毒中采用内源启动子在治疗环境中也可能是有利的,因为转基因仅在病毒在癌细胞而不是组成型外源启动子中复制时表达,所述组成型外源启动子将连续转录转基因并且可能导致抗体或片段的不适当浓度。在一个实施例中,转基因或转基因盒(例如编码bite)受如cmv等外源启动子的控制。有利地,组成型外源启动子的使用导致转基因的连续转录,这在某些情况下可能是期望的。在一个实施例中,一个转基因或转基因盒(例如编码bite)受内源启动子的控制,并且另一个转基因或转基因盒(例如编码bite)受外源启动子的控制。在一个实施例中,病毒中的所有转基因或转基因盒(例如编码bite)都受内源启动子的控制。在另一个实施例中,病毒中的所有转基因或转基因盒(例如编码bite)都受外源启动子的控制。在一个实施例中,转基因或转基因盒进一步包括独立地选自以下的调节元件:i)剪接受体序列,ii)内部核糖体进入序列或高自切割2a肽,iii)kozak序列及iv)其组合。因此,在一个实施例中,转基因盒包括i)或ii)或iii)或iv)。在一个实施例中,转基因盒包括i)和ii)、或i)和iii)、或i)和iv)、或ii)和iii)、或ii)和iv)、或iii)和iv)。在一个实施例中,转基因盒包括i)和ii)和iii)、或i)和ii)和iv)、或i)和iii)和iv)、或ii)和iii)和iv)。在一个实施例中,转基因盒包括i)和ii)和iii)和iv)。在一个实施例中,转基因盒包括在蛋白质(例如bite)编码序列的起始处的kozak序列,其有助于mrna的转译。在一个实施例中,转基因盒编码高自切割效率2a肽。在一个实施例中,转基因盒进一步包括多腺苷酸化序列。在一个实施例中,所述转基因盒进一步包括位于dna序列3'末端处和/或dna序列5'末端处的限制性位点。在一个实施例中,至少一个转基因盒编码单顺反子mrna。在一个实施例中,bite分子半衰期短,例如48小时或更少。在一个实施例中,bite分子在选自e1、e3、bx、by和其组合的区域中编码。有利地,诸位发明人已经确定,可以在外源或内源启动子的控制下将多种个基因插入bx和/或by中,而不会不利地影响病毒的生命周期或载体的稳定性。在一个实施例中,bite分子例如在主要晚期启动子的控制下至少编码在位置bx中。有利地,转基因或转基因盒允许bite或任何其它分子与腺病毒本身一起表达。重要的是,诸位发明人成功地证明了bite的表达不会显著影响enad复制的能力,也不会对其溶瘤活性产生负面影响。在一个实施例中,bite分子例如在主要晚期启动子的控制下至少编码在位置by中。有利地,转基因或转基因盒允许bite或任何其它分子与腺病毒本身一起表达。重要的是,诸位发明人成功地证明了bite的表达不会显著影响enad复制的能力,也不会对其溶瘤活性产生负面影响。在一个实施例中,腺病毒进一步编码第二bite。在一个实施例中,所述第一bite分子对肿瘤抗原具有特异性,例如如上文所描述的肿瘤抗原,并且所述第二bite分子对肿瘤基质抗原具有特异性,例如如上文所描述的基质抗原。在一个实施例中,第一bite分子对选自由以下组成的组的肿瘤抗原具有特异性:cea、muc-1、epcam、her受体her1、her2、her3、her4、pem、a33、g250、碳水化合物抗原ley、lex、leb、psma、tag-72、steap1、cd166、cd24、cd44、e-钙粘蛋白、sparc、erbb2和erbb3,并且第二bite分子对选自由以下组成的组的肿瘤基质抗原具有特异性:成纤维细胞活化蛋白(fap)、trem1、igfbp7、fsp-1、血小板源性生长因子-α受体(pdgfr-α)、血小板源性生长因子-β受体(pdgfr-β)和波形蛋白。在一个实施例中,第一bite分子对epcam具有特异性,并且第二bite分子对选自由以下组成的组的肿瘤基质抗原具有特异性:成纤维细胞活化蛋白(fap)、trem1、igfbp7、fsp-1、血小板源性生长因子-α受体(pdgfr-α)、血小板源性生长因子-β受体(pdgfr-β)和波形蛋白。在一个实施例中,第一bite分子对选自由以下组成的组的肿瘤抗原具有特异性:cea、muc-1、epcam、her受体her1、her2、her3、her4、pem、a33、g250、碳水化合物抗原ley、lex、leb、psma、tag-72、steap1、cd166、cd24、cd44、e-钙粘蛋白、sparc、erbb2和erbb3,并且第二bite对fap具有特异性。在一个实施例中,第一bite分子对epcam具有特异性并且第二bite分子对fap具有特异性。在另一个实施例中,所述第一bite分子对肿瘤抗原具有特异性,并且所述第二bite分子对非tcr活化蛋白具有特异性。在一个实施例中,第一bite分子对选自由以下组成的组的肿瘤抗原具有特异性:cea、muc-1、epcam、her受体her1、her2、her3、her4、pem、a33、g250、碳水化合物抗原ley、lex、leb、psma、tag-72、steap1、cd166、cd24、cd44、e-钙粘蛋白、sparc、erbb2和erbb3。在一个实施例中,第一bite分子对epcam具有特异性,并且第二bite分子对选自由以下组成的组的非tcr活化蛋白具有特异性:cd31、cd2和cd277。在一个实施例中,第一bite分子对肿瘤基质抗原具有特异性并且第二bite分子对非tcr活化蛋白具有特异性。在一个实施例中,第一bite分子对选自由以下组成的组的肿瘤基质抗原具有特异性:成纤维细胞活化蛋白(fap)、trem1、igfbp7、fsp-1、血小板源性生长因子-α受体(pdgfr-α)、血小板源性生长因子-β受体(pdgfr-β)和波形蛋白,并且第二bite分子对选自由以下组成的组的非tcr活化蛋白具有特异性:cd31、cd2和cd277。在一个实施例中,第一bite分子对fap具有特异性,并且第二bite分子对选自由以下组成的组的非tcr活化蛋白具有特异性:cd31、cd2和cd277。在一个实施例中,腺病毒仅包括一个bite。在另一个实施例中,腺病毒包括两个bite。在另一个实施例中,腺病毒包括三个bite。除了编码一种、两种或三个bite之外,病毒还可以编码1个、2个、3个或4个另外的转基因。在一个实施例中,腺病毒进一步编码细胞因子或趋化因子。在一个实施例中,腺病毒进一步编码细胞因子。在一个实施例中,腺病毒进一步编码趋化因子。在另一个实施例中,腺病毒进一步编码细胞因子和趋化因子。在一个实施例中,腺病毒包括一个bite和至少一个细胞因子或趋化因子,例如1个、2个或3个细胞因子,1个、2个或3个趋化因子或2个或3个基因的组合,每个基因独立地编码趋化因子的细胞因子。在另一个实施例中,腺病毒包括两个bite和至少一种细胞因子或趋化因子,例如1种或2种细胞因子,1种或2种趋化因子或细胞因子和趋化因子的组合。在另一个实施例中,腺病毒包括三个bite和至少一种细胞因子或趋化因子。在一个实施例中,细胞因子或趋化因子选自:il-1α、il-1β、il-6、il-9、il-12、il-13、il-17、il-18、il-22、il-23、il-24、il-25、il-26、il-27、il-33、il-35、il-2、il-4、il-5、il-7、il-10、il-15、il-21、il-25、il-1ra、ifnα、ifnβ、ifnγ、tnfα、淋巴毒素α(lta)和gm-csf、il-8、ccl2、ccl3、ccl5、ccl17、ccl20、ccl22、cxcl9、cxcl10、cxcl11、cxcl13、cxcl12、ccl2、ccl19、ccl21、例如il-12、il-18、il-22、il-7、il-15、il-21、ifnγ、tnfα、淋巴毒素α(lta)、ccl3、ccl5、cxcl9、cxcl12、ccl2、ccl19和ccl21。在一个实施例中,经编码细胞因子选自:tnfα超家族(tnfrsf包含tnf-α、tnf-c、ox40l、cd154、fasl、light、tl1a、cd70、siva、cd153、4-1bb配体、trail、rankl、tweak、april、baff、camlg、ngf、bdnf、nt-3、nt-4、gitr配体、eda-a、eda-a2)、tgf-β超家族、il-1家族(即il-1和il-8)、il-2家族、il-10家族、il-17家族、干扰素家族。在一个实施例中,趋化因子选自由以下组成的组:mip-1α、rantes、il-8、ccl5、ccl17、ccl20、ccl22、cxcl9、cxcl10、cxcl11、cxcl13、cxcl12、ccl2、ccl19和ccl21。在一个实施例中,腺病毒进一步包括对检查点蛋白或共刺激分子具有特异性的免疫调节因子,如抗体或抗体片段,或蛋白质或肽配体,或这些分子的特异性结合配体。在一个实施例中,免疫调节因子是对检查点蛋白具有特异性的抗体或抗体片段,或蛋白质或肽配体,如ctla-4、pd-1、pd-l1、pd-l2、vista、b7-h3、b7-h4、hvem、ilt-2、ilt-3、ilt-4、tim-3、lag-3、btla、light或cd160、例如ctla-4、pd-1、pd-l1和pd-l2。在一个实施例中,免疫调节因子是抑制剂,例如检查点抑制剂。在一个实施例中,免疫调节因子是激动剂。在另一个实施例中,免疫调节因子是对共刺激分子具有特异性的抗体或抗体片段,或蛋白质或肽配体,如cd28、cd80、cd86、cd83、icos、b7h2、tl1a和4-1bb。在一个实施例中,腺病毒包括对检查点蛋白具有特异性的第一抗体、抗体片段、蛋白质或肽配体以及对共刺激分子具有特异性的第二抗体、抗体片段、蛋白质或肽配体。在一个实施例中,所述bite包括:vh结构域,其包括seqidno:8、13或18中任一个所阐述的氨基酸序列或与其至少95%相同的氨基酸序列。在一个实施例中,所述bite包括:vl结构域,其包括seqidno:9、12或17中任一个所阐述的氨基酸序列或与其至少95%相同的氨基酸序列。在一个实施例中,所述bite包括scfv,所述scfv包括seqidno:7、11或16中任一个所阐述的氨基酸序列或与其至少95%相同的氨基酸序列。在一个实施例中,本公开中采用的bite(即由腺病毒编码)包括以下两种结合结构域:具有vh结构域,其具有seqidno:8所示的序列或与其至少95%相同的序列,以及具有vl结构域,其具有seqidno:9所示的序列或与其至少95%相同的序列。在一个实施例中,本公开中采用的bite(即由腺病毒编码)包括以下两种结合结构域:具有vh结构域,其具有seqidno:13所示的序列或与其至少95%相同的序列,以及具有vl结构域,其具有seqidno:12所示的序列或与其至少95%相同的序列。在一个实施例中,本公开中采用的bite(即由腺病毒编码)包括以下两种结合结构域:具有vh结构域,其具有seqidno:18所示的序列或与其至少95%相同的序列,以及具有vl结构域,其具有seqidno:17所示的序列或与其至少95%相同的序列。在一个实施例中,本公开中采用的bite(即由腺病毒编码)包括以下四种结合结构域:具有vh结构域,其具有seqidno:8所示序列或与其至少95%相同的序列;和具有vl结构域,其具有seqidno:9所示序列或与其至少95%相同的序列;和具有vh结构域,其具有seqidno:13所示序列或与其至少95%相同的序列的结合结构域;以及具有vl结构域,其具有seqidno:12所示序列或与其至少95%相同的序列。在一个实施例中,本公开中采用的bite(即由腺病毒编码)包括以下四种结合结构域:具有vh结构域,其具有seqidno:8所示序列或与其至少95%相同的序列;和具有vl结构域,其具有seqidno:9所示序列或与其至少95%相同的序列;和具有vh结构域,其具有seqidno:18所示序列或与其至少95%相同的序列的结合结构域;以及具有vl结构域,其具有seqidno:17所示序列或与其至少95%相同的序列。在一个实施例中,本公开中采用的bite(即由腺病毒编码)包括seqidno:7、11、16中所示的序列或与任何一种序列至少95%相同的序列。在一个实施例中,本公开中采用的bite(即由腺病毒编码)包括seqidno:7中所示的序列或与其至少95%相同的序列。在一个实施例中,本公开中采用的bite(即由腺病毒编码)包括seqidno:11中所示的序列或与其至少95%相同的序列。在一个实施例中,本公开中采用的bite(即由腺病毒编码)包括seqidno:16中所示的序列或与其至少95%相同的序列。在一个实施例中,所述bite包括seqidno:2或4中所阐述的氨基酸序列或与其至少95%相同的氨基酸序列,例如seqidno:73或75中所阐述的氨基酸。在一个实施例中,根据本公开的腺病毒包括seqidno:34到37中任一个所阐述的dna序列,或在严格条件下与其杂交的dna酸序列。在一个实施例中,根据本公开的腺病毒包括seqidno中任一个所阐述的dna序列:seqidno:79到82。在一个实施例中,根据本公开的腺病毒包括seqidno:34、35、36、37、79、80、82、96、97、98、99、100、101、102、103、120、298中任一个所示的dna序列或编码相同病毒的序列,或在严格条件下与其中任何一个杂交的序列。在一个实施例中,根据本公开的腺病毒包括seqidno:34、35、36、37、79、80、82、96、97、98、99、100、101、102、103、120或298中任一个所示的dna序列。技术人员意识到dna代码中存在冗余,因此本公开扩展到编码具有本文公开的氨基酸的bite的enad或ad11。c-末端deca-his(hhhhhhhhhhseqidno:24)亲和标记可用于纯化bite或腺病毒。但是,它是可选的,并且可以例如在最终产品中排除。技术人员还将意识到可以使用除deca-his之外的其它亲和标签,并且同样可以排除这些标签而不影响bite或腺病毒的生物学功能。因此,在一个实施例中,bite包括seqidno:2或4中任一个所阐述的氨基酸序列,但不包括序列c-末端的deca-his亲和标签,例如如seqidno:73或75所阐述。在另一个实施例中,腺病毒包括seqidno:34到37中任一个所阐述的dna序列,但不包括deca-his亲和标签,例如如seqidno:79到82中任一个所阐述的dna序列。排除deca-his亲和标签进一步延伸到本文公开的包括deca-his亲和标签的所有其它序列,即本公开包含缺少c-末端deca-his标签的相同氨基酸或dna序列(hhhhhhhhhh或catcaccatcaccatcaccaccatcaccat),例如如seqidno:72到82中任一个所阐述的序列。在一个实施例中,由本公开的病毒编码的bite受外源启动子,例如cmv启动子的控制。当转基因在l5和e4区之间时,外源子可以置于mpl与经编码转基因之间。当转基因在l5和e3区之间时,外源子可以置于经编码转基因与l5之间。在一个方面,提供了包括如本文所描述的腺病毒以及稀释剂或载剂的组合物。在一个方面,提供了治疗患者的方法,包括施用治疗有效量的如本文所描述的腺病毒或组合物。在一个实施例中,所述方法用于治疗癌症,例如上皮癌,具体的说实体瘤。在一个实施例中,提供了一种治疗方法,其包括将根据本公开的病毒与检查点抑制剂(如pd-1或pdl1抑制剂)组合施用,具体的说其中检查点抑制剂在病毒中编码。在一个实施例中,提供了一种治疗方法,其包括施用根据本公开的病毒,其不与检查点抑制剂(例如本文其它地方所列出的,如pd-1或pdl1抑制剂)组合,具体的说其中检查点抑制剂不在病毒编码中。根据本公开由病毒编码的bite具有增强病毒细胞毒性的能力。令人惊讶的是,根据本公开的由病毒编码的bite可以活化cd4+细胞和/或cd8+细胞,例如甚至在肿瘤的抑制环境中的细胞,包含肿瘤的如腹水等液体环境中的t细胞。有利地,根据本公开的由病毒编码的bite可以活化细胞毒性t细胞,例如甚至在肿瘤的抑制环境中的t细胞,包含肿瘤的如腹水等液体环境中的t细胞。甚至更令人惊讶的是,根据本公开的由病毒编码的bite能够刺激(活化)t细胞增殖。根据本公开的编码bite的病毒似乎能够绕过、克服或逆转肿瘤的免疫抑制微环境。在一个实施例中,t细胞的活化导致t细胞标记物,例如cd25的上调。在一个实施例中,根据本公开的病毒中bite的结合对新抗原具有特异性。本公开还扩展到本文公开的新序列。具体实施方式如本文所采用的免疫细胞是在免疫系统中具有功能作用的细胞,包含(但不限于)巨噬细胞、中性粒细胞、树突细胞、nk细胞、如t淋巴细胞(具体的说t细胞和nkt细胞)等淋巴细胞。如本文所使用的术语抗体是指能够通过位于免疫球蛋白分子的可变区中的至少一个抗原识别位点(本文也称为结合位点)特异性结合靶抗原,如碳水化合物、多核苷酸、脂质、多肽、肽等的免疫球蛋白分子。除非上下文另有指示,否则所述术语延伸到全长抗体和包括全长抗体的多特异性抗体分子。如本文所使用的,“抗体分子”包含抗体及其结合片段和任何一种的多特异性形式。如本文所采用的抗原结合位点是指分子的一部分,其包括一对可变区,具体的说与靶抗原特异性相互作用的同源对。具体地,如本文所采用的,旨在表示仅识别其特异性抗原的结合位点或与对抗原具有显著更高的结合亲和力的结合位点,与对其非特异性的抗原的亲和力相比具有特异性,例如结合亲和力高5倍、6倍、7倍、8倍、9倍、10倍。如本文所采用的结合片段或抗体结合片段是指抗体结合片段和多特异性抗体分子,其包括抗体结合片段,包含但不限于fab、修饰fab、fab'、修饰fab'、f(ab')2、fv、单结构域抗体、scfv、二价抗体、三价抗体或四价抗体、bis-scfv、双抗体、三抗体、四抗体和上文任一种的表位结合片段(参见例如holliger和hudson,2005,《自然生物技术(naturebiotech.)》23(9):1126-1136;adair和lawson,2005,《药物设计综述-在线(drugdesignreviews-online)》2(3),209-217)。用于产生和制备这些抗体片段的方法在所属领域中众所周知(参见例如verma等人,1998,《免疫法期刊(journalofimmunologicalmethods)》,216:165-181)。用于本公开的其它抗体片段包含国际专利申请wo05/003169、wo05/003170和wo05/003171中所描述的fab和fab'片段。多价抗体可以包括多种特异性,例如双特异性或者可以是单特异性的(参见例如wo92/22853和wo05/113605)。在一个实施例中,腺病毒包括多特异性抗体分子。如本文所采用的多特异性抗体分子是指具有两个或更多个抗原结合结构域的抗体分子,例如两个(双特异性)或三个(三特异性)或四个(四特异性)结合结构域。本公开的多特异性抗体分子可以由各种抗体片段构建,如上文描述的抗体片段。例如,双抗体是由scfv片段的非共价二聚体构成的双特异性抗体分子,而f(ab')2是由通过铰链区连接的2个fab片段构成的双特异性抗体分子。因此,技术人员将意识到,可以以各种组合布置不同的抗体片段,以产生双特异性或多特异性抗体分子。三特异性或四特异性抗体形式的实例包含但不限于fab3、三抗体、四抗体、三体、dvd-ig、igg-scfv、scfv2-fc、tandab和dnl-fab3。如本文所采用的双特异性抗体分子是指具有两个抗原结合结构域的分子,其可以结合相同或不同的抗原。bite是双特异性抗体分子的亚类。结构域可以结合不同的抗原。可替代地,结构域可以全部结合相同的抗原,包含结合抗原上的相同表位或结合相同抗原上的不同表位。双特异性抗体形式的实例包含但不限于双特异性t细胞衔接器(bite)、f(ab')2、f(ab')-scfv2、di-scfv、双抗体、微抗体、scfv-fc、dart、tandab、scdiabody、scdiabody-ch3、双抗体-ch3、三体、微型抗体、微抗体、tribi微抗体、scfv-ch3kih(杵臼)、fab-scfv、scfv-ch-cl-scfv、scfv-kih、fab-scfv-fc、四价hcab、scdiabody-fc、双抗体-fc、胞内抗体、对接和锁定抗体、immtac、hsabody、scdiabody-has、人体和串联scfv-毒性(参见例如christophspiess等人,《分子免疫学(molecularimmunology)》,67(2015),第95到106页)。本公开的腺病毒包括bite,其对感兴趣的t细胞上的至少表面抗原具有特异性。t细胞表面抗原的实例包含但不限于:cd3、cd2、vla-1、cd8、cd4、ccr6、cxcr5、cd25、cd31、cd45ro、cd197、cd127、cd38、cd27、cd196、cd277和cxcr3,具体的说cd2、cd3、cd31和cd277。如本文所使用的双特异性t细胞衔接器(bite)是指一类人工双特异性单克隆抗体,其包括2个scfv的不同抗体或来自约55kda的单个肽链上的4个不同基因的氨基酸序列。其中一种scfv对免疫细胞具有特异性,如在t细胞表面表达的t细胞抗原,如cd3受体。另一种scfv通常通过肿瘤特异性分子与肿瘤细胞结合。因此,bite能够通过其对t细胞上的抗原和肿瘤细胞上的抗原的特异性在t细胞与肿瘤细胞之间形成连接。这导致t细胞的活化并且触发t细胞对肿瘤细胞发挥其细胞毒性作用,而与mhci或共刺激分子无关。目前批准或正在进行临床试验的基于bite的疗法的实例包含例如靶向cd19的blinatumomab并且其用于治疗非霍奇金淋巴瘤和急性淋巴细胞白血病和solitomab,所述solitomab靶向epcam并且用于治疗胃肠癌和肺癌。在一个实施例中,免疫细胞衔接器(如t细胞衔接器)被布置为vl1-连接子1-vh1-连接子2-vh2-连接子3-vl2的形式,例如采用独立地选自本文公开的连接子序列的连接子。在一个实施例中,根据本公开的bite中的连接子独立地选自seqidno:10、14、23、124到162和166到297。在一个实施例中,连接子1和连接子3具有相同的序列,例如seqidno:10、14、23、124到162和166到296,具体的说10、14和23中任一个所示的序列。在一个实施例中,连接子1和连接子3具有不同的氨基酸序列,例如独立地选自seqidno:10、14、23、124到162和166到296,具体的说10、14和23。在一个实施例中,连接子1是seqidno:10。在一个实施例中,连接子1是seqidno:14。在一个实施例中,连接子3是seqidno:10。在一个实施例中,连接子3是seqidno:14。在一个实施例中,连接子1和连接子3是seqidno:10。在一个实施例中,连接子1和连接子3是seqidno:14。在一个实施例中,连接子1是seqidno:10,并且连接子3是seqidno:14。在一个实施例中,连接子1是seqidno:14,并且连接子3是seqidno:10。在一个实施例中,连接子2与连接子1和连接子3都不同。在一个实施例中,连接子2选自seqidno:10、14、23、124到162和166到297中的任一个,如seqidno:297。在一个实施例中,连接子1的长度范围为10个到30个氨基酸,如10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个或30个。在一个实施例中,连接子3的长度范围为10个到30个氨基酸,如10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个或30个。在一个实施例中,连接子2的长度范围为2个到10个氨基酸,如2个、3个、4个、5个、6个、7个、8个、9个或10个。在一个实施例中,vh1和vl1对根据本公开的t细胞抗原具有特异性,如cd3。在一个实施例中,vh2和vl2对根据本公开的如t细胞抗原等免疫细胞抗原具有特异性,如cd3。在一个实施例中,vh1和vl1对抗原或感兴趣的如癌抗原或基质抗原等具有特异性。在一个实施例中,vh2和vl2对抗原或感兴趣的如癌抗原或基质抗原等具有特异性。如本文所采用的基质或基质抗原是指基质中的抗原治疗靶,包含在基质基质的分子结构中表达,如结缔组织分子或与此基质相关的分子或与基质的细胞组分相关的抗原,例如已经渗入基质的成纤维细胞、肿瘤相关巨噬细胞、树突细胞、nk细胞和/或t细胞上表达。基质抗原的实例包含但不限于fap、tgfβ、trem1、igfbp7、fsp-1、成纤维细胞相关的抗原、ng2、内皮唾液酸蛋白(cd248)、血小板源性生长因子α受体(pdgfr-α)、血小板源性生长因子-β受体(pdgfr-β)和波形蛋白。成纤维细胞可以通过采用抗原成纤维细胞活化蛋白(fap),具体的说不结合cd26的fap特异性抗体来靶向(参见us2012/0258119,通过引用并入本文)。fap最初被鉴定为反应性基质成纤维细胞上的丝氨酸蛋白酶。随后的分子克隆显示fap与seprase相同,seprase是由黑素瘤细胞系表达的170kda膜相关明胶酶。全长cdna编码760个氨基酸(aa)的h型跨膜蛋白酶,其与二肽基肽酶iv(dppiv)高度同源,在整个序列上具有52%的同一性,并且在催化结构域中具有几乎70%的同一性。通过引用并入本文的us5,587,299描述了编码fap的核酸分子及其应用。fap和dppiv具有相似的基因大小,并且在2q24处彼此染色体相邻,表明基因复制事件(genebank登录号u09278)。两种蛋白质均是脯氨酰肽酶家族的成员。这类酶是可诱导的,在细胞表面或细胞外液中有活性,并且独特地能够在倒数第二位置从具有脯氨酸或丙氨酸的多肽切割n-末端二肽。dppiv,也称为cd26,由几种细胞类型结构性表达,包含成纤维细胞、内皮细胞和上皮细胞、白细胞亚群如nk细胞、t淋巴细胞和巨噬细胞。一小部分dppiv在血液中作为可溶性蛋白质循环。与dppiv相反,fap通常不在正常成人组织中表达,并且其蛋白水解活性可溶形式被称为α2-抗纤溶酶裂解酶(apce)。标记的fap表达发生在与活化的基质相关的病症中,包含伤口愈合、上皮癌、骨关节炎、类风湿性关节炎、肝硬化和肺纤维化。fap结构已经解决(pdbid1z68)并且与dppiv的结构非常相似。fap通过约20个氨基酸的未裂解信号序列锚定在质膜中,并且具有六个氨基酸的短氨基末端细胞质结构域。包含催化结构域的蛋白质的主要部分暴露于细胞外环境。fap糖蛋白是由两个相同的97-kda亚基组成的同型二聚体。每个fap-单体亚基由两个结构域组成,αβ水解酶结构域(aa27到53和493到760)和八叶β螺旋桨结构域(aa54到492)包围大腔。在两个区界面处的此腔内的小口袋含有催化三联体(ser624、asp702和his734)。fap在亚基同源二聚化后获得其酶活性,并且除了其二肽基肽酶活性外,fap还具有i型胶原特异性明胶酶和内肽酶活性。β螺旋桨充当蛋白质-蛋白质相互作用的支架并且确定底物和细胞外基质(ecm)结合。此外,β螺旋桨参与形成fap与其它脯氨酰肽酶或与其它膜结合分子的超分子复合物。发现fap和dppiv的异聚体或四聚体复合物的形成与胶原底物上的迁移细胞的伪足有关。i型胶原蛋白诱导fap与β1整联蛋白的紧密结合,由此在伪足的形成和粘附中起主要的组织作用。虽然没有详细了解所涉及的机制,但是在细胞侵袭前沿处形成这种富含蛋白酶的膜结构域有助于定向的细胞外ecm降解。这指示fap和ecm相互作用可能通过整合素途径影响细胞粘附、迁移、增殖和凋亡,并且支持fap在疾病发病机制和进展中的作用,从而与侵袭性细胞行为密切相关。总之,fap被认为是一种多功能蛋白质,所述多功能蛋白质通过其蛋白酶活性和其与其它细胞表面分子形成复合物的能力的组合,以细胞依赖性方式执行其生物学功能。上皮细胞和成纤维细胞系中fap的过度表达促进恶性行为,指向临床情况,其中fap的细胞表达水平与更差的临床结果相关。通过旁分泌信号分子、癌细胞活化基质成纤维细胞并且诱导fap的表达,这进而影响癌细胞的增殖、侵袭和迁移。最近的研究已经证明tgf-β是促进fap蛋白表达的主要因素(chen、h等人,(2009),《实验与分子病理学(expandmolecpathology)》,doi:10.1016/j.yexmp。2009.09.001)。fap在90%的人上皮癌中的反应性基质成纤维细胞中大量表达,包含乳腺癌、肺癌、结肠癌和卵巢癌(garin-chesa、p等人,(1990),《美国科学院院报(pnasusa)》,87:7236-7239)。chen等人最近表明fapα影响ho-8910pm卵巢癌细胞的侵袭、增殖和迁移(chen、h等人,(2009),《实验与分子病理学》,doi:10.1016/j.yexmp。2009.09.001)。fap可以通过结合所述抗原并且在空间上阻断其与生物相关分子的相互作用来靶向。可替代地或另外地,采用如双特异性抗体分子等多特异性抗体分子可以实现fap分子与另一种fap分子或不同分子的交联,例如癌细胞表面上的抗原。这种交联提高了携带抗原的细胞对免疫系统的可见性,然后所述免疫系统可以被活化到中性或破坏免疫系统。肿瘤相关巨噬细胞(tam)被认为表达trem1、cd204、cd68(单独或与cd163或cd206组合)。这些标记可以用于靶向tam。本公开的腺病毒具有感染肿瘤细胞的能力,并且具体的说选择优先感染肿瘤细胞。溶瘤病毒感染引起癌细胞的死亡和溶解,释放新生成的病毒颗粒。编码抗体、bite和其它“有效载荷”的掺入转基因是新合成的并且在它们死亡之前由肿瘤细胞主动分泌,并且一些分子还将在细胞溶解时释放。具有短半衰期的抗体分子可能特别适合用于本公开内容,因为这使脱靶效应最小化,因为如果分子变得全身可用,则身体会快速清除所述分子。nkt细胞具有靶向和破坏肿瘤相关巨噬细胞的能力。然而,它们的活性似乎受到肿瘤缺氧环境的抑制。通过向nkt细胞提供例如在本公开的病毒中编码的il-2和/或il-15,可以恢复此活性。因此,在一个实施例中,根据本公开的病毒进一步编码细胞因子以活化nkt细胞,例如选自il-2、il-15和其组合。编码细胞因子的基因可以与编码抗体分子的基因位于相同的位置或不同的位置,例如独立地选自e1、e3、e4、bx和by。因此,根据本公开的腺病毒具有至少两种或三种攻击肿瘤的机制,包含破坏肿瘤基质的间接机制。如本文所采用的转基因是指已经插入基因组序列的基因,所述基因组序列是对病毒不自然的基因(外源的)或通常不在病毒的特定位置发现的基因。转基因的实例如下。如本文所采用的转基因还包含基因的功能片段,所述基因的功能片段是基因的一部分,其在插入时适合于执行全长基因的功能或大部分功能。除非上下文另有指示,否则转基因和编码序列在插入病毒基因组的上下文中可互换使用。如本文所采用的编码序列意指例如编码功能性rna、肽、多肽或蛋白质的dna序列。通常,编码序列是用于编码目的功能性rna、肽、多肽或蛋白质的转基因的cdna。功能性rna、肽、多肽和感兴趣的蛋白质描述如下。显然,病毒基因组含有dna的编码序列。在本说明书的上下文中,病毒的基因组序列中的内源(天然存在的基因)不被认为是转基因,除非之后通过重组技术修饰,如它们在非天然位置或在非天然环境中。在一个实施例中,如本文所采用的,转基因是指含有基因或cdna序列的dna区段,所述基因或cdna序列已经从一种生物体中分离并且被引入不同的生物体,即本公开的病毒。在一个实施例中,此非天然dna区段可以保留产生功能性rna、肽、多肽或蛋白质的能力。因此,在一个实施例中,插入的转基因编码人类或人源化蛋白质、多肽或肽。在一个实施例中,插入的转基因编码非人类蛋白质、多肽或肽(如非人类哺乳动物蛋白、多肽或肽)或rna分子,例如来自小鼠、大鼠、兔、骆驼、美洲驼或类似物。有利地,本公开的病毒允许转基因在癌细胞内转运。因此,通过这种细胞内递送可以使由人类患者对非人类序列(如蛋白质)生成的应答最小化。dna序列可以包括一种以上的转基因,例如1个、2个、3个或4个转基因,如1种或2种。转基因盒可以包括一种以上的转基因,例如1个、2个、3个或4个转基因,如1种或2种。在一个或多个实施例中,所述盒如图中或实例中的一个或多个所示布置。如本文所采用的转基因盒是指编码以一个或多个编码序列和一个或多个调控元件形式的一个或多个转基因的dna序列。转基因盒可以编码一个或多个单顺反子和/或多顺反子mrna序列。在一个实施例中,转基因或转基因盒编码单顺反子或多顺反子mrna,并且例如所述盒适于在内源启动子或外源启动子或其组合的控制下的位置处插入腺病毒基因组。如本文所采用的单顺反子mrna是指编码单一功能性rna、肽、多肽或蛋白质的mrna分子。在一个实施例中,转基因盒编码单顺反子mrna。在一个实施例中,在编码单顺反子mrna的盒的上下文中,转基因盒意指任选地含有外源启动子的dna区段(其是将确定转基因何时何地处于活跃状态的调节序列)或剪接位点(其是调节序列确定mrna分子何时将被剪接体裂解)编码序列(即转基因),通常衍生自感兴趣的蛋白质的cdna,任选地含有polya信号序列和终止子序列。在一个实施例中,转基因盒可以编码一个或多个多顺反子mrna序列。如本文所采用的多顺反子mrna是指编码两种或更多种功能性rna、肽或蛋白质或其组合的mrna分子。在一个实施例中,转基因盒编码多顺反子mrna。在一个实施例中,在编码多顺反子mrna的盒的上下文中,转基因盒包含任选地含有外源启动子的dna区段(其是将确定转基因何时何地处于活跃状态的调节序列)或剪接位点(其是调节序列确定mrna分子何时将被剪接体裂解)两个或多个编码序列(即转基因),通常衍生自感兴趣的蛋白质或肽的cdna,例如其中每个编码序列被ires或2a肽分开。在待转录的最后编码序列之后,所述盒可以任选地含有polya序列和终止子序列。在一个实施例中,转基因盒编码单顺反子mrna,然后编码多顺反子mrna。在另一个实施例中,转基因盒编码多顺反子mrna,然后是单顺反子mrna。在一个实施例中,腺病毒是人类腺病毒。如本文所采用的“腺病毒”、“血清型”或“腺病毒血清型”是指任何可以指定为50多种目前已知的腺病毒血清型中的任何一种的腺病毒,其被分类为亚组a到f,并且进一步延伸到任何尚未鉴定或尚未分类的腺病毒血清型。参见例如strauss,“腺病毒在人体内的感染(adenovirusinfectionsinhumans)”,载于《腺病毒》,ginsberg,ea.,美国纽约州纽约普莱南出版社,第451到596页,(1984)以及shenk,“腺病毒科:病毒及其复制(adenoviridae:thevirusesandtheirreplication)”,载于《病毒学领域》第2卷第四期,knipe,35ea.,lippincottwilliams和wilkins,第2265到2267页,(2001),如表1所示。表1本公开的腺病毒是亚组b病毒,即ad11,具体的说ad11p(slobitski菌株)及其衍生物,如enad。腺病毒被指定为基于衣壳的其组/血清型,如六邻体和/或纤维。本公开的腺病毒不是a组、c组、d组、e组或f组病毒。本公开的病毒不包括腺病毒死亡蛋白。在一个实施例中,本公开的腺病毒是嵌合的。当腺病毒是嵌合的时,则将采用外衣壳的特性来确定血清型。如本文所采用的嵌合体是指包括来自至少两种不同病毒血清型的dna的病毒,包含同一组内的不同血清型。在一个实施例中,溶瘤病毒具有来自相同血清型的纤维、六邻体和五邻体蛋白,例如ad11,具体的说ad11p,例如在后者的基因组序列的30812到31789、18254到21100和13682到15367位置发现,其中核苷酸位置是相对于genbankid217307399(登录号:gc689208)。在一个实施例中,腺病毒是enadenotucirev(也称为enad,并且以前称为enad)。如本文所采用的enadenotucirev是指seqidno:38的嵌合腺病毒。它是复制型溶瘤性嵌合腺病毒,其与野生型腺病毒相比具有增强的治疗性质(参见wo2005/118825)。enad具有嵌合e2b区,其具有来自ad11p和ad3的dna,以及e3/e4中的缺失。enadenotucirev的结构变化导致基因组比ad11p小约3.5kb,由此为转基因的插入提供了额外的“空间”。enadenotucirev(enad)是嵌合的溶瘤腺病毒,以前称为enad(wo2005/118825),具有来自ad11p的纤维、五邻体和六邻体,因此它是亚组b病毒。它具有嵌合的e2b区,其包括来自ad11p和ad3的dna。在enad中几乎所有e3区和e4区的一部分都缺失。因此,它在基因组中具有显著的空间以容纳额外的遗传物质,同时保持活力。此外,因为enad是亚组b腺病毒,所以人类预先存在的免疫力不如例如ad5那么常见。具有ad11纤维、五邻体和六邻体的嵌合溶瘤病毒的其它实例包含ovad1和ovad2(参见wo2006/060314)。enad似乎优先感染肿瘤细胞,在这些细胞中快速复制并且导致细胞溶解。反过来,这可以生成炎症性免疫应答,由此刺激身体也来对抗癌症。enad的部分成功被假设与体内病毒的快速复制有关。虽然enad选择性地溶解肿瘤细胞,但是可以引入另外的有益性质,例如通过用转基因携带它来增加病毒的治疗活性或减少病毒的副作用,如编码细胞信号蛋白或抗体的转基因或编码刺激一个或多个细胞信号蛋白的实体的转基因。有利地,利用可以在癌细胞内表达的编码如bite等某些蛋白质的dna来携带病毒,可以使身体自身的防御能够更有效地用于对抗肿瘤细胞,例如通过使细胞对于免疫系统更加可见或通过优先向靶肿瘤细胞递送治疗基因/蛋白质。此外,将作为报告基因的转基因插入基因组的能力可以有助于临床或临床前研究。重要的是转基因的表达不会不利地影响病毒的复制或其它有利性质。因此,必须将一个或多个基因插入不损害病毒的复制能力和其它有利性质的位置。另外,腺病毒的基因组是紧密堆积的,并且因此很难找到合适的位置来插入转基因。这也限制了可以容纳的转基因的大小。ovad1和ovad2也是与enadenotucirev相似的嵌合腺病毒,其在基因组中还具有额外的“空间”(参见wo2008/080003)。因此,在一个实施例中,腺病毒是ovad1或ovad2。在一个实施例中,腺病毒是溶瘤的。如本文所采用的溶瘤腺病毒意指与非癌细胞相比优先杀死癌细胞的腺病毒。在一个实施例中,溶瘤病毒是凋亡的。也就是说,其加速了程序性细胞死亡。在一个实施例中,溶瘤病毒是溶细胞的。本公开的溶瘤腺病毒的溶细胞活性可以在代表性肿瘤细胞系中确定,并且数据转换为效力的测量,例如用如ad5等属于亚组c的腺病毒来用作标准物(即,效力为1)。用于确定细胞溶解活性的合适方法是mts测定(参见wo2005/118825的实例4,图2,其通过引用并入本文)。在一个实施例中,溶瘤病毒是坏死性的。也就是说,其引起或加速细胞坏死或免疫原性细胞死亡。在一个实施例中,坏死性细胞死亡是有利的,因为其触发、诱导患者(宿主)免疫应答。除非上下文另有指示,否则本文所采用的腺病毒是指能够进行复制的病毒(如复制型病毒)以及复制缺陷型病毒载体。能够如本文所采用的复制是指复制型病毒或病毒,其复制依赖于癌细胞中的因子,例如上调因子,如p53或类似物。在一个实施例中,病毒是复制型的。在本说明书的上下文中起作用的复制是指具有在体外和体内的细胞中复制的所有必需机制的病毒,即没有包装细胞系的辅助。例如在e1区缺失、能够在互补包装细胞系中复制的病毒载体在本文上下文中不是复制型病毒。病毒载体是复制缺陷的,并且需要包装细胞提供互补基因以允许复制。如本文所采用的腺病毒基因组意指编码与腺病毒的功能/生命周期相关的结构蛋白和元件的dna序列。迄今为止检查的所有人类腺病毒基因组具有相同的一般组织,即编码特定功能的基因位于病毒基因组中的相同位置(在本文中称为结构元件)。病毒基因组的每个末端都具有称为反向末端重复序列(或itr)的短序列,这是病毒复制所必需的。病毒基因组含有五个早期转录单位(e1a、e1b、e2、e3和e4)、三个延迟早期单位(ix、iva2和e2晚期)以及被处理以生成五个晚期mrna家族(l1到l5)的一个晚期单位(主要晚期)。由早期基因编码的蛋白质主要参与宿主细胞对感染的应答的复制和调节,而晚期基因编码病毒结构蛋白。早期基因以字母e为前缀,并且晚期基因以字母l为前缀。腺病毒的基因组紧密堆积,也就是说几乎不存在非编码序列,并且因此很难找到合适的位置来插入转基因。诸位发明人已经鉴定了两个耐受转基因的dna区,具体的说鉴定的位点适合于容纳复杂的转基因,如编码抗体的转基因。也就是说,表达转基因而不会不利地影响病毒的活力、如溶瘤性质或复制等天然性质。在一个实施例中,根据本公开的溶瘤病毒或部分溶瘤病毒可以是e4和/或e3区中的缺失的结果,例如在e4区的一部分中缺失或在e3区中完全缺失,或者可替代地在e4区的一部分(如e4或f4)中缺失并且在e3区中完全缺失,例如在本文公开的序列中举例说明。在一个实施例中,本公开的溶瘤病毒是嵌合的。如本文所采用的嵌合体是指包括来自两种或更多种不同血清型的dna并且具有溶瘤病毒性质的病毒。在一个实施例中,溶瘤病毒是enad或其活性衍生物,其保留病毒的基本有益性质。enad在wo2005/118825中公开(通过引用并入本文)并且本文提供了病毒的完整序列seqidno:38。嵌合e2b区在本文中公开为seqidno:71。可替代的溶瘤病毒包含ovad1和ovad2,它们分别在wo2008/080003中作为seqidno:2和seqidno:3公开,并且通过引用并入本文。有利地,本公开的腺病毒在体外感染多种不同的结肠癌细胞系后展现出与enad相似的病毒活性,例如复制和/或感染性。腺病毒的结构元素本公开还涉及本文公开的病毒或病毒组分/构建体的新序列,如质粒。在一个实施例中,腺病毒包括由式(i)序列构成的基因组5'itr-b1-ba-b2-bx-bb-by-b3-3'itr(i)其中:b1包括e1a、e1b或e1a-e1b;ba包括e2b-l1-l2-l3-e2a-l4;b2是键或包括e3;bx是包括限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在外源启动子控制下)或两者的键或dna序列;bb包括l5;by是键或包括以下的dna序列:限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在如mpl等内源启动子的控制下或在如cmv启动子等外源启动子的控制下)或两者;b3是键或包括e4;其中bx和by中的至少一个不是键并且包括转基因或限制性位点或两者;并且编码包括至少两个结合结构域的多特异性抗原分子,并且所述结构域中的至少一个对感兴趣的t细胞上的表面抗原具有特异性。在一个实施例中,腺病毒包括由式(i)的序列构成的基因组,其中b1bx是键。在一个实施例中,腺病毒包括由式(i)序列构成的基因组,其中:by是键。在一个实施例中,腺病毒包括由式(ia)序列构成的基因组:5'itr-ba-b2-bx-bb-by-b3-3'itr(ia)其中:ba包括e2b-l1-l2-l3-e2a-l4;b2是键或包括e3;bx是包括限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在外源启动子的控制下)或两者的键或dna序列;bb包括l5;by是键或包括以下的dna序列:限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在如mpl等内源启动子的控制下或在如cmv启动子等外源启动子的控制下)或两者;b3是键或包括e4;其中bx和by中的至少一个不是键,并且至少一个包括转基因或限制性位点,如转基因。在一个实施例中,腺病毒包括由式(ia)的序列构成的基因组,其中bx是键。在一个实施例中,腺病毒包括由式(ia)的序列构成的基因组,其中by是键。在一个实施例中,腺病毒包括由式(ib)序列构成的基因组:5'itr-ba-bx-bb-by-b3-3'itr(ib)其中:ba包括e2b-l1-l2-l3-e2a-l4;bx是包括限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在外源启动子的控制下)或两者的键或dna序列;bb包括l5;by是键或包括以下的dna序列:限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在如mpl等内源启动子的控制下或在如cmv启动子等外源启动子的控制下)或两者;b3是键或包括e4;其中bx和by中的至少一个不是键并且包括转基因或限制性位点或两者,如转基因。在一个实施例中,腺病毒包括由式(ib)的序列构成的基因组,其中bx是键。在一个实施例中,腺病毒包括由式(ib)的序列构成的基因组,其中by是键。在一个实施例中,腺病毒包括由式(ic)序列构成的基因组:5'itr-ba-b2-bx-bb-by-3'itr(ic)其中:ba包括e2b-l1-l2-l3-e2a-l4;b2是e3;bx是包括限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在外源启动子的控制下)或两者的键或dna序列;bb包括l5;by是键或包括以下的dna序列:限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在如mpl等内源启动子的控制下或在如cmv启动子等外源启动子的控制下)或两者;其中bx和by中的至少一个不是键并且包括转基因或限制性位点或两者,如转基因。在一个实施例中,腺病毒包括由式(ic)的序列构成的基因组,其中bx是键。在一个实施例中,腺病毒包括由式(ic)的序列构成的基因组,其中by是键。在一个实施例中,腺病毒包括由式(id)序列构成的基因组:5'itr-b1-ba-bx-bb-by-b3-3'itr(id)其中:b1包括e1a、e1b或e1a-e1b;ba包括e2b-l1-l2-l3-e2a-l4;bx是包括限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在外源启动子的控制下)或两者的键或dna序列;bb包括l5;by是键或包括以下的dna序列:限制性位点、一个或多个转基因(具体的说编码至少一个根据本公开的bite的转基因,例如在如mpl等内源启动子的控制下或在如cmv启动子等外源启动子的控制下)或两者;b3是键或包括e4;其中bx和by中的至少一个不是键并且包括转基因、限制性位点或两者。在一个实施例中,腺病毒包括由式(id)的序列构成的基因组,其中bx是键。在一个实施例中,腺病毒包括由式(id)的序列构成的基因组,其中by是键。在一个实施例中,腺病毒包括由式(ie)序列构成的基因组:5'itr-b1-ba-b2-bb-by-3'itr(ie)其中:b1包括e1a、e1b或e1a-e1b;ba包括e2b-l1-l2-l3-e2a-l4;b2包括e3;bb包括l5;by是键或包括以下的dna序列:根据本公开的一个或多个转基因编码至少一个bite(例如在如mpl等内源启动子的控制下或在如cmv启动子等外源启动子的控制下);其中bx和by中的至少一个不是键并且包括转基因、限制性位点或两者。在一个实施例中,提供了式(i)、(ia)、(ib)、(ic)、(id)或(ie)的化合物,其中bx和by不是键并且包括转基因限制性位点或两者,如bx和by均是转基因。在式(i)、(ia)、(ib)、(ic)或(id)的一个实施例中,仅bx编码一个或两个bite,例如一个bite(并且by不编码bite),具体的说所述一个或多个bite在如cmv启动子等外源启动子的控制下。在式(i)、(ia)、(ib)、(ic)或(id)的一个实施例中,仅by编码一个或两个bite,例如一个bite(并且bx不编码bite),具体的说所述一个或多个bite在如mpl等内源启动子的控制下或在如cmv启动子等外源启动子的控制下。在式(i)、(ia)、(ib)、(ic)或(id)的一个实施例中,bx编码bite(例如在如cmv启动子等外源启动子的控制下)并且by编码bite(例如在如mpl等内源启动子的控制下或在如cmv启动子等外源启动子的控制下)。键是指将一个dna序列连接到另一个dna序列的共价键,例如将病毒基因组的一个区段连接到另一个区段。因此,当本文的式(i)、(ia)、(ib)、(ic)、(id)或(ie)中的变量表示键时,由键表示的特征或元素不存在,即缺失。由于腺病毒的结构通常类似于下文的元素是根据结构要素和参考的常用术语来讨论的,这些是本领域技术人员已知的。当在本文中提及元件时,我们指的是编码所述元件的dna序列或编码腺病毒中所述元件的相同结构蛋白的dna序列。因为dna代码的冗余,所以后者是相关的。可能需要考虑病毒对密码子使用的偏好以获得优化结果。来自本公开的病毒中采用的腺病毒的任何结构元件可以包括天然序列或由天然序列组成,或者可以在给定长度上具有至少95%的相似性,如96%、97%、98%、99%或100%。可以修改原始序列以省略遗传物质的10%、9%、8%、7%、6%、5%、4%、3%、2%或1%。技术人员知道,当进行改变时,必须不破坏病毒的阅读框,以便破坏结构蛋白的表达。在一个实施例中,给定元件是全长序列,即全长基因。在一个实施例中,给定元素小于全长并且保持与全长序列相同或对应的功能。在一个实施例中,对于在本公开的构建体中任选的给定元件,dna序列可以小于全长并且不具有功能性。编码腺病毒的结构或功能蛋白的结构基因通常通过dna的非编码区连接。因此,为了将转基因插入本公开的病毒中,在哪里“切割”感兴趣的结构元件的基因组序列(尤其是其非编码区)存在一些灵活性。因此,出于本说明书的目的,所述元件将被认为是参考的结构元件,其程度适合于目的并且不编码外来材料。因此,如果合适,所述基因将与合适的非编码区相关联,例如在病毒的天然结构中发现的。因此,在一个实施例中,将插入物(如编码限制性位点和/或转基因的dna)插入基因组病毒dna的非编码区,如内含子或基因间序列。已经说过,腺病毒的一些非编码区可能具有功能,例如在可替代的剪接、转录调节或转译调节中,并且可能需要考虑这一点。本文鉴定的与l5区相关的位点(例如l5与e4区之间)适合于容纳编码复杂实体的各种dna序列,如rnai、细胞因子、单链或多聚体蛋白质,如抗体,如bite。本文所采用的基因是指编码和与其相关的任何非编码序列,例如内含子和相关的外显子。在一个实施例中,基因包括必需的结构组分或仅由必需的结构组分组成,例如编码区。下文是关于腺病毒的特定结构元素的讨论。反向末端重复(itr)序列对于所有已知的腺病毒是共同的,并且由于其对称性而如此命名,并且是病毒染色体复制起点。这些序列的另一个性质是其形成发夹的能力。如本文所采用的5'itr是指来自腺病毒5'末端的部分或全部itr,其在合适位置掺入腺病毒时保留itr的功能。在一个实施例中,5'itr包括seqidno:38的约1bp到138bp的序列或沿整个长度的序列90%、95%、96%、97%、98或99%相同的序列或由其组成,具体的说由seqidno:38的约1bp到138bp组成的序列。如本文所采用的3'itr是指腺病毒3'末端的部分或全部itr,其在合适位置掺入腺病毒时保留itr的功能。在一个实施例中,3'itr包括seqidno:38的约32189bp到32326bp的序列或沿整个长度的序列90%、95%、96%、97%、98或99%相同的序列或由其组成,具体的说由seqidno:38的约32189bp到32326bp组成的序列。如本文所采用的b1是指dna序列编码:腺病毒的e1a的部分或全部、腺病毒的e1b区的部分或全部以及独立地腺病毒的e1a区和e1b区的部分或全部。当b1是键时,则e1a和e1b序列将从病毒中省略。在一个实施例中,b1是键,并且因此病毒是载体。在一个实施例中,b1进一步包括转基因。本领域已知e1区可以容纳转基因,所述转基因可以以破坏性的方式插入e1区(即在序列的“中间”)或者可以缺失部分或全部e1区以提供更多的空间以容纳遗传物质。如本文所采用的e1a是指编码部分或全部腺病毒e1a区的dna序列。后者在本文中是指多肽/蛋白质e1a。其可以被突变使得由e1a基因编码的蛋白质具有保守或非保守的氨基酸变化,使得其具有:与野生型相同的功能(即对应的非突变蛋白质);与野生型蛋白质相比功能增加;功能下降,如与野生型蛋白质相比无功能;或者与野生型蛋白质或其适当组合相比具有新功能。如本文所采用的e1b是指编码部分或全部腺病毒e1b区(即多肽或蛋白质)的dna序列,其可以被突变,使得由e1b基因/区编码的蛋白质具有保守或非保守的氨基酸变化,使得其具有:与野生型相同的功能(即对应的非突变蛋白质);与野生型蛋白质相比功能增加;功能下降,如与野生型蛋白质相比无功能;或者与野生型蛋白质或其适当组合相比具有新功能。因此,相对于如野生型e1a和/或e1b等野生型e1区,b1可以被修饰或未修饰。技术人员可以容易地识别e1a和/或e1b是否存在或(部分)缺失或突变。如本文所采用的野生型是指已知的腺病毒。已知的腺病毒是已经鉴定和命名的腺病毒,无论所述序列是否可用。在一个实施例中,b1具有seqidno:38的139bp到3932bp的序列。如本文所采用的,ba是指编码e2b-l1-l2-l3-e2a-l4区的dna序列,包含任何非编码序列,视情况而定。通常,此序列将不包括转基因。在一个实施例中,所述序列与来自已知腺病毒的连续序列基本相似或相同,例如表1中所示的血清型,具体的说b组病毒,例如ad3、ad7、ad11、ad14、ad16、ad21、ad34、ad35、ad51或其组合,如ad3、ad11或其组合。在一个实施例中,e2b-l1-l2-l3-e2a-l4是指包括这些元件和与所述区相关的其它结构元件,例如ba将通常包含编码蛋白质iv2a的序列,例如如下:iv2aiv2a-e2b-l1-l2-l3-e2a-l4在一个实施例中,e2b区是嵌合的。也就是说,包括来自两种或更多种不同腺病毒血清型的dna序列,例如来自ad3和ad11,如ad11p。在一个实施例中,e2b区在整个长度上具有seqidno:38的5068bp到10355bp的序列或与其95%、96%、97%、98%或99%相同的序列。在一个实施例中,组分ba中的e2b包括seqidno:71中所示的序列(其对应于wo2005/118825中公开的seqidno:3)。在一个实施例中,ba具有seqidno:38的3933bp到27184bp的序列。如本文所采用的e3是指编码部分或全部腺病毒e3区(即蛋白质/多肽)的dna序列,其可以被突变,使得由e3基因编码的蛋白质具有保守或非保守的氨基酸变化,使得其具有与野生型相同的功能(对应的未突变蛋白);与野生型蛋白质相比功能增加;功能降低,如与野生型蛋白质相比无功能或者与野生型蛋白质或其组合相比具有新功能,视情况而定。在一个实施例中,e3区形成表1中给出的腺病毒血清型或其组合,具体的说b组血清型,例如ad3、ad7、ad11(具体的说ad11p)、ad14、ad16、ad21、ad34、ad35、ad51或其组合,如ad3、ad11(具体的说ad11p)或其组合。在一个实施例中,e3区被部分缺失,例如95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%缺失。在一个实施例中,b2是键,其中不存在编码e3区的dna。在一个实施例中,编码e3区的dna可以被转基因代替或中断。如本文所采用的,用如本文所采用的转基因代替的e3区包含部分或全部e3区被转基因代替。在一个实施例中,b2区包括seqidno:38的27185bp到28165bp的序列。在一个实施例中,b2由seqidno:38的27185bp到28165bp的序列组成。如本文所采用的bx是指bb中l5基因的5'末端附近的dna序列。在如本文所采用的l5基因的5'末端附近或近端是指:邻近(邻接)l5基因的5'末端或与其固有相关的非编码区,即与l5基因的5'主要末端紧靠或邻接或与其固有相关的非编码区。可替代地,在附近或近端可以指闭合l5基因,使得在bx区与l5基因的5'末端之间不存在编码序列。因此,在一个实施例中,bx直接连接到l5的碱基,其代表例如l5基因的编码序列的起始。因此,在一个实施例中,bx直接连接到l5的碱基,其代表例如非编码序列的起点,或直接连接到与l5天然相关的非编码区。如本文所采用的,天然关联l5的非编码区是指所有非编码区的一部分,所述非编码区是l5基因的一部分或与其邻接但不是另一基因的一部分。在一个实施例中,bx包括seqidno:39的序列。此序列是人工非编码序列,其中可以插入dna序列,例如包括转基因(或转基因盒)、限制性位点或其组合。此序列是有利的,因为其充当缓冲液,由于允许转基因的确切位置具有一定的灵活性,同时最小化对病毒稳定性和活力的破坏性影响。一个或多个插入物可以在seqidno:39中从5'末端、3'末端或在bp1到bp201之间的任何点处发生,例如在碱基对1/2、2/3、3/4、4/5、5/6、6/7、7/8、8/9、9/10、10/11、11/12、12/13、13/14、14/15、15/16、16/17、17/18、18/19、19/20、20/21、21/22、22/23、23/24、24/25、25/26、26/27、27/28、28/29、29/30、30/31、31/32、32/33、33/34、34/35、35/36、36/37、37/38、38/39、39/40、40/41、41/42、42/43、43/44、44/45、45/46、46/47、47/48、48/49、49/50、50/51、51/52、52/53、53/54、54/55、55/56、56/57、57/58、58/59、59/60、60/61、61/62、62/63、63/64、64/65、65/66、66/67、67/68、68/69、69/70、70/71、71/72、72/73、73/74、74/75、75/76、76/77、77/78、78/79、79/80、80/81、81/82、82/83、83/84、84/85、85/86、86/87、87/88、88/89、89/90、90/91、91/92、92/93、93/94、94/95、95/96、96/97、97/98、98/99、99/100、100/101、101/102、102/103、103/104、104/105、105/106、106/107、107/108、108/109、109/110、110/111、111/112、112/113、113/114、114/115、115/116、116/117、117/118、118/119、119/120、120/121、121/122、122/123、123/124、124/125、125/126、126/127、127/128、128/129、129/130、130/131、131/132、132/133、133/134、134/135、135/136、136/137、137/138、138/139、139/140、140/141、141/142、142/143、143/144、144/145、145/146、146/147、147/148、148/149、150/151、151/152、152/153、153/154、154/155、155/156、156/157、157/158、158/159、159/160、160/161、161/162、162/163、163/164、164/165、165/166、166/167、167/168、168/169、169/170、170/171、171/172、172/173、173/174、174/175、175/176、176/177、177/178、178/179、179/180、180/181、181/182、182/183、183/184、184/185、185/186、186/187、187/188、189/190、190/191、191/192、192/193、193/194、194/195、195/196、196/197、197/198、198/199、199/200或200/201之间。在一个实施例中,bx包括seqidno:39,其中dna序列插入bp27与bp28之间或对应于seqidno:38的28192bp与28193bp位置之间的位置。在一个实施例中,插入物是限制性位点插入物。在一个实施例中,限制性位点插入物包括一个或两个限制性位点。在一个实施例中,限制性位点是包括2个限制性位点的19bp限制性位点插入物。在一个实施例中,限制性位点插入物是包括1个限制性位点的9bp限制性位点插入物。在一个实施例中,限制性位点插入物包括一个或两个限制性位点和至少一个转基因,例如一个或两个转基因。在一个实施例中,限制性位点是19bp限制性位点插入物,其包括2个限制性位点和至少一个转基因,例如一个或两个转基因。在一个实施例中,限制性位点插入物是9bp限制性位点插入物,其包括1个限制性位点和至少一个转基因,例如一个、两个或三个转基因,如一个或两个。在一个实施例中,两个限制性位点夹在一个或多个,如两个转基因中(例如在转基因盒中)。在一个实施例中,当bx包括两个限制性位点时,所述限制性位点彼此不同。在一个实施例中,bx中的所述一个或多个限制性位点在其已经插入的特定腺病毒基因组中是非天然发生的。在一个实施例中,bx中的所述一个或多个限制性位点不同于位于腺病毒基因组中其它位置的其它限制性位点,例如不同于引入基因组其它部分的天然发生的限制性位点和/或限制性位点,如引入by的限制性位点。因此,在一个实施例中,一个或多个限制性位点允许区段中的dna被特异性切割。有利地,使用“独特的”限制性位点可简单地通过使用适当的限制酶来提供对病毒基因组切割位置的选择性和控制。具体地,如本文所采用的,切割是指使用对限制性位点特异的酶仅在期望的位置(通常是一个位置)切割病毒,尽管偶尔其可以是一对位置。如本文所采用的一对位置是指彼此接近的两个限制位点,其被设计为由相同的酶切割(即,不能彼此区分)。在一个实施例中,限制性位点插入物是seqidno:50。在一个实施例中,bx具有seqidno:38的28166bp到28366bp的序列。在一个实施例中,bx是键。在一个实施例中,bx包括限制性位点,例如1个、2个、3个或4个限制性位点,如1个或2个。在一个实施例中,bx包括至少一个转基因,例如1个或2个转基因。在一个实施例中,bx包括至少一个转基因,例如1个或2个转基因和一个或多个限制性位点,例如2个或3个限制性位点,具体的说其中限制性位点夹杂基因或包括基因的dna序列以允许它/它们被特异性地从基因组中切除和/或被代替。可替代地,限制性位点可以将每个基因夹在中间,例如当存在两个转基因时,需要三个不同的限制性位点以确保可以选择性地切除和/或代替的基因。在一个实施例中,一个或多个,例如所有转基因都是转基因盒的形式。在一个实施例中,bx包括seqidno:39。在一个实施例中,seqidno:39被例如转基因中断。在实施例中,seqidno:39是不间断的。在一个实施例中,bx不包括限制性位点。在一个实施例中,bx是键。在一个实施例中,bx包括一个或多个转基因或由其组成。在一个实施例中,by包括限制性位点,例如1个、2个、3个或4个限制性位点,如1个或2个。在一个实施例中,by包括至少一个转基因,例如1个或2个转基因。在一个实施例中,by包括至少一个转基因,例如1个或2个转基因和一个或多个限制性位点,例如2个或3个限制性位点,具体的说其中限制性位点夹杂基因或包括基因的dna序列以允许它/它们被特异性地从基因组中切除和/或被代替。可替代地,限制性位点可以将每个基因夹在中间,例如当存在两个转基因时,需要三个不同的限制性位点以确保可以选择性地切除和/或代替的基因。在一个实施例中,一个或多个,例如所有转基因都是转基因盒的形式。在一个实施例中,by包括seqidno:40。在一个实施例中,seqidno:40被例如转基因中断。在实施例中,seqidno:40是不间断的。在一个实施例中,by不包括限制性位点。在一个实施例中,by是键。在一个实施例中,by包括一个或多个转基因或由其组成。在一个实施例中,bx和by各自包括限制性位点,例如1个、2个、3个或4个限制性位点,如1个或2个。在一个实施例中,bx和by各自包括至少一个转基因,例如1个或2个转基因。在一个实施例中,bx和by各自包括至少一个转基因,例如1个或2个转基因和一个或多个限制性位点,例如2个或3个限制性位点,具体的说其中限制性位点夹杂基因或包括基因的dna序列以允许其被特异性地从基因组中切除和/或被代替。可替代地,限制性位点可以将每个基因夹在中间,例如当存在两个转基因时,需要三个不同的限制性位点以确保可以选择性地切除和/或代替的基因。在一个实施例中,一个或多个,例如所有转基因都是转基因盒的形式。在一个实施例中,bx和by分别包括seqidno:39和seqidno:40。在一个实施例中,bx和by不包括限制性位点。在一个实施例中,bx是键并且by不是键。在一个实施例中,by是键并且bx不是键。如本文所采用的,bb是指编码l5区的dna序列。如本文所采用的,l5区是指含有编码纤维多肽/蛋白质的基因的dna序列,在上下文中视情况而定。纤维基因/区编码纤维蛋白,所述纤维蛋白是腺病毒的主要衣壳组分。纤维在受体识别中起作用,并且有助于腺病毒选择性结合和感染细胞的能力。在本公开的病毒中,纤维可以来自任何血清型11的腺病毒株,如ad11p。在一个实施例中,bb具有seqidno:38的28367bp到29344bp的序列。与如本文所采用的by相关的dna序列是指bb的l5基因的3'末端附近的dna序列。在如本文所采用的l5基因的3'末端附近或近端是指:邻近(邻接)l5基因的3'末端或与其固有相关的非编码区,即与l5基因的3'主要末端紧靠或邻接或与其固有相关的非编码区(即l5内源的非编码序列的全部或部分)。可替代地,在附近或近端可以指闭合l5基因,使得在by区与l5基因的3'末端之间不存在编码序列。因此,在一个实施例中,by直接连接到l5的碱基,其代表编码序列的“末端”。因此,在一个实施例中,by直接连接到l5的碱基,其代表非编码序列的“末端”,或直接连接到与l5天然相关的非编码区。本文中可固有地和自然地互换使用。在一个实施例中,by包括seqidno:40的序列。此序列是非编码序列,其中可以插入dna序列,例如包括转基因(或转基因盒)、限制性位点或其组合。此序列是有利的,因为其起缓冲液的作用,由于允许转基因的确切位置具有一定的灵活性,同时最小化对病毒稳定性和活力的破坏性影响。一个或多个插入物可以在seqidno:40中从5'末端、3'末端或在bp1到bp35之间的任何点发生,例如在碱基对1/2、2/3、3/4、4/5、5/6、6/7、7/8、8/9、9/10、10/11、11/12、12/13、13/14、14/15、15/16、16/17、17/18、18/19、19/20、20/21、21/22、22/23、23/24、24/25、25/26、26/27、27/28、28/29、29/30、30/31、31/32、32/33、33/34或34/35之间。在一个实施例中,by包括seqidno:40,其中dna序列插入位置bp12与bp13之间,或者对应于seqidno:38中29356bp和29357bp的位置。在一个实施例中,插入物是限制性位点插入物。在一个实施例中,限制性位点插入物包括一个或两个限制性位点。在一个实施例中,限制性位点是包括2个限制性位点的19bp限制性位点插入物。在一个实施例中,限制性位点插入物是包括1个限制性位点的9bp限制性位点插入物。在一个实施例中,限制性位点插入物包括一个或两个限制性位点和至少一个转基因,例如一个或两个或三个转基因,如一个或两个转基因。在一个实施例中,限制性位点是19bp限制性位点插入物,其包括2个限制性位点和至少一个转基因,例如一个或两个转基因。在一个实施例中,限制性位点插入物是9bp限制性位点插入物,其包括1个限制性位点和至少一个转基因,例如一个或两个转基因。在一个实施例中,两个限制性位点夹在一个或多个,如两个转基因中(例如在转基因盒中)。在一个实施例中,当by包括两个限制性位点时,所述限制性位点彼此不同。在一个实施例中,by中的所述一个或多个限制性位点在其已经插入的特定腺病毒基因组中是非天然发生(如罕有的)的。在一个实施例中,by中的所述一个或多个限制性位点不同于位于腺病毒基因组中其它位置的其它限制性位点,例如不同于引入基因组其它部分的天然发生的限制性位点或限制性位点,如bx。因此,在一个实施例中,一个或多个限制性位点允许区段中的dna被特异性切割。在一个实施例中,限制性位点插入物是seqidno:51。在一个实施例中,by具有seqidno:38的29345bp到29379bp的序列。在一个实施例中,by是键。在一个实施例中,插入物在seqidno:40中的bp12之后。在一个实施例中,插入物位于seqidno:38的约29356bp的位置。在一个实施例中,插入物是包括一个或多个转基因的转基因盒,例如1个、2个或3个,如1个或2个。如本文所采用的,e4是指编码部分或全部腺病毒e4区(即多肽/蛋白质区)的dna序列,其可以被突变,使得由e4基因编码的蛋白质具有保守或非保守的氨基酸变化,和具有与野生型相同的功能(对应的非突变蛋白);与野生型蛋白质相比功能增加;功能降低,如与野生型蛋白质相比无功能或者与野生型蛋白质或其组合相比具有新功能,视情况而定。在一个实施例中,e4区缺失e4或f4。在一个实施例中,e4区被部分缺失,例如95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%或5%缺失。在一个实施例中,e4区具有seqidno:38的32188bp到29380bp的序列。在一个实施例中,b3是键,即其中不存在e4。在一个实施例中,b3具有由seqidno:38的32188bp到29380bp组成的序列。如本文所采用的,数字范围包括端点。技术人员将理解,本文式中的元素,如式(i)、(ia),(ib)、(ic)、(id)和(ie)是连续的,并且可以包含非编码dna序列以及本文提及的基因和编码dna序列(结构特征)。在一个或多个实施例中,本公开的式试图描述腺病毒基因组中的天然发生的序列。在此上下文中,技术人员将清楚所述配方是指表征基因组相关区段的主要元件,并且并不旨在是dna的基因组延伸的详尽描述。如本文所采用的,e1a、e1b、e3和e4各自独立地指野生型及其等同物,如本文所描述的每个区的突变或部分缺失形式,具体的说来自已知腺病毒的野生型序列。如本文所采用的,“插入”是指在5'末端、3'末端或在给定dna序列参考片段内掺入的dna序列,使得其中断参考序列。后者是用作相对于插入物所在的参考点的参考序列。在本公开的上下文中,插入物通常出现在seqidno:10或seqidno:11中。插入物可以是限制性位点插入物、转基因盒或两者。当序列被中断时,病毒仍将包括原始序列,但通常其将两个片段夹在插入物中。在一个实施例中,转基因或转基因盒不包括非偏向插入转座子,如tn7转座子或其部分。如本文所采用的,tn7转座子是指如wo2008/080003中所描述的非偏向插入转座子。在一个实施例中,bx和by中的一个或多个限制性位点独立地选自对本文所描述的酶具有特异性的限制性位点,例如noti、fsei、asisi、sgfi和sbfi,具体的说插入的限制性位点都是不同的,如noti特异性位点和位于bx中的fsei特异性位点和位于by中的sgfi和sbfi。如上文在一个实施例中所讨论的,区bx和/或by不包括限制性位点。有利地,可以在不具有限制性位点的情况下制备本公开的病毒和构建体,例如使用合成技术。这些技术在创建病毒和构建体时具有很大的灵活性。此外,诸位发明人已经确定,当通过合成技术制备病毒和构建体时,其性质不会降低。启动子如本文所采用的,启动子是指启动一个或多个特定基因的转录的dna区。启动子通常位于其在相同链上和dna上游(即5')转录的基因的近端。如在此上下文中所采用的近端意指足够接近作为启动子的功能。在一个实施例中,启动子在转录起始位点的100bp内。因此,如本文所采用的,内源启动子是指在插入转基因的腺病毒(或构建体)中天然发生(即天然存在的)的启动子。在一个或多个实施例中,所采用的内源启动子是病毒基因组中其原始位置的病毒中天然发生的启动子,具体的说这是一个或多个转基因表达中采用的主要或唯一的启动子。在一个实施例中,用于促进转译和任选地转基因转录的内源启动子是一种常驻启动子,即整合在腺病毒基因组中并且之前未通过重组技术引入的内源启动子。如本文所采用的受内源启动子的控制是指转基因/转基因盒以适当的朝向插入以受所述内源启动子的控制。也就是说,当启动子通常在反义链上时将盒插入,例如以反义朝向插入。话虽如此,基因可以用两种朝向之一表达。然而,对于给定的(特定)转基因,通常一个朝向提供比另一个朝向更高的表达水平。在一个实施例中,盒处于有义朝向。也就是说,以5'到3'的方向转录。在一个实施例中,盒处于反义朝向。也就是说,以3'到5'朝向转录。例如,可以通过采用编码转基因和剪接受体序列的基因来利用病毒中的内源启动子。因此,在一个实施例中,当受内源启动子的控制时,盒将包括剪接受体序列。因此,在一个实施例中,编码序列,例如编码抗体或抗体结合片段的序列进一步包括剪接受体序列。在一个实施例中,一个或多个转基因、或转基因盒受e4启动子或主要晚期启动子,如主要晚期启动子(ml启动子)的控制。如本文所采用的受控制意指当特定启动子指示时,转基因被活化,即转录。如本文所采用的,主要晚期启动子(ml启动子或mlp)是指控制如l5基因等“晚期表达”基因表达的腺病毒启动子。mlp是“有义链”启动子。也就是说,启动子影响5'到3'朝向上启动子下游的基因。如本文所采用的,主要晚期启动子是指位于病毒基因组中的原始主要晚期启动子。如本文所采用的,e4启动子是指e4区的腺病毒启动子。e4区是反义区;因此启动子是反义启动子。也就是说,启动子在3'到5'方向上位于e4区的上游。因此,受e4启动子控制的任何转基因盒可能需要适当地定向。在一个实施例中,受e4启动子控制的盒处于反义朝向。在一个实施例中,盒在有义朝向上受e4启动子的控制。如本文所采用的,e4启动子是指位于病毒基因组中的原始e4启动子。因此,在一个实施例中,提供了复制型溶瘤性腺病毒血清型11(如ad11p)或其病毒衍生物,其中纤维、六邻体和衣壳是血清型11(如ad11p),其中病毒基因组包括编码治疗性抗体或抗体结合片段的dna序列(如bite),其中所述dna序列受腺病毒内源性启动子控制,选自e4和主要晚期启动子(即e4启动子或主要晚期启动子),使得转基因不会干扰病毒复制,例如与l5区相关(即在所述区之前或之后),如位于病毒基因组中的l5之后,具体的说位于l5区与e4区之间。在一个实施例中,通过重组技术将内源启动子在所需位置处引入病毒基因组中,例如引入转基因盒中。然而,在本说明书的上下文中,此布置通常称为外源启动子。在一个实施例中,转基因盒包括外源启动子。如本文所采用的,外源启动子是指将转基因插入的腺病毒中并非天然发生的启动子。通常,外源启动子来自其它病毒或是哺乳动物启动子。如本文所采用的,外源启动子是指通常位于感兴趣的基因上游的dna元件,其调节基因的转录。在一个实施例中,基因表达的调节是外源启动子,例如cmv(巨细胞病毒启动子)、cba(鸡β-肌动蛋白启动子)或pgk(磷酸甘油酸激酶1个启动子),如cmv启动子。在一个实施例中,所采用的cmv外源启动子具有seqidno:52的核苷酸序列。在一个实施例中,所采用的pgk外源启动子具有seqidno:53的核苷酸序列。在一个实施例中,所采用的cba外源启动子具有seqidno:54的核苷酸序列。在一个实施例中,提供了复制型溶瘤性腺病毒血清型11(如ad11p)或其病毒衍生物,其中纤维、六邻体和衣壳是血清型11(如ad11p),其中病毒基因组包括编码治疗性抗体或抗体结合片段(如根据本公开的bite)的dna序列,其位于病毒基因组的一部分中,其在病毒复制周期的晚期表达并且使得转基因不会干扰病毒复制,其中所述dna序列受腺病毒外源的启动子的控制(例如cmv启动子)。在一个实施例中,编码抗体或片段(如根据本公开的bite)的dna序列与l5区相关,如本文其它地方所描述的,具体的说位于l5区与e4区之间。在一个实施例中,外源启动子是抗原呈递细胞启动子。如本文所采用的,抗原呈递细胞启动子是指由抗原呈递细胞选择性表达的基因的启动子,如树突细胞或巨噬细胞。这些基因包含但不限于:flt-3、flt-3配体、tlrs、cd1a、cd1c、cd11b、cd11c、cd80、cd83、cd86、cd123、cd172a、cd205、cd207、cd209、cd273、cd281、cd283、cd286、cd289、cd287、cxcr4、gitr配体、ifn-α2、il-12、il-23、ilt1、ilt2、ilt3、ilt4、ilt5、ilt7、tslp受体、cd141、cd303、cadm1、clec9a、xcr1或cd304;如ctiia或gilt等抗原加工和呈递介质。因此,在一个实施例中,外源启动子适合于在所述抗原呈递细胞中选择性表达转基因。其它调节序列如本文所采用的,“基因表达调节因子”(或调节/调节元件)是指遗传特征,如通常通过启动或增强转录或转译而在基因表达中起作用的启动子、增强子或剪接受体序列。如本文所采用的,“剪接受体序列”、“剪接受体”或“剪接位点”是指确定何时mrna分子将被剪接体复合物的小核核糖核蛋白识别的调节序列。一旦组装后,剪接体催化mrna分子的剪接受体位点与上游剪接供体位点之间的剪接,从而产生可以被转译成产生单个多肽或蛋白质的成熟mrna分子。在本发明中可以采用不同大小的剪接受体序列,并且这些可以描述为短剪接受体(小)、剪接受体(中等)和分支剪接受体(大)。如本文所采用的,ssa意指短剪接受体,通常仅包括剪接位点,例如4个碱基对。如本文所采用的,sa意指剪接受体,通常包括短剪接受体和多聚嘧啶束,例如16bp。如本文所采用的,bsa意指支链剪接受体,通常包括短剪接受体,多聚嘧啶束和分支点,例如26个碱基对。在一个实施例中,在本公开的构建体中采用的剪接受体显示在seqidno:55到seqidno:57中。在一个实施例中,ssa具有seqidno:55的核苷酸序列。在一个实施例中,sa具有seqidno:56的核苷酸序列。在一个实施例中,bsa具有seqidno:57的核苷酸序列。在一个实施例中,剪接受体序列独立地选自包括以下的组:tgctaatcttcctttctctcttcagg(seqidno:57)、cctttctctcttcagg(seqidno:56)和cagg(seqidno:55)。在一个实施例中,剪接位点立即由包括ccacc的共有kozak序列进行(即,在5'到3'方向上进行)。在一个实施例中,剪接位点和kozak序列散布多达100个或更少的碱基对。在一个实施例中,kozak序列具有seqidno:58的核苷酸序列。通常,当受内源或外源启动子(如内源启动子)的控制时,编码序列将立即由kozak序列进行。编码区的起始是由起始密码子(aug)指示的,例如在序列(gcc)gccrccaugg[seqidno:59]的上下文中,编码序列的“开始”的开始由粗体的碱基指示。小写字母表示此位置的共同碱基(不过其可以变化)并且大写字母指示高度保守的碱基,即“augg”序列是恒定的或很少(如果有的话)变化;“r”指示通常在此位置观察到嘌呤(腺嘌呤或鸟嘌呤),并且括号内的序列(gcc)具有不确定的意义。因此,在一个实施例中,将起始密码子aug掺入kozak序列中。如本文所采用的,内部核糖体进入dna序列是指编码内部核糖体进入序列(ires)的dna序列。如本文所采用的,ires意指允许启动信使rna(mrna)序列转译的核苷酸序列,包含在mrna序列内起始的开始。当盒编码多顺反子mrna时,这是特别有用的。使用ires产生多顺反子mrna,其被转译成多个单独的蛋白质或肽。在一个实施例中,内部核糖体进入dna序列具有seqidno:60的核苷酸序列。在一个实施例中,特定的ires仅在基因组中使用一次。这可能对基因组的稳定性有益。如本文所采用的,“高自切割效率2a肽”或“2a肽”是指在转译后有效切割的肽。合适的2a肽包含p2a、f2a、e2a和t2a。诸位发明人已经注意到,一旦使用编码给定2a肽的特异性dna序列一次,就可能不能再次使用相同的特异性dna序列。然而,dna代码中的冗余可以用于生成转译成相同2a肽的dna序列。当盒编码多顺反子mrna时,使用2a肽特别有用。使用2a肽导致转译的单个多肽链在转译后被修饰以生成多个单独的蛋白质或肽。在一个实施例中,所采用的经编码p2a肽具有seqidno:61的氨基酸序列。在一个实施例中,所采用的经编码f2a肽具有seqidno:62的氨基酸序列。在一个实施例中,所采用的经编码e2a肽具有seqidno:63的氨基酸序列。在一个实施例中,所采用的经编码t2a肽具有seqidno:64的氨基酸序列。在一个实施例中,由一个或多个转基因编码的mrna或每种mrna包括多腺苷酸化信号序列,如通常在mrna序列的末端处,例如如seqidno:65所示。因此,转基因或转基因盒的一个实施例包括至少一个编码多腺苷酸化信号序列的序列。如本文所采用的,“polya”、“多聚腺苷酸化信号”或“多聚腺苷酸化序列”意指通常含有aataaa位点的dna序列,其一旦转录就可以被多蛋白复合物识别,所述多蛋白复合物裂解并且多聚腺苷酸化新生的mrna分子。在一个实施例中,多腺苷酸化序列具有seqidno:65的核苷酸序列。在一个实施例中,构建体不包含多腺苷酸化序列。在一个实施例中,基因表达的调节子是剪接受体序列。在一个实施例中,编码蛋白质/多肽/肽的序列,如抗体或抗体片段(如根据本公开的bite)进一步包括多腺苷酸化信号。由转基因编码的分子如本文所描述的,病毒中的至少一个转基因编码bite,其中一种结合结构域对t细胞表面抗原具有特异性。第二结合结构域可以靶向合适的抗原,例如病原体抗原、癌抗原、基质抗原。癌抗原(也称为肿瘤抗原)是特别感兴趣的一类,并且包含例如选自cea、muc-1、epcam、her受体her1、her2、her3、her4、pem、a33、g250、碳水化合物抗原ley、lex、leb、psma、tag-72、steap1、cd166、cd24、cd44、e-cadherin、sparc、erbb2、erbb3、wt1、muc1、lmp2、独特型、hpve6和e7、egfrviii、her-2/neu、magea3、p53非突变、p53突变体、ny-eso-1、gd2、psma、pcsa、psa、melana/mart1、ras突变体、蛋白酶3(pr1)、bcr-abl、酪氨酸酶、存活蛋白、psa、htert,具体的说wt1、muc1、her-2/neu、ny-eso-1、存活蛋白和htert。基质抗原包含成纤维细胞抗原,例如本文所描述的那些,如fap、肿瘤相关巨噬细胞抗原和髓源性抑制细胞抗原,例如包含cd163、cd206、cd68、cd11c、cd11b、cd14、csf1受体、cd15、cd33和cd66b。如果合适,下文的靶列表可以根据本公开在bite中编码,或者可替代地可以作为另外的治疗性转基因或两者提供。在一个实施例中,一个或多个转基因独立地编码蛋白质、肽、rna分子,如rna分子。有利地,转基因可以在细胞内递送,并且随后可以转录并且如果合适的话可以转译。由转基因编码的遗传物质的实例包含例如抗体或其结合片段、趋化因子、细胞因子、免疫调节因子、酶(例如能够转化活性剂中的前药)和rnai分子。如本文所采用的,肽是指2个到50个残基的氨基酸序列,例如5个到20个残基。如本文所采用的,多肽是指不含三级结构的多于50个残基的氨基酸序列,具体的说不具有二级结构和三级结构。蛋白质是指超过50个残基的氨基酸序列,具有二级和/或三级结构,具体的说具有二级结构和三级结构。在一个实施例中,编码序列编码治疗性rna、治疗性肽、治疗性多肽或治疗性蛋白质(即,治疗性基因)。如本文所采用的,免疫调节基因或转基因意指编码肽或蛋白质分子的基因,其可以定性或定量地修饰免疫系统细胞的一个或多个活性。如本文所采用的,治疗性基因意指编码可以用于治疗、改善或预防疾病的实体的基因,例如所述基因表达治疗性蛋白质、多肽、肽或rna,其至少减缓、停止或逆转如癌症等疾病的进展。在一个实施例中,当在如癌细胞等细胞中转录或转译时由转基因编码的实体增加由细胞产生的危险信号。如本文所采用的,“危险信号”是指由经历损伤、应激或非凋亡性死亡的细胞产生的各种分子,其作为警报信号,例如通过刺激先天免疫系统的细胞直接响应以及用于增强活化适应性免疫系统的细胞。众所周知,肿瘤的微环境经常发生变化,使得天然的人体免疫应答受到下调。因此,从肿瘤内部重新启动免疫应答的能力在癌症治疗中可能是非常有趣的。在一个实施例中,经编码治疗性肽或蛋白质被设计为分泌到细胞外环境中。在一个实施例中,功能性rna、肽、多肽或蛋白质(如抗体)被释放到细胞的外部微环境中,例如释放到培养上清液中,或体内:组织、基质、循环、血液和/或淋巴系统。在一个实施例中,由转基因编码的肽、多肽或蛋白质(包含根据本公开的bite)包括信号序列。如本文所采用的,信号肽是指位于蛋白质n-末端的短的13个到36个残基肽序列,其有助于蛋白质进入分泌途径以进行分泌或膜表达。在一个实施例中,前导序列(信号肽)具有seqidno:66或seqidno:67的氨基酸序列。在另一个实施例中,如抗体等经编码治疗性肽或蛋白质被设计为在细胞的表面膜中表达为膜锚定形式,例如通过包含在蛋白质中编码跨膜结构域或用于附着脂质膜锚的位点。通常,本公开的一个或多个bite不表达为细胞表面锚定形式。在一个实施例中,如抗体等功能性rna、肽、多肽或蛋白质从腺病毒感染的细胞中释放,例如通过活性分泌或作为细胞溶解的结果。因此,在一个实施例中,腺病毒溶解细胞,由此释放如抗体等功能性rna、肽、多肽或蛋白质。在另一个实施例中,经编码的另外的如抗体等治疗性肽或蛋白质被设计为保留在完整细胞内。有利地,如由本公开的腺病毒表达的抗体等功能性rna、肽、多肽或蛋白质可以作为mrna和抗体蛋白在体内的组织中检测。此外,如抗体等表达的功能性rna、肽或蛋白质可以在elisa中结合其配体。又另外地,如抗体等功能性rna、肽、多肽或蛋白质可以早期检测到(例如在感染后3天内)并且表达持续数周。在一个实施例中,本公开的腺病毒如在感染的约3天或更长时间内表达如抗体等功能性rna、肽、多肽或蛋白质,如在约36小时、48小时、60小时或72小时内或如2天、3天、4天、5天或6天。在一个实施例中,本公开的腺病毒表达如抗体等功能性rna、肽、多肽或蛋白质数周,如约1周、2周、3周、4周、5周或6周。如7天、8天、9天、10天、11天、12天、13天、14天、15天、16天、17天、18天、19天、20天、21天、22天、23天、24天、25天、26天、27天、28天、29天、30天、31天、32天、33天、34天、35天、36天、37天、38天、39天、40天、41或42天。有利地,如抗体表达等功能性rna、肽或蛋白质表达足以能够检测如血液中的抗体等功能性rna、肽、多肽或蛋白质。在一个实施例中,如由本公开的腺病毒表达的抗体等功能性rna、肽或蛋白质进入血流和/或淋巴系统。在一个实施例中,本公开的腺病毒是溶瘤病毒,所述溶瘤病毒具有增强的癌细胞治疗指数。在一个实施例中,编码序列进一步编码功能性rna,例如治疗性rna。如本文所采用的,功能性rna是指具有除编码蛋白质或肽之外的功能的rna,并且包含例如包含适于抑制或降低基因活性的rna构建体,包含如shrna和mirna等rnai。如本文所采用的,shrna是指短发夹rna,所述短发夹rna是产生紧密发夹转向的rna序列,其可以用于通过rna干扰(rnai)沉默靶基因表达。如本文所采用的,mirna(微rna)是指小非编码rna分子(含有约22个核苷酸),其通过碱基配对与mrna分子内的互补序列起作用,以调节转录或转录后水平的基因表达。由mirna结合的mrna链被沉默因为它们不再能被核糖体转译成蛋白质,并且这种复合物通常被细胞主动分解。在一个实施例中,转基因编码蛋白质。如本文所采用的,蛋白质包含蛋白质配体、蛋白质受体或抗体分子。如本文所采用的,蛋白质配体是指与细胞受体结合或以其它方式与细胞受体结合以影响细胞功能的细胞表面膜或分泌蛋白质的结合片段,例如通过刺激细胞内信号传导和调整细胞内的基因转录。在一个实施例中,表达的蛋白质被工程化以在细胞表面上表达和/或从细胞分泌。在一个实施例中,经编码蛋白质是如bite等双特异性抗体。在一个实施例中,转基因进一步编码酶,例如有助于降解肿瘤的细胞外基质的酶,例如dnase、胶原酶、基质金属蛋白酶(如mmp2或14)或类似物。合适的抗体和抗体片段可以是激动的或拮抗的,并且包含具有抗癌活性的抗体和抗体片段以及修饰宿主细胞对癌症应答的抗体和抗体片段,例如:激动剂或拮抗性抗体或抗体片段可以减少血管形成或使肿瘤的血管形成正常化。在一个实施例中,激动性抗体或其它经编码蛋白质可以使宿主细胞对宿主的先天性和适应性免疫应答更加可见,例如通过表达抗原、危险信号、细胞因子或趋化因子来吸引和活化宿主细胞,或通过结合共刺激或检查点途径分子来增强适应性免疫应答。如本文所采用的,治疗性抗体或抗体结合片段是指在被插入溶瘤病毒时对患者的病理学,例如对待治疗的癌症具有有益的影响的抗体或抗体结合片段。如本文所采用的,有益的影响是指体内表达的抗体的理想和/或有利效果。治疗性抗体和抗体结合片段的类别包含:抗egf抗体、抗vegf抗体、抗pdgf抗体、抗ctla抗体、抗pd1抗体、抗pdl1抗体和抗fgf抗体。适合掺入本公开病毒的注册治疗性抗体包含:阿昔单抗、阿达木单抗、阿仑单抗、巴利昔单抗、贝利木单抗、贝伐单抗、本妥昔单抗、康纳单抗、西妥昔单抗、塞妥珠单抗、达利珠单抗、地诺单抗、依库珠单抗、依法利珠单抗(efalixumab)、吉妥珠单抗、戈利木单抗、替伊莫单抗、英利昔单抗、伊匹单抗、莫罗单抗-cd3、奥法木单抗、帕利珠单抗、帕尼单抗、兰尼单抗、利妥昔单抗、托珠单抗、托西莫单抗和曲妥珠单抗。在一个实施例中,所采用的抗体或抗体片段的抗体可变区序列与贝伐单抗(也称为)的可变区95%到100%相似或相同,如96%、97%、98%或99%相似或相同。适合掺入本公开的病毒的还有那些被批准用于癌症适应症的抗体及其结合片段的编码序列,例如曲妥珠单抗、托西莫单抗、利妥昔单抗、帕尼单抗、奥法木单抗、伊匹单抗、替伊莫单抗、吉妥珠单抗、地诺单抗、西妥昔单抗、本妥昔单抗、贝伐单抗、阿达木单抗。在一个实施例中,所采用的抗体或抗体片段的抗体可变区序列与已知抗体或本文公开的抗体的可变区95%到100%相似或相同。如本文所使用的,“抗体分子”包含抗体及其结合片段。如本文所采用的,抗体通常是指全长抗体和包括全长抗体的双特异性或多特异性形式。抗体结合片段包含能够靶向抗原的抗体片段,其具有与其衍生的原始“抗体”相同、相似或更好的特异性。抗体片段包含:fab、修饰fab、fab'、修饰fab'、f(ab')2、fv、单结构域抗体(例如vh或vl或vhh)、scfv、二价抗体、三价抗体或四价抗体、双scfv、双抗体、三抗体、四抗体和上述任一种的表位结合片段(参见例如holliger和hudson,2005,《自然生物技术》,23(9):1126-1136;adair和lawson,2005,《药物设计综述-在线》2(3),209-217)。用于产生和制备这些抗体片段的方法在所属领域中众所周知(参见例如verma等人,1998,《免疫法期刊(journalofimmunologicalmethods)》,216,165-181)。用于本发明的其它抗体片段包含国际专利申请wo2005/003169、wo2005/003170和wo2005/003171中所描述的fab和fab'片段。多价抗体可以包括多种特异性,例如双特异性或者可以是单特异性的(参见例如wo92/22853、wo05/113605、wo2009/040562和wo2010/035012)。如本文所采用的,特异性是指仅识别其特异性抗原的抗体或片段,或者对抗原具有显著更高的结合亲和力的抗体或片段,与对其不具有特异性的抗原的结合亲和力相比是具有特异性的,例如结合亲和力高5倍、6倍、7倍、8倍、9倍、10倍。可以采用已知的抗体或抗体结合片段来生成具有相同cdr或相同可变区的可替代的抗体形式,例如可以容易地将全长抗体转化为fab、fab'或scfv片段。可以在本公开的构建体中采用多种不同形式的抗体,包含来自非人类动物的抗体分子、人类抗体分子、人源化抗体分子和嵌合抗体分子。在一个实施例中,抗体或结合片段是单克隆的。单克隆抗体可通过本领域已知的任何方法制备,如杂交瘤技术(kohler&milstein,1975,《自然(nature)》,256:495-497);三体瘤技术、人类b细胞杂交瘤技术(kozbor等人,1983,《今日免疫学(immunologytoday)》,4:72)和ebv-杂交瘤技术(cole等人,《单克隆抗体与癌症治疗(monoclonalantibodiesandcancertherapy)》,第77到96页,alanrliss,inc.,1985)。在一个实施例中,抗体或结合片段是非人类的,即完全来自非人类来源。这是可能的,因为抗体和片段可以通过病毒在癌细胞内递送。在一个实施例中,抗体是嵌合的,例如具有一个或多个人类恒定区和非人类可变区。在一个实施例中,抗体或结合片段是人类的,即来自完全人源的。在一个实施例中,抗体或结合片段是人源化的。人源化抗体(其包含cdr嫁接的抗体)是具有来自非人类物种的一个或多个互补决定区(cdr)和来自人类免疫球蛋白分子的框架区的抗体分子(参见例如us5,585,089;wo91/09967)。应当理解,可能仅需要转移cdr的特异性决定残基而不是整个cdr(参见例如,kashmiri等人,2005,《方法(methods)》,36,25-34)。人源化抗体可以任选地进一步包括一个或多个衍生自非人类物种的框架残基,例如cdr就是从这些残基中衍生的。在一个实施例中,编码序列编码抗体重链、抗体轻链或抗体片段。如本文所采用的,重链(hc)是指抗体的大多肽亚基。如本文所采用的,轻链(lc)是指抗体的小多肽亚基。在一个实施例中,抗体轻链包括cl结构域、κ或λ。可以使用本领域已知的任何合适的方法获得用于本公开的抗体。抗原多肽/蛋白质包含融合蛋白,包含表达多肽(如活化的t细胞)的细胞(重组或天然)可以用于产生特异性识别抗原的抗体。多肽可以是“成熟”多肽或其生物活性片段或衍生物。可以使用测定以测量与抗原的结合和/或测定以测量拮抗受体的能力来执行抗体的筛选。结合测定的实例是elisa,具体的说使用融合蛋白(任选地包括报道分子),其固定在平板上,并且采用缀合的第二抗体来检测与融合蛋白结合的抗原抗体。如果存在,本发明的抗体分子的恒定区结构域可以考虑所提出的抗体分子的功能,并且具体的说可能需要的效应子功能来选择。例如,恒定区结构域可以是人类iga、igd、ige、igg或igm结构域。特别地,当抗体分子用于治疗用途并且需要抗体效应子功能时,可以使用人类igg恒定区结构域,尤其是igg1和igg3同种型。可替代地,当抗体分子旨在用于治疗目的并且不需要抗体效应子功能时,可以使用igg2和igg4同种型,例如用于简单的激动活性或用于靶中和。应当理解,还可以使用这些恒定区结构域的序列变体。例如,可以使用igg4分子,其中241位的丝氨酸已经如angal等人,《分子免疫学》,1993,30(1),105-108中所描述的变为脯氨酸。对于某些抗体功能,例如用于向如免疫系统的细胞等携带抗体靶分子的细胞递送活化信号,使用膜锚定形式的抗体使得抗体将在表达细胞的表面上表达可能是有利的。这种细胞表面表达的结合分子能够在另一个细胞表面上的靶信号分子之间实现有效的多聚体相互作用,这增强了从靶分子向受体细胞的活化信号的递送。有利地,本公开的腺病毒可以表达全长抗体、如scfv等抗体片段、多特异性抗体,具体的说如本文所描述的bite等双特异性抗体。在一个实施例中,编码抗体或抗体片段的序列(如根据本公开的bite)包括或进一步包括内部核糖体进入序列。如本文所采用的,内部核糖体进入序列(ires)意指允许在信使rna(mrna)序列的中间开始转译的核苷酸序列。在一个实施例中,经编码治疗性蛋白质或肽是靶特异性蛋白质、多肽或肽。如本文所采用的,靶特异性蛋白质或肽是指靶蛋白质本身,或直接结合(例如对靶特异)或以其它方式修饰靶蛋白质或肽的水平的不同蛋白质或肽。前者的实例是细胞因子,而后者的实例是针对所述细胞因子的抗体。感兴趣的靶通常涉及与疾病相关的,具体的说癌症的特定细胞、细胞产物、抗原或信号传导途径。取决于上下文,靶还涉及从编码蛋白质或多肽的基因转录的mrna或类似物,其例如可以通过rnai型技术抑制。因此,在如rnai技术等rna的上下文中,靶是由靶基因编码的mrna。感兴趣的靶的实例包含但不限于:刺激性t细胞共受体及其配体、检查点抑制性t细胞共受体分子及其配体、由调节性t细胞表达的受体及其配体、髓源性抑制细胞和免疫抑制性免疫细胞、树突细胞和抗原呈递细胞受体及其配体、抗原加工和呈递介质、细胞因子和细胞因子受体、趋化因子和趋化因子受体、转录因子和转录调节因子、细胞内运输分子和细胞功能调节因子、肿瘤细胞和肿瘤微环境受体和产物、如ido等细胞内肿瘤细胞酶、用于由免疫细胞识别的抗原。因此,在一个实施例中,如本文所采用的,靶是指可以例如在适当时被例如抗体或其中的结合片段抑制、中和或活化的蛋白质或多肽。在细胞因子的上下文中,靶是指细胞因子本身或对细胞因子特异的抗体或其结合片段。因此,病毒可以编码和表达细胞因子本身,因为其释放可以刺激“宿主”免疫应答。在配体的上下文中,配体的突变形式可以由病毒编码,所述病毒与天然配体竞争以结合受体。突变的配体可以具有增加的对受体的结合亲和力,例如使得其具有缓慢的解离速率,由此占据受体并且增加或减少其信号传导。可替代地,与野生型配体相比,突变配体的活性可以降低,由此降低通过天然配体的受体的结合和总体活性。在一个实施例中,根据本公开的病毒或构建体编码前药、免疫调节因子和/或酶。如本文所采用的,前药意指作为无活性(或少于完全活性)衍生物施用的分子,其随后通常通过正常代谢过程转化为体内活性药理学试剂。前药作为预期药物的一种前体。前药转化酶作为将前药转化为其药理活性形式的酶。如本文所采用的,免疫调节因子意指免疫应答的调节因子。免疫调节因子在将免疫应答调节到所需水平方面起作用,如免疫增强、免疫抑制或免疫耐受的诱导。t细胞需要两个信号才能完全活化。通过t细胞受体提供抗原特异性的第一信号,其与抗原呈递细胞(apc)膜上的肽-mhc分子相互作用。第二信号即共刺激信号是抗原非特异性的,并且由apc膜上表达的共刺激分子与t细胞之间的相互作用提供。因此,如本文所采用的,共刺激分子意指为t细胞活化、增殖和存活所需的抗原特异性信号提供互补信号的分子。共刺激分子的实例包含但不限于cd28、cd80、cd86、cd83和4-1bb。如本文所采用的,酶意指在活生物体中起催化剂作用的物质调节化学反应进行的速率,而在所述过程中本身不会改变。以下是示例性靶肽/多肽和蛋白质的非详尽讨论。在一个实施例中,靶是检查点蛋白,如免疫检查点或细胞周期检查点蛋白。检查点蛋白的实例包含但不限于:ctla-4、pd-1、pd-l1、pd-l2、vista、b7-h3、b7-h4、hvem、ilt-2、ilt-3、ilt-4、tim-3、lag-3、btla、light或cd160,例如ctla-4、pd-1、pd-l1和pd-l2。在一个实施例中,提供了对其中之一具有特异性的抗体或其结合片段。因此,在一个实施例中,转基因或转基因盒编码对ctla-4、pd-1、pd-l1或pd-l2具有特异性的抗体或抗体片段。在一个实施例中,腺病毒表达对ctla-4、pd-1、pd-l1或pd-l2具有特异性的抗体或抗体片段。在一个实施例中,抗体是检查点抑制剂抗体,例如抗pd-l1。在一个实施例中,腺病毒表达全长抗人类pd-l1抗体。在一个实施例中,全长抗人类pd-l1抗体的表达受如主要晚期启动子(mlp)等内源启动子的控制,具体的说在位置by。在一个实施例中,腺病毒表达scfv形式的抗人类pd-l1抗体。在一个实施例中,scfv形式的抗人类pd-l1抗体的表达受如主要晚期启动子等内源启动子的控制,具体的说在位置by。在一个实施例中,提供了根据本公开的编码抗体或其结合片段的病毒或构建体,用于例如本文示例的对ctla-4具有特异性的全长抗体或scfv。在一个实施例中,靶是一个或多个独立地选自包括以下的组:cd16、cd25、cd33、cd332、cd127、cd31、cd43、cd44、cd162、cd301a、cd301b和半乳糖凝集素-3。在一个实施例中,提供了对其具有特异性的抗体或其结合片段,例如全长抗体或scfv。在一个实施例中,例如可以被抗体或结合片段进行靶向的靶是一个或多个独立地选自包括以下的组:flt-3、flt-3配体、tlrs、tlr配体、ccr7、cd1a、cd1c、cd11b、cd11c、cd80、cd83、cd86、cd123、cd172a、cd205、cd207、cd209、cd273、cd281、cd283、cd286、cd289、cd287、cxcr4、gitr配体、ifn-α2、il-12、il-23、ilt1、ilt2、ilt3、ilt4、ilt5、ilt7、tslp受体、cd141、cd303、cadm1、clec9a、xcr1和cd304。在一个实施例中,本公开中采用的bite的靶是肿瘤细胞抗原。在一个实施例中,靶是一个或多个独立地选自包括以下的组:cea、muc-1、epcam、her受体her1、her2、her3、her4、pem、a33、g250、碳水化合物抗原ley、lex、leb、psma、tag-72、steap1、cd166、cd24、cd44、e-钙粘蛋白、sparc、erbb2、erbb3。在一个实施例中,本公开中采用的bite的靶是肿瘤基质抗原。在一个实施例中,本公开中采用的bite的靶是一个或多个独立地选自包括以下的组:fap、trem1、igfbp7、fsp-1、血小板源性生长因子-α受体(pdgfr-α)、血小板源性生长因子-β受体(pdgfr-β)和波形蛋白。在一个实施例中,例如可以被抗体或结合片段(如bite)靶向的靶是癌症靶。在一个实施例中,靶是一个或多个独立地选自包括以下的组:ox40、ox40配体、cd27、cd28、cd30、cd40、cd40配体、tl1a、cd70、cd137、gitr、4-1bb、icos或icos配体,例如cd40和cd40配体。在一个实施例中,转基因盒编码包括cd40或cd40配体的配体,或靶向cd40或cd40配体的抗体、抗体片段或shrna。在一个实施例中,腺病毒表达包括cd40或cd40配体的配体,或靶向(特异于)cd40或cd40配体的抗体、抗体片段或shrna。在一个实施例中,靶是一个或多个独立地选自包括以下的组的细胞因子:il-1α、il-1β、il-6、il-9、il-12、il-13、il-17、il-18、il-22、il-23、il-24、il-25、il-26、il-27、il-33、il-35。白细胞介素-2(il-2)、il-4、il-5、il-7、il-10、il-15、il-21、il-25、il-1ra、ifnα、ifnβ、ifnγ、tnfα、tgfβ、淋巴毒素α(lta)和gm-csf。在一个实施例中,转基因盒编码对il-12、il-18、il-22、il-7、il-15、il-21、ifnα、ifnγ、tnfα、tgfβ或淋巴毒素α(lta)。具有特异性的抗体或抗体片段,在一个实施例中,腺病毒表达il-12、il-18、il-22、il-7、il-15、il-21、ifnα、ifnγ、tnfα、tgfβ或淋巴毒素α(lta)。在一个实施例中,ifn的氨基酸序列γ是seqidno:68。在一个实施例中,ifnα的氨基酸序列是seqidno:69。在一个实施例中,tnfα的氨基酸序列是seqidno:70。在一个实施例中,靶是例如一个或多个独立地选自包括以下的组的趋化因子:il-8、ccl3、ccl5、ccl17、ccl20、ccl22、cxcl9、cxcl10、cxcl11、cxcl13、cxcl12、ccl2、ccl19、ccl21、cxcr2、ccr2、ccr4、ccr5、ccr6、ccr7、ccr8、cxcr3、cxcr4、cxcr5和crth2。在一个实施例中,转基因盒编码对ccl5、cxcl9、cxcl12、ccl2、ccl19、ccl21、cxcr2、ccr2、ccr4或cxcr4具有特异性的抗体或抗体片段。在趋化因子的上下文中,靶包含病毒编码和表达趋化因子的位置,例如诱导或增强宿主对癌症的免疫应答。在一个实施例中,腺病毒表达对ccl5、cxcl9、cxcl12、ccl2、ccl19、ccl21、cxcr2、ccr2、ccr4或cxcr4具有特异性的抗体或抗体片段。在一个实施例中,靶是一个或多个独立地选自包括以下的组:stat3,stat1,stat4,stat6,ctiia,myd88和nfκb家族成员,例如蛋白质被抑制剂,例如抗体或其结合片段靶向或从相关基因转录的mrna被如rnai等机制抑制。在一个实施例中,靶是hsp70或如存活蛋白等细胞存活和死亡的调节因子,例如蛋白质被抑制剂,例如抗体或其结合片段靶向或从相关基因转录的mrna被如rnai等机制抑制。在一个实施例中,靶是一个或多个独立地选自包括以下的组:双调蛋白、btc、nrg1a、nrg1b、nrg3、tgfα、lrig1、lrig3、egf、egf-l6、上皮细胞有丝分裂蛋白抗体、hb-egf、egfr、her2、her3和her4,例如蛋白质被抑制剂,例如抗体或其结合片段靶向或从相关基因转录的mrna被如rnai等机制抑制。在一个实施例中,靶是用于一个或多个独立地选自包括以下的组的配体或受体:hedgehog、fgf、igf、wnt、vegf、tnf、tgfβ、pdgf和notch。在一个实施例中,腺病毒表达对vegf具有特异性的抗体或抗体片段。在一个实施例中,抗体是抗vegf抗体。例如,如具有抗体贝伐单抗的氨基酸序列的抗体或其等同物。在一个实施例中,腺病毒表达全长抗人类vegf抗体。在一个实施例中,全长抗人类vegf抗体的表达受如主要晚期启动子(mlp)等内源启动子的控制,具体的说在位置by。在一个实施例中,腺病毒表达scfv形式的抗人类vegf抗体。在一个实施例中,scfv形式的抗人类vegf抗体的表达受如主要晚期启动子等内源启动子的控制,具体的说在位置by。在一个实施例中,靶是ido。在一个实施例中,靶是用于免疫细胞识别的抗原(如由bite参与的t细胞)是一个或多个独立地选自包括以下的组的蛋白质或肽:来自感染性生物的免疫原性蛋白,如巨细胞病毒抗原、流感抗原、乙型肝炎表面和核心抗原、白喉类毒素、crm197、破伤风类毒素;衍生自这些抗原的肽是已知的t细胞或抗体表位,或基因工程复合物或这些抗原的多聚体;肿瘤来源的蛋白质作为抗原;衍生自这些抗原的肽,所述抗原是已知的t细胞或抗体表位;以及基因工程化的合成物或这些抗原的多聚体,例如wt1、muc1、lmp2、独特型、hpve6和e7、egfrviii、her-2/neu、magea3、p53非突变体、p53突变体、ny-eso-1、gd2、psma、pcsa、psa、gp100、cea、melana/mart1、ras突变体、蛋白酶3(pr1)、bcr-abl、酪氨酸酶、存活蛋白、psa、htert,具体的说wt1、muc1、her-2/neu、ny-eso-1、存活蛋白或htert。技术人员将理解,由于密码子冗余,编码给定氨基酸序列的核酸序列存在许多可能性,所述沉默核酸碱基对突变是可耐受的,并且编码如seqidno中任一所限定的给定氨基酸序列的所有核酸序列是本公开所设想的。在一个实施例中,由转基因编码的肽、多肽或蛋白质是模拟表位。如本文所采用的,模拟表位是分子,通常是肽,所述分子模拟表位的结构。后一种性质引起类似于表位引发的抗体应答。用于给定表位抗原的抗体将识别模拟所述表位的模拟表位。模拟表位通常通过生物淘选从噬菌体展示文库获得。正在开发利用模拟表位的疫苗。因此,已知特异性的抗体可以用于筛选文库(例如噬菌体展示中的肽文库-例如ab序列文库或非抗体肽文库,具体的说那些优化用于产生具有更稳定3d构象的肽的文库)-模拟表位的生成被充分描述在艺术领域(参见tribbickg、roddas.用于发现与抗体样分子结合的肽配体的组合方法。《分子识别期刊(jmolrecognit.)》200215(5):306-10;masukot、ohnoy、masukok、yagih、uejimas、takechim、hashimotoy.通过使用表达与绿色荧光蛋白融合的靶分子的转染子免疫的大鼠的强有力策略,朝向膜癌蛋白的治疗性抗体。《癌症科学(cancersci.)》2011102(1):25-35)。在一个实施例中,模拟表位或其它设计的疫苗抗原由转基因编码并且表达以在受体患者中诱导抗体应答,其中诱导的抗体具有所期望的治疗效果。在一个实施例中,具有来自所期望的人类配体的肽序列的gfp-肽融合蛋白用于诱导抗自身靶抗体应答,例如已知对于结合靶分子pd-1重要的pd-l1的肽区可以与gfp或其它高免疫原性外来载剂蛋白质基因连锁,使得对肽的免疫抗体应答包含与天然pdl1分子交叉反应的抗体,并且因此以与直接编码抗pdl1抗体相同的方式阻断pd-l1:pd-1相互作用。本领域充分描述了用于诱导抗自身治疗性抗体应答的疫苗的概念(参见spohng、bachmannmf.治疗性疫苗接种以阻断受体-配体相互作用。《关于药物疗法的专家意见(expertopinbiolther.)》20033(3):469-76;linka、bachmannmf.免疫药物:用治疗性抗细胞因子疫苗破坏b-但不破坏t细胞耐受性。《免疫疗法(immunotherapy)》20102(4):561-74;delavalléel、assiere、semeranol、bessisn、boissiermc.抗细胞因子疫苗的新兴应用。《疫苗专家评论(expertrevvaccines)》,20087(10):1507-17)。在一个或多个实施例中,所采用的转基因编码seqidno:2、4、7、11或16中任一个所示的序列。在另一个实施例中,所采用的转基因编码在c-末端处排除deca-his亲和标记的序列,例如seqidno:72到78中任一个所阐述的病毒所示。有利地,本公开的腺病毒表达并且释放抗体形式(如bite)和如细胞因子等其它蛋白质由其中的转基因编码到体外培养上清液中或到体内肿瘤组织基质中。前导序列可以帮助经编码蛋白质/多肽或肽离开癌细胞。因此,在一个实施例中,经编码“蛋白质”包括前导序列。如本文所采用的,前导序列是指位于启动子序列与编码区之间的多核苷酸序列,其可以在转录或转译水平上调节基因表达。在一个实施例中,编码序列编码肽。如本文所采用的,肽是指不是完整功能蛋白的氨基酸链。通常,保留蛋白质的一些或全部功能的片段,其是免疫系统的片段,或者可以被免疫系统识别,例如可以被t细胞识别的8个或更多个氨基酸的肽。在一个实施例中,转基因是报告基因,所述报告基因编码例如包含生物发光的成像剂、荧光成像剂(包含可活化的荧光成像剂),如荧光素酶、gfp或egfp或红色荧光蛋白。如本文所采用的,报告基因或报告序列意指产生在真核细胞中容易检测的产物的基因或dna序列,并且可以用作标记物以确定与其dna紧密连接或组合的另一种基因的活性。报告基因赋予易于鉴定和测量的表达它们的细胞或生物体的特性或者是可选择的标记。报告基因通常用作指示某种基因是否已经被细胞或生物群体吸收或表达。常见报告基因的实例包含但不限于:lacz、荧光素酶、gfp、egfp、新霉素磷酸转移酶、氯霉素乙酰转移酶、碘化钠同向转运体(nis)、硝基还原酶(例如nfsa、nfsb)细胞内金属蛋白、hsv1-tk或雌激素受体。在一个实施例中,遗传物质(具体的说转基因)不编码或表达如显像剂、荧光素酶、gfp或egfp等报告基因。通过检查一组肿瘤细胞中的溶解潜力,可以研究根据本公开的病毒对特异性肿瘤类型的偏好,例如结肠肿瘤细胞系包含ht-29、dld-1、ls174t、ls1034、sw403、hct116、sw48和colo320dm。任何可用的结肠肿瘤细胞系对于这种评估同样有用。前列腺细胞系包含du145和pc-3细胞。胰腺细胞系包含panc-1细胞。乳腺肿瘤细胞系包含mda231细胞系,并且卵巢细胞系包含ovcar-3细胞系。造血细胞系包含但不限于:raji和daudib淋巴细胞、k562成红细胞样细胞、u937骨髓细胞和hsb2t淋巴细胞。其它可用的肿瘤细胞系同样有用。本公开还延伸到本公开的新序列。在一个实施例中,病毒以本文公开的任一个序列显示,例如seqidno:34到37中的任一个或与其至少95%相同的序列,例如如seqidno:79到82中任一个所阐述。配制品本公开还涉及如本文所描述的病毒的药物配制品。在一个实施例中,提供了液体胃肠外配制品,例如对于根据本公开的输注或注射能够溶瘤的复制物,其中所述配制品提供的剂量范围为每体积剂量1×1010到1×1014个病毒颗粒。肠胃外配制品意指设计为不通过胃肠道递送的配制品。典型的肠胃外递送途径包含注射、植入或输注。在一个实施例中,配制品以推注递送的形式提供。在一个实施例中,肠胃外配制品是以注射的形式。注射包含静脉内、皮下、肿瘤内或肌内注射。如本文所采用的,注射意指通过注射器将液体注入体内。在一个实施例中,本公开的方法不涉及肿瘤内注射。在一个实施例中,肠胃外配制品是以输注形式。如本文所采用的,输注意指通过滴注、输注泵、注射器驱动器或等效装置以较慢的速率施用流体。在一个实施例中,输注在1.5分钟到120分钟的范围内施用,如约3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟、11分钟、12分钟、13分钟、14分钟、15分钟、16分钟、17分钟、18分钟、19分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、60分钟、65分钟、70分钟、65分钟、80分钟、85分钟、90分钟、95分钟、100分钟、105分钟、110分钟或115分钟。在一个实施例中,一剂量的配制品小于100ml,例如30ml,如通过注射器驱动器施用。在一个实施例中,一剂量的配制品小于10ml,例如9ml、8ml、7ml、6ml、5ml、4ml、3ml、2ml或1ml。在一个实施例中,一剂量的配制品小于1ml,如0.9ml、0.8ml、0.7ml、0.6ml、0.5ml、0.4ml、0.3ml、0.2ml或0.1ml。在一个实施例中,注射以缓慢注射施用,例如在1.5分钟到30分钟的时间内施用。在一个实施例中,所述配制品用于静脉内(i.v.)施用。此途径对溶瘤病毒的传递特别有效,因为其可以快速进入大多数器官和组织,并且是特别适用于转移瘤的治疗,例如已建立的转移灶,尤其是位于如肝脏和肺部等高度血管化区的转移灶。治疗配制品通常在制造和储存条件下是无菌和稳定的。所述组合物可以被配制成适合于施用于人类的溶液、微乳液、脂质体或其它肠胃外配制品,并且可以被配制成如注射器或小瓶等预填充装置,具体的说作为单剂量。配制品通常包括药学上可接受的稀释剂或载剂,例如与病毒相容的无毒等渗载剂,并且其中病毒在所需的一段时间内是稳定的。载剂可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)及其合适的混合物。例如,通过使用分散剂或表面活性剂,如卵磷脂或如聚山梨醇酯80或40等非离子表面活性剂,可以保持适当的流动性。在分散体中,可以通过表面活性剂的存在来辅助维持所需的粒度。等渗剂的实例包含组合物中的糖、如甘露醇等多元醇、山梨糖醇或氯化钠。在一个实施例中,所采用的肠胃外配制品可以包括例如下列缓冲液中的一个或多个:4-(2-羟乙基)-1-哌嗪乙磺酸、磷酸盐缓冲液和/或tris缓冲液、糖,例如右旋糖、甘露糖、蔗糖或类似物、如氯化钠等盐、氯化镁或氯化钾、洗涤剂,如briji、ps-80、ps-40或类似物等非离子表面活性剂。配制品还可以包括如edta或乙醇或edta和乙醇的组合等防腐剂,所述防腐剂被认为可以防止一个或多个可能的降解途径。在一个实施例中,配制品将包括根据本公开的纯化的溶瘤病毒,例如每剂量1×1010个到1×1014个病毒颗粒,如每剂量1×1010个到1×1012个病毒颗粒。在一个实施例中,配制品中病毒的浓度范围为2×108vp/ml到2×1014vp/ml,如2×1012vp/ml。在一个实施例中,肠胃外配制品包括甘油。在一个实施例中,配制品包括如本文所描述的溶瘤腺病毒、hepes(n-2-羟乙基哌嗪-n'-2-乙磺酸)、甘油和缓冲液。在一个实施例中,肠胃外配制品由本公开的病毒、例如5mmhepes、例如5%到20%(v/v)甘油、盐酸组成,例如将ph调节到7到8的范围并且水用于注射。在一个实施例中,将浓度为2×1012vp/ml的0.7ml的本公开的病毒配制在5mmhepes、20%甘油中,最终ph为7.8。在《雷明顿氏药物科学(remington'spharmaceuticalsciences)》(mackpublishingcompany(马克出版公司),新泽西州,1991)中可获得药学上可接受的载剂的详尽讨论。在一个实施例中,配制品作为包含吸入的局部施用的配制品提供。合适的可吸入制剂包含可吸入粉末、含有推进剂气体的计量气溶胶或不含推进剂气体的可吸入溶液。根据本公开的可吸入粉末通常含有如本文所描述的病毒和生理学上可接受的赋形剂。这些可吸入粉末可以包含单糖(例如葡萄糖或阿拉伯糖)、二糖(例如乳糖、蔗糖、麦芽糖)、低聚糖和多糖(例如葡聚糖)、多元醇(例如山梨糖醇、甘露醇、木糖醇)、盐(例如氯化钠、碳酸钙)或其彼此的混合物。适合使用单糖或二糖,使用乳糖或葡萄糖,具体的说但不限于其水合物形式。用于在肺中沉积的颗粒需要小于10微米的粒度,如1微米到9微米,例如0.1μm到5μm,具体的说1μm到5μm。携带病毒的粒度是最重要的,并且因此在一个实施例中,根据本公开的病毒可以被吸附或吸收到颗粒上,如给定大小的乳糖颗粒。可以用于制备可吸入气溶胶的推进剂气体在本领域中是已知的。合适的推进剂气体选自烃类,如正丙烷、正丁烷或异丁烷以及卤代烃,如甲烷、乙烷、丙烷、丁烷、环丙烷或环丁烷的氯化和/或氟化衍生物。上述推进剂气体可以单独使用或以其混合物使用。特别合适的推进剂气体是选自tg11、tg12、tg134a和tg227的卤代烷烃衍生物。在上述卤代烃中,tg134a(1,1,1,2-四氟乙烷)和tg227(1,1,1,2,3,3,3-七氟丙烷)及其混合物是特别合适的。含有推进剂气体的可吸入气溶胶还可以含有其它成分,如助溶剂、稳定剂、表面活化剂(表面活性剂)、抗氧化剂、润滑剂和调节ph的方法。所有这些成分在本领域中是已知的。根据本发明的含有推进剂气体的可吸入气溶胶可以含有最多5%重量的活性物质。根据本发明的气溶胶含有例如0.002重量%到5重量%、0.01重量%到3重量%、0.015重量%到2重量%、0.1重量%到2重量%、0.5重量%到2重量%或0.5重量%到1重量%的活性成分。可替代地,肺部的局部施用还可以通过施用液体溶液或悬浮液配制品,例如采用如喷雾器等装置,例如,连接到压缩机的喷雾器(例如,连接到由弗吉尼亚州里士满的帕里呼吸设备公司(parirespiratoryequipment,inc.)制造的parimaster(r)压缩机的parilc-jetplus(r)喷雾器)。本发明的病毒可以分散在溶剂中递送,例如以溶液或悬浮液的形式递送,例如如上文所描述的用于肠胃外配制品。其可以悬浮在合适的生理溶液中,例如盐水或其它药理学上可接受的溶剂或缓冲溶液。本领域已知的缓冲溶液可以含有0.05mg到0.15mg的乙二胺四乙酸二钠、8.0mg到9.0mg氯化钠、0.15mg到0.25mg聚山梨醇酯、0.25mg到0.30mg无水柠檬酸和0.45mg到0.55mg柠檬酸钠/1ml水,以便达到约4.0到5.0的ph。治疗性悬浮液或溶液配制品还可以含有一个或多个赋形剂。赋形剂在本领域中是众所周知的并且包含缓冲液(例如,柠檬酸盐缓冲液、磷酸盐缓冲液、乙酸盐缓冲液和碳酸氢盐缓冲液)、氨基酸、尿素、醇、抗坏血酸、磷脂、蛋白质(例如血清白蛋白)、edta、氯化钠、脂质体、甘露醇、山梨糖醇和甘油。溶液或悬浮液可以包封在脂质体或可生物降解的微球中。配制品通常采用无菌制造方法以基本上无菌的形式提供。这可以包含通过过滤用于配制品的缓冲溶剂/溶液的生产和灭菌、抗体在无菌缓冲溶剂溶液中的无菌悬浮以及通过本领域普通技术人员熟悉的方法将配制品分配到无菌容器中。根据本公开的可雾化配制品可以例如作为包装在箔包封中的单剂量单位(例如,密封的塑料容器或小瓶)提供。每个小瓶含有体积中的单位剂量,例如2ml溶剂/溶液缓冲液。治疗在另外的方面,本公开涉及如本文所描述的用于治疗的病毒或其配制品,具体的说用于治疗癌症。在一个实施例中,治疗方法用于治疗肿瘤,具体的说实体瘤。如本文所采用的,肿瘤是指由过度细胞分裂引起的异常组织块,其是不受控制的和渐进的,也称为肿瘤。肿瘤可以是良性的(非癌性的)或恶性的。肿瘤涵盖所有形式的癌症和转移。在一个实施例中,肿瘤是实体瘤。实体瘤可以定位或转移。在一个实施例中,肿瘤是上皮来源的。在一个实施例中,肿瘤是恶性肿瘤,如结肠直肠癌、肝癌、前列腺癌、胰腺癌、乳腺癌、卵巢癌、甲状腺癌、肾癌、膀胱癌、头颈癌或肺癌。在一个实施例中,肿瘤是结肠直肠恶性肿瘤。如本文所采用的,恶性肿瘤意指癌细胞。在一个实施例中,溶瘤腺病毒用于治疗或预防转移。在一个实施例中,本文的方法或配制品用于治疗耐药性癌症。在一个实施例中,病毒与进一步的癌症治疗或疗法的施用组合施用。在一个实施例中,提供了根据本公开的用来制造用于治疗癌症,例如上文所描述的癌症的药物的病毒或配制品。在另外的方面,提供了一种治疗癌症的方法,其包括将治疗有效量的根据本公开的病毒或配制品施用给有需要的患者,例如人类患者。在一个实施例中,本文的溶瘤病毒或配制品与另一种疗法组合施用。如本文所采用的,“组合”旨在涵盖在癌症治疗或疗法之前,同时和/或之后施用溶瘤病毒的位置。癌症疗法包含手术、放射疗法、靶向疗法和/或化学疗法。如本文所采用的,癌症治疗是指用治疗化合物或生物制剂治疗,例如旨在治疗癌症和/或其维持疗法的抗体。在一个实施例中,癌症治疗选自任何其它抗癌疗法,包含化学治疗剂、靶向抗癌剂、放射疗法、放射性同位素疗法或其任何组合。在一个实施例中,本公开的如溶瘤腺病毒等病毒可以用作对于如手术(新辅助疗法)等疗法的预治疗,以缩小肿瘤、治疗转移和/或预防转移或进一步转移。可以在如手术(辅助疗法)等疗法后使用溶瘤腺病毒以治疗转移和/或预防转移或进一步转移。如本文所采用的,同时地是与溶瘤腺病毒配制品同时或大致同时施用另外的癌症治疗。治疗可以包含在相同的配制品中或作为单独的配制品施用。在一个实施例中,病毒与化学治疗剂的施用组合施用。如本文所采用的,化学治疗剂是指特异性的抗肿瘤化学试剂或选择性破坏恶性细胞和组织的药物。例如,烷化剂、抗代谢物、蒽环霉素、植物生物碱、拓扑异构酶抑制剂以及其它抗肿瘤剂。化学疗法的其它实例包含多柔比星、5-氟尿嘧啶(5-fu)、紫杉醇、卡培他滨、伊立替康以及如顺铂和奥沙利铂等铂。优选的剂量可以由医师根据所治疗的癌症的性质来选择。在一个实施例中,治疗剂是更昔洛韦,其可以帮助控制免疫应答和/或肿瘤血管形成。在一个实施例中,本文方法中采用的一个或多个疗法是节拍法,即使用低剂量抗癌药物的连续或频繁治疗,通常伴随其它治疗方法。亚组b溶瘤腺病毒,具体的说ad11和由其衍生的如enad等腺病毒可以与化学治疗剂特别协同,因为所述腺病毒似乎具有很大程度上不依赖于细胞凋亡的作用机制,从而通过主要的坏死性机制杀死癌细胞。而且,化学疗法期间发生的免疫抑制可以使溶瘤病毒更有效地发挥作用。如本文所采用的,治疗剂量是指当在合适的治疗方案中采用时适合于实现预期治疗效果的如溶瘤腺病毒等病毒的量,所述合适的治疗方案例如改善疾病的症状或病症。当病毒颗粒的数量足以导致以下情况时,剂量可以被视为治疗癌症或转移的治疗剂量:肿瘤或转移性生长减慢或停止、或肿瘤或转移的大小缩小和/或延长患者的寿命。合适的治疗剂量通常是治疗效果与可耐受毒性之间的平衡,例如考虑到治疗所获得的益处,副作用和毒性是可耐受的。在一个实施例中,每周施用根据本公开的病毒或治疗构建体(包含由其构成的配制品),例如一周1剂量在第1天、第3天、第5天施用,然后每个后续一周施用一剂量。在一个实施例中,根据本公开的病毒或治疗构建体(包含由其构成的配制品)每两周或每三周施用,例如在第1周的第1天、第3天和第5天施用,并且在第2周或第3周也在第1天、第3天和第5天施用。此给药方案可以适当地重复多次。在一个实施例中,每月施用根据本公开的病毒或治疗构建体(包含由其构成的配制品)。在一个实施例中,通过重组技术制备本公开的病毒和构建体。技术人员将理解,携带腺病毒基因组可以通过其它技术手段制造,包含完全合成基因组或包括所有基因组的一部分的质粒。技术人员将理解,在合成基因组的情况下,插入区可以不包括限制性位点核苷酸,因为后者是使用克隆方法插入基因后的假象。在一个实施例中,携带腺病毒基因组完全合成制造,例如按照seqidno:34到37。本公开进一步扩展到通过插入转基因或转基因盒获得或可获得的式(i)的腺病毒或其子公式。如本文所采用的,“是”意指包括。在本说明书的上下文中,“包括”应解释为“包含”。包括某些特征/元件的本发明的实施例还旨在扩展到相关元件/特征的“由……组成”或“基本上由……组成”的可替代的实施例。在技术上适当时,可以组合本发明的实施例。如专利和申请等技术参考文献以引用的方式并入本文中。本文具体和明确地叙述的任何实施例可以单独或与一个或多个另外的实施例组合形成免责声明的基础。本申请要求gb1614607.8、gb1700663.6、gb1706219.1和gb1713765.4的优先权,其通过引用并入本文。这些文件可以用于纠正本说明书中的错误,具体的说序列表中的错误。仅通过以下实例进一步描述本发明,所述实例参考附图,在附图中:附图说明图1(a)是根据本公开的包括或缺少任选的十八组氨酸(decahistidine)亲和标签的bite抗体的示意图。igsp:信号肽;10his:十八组氨酸亲和标签;l:gs连接子;vl:可变轻结构域;vh可变重结构域。(b)psf-cmv-epcambite的质粒图谱。(c)psf-cmv-fapbite的质粒图谱。(d)psf-cmv-对照bite的质粒图谱。图2(a)斑点印迹示出了重组bite定量。(b)示出了显示fap的elisa结果的图。(c)显示epcam的elisa结果的图。图3示出了在fapbite和对照bite存在下使用流式细胞术测量的单独或与nhdf细胞共培养的t细胞的cd69(a)和cd25(b)的表达水平的图。图4(a)示出了在fapbite存在下单独或与nhdf细胞共培养的t细胞和通过细胞内细胞因子染色测量的对照bite的ifnγ表达水平的图。图(b)和图(c)示出了在epcambite存在下单独或与dld细胞共培养的t细胞的cd69和cd25的表达水平,并且使用流式细胞术测量了对照bite。图5(a)示出了在epcambite存在下与dld细胞共培养的t细胞和通过细胞内细胞因子染色测量的对照bite的ifnγ表达水平的图。图(b)和图(c)示出了在epcambite存在下与dld细胞共培养的pbmc的cd69和cd25的水平,并且使用流式细胞术测量了对照bite。图6(a)示出了显示已经与t细胞和fapbite或对照bite共培养的nhdf细胞的细胞毒性的ldh测定的结果的图。(b)示出了显示已经与t细胞和fapbite或对照bite共培养的btc100细胞的细胞毒性的ldh测定结果的图。(c)与t细胞和fapbite与对照bite共培养后的nhdf细胞的图。图7(a)示出了多个患者衍生细胞中的fap表达的散点图。(b)示出了跨多个细胞和细胞系表达epcam和fap的细胞百分比的图。图8(a)示出了随着bite浓度增加,fapbite的nhdf剂量应答的图。图(b)和图(c)示出了显示已经与t细胞和epcambite或对照bite共培养的dld细胞的细胞毒性的ldh测定的结果。图9(a)示出了显示已经与t细胞和epcambite或对照bite共培养的skov细胞的细胞毒性的ldh测定的结果的图。(b)示出了显示已经与t细胞和epcambite或对照bite共培养的mcf7细胞的细胞毒性的ldh测定结果的图。图10示出了显示随着bite浓度增加,epcambite的nhdf剂量应答的图。图11(a)示出了通过fap或同位素对照抗体确定并且通过流式细胞术分析的cho细胞中的fap表达的图。(b)示出了显示已经与t细胞和fapbite或对照bite共培养的cho或cho-fap细胞的细胞毒性的ldh测定结果的图。图12示出了使用流式细胞术分析cho对cho-fap细胞的t细胞活化(基于cd69和cd25表达水平)的图。图13(a)示出了通过用epcam的或同位素对照抗体染色确定,并且使用流式细胞术分析的亲本细胞系对稳定转染变体的epcam表达的图。(b)示出了显示已经与t细胞和epcambite或对照bite共培养的cho或cho-epcam细胞的细胞毒性的ldh测定结果的图。图14示出了使用流式细胞术分析cho对cho-epcam细胞的t细胞活化(基于cd69和cd25表达水平)的图。图15(a)示出了fapbite活化使用流式细胞术分析的cd4+或cd8+t细胞(基于cd69和cd25表达水平)的能力的图。(b)示出了显示已经与cd4+或cd8+t细胞和fapbite或对照bite共培养的nhdf细胞的细胞毒性的ldh测定结果的图。图16(a)示出了在epcam存在下通过dld细胞的cd4+和cd8+t细胞活化(基于cd69和cd25表达水平)或使用流式细胞术分析对照bite的图。(b)示出了显示已经与cd4+或cd8+t细胞和epcambite或对照bite共培养的dld细胞的细胞毒性的ldh测定结果的图。图17(a)示出了用对照或fapbite培养的腹水中cd3+t细胞的数量的图。(b)示出了用对照或fapbite培养的腹水中t细胞的cd25表达水平的图。(c)示出了用对照或fapbite培养的腹水的fap+细胞数量的图。图18(a)本公开的腺病毒的基因组的示意性表示。(b)比较cmv对sa启动子驱动的表达的动力学的图。图19(a)示出了ng-601、ng-602、ng-603、ng-604、ng-605、ng-606和enad的每个细胞检测到的病毒基因组数量的定量的图。(b)示出了通过感染a549细胞评估的ng-601、ng-602、ng-603、ng-604、ng-605、ng-606或enad的溶瘤活性的图。图20(a)示出了使用流式细胞术分析,通过ng-601、ng-602、ng-605和ng-606在与cho-fap共培养时t细胞活化(基于cd69和cd25表达水平)的图。(b)示出了使用流式细胞术分析,通过ng-601、ng-602、ng-605和ng-606在与cho-epcam共培养时t细胞活化(基于cd69和cd25表达水平)的图。图21示出了显示确定从ng-605和ng-606产生的fapbite的量的实验结果的图。图22示出了显示确定从ng-601和ng-602产生的epcambite的量的实验结果的图。图23示出了用ng-607、ng-608、ng-609和ng-610感染的ad293细胞的显微镜图像。图24(a)指示使用xcelligence进行分析,用enad感染的dld细胞的细胞毒性的图。(b)指示使用xcelligence进行分析,用enad感染的skov细胞的细胞毒性的图。(c)指示使用xcelligence进行分析,用enad感染的nhdf细胞的细胞毒性的图。图25(a)指示使用xcelligence进行分析,ng-603、ng-604、ng-605、ng-606和enad杀死nhdf细胞的能力的图。(b)指示使用ldh测定法进行分析,ng-603、ng-604、ng-605、ng-606和enad杀死nhdf细胞的能力的图。图26示出了显示使用流式细胞术分析,通过ng-603、ng-604、ng-605、ng-606与nhdf细胞、skov和t细胞共培养的t细胞活化(基于cd69和cd25表达水平)的图。图27(a)示出了使用流式细胞术分析,通过ng-603、ng-604、ng-605、ng-606与nhdf和多个skov细胞对单个skov共培养的t细胞活化(基于cd69和cd25表达水平)的图。(b)指示使用ldh测定法分析,用ng-605和ng-606感染的nhdf细胞的细胞毒性的图。图28示出了通过重组fapbite、enad、ng-603或ng-605,来自nhdf细胞溶解的间隔拍摄视频的静止帧图像。图29示出了通过ng-607、ng-608、ng-609或ng-610,来自nhdf细胞溶解的间隔拍摄视频的静止帧图像。图30示出了指示使用xcelligence进行分析,在存在t细胞或不存在t细胞的情况下,用enad、ng-601、ng-602、ng-603和ng-604感染的dld细胞的细胞毒性的图。图31示出了指示使用ldh测定法进行分析,在存在t细胞或不存在t细胞的情况下,用enad、ng-601、ng-602、ng-603和ng-604感染的dld细胞的细胞毒性的图。图32示出了使用流式细胞术分析,通过enad、ng-601、ng-602、ng-603和ng-604显示t细胞活化(基于cd69和cd25表达水平)的图。图33示出了使用xcelligence评估在存在或不存在cd3+t细胞时,确定ng-601在不同感染复数(moi)下杀死dld肿瘤细胞的能力的实验结果。图34示出了指示使用xcelligence评估在存在或不存在cd3+t细胞时,enad和ng-601、ng-602、ng-603和ng-604杀死skov肿瘤细胞的能力的图。图35示出了指示使用ldh测定法评估在存在或不存在cd3+t细胞时,enad和ng-601、ng-602、ng-603和ng-604杀死skov肿瘤细胞的能力的图。图36示出了显示使用流式细胞术分析,通过与skov肿瘤细胞共培养的enad、ng-601、ng-602、ng-603和ng-604的t细胞活化(基于cd69和cd25表达水平)的图。图37示出了显示使用流式细胞术分析,通过与腹水细胞共培养的enad、ng-601、ng-602、ng-603和ng-604的t细胞活化(基于cd69和cd25表达水平)的图。图38示出了通过epcambite、enad、ng-601或ng-603,来自nhdf细胞溶解的间隔拍摄视频的静止帧图像。图39示出了从患者获得的腹水细胞的显微镜图像,所述腹水细胞被本公开的病毒感染并且用enad-cmv-gfp和enad-sa-gfp作为报道基因染色以确定感染和晚期病毒基因表达。图40(a)指示在用本公开的病毒感染的腹水样品中cd3+t细胞上cd25的表达水平的图。(b)指示用本公开的病毒感染的腹水样品中fap+细胞的数量的图。图41示出了从癌症患者获得的腹水细胞的显微镜图像,所述腹水细胞被本公开的病毒感染并且用enad-cmv-gfp和enad-sa-gfp作为报道基因染色以确定感染和晚期病毒基因表达。图42示出了指示从癌症患者获得并且用本公开的病毒感染的腹水样品中cd3+t细胞的数量的图。图43示出了指示从癌症患者获得并且用本公开的病毒感染的腹水样品中cd3+t细胞上的cd25表达水平的图。图44示出了指示从癌症患者获得并且用本公开的病毒感染的腹水样品中的fap+细胞数量的图。图45epcambite的表征及其对pbmc衍生t细胞的影响(a)靶向epcam的bite和非特异性对照bite的结构示意图。vl和vh结构域与富含丝氨酸和甘氨酸的柔性肽连接子(l)连接,以获得灵活性和溶解性。igsp,轻链免疫球蛋白信号肽;10his,decahistidine亲和标签。(b)在含有bite的上清液存在下,单独培养或与dld细胞(5:1)一起培养的cd3纯化的pbmc上活化标记物cd69和(c)cd25的诱导。在共培养24小时后通过流式细胞术测量cd69和cd25。评估显著性对igg同种型(d)在与dld细胞(5:1)和含有bite的上清液共培养6小时后ifnγ阳性t细胞的百分比。(e)与dld细胞(5:1)和含有bite的上清液共培养的cfse染色的t细胞的分部指数和进入增殖的亲本t细胞群的百分比所代表的增殖。共培养后5天通过流式细胞术测量荧光。分部指数使用flowjo增殖工具建模。(f)通过cd107a外化测量的t细胞脱粒,与dld细胞(5:1)和含有bite的上清液共培养。通过与cd107a特异性抗体共培养6小时评估外化,然后进行流式细胞术分析。(g)在含有bite的上清液存在下,使用来自t细胞与dld细胞(5:1)的共培养物的上清液,通过legendplex人类th细胞因子组测量细胞因子水平48小时。每种条件以生物学一式三份测量,并且数据表示为平均值±sd。除非另有说明,使用tukey的posthoc分析的单向anova测试评估显著性对未治疗的显著性,*p<0.05、**p<0.01、***p<0.001。图46重组epcambite的表征(a)斑点印迹以估计由转染的hek293a细胞产生的epcambite的量。(b)通过对照或重组epcam或非特异性bite测量epcam结合水平的elisa。通过使用tukey的posthoc分析的单向anova检验与空载体对照样品比较评估显著性,***p<0.001图47epcambite介导的t细胞细胞毒性的抗原特异性评估(a)在与cho或cho-epcam细胞(5:1)和含有bite的上清液共培养的cd3+t细胞上诱导活化标记物cd25,在共培养24小时后通过facs分析测量。(b)单独或与t细胞共培养的含有bite的上清液培养的cho或cho-epcam细胞的细胞毒性。通过在孵育24小时后将ldh释放到培养上清液中来评估细胞毒性。(c)与t细胞(1:5)和含有bite的上清液共培养24小时后多种epcam阳性癌细胞的细胞毒性。在共培养24小时后通过mts测定法测量活力。(d)与通过使用同种型对照抗体测量的背景荧光相比,通过(c)中的epcam阳性细胞系的facs分析评估的epcam表达水平(n=1)。(ac)每种条件以生物学一式三份测量,并且表示为平均值±sd。使用tukey的posthoc分析的单向anova测试评估显著性对未治疗或仅t细胞对照的显著性,*p<0.05、**p<0.01、***p<0.001。图48表达enad的epcambite在skov3细胞中的细胞毒性在不存在(a)或存在(b)t细胞的情况下,将skov3细胞与enad或重组病毒一起孵育,并且通过在指定时间点的ldh释放来测量细胞毒性。通过使用tukey的posthoc分析的单向anova检验与未感染的对照孔进行比较来评估显著性,***p<0.001图49识别哪些t细胞负责bite介导的细胞毒性(a)在cd3t细胞与dld细胞(5:1)和含有bite的上清液共培养后24小时后,bite介导的cd4和cd8细胞的t细胞活化。通过cd69和cd25的表面表达评估活化,并且通过流式细胞术测量。(b)cfse染色的cd4和cd8t细胞与dld细胞共培养并且与含有bite的上清液一起孵育的增殖应答。孵育5天后,通过facs分析测量荧光。(c)与dld细胞和含有bite的上清液共培养6小时后cd4和cd8细胞的脱粒。在共培养期间将cd107a特异性抗体添加到培养基中,并且通过流式细胞术评估脱粒。(d)通过将dld细胞与cd4或cd8纯化的t细胞(1:5)和含有bite的上清液孵育24小时后,通过ldh释放到上清液中来评估cd4或cd8t细胞亚群的细胞毒性。每种条件以生物学一式三份测量,并且表示为平均值±sd。除非另有说明,否则将epcambite治疗与对照bite进行比较,并且使用tukey的posthoc分析的单向anova测试评估显著性,*p<0.05、**p<0.01、***p<0.001。图50在dld细胞中通过表达enad的epcambite的细胞毒性和t细胞活化在不存在(a)或存在t细胞(b)的情况下感染的dld细胞的细胞毒性。感染dld细胞并且与t细胞共培养,并且在特定时间点通过ldh释放测量细胞毒性。(c-d)采集来自(b)的t细胞并且染色活化标记物cd69(c)或cd25(d),并且通过流式细胞术分析。(e-f)从用重组病毒感染的dld细胞产生的epcambite的定量。dld在与cd3+细胞和不同已知量的重组epcambite(e)共培养中释放(ab)的ldh标准曲线。平行地,将共培养物与来自3天感染的dld细胞(f)的稀释上清液(10,000倍)一起孵育。对于enad-cmv-epcambite和enad-sa-epcambite,标准曲线分别允许大约确定在165μg和50μg/百万dld细胞中产生的epcambite。通过使用tukey的posthoc分析的单向anova检验与未感染的对照孔进行比较来评估显著性,***p<0.001图51使用细胞系和pbmc衍生的t细胞表征表达epcambite的溶瘤病毒enad(a)用亲本enad或重组病毒(100vp/细胞)感染dld细胞,并且在24小时或72小时采集孔。通过使用针对病毒六邻体的qpcr测量基因组来评估复制。(b)随着病毒浓度的增加,用enad或重组病毒感染的dld细胞的细胞毒性。感染5天后通过mts测定法测量细胞毒性。(c)通过免疫印迹分析评估来自第3天未感染或感染病毒的hek293a细胞的上清液的转基因表达,并且用抗his抗体探测。(d)用cho或cho-epcam(e:t5:1)培养的cd3阳性t细胞和来自(d)的稀释hek293a上清液的活化标记物cd25的诱导。通过流式细胞术通过cd25的表面表达来测量活化。(e)与来自(d)的hek293a上清液一起孵育或与cd3纯化的pbmc(e:t5:1)共培养的cho或cho-epcam细胞的细胞毒性将hek293a上清液稀释300倍。通过在孵育24小时后释放到上清液中的ldh评估细胞毒性。每种条件以生物学一式三份测量,并且表示为平均值±sd。每种情况与未治疗的情况相比,使用tukey的posthoc分析的单向anova测试评估显著性,*p<0.05、**p<0.01、***p<0.001。图52恶性渗出物的细胞组合物(a)代表性图像(胸腔积液样品,来自图57的患者3)证明通过流式细胞术评估的腹水液和渗出液的细胞组成的筛选。(b)表中记录了每种细胞类型的绝对数量(10,000个细胞样品量)。图53表达epcambite的enad在部分enad抗性癌细胞系中的优越效力(a-b)通过基于xcelligence的细胞毒性测定,在160小时内实时监测skov3细胞的活力。接种skov3细胞并且在0小时用enad或bite携带的enad病毒感染,未感染的细胞用作阴性对照。在(b)中,感染后2小时添加cd3纯化的pbmc(5:1),并且以15分钟的间隔测量阻抗。(c-d)将cd3纯化的pbmc与用亲本enad或重组携带病毒感染的skov3细胞(5:1)一起培养。在每个时间点,采集t细胞并且通过流式细胞术分析cd69(c)或cd25(d)的表面表达。(e)延时序列,显示用enad、enad-cmvepcambite或未感染的skov3癌细胞(未染色)、nhdf成纤维细胞(红色)和cd3纯化的pbmc(蓝色)的共培养物。使用cellevent半胱天冬酶3/7检测试剂(绿色)显现细胞凋亡。在nikonte2000-eeclipse倒置显微镜上以15分钟的间隔拍摄图像,持续96小时。在显示的时间记录代表性图像;原始放大倍数×10;比例尺100μm。(a-d)每种条件以生物学一式三份测量,并且表示为平均值±sd。通过使用tukey的posthoc分析的单向anova测试与未感染对照进行比较来评估显著性,*p<0.05、**p<0.01、***p<0.001。图54pd1的表达和pd1抗体对bite介导的t细胞活化的影响(a)通过流式细胞术评估在初始分离胸腔积液后通过内源性t细胞的pd1表达。(b-d)在游离bite、enad或重组病毒的存在下,将来自胸腔积液(来自三个不同患者)的未纯化的总细胞在来自相同胸膜渗出物的100%液体中孵育。5天后,采集总细胞群,并且定量(b)cd3+t细胞数量和(c)cd25+细胞数量。(d)使用流式细胞术测量epcam+细胞的数量。通过使用tukey的posthoc分析的单向anova检验与未处理的对照孔进行比较来评估显著性,***p<0.001图55表达epcambite的enad可以选择性地杀死来自化疗预处理的患者的原代人类肿瘤细胞(a)epcam+细胞或(b)fap+成纤维细胞的细胞毒性,首先从三个患者的腹水中分离并且离体扩增,然后与重组bite一起孵育或用enad或重组病毒感染。5天后通过流式细胞术测量细胞毒性。(c)用来自(a+b)的腹水衍生的epcam+和fap+细胞培养的cd3阳性t细胞上的活化标记物cd25的诱导。每种条件以生物学一式三份测量,并且表示为平均值±sd。通过使用tukey的posthoc分析的单向anova测试与未处理的进行比较来评估显著性,*p<0.05、**p<0.01、***p<0.001。图56epcambite可以克服腹水液的免疫抑制作用并且活化内源性t细胞(a-b)pbmc衍生的t细胞与rpmi培养基中的抗cd3抗体或来自五个卵巢癌患者的100%腹膜腹水液的存在下一起孵育。(a)在24小时分析t细胞活化标记物cd69和cd25的诱导,并且(b)使用流式细胞术通过cd107a外化测量t细胞的脱粒。(c)通过基于xcelligence的细胞毒性测定,在60小时内实时监测mcf7细胞的活力。接种mcf7细胞,并且在rpmi培养基或100%腹水液#1或#2存在下于25小时与对照或epcambite一起孵育。未处理的细胞用作阴性对照。同时添加cd3纯化的pbmc(5:1),并且以15分钟的间隔测量阻抗。(d)在游离epcam或对照bite存在下,将来自腹膜腹水的内源性未纯化的总细胞在100%腹水液中孵育。24小时后,采集总细胞群,并且通过流式细胞术测量cd3+/cd69+andcd3+/cd25+细胞的数量。每种条件以生物学一式三份测量,并且表示为平均值±sd。通过使用tukey的posthoc分析的单向anova测试与rpmi(a+b)、未处理(d)或对照bite(e)进行比较来评估显著性,*p<0.05、**p<0.01、***p<0.001。图57表达epcambite的enad可以活化内源性t细胞以杀死恶性胸膜渗出物中的内源性肿瘤细胞在游离bite、enad或重组病毒的存在下,将来自胸腔积液(来自四个不同患者)的未纯化的总细胞在来自相同胸膜渗出物的100%液体中孵育。5天后,采集总细胞群,并且定量(a)cd3+t细胞数量和(b)cd25+细胞数量。(c)使用流式细胞术测量epcam+细胞的数量。(d)用enad或enad-cmvepcambite治疗后患者3(癌细胞和淋巴细胞)的胸腔积液细胞的代表性图像(放大倍数×10;比例尺100μm)和流式细胞术分析。(e)在第5天,在与游离重组bite孵育或用enad或重组病毒感染后,使用胸腔积液培养物,通过legendplex人类th细胞因子组测量细胞因子水平。每种条件以生物学一式三份测量,并且表示为平均值±sd。通过对照样品使用tukey的posthoc分析的单向anova测试与未处理的对照样品进行比较来评估显著性,*p<0.05、**p<0.01、***p<0.001。图58示出了使用人类il-10elisamax试剂盒(biolegend,430604)在正常血清(ns)或患者恶性渗出液(a:腹膜腹水,p:胸腔积液)中测量的il-10的量。图59示出了通过流式细胞术测量的患者液体中cd3/28珠介导的pbmct细胞活化(基于cd69/cd25水平)与正常血清的比较。a:患者渗出液,p:胸腔积液。图60示出了患者体液中cd3/28珠介导的pbmct细胞脱粒(基于cd107a表达)。a:腹水,p:胸腔积液。图61示出了患者体液中il-10水平与cd3/cd28珠介导的t细胞脱粒之间的相关性。图62示出了患者体液中epcambite珠介导的pbmct细胞活化(基于cd69/cd25表达)。a:腹水,p:胸腔积液。图63示出了患者体液中epcambite珠介导的pbmct细胞脱粒(基于cd107a表达)。a:腹水,p:胸腔积液。图64示出了患者体液中epcambite珠介导的skov3的细胞毒性。a:腹水,p:胸腔积液。图65示出了rpmi培养基中epcambite介导的t细胞活化(基于cd25/cd69表达)与腹水液的关系。图66示出了enad-sa-epcambite和enad-sa-对照bite在rpmi培养基中诱导t细胞介导的靶细胞溶解与腹水液的关系。((a)cd3+的数量。(b)t细胞的cd25表达。(c)通过流式细胞术确定的epcam+细胞数量。图67示出了enad-sa-epcambite和enad-sa-对照bite在腹水液中诱导t细胞介导的靶细胞溶解的能力(7个患者样品)。(a)cd3+的数量。(b)t细胞的cd25表达。(c)通过流式细胞术确定的epcam+细胞数量。图例请参见图67a。图68示出了在人类成纤维细胞存在下通过重组fapbite蛋白活化t细胞细胞因子产生和用抗cd3/cd28珠进行多克隆活化的比较。(a)通过elisa测量的ifnγ水平。(b)通过细胞因子珠阵列测量的细胞因子水平。图69fap靶向bite诱导t细胞脱粒和fap+细胞的特异性细胞毒性(a)用nhdf细胞(5:1)和(b)含有bite的上清液对培养物中的t细胞进行脱粒。通过用cd107a特异性抗体培养6小时后cd107a的外化来评估脱粒,并且通过流式细胞术测量。cd3/cd28磁珠用作阳性对照。(c)与t细胞(1:5)和10倍连续稀释的含有bite的上清液共培养24小时后nhdf细胞的细胞毒性。通过将ldh释放到培养上清液中来评估细胞毒性。(d)在与来自六个健康供体和含有bite的上清液的pbmc衍生的t细胞(1:5)共培养24小时后,评估ldh释放(左)和t细胞上cd25诱导(右)对nhdf的溶解。图70表达fapbite的enad选择性杀死fap+成纤维细胞,并且降低腹膜腹水样品中的tgfb(a,b)用pbmc衍生的t细胞和enad或重组病毒培养72小时后fap+成纤维细胞(a)和epcam+肿瘤细胞(b)的数目。首先从三名患者腹水中分离腹水细胞并且离体扩增。通过流式细胞术在感染后72小时测量细胞数量。(c)在感染后72小时测量来自(a)的pbmc衍生的cd3细胞上的活化标记物cd25的诱导。(d)使用从(a)采集的上清液通过elisa测量tgfb的水平。图71示出了fapbite蛋白和enad-fapbite病毒对患者恶性腹水活检样品中内源性肿瘤相关t细胞的活化和相关的fap+细胞杀伤。(a)通过cd25表达测量的t细胞活化。(b)通过流式细胞术测量的残留数量的fap+细胞。图72pd-l1阻断抗体对患者样品中bite介导的t细胞活化的影响(a)通过流式细胞术评估在从腹膜腹水初始分离后fap+细胞上内源性t细胞和pd-l1对pd1的表达。(b)在存在游离bite、enad或重组病毒的情况下,在存在或不存在抗pd-l1阻断抗体的情况下,将来自腹膜腹水的未纯化的总细胞在来自相同渗出物的50%液体中孵育。2天后,采集总细胞群,并且通过流式细胞术定量cd25+t细胞的数量。(c)通过elisa测量的来自(b,d)的培养上清液中的干扰素γ的量。(d)使用流式细胞术测量(b)中残留的fap+细胞的数量。图73表达bite的enad活化并且重定向来自患者活组织检查样品的t细胞以溶解nhdf成纤维细胞(a)从健康供体或恶性渗出癌活组织检查样品中分离后内源性t细胞的pd-1表达。通过流式细胞术测量pd-1表达。(b)通过流式细胞术测量的pbmc和癌症活组织检查样品的未纯化细胞群中cd3+细胞的比例。(c)在处理后120小时从(b)采集的培养上清液中通过elisa测量的干扰素γ水平。(d)通过与pbmc或总癌症活检细胞(1:5)和含有bite的上清液共培养的xcelligence细胞毒性测定,在130小时内实时监测nhdf成纤维细胞的活力。图74示出了免疫抑制性腹水液样品对fapbite介导的和抗cd3/cd28珠介导的pbmct细胞活化的影响。(a)用抗cd3/cd28磁珠活化的pbmct细胞。(b)在nhdf细胞存在下用对照或fapbite活化的pbmct细胞。ns:正常血清,a:腹膜腹水。图75表达enad的fapbite使患者腹水中的cd11b+巨噬细胞极化为更炎性的表型(a)在存在游离bite或表达病毒的bite的情况下,将来自腹水样品的未纯化的总细胞在50%腹水液中孵育。干扰素γ治疗用作阳性对照。3天后,采集总细胞群并且通过流式细胞术测量cd3+细胞上活化标记物cd25的诱导。(b)通过elisa测量来自(a)的培养上清液中的干扰素γ的水平。(c)在第3天,通过流式细胞术测量来自(a)的cd11b+细胞上的cd68、cd86、cd206和cd163的表达水平。来自一式三份的代表性流式细胞术光谱与完整数据集一起显示。图76实体前列腺肿瘤的结构和细胞组成的表征(a)epcam染色,(b)cd8染色,(c)fap染色。(d)用表达病毒的bite处理后前列腺肿瘤切片内cd25诱导的代表性免疫组织化学图像。用leica振动切片机将肿瘤核切成300μm厚度,培养并且在插入物中感染,并且在处理7天后采集。(e)通过elisa测量的组织切片培养基中ifng的水平。在指定的时间点从恶性和良性组织的切片培养物中采集上清液。(f)通过elisa测量的恶性和良性组织的组织培养基中il-2的水平。图77a到图77c示出了实例33中使用的转基因盒的示意图。图77d示出了指示ng-611、ng-612和ng-617处理的肿瘤细胞中经每个细胞检测病毒基因组的数目的图。图78示出了与ng-612、enadenotucirev或未处理的对照上清液相比,在用ng-611病毒颗粒处理后24小时、48小时或72小时与表达skov细胞的epcam和从a549细胞采集的上清液共培养后表达cd69(a)、cd25(b)、hla-dr(c)、cd40l(d)或细胞表面cd107a(e)的t细胞的百分比。图79示出了与ng-611、enadenotucirev或未处理的对照上清液相比,在用ng-612病毒颗粒处理后24小时、48小时或72小时与表达mrc-5细胞的fap和从a549细胞采集的上清液共培养后表达cd69(a)、cd25(b)、hla-dr(c)、cd40l(d)或细胞表面cd107a(e)的t细胞的百分比。图80示出了表达epcam和fap的mrc-5细胞的百分比图81示出了在用ng-611、ng-612或enadenotucirev病毒颗粒或未处理的对照上清液处理后24小时、48小时或72小时与skov细胞(a)或mrc-5细胞(b)的t细胞共培养物的上清液中的ifnγ表达,其与从a549细胞采集的上清液一起孵育。图82示出了体内表达病毒的bite的抗肿瘤功效和免疫活化。(a)用盐水、enadenotucirev或ng-611治疗的小鼠的肿瘤体积。(b)与enadenotucirev治疗或未治疗的对照相比,ng-611治疗的肿瘤中cd8与cd4t细胞的比例。图83示出了转基因盒的示意图。(a)ng-615,(b)ng-640,(c)ng-641。图84示出了指示ng-612和ng-615处理的肿瘤细胞中经每个细胞检测病毒基因组的数目的图。图85示出了ifnα、mip1α和flt3l在ng-615的细胞上清液中与enadenotucirev与未处理的对照肿瘤细胞的上清液的表达。图86示出了与ng-612、enadenotucirev或未处理的对照上清液相比,在用ng-615病毒颗粒处理后24小时、48小时或72小时与表达mrc-5细胞的fap和从a549细胞采集的上清液共培养后表达cd69(a)、cd25(b)、hla-dr(c)、cd40l(d)或细胞表面cd107a(e)的t细胞的数量。图87示出了在用ng-612、ng-615或enadenotucirev病毒颗粒或未处理的对照上清液处理后24小时、48小时或72小时与mrc-5细胞的t细胞共培养物的上清液中的ifnγ表达,其与从a549细胞采集的上清液一起孵育。图88示出了ng-618转基因盒的示意图图89示出了在用ng-611、ng-612、ng-615或enadenotucirev病毒颗粒处理后72小时与从a549细胞采集的上清液孵育后,mrc-5细胞上表面fap表达(a)或skov细胞上的epcam表达(b)的检测。图90示出了与enadenotucirev或未处理的对照相比,在用ng-618病毒颗粒处理后72小时与表达mrc-5细胞的fap和从a549细胞采集的上清液共培养后表达cd24(a)、cd40l(b)或细胞表面cd107a(c)的t细胞的百分比。图91示出了与enadenotucirev或未处理的对照相比,在用ng-618病毒颗粒处理后72小时与表达skov细胞的epcam和从a549细胞采集的上清液共培养后表达cd24(a)、cd40l(b)或细胞表面cd107a(c)的t细胞的百分比。图92示出了与enadenotucirev或未处理的对照相比,在用ng-618病毒颗粒处理后72小时与t细胞和从a549细胞采集的上清液共培养后死亡的mrc-5(a)或skov(b)细胞的百分比。序列seqidno:1抗epcambitedna编码序列,具有n-末端信号序列和c-末端deca-his亲和标签seqidno:2抗epcambite蛋白质序列,具有n-末端信号序列和c-末端deca-his亲和标签seqidno:3抗fapbitedna编码序列,具有n末端信号序列和c末端deca-his亲和标签seqidno:4抗fapbite氨基酸序列,具有n末端信号序列和c末端deca-his亲和标签seqidno:5:对照(抗fha)bitedna编码序列,具有n末端信号序列和c末端deca-his亲和标签seqidno:6:对照(抗fha)bite氨基酸序列,具有n末端信号序列和c末端deca-his亲和标签seqidno:7:抗cd3scfv氨基酸序列seqidno:8:抗cd3vhseqidno:9:抗cd3vlseqidno:10:抗cd3scfv连接子序列seqidno:11:抗fapscfvseqidno:12:抗fapvl结构域seqidno:13:抗fapvh结构域seqidno:14:抗fap和抗epcam连接子序列seqidno:15:bite前导序列seqidno:16:抗epcamscfvseqidno:17:抗epcamvlseqidno:18:抗epcamvhseqidno:19:对照bite(抗fha)seqidno:20:对照(抗fha)scfvseqidno:21:对照(抗fha)vlseqidno:22:对照(抗fha)vhseqidno:23:对照(抗fha)scfv连接子序列seqidno:24:deca-his标签序列seqidno:25:fapbite-p2a-rfp(italics=前导,bold=弗林蛋白酶切割位点,underline=p2a序列,小写=rfp)seqidno:26:对照(抗fha)bite-p2a-rfp(italics=前导,bold=弗林蛋白酶切割位点,underline=p2a序列,小写=rfp)seqidno:27:人类epcamdna编码序列seqidno:28:人类epcam氨基酸序列seqidno:29:人类fapdna编码序列seqidno:30:人类fap氨基酸序列seqidno:31:cmv启动子序列seqidno:32:sv40晚期多腺苷酸化序列seqidno:33:零序列seqidno:34:ng-601(enad-cmv-epcambite)seqidno:35:ng-602(enad-sa-epcambite)seqidno:36:ng-605(enad-cmv-fapbite)seqidno:37:ng-606(enad-sa-fapbite)seqidno:38enad基因组seqidno:39bxdna序列对应于并且包含enad基因组的bp28166到bp28366seqidno:40bydna序列对应于并且包含enad基因组的bp29345到bp29379seqidno:41his-tagseqidno:42剪接受体序列。seqidno:43sv40多腺苷酸化序列seqidno:44epcambite核酸序列(okt3)seqidno:45fapbite核酸序列(okt3)seqidno:46fapbite核酸序列(acd3)seqidno:47ng-611转基因盒seqidno:48ng-612转基因盒seqidno:49ng-613转基因盒seqidno:50限制性位点插入(bx)seqidno:51限制性位点插入(by)seqidno:52cmv启动子序列seqidno:53pgk启动子序列seqidno:54cba启动子序列seqidno:55短剪接受体(ssa)dna序列seqidno:56剪接受体(sa)dna序列seqidno:57分支剪接受体(bsa)dna序列seqidno:58kozak序列(零序列)seqidno:59起始密码子的实例seqidno:60内部核糖体进入序列(ires)seqidno:61p2a肽seqidno:62f2a肽seqidno:63e2a肽seqidno:64t2a肽seqidno:65多聚腺苷酸化(polya)序列seqidno:66前导序列seqidno:67前导序列seqidno:68ifnγ氨基酸序列seqidno:69ifnα氨基酸序列seqidno:70tnfα氨基酸序列seqidno:71对应于enad基因组的e2b区的dna序列(bp10355到bp5068)seqidno:72:抗epcambitedna编码序列,具有n末端信号序列和c末端deca-his亲和标签seqidno:73:抗epcambite蛋白质序列,具有n末端信号序列,不具有c末端deca-his亲和标签seqidno:74:抗fapbitedna编码序列,具有n末端信号序列,不具有c末端deca-his亲和标签seqidno:75:抗fapbite氨基酸序列,具有n末端信号序列,不具有c末端deca-his亲和标签seqidno:76:对照(抗fha)bitedna编码序列,具有n末端信号序列,不具有c末端deca-his亲和标签seqidno:77:对照(抗fha)bite氨基酸序列,具有n末端信号序列,不具有c末端deca-his亲和标签seqidno:78:对照bite(抗fha),不具有c末端deca-his亲和标签的seqidno:79:ng-601(enad-cmv-epcambite),不具有deca-his亲和标签seqidno:80:ng-602(enad-sa-epcambite),不具有deca-his亲和标签seqidno:81:ng-605(enad-cmv-fapbite),不具有deca-his亲和标签seqidno:82:ng-606(enad-sa-fapbite),不具有deca-his亲和标签seqidno:83:epcambite核酸序列(okt3)seqidno:84:零序列seqidno:85:fapbite核酸序列(okt3)seqidno:86:零序列seqidno:87:fapbite核酸序列(acd3)seqidno:88:ng-611转基因盒seqidno:89:ng-612转基因盒seqidno:90:ng-613转基因盒seqidno:91:ng-614转基因盒seqidno:92:ng-617转基因盒seqidno:93:epcambite氨基酸序列(okt3)seqidno:94:fapbite氨基酸序列(okt3)seqidno:95:fapbite氨基酸序列(acd3)seqidno:96:ng-611基因组seqidno:97:ng-612基因组seqidno:98:ng-613基因组seqidno:99:ng-614基因组seqidno:100:ng-617基因组seqidno:101:ng-615基因组seqidno:102:ng-640基因组seqidno:103:ng-641基因组seqidno:104:零序列seqidno:105:flt3l核酸序列seqidno:106:零序列seqidno:107:mip1α核酸序列seqidno:108:柔性连接子序列seqidno:109:ifnα核酸序列seqidno:110:cxcl10核酸序列seqidno:111:cxcl9核酸序列seqidno:112:ng-615转基因盒seqidno:113:ng-640转基因盒seqidno:114:ng-641转基因盒seqidno:115:flt3l氨基酸序列seqidno:116:mip1α氨基酸序列seqidno:117::ifnα氨基酸序列seqidno:118:cxcl9氨基酸序列seqidno:119:cxcl10氨基酸序列seqidno:120:ng-618基因组seqidno:121:ng-618epcambite核酸序列seqidno:122:ng-618fapbite核酸序列seqidno:123:ng-618转基因盒seqidno:124到297是连接子序列seqidno:298ng-616基因组实例实例1设计重组bite并且如本实例中所描述制备蛋白质。bite工程化通过将具有不同特异性的两个单链抗体片段(scfv)与柔性gly4ser连接子连接来生成bite。scfv是通过连接子从亲本单克隆抗体连接vh和vl结构域而创建的。每个bite设计有用于哺乳动物分泌的n-末端信号序列和用于检测和纯化的c-末端十八组氨酸亲和标签。通过标准dna克隆技术工程化bite并且将其插入蛋白质表达载体中(图1)。抗epcambite是来自专利wo2005040220(其中seqidno:63)的抗epcambite,其中添加了信号序列和亲和标签。使用来自专利wo2010037835a2的抗fapscfv和来自专利wo2005040220(其中的seqid63)的抗cd3scfv从头创建抗fapbite,其中添加了信号序列和亲和标签。对照bite使用来自hussein等人,2007的抗fha(来自百日咳博德特氏菌的丝状血细胞凝集素)scfv(husseinah等人(2007)“针对百日咳博德特氏菌表面粘附素丝状血凝素和百日咳杆菌素的单链可变片段抗体的构建和表征”。感染免疫75,5476-5482),以及来自专利wo2005040220(其中seqidno:63)的抗cd3scfv,其中添加了信号序列和亲和标签。这些bite的dna编码和氨基酸序列是seqidno:1到6。重组bite生产通过使用cmv启动子(seqidno:31)将各序列克隆到psf-cmv载体中以驱动蛋白质表达来产生重组bite蛋白质(图1)。通过nanodrop测量质粒、psf-cmv-epcambite、psf-cmv-fapbite和psf-cmv-对照bite(表2)的质粒dna浓度。包含空psf-cmv载体作为阴性对照。用4mloptimem稀释各54.7μg。将109.2ugpei(线性,mw25000,美国polysciences公司)在4mloptimem培养基中稀释,并且与4ml稀释的dna混合以生成dna-pei复合物(dna:pei比为1:2(w/w))。在室温下孵育20分钟后,用optimem将复合物混合物补足到18ml,并且将此转染混合物添加到含有90%汇合的ad293细胞的t175烧瓶中。将细胞与转染混合物在37℃、5%co2孵育4小时后,将30ml细胞培养基(补充有谷氨酰胺的dmem高葡萄糖,无酚红)添加到细胞中,并且将烧瓶在37℃、5%co2下孵育48小时。将另一个细胞烧瓶与psf-cmv-gfp平行转染以确保有效的转染效率。为了采集分泌的蛋白质,收集转染细胞的上清液,并且在4℃下以350g离心5分钟以去除细胞组分(allegrax-15r,贝克曼库尔特有限公司(beckmancoulter))。将上清液转移到10kmwcoamiconultra-15离心过滤装置(密理博公司(millipore))中。在4750rpm和4℃下旋转后,用流过物调节渗余物的体积以获得高50倍的浓度。将等分的浓缩蛋白质储存在-80℃。表2在命名构建体中用作前缀的“p”指示构建体是质粒。重组bite检测为了检测bite,可以使用蛋白质印迹技术用抗his抗体探测c-末端的十八组氨酸亲和标签。用溶解缓冲液调节蛋白质样品到终体积15μl,包含含有β-巯基乙醇和sds的2.5μl6xlaemmlisds样品缓冲液。将样品在95℃孵育5分钟以使蛋白质变性并且加载到15孔10%预制聚丙烯酰胺凝胶(mini-proteantgx预制凝胶,英国生命科学公司(biorad))上。在mini-proteantetra系统(英国生命科学公司)内的1x运行缓冲液中,凝胶在180v下运行45分钟。将来自sds凝胶的蛋白质通过在300ma和4℃下90分钟内在微型反式印迹细胞(minitrans-blotcell)(英国生命科学公司)内的1x转移缓冲液中湿电印迹转移到硝酸纤维素膜上。在冰袋存在下执行转移以限制热量。然后将硝酸纤维素膜用pbs-t中的5%牛奶在摇床上在室温下封闭1小时,并且用抗his(c-末端)抗体(小鼠α-6xhis,克隆3d5,英国英杰公司(invitrogen),#46-0693)探测,在pbs/5%牛奶中1:5000稀释。在摇床上于4℃孵育过夜后,洗涤膜并且用hrp标记的多克隆次级α-小鼠免疫球蛋白抗体(在pbs/5%牛奶中1:10.000,dako公司,#p0161)在室温下探测1小时。为了可视化,按照制造商的说明应用supersignalwestdura延长持续时间基板(英国赛默飞世尔科技公司)并且暴露于x射线胶片并在自动胶片处理器中显影。结果证明了用bite表达质粒转染的ad293细胞中bite蛋白的表达和分泌,但不是亲本载体。重组bite定量为了测量重组bite蛋白的量,使用斑点印迹技术将bite信号与his标记的(c-末端10his)蛋白标准品(10xhis标记的人类组织蛋白酶d,biolegend公司,#556704)进行比较。制备两倍系列稀释的bite样品和蛋白质标准品,并且将1.5μl各自直接施加到硝酸纤维素膜上并且空气干燥20分钟。然后执行上文所描述的用于蛋白质印迹的阻断和染色方案。调节蛋白质标准品的摩尔浓度以表示bite浓度为250μg/ml。结果(图2a)证明了用bite表达质粒转染的ad293细胞中bite蛋白的表达和分泌。fap结合elisa通过酶联免疫吸附测定(elisa)评估从用psf-cmv-fapbite或psf-cmv-对照bite转染的细胞分泌的fapbite和对照(抗fha)bite(seqidno:4和6)的fap结合活性。包含空psf-cmv载体上清液作为阴性对照。通过在4℃下用pbs缓冲液中的人类fap/seprase蛋白(100ng/孔,义翘神州科技有限公司(sinobiologicalinc),10464-h07h-10)涂覆过夜来制备elisa板(nuncimmunomaxisorp96孔微孔板)。用pbs0.05%吐温20在所有后续结合步骤之间洗涤板。将板在室温下用5%bsa的pbs0.05%吐温20封闭1小时。将等分的bite蛋白或从空psf-cmv载体转染的孔采集的蛋白质稀释10倍到pbs/5%bsa/0.05%吐温20中。将所有样品添加到fap涂覆的板中并且在室温下孵育2小时。将检测抗体,抗his(c末端)抗体(小鼠抗6xhis,克隆3d5,英杰公司,英国,#46-0693)以1:1000稀释,并且在室温下施加1小时。然后在室温下施加hrp缀合的抗小鼠fc(在pbs/5%牛奶中1:1000,dako公司)1小时,接着用hrp底物溶液3.3.5.5'-四甲基乙二胺(tmb,赛默飞世尔科技公司)执行hrp检测。使用终止溶液终止反应,并且在读板器上在450nm处测量显色。针对fapbite、对照bite和空载体上清液绘制450nm处的吸光度,证明fapbite与fap蛋白的特异性结合。结果(图2b)示出了fapbite而非对照bite与重组fap蛋白的特异性结合。epcam结合elisa通过酶联免疫吸附测定(elisa)评估从用psf-cmv-epcambite或psf-cmv-对照bite转染的细胞分泌的epcambite和对照bite(seqidno:2和6)的epcam结合活性。包含空psf-cmv载体上清液作为阴性对照。通过在4℃下用pbs缓冲液中的人类epcam/trop-1蛋白(50ng/孔,义翘神州科技有限公司(sinobiologicalinc),#10694-h02h-50)涂覆过夜来制备elisa板(nuncimmunomaxisorp96孔微孔板)。用pbs0.05%吐温20在所有后续结合步骤之间洗涤板。将板在室温下用5%bsa的pbs0.05%吐温20封闭1小时。将等分的bite蛋白或从空psf-cmv载体转染的孔采集的蛋白质稀释10倍到pbs/5%bsa/0.05%吐温20中。将所有样品添加到epcam涂覆的板中并且在室温下孵育2小时。将检测抗体,抗his(c末端)抗体(小鼠抗6xhis,克隆3d5,英杰公司,英国,#46-0693)以1:5000稀释,并且在室温下施加1小时。然后在室温下施加hrp缀合的抗小鼠fc(在pbs/5%牛奶中1:1000,dako公司)1小时,接着用hrp底物溶液3.3.5.5'-四甲基乙二胺(tmb,赛默飞世尔科技公司)执行hrp检测。使用终止溶液终止反应,并且在读板器上在450nm处测量显色。针对epcambite、对照bite和空载体上清液绘制450nm处的吸光度证明epcambite与重组epcam的特异性结合。结果(图2c)示出了epcambite而非对照bite与重组epcam蛋白的特异性结合。实例2在构建携带bite转基因的enad病毒之前,在许多不同的测定中评估重组bite蛋白的功能活性。人类外周血单个核细胞(pbmc)的分离通过密度梯度离心从健康供体的新鲜人类血液样品或从牛津的英国国家医疗服务系统血液与移植管理处(nhsblood和transplantuk)获得的全血白细胞锥体分离人类pbmc。在任一种情况下,将样品用pbs1:2稀释,并且将25ml此混合物在50ml离心管中分层到13mlficoll(1.079g/ml,淋巴细胞分离液(ficoll-paqueplus),gehealthcare公司)上。将样品在22℃下以1600rpm离心30分钟(allegrax-15r,beckmancoulter),用最低减速设置以保持相分离。离心后,可以观察到4层,其中包含在顶端的等离子体层,下面是含有pbmc的界面,底部是一个ficoll层和一层红细胞和粒细胞。使用巴斯德吸管收集pbmc,并且用pbs(1200rpm,室温下10分钟)洗涤两次,并且重悬于补充有10%fbs的rpmi培养基中。分离cd3阳性t细胞根据制造商的方案,使用pant细胞分离试剂盒(美天旎生物技术公司(miltenyibiotec),#130-096-535)通过耗尽非cd3细胞从pbmc中提取cd3阳性(cd3+)t细胞。处理原发性腹水样品从丘吉尔医院(牛津大学医院)的肿瘤病房接收来自多种适应症的患者的原发性人类腹水样品,包含但不限于卵巢癌、胰腺癌、乳腺癌和胃癌。在收到样品后,将细胞和流体部分分离,将等分试样的流体冷冻在-20℃下以便储存和将来的分析。按照制造商的说明,用红细胞溶解缓冲液(罗氏公司(roche),#11814389001)处理细胞级分以去除红细胞。通过对epcam、egfr、fap、cd45、cd11b、cd56、cd3、cd4、cd8、pd1和ctla4的染色确定每个样品中存在的细胞类型,并且通过流式细胞术分析。然后将新鲜细胞用于离体t细胞活化和靶细胞溶解实验。在一些情况下,将细胞在补充有10%fbs的dmem中传代以用于后续实验。细胞系维护将所有细胞系维持在表3中指定的dmem(西格玛奥德里奇公司(sigma-aldrich),英国)或rpmi培养基(西格玛奥德里奇公司,英国)中,在潮湿的培养箱(mco-17aic,三洋公司(sanyo))中于37℃和5%co2下补充有10%(v/v)胎牛血清(fbs,gibcotm)和1%(v/v)青霉素/链霉素(10mg/ml,西格玛奥德里奇公司,英国),除非另有说明。通过用胰蛋白酶/edta(0.05%胰蛋白酶0.02%edta,西格玛奥德里奇公司,英国)酶促解离,每2天到3天将细胞分开,然后达到汇合。在此过程中,抽吸培养基,并且用15mlpbs洗涤细胞,并且随后用2ml胰蛋白酶/edta在37℃处理细胞2分钟到10分钟。用10ml含有10%fbs的dmem中和胰蛋白酶,并且将一部分细胞转移到含有新鲜培养基的新烧瓶中。对于常规细胞培养,培养基补充有10%fbs,用于2%fbs的感染和病毒质粒转染以及用于没有fbs补充的重组bite质粒转染。表3统计在比较两个条件的情况下,使用t检验执行统计分析。在所有其它情况下,通过使用单向anova执行统计分析。通过重组fapbite表征人类t细胞活化比较了fapbite在存在或不存在正常人类皮肤成纤维细胞(nhdf)细胞的情况下诱导t细胞活化的能力。在单独的培养基或300ng/mlfap或对照bite的存在下,将人类cd3+t细胞(96孔u-底板中每孔70,000个细胞)单独或与nhdf细胞(10:1t:nhdf)共培养。将细胞在37℃共培养24小时,并且随后用无酶细胞解离缓冲液(赛默飞世尔科技公司,#13151014)采集。然后通过抗体染色和流式细胞术分析cd45+t细胞上cd69(图3a)和cd25(图3b)的表达水平,并且表示为几何平均荧光(gmfi)值。将板固定的抗cd3抗体(7.5μg/ml)用作t细胞活化的阳性对照。fapbite选择性诱导t细胞上活化标记物cd69和cd25的表达,指示其能够活化t细胞。在第二个类似的实验中,在与nhdf细胞(200,000个cd3+细胞加上96孔板的孔中的40,000个nhdf)和300ng/mlfap或对照bite共培养6小时后,通过细胞内细胞因子染色评估t细胞。对cd45+t细胞进行细胞内染色以进行ifnγ表达,在采集前5小时将布雷菲德菌素a添加到培养基中。作为阳性对照,用可溶性pma(10ng/ml)和离子霉素(1μg/ml)刺激t细胞。图4a中示出的结果指示,与对照bite相比,在nhdf存在下的fapbite导致显著更高数量的表达ifnγ的t细胞。实例3进行与实例2中相似的一组实验以表征重组epcambite蛋白。通过重组epcambite表征人类t细胞活化比较了在存在或不存在epcam阳性dld细胞系的情况下epcambite诱导t细胞活化的能力。在单独的培养基或600ng/mlepcam或对照bite的存在下,将人类cd3+t细胞(96孔u-底板中每孔70,000个细胞)单独或与dld细胞(10:1t:dld)共培养。将细胞在37℃共培养24小时,并且随后用无酶细胞解离缓冲液采集。然后通过抗体染色和流式细胞术分析cd45+t细胞上cd69和cd25的表达水平,并且将数据表示为几何平均荧光(gmfi)值。将板固定的抗cd3抗体(7.5μg/ml)用作t细胞活化的阳性对照。epcambite选择性诱导t细胞上活化标记物cd69和cd25的表达,指示其能够活化t细胞(图4b和图c)。在类似的实验中,在与dld细胞(200,000个cd3+t细胞加上96孔板的每孔40,000个dld细胞)和300ng/mlepcam或对照bite共培养6小时后,通过细胞内细胞因子染色评估t细胞。对cd45+t细胞进行细胞内染色以进行ifnγ表达,在采集前5小时将布雷菲德菌素a添加到培养基中。作为阳性对照,用可溶性pma(10ng/ml)和离子霉素(1μg/ml)刺激t细胞。结果示出了与对照bite相比,在dld存在下的epcambite导致显著更高数量的表达ifnγ的t细胞(图5a)。在另一个类似的实验中,来自8个不同献血者的pbmc用于评估bite介导的t细胞活化中的供体依赖性变异。在单独培养基或300ng/ml对照或epcambite存在下,将dld(7,000个细胞)与100,000个pbmc在u形底96孔板中共培养。将细胞在37℃共培养24小时,并且随后采集。然后通过抗体染色和流式细胞术分析cd45+t细胞上cd69和cd25的表达水平,并且将数据表示为几何平均荧光(gmfi)值。结果示出了epcambite诱导来自所有8个供体的cd3+t细胞中活化标记物cd69和cd25的表达(图5b和图c)。实例4在此实例中,评估了重组fapbite活化的t细胞诱导成纤维细胞靶细胞死亡的能力。fapbite诱导t细胞介导的fap阳性细胞系和原发细胞的溶解在单独培养基或300ng/ml对照或fapbite存在下,将nhdf(7,000个细胞)与70,000个t细胞在u形底96孔板的孔中共培养。共培养24小时后,采集上清液,并且按照制造商的说明通过ldh测定法确定细胞毒性。图6a中的结果示出了fapbite显著增加nhdf细胞的溶解。在类似的实验中,在具有或不具有300ng/ml对照或fapbite下,将7,000个原代肺成纤维细胞(btc100)与70,000个cd3+t细胞共培养。共培养24小时后,采集上清液,并且通过ldh测定法确定细胞毒性。图6b和图c中的结果示出了fapbite显著增加原发性人类癌症相关成纤维细胞(caf)细胞的溶解。这些和其它患者来源的细胞系的fap表达如图7所示。通过将8,000个nhdf细胞与40,000个t细胞共培养并且bite浓度范围为2×103到2×10-2ng/ml来评估fapbite介导的细胞溶解的剂量-应答关系。在37℃共培养24小时后,对上清液执行ldh测定以确定靶细胞的细胞毒性。使用集成到graphpadprism中的四参数非线性拟合模型拟合剂量应答曲线,从而生成fapbite的ec50值为3.2ng/ml。结果(图8a)示出了通过ldh测定法测量的fapbite浓度与细胞毒性之间的剂量依赖性关系(显示为abs490)。实例5使用与实例4中类似的研究来证明重组epcambite活化的t细胞诱导靶肿瘤细胞死亡的能力。epcambite诱导t细胞介导的epcam阳性细胞系的溶解在单独培养基或300ng/ml对照或epcambite存在下,将dld肿瘤细胞(7,000个细胞)与70,000个t细胞在u形底96孔板的孔中共培养。共培养24小时后,采集上清液,并且通过ldh测定法确定细胞毒性。图8b中的结果示出了epcambite显著增加dld细胞的溶解(在图8c中示出了dld细胞上的epcam表达)。在类似的实验中,在具有或不具有300ng/ml对照或epcambite下,将4,000个skov细胞与40,000个cd3+t细胞共培养。共培养24小时后,采集上清液,并且通过ldh测定法确定细胞毒性。图9a中的结果示出了epcambite显著增加skov细胞的溶解。在另一个类似的实验中,在具有或不具有300ng/ml对照或epcambite下,将5,000个mcf7细胞与50,000个cd3+t细胞共培养。共培养24小时后,采集上清液,并且通过ldh测定法确定细胞毒性。图9b中的结果示出了epcambite还显著增加mcf7细胞的溶解。通过将8,000个dld与40,000个t细胞共培养并且epcam或对照bite浓度范围为2×103到2×10-2ng/ml来评估epcambite介导的细胞溶解的剂量-应答关系。在37℃共培养24小时后,对上清液执行ldh测定以确定靶细胞的细胞毒性。使用集成到graphpadprism中的四参数非线性拟合模型拟合剂量应答曲线,从而生成epcambite的ec50值为7.4ng/ml。图10中的结果示出了epcambite浓度与细胞毒性之间的剂量依赖关系。总之,此实例的结果证明epcambite能够诱导t细胞介导的多种epcam阳性肿瘤细胞系的溶解。实例6生成稳定的表达fap的cho和ad293细胞系,作为通过与亲本未转染细胞比较证明fapbite的fap抗原特异性的手段。表达fap的稳定转染的细胞系的生成从ncbi数据库(seqid30)获得fap基因的蛋白质序列,逆转录以生成由牛津遗传学有限公司(oxfordgeneticsltd)(英国牛津)合成的dna编码序列。通过标准克隆技术将fap基因克隆到psf-lenti载体中,产生psf-lenti-fap载体。用慢病毒fap表达载体与psf-cmv-hiv-gag-pol、psf-cmv-vsv-g、psf-cmv-hiv-rev一起转染hek293t细胞。脂质体2000用作转染试剂,并且以dna:脂质体比例为1:2添加到载体dna中,并且与细胞在37℃下孵育。48小时后采集含有慢病毒的上清液并且与聚凝胺混合(终浓度,8μg/ml)。将慢病毒/聚凝胺混合物添加到接种的ad293或cho细胞中并且在37℃下孵育。在第4天,将上清液更换为含有嘌呤霉素的培养基(ad293为2μg/ml,并且cho为7.5μg/ml)。然后克隆选择稳定的变体,并且通过用fap或同位素对照抗体染色确定亲本细胞系或稳定转染的变体的fap表达,并且通过流式细胞术分析(图11a)。fapbite介导的靶细胞溶解对表达fap的细胞是特异性的在单独培养基或2μg/ml对照或fapbite存在于u形底96孔板的孔中,单独或与人类t细胞(70,000个)共培养cho或cho-fap细胞(7,000个细胞)。孵育24小时后,采集上清液,并且如实例4中所描述的通过ldh细胞毒性测定法测量靶细胞细胞毒性(图11b)。还通过流式细胞术分析cd69和cd25的表达水平来确定t细胞活化(图12)。仅当cho-fap细胞与t细胞和fapbite一起培养时才观察到细胞毒性。这指示fapbite介导的t细胞活化和靶细胞溶解是高度特异性的并且限于fap表达细胞,而不是fap阴性亲本细胞系。实例7生成稳定的表达epcam的cho和ad293细胞系,作为通过与亲本未转染细胞比较证明epcambite的epcam抗原特异性的手段。表达epcam的稳定转染的细胞系的生成从ncbi数据库(seqid28)获得epcam基因的蛋白质序列,逆转录以生成由牛津遗传学有限公司(oxfordgeneticsltd)(英国牛津)合成的dna编码序列。通过标准克隆技术将epcam基因克隆到psf-lenti载体中,产生psf-lenti-epcam载体。用慢病毒epcam表达载体与psf-cmv-hiv-gag-pol、psf-cmv-vsv-g、psf-cmv-hiv-rev一起转染hek293t细胞。脂质体2000用作转染试剂,并且以dna:脂质体比例为1:2添加到载体dna中,并且与细胞在37℃下孵育。48小时后采集含有慢病毒的上清液并且与聚凝胺混合(终浓度,8μg/ml)。将慢病毒/聚凝胺混合物添加到接种的ad293或cho细胞中并且在37℃下孵育。在第4天,将上清液更换为含有嘌呤霉素的培养基(ad293为2μg/ml,并且cho为7.5μg/ml)。然后克隆选择稳定的变体,并且通过用epcam或同位素对照抗体染色确定亲本细胞系或稳定转染的变体的epcam表达,并且通过流式细胞术分析(图13a)。epcambite介导的靶细胞溶解对表达epcam的细胞是特异性的在单独培养基或2μg/ml对照或epcambite存在于u形底96孔板的孔中,单独或与人类t细胞(70,000个)共培养cho或cho-epcam细胞(7,000个细胞)。孵育24小时后,采集上清液,并且通过ldh细胞毒性测定法测量靶细胞细胞毒性(图13b)。还通过流式细胞术分析cd69和cd25的表达水平来确定t细胞活化(图14)。仅当cho-epcam细胞与t细胞和epcambite一起培养时才观察到细胞毒性。这指示epcambite介导的t细胞活化和靶细胞溶解是高度特异性的并且限于epcam表达细胞,而不是epcam阴性亲本细胞系。实例8在进一步的实验中,评估了重组fapbite蛋白活化cd4或cd8t细胞的能力以及这些t细胞亚群中的每一种溶解nhdf细胞的能力。在300ng/ml对照或fapbite存在下,在u形底96孔板的孔中将cd3+t细胞(35,000个)与7,000个nhdf细胞共培养,并且在37℃下孵育24小时。采集细胞并且用针对cd4或cd8和cd69和cd25的抗体染色,并且通过流式细胞术分析。结果(图15a)证明fapbite诱导cd4+和cd8+t细胞中活化标记物cd69和cd25的增加。在类似的实验中,评估了每个t细胞亚群(cd4和cd8)杀死靶细胞的能力。根据制造商的方案,通过使用cd4t细胞分离试剂盒(美天旎生物技术公司,#130-045-101)的阳性选择从cd3纯化的细胞中提取cd4+t细胞,其中cd8细胞在非分离的流过物中。在u形底96孔板的孔中,将7,000个nhdf与35,000个cd4+或cd8+t细胞一起与300ng/ml对照或fapbite共培养,并且在37℃孵育。24小时后,采集上清液,并且通过ldh细胞毒性测定法测量靶细胞细胞毒性。结果(图15b)示出了fapbite诱导cd4+和cd8+t细胞以杀死nhdf细胞。实例9评估了epcambite活化cd4+或cd8+t细胞的能力以及每个亚群溶解dld肿瘤细胞的能力。在300ng/ml对照或epcambite存在下,在u形底96孔板的孔中将cd3+t细胞(35,000个)与7,000个dld细胞共培养,并且在37℃下孵育24小时。采集细胞并且用针对cd4或cd8和cd69和cd25的抗体染色,并且通过流式细胞术分析。结果(图16a)证明epcambite诱导cd4+和cd8+t细胞中活化标记物cd69和cd25的增加。在类似的实验中,评估了每个t细胞亚群(cd4和cd8)杀死靶细胞的能力。根据制造商的方案,通过使用cd4t细胞分离试剂盒的阳性选择从cd3纯化的细胞中提取cd4+t细胞,其中cd8细胞在未选择的流过物中。在u形底96孔板的孔中,将7,000个dld与35,000个cd4+或cd8+t细胞与300ng/ml对照或epcambite共培养,并且在37℃孵育。24小时后,采集上清液,并且通过ldh细胞毒性测定法测量靶细胞细胞毒性(图16b)。结果示出了epcambite诱导cd4+和cd8+t细胞以杀死dld细胞。实例10表征fapbite介导的原发性恶性腹水自体肿瘤相关淋巴细胞的活化为了使用癌症患者衍生细胞评估bite蛋白的活性,获得含有cd3+t细胞和fap+细胞的原发性恶性腹水液样品用于测试。在500ng/ml对照或fapbite存在下,在100%腹水液或补充有1%人类血清的培养基中,将未纯化的腹水细胞(因此从接收时保持不变)以每孔250,000个细胞接种于u形底96孔板中。未处理的孔用作阴性对照。在37℃孵育5天后,采集总细胞群并且确定cd3+t细胞的数量(图17a)和cd3+t细胞上cd25的表达水平(图17b)。使用精密计数珠确定每孔的总细胞数。结果证明,fapbite导致癌症患者的肿瘤相关t细胞的t细胞活化显著增加。作为上述实验的延伸,采集重复孔并且通过流式细胞术确定fap+细胞的数量(图17c)。使用精密计数珠确定每孔的总细胞数。结果示出了fapbite导致腹水样品中自体fap表达细胞数量的显著减少。实例11使用下文所描述的方法工程化、产生和纯化表达重组bite的enad病毒。表达bite的enadenotucirev的生成enad是能够进行复制的嵌合b组腺病毒,在e2b区含有ad3的频繁非同源核苷酸取代ad11p,几乎完整的e3缺失和较小的e4缺失定位于e4或f4(kuhn等人,定向进化生成用于治疗结肠癌的新型溶瘤病毒,《公共科学图书馆期刊(plosone)》,2008年6月18日;3(6):e2409)。本研究中使用的腺病毒基因组的示意图显示在图18a中。通过直接插入编码epcambite(seqidno:1)、fapbite(seqidno:3)或对照bite(seqidno:5)的盒,质粒penad2.4用于生成质粒penad2.4-cmv-epcambite、penad2.4-sa-epcambite、penad2.4-cmv-fapbite、penad2.4-sa-fapbite、penad2.4-cmv-对照bite、penad2.4-sa-对照bite(表4)。转基因盒含有5'短剪接受体序列(seqidno:33)或外源cmv启动子(seqidno:31)、epcam、fap或对照bitecdna序列和3'多聚腺苷酸化序列(seqidno:32)。通过dna测序确认质粒的构建。外源cmv启动子具有组成型活性,并且因此导致转基因的早期表达。剪接受体序列在病毒主要晚期启动子的控制下驱动表达,并且在病毒基因组复制开始后导致后来的转基因表达。此启动子驱动的表达的动力学可以在图18b中观察到,其中gfp用作转基因。表4质粒id[质粒dna]ng/mlpenad2.4-cmv-epcambite205.3penad2.4-sa-epcambite325.2penad2.4-cmv-fapbite1322.8penad2.4-sa-fapbite3918.3penad2.4-cmv-对照bite189.1penad2.4-sa-对照bite236.2penad2.4-cmv-fapbite-rfp1599penad2.4-sa-fapbite-rfp1872penad2.4-cmv-对照bite-rfp1294penad2.4-sa-对照bite-rfp2082病毒生产和表征质粒enad2.4-cmv-epcambite、penad2.4-sa-epcambite、penad2.4-cmv-fapbite、penad2.4-sa-fapbite、penad2.4-cmv-对照bite、penad2.4-sa-对照bite为通过用酶asci限制性消化来线性化以产生线性病毒基因组。通过异丙醇提取纯化消化的dna,并且在300μl>95%分子生物级乙醇和10μl3m乙酸钠中于-20℃沉淀16小时。通过在14000rpm离心5分钟沉淀析出的dna,并且在500μl70%乙醇中洗涤,然后再次以14000rpm离心5分钟。将干净的dna沉淀空气干燥并且重悬于100μl水中。将6.25μgdna与15.6μl脂质体转染试剂在optimem中混合,并且在室温下孵育20分钟。然后将转染混合物添加到含有生长到80%汇合的ad293细胞的t-25烧瓶中。将细胞与转染混合物在37℃孵育4小时后,向细胞中添加5%co24ml的细胞培养基(dmem高葡萄糖和谷氨酰胺补充有10%fbs),并且将烧瓶在37℃,5%co2孵育。每24小时监测转染的ad293细胞,并且每48小时到72小时补充额外的培养基。通过观察细胞单层中的显著细胞病变效应(cpe)来监测病毒的产生。一旦观察到广泛的cpe,通过三次冻融循环从ad293细胞采集病毒。通过连续稀释采集的溶解物并且重新感染ad293细胞,并且采集含有单个噬菌斑的孔来选择单个病毒克隆。一旦感染达到完全cpe,就进行ad293细胞的连续感染,以便扩增病毒原种。通过观察细胞单层中的显著cpe证实扩增期间活病毒的产生。病毒纯化一旦扩增有效的病毒原种,通过双氯化铯密度梯度离心(条带化)纯化病毒以产生ng-601、ng-602、ng-603、ng-604、ng-605和ng-606病毒原种。按照制造商的说明,通过micobca测定(生命技术公司(lifetechnologies))滴定这些原种(表5)。表5实例12使用下文所描述的方法表征ng-601、ng-602、ng-603、ng-604、ng-605和ng-606病毒的活性。在癌细胞系中与enad相比编码enad活性的bite的表征通过感染a549肺癌细胞分析ng-601、ng-602、ng-603、ng-604、ng-605、ng-606或enad复制的能力,并且通过qpcr评估。将a549细胞以2×105个细胞/孔的细胞密度接种在24孔板的孔中。将板在37℃、5%co2下孵育18小时,然后将细胞用每个细胞100个病毒颗粒(ppc)感染或保持未感染。感染后24小时、48小时或72小时采集孔,并且使用purelink基因组dna微型试剂盒(英杰公司)根据制造商的方案纯化dna。使用表6中详述的反应混合物中的enad六邻体基因特异性引物-探针组,通过qpcr对每种提取的样品或标准物定量总病毒基因组。按照表7中的程序执行qpcr。表6试剂体积/孔(μl)2×qpcrbio探针混合物(pcrbiosystems)10enad正向引物0.08enad反向引物0.08enad探针0.8nfw4.04样品5孔体积20表7对每个细胞检测到的病毒基因组数量的定量证明ng-601、ng-602、ng-603、ng-604、ng-605、ng-606和enad病毒复制在a549细胞系中具有可比性(图19a)。通过感染a549评估ng-601、ng-602、ng-603、ng-604、ng-605、ng-606或enad的溶瘤活性(图19b)。将a549细胞以1.5×104个细胞/孔的细胞密度接种在96孔板中。将板在37℃、5%co2下孵育18小时,然后用增加的ppc病毒(5倍连续稀释,4.1×10-7到5000病毒ppc)感染细胞或者保持未感染。在第5天通过celltiteraqueous单溶液细胞增殖测定试剂盒(celltiteraqueousonesolutioncellproliferationassay)(mts)(普洛麦格公司(promega),#g3582)测量a549细胞毒性。使用集成到graphpadprism中的四参数非线性拟合模型拟合剂量应答曲线。为每种病毒生成的ic50值证明ng-601、ng-602、ng-603、ng-604、ng-605、ng-606和enad的溶瘤活性对于每种病毒具有可比性。从ng-601、ng-602、ng-603、ng-604、ng-605、ng-606确认功能性bite转基因表达为了确定病毒ng-601、ng-602、ng-605、ng-606是否产生功能性bite,使用cho、cho-epcam和cho-fap细胞系作为靶细胞执行t细胞活化测定。将10,000个靶细胞与50,000个cd3+t细胞在u-底96孔板的孔中共培养,其中ad293病毒上清液在培养基中稀释100倍并且在37℃、5%co2下孵育24小时。采集t细胞并且用对cd25和cd69具有特异性的抗体染色,并且通过流式细胞术分析。结果(图20a和图20b)指示病毒ng-601和ng-602表达功能性bite转基因,当与cho-epcam细胞共培养时,所述功能性bite转基因活化t细胞,并且ng-605和ng-606表达功能性bite转基因,当与cho-fap细胞共培养时活化t细胞,但与cho细胞共培养时不活化t细胞。结肠癌细胞系中bite表达的定量评估了ng-601、ng-602、ng-605、ng-606感染人类结肠癌细胞系dld的bite表达的量。将dld细胞以每孔1.2×106个细胞的密度接种在6孔培养板中。接种后18小时,用100ppc的enad、ng-601、ng-602、ng-603、ng-604、ng-605、ng-606感染dld细胞。将细胞培养72小时,然后从孔中收集上清液并且以1200rpm离心5分钟以去除细胞碎片。然后将澄清的上清液用于杀伤测定,与用已知浓度的重组bite生成的标准曲线相比具有细胞毒性,从而能够确定病毒上清液中bite的量。为了确定从ng-605和ng-606产生的fapbite的量,执行了细胞毒性测定法,其中8,000个nhdf与40,000个cd3+t细胞共培养,并且dld病毒上清液以1/103、1/104和1/105稀释。通过将nhdf和cd3+t细胞与fap或对照bite以10倍连续稀释度从3333到3.33x10-4ng/μl孵育来生成标准曲线。处理后24小时采集上清液,并且通过ldh测定法测量细胞毒性。通过比较病毒上清液的细胞毒性与重组bite标准曲线的细胞毒性来确定表达的bite的量。结果(图21)指示病毒ng-605和ng-606分别产生每百万dld细胞9.8μg和49.2μgfapbite。为了确定从ng-601和ng-602产生的epcambite的量,执行了细胞毒性测定法,其中8,000个dld细胞与40,000个cd3+t细胞共小室培养,并且dld病毒上清液以1/103、1/104和1/105稀释。通过将dld和cd3+t细胞与epcam或对照bite以10倍连续稀释度从3333到3.33x10-4ng/μl孵育来生成标准曲线。处理后24小时采集上清液,并且通过ldh测定法测量细胞毒性(图22)。通过比较病毒上清液的细胞毒性与重组bite标准曲线的细胞毒性来确定表达的bite的量。结果指示病毒ng-601和ng-602分别产生每百万dld细胞165μg和50.3μgepcambite。实例13除编码fap或对照bite外,ng-607、ng-608、ng-609、ng-610病毒还携带用于使用荧光显微镜方法观察感染细胞(seqidno:25和26,表4)的红色荧光蛋白(rfp)转基因。使用下文所描述的方法表征这些病毒的功能活性。确认来自ng-607、ng-608、ng-609、ng-610的转基因表达通过感染ad293细胞评估病毒ng-607、ng-608、ng-609和ng-610产生其bite转基因的能力。将ad293细胞以1×106个细胞/孔接种在6孔板中。将板在37℃、5%co2下孵育24小时,然后将细胞用100ppc的病毒感染或保持未感染。在感染后48小时,用荧光汞灯照射噬菌斑并且拍照(图23)。结果表明病毒ng-607、ng-608、ng-609和ng-610表达rfp转基因。实例14在接下来的一系列实验中,评估了enad和fap或对照bite病毒ng-603、ng-604、ng-605、ng-606、ng-607、ng-608、ng-609、ng-610杀死包含肿瘤细胞和成纤维细胞的靶细胞的能力。在第一项研究中,使用xcelligence技术评估enad杀死dld细胞的能力。将dld细胞以1.2×104个细胞/孔接种在48孔e-板中,并且在37℃、5%co2下孵育18小时,然后用100enadppc感染细胞或保持未感染。xcelligence用于在8天的孵育期间每15分钟测量靶细胞的细胞毒性。结果(图24a)表明enad能够在所述时间段内有效杀死dld细胞。在类似的实验中,使用xcelligence技术评估enad杀死skov细胞的能力。将skov细胞以1×104个细胞/孔接种在48孔e-板中,并且在37℃、5%co2下孵育18小时,然后用100enadppc感染细胞或保持未感染。xcelligence用于在8天的期间每15分钟测量靶细胞的细胞毒性。结果(图24b)表明skov细胞在此时间范围内对enad介导的细胞毒性具有抗性。在类似的实验中,使用xcelligence技术乙酰酒石酸铝还评估了enad杀死nhdf细胞的能力。将nhdf细胞以4×103个细胞/孔接种在48孔e-板中,并且在37℃、5%co2下孵育18小时,然后用100enadppc感染细胞或保持未感染。xcelligence用于在与a549和skov细胞相同的时间段内每15分钟测量靶细胞的细胞毒性。结果(图24c)表明enad在观察到的时间段内不能杀死nhdf细胞。在类似的实验中,使用xcelligence在与skov肿瘤细胞和cd3+t细胞的共培养中评估ng-603、ng-604、ng-605、ng-606和enad杀死nhdf细胞的能力。将nhdf细胞和skov细胞分别以4×103和1×103个细胞/孔接种在48孔e板中。将板在37℃、5%co2下孵育18小时,然后用100ppc的ng-603、ng-604、ng-605或ng-606的enad感染细胞或保持未感染。孵育2小时后,向每个孔中添加37,500个cd3+t细胞。xcelligence用于每15分钟测量靶细胞的细胞毒性。结果(图25a)证明表达fapbite的病毒ng-605和ng606,但不是enad或表达对照bite的病毒ng-603和ng-604,能够诱导nhdf细胞的溶解,其中动力学依赖于用于bite表达的启动子(cmv启动子更快)。在类似的实验中,使用ldh细胞毒性测定法在与skov和cd3+t细胞的共培养中评估ng-603、ng-604、ng-605、ng-606和enad杀死nhdf细胞的能力。将nhdf细胞和skov细胞分别以8×103和2×103个细胞/孔接种于96孔u形底板中,并且用100ppc的ng-603、ng-604、ng-605或ng-606的enad感染细胞或保持未感染。孵育2小时后,向每个孔中添加75,000个cd3+t细胞,并且将板在37℃、5%co2下孵育。在处理后0小时、24小时、48小时和96小时采集上清液,并且通过ldh细胞毒性测定法测量细胞毒性。结果(图25b)证明表达fapbite的病毒ng-605和ng606,但不是enad或表达对照bite的病毒ng-603和ng-604,能够诱导nhdf细胞的溶解,其中动力学依赖于用于bite表达的启动子。作为上述ldh实验的延伸,还在处理后0小时、24小时、48小时和96小时采集细胞,用cd45、cd69和cd25的抗体染色并且通过流式细胞术分析。结果(图26)证明表达fapbite的病毒ng-605和ng-606,但不是enad或表达对照bite的病毒ng-603和ng-604,能够诱导t细胞活化,其中动力学依赖于用于bite表达的启动子。在类似的实验中,评估了对fap诱导fapbite介导的t细胞活化的依赖性。在96孔u型底的板中,skov细胞以2×103个细胞/孔单独地或与nhdf细胞组合在8×103个细胞/孔接种。将病毒颗粒以100ppc添加到每个孔中,并且将板在37℃、5%co2下孵育。两小时后,添加75,000个cd3+t细胞,并且进一步孵育板。在感染后96小时,采集细胞并且染色cd45和cd25并且通过流式细胞术分析(图27a)。结果证明,表达fapbite的病毒ng-605和ng-606仅在fap阳性nhdf细胞存在下诱导t细胞活化。在类似的实验中,进一步研究了ng-605和ng-606中启动子(cmv或病毒mlp/sa)驱动的bite表达的特异性。在96孔u形底板中,以4×103个细胞/孔接种nhdf细胞。每孔添加100个病毒颗粒,并且将板在37℃、5%co2下孵育。两小时后,添加40,000个cd3细胞并且进一步孵育板。在感染后72小时,采集上清液并且通过ldh细胞毒性测定法测量细胞毒性。结果(图27b)证明cmv驱动的病毒ng-605,但不是sa驱动的ng-606,能够在单独感染nhdf细胞时介导nhdf细胞的杀伤。结果指示ng-605和ng-606均能够诱导t细胞活化和靶细胞溶解,尽管动力学特征根据所使用的启动子略有不同。获得间隔拍摄视频以通过重组fapbite、enad、ng-603或ng-605观察病毒或t细胞介导的靶细胞溶解。用celltrackerorangecmtmrdye(生命技术公司,#c2927)染色nhdf细胞,并且按照制造商的方案用celltrace紫细胞增殖试剂盒(celltracevioletcellproliferationkit)(生命技术公司,#c34557)染色cd3+t细胞。将染色的nhdf以7.5×103个细胞/孔接种在24孔板中,与1.35×104dld或skov肿瘤细胞共培养。将板在37℃、5%co2下孵育18小时。然后用300ng/mlfapbite处理细胞或用100ppc的enad、ng-603和ng-605感染细胞或保持不处理。孵育两小时后,除了1.5μmcellevent半胱天冬酶3-7试剂(生命技术公司,#c10423)之外,将100,000个染色的cd3+t细胞添加到必要的孔中。在nikonte2000-eeclipse倒置显微镜上获得视频,每15分钟捕获图像,持续96小时。在图28中示出了视频中的帧。结果示出了重组fapbite和ng-605,但不是enad或ng-603,能够诱导nhdf细胞的快速溶解。在类似的实验中,用celltrackergreencmfdadye(生命技术公司,#c2925)染色nhdf细胞,并且按照制造商的方案用celltrace紫细胞增殖试剂盒(celltracevioletcellproliferationkit)(生命技术公司,#c34557)染色cd3+t细胞。将染色的nhdf以7.5×103个细胞/孔接种在24孔板中,与1.35×104dld或skov肿瘤细胞共培养。将板在37℃、5%co2下孵育18小时。然后用100ppc的ng-607、ng-608、ng-609或ng-610感染细胞或保持未感染。孵育两小时后,将100,000个染色的cd3+t细胞添加到必要的孔中。在nikonte2000-eeclipse倒置显微镜上获得视频,每15分钟捕获图像,持续96小时。在图29中示出了视频中的帧。结果示出了所有病毒都导致肿瘤细胞感染(rfp,红色荧光,阳性),但只有ng-609和ng-610能够诱导共培养的nhdf细胞快速溶解。实例15在此系列实验中,评估了enad和epcam或对照bite病毒ng-601、ng-602、ng-603和ng-604杀死包含肿瘤细胞和成纤维细胞的靶细胞的能力。通过enad、ng-601、ng-602、ng-603和ng-604对人类t细胞活化和epcam阳性靶细胞溶解的表征使用xcelligence技术评估enad和ng-601、ng-602、ng-603和ng-604在存在或不存在cd3+t细胞的情况下杀死dld肿瘤细胞的能力。将dld细胞以1.2×104个细胞/孔接种在48孔e板中。将板在37℃、5%co2下孵育18小时,然后将细胞用100ppc的enad感染或保持未感染。感染后两小时,将75,000个cd3+t细胞添加到必要的孔中。xcelligence用于每15分钟测量靶细胞的细胞毒性。结果(图30)证明ng-601和ng-602以t细胞依赖性方式导致显著更快的dld细胞毒性。在类似的实验中,使用ldh细胞毒性测定法评估enad和ng-601、ng-602、ng-603和ng-604在存在或不存在cd3+t细胞的情况下杀死dld肿瘤细胞的能力。将dld细胞以2×104个细胞/孔接种在96孔u形底板中,并且用100ppcenad感染细胞或保持未感染。感染后两小时,将150,000个cd3+t细胞添加到必要的孔中。将板在37℃、5%co2下孵育并且采集上清液,并且在感染后0小时、24小时、48小时和72小时通过ldh细胞毒性测定法进行分析。结果(图31)证明ng-601和ng-602以t细胞依赖性方式导致更快的dld细胞毒性。作为上述ldh实验的延伸,还在处理后0小时、24小时、48小时和96小时采集细胞,用cd45、cd69和cd25的抗体染色并且通过流式细胞术分析以确定cd3+t细胞的活化状态。结果(图32)证明表达epcambite的病毒ng-601和ng-602,但不是enad或表达对照bite的病毒ng-603和ng-604,能够诱导t细胞活化,其中动力学依赖于用于bite表达的启动子。在另一个实验中,使用xcelligence技术评估ng-601在存在或不存在cd3+t细胞的情况下以不同的感染复数(moi)杀死dld肿瘤细胞的能力。将dld细胞以2×104个细胞/孔接种在48孔e板中。将板在37℃、5%co2下孵育18小时,然后用moi(ppc)的ng-601感染细胞,其变化范围为0.001到10或保持未感染。感染后两小时,将150,000个cd3+t细胞添加到必要的孔中。xcelligence用于每15分钟测量靶细胞的细胞毒性。结果(图33)证明,在moi低至0.001时,ng-601以t细胞依赖性方式导致更快的dld细胞毒性。在类似的实验中,使用xcelligence技术评估enad和ng-601、ng-602、ng-603和ng-604在存在或不存在cd3+t细胞的情况下杀死skov肿瘤细胞的能力。将skov细胞以1×104个细胞/孔接种在48孔e板中。将板在37℃、5%co2下孵育18小时,然后用enad(100ppc)感染细胞或保持未感染。感染后两小时,将50,000个cd3+t细胞添加到必要的孔中。xcelligence用于每15分钟测量靶细胞的细胞毒性。结果(图34)表明skov细胞在本研究的时间范围内对enad介导的细胞毒性具有抗性,然而ng-601和ng-602能够在cd3+t细胞存在下诱导skov细胞的快速溶解。在类似的实验中,使用ldh细胞毒性测定法评估enad和ng-601、ng-602、ng-603和ng-604在存在或不存在cd3+t细胞的情况下杀死skov细胞的能力。将skov细胞以2×104个细胞/孔接种在96孔u形底板中,并且用enad(100ppc)感染细胞或保持未感染。感染后两小时,将150,000个cd3+t细胞添加到必要的孔中。将板在37℃、5%co2下孵育并且采集上清液,并且在感染后0小时、24小时、48小时和72小时通过ldh细胞毒性测定法进行分析。结果(图35)与先前的数据一致并且表明skov细胞在此时间范围内对enad介导的细胞毒性具有抗性,然而ng-601和ng-602能够在cd3+t细胞存在下诱导skov细胞的快速溶解。作为上述ldh实验的延伸,还在处理后0小时、24小时、48小时和96小时采集细胞,用cd45、cd69和cd25的抗体染色并且通过流式细胞术分析以确定cd3+t细胞的活化状态(图36)。结果证明表达epcambite的病毒ng-601和ng-602,但不是enad或表达对照bite的病毒ng-603和ng-604,能够诱导t细胞活化,其中动力学依赖于用于bite表达的启动子。在类似的实验中,评估了enad和ng-601、ng-602、ng-603和ng-604从cd3+epcam阴性的原发性腹水样品中活化癌症患者来源的cd3+t细胞的能力。将epcam阳性dld细胞以每孔1×104个细胞接种在96孔u形底板中,并且与100,000个腹水细胞共培养(在接收时保持不变)。细胞用100ppc的病毒颗粒感染或保持未感染。在37℃下孵育48小时后,采集总细胞群并且通过流式细胞术确定cd3+t细胞上cd25的表达水平。结果(图37)证明表达epcambite的病毒ng-601和ng-602,但不是enad或表达对照bite的病毒ng-603和ng-604,能够诱导患者来源的cd3+t细胞的t细胞活化。结果指示,epcambite病毒ng-601和ng-602均能够诱导t细胞活化和靶细胞溶解,尽管动力学特征根据所使用的启动子略有不同。获得间隔拍摄视频以通过重组epcambite、enad、ng-601或ng-603观察病毒或t细胞介导的靶细胞溶解。用celltrackerorangecmtmrdye(生命技术公司,#c2927)染色nhdf细胞,并且按照制造商的方案用celltrace紫细胞增殖试剂盒(celltracevioletcellproliferationkit)(生命技术公司,#c34557)染色cd3+t细胞。将染色的nhdf以7.5×103个细胞/孔接种在24孔板中,与1.35×104dld或skov肿瘤细胞共培养。将板在37℃、5%co2下孵育18小时。然后用300ng/mlepcambite处理细胞或用100ppc的enad、ng-601或ng-603感染细胞或保持不处理。孵育两小时后,除了1.5μmcellevent半胱天冬酶3-7试剂(生命技术公司,#c10423)之外,将100,000个染色的cd3+t细胞添加到必要的孔中。在nikonte2000-eeclipse倒置显微镜上获得视频,每15分钟捕获图像,持续96小时。在图38中示出了视频中的帧。结果示出了重组epcambite和ng-605导致dld和skov靶细胞的快速溶解,但nhdf保持不受影响。实例16在此实例中,评估了enad、ng-603、ng-604、ng-605和ng-606对来自癌症患者的fap+原发性恶性腹水的自体肿瘤相关淋巴细胞的活化。被认为适合进一步分析的患者样品是含有cd3+t细胞和fap+细胞的样品。在第一个实验中,将来自患者的未纯化(因此从接收时保持不变)腹水细胞以每孔250,000个细胞接种于100%腹水液中的u形底96孔板中。用100ppc的病毒感染细胞,未处理的孔用作阴性对照。enad-cmv-gfp和enad-sa-gfp还作为报道基因包含在实验中,并且分别用于确定感染和晚期病毒基因表达,显微照片如图39所示。在37℃孵育5天后,采集总细胞群并且确定cd3+t细胞上cd25的表达水平(图40a)。使用精密计数珠确定每孔的总细胞数。结果证明fapbite病毒ng-605和ng-606导致肿瘤相关淋巴细胞的t细胞活化显著增加。作为上述实验的延伸,采集重复孔并且通过流式细胞术确定内源性fap+细胞的数量。使用精密计数珠确定每孔的总细胞数。结果(图40b)示出了ng-605和ng-606导致腹水样品中表达自体fap细胞数量的显著减少,表明一些fap+细胞已经被活化的t细胞杀死。在第二个实验中,在100%腹水液或补充有1%人类血清的培养基中,将来自癌症患者的未纯化(因此从接收时保持不变)腹水细胞以每孔250,000个细胞接种于u形底96孔板中。用100ppc的病毒感染细胞,未处理的孔用作阴性对照。还包含enad-cmv-gfp和enad-sa-gfp作为报道基因以分别用于确定感染和晚期病毒基因表达,显微照片如图41所示。在37℃下孵育5天后,采集总细胞群并且确定cd3+t细胞的数量(图42)和cd3+t细胞上cd25的表达水平(图43)。使用精密计数珠确定每孔的总细胞数。结果证明,对于此患者,重组fapbite和ng-605而非ng-606导致培养基中肿瘤相关淋巴细胞的t细胞活化显著增加。这两种病毒都没有导致腹水液中的活化。作为上述实验的延伸,采集重复孔并且通过流式细胞术确定fap+细胞的数量(图44)。使用精密计数珠确定每孔的总细胞数。结果证明,重组fapbite和ng-605而非ng-606导致培养基中表达自体fap细胞数量的显著减少。两种病毒均未导致腹水液中fap+细胞减少。实例17-材料和方法细胞系hek293a、dld、skov3、mcf7、a431、a549和pc3细胞(atcc)在杜氏改良的伊格尔氏培养基(dulbecco'smodifiedeagle'smedium)(dmem,西格玛奥德里奇公司,英国)和在洛斯维·帕克纪念研究所(roswellparkmemorialinstitute)(rpmi-1640,西格玛奥德里奇公司,英国)的cho细胞(atcc)中培养。生长培养基补充有10%(v/v)胎牛血清(fbs,gibco公司,英国)和1%(v/v)青霉素/链霉素(10mg/ml,西格玛奥德里奇公司),并且细胞维持在37℃和5%co2的潮湿气氛中。对于病毒感染和病毒质粒转染,将细胞维持在补充有2%fbs的dmem中。对于重组bite质粒转染,将细胞维持在不含fbs的dmem中。通过流式细胞术确定靶细胞系的epcam表达。表达epcam的稳定的细胞系的生成从ncbi数据库和dna获得epcam基因的蛋白质序列(id:4072)由牛津遗传学有限公司(英国牛津)合成。通过标准克隆技术将epcam基因克隆到psf-lenti载体中,产生psf-lenti-epcam载体。使用lipofectamine2000与慢病毒epcam表达载体以及psf-cmvhiv-gag-pol、psf-cmv-vsv-g、psf-cmv-hiv-rev(牛津遗传学有限公司)一起转染hek293t细胞。48小时后采集含有慢病毒的上清液并且与聚凝胺(8μg/ml)混合。将慢病毒/聚凝胺混合物添加到cho细胞中并且在37℃下孵育。在第4天,将上清液更换为含有7.5μg/ml嘌呤霉素的培养基。然后克隆选择稳定的变体,并且通过用epcam或同位素对照抗体的抗体染色确定亲本细胞系或稳定转染的变体的epcam表达,并且通过流式细胞术分析。扩增阳性克隆并且用于进一步的实验。外周血单个核细胞(pbmc)的制备和t细胞分离通过密度梯度离心(boyum公司,1968)从获得自英国国家医疗服务系统血液与移植管理处(英国牛津)的全血白细胞锥体中分离pbmc。用pbs将血液1:2稀释并且分层到ficoll(1,079g/ml,淋巴细胞分离液,gehealthcare公司)上,然后在22℃以低减速度以400g离心30分钟。离心后,收集pbmc并且用pbs洗涤两次(300g,室温下10分钟),并且重悬于补充有10%fbs的rpmi-1640培养基中。为了从pbmc中提取cd3阳性t细胞,根据制造商的方案,使用pant细胞分离试剂盒(美天旎生物技术公司,#130-096-535)去除非cd3细胞。为了进一步分离cd4-阳性t细胞和cd8-阳性t细胞,使用cd4+微珠(美天旎生物技术公司,#130-045-101)对cd3t细胞进行另一轮纯化。处理原发性腹水和胸腔积液在患有多种晚期癌症适应症的患者(包括但不限于卵巢癌、胰腺癌、乳腺癌和肺癌)的知情同意下,从牛津大学医院(英国牛津)丘吉尔医院接收到原发性人类恶性腹水和胸腔积液样品。这项工作得到了牛津组织病理学研究中心研究伦理委员会的批准。收到后,分离细胞和液体部分,并且立即使用液体或将等分试样储存在-20℃下以备将来的分析。按照制造商的说明,用红细胞溶解缓冲液(罗氏公司,英国)处理细胞级分。通过台盼蓝染色确定细胞数和活力。通过对epcam、egfr、fap、cd45、cd11b、cd56、cd3、cd4、cd8、pd1和ctla4的抗体染色确定每个样品中存在的细胞类型,并且通过流式细胞术分析。对于离体t细胞活化和靶细胞溶解实验,使用新鲜细胞和液体。在一些情况下,将贴壁细胞在补充有10%fbs的dmem中传代并且扩增以备后用。bite工程化和生产通过将两个具有不同特异性的scfv与灵活的gs连接子连接来生成bite。通过连接子从亲本单克隆抗体连接vh和vl结构域来创建每个scfv。每个bite具有用于哺乳动物分泌的免疫球蛋白轻链(ig)n-末端信号序列和用于检测和纯化的c-末端十八组氨酸亲和标签。通过标准dna克隆技术工程化bite并且将其插入蛋白质表达载体(psfcmv-amp)中,用于巨细胞病毒(cmv)启动子驱动的组成型蛋白质表达和分泌。使用聚乙烯亚胺(pei,线性,mw25000,美国polysciences公司)在以下条件下将psf-cmv-epcambite或psf-cmv-对照bite质粒dna转染到hek293a细胞中,55μg质粒dna:110μgpei(dna:pei比例为1:2(w/w))添加到细胞中,在37℃下孵育4小时,然后用新鲜的无血清dmem替换,并且进一步在37℃、5%co2下孵育48小时。将细胞与psf-cmv-gfp平行转染以确保转染效率。为了采集分泌的蛋白质,收集转染细胞的上清液并且在350g、4℃下离心5分钟以去除细胞组分。将上清液转移到10,000mwcoamiconultra-15离心过滤装置(密理博公司(millipore))中。在4750g和4℃下离心后,用流过物调节渗余物的体积以获得高50倍的浓度。将等分的浓缩蛋白质储存在-80℃。表达bite的enadenotucirev的生成通过使用gibson组装技术将编码epcambite或对照bite的转基因盒直接插入碱性enad质粒penad2.4中,生成质粒penad2.4-cmv-epcambite、penad2.4-sa-epcambite、penad2.4-cmv-对照bite、penad2.4-sa-对照bite。转基因盒含有5'短剪接受体序列或外源cmv启动子,随后是epcam或对照bitecdna序列和3'多腺苷酸化序列。在图18中示出了插入的转基因盒的示意图。通过dna测序确认质粒的正确构建。在转染hek293a细胞之前,通过用酶asci进行限制性消化来线性化质粒enad2.4-cmv-epcambite、penad2.4-sa-epcambite、penad2.4-cmv-对照bite和penad2.4-sa-对照bite。通过观察细胞单层中的细胞病变效应(cpe)来监测病毒的产生。一旦观察到广泛的cpe,通过三次冻融循环从hek293a细胞采集病毒。通过连续稀释采集的溶解物并且重新感染hek293a细胞,并且采集含有单个噬菌斑的孔来选择单个病毒克隆。一旦感染达到完全cpe,就进行hek293a细胞的连续感染,以便扩增病毒原种。一旦扩增有效的病毒原种,通过双氯化铯条带纯化病毒以产生enad-cmvepcambite、enad-sa-epcambite、enad-cmv-对照bite、enad-sa-对照bite病毒原种。根据制造商的说明,通过tcid50和picogreen测定(生命技术公司)滴定这些原种。上清液的制备为了评估bite介导的细胞因子释放,将dld细胞(20,000)在单独的96孔平底板或2ng/μlepcam或对照bite中接种100,000个cd3+t细胞。在37℃和5%co2下孵育48小时后,收集上清液,通过离心去除细胞组分,并且将等分试样储存在-20℃。为了评估来自重组病毒的bite转基因表达,用enad-cmv-epcambite、enad-sa-epcambite、enad-cmv对照bite、enad-sa-对照bite或enad以100vp/细胞感染hek293a(1e6)或dld细胞(1.2e6)。将细胞培养72小时,此时推进细胞病变效应(cpe)。收集上清液并且以300g离心5分钟,以去除细胞碎片并且储存在-20℃下用于将来的分析。免疫印迹斑点印迹用于测量由质粒转染产生的重组bite的浓度。制备每个bite和蛋白质标准品(10×his标记的(cterminus)人类组织蛋白酶d,biolegend公司,#556704)的两倍系列稀释液。调节蛋白质标准品的摩尔浓度以表示bite浓度为100μg/ml。将两μl每种样品和蛋白质标准物直接施加到硝酸纤维素膜上。将膜空气干燥、封闭并且用α-6xhis(c-末端)抗体(1:5000,克隆3d5,英杰公司,英国,#46-0693)探测以检测c-末端his-标记的蛋白质,然后洗涤和用抗小鼠第二抗体(1:10000,dako公司,#p0161)孵育,并且根据制造商的说明书通过应用supersignalwestdura持久底物(赛默飞世尔科技公司,#34075)进行检测。通过蛋白质印迹分析病毒感染的hek293a细胞的上清液的bite表达。通过sds-page分离上清液,并且根据制造商的方案(bio-rad公司)转移到硝酸纤维素膜上。将膜进一步与上文斑点印迹方案进行相同地处理。酶联免疫吸附测定(elisa)为了评估epcam结合,通过在4℃下用人类epcam/trop-1蛋白(50ng/孔,义翘神州科技有限公司,#10694-h02h-50)涂覆过夜来制备elisa板。将板在环境温度下用5%bsa封闭1小时,然后与稀释的epcambite转染的hek293a上清液、对照bite转染的hek293a上清液和空的psf-cmv载体转染的hek293a上清液(2小时,室温)一起孵育。将板用pbs-t洗涤三次,并且随后在每个将来的结合步骤后洗涤。将板与抗his(c-末端)抗体(1:5000,克隆3d5,#46-0693,英杰公司,英国)在室温下孵育1小时,然后在室温下与hrp缀合的抗小鼠-fc(在pbs/5%牛奶中1:1000,dako公司)孵育1小时。使用3.3.5.5'-四甲基乙二胺(tmb,赛默飞世尔科技公司)执行hrp检测,并且使用终止溶液终止反应。在wallac1420读板器(珀金埃尔默股份有限公司(perkinelmer))上测量450nm处的吸光度。流式细胞术在facscalibur流式细胞术(bd生物科学)上执行流式细胞术分析,并且用flowjov10.0.7r2软件(treestar公司,美国)处理数据。对于不同细胞群的分类,使用对cd45(hi30,biolegend公司)、cd11b(icrf44,biolegend公司)、epcam(9c4,biolegend公司)和fap(427819,r&dsystems公司)具有特异性的抗体。为了分析t细胞群,使用以下与不同荧光团偶联的抗体克隆:cd69(fn50,biolegend公司)、cd25(bc96,biolegend公司)、ifnγ(4s.b3,biolegend公司)、αcd107a抗体(h4a3,biolegend公司)、cd3(hit3a,biolegend公司)、cd4(okt4,biolegend公司)、cd8a(hit8a,biolegend公司)、pd1(h4a3,biolegend公司)。在每种情况下,使用适当的同种型对照抗体。表征人类t细胞活化cd69和cd25表达水平通过cd69和cd25的表面表达评估重组epcambite或epcambite病毒诱导t细胞活化的能力。来自pbmc或腹水样品的人类cd3细胞(在96孔平底板中75,000个细胞/孔)在单独培养基、epcam或对照bite蛋白(2ng/μl)或重组病毒(100vp/细胞)的存在下单独或与dld、skov、cho、choepcam或腹水靶细胞(15,000)一起培养。在一些情况下,添加抗pd1(invivogen公司,#hpd1ni-mab7)抗体,终浓度为2.5μg/ml。将cd3细胞与cd3/cd28磁珠(dynabeads)(赛默飞世尔科技公司,#11131d)一起孵育,作为t细胞活化的阳性对照。除非另有说明,否则将细胞在37℃下培养24小时,并且随后用无酶细胞解离缓冲液(gibco公司,#13151014)采集。用cd69、cd25、cd3、cd4或cd8表面表达抗体对总细胞进行染色,并且通过流式细胞术分析。通过与rpmi-1640中的板固定的cd3抗体(7.5μg/ml,hit3a,biolegend公司,#300313)或从恶性腹水样品中分离的液体一起孵育,通过多克隆活化cd3纯化的pbmc(100,000)来研究腹水液对t细胞活化(cd69、cd25)的影响。ifnγ表达通过ifnγ表达,通过将t细胞与dld细胞共培养6小时来评估epcambite诱导t细胞活性的能力(在平底96孔板中,200,000个cd3细胞/孔、40,000个dld细胞/孔)和2ng/μl重组epcam或对照bite。作为阳性对照,用可溶性pma/离子霉素细胞活化混合物(biolegend公司,#423301)刺激t细胞。在采集前5小时将布雷菲德菌素a(golgiplug,bd生物科学)添加到培养基中,此时采集cd3+t细胞并且细胞内染色ifnγ表达并且通过流式细胞术分析。t细胞增殖为了研究t细胞增殖,将100,000cfse标记的(celltracecfse试剂盒,英杰公司,#c34554)cd3+t细胞与具有2ng/μlepcam或对照bite的96孔板形式的20,000个dld细胞一起孵育。共培养后五天,对细胞进行cd3,cd4或cd8染色,并且通过流式细胞术测量活cd3+t细胞的cfse荧光,使用精确计数珠标准化总细胞数(5000/孔,biolegend公司,#424902)。使用flowjov7.6.5软件的增殖功能分析和建模荧光数据。数据表示为进入增殖周期的原始细胞的百分比(%除以)或原始种群中的细胞经历的平均细胞分裂数(分裂指数)。cd107a脱粒在单独培养基或2ng/μl对照或epcambite存在下,将dld细胞(15,000细胞/孔)与平底96孔板中的75,000个cd3+t细胞共培养。将αcd107a或同种型对照抗体直接添加到培养基中。在37℃和5%co2下孵育1小时后添加莫能菌素(golgistop,bd生物科学),然后进一步孵育5小时。随后采集细胞,染色cd3、cd4或cd8并且通过流式细胞术分析。细胞因子释放按照制造商的说明使用legendplex人类t辅助细胞因子面板(legendplexhumanthelpercytokinepanel)(biolegend公司,#740001)和流式细胞术定量从dld/pbmc或胸腔积液细胞培养物中采集的上清液中的细胞因子。分析中包含的细胞因子是il-2、il-4、il-5、il-6、il-9、il-10、il-13、il-17a、il-17f、il-21、il-22、ifnγ和tnfα。体外靶细胞细胞毒性测定通过ldh释放或mts测定评估由重组bite或病毒介导的靶细胞细胞毒性。在单独培养基、稀释的上清液或病毒(100vp/细胞)存在下,将靶细胞(dld、skov、ht-29、a431、a549、pc3、cho、cho-epcam)与cd3、cd4或cd8t细胞(e:t5:1)在平底96孔板中共培养。共培养24小时后(除非另有说明),采集上清液和细胞,并且按照制造商的说明通过ldh测定法(cytotox96非放射性细胞毒性测定,普洛麦格公司,#g1780)或mts活力测定法(celltiter96细胞增殖测定,普洛麦格公司,#g3580)确定细胞毒性。通过比较稀释的病毒上清液诱导的细胞毒性与使用重组bite生成的标准曲线的细胞毒性来确定由病毒感染的dld细胞产生的bite的量。为了评估病毒的溶瘤活性,将dld细胞在37℃和5%co2下接种于96孔板(25,000个细胞/孔)中18小时,然后用增加的vp/细胞(5倍连续稀释,100到5.12e-5vp/细胞)感染或保持未感染。在第5天通过mts活力测定法测量dld细胞毒性。拟合剂量应答曲线并且使用集成到prism7软件(graphpad软件)中的四参数非线性拟合模型确定ic50。使用xcelligencertcadp技术(艾森生物公司(aceabiosciences))实时监测细胞活力。将dld、skov3或mcf7细胞以12,000个细胞/孔接种在48孔e-板中。将板在37℃、5%co2下孵育18小时,然后用bite(2ng/μl)处理细胞或用病毒(100vp/细胞)感染细胞或保持不处理。感染后两小时,将75,000个cd3+细胞添加到必要的孔中。每15分钟测量细胞阻抗,持续时间长达160小时。对于离体细胞毒性测定,将来自腹水或胸腔积液样品的未纯化细胞重新悬浮于腹水液中并且在平底96孔板中铺板(1.5e5/孔)。在37℃、5%co2下孵育所述持续时间后,通过ldh测定分析上清液或通过细胞解离缓冲液采集总细胞,染色cd3、cd25和epcam,并且通过流式细胞术分析。对于pd1阻断实验,包含抗pd1抗体(2.5μg/ml,invivogen公司,#hpd1ni-mab7)抗体。病毒基因组复制和qpcr通过在用100vp/细胞感染之前在24孔板(150,000细胞/孔)中在37℃、5%co2下接种dld细胞18小时来分析enad-cmv-epcambite、enad-sa-epcambite、enad-cmv-对照bite、enad-sa对照bite或enad复制其基因组的能力。感染后24小时和72小时采集孔,并且根据制造商的方案使用purelink基因组dna微型试剂盒(英杰公司,#k182001)纯化dna。使用特异性引物-探针组(引物:tacatgcacatcgccgga/cgggcgaactgcacca,探针:ccggactcaggtactccgaagcatcct),通过针对enad六邻体的qpcr定量总病毒基因组。显微镜在zeissaxiovert25显微镜上捕获明场和荧光图像。获得时间推移视频以通过enad或enad-cmvepcambite观察病毒或t细胞介导的靶细胞溶解。未感染的细胞用作阴性对照。用celltrackerorangecmtmrdye(生命技术公司,#c2927)染色nhdf细胞,并且按照制造商的方案用celltrace紫细胞增殖试剂盒(celltracevioletcellproliferationkit)(生命技术公司,#c34557)染色cd3+细胞。将染色的nhdf以7,500个细胞/孔接种在24孔板中,以13,500个细胞/孔接种在共培养skov3中。将板在37℃、5%co2下孵育18小时。然后用300ng/mlepcambite处理细胞或用100vp/细胞的enad或enad2.4-cmv-epcambite感染细胞或保持不处理。孵育2小时后,除了1.5μmcellevent半胱天冬酶3-7试剂(生命技术公司,#c10423)之外,将100,000个染色的cd3+添加到必要的孔中。在nikonte2000-eeclipse倒置显微镜(10倍光学物镜)上以15分钟的间隔捕获图像,覆盖96小时的期间。使用imagej软件生成延时视频(12帧/秒)。统计在比较两个以上实验条件的所有情况下,使用tukey的posthoc分析的单向anova测试执行统计分析。所有数据都以平均值±sd表示。使用的显著水平是p=0.01-0.05(*)、0.001–0.01(**)、0.0001-0.001(***)。除非另有说明,否则所有体外实验一式三份执行。实例18-靶向epcam的bite的生成和产生通过将对cd3ε和epcam具有特异性的两种scfv与柔性甘氨酸-丝氨酸(gs)连接子连接来工程化靶向epcam的bite。还产生了识别cd3ε和无关抗原(百日咳博德特氏菌的丝状血细胞凝集素粘附素(fha))的对照bite。将两个bite工程化成含有用于哺乳动物分泌的n-末端信号序列和用于检测和纯化的c-末端十八组氨酸亲和标记(图45a)。为了表征重组bite的功能,将其克隆到cmv立即早期启动子(分别为psf-cmv-epcambite和psf-cmv-对照bite)的转录控制下的表达载体中。用表达载体转染贴壁hek293细胞(hek293a),并且采集上清液并且浓缩50倍用于进一步分析。为了估计产生的bite的量,使用抗his,在斑点印迹中使用十八组氨酸标记的组织蛋白酶d作为标准连续稀释和评价样品。通过这种方式,在转染后48小时,可以估计产生于上清液中的bite水平约为20μg/ml(1.8e7hek293a细胞的)(图46a)。通过elisa证明epcambite而非对照bite与重组epcam蛋白的特异性结合(图46b)。实例19-通过重组epcambite表征人类t细胞活化通过将未刺激的人类原代cd3+细胞添加到人类dld结肠直肠癌细胞的培养物中来评估重组epcambite蛋白活化pbmc衍生的t细胞的能力,已知其在其表面上表达epcam(karlsson等人,2008)。添加2.5ng/mlepcambite(作为来自转导的hek293a细胞的上清液)导致t细胞活化标记物cd69和cd25的显著增加(图45b和图45c),而对照bite没有效果。在不存在肿瘤细胞的情况下将cd3细胞暴露于epcambite产生cd69和cd25的非常适度的增加,并且这指示抗体介导的cd3聚集对于通过此抗cd3结合的完全活化是必需的。在肿瘤细胞存在下由epcambite刺激的t细胞还示出了γ干扰素(图45d)和细胞增殖(图45e)的产生显著增加,而对照bite没有效果。t细胞活化的目的是引起脱粒介导的细胞毒性,并且表面cd107a/lamp1的表达(指示脱粒,aktas等人)被epcambite强烈上调,但不受对照的强烈上调(图45f)。通过使用细胞因子珠阵列的流式细胞术表征在dld细胞存在下epcambite介导的pbmc衍生的t细胞活化后细胞因子的释放。如前所述,对照bite示出了很少的活性,尽管epcambite触发了几种细胞因子的释放,包含高水平的il-2、il-6、il-10、il-13、γ干扰素和tnf(图45g)。il-2、γ干扰素和tnf的产生通常与th1应答相关,而il-6和il-10通常与th2应答相关(mosmann&sad,1996)。实例20-重组epcambite的特异性大多数人类上皮细胞表达epcam,因此为了评估epcambite的作用是否具有抗原特异性,使用慢病毒载体工程化中国仓鼠卵巢细胞(cho细胞)以在其表面上表达人类epcam。在存在epcambite和cho-epcam细胞的情况下,外源添加的pbmc衍生的t细胞示出了强烈的活化(通过cd25表达评估,参见图47a)和用亲本cho对照细胞或对照bite未见的相关细胞毒性(图47b)。这指示epcambite的细胞毒性是抗原特异性的。然后,我们评估了epcambite是否会杀死一系列肿瘤细胞,以及观察到的epcambite介导的细胞毒性水平是否依赖于epcam表达的密度。在六种不同的癌细胞系中测量在epcambite存在下t细胞的细胞毒性,在dld和a431中观察到最大的细胞毒性,在a549和pc3中观察到最少的细胞毒性(图47c)。这示出了与epcam的表面水平(通过流式细胞术确定)松散相关,其中a549和pc3细胞示出了最低水平并且dld示出了最高水平(图47d)。这表明epcam表达的存在和水平确实影响细胞毒性的程度,尽管其它因素(可能是细胞对颗粒酶介导的细胞凋亡的内在抗性)还在确定细胞杀伤的总体水平中起作用。实例21-bite介导的cd4+和cd8+t细胞亚群的活化为了确定哪些t细胞类型被epcambite活化,将pbmc衍生的t细胞与dld细胞一起孵育并且在流动分析之前使用bite活化。cd4+和cd8+细胞均示出高水平的cd69和cd25表达(图49a),尽管活化的cd4细胞的百分比通常略高。使用cfse染色评估epcambite介导的t细胞增殖(图49b),并且通过cd197a/lamp1的表达进行脱粒(图49c),并且对于cd4+和cd8+细胞均观察到类似的活化水平。最后,使用epcambite比较实现的肿瘤细胞细胞毒性水平以活化纯化的cd4+和cd8+亚群。所有t细胞制剂示出相似的细胞毒性(图49d),指示cd4+和cd8+细胞均可以促成观察到的bite介导的细胞毒性。实例22-来自溶瘤腺病毒enadenotucirev的epcambite的表达enadenotucirev(enad)是溶瘤腺病毒,b组11型和3型腺病毒的嵌合体,具有镶嵌的e2b区,几乎完整的e3缺失和映射到e4或f4的较小的e4缺失(kuhn,2008)。目前正在进行几项治疗癌症的早期临床试验,所述病毒将良好的全身药代动力学和有前景的临床活性与编码和表达转基因的可能性相结合(calvo2014,boni2014)。使用通过gibson组装插入病毒骨架的穿梭载体,epcambite在紧邻纤维基因下游的enad内编码(图18)。将bite置于cmv立即早期启动子(enad-cmv-epcambite)的转录控制下,或置于腺病毒主要晚期启动子(mlp;enad-sa-epcambite)的剪接受体位点的下游。在前一种配置中,只要病毒成功感染细胞就应表达bite,而mlp剪接受体位点的表达只有在mlp在允许病毒复制的细胞中被活化时才会发生。还引入了对照bite(识别cd3和fha)以创建两种对应的对照病毒。克隆病毒,在hek293a细胞中获救,并且在超滤液中制备大批的病毒,并且通过氯化铯条带纯化两次。用亲本enad和重组bite病毒感染dld在所有测试时间点产生相似量的病毒基因组(通过qpcr测量),指示bite转基因不干扰病毒复制动力学(图51a)。接下来,我们研究了在没有人类t细胞的情况下病毒的复制和溶瘤性质。用增加的病毒颗粒(vp)/细胞的病毒批次感染dld细胞,并且在第5天通过mts测定法测量细胞毒性。由cmv启动子或剪接受体调节的所有重组病毒,包含具有epcam和对照bite的重组病毒,示出了与亲代病毒无法区分的细胞毒活性,显示遗传修饰未改变病毒的内在溶瘤活性(图51b)。为了评估bite表达和分泌,使用表达bite的enad病毒感染hek293a细胞,并且使用抗his抗体通过蛋白质印迹检查72小时上清液。如图51c所示,所有四种病毒(两种表达对照bite和两种表达epcambite)示出了分泌到上清液中的相似水平的bite。实例23-通过病毒产生的epcambite选择性杀死epcam阳性细胞将来自enad-epcambite感染的hek293a细胞的上清液添加到具有或不具有pbmc衍生的t细胞的cho和cho-epcam细胞培养物中;24小时后测量t细胞活化和对cho/cho-epcam细胞的细胞毒性。在cho细胞的情况下,cd25的t细胞表达没有增加(图51d),也没有任何处理观察到的任何细胞毒性(图51e)。然而,使用来自已经用enad-cmv-epcambite或enad-sa-epcambite病毒感染的hek293a细胞的上清液,与cho-epcam细胞一起孵育的t细胞示出了cd25表达显著增加(图51d)。正如预期的那样,只有在已经用enad-cmv-epcambite或enad-sa-epcambite病毒感染的293a细胞的上清液存在下添加t细胞时,这才转化为对cho-epcam细胞的选择性细胞毒性(图51e)。至关重要的是,在没有t细胞的情况下没有细胞毒性,或者当使用来自hek293a的上清液时细胞已经用表达对照bite的enad感染。实例24-表达enad的epcambite的优异细胞毒性enad通过直接溶瘤作用快速杀死大多数癌细胞(kuhn,2008),尽管一些细胞-具体的说skov3卵巢癌细胞-部分抗性并且杀死更慢。因此,我们推断,携带end分泌epcambite,从而导致t细胞的细胞毒活化可能在skov3细胞中特别明显。因此,细胞在接种后24小时暴露于病毒(100vp/细胞),并且通过xcelligence系统监测细胞死亡。2小时后,将pbmc衍生的t细胞添加(或不添加)到skov3细胞培养物中。在不存在t细胞的情况下,肿瘤细胞生长约72小时(由图53a中的细胞指数信号增加表明),但细胞生长然后达到平台并且在不受病毒感染的情况下保持稳定,直至至少160小时。所有测试的病毒,包含亲本enad,在测量的时间内均未诱导可观察到的靶细胞细胞毒性。然而,当与pbmc衍生的t细胞共培养时,cmv和sa-epcambite携带的病毒均诱导快速skov3溶解,cmv驱动的诱导溶解在16小时内,并且sa在添加t细胞后44小时内(图53b)。重要的是,即使添加t细胞,亲本enad或非特异性bite对照病毒在此时间范围内也未显示靶细胞溶解。此结果通过ldh测定证实,其中建立了与上述相同的共培养物,在感染后24小时、48小时和96小时测量细胞毒性(图48)。dld细胞中的类似发现进一步支持了这些结果,其中表达epcambite的病毒以比对照bite病毒显著更快的速率诱导细胞毒性(图50a+图50b)。为了证实靶细胞的细胞毒性是通过t细胞活化介导的,在每个时间点采集cd3细胞,并且通过cd69和cd25表达确定活化状态,从而证明了与细胞毒性观察到的相似的表达动力学(图53c和图53d,图50c和图50d)。通过比较由感染的dld上清液诱导的细胞毒性(abs490)与由已知量的重组bite诱导的细胞毒性(即创建标准曲线(abs490))来确定由感染的dld细胞产生的epcambite的近似量。将与cd3纯化的pbmc(1:5)共培养的dld与重组bite(图50e)或感染的dld上清液(图50f)一起孵育,并且在24小时测量ldh释放,这使我们能够确定epcambite是对于enad-cmv-epcambite和enad-saepcambite,分别以165μg和50μg/百万dld产生。epcambite的ec50为7.4ng/ml(图50e和图50f),并且因此epcambite由重组病毒以可能达到治疗剂量的水平产生。通过时间推移视频显微镜观察表达epcambite的enad的细胞毒性。在半胱天冬酶染色剂存在下(当胱天蛋白酶被活化时,cellevent半胱天冬酶3-7试剂产生绿色染色),将skov3肿瘤细胞(未标记的)与正常人类成纤维细胞(epcam阴性,标记为红色,用作非靶对照细胞)和pbmc衍生的t细胞(标记为蓝色)共孵育。表达epcambite的enad与外源t细胞的组合再次对skov3肿瘤细胞产生显著的细胞毒性,当用enad-cmv-epcambite而不是亲本enad感染时,其显示出强烈的细胞凋亡诱导。重要的是,共培养中的epcam阴性nhdf始终存在。在图53e中示出了来自skov3视频的不同时间点的代表性荧光图像。还示出了显示与nhdf共培养的dld细胞(其本质上对病毒更敏感)的等效时间推移视频。实例25-epcambite可以克服免疫抑制,活化内源性t细胞并且杀死恶性腹膜腹水内的内源性肿瘤细胞将含有epcam阳性肿瘤细胞和原代成纤维细胞(作为对照,非表达epcam的细胞)的恶性腹膜腹水样品的三个临床样品离体扩增,并且将混合的原代细胞群与pbmc衍生的t细胞一起孵育,并且在培养基中用游离bite或100vp/细胞enad-epcambite处理。72小时后,通过流式细胞术测量epcam阳性靶细胞(图55a)或非靶成纤维细胞活化蛋白(fap)阳性成纤维细胞(图55b)的水平。通过测量cd25表达分析t细胞的活化(图55c)。游离epcambite和表达epcambite的病毒诱导t细胞活化,导致epcam阳性肿瘤细胞消耗,原发性fap阳性(epcam阴性)成纤维细胞数量未显示出变化。这在所有患者的样品中都观察得到,并且没有其它治疗示出任何显著效果。这证明epcambite(或编码它的溶瘤病毒)可以介导pbmc衍生的t细胞对人类卵巢腹水肿瘤细胞的活化和选择性细胞毒性。恶性渗出物可能代表具有潜在免疫耐受性的环境,其具有通常在晚期转移性癌症患者中观察到的抑制的免疫应答。为了验证这一假设,我们用培养基中的抗cd3抗体或来自五名腹膜恶性肿瘤患者的100%腹水液进行多克隆刺激的pbmc衍生的t细胞。在rpmi培养基中,抗cd3抗体为cd25和cd69提供了约50%的t细胞阳性,如通过降低的抗体介导的cd69/cd25表达升高所确定的,腹水液的存在似乎减弱了t细胞的活化,并且这对于患者流体#2尤其明显(图56a)。这支持了我们的观点,即腹水液的成分可能发挥免疫抑制或耐受作用。然而,活化标记物增加的这种减弱与t细胞脱粒的抑制无关,其中腹水液中的cd107a外化与培养基中的类似(图56b)。由此可见,bite可能能够绕过肿瘤微环境相关的t细胞免疫抑制机制(nakamura&smyth,2016)。因此,我们研究了pbmc衍生的t细胞和epcambite在免疫抑制性腹水液存在下介导靶细胞细胞毒性的能力。与腹水液1和2一起孵育的t细胞在rpmi培养基中(使用xcelligence测量)诱导与人类乳腺癌mcf7细胞系相似的溶解,尽管在患者腹水液#2存在下细胞毒性显示延迟约8小时(图56c)。除了存在的免疫抑制液和肿瘤细胞外,腹水还含有肿瘤相关的淋巴细胞和肿瘤基质的支持细胞,从而提供了独特的肿瘤样模型系统来测试bite介导的内源性患者来源t细胞的活化。在用游离重组bite孵育总内源细胞和腹水液24小时后,评估患者t细胞的活化(图56d)。在这种高度临床相关的环境中,epcambite(但不是对照组)诱导cd69和cd25表达,尽管当实验在100%腹水中执行时cd25处于较低水平而不是在简单培养基中。这些数据表明,epcambite可以克服腹膜腹水液中至少一些免疫抑制作用来活化内源性t细胞。通过测量ldh的释放来评估细胞毒性,并且当在培养基中以及在100%腹水液中进行实验时,bite引起显著的上升。这指示一些腹水细胞已被bite介导的细胞毒性杀死,尽管鉴于原发性腹水中存在多种细胞类型,但不可能限定杀死肿瘤细胞的比例。实例26-表达epcambite的enad可以活化内源性t细胞以杀死恶性胸膜渗出物中的内源性肿瘤细胞为了研究表达epcambite的病毒在另一个临床相关环境中的作用,我们从一系列恶性肿瘤患者中获得了几个胸膜渗出物样品。在初始筛选时(图52中示出了一个实例),被认为适合进一步分析的样品是含有cd3和epcam阳性细胞的样品。我们还评估了初始分离后内源性t细胞pd1的表达,而只有10%的pbmc衍生的t细胞表达pd1,所有恶性胸腔积液样品t细胞至少40%为pd1阳性并且有时达到高为100%(图54)。在500ng/ml游离epcambite或100vp/细胞病毒编码bite的存在下,将未纯化的总细胞(通过离心和重悬浮分离)在100%胸腔积液中以固定浓度孵育。5天后,采集总细胞群,并且测量cd3+细胞的总数(图57a)。与未处理的对照相比,仅接受游离epcambite或编码epcambite的enad的样品示出了t细胞增殖。这证实了epcambite与epcam靶结合并且交联cd3以刺激内源性t细胞。还确定了cd3细胞上cd25的表达水平(图57b)。游离epcambite诱导所有患者样品中肿瘤相关淋巴细胞的显著t细胞活化(通过cd25表达评估),甚至在胸腔积液的可能的免疫耐受环境中也是如此。在这种情况下,添加抗pd1阻断抗体对epcambite介导的t细胞活化没有影响(图54b和图54c)。患者之间存在显著差异(尽管来自同一患者的样品之间几乎没有变化),依赖于供体的活化范围为50%到90%。类似地,用表达epcambite的enad处理的样品在一些患者中示出了高活化(对于enad-cmv-epcambite和enad-sa-epcambite,范围从10%到20%直到80%)。有趣的是,显示出最低bite介导的活化的患者还示出了最低水平的背景t细胞活化。亲本enad或表达对照bite的enad或游离对照bite在背景上没有引起刺激。我们通过在五天孵育结束时通过流式细胞术测量epcam阳性细胞的残留水平来评估表达bite的病毒介导epcam靶向细胞毒性的能力(图57c)。游离的epcambite和编码epcambite的两种病毒在每种情况下都引起自体epcam表达细胞的显著消耗,而其它处理对epcam阳性细胞的水平几乎没有或没有影响。在样品#1的情况下,与未处理的对照相比,所有基于enad的病毒的存活率略微降低,并且这可能代表直接病毒溶瘤作用的影响。与pd1阻断抗体对t细胞活化缺乏影响相结合,其对epcambite介导的靶细胞杀伤没有影响,在不存在pd1阻断剂的情况下epcam+细胞(患者2、3和4)具有几乎完全细胞毒性(图54d)。亲本enad和enad-cmv-epcambite的不同作用通过图57d中的显微镜显示,其中bite的表达降低肿瘤细胞的存在并且扩增t细胞群。相关的流式细胞术图证实了用表达epcambite的病毒处理后t细胞的显著扩增和活化。最后,通过测量使用legendplex蛋白质阵列产生的关键细胞因子的水平来表征各种处理的效果(图57e)。到目前为止,最大倍数增加的是γ干扰素,在用游离的epcambite或编码epcambite的enad处理后,其增加了近1000倍。这两种治疗还使il-5、il-13、肿瘤坏死因子(tnf)、il17a和il17f的表达增加约10倍,这是活化t细胞的特征。单独的enad(或表达对照bite)还引起γ干扰素的10倍升高,但是在其它方面没有治疗引起细胞因子表达的任何明显变化。实例27-讨论溶瘤病毒提供了一种有趣的新策略,将多种治疗方式结合在一个有针对性的自我放大剂中(keller&bell,2016;seymour&fisher,2016)。由于它们在癌细胞内选择性复制并且在细胞间传播,因此一些溶瘤病毒被认为通过非凋亡性死亡途径介导细胞死亡(ingemarsdotter等人,2010;li等人,2013),这是允许病毒颗粒从垂死细胞中逃逸的过程的一部分。特别地,enad通过称为肿瘤或缺血性细胞死亡的促炎过程杀死细胞(dyer,2017)。这种非凋亡性死亡机制导致几种促炎细胞组分的释放,如atp、hmgb1和钙网蛋白的暴露(称为损伤相关分子模式,damp)(weerasinghe和buja,2012),并且可能是病毒促进有效抗癌免疫应答的能力的关键。然而,除了直接溶解的后果之外,病毒还提供编码和表达其它抗癌生物制剂的潜力,从而避免了递送挑战并且确保生物制剂在肿瘤微环境中达到其最高浓度。imlygic编码gm-csf,然而携带病毒的可能性实际上是无限的,并且提供了许多令人兴奋的机会来设计具有添加的或协同的抗癌作用的多模式治疗策略(degruijl等人,2015;hermiston&kuhn,2002)。在溶瘤病毒中编码bite提供了活化肿瘤浸润淋巴细胞变成细胞毒性和溶解抗原阳性靶细胞的有力手段,从而提供了与直接病毒溶解的效果完全分开的治疗方式。在此研究中,我们已经示出了bite靶向的细胞毒性是完全抗原特异性的,可以由cd4和cd8t细胞介导(brischwein等人,2006),并且可以掺入溶瘤腺病毒中并且仅在允许病毒复制的细胞中表达。此外,目前的研究首次示出了液体癌活组织检查中的内源性t细胞可以被bite和病毒编码的bite活化,并且可以杀死内源性肿瘤细胞而无需任何额外的刺激或逆转免疫抑制。重要的是,这甚至可以在包括腹膜腹水或胸腔积液的微环境的初级流体中发生,作为实体瘤的免疫抑制微环境的替代物。携带溶瘤病毒以表达bite结合了两种截然不同的治疗机制,前者提供允许病毒感染的肿瘤细胞的溶解性死亡,并且后者通过特异性的选择的抗原靶向t细胞细胞毒性。这在治疗方法的设计中提供了相当大的灵活性,可能使用bite向肿瘤相关细胞递送细胞毒性,所述细胞对病毒的直接杀伤具有相对抗性。例如,虽然我们已经使用识别癌相关抗原(epcam)的bite示例了这里的技术,但也可以使用bite方法靶向肿瘤相关成纤维细胞或其它基质细胞的细胞毒性。实际上,即使当bite识别的靶不限于在肿瘤微环境中表达时,通过将bite产生与病毒复制相关联,允许bite的表达在空间上限于肿瘤,从而使全身毒性最小化。这很重要,因为静脉内施用的bite示出了相对短的循环动力学(klinger等人,2012),并且通常与相当大的靶向肿瘤外毒性相关(teachey等人,2013)。先前已经使用具有靶向ephrina2的bite的溶瘤痘苗病毒探索了在溶瘤病毒内编码bite的可能性。此试剂示出了ephrinbite可以在体外和体内介导pbmc的活化和抗原靶向的肿瘤细胞杀伤。有趣的是,虽然bite可以活化t细胞,但是如果不添加外源性il-2,其就不会导致t细胞增殖,而目前研究中使用的bite导致体外pbmc的广泛增殖和使用离体临床活检样品的肿瘤相关淋巴细胞的广泛增殖。我们认为观察到的差异可能反映了不同的bite设计,所使用的不同溶瘤病毒或可能取决于抗原密度,从而在t细胞上产生足够的cd3交联。溶瘤病毒治疗的一个中心目标是创建识别患者特异性新抗原以及“公共”肿瘤相关抗原的抗癌t细胞应答。溶解病毒可以通过在damp背景下溶解肿瘤细胞以及病毒相关病原体相关分子模式(pamp)来刺激改善的抗原呈递来实现这一点。在静脉内递送enad后,切除的结肠肿瘤的免疫组织化学染色表明所述病毒促进cd8+t细胞大量流入肿瘤组织(garcia-carbonero,2017)。然而,尽管这可能是非常有效的方法,但是适应性t细胞应答最终依赖于肿瘤细胞对mhci类抗原的表达,以允许靶向杀伤。mhc表达缺失是充分证明的肿瘤免疫逃避策略(garrido等人,2016)。值得注意的是,由bite携带的溶瘤病毒立即参与的细胞毒性策略由肿瘤细胞独立于mhci类来发挥作用,并且因此即使当肿瘤细胞丧失mhc表达时也可以用于杀死癌细胞。因此,本研究证明在enad内编码bite提供了一种特别有前景的策略,以在扩散的肿瘤中实现靶向表达,利用已知的血液稳定性和病毒的全身生物利用度,这现已经在几个早期临床试验中进行了研究。值得注意的是,在一项在原发性结肠癌切除前几天静脉注射病毒的研究中,随后对肿瘤切片的免疫组织学评估示出了病毒已经通过肿瘤到达区,并且产生强烈的核内六邻体信号,从而指示感染成功并且病毒在肿瘤细胞中选择性复制。这证实了临床前数据(di等人,2014;illingworth,2017),所述数据指示此病毒在100%人类血液中是稳定的,并且应该能够对人类患者的播散性和转移性恶性肿瘤进行肿瘤靶向感染。bite可以由enad编码而没有任何溶瘤毒力的损失(图51b),反映了病毒的相当大的转基因包装能力。转基因的存在不会影响病毒颗粒的物理化学性质,因此经修饰的病毒应该展现出与亲本试剂完全相同的临床药代动力学,并且应该能够在整个身体的肿瘤内选择性地表达经编码bite。这为系统靶向的癌症免疫疗法提供了一种令人兴奋且可能非常有效的新方法,所述癌症免疫疗法现在应优先用于临床评估。实例28患者恶性渗出液对人类t细胞活化和靶细胞细胞毒性的免疫抑制恶性渗出物代表具有潜在免疫耐受性的环境,其具有通常在晚期转移性癌症患者中观察到的抑制的免疫应答。使用人类il-10elisamax试剂盒(biolegend,430604)在正常血清或患者恶性渗出液(a,腹膜腹水;p,胸腔积液)中测量被认为是抗炎细胞因子的il-10的量。渗出液中的il-10水平(88.1pg/ml到633.4pg/ml)远远超过在正常血清中测量的水平(7.2pg/ml到10pg/ml)。参见图58。研究了cd3/cd28珠(gibco,11161d)在正常血清、腹水或胸膜液存在下活化pbmct细胞的能力。在正常血清或患者渗出液(50%)中用cd3/cd28珠(遵循制造商说明书)处理人类pbmct细胞(96孔板中每孔100,000个细胞)。在每种液体中不处理的t细胞作为阴性对照。培养24小时后,采集细胞并且然后通过抗体染色分析cd3+t细胞上cd69和cd25的表达水平,并且将流式细胞术表示为双阳性(cd69+cd25+细胞)的百分比(图59)。在正常血清中,抗cd3/cd28珠产生cd25和cd69双重阳性的约60%的t细胞,而腹水液的存在减弱了6/12液体中的t细胞活化。在类似的实验中,在正常血清、腹水或胸膜液(50%)存在下用cd3/cd28珠处理100,000个t细胞。将抗cd107a或同种型对照抗体直接添加到培养基中。1小时后,根据制造商的说明添加莫能菌素(bdgolgistop,bdbiosciences)。再过5小时后,采集细胞并且通过流式细胞术分析以确定脱粒(图60)。在正常血清中,抗cd3/cd28珠产生约22.5%的t细胞脱粒,而腹水液的存在减弱了10/12液体中的t细胞活化。脱粒水平与每种液体中il-10的量显著相关(pearson系数,r=-0.7645;p=0.0038)(图61)。在类似的实验中,在正常血清、腹水或胸膜液(50%)存在下,将75,000个t细胞与15,000个skov3和epcam共培养。用每种液体中的对照bite处理的t细胞作为阴性对照。培养24小时后,采集细胞并且然后通过抗体染色分析cd3+t细胞上cd69和cd25的表达水平,并且将流式细胞术表示为双阳性(cd69+cd25+细胞)的百分比(图62)。在正常血清中,epcambite给予约67.6%的cd25和cd69双重阳性的t细胞,而腹水液的存在减弱了0/12液体中的t细胞活化,并且在4/10液体中略微诱导活化。在类似的实验中,在正常血清、腹水或胸膜液(50%)存在下,将75,000个t细胞与15,000个skov3和epcam共培养。用每种液体中的对照bite处理的t细胞作为阴性对照。将抗cd107a或同种型对照抗体直接添加到培养基中。1小时后,根据制造商的说明添加莫能菌素(bdgolgistop,bdbiosciences)。再过5小时后,采集细胞并且通过流式细胞术分析以确定脱粒(图63)。在正常血清中,epcambite珠给予约41.4%的t细胞脱粒,而腹水液的存在减弱了2/12液体中的t细胞活化。使用xcelligence技术评估enad-sa-epcambite和enad-sa-对照bite诱导恶性渗出液中t细胞介导的靶细胞溶解的能力。将skov细胞分别以1e4细胞/孔接种在48孔e板中。将板在37℃、5%co2下孵育18小时,然后将细胞用每个细胞100个病毒颗粒(ppc)感染或保持未感染。两小时后,添加正常血清或患者渗出液(最终,50%)中的pbmct细胞(5:1)。xcelligence用于每10分钟测量靶细胞的细胞毒性(图64)。结果表明,t细胞的bite介导的skov3溶解与所使用的液体无关。将未纯化的腹水细胞(因此从接收时保持不变)以每孔100,000个细胞接种于rpmi培养基或腹水液中的平底96孔板中。用epcam或对照bite处理细胞,未处理的孔用作阴性对照。在37℃孵育24小时后,采集细胞并且确定cd3细胞上cd25和cd69的表达水平(图65)。结果证明epcambite导致肿瘤相关淋巴细胞的t细胞活化(cd69/cd25双阳性)显著增加,腹水液略微增加。在类似的实验中,将未纯化的腹水细胞(因此从接收时保持不变)以每孔100,000个细胞接种在rpmi培养基或腹水液中的平底96孔板中。用epcam、对照bite或重组bite病毒(100vp/细胞)处理细胞,未处理的孔用作阴性对照(图66)。在37℃孵育5天后,采集总细胞群,并且确定cd3+细胞的数量(图66a)和cd3细胞上cd25的表达水平(图66b)和通过流式细胞术确定的内源性epcam+细胞的数量(图66c)。使用精密计数珠确定每孔的总细胞数。结果证明epcambite和enad表达epcambite导致肿瘤相关淋巴细胞的t细胞活化(cd3数,cd25)和rpmi培养基和腹水液中epcam+细胞的细胞毒性显著增加。作为上述实验的延伸,在腹水液中相同地处理另外六个患者的渗出物样品(总共7个)(图67),并且通过流式细胞术确定cd3+的数量(图67a)、t细胞的cd25表达(图67b)和epcam+细胞的数量(图67c)。结果示出了epcambite和表达epcambite的enad导致肿瘤相关淋巴细胞的t细胞活化(cd3数,cd25)和epcam+细胞的细胞毒性在一系列渗出活检样品中可重复地显著增加。实例29fapbite通过不同的供体t细胞介导t细胞的活化和fap+细胞的杀伤在其它实验中,与使用抗cd3/cd28磁珠的对照bite和多克隆t细胞活化相比较,使用实例2中描述的方法进一步评估在nhdf和t细胞的共培养物中测试的重组fapbite蛋白的t细胞活化性质。培养24小时后取出的上清液通过elisa测试ifnγ(图68a),并且通过细胞因子珠阵列(legendplex人类t辅助细胞因子组,biolegend#74001)测试一组细胞因子(图68b)。对照bite诱导任何细胞因子没有显著变化,然而,fap-bite导致γ干扰素、il-2、tnfα、il-17和il-10的强烈增加,与刺激的t细胞的不同亚群一致,并且ifnγ的产生远远大于由抗cd3/cd28引发的。在存在nhdf细胞的情况下用fapbite但不用对照bite刺激还诱导t细胞(cd4+和cd8+亚群)的快速脱粒(在6小时内),如通过t细胞表面上cd107a/lamp1的外化(通过流式细胞术评估)所确定的,这与它们杀死靶细胞的能力密切相关(图69a和图69b)。通过fapbite进行的此脱粒诱导转化为有效的成纤维细胞溶解(图69c),通过与pbmct细胞(ec50为约2.5ng/ml)共培养24小时后的ldh释放所测量的,其中使用6/6供体t细胞观察到诱导的t细胞活化和细胞毒性(图69d)。对照bite没有诱导细胞毒性,与保持在灭活状态的t细胞一致。实例30fapbite和enad-fapbite病毒对不同癌症患者原发性恶性腹水样品细胞的影响作为实例16中所描述的研究的后续,获得来自另外的癌症患者的新鲜原发性恶性腹膜腹水用于研究enadfapbite病毒活性。将含有epcam+肿瘤细胞和fap+成纤维细胞的三个患者样品离体扩增,并且将混合(贴壁)细胞群与pbmc衍生的t细胞和未修饰的或表达bite的enad病毒一起培养。72小时后,采集总细胞并且通过流式细胞术确定fap+(图70a)和epcam+细胞(图70b)的数量。另外,测量t细胞的活化状态(通过cd25表达)(图70c)。用enad-cmv-fapbite和enad-sa-fapbite感染诱导所有患者样品中的t细胞活化和fap+细胞消耗,而epcam+肿瘤细胞的水平没有显著变化。亲本enad或对照病毒均未诱导可观察到的t细胞活化,fap+细胞数量与未感染对照相似。重要的是,fap+成纤维细胞的这种消耗一致地导致在上清液中检测到的免疫抑制细胞因子tgfβ水平的强烈降低(图70d)。在第二系列实验中,评估来自五个患者活组织检查样品的总(和未纯化)细胞以评估样品中内源性肿瘤相关t细胞的活性。将细胞接种在50%腹水液中,并且用重组对照或fapbite蛋白或100vp/细胞的enad或enad-bite病毒处理。孵育5天后,通过流式细胞术测量t细胞活化(通过cd25表达)和残留数量的fap+细胞(图71a和图71b)。在所有3个患者样品中,重组fap-bite和enad-cmv-fapbite诱导强烈的t细胞活化,高达约80%的患者来源的t细胞被活化,这导致fap+成纤维细胞显著消耗。有趣的是,enad-sa-fap-bite在2/3样品中诱导cd25表达,在患者1中没有可观察到的活化或fap+细胞消耗。这可能是由于病毒感染的肿瘤细胞不足以及bite蛋白的产生(通过流式细胞术在此样品中未检测到epcam+肿瘤细胞),这与肿瘤细胞对mlp(sa)驱动的转基因表达的需求一致(这还可能解释了enad-sa-fap-bite病毒缺乏t细胞活化和fap+细胞消耗,患者腹水样品如图42到图44所示)。总的来说,数据示出了在肿瘤细胞感染后,表达fap-bite的enad可重复地导致肿瘤相关t细胞的活化以杀死内源性成纤维细胞。另一项实验研究了是否可以通过使用患者活组织检查样品阻断pd-1检查点来改善fap-bite活性,其中t细胞为73.6%pd-1阳性并且fap+细胞为62.9%pdl1阳性(图72a)。在存在或不存在针对人类pdl1的纯化的阻断小鼠igg2b抗体(biolegend,克隆29e.2a3)的情况下建立与上文所描述的那些类似的共培养物,终浓度为2.5μg/ml。培养2天后,采集总细胞并且测量残留的fap+细胞和t细胞活化。包含阻断性抗pdl1抗体导致cd25诱导适度增加(图72b)和ifnγ产生高两倍(图72c),而在第2天在任一情况下均没有改变fap+细胞的消耗,几乎完全溶解(图72d)。据报道,从卵巢癌患者腹水中分离的肿瘤相关淋巴细胞(tal)富集了pd-1的表达并且影响了效应子功能-包含细胞毒性和ifng产生。与此一致,来自六个癌症患者腹水活组织检查的cd3+细胞的pd-1表达比来自三个健康供体的外周血单核细胞(pbmc)的所述表达高2倍(图73a)。为了评估这些癌症活组织检查样品中t细胞的功能,将nhdf细胞和未纯化的pbmc或腹水细胞(在图73b中示出了样品中的每一个的%cd3+细胞)与对照或含有fapbite的上清液共培养,并且5天后采集上清液,并且通过elisa测试ifnγ(图73c)。对照bite未诱导ifnγ。三个腹水细胞样品以与pbmc样品相似的水平产生ifnγ,而其它三个样品对fapbite具有减弱的应答。我们接下来研究这些t细胞诱导bite介导的nhdf细胞溶解的能力。将nhdf铺板,并且将pbmc或腹水细胞与含有bite的上清液一起添加,并且使用xcelligence细胞毒性测定系统实时监测培养物中细胞的活力。尽管ifnγ产生的可变性,当添加fapbite时,所有腹水样品都诱导nhdf细胞的完全细胞毒性,总体相似的bite介导的nhdf溶解速率与pbmc受影响时的速率相似(图73d)。为了研究fapbite是否可以在存在患者恶性渗出物样品(全部为50%)的情况下介导t细胞活化,在nhdf细胞存在下用对照或fapbite活化pbmct细胞,或用50%正常人类血清(ns)或不同(无细胞)恶性渗出物样品中的抗cd3/cd28磁珠活化。然而在正常血清中,74%的t细胞在用抗cd3/cd28珠刺激后24小时被活化(cd25和cd69均为双阳性),与ns中的应答相比,3/5测试的腹水液显著减弱了t细胞活化(图74a)。然而,当pbmc与nhdf一起培养并且用fapbite刺激时,在任何渗出液存在下都没有观察到t细胞活化的抑制(图74b),这证明fapbite可以克服免疫抑制机制以活化t细胞。实例31enad-fapbite介导的溶瘤和t细胞刺激将患者腹水中的cd11b+tam极化为更活化的表型调查是否通过fapbite介导的t细胞活化产生th1细胞因子,包含ifnγ、tnfα和il-2,以及随后消除fap+成纤维细胞(以及相关的tgfβ1减少与肿瘤的其它变化相关)从免疫抑制和促致癌基因到抗肿瘤活性的微环境评估了未分离的腹水细胞样品中对肿瘤相关巨噬细胞(tam)的作用。将未纯化的患者腹水细胞全部置于50%腹水液中,用游离对照或fapbite处理或用enad-sa-对照bite或enad-sa-fapbite病毒(100vp/细胞)感染。平行地,用ifnγ处理一些细胞以诱导活化的cd11b骨髓细胞表型。孵育3天后,首先测量t细胞的活化状态;通过流式细胞术测量cd25+细胞并且通过elisa测量ifnγ分泌。用fapbite和enad-sa-fapbite处理导致约60%的cd3+t细胞变为cd25+(图75a)和培养上清液中的大量ifnγ(图75b)。对于cd25表达或ifnγ,未观察到对照bite或对照病毒增加超过背景。为了评估tam极化,通过流式细胞术在cd11b+细胞上测量cd64和cd86(m1或“活化的”巨噬细胞标记物)和cd206和cd163(m2或tam标记物)的表达水平(图75c)。用游离fapbite或表达fapbite的enad处理诱导更活化的表型,表现为cd64表达的显著增加,以及cd206和cd163的强烈降低-类似于将ifnγ掺入培养物中时观察到的。虽然在此实验中用游离fapbite或对照病毒处理在背景上没有引起cd86的明显变化,但是表达fapbite的enad诱导cd86表达的大量增加,指示enad病毒感染和fapbite活性可以协同活化如此处测试的恶性腹水样品等抑制性肿瘤微环境中的原发性骨髓细胞。在此研究中,ifnγ处理诱导cd86的适度降低,指示由enad-sa-fapbite观察到的cd86的强烈增加可能是通过ifnγ非依赖性机制。实例32enad-fapbite活化肿瘤浸润淋巴细胞并且在离体固体前列腺肿瘤活检中诱导细胞毒性组织切片培养提供了各种组织、器官和肿瘤的最现实的临床前模型之一。为了评估在这种高度临床相关的环境中表达fapbite的病毒的活性,研究了来自切除的人类前列腺的恶性和良性前列腺组织的几个成对穿孔活组织检查。在初始筛选时,前体组织可再现地显示具有散布在含有分散的cd8t细胞(图76b)的基质的大区之间的epcam+肿瘤细胞的环状环(图76a)。在邻近肿瘤区的成纤维细胞上发现fap染色(图76c)。通过振动切片机将核心切成300μm厚度,并且在病毒存在下(1.5e9vp/切片)建立切片培养物或保持未感染。7天后,固定切片、石蜡包埋、切片并且通过免疫组织化学(ihc)通过染色cd25表达评估t细胞活化状态(图76d)。仅接受enad-cmv-fapbite或enad-sa-fapbite的样品示出了肿瘤浸润性t细胞的活化,通过强cd25染色显示。未经处理或对照病毒处理均未检测到cd25阳性细胞。通过elisa测试感染后第4天和第7天从这些切片培养物中取出的上清液的ifnγ和il-2,在用enad-sa-fapbite病毒培养物中检测到的用fapbite病毒(图76e)和il-2感染的恶性但非良性的前列腺切片培养物中检测到ifnγ的增加(图76f)。与cmv驱动的fapbite病毒相比,enad-sa-fapbite诱导更高量的ifnγ,其可以更早检测到。实例33-表达epcam或fapbite的enad病毒生成编码单个bite的五种病毒(ng-611、ng-612、ng-613、ng-614、ng-617)(表8)。表8病毒id转基因盒ng-611(seqidno:96)ssa1-epcambite2-his3-pa4ng-612(seqidno:97)ssa1-fapbite5-his3-pa4ng-613(seqidno:98)sa6-fapbite5-his3-pa4ng-614(seqidno:99)sa6-fapbite7-his3-pa4ng-617(seqidno:100)ssa1-fapbite5-pa41seqidno.55;2seqidno.83;3seqidno.84;4seqidno.65;5seqidno.85;6seqidno.86;7seqidno.87;在每个转基因盒中,编码bite的cdna在5'末端处侧接短剪接受体序列(ssa,sequenceidno:55)或更长的剪接受体序列(sa,sequenceidno:86)。在bite的3'末端处,编码sv40晚期poly(a)序列(pa,sequenceidno:65),之后是组氨酸标签(his,seqidno.41)或没有标签。在病毒ng-611、ng-612、ng-613和ng-617中,bite分子的抗cd3部分使用小鼠抗人类cd3ε单克隆抗体okt3的单链变体。病毒生产质粒penad2.4用于通过直接插入合成的转基因盒(分别为seqidno:88到92)使质粒png-611、png-612、png-613、png-614和png-617生成。png-611转基因盒编码靶向bite的epcam(seqidno.93),png-612、png-613和png-617转基因盒编码靶向seqidno.94的bite的fap,并且png-614转基因盒编码靶向seqidno.95的bite的fap。在图77a到图77c中示出了转基因盒的示意图。通过限制性分析和dna测序确认质粒dna的构建。质粒、png-611、png-612、png-613、png-614和png-617通过用酶asci限制性消化进行线性化以产生病毒基因组。根据下文给出的方法扩增和纯化病毒。通过苯酚/氯仿提取纯化消化的dna,并且在300μl>95%分子生物级乙醇和10μl3m乙酸钠中于-20℃沉淀16小时。通过在14000rpm离心5分钟沉淀析出的dna,并且在500μl70%乙醇中洗涤,然后再次以14000rpm离心5分钟。将干净的dna团粒空气干燥,重悬浮于含有15μl脂质体转染试剂的500μloptimem中,并且在室温下孵育30分钟。然后将转染混合物逐滴添加到含有生长到70%汇合的293细胞的t-25烧瓶中。将细胞与转染混合物在37℃孵育2小时后,向细胞中添加5%co24ml的细胞培养基(dmem高葡萄糖和谷氨酰胺补充有2%fbs),并且将烧瓶在37℃,5%co2孵育。每24小时监测转染的293细胞,并且每48小时到72小时补充额外的培养基。通过观察细胞单层中的显著细胞病变效应(cpe)来监测病毒的产生。一旦观察到广泛的cpe,通过三次冻融循环从293细胞采集病毒。采集的病毒用于再感染293细胞以便扩增病毒原种。通过观察细胞单层中的显著cpe证实扩增期间活病毒的产生。一旦观察到cpe,通过三次冻融循环从293细胞采集病毒。在通过双氯化铯条带纯化病毒以产生纯化的病毒原种之前,将扩增的病毒原种用于进一步扩增。通过qpcr评估病毒活性用1ppcng-611、ng-612、ng-617、enadenotucirev或保持未感染的a549细胞感染72小时,用于通过qpcr定量病毒dna。收集细胞上清液并且通过以1200rpm离心5分钟来澄清。根据制造商的方案,使用qiagendneasy试剂盒从45μl上清液中提取dna。还使用dneasy试剂盒制备并且提取使用enadenotucirev病毒颗粒(2.5e10到2.5e5vp)的标准曲线。使用针对早期基因e3的病毒基因特异性引物-探针,通过qpcr分析每个提取的样品或标准品。每个细胞检测到的病毒基因组数量的定量证明ng-611、ng-612和ng-617在a549细胞系中示出了显著的基因组复制(图77d)。对于包含亲本病毒enadenotucirev的所有测试的病毒,这是类似的,指示包含bite转基因不影响病毒复制活性。在未感染的细胞中未检测到病毒基因组(数据未显示)。由表达bite的病毒介导的t细胞活化和脱粒。癌细胞感染将a549细胞以2.5e5细胞/孔的密度接种到24孔板中。将板在37℃、5%co2下孵育4小时,然后用1ppc的ng-611、ng-612、enadenotucirev感染细胞或保持未感染。在感染后24小时、48小时或72小时,从细胞中采集上清液,通过以1200rpm离心5分钟来澄清并且快速冷冻。t细胞测定将表达肺成纤维细胞系mrc-5或表达epcam的卵巢癌细胞skov3的fap分别以5.7e4细胞/孔和1.2e5细胞/孔的密度接种到48孔板中。将板在37℃、5%co2下孵育4小时,然后用150μl/孔从a549板采集的解冻上清液替换培养基。然后还将从人类pbmc供体分离的纯化的cd3t细胞添加到板中,得到t细胞与mrc-5或skov3的比例为2比1。将共培养物在37℃、5%co2下孵育16小时,然后收集细胞上清液用于elisa分析,并且采集t细胞用于流式细胞术分析。从共培养孔中去除含有非贴壁细胞的培养基并且离心(300xg)。小心去除上清液,用pbs5%bsa稀释1倍,并且储存用于elisa分析。用pbs洗涤贴壁细胞单层一次,并且然后用胰蛋白酶分离。使用10%fbsrpmi培养基灭活胰蛋白酶,并且将细胞添加到已经从培养上清液中收集的细胞团粒中。将细胞离心(300xg),弃去上清液,并且将细胞团粒在200μl的pbs中洗涤。将细胞再次离心,然后在室温下重悬于50μl含有live/deadaqua(生命技术公司)的pbs中15分钟。将细胞在fac缓冲液中洗涤一次,然后用直接缀合的抗体组进行染色:与af700缀合的抗cd3;与bv421缀合的抗cd25;与pe/cy5缀合的抗hla-dr;与bv605缀合的抗cd40l;与pe缀合的抗cd69和与fitc缀合的抗cd107a。来自每种共培养条件的细胞样品也用相关的同种型对照抗体染色。所有染色都在fac缓冲液中以50μl/孔的总体积在4℃下进行15分钟。然后用fac缓冲液(200μl)洗涤细胞两次,然后再悬浮于200μl的fac缓冲液中并且通过流式细胞术(attune)分析。上调t细胞活化标记物通过在活的单细胞上表达t细胞活化标记物cd25、cd69、hla-dr和cd40l或t细胞脱粒标记物cd107a来评估t细胞活化的流式细胞术分析。这些数据示出了当与epcam+skov3细胞共培养时,与ng-612、enadenotucirev或未处理的对照上清液相比,当向细胞中添加ng-611上清液时,表达cd25、cd69、hla-dr、cd40l或细胞表面cd107a的t细胞的数量显著增加(图78)。对于所有这些标记物,来自感染24小时的a549细胞的上清液刺激很少的t细胞活化,然而,在感染后48小时,上清液刺激所有标记物上的显著t细胞活化。在感染后72小时也是这种情况。当与fap+mrc-5细胞共培养时,与ng-611、enadenotucirev或未处理的对照上清液相比,当向细胞中添加ng-612上清液时,表达cd25、cd69、hla-dr、cd40l或细胞表面cd107a的t细胞的数量显著增加(图79)。使用ng-611病毒还可以观察到一些t细胞活化,这可能是由于与由ng-611病毒表达的epcambite接合的mrc-5细胞系中epcam(约5%)的低表达但可检测到的表达(图80)。对于所有这些标记物,来自感染24小时的a549细胞的上清液刺激很少的t细胞活化,然而,在感染后48小时,上清液刺激所有标记物上的显著t细胞活化。在与感染后72小时采集的上清液孵育后,cd25和cd69标记物也被上调,然而,在感染后72小时和感染后48小时采集上清液,检测到较低水平的活化标记物hla-dr、cd40l和cd107a。这可能是由于在感染的后期存在高水平的bite导致快速和有效的t细胞活化,这意味着效应子功能需要在早于产生上清液的16小时的时间点测量。为了检测ifnγ表达,将共培养上清液稀释到5%bsa/pbs测定缓冲液(范围为1:10到1:1000)中,并且使用人类ifnγqingtikineelisa试剂盒(r&dsystems)根据制造商的方案进行elisa。通过从标准曲线内插确定分泌的ifnγ的浓度。ifnγ的表达只能在使用skov3细胞(图81a)上的ng-611或mrc-5细胞(图81b)上的ng-611、ng-612的共培养物的上清液中检测到。实例34:体内表达bite的病毒的免疫活化和抗肿瘤功效在移植后18周,将nsg小鼠人源化cd34+造血干细胞(来自杰克森实验室(jacksonlabs))在两侧腹侧皮下植入hct116肿瘤细胞。一旦肿瘤达到80mm3到400mm3,将小鼠分组,使得每个治疗组具有相等的肿瘤体积分布,每组7只小鼠。用盐水、enadenotucirev或ng-611瘤内注射小鼠,每次注射5×109个颗粒,每个肿瘤注射2次。对两侧的肿瘤进行治疗。每周测量3到4次肿瘤体积并且证明与enadenotucirev或未治疗的对照相比,ng-611治疗在给药后20天导致显著的抗肿瘤应答(图82a)。在给药后20天后,处理来自每组中4只小鼠的一个肿瘤用于流式细胞术,同时将剩余的肿瘤在干冰上冷冻。流式细胞术在小体积的rpmi培养基中切除后立即对肿瘤样品进行机械解聚。然后使解聚的肿瘤通过70μm细胞滤网并且以300g离心10分钟。将细胞团粒重悬于100μl含有live/deadaqua(生命技术公司)的pbs中,在冰上保持15分钟。将细胞在fac缓冲液(5%bsapbs)中洗涤一次,然后用一组直接缀合的抗体染色:抗cd8(rpa-t8,af700);抗cd4(rpa-t4,pe);抗cd45(2d1,apc-fire750);抗cd3(okt3,percp-cy5.5);抗cd25(m-a251,pe-dazzle594);抗cd69(fn50,apc);抗hla-dr(l243,bv605);抗cd107a(h4a3,fitc)。还用相关的同种型对照抗体染色肿瘤细胞悬浮液库。所有染色都在fac缓冲液中以50μl/孔的总体积在4℃下进行20分钟。用fac缓冲液(200μl)洗涤细胞三次,然后再悬浮于200μl的fac缓冲液中并且通过流式细胞术(attune)分析。fac分析证明与enadenotucirev处理或未处理的对照相比,在ng-611处理的肿瘤中肿瘤中cd8与cd4t细胞的比例显著增加(图82b)。实例35-enad病毒共表达fapbite和免疫调节细胞因子和趋化因子生成编码fapbite和免疫调节蛋白的三种病毒(ng-615、ng-640和ng-641)(表9)。表91seqidno.55;2seqidno.87;3seqidno.63;4seqidno.105;5seqidno.61;6seqidno.107;7seqidno.64;8seqidno.109;9seqidno.65;10seqidno.110;11seqidno.111;12seqidno.86病毒生产质粒penad2.4用于通过直接插入合成的转基因盒(分别为seqidno:112到114)使质粒png-615、png-616、png-640和png-641生成。ng-615和ng-616含有四种编码fap靶向bite(seqidno:94)、flt3l(seqidno.115)、mip1α(seqidno.116)和ifnα(seqidno.117)的转基因。ng-640和ng-641编码靶向bite的fap(seqidno.94)、cxcl9(seqidno.118)和cxcl10(seqidno.119),ng-641还含有编码ifnα的第四转基因(seqidno.117),在图83a到图83c中示出了转基因盒的示意图。通过限制性分析和dna测序确认质粒dna的构建。质粒、png-615、png-616、png-640和png-641通过用酶asci限制性消化进行线性化以产生病毒基因组。根据实例33中详述的方法扩增和纯化病毒。通过qpcr和转基因elisa评估病毒活性癌细胞感染用1ppcng-615、enadenotucirev或保持未感染的a549细胞感染72小时,用于通过qpcr定量病毒dna并且通过elisa分析转基因表达。收集细胞上清液并且通过以1200rpm离心5分钟来澄清。将45μl上清液用于dna分析,并且剩余的上清液用于elisa。qpcr根据制造商的方案,使用qiagendneasy试剂盒从上清液样品中提取dna。还使用dneasy试剂盒制备并且提取使用enadenotucirev病毒颗粒(2.5e10到2.5e5vp)的标准曲线。使用针对早期基因e3的病毒基因特异性引物-探针,通过qpcr分析每个提取的样品或标准品。对每个细胞检测到的病毒基因组数量的定量证明,ng-615在a549细胞系中示出了与亲本病毒enadenotucirev相似水平的显著基因组复制(图84)。这些数据指示包含bite和三种免疫调节转基因不会显著影响病毒复制活性。在未感染的细胞中未检测到病毒基因组。elisa使用verikine人类ifnα试剂盒(pblassayscience)进行ifnαelisa,使用人类ccl3quantikineelisa试剂盒(r&dsystems)进行mip1αelisa并且使用flt3l人类elisa试剂盒(abcam)进行flt3lelisa。所有测定均根据制造商的方案进行。通过从标准曲线内插确定分泌的ifnα、mipα或flt3l的浓度。ifnα、mip1α和flt3l表达可以在ng-615的细胞上清液中检测到,但不能在enadenotucirev或未处理的对照细胞中检测到(图85)。由表达bite的病毒介导的t细胞活化和脱粒。癌细胞感染将a549细胞以2.5e5细胞/孔的密度接种到24孔板中。将板在37℃、5%co2下孵育4小时,然后用1ppc的ng-612、ng-615、enadenotucirev感染细胞或保持未感染。在感染后24小时、48小时或72小时,从细胞中采集上清液,通过以1200rpm离心5分钟来澄清并且快速冷冻。t细胞测定将表达肺成纤维细胞系mrc-5的fap以5.7e4细胞/孔的密度接种到48孔板中。将板在37℃、5%co2下孵育4小时,然后用150μl/孔从a549板采集的解冻上清液替换培养基。然后还将从人类pbmc供体分离的纯化的cd3t细胞添加到板中,得到t细胞与mrc-5的比例为2比1。将共培养物在37℃、5%co2下孵育16小时,然后收集细胞上清液用于elisa分析,并且根据实例29中详述的方法采集t细胞用于流式细胞术分析。上调t细胞活化标记物通过在活的cd3+单细胞上表达t细胞活化标记物cd25、cd69、hla-dr和cd40l或t细胞脱粒标记物cd107a来评估t细胞活化的流式细胞术分析。这些数据示出了当与fap+mrc-5细胞共培养时,与enadenotucirev或未处理的对照上清液相比,当向细胞中添加ng-615或612上清液时,表达cd25、cd69、hla-dr、cd40l或cd107a的t细胞的数量显著增加(图86)。分泌刺激性细胞因子ifnγ为了检测ifnγ表达,将共培养上清液稀释到5%bsa/pbs测定缓冲液(范围为1:10到1:1000)中,并且使用人类ifnγqingtikine试剂盒(randdsystems)根据制造商的方案进行。通过从标准曲线内插确定分泌的ifnγ的浓度。ifnγ的表达只能在使用ng-612或ng-615感染的a549上清液的共培养物的上清液中检测到(图87)。实例36-enad病毒共表达靶向fap的bite和靶向epcam的bite生成编码两个bite分子的病毒ng-618,一种靶向epcam(epcambite),并且一种靶向fap(fapbite)(表10)。表10病毒id转基因盒ng-618(seqidno:120)ssa1-epcambite2-p2a3-fapbite4-pa51seqidno.55;2seqidno.121;3seqidno.106;4seqidno.122;5seqidno.65;病毒生产质粒penad2.4用于通过直接插入合成的转基因盒(seqidno.123)生成质粒png-618。ng-618病毒含有两种编码靶向bite的epcam(seqidno.93)和靶向bite的fap(seqidno.95)的转基因。在图88中示出了转基因盒的示意图。通过限制性分析和dna测序确认质粒dna的构建。通过用酶asci限制性消化使质粒png-618线性化以产生病毒基因组。根据实例33中详述的方法扩增和纯化病毒由表达bite的病毒介导的t细胞活化和脱粒。癌细胞感染将a549细胞以1.2e6细胞/孔的密度接种到6孔板中。将板在37℃、5%co2下孵育4小时,然后用ng-611、ng-612、ng-618、enadenotucirev感染细胞或保持未感染。在感染后72小时,从细胞中采集上清液,并且通过以1200rpm离心5分钟来澄清。t细胞测定将表达肺成纤维细胞系mrc-5的fap和表达a549细胞的epcam以1.5e5细胞/孔的密度接种到24孔板中。还将mrc-5和a549细胞以1比1的比例混合,并且以1.5e5细胞/孔的总细胞密度接种到24个平板中。将板在37℃、5%co2下孵育4小时,然后用300μl/孔从a549板采集的解冻上清液替换培养基。然后还将从人类pbmc供体分离的纯化的cd3t细胞添加到板中,得到t细胞与mrc-5或skov3细胞的比例为2比1。将共培养物在37℃、5%co2下孵育16小时,然后收集细胞上清液用于elisa分析,并且采集t、mrc-5和a549细胞用于流式细胞术分析。检测mrc-5或skov细胞上的fap和epcam通过在fac缓冲液中洗涤细胞一次,然后用直接缀合的抗体组染色来分别评估mrc-5或skov细胞表面上可检测的fap或epcam的流式细胞术分析:与af647缀合的抗fap;与pe缀合的抗epcam。分析示出了在与用表达fap-bite的病毒ng-618感染的细胞的上清液一起孵育的mrc-5细胞上不再能检测到fap表达,但是在用来自用enad或未处理细胞处理的细胞的上清液孵育的>80%的细胞上检测到fap表达(图89a)。这些数据指示由ng-618病毒产生的fap-bite与其阻断抗fap抗体结合的mrc-5细胞上的fap靶结合。评估活的、大的单细胞skov细胞的可检测的epcam表达。在与表达epcam-bite的病毒ng-618(17%的细胞)感染的细胞的上清液一起孵育的skov细胞中,只检测到较低水平的epcam表达,但是在用enad或未处理细胞处理的细胞的上清液孵育的>40%细胞中检测到epcam表达(图89b)。总的来说,这些数据指示ng-618产生与epcam和fap靶蛋白结合的bite分子。上调t细胞活化标记物通过在活的cd3+单细胞上表达t细胞活化标记物cd25、cd69、hla-dr和cd40l或t细胞脱粒标记物cd107a来评估t细胞活化的流式细胞术分析。这些数据示出了当与fap+mrc-5细胞共培养时,与enadenotucirev或未处理的对照上清液相比,当向细胞中添加ng-618上清液时,表达cd25、cd40l或cd107a的t细胞的数量显著增加(图90)。与enadenotucirev或未处理的对照上清液相比,当将ng-618上清液添加到epcam+skov3细胞时,表达cd25、cd40l或cd107a的t细胞的数量也显著增加(图91)。这些数据证明ng-618病毒表达的两个bite分子在诱导t细胞活化方面都是有功能的。分析t细胞介导的靶(mrc-5和skov)细胞杀伤通过在室温下将含有live/deadaqua(生命技术公司)的50μl的pbs中的细胞染色15分钟来评估mrc-5和skov细胞活力的流式细胞术分析。将细胞在fac缓冲液中洗涤一次,然后用直接缀合的抗体组进行染色:与af647缀合的抗fap;与pe缀合的抗epcam。与ng-618上清液样品一起孵育后,mrc-5和skov细胞活力显著降低,而在enadenotucirev或未处理的对照上清液中未检测到显著的细胞死亡(图92)。这些数据证明了ng-618共表达的fap和靶向bite的epcam诱导t细胞介导的靶细胞杀伤的功能性的能力。序列seqidno:25:fapbite-p2a-rfp(italics=前导,bold=弗林蛋白酶切割位点,underline=p2a序列,小写=rfp)mgwsciilflvatatgvhsdivmtqspdslavslgeratinckssqsllysrnqknylawyqqkpgqppkllifwastresgvpdrfsgsgfgtdftltisslqaedvavyycqqyfsypltfgqgtkveikggggsggggsggggsqvqlvqsgaevkkpgasvkvscktsrytfteytihwvrqapgqrlewigginpnngipnynqkfkgrvtitvdtsastaymelsslrsedtavyycarrriaygydeghamdywgqgtlvtvssggggsdvqlvqsgaevkkpgasvkvsckasgytftrytmhwvrqapgqglewigyinpsrgytnyadsvkgrftittdkststaymelsslrsedtatyycaryyddhycldywgqgttvtvssgegtstgsggsggsggaddivltqspatlslspgeratlscrasqsvsymnwyqqkpgkapkrwiydtskvasgvparfsgsgsgtdysltinsleaedaatyycqqwssnpltfgggtkveikhhhhhhhhhhrrkrgsgatnfsllkqagdveenpgpmselikenmhmklymegtvnnhhfkctsegegkpyegtqtmkikvveggplpfafdilatsfmygskafinhtqgipdffkqsfpegftwerittyedggvltatqdtsfqngciiynvkingvnfpsngpvmqkktrgweantemlypadgglrghsqmalklvgggylhcsfkttyrskkpaknlkmpgfhfvdhrlerikeadketyveqhemavakycdlpsklghrseqidno:26:对照(抗fha)bite-p2a-rfp(italics=前导,bold=弗林蛋白酶切割位点,underline=p2a序列,小写=rfp)mgwsciilflvatatgvhseldivmtqapaslavslgqratiscrasksvsssgynylhwyqqkpgqppklliylasnlesgvparfsgsgsgtdftlnihpveeedaatyycqhsrefpltfgagtkleikssggggsggggggssrsslevqlqqsgpelvkpgasvkiscktsgytftgytmhwvrqshgkslewigginpknggiiynqkfqgkatltvdkssstasmelrsltsddsavyycarrvyddypyyyamdywgqgtsvtvssakttppsvtsggggsdvqlvqsgaevkkpgasvkvsckasgytftrytmhwvrqapgqglewigyinpsrgytnyadsvkgrftittdkststaymelsslrsedtatyycaryyddhycldywgqgttvtvssgegtstgsggsggsggaddivltqspatlslspgeratlscrasqsvsymnwyqqkpgkapkrwiydtskvasgvparfsgsgsgtdysltinsleaedaatyycqqwssnpltfgggtkveikhhhhhhhhhhrrkrgsgatnfsllkqagdveenpgpmselikenmhmklymegtvnnhhfkctsegegkpyegtqtmkikvveggplpfafdilatsfmygskafinhtqgipdffkqsfpegftwerittyedggvltatqdtsfqngciiynvkingvnfpsngpvmqkktrgweantemlypadgglrghsqmalklvgggylhcsfkttyrskkpaknlkmpgfhfvdhrlerikeadketyveqhemavakycdlpsklghrseqidno:33:剪接受体序列caggseqidno:55短剪接受体(ssa)dna序列(零序列)caggseqidno:58kozak序列(零序列)ccacc当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1