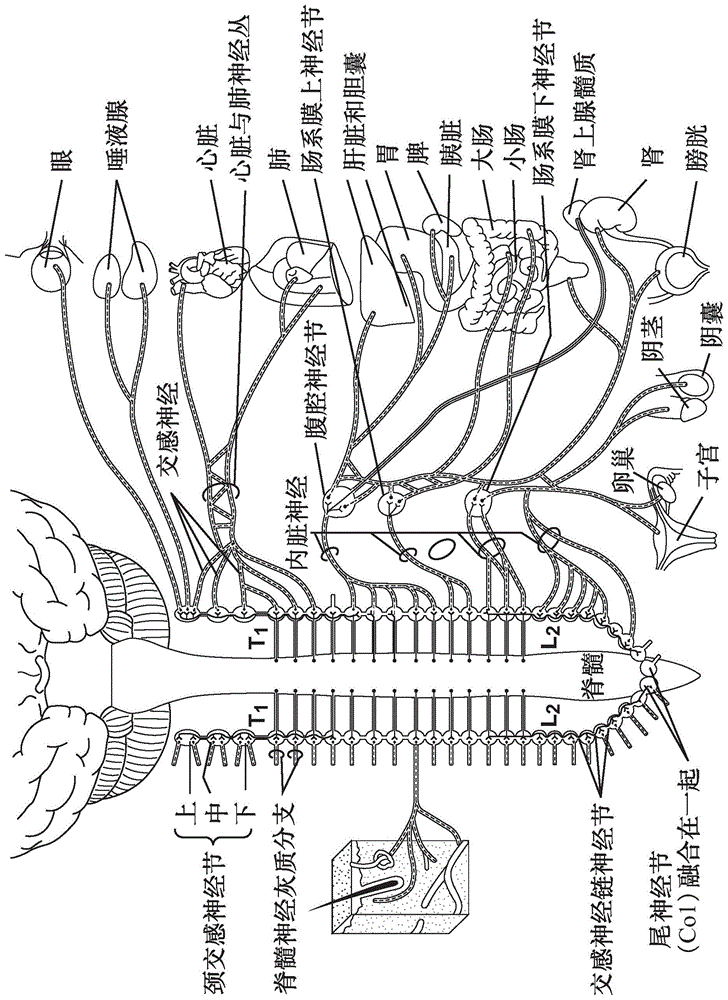
通过脏神经消融术治疗心脏衰竭的装置、系统和方法与流程
本专利的优先级高于以下美国临时专利,且包含此处每一项专利的所有内容:62/368,912(2016年7月29日申请)、62/411,492(2016年10月21日申请)与62/482,142(2017年4月5日申请)。援引合并本发明领域涉及到的所有发表的内容和申请的专利统一作为本发明包含的特定的或独立的合并援引。
背景技术:
:心脏衰竭(heartfailure,hf)是当心脏无法泵输足够的血液来维持身体器官时的一种医学状态。心脏衰竭是一种严重的疾病,影响着美国以及世界上千千万万的人。单在美国,约有510万人民患有心脏衰竭,并且根据美国疾病控制中心的数据,在该症状所需的护理、治疗、药物和生产损耗上的开支超过了300亿美元。正常的心脏是一种主要由肌肉组成的泵结构,平均大小略大于一拳大小,可以通过循环系统连续地为身体提供含氧血液。在心脏衰竭的情况下,虚弱的心脏无法为身体提供足量的血液,并导致心肌病(心脏肌肉疾病),其症状有呼吸疲劳和短促,甚至连日常活动,例如行走,都十分困难。通常,为了弥补这种功能障碍,心脏和身体经过一些生理变化来掩盖心脏无法维持身体机能的现象。这些变化包括心室增大、心肌增生、心率加快、血压升高、血流不畅、以及四肢和肺部的体液失衡。衡量心脏健康的一种常用指标是左心室射血分数(leftventricularejectionfraction,lvef)或射血分数。从定义上讲,在心室收缩前一瞬心室的血液容量为舒张末期容积(end-diastolicvolume,edv)。类似地,在心室收缩后心室内剩余的血量为收缩末期容积(end-systolicvolume,esv)。edv与esv之差为心搏量(strokevolume,sv)。sv表示了每一次心跳中从左右心室射出的血量。射血分数(ejectionfraction,ef)是每一次心跳中sv与edv之比。心输出量(cardiacoutput,co)是每个心室一分钟可以泵出的血量。co等于sv乘以心率(heartrate,hr)。心肌病是心脏肌肉变得薄弱、被拉伸或表现出其它结构性问题的疾病,心肌病可以进一步归类为基于心室射血分数的收缩和舒张功能障碍。收缩功能障碍表现为心肌收缩性降低。当左心室的大部分心肌收缩性降低时会导致lvef的降低。co依靠两种方式维持:左心室增大可以提高sv,并且由于通过拉伸心脏肌肉而增强的机动性能,使得收缩性可以提高。然而,这些弥补机制迟早会由于持续的心脏衰弱和co降低而变得不起作用,从而导致心脏衰竭的临床表现。心脏左侧没有足够的力量泵出足量的血液到循环系统中。这样会导致血流倒灌进入肺部,并形成肺淤血。通常来说,lvef小于40%就被定义为收缩功能障碍,这种患者可以广泛归类为射血分数降低的心脏衰竭(heartfailurewithreducedejectionfraction,hfref)。舒张功能障碍是指左心室充盈异常,并伴有提高的充盈压。在心脏舒张期,当心肌放松时,左心室的充盈是一种被动过程,取决于心肌的顺应性(定义为体积变化与压力变化之比)或舒张性。当心室无法放松或充盈时,心肌可以增强来弥补衰弱的sv。这种随之而来的心肌增生会进一步导致不充分的充盈。舒张功能障碍可以导致,特别是在足、踝和腿部的水肿或积水。另外,有些患者由于肺部流量的累积还患有肺淤血。对于患有hf而没有收缩功能障碍的患者,舒张功能障碍是可能的病因。舒张功能障碍不仅仅表现为肥厚型心肌病(hypertrophiccardiomyopathy,hcm),还表现为心肌硬化,无法伸展来顺应被动充盈。通常来说,lvef小于40%就被定义为舒张功能障碍,这种患者可以广泛归类为射血分数有所保留的心脏衰竭(heartfailurewithpreservedejectionfraction,hfpef)。尽管已有许多药物治疗可以成功地定向于治疗收缩功能障碍和hfref,对于大批患有舒张功能障碍和hfpef的患者目前还没有治疗保障。hfref和hfpef患者的临床病程对于伴有呼吸困难、运动能力降低和外周性水肿的急性失代偿性心力衰竭(acutedecompensatedheartfailure,adhf)的复发表现具有重要意义。adhf的复发住院消耗了大量已有的医疗资源,并且将会持续产生巨大的花费。尽管对hf的病理生理学已有更好的了解,现代医学仍然没有研发出针对慢性hf或复发性adhf的新的治疗方法。在过去的几十年里,针对adhf的管控和预防已经并且继续着重于了解经典模式,盐和液体潴留是血管内液体扩张和心脏失代偿的原因。因此,安全有效地治疗心衰患者的改进方法,和用作治疗的装置和系统是很有所需的。技术实现要素:鉴于上述情况,运用可以影响神经元介质激活机制的设备和方法来治疗hf,包括治疗hfpef、循环血容量扩大耐受性受阻、运动受限、深呼吸困难的患者,是很理想的。本发明包括通过消融一部分的胸内脏神经(thoracicsplanchnicnerves,tsn)为hf患者提供改进治疗方案的方法、装置和系统,包括消融内脏大神经、内脏小神经和内脏细小神经,以及来自交感神经链形成的至少一条支配腹腔腔室器官和血管的胸内脏组成神经,特别是内脏大神经(greatersplanchnicnerve,gsn)。由于内脏大神经、内脏小神经和内脏细小神经形成了从交感神经干中分支出的节前纤维神经,并传递到腹腔神经节,所有在交感神经干和腹腔神经节之间形成胸内脏神经的节前纤维神经都叫笼统称作胸内脏神经。通过选择性地消融特定的神经,本发明提供了可以影响血流量循环、血压、血流和普遍影响心脏和循环系统的创新性方法和装置。这样,基于最现代的心衰生理学理论,本发明介绍了治疗hf,特别是hfpef,的创新性解决方案。导管引导工具包括使用血管外标记,例如肋间空间和/或椎骨。内扫描或探测方法包括射线成像标记的荧光镜探测、ct扫描、mri和/或超声探测。这些扫描方法可以用于神经的直接成像,或附近血管(例如奇静脉)和非血管组织(例如横膈膜、椎骨、肋骨)的成像中。使用放射性对照和导丝可以辅助消融元件的放置。在靶标位置,一些提出的靶标调节方法,特别是消融一条靶标神经的方法包括利用低温或高温来消融,局部给药(例如神经性药物、交感神经溶解剂、神经毒素的局部注射和局部浸润),局部麻醉,或能量导送,包括射频消融,超声能量导送,或机械挤压。本发明可以提供用于心导管实验室中的方法,来消融一条胸内脏神经,例如在身体左侧或右侧的单侧内脏大神经,或双侧的内脏大神经,使得血液有效流通并到达内脏器官或血管,以及内脏血管床(静脉池)中,从而提高静脉顺应性,达到降低心脏前负荷或使其正常化,降低静脉淤血,缓解肺淤血,降低肺血压并缓和特别是晕倒带来的呼吸困难,提高或相对维持心搏量,增强血液循环,整体增强在直立姿势改变时保持正常反应的心脏功能的目的。本发明中的治疗方法、装置和系统可以保障心衰病患重返较高质量的生活,并降低adhf的住院率。进一步而言,本发明可以用于治疗急性或慢性的失代偿性hf。急性失代偿性hf可以通过释放应力体积和静脉淤血来预防,或者可以暂停其进程,在hf中肾功能障碍的主要方面。本发明中的治疗装置和方法可以辅助用于例如利尿剂治疗的传统治疗方案中,因为其可以打断或延迟心失代偿的进程。释放应力体积和静脉淤血可以提高患者对利尿剂的反应性。在慢性心衰状态下,本发明中的治疗装置和方法可以用来提高血流的覆盖分布,提高静脉顺应性和容量,释放静脉淤血,在运动时降低肺动脉和左心房血压,提升心室放松效果,并因此可以改进淤血带来的症状,例如气短,并提升运动能力。与以往的神经消融方法相比,本发明中的治疗装置和方法在于可靠而持续地对所选tsn进行安全消融,而无副作用或副作用很小,例如疼痛,以往手术过程中的体位性和胃肠道副作用,对胃功能严重的长期损伤,对肺和脏胸膜的损伤,或其它无意的、非靶标的神经损伤。另外,本发明中的治疗装置和方法满足长期治疗hf的需求,特别是对舒张功能障碍或hfpef的患者,而且特别是对降低肺动脉血压和缓解运动中呼吸困难(气短)以及其它情况下的需求,从而提升可观测到的健康状况,包括通过降低出力时的肺毛细血管楔压和肺动脉血压来提升运动能力。本发明中其它的实施例包括:1.一种神经消融装置,特指通过神经消融来治疗心脏衰竭,包括:a.一种包含至少一个消融元件的血管内导管;b.一种能量源,可以向该消融元件传输能量;和c.一种能量源控制器,可以控制该能量源并执行向该消融元件充能的指令。2.实施例构想1中的装置,其中所述的血管内导管包括:i.近端部分,ii.一种柔性套管,和iii.远端部分,其中所述的柔性套管连接近端部分和远端部分,并且可以进入患者的血管中,其中所述的近端部分可以留在患者体外,并且其中所述的远端部分可以通过患者的血管并可以包含至少一个消融元件。3.以上任意一个实施例构想中的装置,其中所述的导管包括至少一个刺激元件和/或至少一个探测元件。4.实施例构想3中的装置,其中所述导管的的远端部分包括至少一个消融元件,至少一个刺激元件和至少一个探测元件。5.以上实施例构想3或4中任意一项所述的装置,其中所述的能量源可以向该消融元件、该刺激元件和/或该探测元件传输能量。6.以上实施例构想3、4或5中任意一项所述的装置,其中所述的能量源控制器可以控制该能量源来执行指令,包括至少两项以下的内容:a.向该消融元件供能,b.向该刺激元件供能,并c.向该探测元件供能。7.以上实施例构想3、4、5或6中任意一项所述的装置,其中所述的能量源控制器可以控制该能量源来执行指令,包括以下的内容:d.向该消融元件供能,e.向该刺激元件供能,并f.向该探测元件供能。8.以上实施例构想中任意一项所述的装置,其中所述的能量源是该导管近端部分的一部分。9.以上实施例构想中任意一项所述的装置,其中所述的控制器包括一种电子控制单元和一种内置软件程序,在该电子控制单元执行指令时,该控制器可以执行控制指令,或者包括一种用来执行控制的模拟电路。10.以上实施例构想中任意一项所述的装置,进一步包括一种用户界面,或者该导管近端部分的一部分可以与该控制器进行信息交流,可以接受用户输入的信息,并将其传达到该控制器中。11.以上实施例构想中任意一项所述的装置,包括若干消融元件,并且其中所述的每一个消融元件与至少一个刺激元件相连。12.以上实施例构想中任意一项所述的装置,其中所述的消融元件可以从以下选项中选择:一种电极,一种低温控制器,一种药物传送装置,神经阻隔介质,一种超声装置,一种射频装置,一种热消融装置,一种激光发射装置,或这几种装置的组合体,并且/或者其中所述的刺激元件可以从以下选项中选择:一种电极,一种低温控制器,一种药物传送装置,神经阻隔介质,一种超声装置,一种射频装置,一种热消融装置,一种激光发射装置,或这几种装置的组合体。13.以上实施例构想3到12中任意一项所述的装置,其中所述的刺激元件包括至少一个电极或包括一种电极对或包括多个电极对,或者其中所述的控制器可以向该能量源发出指令,来向该刺激元件供能,能量的形式可以是波形在10到500赫兹范围内的电流。可以通过调节该波形来优化tsn对刺激的反应结果,并将疼痛反应最小化。例如,可以利用一种转换速率高并且振幅低的神经刺激波形来激发一种来自tsn的生理反应,例如血压或心率的提高,但是并不会使患者有疼痛感。在一种实施例构想中,该刺激tsn的电流周期可以很短,可以是相对时值的范围内,并且可以产生一种最小强度为12.3v/m的电场。为了生成该电场,可以使用一种3f到8f的导管,该导管包含进行单级或双极刺激的电极。该电极的长度可以在0.5到4毫米范围内。对于200到100欧的典型刺激阻抗,相应的刺激电流可以是0.1到5毫安,或刺激电压可以是0.05到5伏。电势场强度在30到500v/m范围内,在脉冲时长为0.12毫秒时,可以安全地捕获tsn,并不会引起疼痛。14.以上实施例构想中任意一项所述的装置,其中所述的消融元件包括一种射频装置,并且其中所述的射频装置可以输出一种频率在300khz到3mhz范围内的电流和5到50瓦范围内的能量。15.以上实施例构想3到14中任意一项所述的装置,其中所述的探测元件可以从以下选项中选择:a.全身静脉压传感器,b.肺静脉压传感器,c.肺动脉压传感器,d.至少一个心输出量探测器,e.至少一个血流量监测器,f.或以上的组合。16.以上实施例构想3到15中任意一项所述的装置,其中所述的远端部分进一步包括两个不同的探测元件,分别可以放置于患者血管中的相对位置。17.以上实施例构想3到16中任意一项所述的装置,其中所述的探测元件包括一个或多个血压传感器。18.以上实施例构想3到17中任意一项所述的装置,其中所述的探测元件包括一个或多个组织温度传感器。19.以上实施例构想3到18中任意一项所述的装置,其中所述的探测元件包括一个或多个血流动力传感器。20.以上实施例构想3到19中任意一项所述的装置,其中所述的探测元件包括一个或多个环境温度传感器。21.以上实施例构想3到20中任意一项所述的装置,其中所述的探测元件包括一个或多个组织阻抗传感器。22.以上实施例构想中任意一项所述的装置,其中所述的远端部分包括一种可部署的结构,可以从下列中选择:一种球囊,一种笼结构,一种篮结构,一种预成型结构,套索或环结构,以及以上的组合结构。23.以上实施例构想中任意一项所述的装置,包括一种导丝,或可以配备一种无创性尖端,来辅助该导管在患者血管中的递送。24.根据实施例构想23中所述的装置,其中所述的导管包括一种导丝腔,可以通过导丝递送该导管。25.以上实施例构想3到24中任意一项所述的装置,其中所述的消融元件和刺激元件位于该导管上的相对位置上,在该区域内,该刺激元件可以释放刺激信号,在相应的消融区域内,该消融元件可以传输足够的消融能量,来实现不可逆的神经组织消融。26.以上实施例构想中任意一项所述的装置,其中所述的导管是一个或多个无菌的、可伸长的、柔性的、灌浸的、套裹的、可弯曲的、射线荧光的、不透射线的或以上性质的组合。27.以上实施例构想中任意一项所述的装置,其中所述该控制器执行的指令进程包括执行映射算法来为消融元件和刺激元件中的一个或两个识别患者血管中合适的位置。28.以上实施例构想27中,其中所述的控制器可以在向能量源发出指令为消融元件和刺激元件中的一个或两个传递能量之前,执行所述的映射算法。29.以上实施例构想27和28中,其中所述的映射算法包括:a)对该能量源发出指令向消融元件和刺激元件中的一个或两个传递能量,从而施加一种从静脉内穿过静脉壁的刺激,并刺激邻近的神经,b)探测患者体内血流动力或生理参数的变化,c)根据探测的变化来判断至少一个消融元件,或至少一个刺激元件是否处于合适的位置。30.以上实施例构想29中,其中所述判断至少一个消融元件,或至少一个刺激元件是否处于合适的位置包括以下步骤:1)将患者体内血流动力或生理参数的变化与预定值或数据组相比较,2)如果患者体内血流动力或生理参数在可接受数值范围内,则可以判断至少一个的消融元件,或至少一个的刺激元件位于合适的位置。31.以上实施例构想29和30中,其中所述的映射算法包括如果c)患者体内血流动力或生理参数的探测值判断为在可接受数值范围内,则d)释放一个信号来表示至少一个的消融元件,或至少一个的刺激元件位于合适位置的步骤。32.以上实施例构想31中,其中所述释放的信号包括向与控制器连接的用户界面发出指令来产生一个视听信号。33.以上实施例构想29到32中任意一项所述的装置,其中所述的映射算法包括如果c)患者体内血流动力或生理参数的探测值判断为不在可接受数值范围内,则e)释放另一个信号来表示至少一个的消融元件,或至少一个的刺激元件位于错误位置的步骤。34.以上实施例构想33中,其中所述释放的另一个信号包括向与控制器连接的用户界面发出指令来产生不同于之前第一个信号另一个视听信号。35.以上实施例构想29到34中任意一项所述的装置,其中所述的映射算法包括探测该导管远端部分位置重置的信号,并重复步骤a)到c),a)到d)或a)到e),直到患者体内血流动力或生理参数的探测值判断为在可接受数值范围内。36.以上实施例构想25到35中任意一项所述的装置,其中所述的消融元件包括一个或多个消融电极或电极对,并且/或者其中所述的刺激元件包括一个或多个刺激电极或电极对。37.以上实施例构想36中所述的装置,其中所述向能量源发出指令来为至少一个的消融元件或至少一个的刺激元件传递能量的步骤包括向该能量源发出指令将电能释放在该至少一个的消融元件或至少一个的刺激元件上。38.以上实施例构想36或37中所述的装置,其中所述判断该至少一个的消融元件或至少一个的刺激元件处于合适位置的步骤包括,通过探测患者血流动力或生理参数中至少一个参数在消融电极或刺激电极释放电能时的变化,来判断消融电极或刺激电极是否接近患者体内的靶标神经。39.以上实施例构想36、37或38中所述的装置,其中所述的导管包括若干消融电极,或可位于该导管的远端部分,并且其中所述向该能量源发出指令为该消融电极传输电能时向该能量源发出的指令包括:1)从每一个消融电极释放一系列电能,并2)选择至少一个消融电极,在释放电能时,可以引起血流动力或生理参数中至少一个参数的变化。40.以上实施例构想36、37、38或39中所述的装置,其中所述的导管包括若干刺激电极,或可位于该导管的远端部分,并且其中所述向该能量源发出指令为该刺激电极传输电能时向该能量源发出的指令包括:1)从每一个刺激电极释放一系列电能,并2)选择至少一个刺激电极,在释放电能时,可以引起血流动力或生理参数中至少一个参数的变化。41.以上实施例构想36到40中任意一项所述的装置,其中所述向该能量源发出指令来向该刺激电极释放电能包括向该能量源发出指令来按序向每一个刺激电极传输至少一个刺激脉冲,并且其中所述的映射算法包括:1)在刺激电极未向静脉释放电能时,记录血流动力或生理参数的基准值,并2)记录血流动力或生理参数在每一刺激脉冲作用下的反应值。42.以上实施例构想36到41中任意一项所述的装置,其中所述向该能量源发出指令来向该消融电极释放电能包括向该能量源发出指令来按序向每一个消融电极传输至少一个刺激脉冲,并且其中所述的映射算法包括:1)在消融电极未向静脉释放电能时,记录血流动力或生理参数的基准值,并2)记录血流动力或生理参数在每一刺激脉冲作用下的反应值。43.以上实施例构想41或42中所述的装置,其中所述的映射算法包括在记录数值时,将其与消融电极或刺激电极释放电能的记录值相关联。44.以上实施例构想41、42或43中所述的装置,其中所述的刺激脉冲是0到10ma范围内的电流(i),脉冲宽度(pw)在100到1000us范围内,频率(f)在20到40hz范围内,并且周期(d)在20到60秒范围内。45.以上实施例构想41、42、43或44中所述的装置,释放每一系列能量时进一步包括:1)判断所选血流动力或生理参数的数值是否超过基准值一定的阈值,或者超过基准值的20%,2)允许所选血流动力或生理参数的数值回落至或接近基准值,并重复测量至少三次,记录该至少三次测量的平均值,并3)如果标准差在+/-10%以内,确认所选参数的变化。46.以上实施例构想29到45中任意一项所述的装置,其中所述血流动力或生理参数可以从以下反应中选取:瞳孔放大、出汗增多、心率加快、血压升高、平均动脉血压升高或者这些的组合。47.以上实施例构想中任意一项所述的装置,其中所述的导管可以用来消融内脏大神经、内脏大神经根或交感神经链主干。48.以上实施例构想36到47中任意一项所述的装置,其中所述的消融元件包括至少两个射频电极,位于该导管的远端部分。49.以上实施例构想中任意一项所述的装置,包括一种映射装置,可以与控制器进行信息交流。50.以上实施例构想中所述的装置,其中所述的成像装置包括以下内容中的一种:x光成像装置,ct成像装置,磁共振成像(mri)装置、超声成像传感器。51.以上实施例构想27到48中任意一项所述的装置,并结合实施例构想49或50,其中所述的映射算法包括接收来自成像装置的图像,并根据此图像判断放置消融元件的正确位置。52.实施例构想51中任意一项所述的装置,其中所述的映射算法进一步包括通过能量源向消融元件传输能量,从而对该血管结构周围的组织进行消融,装置的远端部分会处于此区域,例如肋间静脉区域,的5毫米范围内。53.实施例构想51或52中所述的装置,其中所述的控制器可以在只有确认消融元件位置正确时,使消融能量可以从能量源传输到消融元件。54.实施例构想51、52或53中所述的装置,其中所述的消融元件包括至少两个射频消融电极,并且其中所述判断消融元件位置正确与否包括根据所述的图像判断该至少两个的电极是否位于正确位置。55.实施例构想54中所述的装置,其中所述通过能量源向消融元件传输能量的过程包括通过能量源向该至少两个的射频电极传输能量,从而对该血管结构周围的组织进行消融,装置的远端部分会处于此区域,例如肋间静脉区域,的5毫米范围内。56.以上实施例构想中任意一项所述的装置,其中所述的导管,并且特指该导管的远端部分,可以插入患者的肋间静脉,并可以在其中距离从该奇静脉分支出来一定距离的位置放置消融元件或刺激元件,特指距离血管接口5厘米(例如3厘米、2厘米、1厘米)范围内。实施例56所述的装置,其中所述的导管,并且特指该导管的远端部分,可以将该消融元件或该刺激元件,例如最远端的消融/刺激元件或射频电极,置于肋间静脉中距离肋椎关节5毫米的范围内。57.以上两个实施例构想中任意一项所述的装置,其中所述的导管,并且特指该导管的远端部分,包括至少两个射频电极,这两个射频电极可以作为消融元件或刺激元件,并且其中所述的导管,并且特指该导管的远端部分,在最远的电极置于肋间静脉中距离肋椎关节5毫米的范围内时,该至少两个的射频电极可以处于肋椎关节和连接着一条奇静脉的肋间静脉接口之间的位置。58.以上三个实施例构想中任意一项所述的装置,其中所述的导管包括一个或多个位于其远端部分的标记,用来识别导管插入血管,特别是肋间静脉,的深度。59.实施例构想58中所述的装置,其中所述的标记包括不透射线标记、机械标记,或者是不透射线的环带,环形突出标记或环形刻痕标记,位于该导管的远端部分并可以通过成像装置识别。60.以上实施例构想49到59中任意一项所述的装置,其中所述的成像装置,在该导管的远端部分处于一条肋间静脉中时,可以生成患者肺中相关位置的图像,该图像可以显示所述肋间静脉包含该导管远端部分,并且其中所述的控制器可以:1)接收所生成的图像,2)从生成的图像中判断所述的肋间静脉相对患者肺是否处于预定的距离范围内,3)只有患者肺的位置在所述预定距离外时,控制能量源传输消融能量。61.以上实施例构想49到60中任意一项所述的装置,其中所述的成像装置包括一种超声成像传感器,与该控制器连接并进行信息交流,并且位于该导管的远端部分。62.以上实施例构想中所述的装置,其中所述的超声成像传感器可以生成声波来反映肋间静脉与患者肺的相对位置,并且其中所述的控制器可以:1)接收生成的声波,2)从生成的声波中判断所述的肋间静脉相对患者肺是否处于预定的距离范围内,3)只有患者肺的位置在所述预定距离外时,控制能量源传输消融能量。63.实施例构想60、61或62中所述的装置,其中所述的预定距离至少是6毫米,其中所述的控制器可以在患者肺的位置距离所述肋间静脉至少6毫米时,控制该能量源传输消融能量,并且可以在患者肺的位置距离所述肋间静脉小于6毫米时,控制该能量源停止传输消融能量。64.以上实施例构想中任意一项所述的装置,其中所述的控制器控制的该能量源传输的消融能量可以造成消融元件周围5毫米范围内的组织热损伤,同时不会对5毫米范围以外的组织造成消融。65.以上实施例构想中任意一项所述的装置,其中所述的控制器可以执行对肺组织存在与否的探测程序,包括以下步骤:接收或判断位于消融元件附近的消融区域内组织的生理参数的至少一个测量值,将此生理参数数值与至少一个参考数值进行比较,并根据所述比较结果来探测消融区域中肺组织的存在情况。66.实施例构想65中所述的装置,其中所述的生理参数是一种组织电信号参数。67.实施例构想66中所述的装置,其中所述的生理参数是一种组织电阻抗参数。68.实施例构想65或66中所述的装置,其中所述的控制器可以接受所测量导管电极与地极之间或两个导管电极之间组织的生理参数数据。69.实施例构想65、66、67或68中所述的装置,包括一种电参数传感器,与该控制器连接进行信息交流,并且其中所述的控制器可以:-控制能量源在与之相连的导管电极和地级之间,或在两个与之相连的导管电极之间产生电流,-接收来自该电参数传感器的生理参数测量数据。70.实施例构想65中所述的装置,其中所述的生理参数是一种组织的声学参数。71.实施例构想66中所述的装置,其中所述的生理参数是一种组织的声学传导参数。72.实施例构想70或71中所述的装置,其中所述的控制器可以接受所测量导管声学发生器与位于该导管之外的接收器之间或统一导管上的声学发生器和接收器之间组织的生理参数数据,所述的声学传感器和声学接收器与该控制器连接进行信息交流。73.实施例构想72中所述的装置,其中所述的控制器可以:-控制能量源使一种声学信号可以从所述的声学发生器发出,-从该声学接收器中接收一种可探测的声学信号,作为发出声学信号的后续动作,-根据所述的发出和接收的信号判断生理参数的数值。74.实施例构想67、68或69中所述的装置,其中所述用于测量组织阻抗的电频率在5khz到5mhz范围内。75.实施例构想65到74中任意一项所述的装置,其中所述的控制器只有在消融区域内没有肺组织的情况下,可以控制该能量源进行充能,或传输消融能量。76.以上实施例构想中任意一项所述的装置,其中所述的控制器可以向该能量源发出指令,来释放适量的消融能量,从而进行消融,同时不会对肺造成损伤。77.以上实施例构想中所述的装置,其中所述消融元件包括一种消融电极,并且其中所述对消融能量的适量控制涉及到能量的大小,增量和时间。78.实施例构想77中所述的装置,其中所述的消融元件可以是聚焦或非聚焦的,高频或低频的超声波,并且对能量的适量控制涉及到能量的大小,时间,聚焦深度或频率。79.以上实施例构想中任意一项所述的装置,其中所述的控制器可以向能量源发出指令来连续性或间隙性释放消融能量。80.以上实施例构想65到79中任意一项所述的装置,其中所述的控制器可以连续地或在某时间间隔内进行肺组织存在与否的探测程序。81.实施例构想80中所述的装置,其中所述的控制器可以在探测出肺组织处于消融区域内时防止该能量源对消融元件供能,并在探测出肺组织不处于消融区域内时该能量源可以对消融元件供能。82.以上实施例构想中任意一项所述的装置,包括一种导管回收元件,可以将该导管从血管内完全或部分收回。83.实施例构想82中所述的装置,其中所述的导管回收元件包括一种自动机制,与该控制器相连进行信息交流,并作用于该导管,该控制器可以向该自动机制发出指令,将该导管从血管中收回。84.实施例构想83中所述的装置,其中所述的自动机制包括一种线性制动器、一种机动元件、一种棘轮、一种棘轮架或一种螺旋机制中的一种。85.根据实施例构想83或84中所述的装置,其中所述的控制器可以向该自动机制发出指令,将该导管从血管中以一种固定速率或由反馈信号决定的速率收回。86.以上实施例构想中所述的装置,其中所述的反馈信号包括所述组织温度的变化或阻抗的变化,并且其中所述的控制器可以根据所述的反馈信号,通过该自动机制将该导管从血管中自动拉回。87.以上实施例构想83到86中任意一项所述的装置,其中所述的控制器可以向自动机制发出指令,将该导管从血管中收回的同时,向消融电极供能,并沿血管壁进行消融。88.以上实施例构想83到87中任意一项所述的装置,其中所述的控制器可以向自动机制发出指令,根据一种螺旋标识,将该导管从血管中收回。89.以上实施例构想83到88中任意一项所述的装置,其中所述的控制器可以向自动机制发出指令,以某一固定速率将该导管从血管中收回,例如每秒约1毫米,同时传输消融能量,从而可以造成延长的消融损伤。90.以上实施例构想83到89中任意一项所述的装置,其中所述向的控制器可以向自动机制发出指令,按照某一固定速率将该导管从血管中收回,例如每秒约1毫米,同时通过在短距离内释放能量来造成若干静态损伤,例如造成若干5毫米大小的重复位置的损伤。91.以上实施例构想中任意一项所述的装置,包括可部署的曲线结构和位于该曲线结构上的可部署消融元件。92.实施例构想91中所述的装置,其中所述的曲线结构可以由超弹材料,例如镍钛诺,制成,并且该曲线结构可以用来确认血管壁的轮廓。93.实施例构想91或92中任意一项所述的装置包括不同长度的曲线结构,可以在收回套管时聚集存留在较小的装置中。94.以上实施例构想中任意一项所述的装置包括安置在一种螺旋形弹簧上的电极。95.以上实施例构想中任意一项所述的装置,其中所述的指令程序包括一系列的监控,包括对一种生理反应的监控,来确认靶标神经是否成功消融,并在该生理反应与传输消融能量之前相比未变化时可以反复传输消融能量。96.以上实施例构想中任意一项所述的装置包括一种呼吸监控装置,与该控制器相连进行信息交流。97.以上实施例构想中所述的装置,其中所述的呼吸监控装置包括一个或多个呼吸传感器,或包括一种呼吸带、一种加速度计、一种氧饱和度仪、一种组织阻抗计,可以用来产生与患者呼吸相关的电信号。98.以上实施例构想中所述的装置,其中所述的控制器可以:-来自该呼吸监控装置与患者呼吸相关的电信号-从该信号中判断如下情况中的一项或多项:·呼吸率(单位时间内的呼吸次数)·呼吸率(单位时间内的呼出或吸入量)·每一次呼吸中呼气的开始时间·每一次呼吸中吸气的开始时间·每一次呼吸中呼气的时长·每一次呼吸中吸气的时长-根据以上一个或多个参数控制所述的能量源传输消融能量。99.实施例构想96或97中所述的装置,其中所述的呼吸监控装置可以生成与患者呼吸相关的电信号,并且自带的计算单元可以从所述的一个或多个信号中判断与患者呼吸相关的如下参数:·呼吸率(单位时间内的呼吸次数)·呼吸率(单位时间内的呼出或吸入量)·每一次呼吸中呼气的开始时间·每一次呼吸中吸气的开始时间·每一次呼吸中呼气的时长·每一次呼吸中吸气的时长其中所述的控制器可以接受所述呼吸参数中段一个或多个,并根据参数控制所述的能量源传输消融能量。100.实施例构想98或99中任意一项所述的装置,其中所述的控制器可以将消融能量的传输与所述呼吸参数同步。101.以上实施例构想96到100中任意一项所述的装置,其中所述的控制器可以控制该能量源仅在呼气时传输消融能量。102.以上实施例构想96到101中任意一项所述的装置,其中所述的控制器可以探测到患者吸气的开始,并紧接着在患者开始吸气时,向该能量源发出指令来中止消融能量传输。103.以上实施例构想96到102中任意一项所述的装置,其中所述的控制器可以探测到患者吸气动作正在进行,并在患者吸气时,向该能量源发出指令来阻止消融能量的传输。104.以上实施例构想96到103中任意一项所述的装置,其中所述的控制器可以探测到患者吸气的结束,并在患者结束吸气时,向该能量源发出指令来恢复消融能量传输。105.以上实施例构想中任意一项所述的装置,其中所述的控制器在传输消融能量时或之前,可以向该用户界面发出一个信号,来指导该患者进行极限程度的呼气。106.以上实施例构想中任意一项所述的装置,其中所述的控制器可以根据呼吸率来调节能量和消融时间,来维持预定时间段内的消融总能量。107.以上实施例构想中任意一项所述的装置,其中所述的控制器可以控制所述的能量源以一定的幅度传输消融能量,从而可以在患者呼气期间产生热损伤。108.一种改善患有心衰或与心衰相关症状患者心脏功能的方法包括:放置一种血管内导管,该导管包括近端部分、柔性套管和远端部分,其中所述的柔性套管包括其近端和远端部分,并且其长度足以接近患者腹腔血管内相对于介入位置的附近,其中所述的近端部分留在患者体外,并且其中所述的远端部分可以在患者血管中递进,并可以到达与腹腔血管壁接触的位置,并包括至少一个消融元件、至少一个刺激元件和至少一个探测元件;在患者血管中递送该远端部分;使用至少一个消融元件;并从患者体内回收该血管内导管。109.实施例构想108中所述的方法,其中所述的递送步骤进一步包括确认放置成功与否。110.实施例构想108中所述的方法,其中所述消融元件的使用进一步包括确认某条神经成功消融与否。111.实施例构想108中所述的方法,其中所述的近端部分包括一种能量源和一种内置逻辑算法和软件的控制器。112.实施例构想108中所述的方法,其中所述的近端部分包括一种能量源和一种内置逻辑算法和软件的控制器,并进一步包括一种用户界面。113.实施例构想108中所述的方法,其中所述的每一个消融元件至少装配有一个刺激元件。114.实施例构想108中所述的方法,其中所述的远端部分进一步包括一种探测元件,可以从,系统性肺动静脉血压传感器、至少一个心输出量探测器、至少一个血流监测器或以上的组合,中选取。115.实施例构想108中所述的方法,其中所述的远端部分进一步包括一种探测元件和至少一个其它的位于该循环系统不同位置的探测元件。116.实施例构想108中所述的方法,其中所述的消融元件可以从下列选项中选择:一种电极、低温控制台、药物递送装置、注入神经传导阻隔介质、超声装置、射频装置、热消融装置、激光装置和以上各种组合。117.实施例构想116中所述的方法,其中所述的射频装置向外输出电流的频率在350到500khz范围内,并且功率在5到50w范围内。118.实施例构想108中所述的方法,其中所述的探测元件可以是一种血压传感器。119.实施例构想108中所述的方法,其中所述的探测元件可以是一种组织温度传感器。120.实施例构想108中所述的方法,其中所述的探测元件可以是一种血流动力学传感器。121.实施例构想108中所述的方法,其中所述的探测元件可以是一种环境温度传感器。122.实施例构想108中所述的方法,其中所述的探测元件可以是一种组织阻抗传感器。123.实施例构想108中所述的方法,其中所述的远端部分包括一种可部署的结构,可以从下列选项中选择:一种球囊、笼结构、篮结构、预成型结构、套索环形结构和以上各种的组合。124.实施例构想108中所述的方法,其中所述的介入位置可以是桡静脉,臂静脉,锁骨下静脉,颈静脉或股静脉。125.实施例构想108中所述的方法,其中所述的放置步骤是这样进行的,通过引进并递送一种导丝来辅助导管在患者血管中的递进。126.实施例构想108中所述的方法,其中所述的腹部血管可以是小静脉。127.实施例构想108中所述的方法,其中所述的腹部血管可以是小胸静脉。128.实施例构想108中所述的方法,其中所述的腹部血管可以是一条奇静脉。129.实施例构想108中所述的方法,其中所述的腹部血管可以是一条半奇静脉。130.实施例构想108中所述的方法,其中所述的腹部血管可以是一条肋间静脉。131.实施例构想108中所述的方法,其中所述的消融元件和刺激元件位于该导管上相对分开的位置,从而在其间的区域内,通过刺激元件传输的刺激信号在此区域可以对应于消融元件传输消融能量的消融区域,从而足以产生对神经组织的不可逆消融作用。132.实施例构想108中所述的方法,其中所述的导管可以是无菌的、可伸长的、柔性的、灌浸的、套裹的、可弯曲的、射线荧光的、不透射线的或以上性质的组合。133.实施例构想108中所述的方法,其中所述对放置该远端部分位置的确认是通过一种自动算法对血流动力学或生理参数的变化判断来进行的。134.实施例构想133中所述的方法包括选择电极或电极对,记录血流动力学参数的基准线,通过电流(i)传输刺激脉冲,脉宽(pw)、频率(f)和周期(d)在0到10ma、100到100us、20到40hz、50%的周期在20到60秒范围内,记录选出的血流动力学参数。135.实施例构想134中所述的方法进一步包括判断所选血流动力或生理参数的数值是否超过基准值的20%,允许所选血流动力或生理参数的数值回落至或接近基准值,并重复测量至少三次,记录该至少三次测量的平均值,并且如果标准差在+/-10%以内,确认所选参数的变化。136.实施例构想135中所述的方法,其中所述血流动力或生理参数可以从以下反应中选取:瞳孔放大、出汗增多、心率加快、血压升高、平均动脉血压升高或者这些的组合。137.一种改善患有心衰或与心衰相关症状患者心脏功能的方法包括:实施例构想137中所述的方法放置一种血管内导管,该导管包括近端部分、柔性套管和远端部分,其中所述的柔性套管包括其近端和远端部分,并且其长度足以接近患者腹腔血管内相对于介入位置的附近,其中所述的近端部分留在患者体外,并且其中所述的远端部分可以在患者血管中递进,并可以到达与靶标神经邻近的血管壁接触的位置,并包括至少一个消融元件、至少一个刺激元件和至少一个探测元件;在患者血管中递送该远端部分,在静脉内壁释放电刺激来刺激邻近的神经,探测生理变化,从而确认至少一个的消融元件是否成功放置;预先在静脉内壁释放足以刺激邻近神经的电刺激,来确认对靶标神经的不可逆消融;并从患者体内回收该血管内导管。138.实施例构想137中所述的方法进一步包括该远端部分的重复放置和重复进行电刺激,直到确认成功放置。139.一种方法包括在电极向肋间静脉释放电能时,通过探测患者至少一个血流动力学参数或生理参数的变化,来判断导管电极在肋间静脉中是否邻近于患者的靶标神经。140.实施例构想139中所述的方法,其中所述的电极是多个导管电极中的一个,并且该方法进一步包括从每一个电极向肋间静脉轮流释放电能,并选择其中至少一个电极,在其释放电能时,可以引起至少一个所选的血流动力学参数或生理参数的变化。141.实施例构想140中所述的方法进一步包括在电极不在肋间静脉上释放电能时记录血流动力学参数或生理参数的基准线,向每一个电极轮流释放至少一个刺激脉冲,其中所述刺激脉冲的电流(i)传输刺激脉冲,脉宽(pw)、频率(f)和周期(d)分别在0到10ma、100到100us、20到40hz、20到60秒范围内,记录选出的相应于每个刺激脉冲的血流动力学参数或生理参数,并在记录数据时将记录的数值与释放电能的电极相关联。142.实施例构想142中所述的方法,在每一系列的能量释放过程中,进一步包括判断所选血流动力或生理参数的数值是否超过基准线,允许所选血流动力或生理参数的数值回落至或接近基准值,并重复测量至少三次,记录该至少三次测量的平均值,并且如果标准差在+/-10%以内,确认所选参数的变化。143.实施例构想139中所述的方法,其中所述的血流动力或生理参数可以从以下反应中选取:瞳孔放大、出汗增多、心率加快、血压升高、平均动脉血压升高或者这些的组合。144.一种用来消融内脏大神经或内脏大神经根的导管包括至少两个射频电极,位于该导管的远端部分,一种递送导丝的内腔,该导管可以造成多个复位的损伤。145.使用实施例构想144中所述导管的方法包括的步骤有:a.)通过患者的静脉系统向肋间静脉递送该导管的远端部分,其中所述最远端的射频电极放置于肋间静脉内,并距离肋椎关节5毫米以内的范围,其中所述的至少两个的射频电极可以处于肋椎关节和连接着一条奇静脉的肋间静脉接口之间的位置,b.)运用一种医学成像模式显示该肋间静脉内的该导管的远端部分,从而确认该至少两个的射频电极位于理想位置,c.)向该至少两个的射频电极传输消融射频能量,来对该肋间静脉周围5毫米半径范围内的组织进行热消融,并d.)从患者体内收回该导管。146.实施例构想145中所述的方法进一步包括监测一种生理反应,来确认靶标神经是否成功消融,并在该生理反应与释放消融能量前相比未变化时反复释放消融能量。147.一种对内脏大神经或内脏大神经根进行血管内消融的系统包括一种消融导管,可以对内脏大神经或内脏大神经根进行血管内消融,一种呼吸监控装置、一种计算机控制器和一种消融控制台,该计算机控制器可以利用其中所述来自该呼吸监控装置的信号控制消融能量的释放,幅度足够大的能量可以在患者呼气时产生热损伤,并在患者吸气时停止释放。148.一种对肋间静脉内的内脏大神经或内脏大神经根进行血管内消融的导管包括一种位于该导管远端部分的消融能量元件和一种超声成像传感器,和一个导丝腔。149.使用实施例构想148中所述导管的方法包括从该超声成像传感器中生成一种声波,来显示患者肺相对该肋间静脉的位置图像,在该患者肺位于该肋间静脉壁6毫米以外时进行能量传输,并在该患者肺位于该肋间静脉壁6毫米以内时不进行能量传输,其中所述的消融能量是用来距离该消融元件5毫米范围内造成热损伤,而非消融5毫米范围外的组织。150.一种改善患有心衰或与心衰相关症状患者心脏功能的方法包括:至少消融一条胸内脏神经的一部分,来阻隔神经信号在该神经中的传导,通过阻隔该神经信号可以提高该内脏血管池中血管的顺应性。151.实施例构想150中所述的方法进一步包括在血管间向一条肋间静脉递送一种携带在消融导管上的消融元件,并且其中所述的消融步骤包括从该消融元件向该胸内脏神经的至少一部分递送消融能量。152.实施例构想151中所述的方法进一步包括从一条奇静脉、半奇静脉或半奇静脉附属静脉向该肋间静脉内递送该消融导管。153.实施例构想152中所述的方法,其中所述向该肋间静脉内递送该消融导管包括向t5至t11,或t8至t11肋间静脉中的一条内递送该消融导管。154.实施例构想152中所述的方法,其中所述向该肋间静脉内递送该消融导管包括向横膈膜向上三级内的一条肋间静脉中内递送该消融导管。155.实施例构想151中所述的方法,其中所述递送该消融能量包括在该消融元件位于距离接口0到50毫米范围内该肋间静脉从一条奇静脉分出的位置时递送消融能量。156.实施例构想151中所述的方法,其中所述从该消融元件向至少一个的内脏神经、一条内脏神经根和一条交感神经链干神经递送消融能量包括从该消融元件向其周围5毫米半径范围内创造消融区域。157.实施例构想151中所述的方法,其中所述消融步骤包括在该肋间静脉中回收该消融元件,同时从该消融元件释放消融能量来创造一种轴向延伸的消融区域,或者轴向延伸的非线性(螺旋)消融区域。158.实施例构想151中所述的方法,其中所述递送消融能量包括递送消融射频能量。159.实施例构想151中所述的方法,其中所述递送消融能量包括递送消融超声能量。160.实施例构想159中所述的方法,其中所述的消融元件包括一种超声传感器,进一步包括向一种球囊中填充流体,使得该超声传感器处于该球囊中。161.实施例构想151中所述的方法进一步包括在该肋间静脉中确认消融元件的理想位置。162.实施例构想161中所述的方法,其中所述的消融导管进一步包括一种临时模块元件,其中所述向对象肋间静脉内递送消融元件的同时也向其中递送该模块元件。163.实施例构想162中所述的方法进一步包括从该临时模块元件传递一种不同于消融信号的临时模块信号,或可以是一种抑制或刺激信号,并测量相应于该临时模块信号的生理反应(例如血流动力学变化),并根据此反应判断消融元件是否在理想的位置递送消融能量并对至少一个的内脏神经、内脏神经根和交感神经链干神经进行成功消融。164.实施例构想163中所述的方法,其中所述测量一种生理反应包括测量血压和心率中的至少一项。165.实施例构想163中所述的方法,其中所述的判断步骤包括判断至少一条非靶标神经是否处于消融区域中。166.实施例构想150中所述的方法可以为对象带来的好处有可测量的运动能力改善程度。167.一种经血管消融导管包括一种安装在第一套管上的球囊,在此第一套管中有一条内腔通道,一种第二套管可以在此通道中滑移,并且在该第二套管上安装有一种能量传输元件。168.实施例构想167中所述的导管,其中所述的能量传输元件直径大于该内腔,并位于可部署球囊的远端。169.实施例构想167或168中所述的导管进一步可以使得该能量传输元件在该可部署球囊远端部分0到3厘米的距离范围内滑移。170.实施例构想167到169中所述的导管进一步包括一种通过该第二套管的导丝腔。171.实施例构想167到170中所述的导管进一步包括第二个可部署球囊,位于该能量传输元件远端,并且其中所述的导管可以使该能量传输元件在该第一球囊和第二球囊之间的距离内滑移。172.一种可以改善心脏功能,同时降低对象肺组织损伤风险的方法包括:探测对象肺的至少一个生理特性;并传输消融能量来对一条内脏神经、内脏神经根和交感神经链干神经中的至少一条进行消融,从而阻隔神经信号在该神经上的传递,即通过阻隔该神经信号可以提高该内脏血管池中血管的顺应性,并且其中所述传输的至少一个的消融能量是根据对象肺至少一个的特性而定。173.实施例构想172中所述的方法,其中所述探测对象肺的至少一个生理特性包括探测患者呼吸周期的至少一个方面。174.实施例构想172中所述的方法,其中所述探测患者呼吸周期的至少一个方面包括探测患者何时处于吸气或呼气的状态,并且在相对应患者呼气和吸气时,探测该消融能量传输的至少一个的传输参数。175.实施例构想174中所述的方法,在吸气时不传输该消融能量。176.实施例构想175中所述的方法,在患者呼气后的闭气状态下传输该消融能量。177.实施例构想176中所述的方法进一步包括引导该患者在呼气后进行闭气。178.实施例构想175中所述的方法,在呼气的部分时间段内可以传输消融能量。179.实施例构想173中所述的方法进一步包括在判断该患者的肺处于消融区域时暂停消融能量的传输,并在判断该患者的肺处于消融区域以外时重新开始传输消融能量。180.实施例构想173中所述的方法进一步包括当患者进入该呼气周期的第一阶段时暂停消融能量的传输,并在判断患者进入该呼气周期非同与该第一阶段的第二阶段时重新开始消融能量的传输。181.实施例构想172中所述的方法,其中所述探测患者肺的至少一个生理特性包括探测该靶标神经附近的组织阻抗或传导性,从而预测该肺与一种消融元件或消融区域的相对位置。182.实施例构想181中所述的方法,其中所述传输消融能量包括在判断该肺位于预定距离以外后传输消融能量。183.实施例构想181中所述的方法,其中所述探测该靶标神经附近的组织阻抗或传导性包括在一个呼吸周期内探测阻抗或传导性,并在该患者的呼吸周期内反映出该靶标神经附近的阻抗或传导性的变化。184.实施例构想183中所述的方法,其中所述传输消融能量包括在判断该肺位于预定距离以外后传输消融能量。185.实施例构想183中所述的方法,其中所述探测该靶标神经附近的组织阻抗或传导性包括在一个呼吸周期内探测阻抗或传导性,并在该患者的呼吸周期内反映出该靶标神经附近的阻抗或传导性的变化。186.实施例构想185中所述的方法进一步包括根据探测的阻抗和传导性判断该患者何时处于呼气阶段的末尾阶段。187.实施例构想184中所述的方法,其中所述预测该肺与一种消融元件或消融区域的相对位置是在该患者处于呼气或呼气的末尾阶段时进行的。188.实施例构想183中所述的方法进一步包括监控该患者的呼吸周期,并将该周期与该周期内探测的阻抗和传导性相关联。189.实施例构想181中所述的方法,其中所述预测该肺与一种消融元件的相对位置包括预测肺组织和一种消融元件或消融区域之间的距离。190.实施例构想189中所述的方法,其中所述预测该肺与一种消融元件或消融区域的相对位置包括在该患者处于呼气或呼气的末尾阶段时预测该肺与一种消融元件或消融区域的相对位置。191.实施例构想189中所述的方法,其中所述传输消融能量是在判断该肺距离该消融元件或消融区域足够远时进行的。192.实施例构想181中所述的方法,其中所述探测的阻抗和传导性包括运用位于一条肋间静脉中的探测装置来探测组织的阻抗和传导性。193.实施例构想172中所述的方法,其中所述探测患者肺的至少一个生理特性包括成像显示该血管内的组织,在该血管内放置有一种成像元件,可以判断该血管与肺组织的距离。194.实施例构想193中所述的方法,其中所述判断该血管与肺组织的距离包括判断该肺组织与一种消融元件或消融区域的距离是否足够远,从而可以安全地对该内脏神经、内脏神经根和交感神经链干神经中至少一条进行消融,并且传输消融能量是在判断该肺距离该血管或消融区域足够远时进行的。195.实施例构想172中所述的方法进一步包括向靶标神经组织而不是向非靶标组织传导消融能量。196.实施例构想172中所述的方法进一步包括在一条肋间静脉中,或通过奇静脉,放置一种消融导管的远端部分。197.实施例构想196中所述的方法,其中所述的肋间静脉可以是t5至t11或t8至t11肋间静脉。198.实施例构想196中所述的方法,其中所述的肋间静脉是该患者横膈膜向上三级以内的一条肋间静脉。199.实施例构想172中所述的方法,其中所述传输该消融能量包括向一个区域传输消融能量,此区域是该肺凹进的区域或没有肺组织的区域。200.实施例构想172中所述的方法进一步包括引导该患者进行呼气或呼气后进行闭气中至少一项动作,并且其中所述消融能量的传输不是在吸气阶段中进行,而是在患者呼气或呼气后进行闭气的阶段中进行。201.实施例构想172中所述的方法可以为对象带来的好处包括可测量的运动能力改善程度。202.实施例构想201中所述的方法,其中所述可测量的运动能力改善程度包括肺毛细血管楔压(pcwp)增量的降低和相应于运动时肺动脉血压(pap)的降低。203.实施例构想172中所述的方法可以带来的好处包括血管顺应性(以dp/dv为指标)的可测量的改善。204.实施例构想172中所述的方法可以带来的好处包括降低肺动脉血压和以肺动脉血压为指标的pcwp。205.一种改善患有心衰或与心衰相关症状患者心脏功能的方法包括:向邻近一条胸内脏神经的一条血管递送一种消融导管,该消融导管包括一种消融元件和一种与该消融元件周向间隔排列的肺监控元件;启动该肺监控元件;判断该患者的肺是否位于与消融元件相应的消融区域之外;启动该消融元件在该患者的肺位于消融区域之外时向一条内脏神经传输消融能量,并因此可以阻隔该胸内脏神经的神经信号传导。206.一种改善患有心衰或与心衰相关症状患者心脏功能的方法包括:向一条肋间静脉血管内递送一种消融导管,该消融导管包括一种消融元件和一种与该消融元件周向间隔排列的肺监控电极;启动该肺监控电极;监控该肺监控电极附近感应区内的生理阻抗;判断该患者的肺是否位于与消融元件相应的消融区域之外的安全区域;并启动该消融元件在该患者的肺位于消融区域之外的安全区域时向一条内脏大神经传输消融能量,并因此可以阻隔该胸内脏大神经的神经信号传导。207.一种改善患有心衰或与心衰相关症状患者心脏功能的方法包括:向邻近一条内脏神经的一条血管递送一种消融导管,该消融导管包括一种消融元件;判断该患者的肺是否位于与消融元件相应的消融区域之外,或与该消融元件距离足够远从而避免严重伤害;启动该消融元件在该患者的肺位于消融区域之外或距离足够远时向一条内脏神经传输消融能量,并因此可以阻隔该内脏大神经的神经信号传导。208.一种胸内脏神经的血管内消融系统包括一种导管,该导管包括一种远端部分,可以通过患者的血管向一条奇静脉、半奇静脉、半奇静脉附属静脉或后肋间静脉内递送,该远端部分包括:一种消融能量传输元件,可以在消融区域内消融组织;一种阻抗测量电极,可以测量生理阻抗感应区内的组织生理阻抗;和一种控制器,可以与该消融能量传输元件和阻抗测量电极进行信息交流;其中所述的控制器可以:在测量的组织阻抗表示肺组织不在该生理阻抗感应区时提高消融能量的传输量;并在测量的组织阻抗表示肺组织在该生理阻抗感应区时降低消融能量的传输量209.实施例构想208中所述的系统,其中所述的生理阻抗测量电极位于该消融能量传输元件30毫米范围内。210.实施例构想208或209中所述的系统,其中所述的生理阻抗测量电极位于该消融能量传输元件至少10毫米距离之外。211.实施例构想208中所述的系统,其中所述测量的表示肺组织在该生理阻抗感应区的组织阻抗包括500到2000欧范围内的阻抗,并且测量的表示肺组织不在该生理阻抗感应区的组织阻抗包括100到500欧范围内的阻抗。212.实施例构想209中所述的系统可以在从该消融能量传输元件半径不超过5毫米的范围内创造消融区域,并且可以在从该阻抗测量元件半径大于该消融区域但是不超过20毫米的范围内创造生理阻抗感应区域。213.实施例构想208中所述的系统进一步包括一种阻抗参照电路。214.实施例构想208中所述的系统进一步包括一种第二阻抗测量电极,位于该导管第一阻抗测量电极的近端区域。215.实施例构想214中所述的系统,其中所述的导管可以将该第一阻抗测量电极置于第一条肋间静脉中,并且将该第二阻抗测量电极置于一条奇静脉、第二条肋间静脉、半奇静脉或半奇静脉附属静脉中的一项中。216.实施例构想214中所述的系统,其中所述的导管可以将该第一和第二阻抗电极置于某区域中,在该区域中电流可以在这两个电极间流通,该区域经过了该患者肺组织随呼吸动作进出的区域。217.实施例构想208中所述的系统,其中所述至少一个的消融电极是一种射频电极,与一种弥散地级进行电交流。218.实施例构想208中所述的系统,其中所述至少一个的消融电极是两个射频电极,在该导管远端部分形成一种双极结构。219.使用实施例构想218中所述导管的方法包括将这两个射频电极置于一条肋间静脉中的区域内,该区域是在该接口和该奇静脉之间并且邻近肋椎关节的一条胸内脏神经横穿该肋间静脉的区域。220.一种经血管神经消融的方法包括:向邻近靶标神经的一条血管内递送一种携带一种消融元件的可伸长套管,该血管有一条内腔;在沿该血管的某一位置缩小该内腔的尺寸;在缩小步骤之后,从该消融元件向该靶标神经传输消融能量;并运用该消融能量消融该靶标神经的至少一部分。221.一种经血管神经消融的方法包括:向邻近靶标神经的一条血管内递送一种携带一种消融元件的可伸长套管,该血管有一条内腔;在沿该血管的某一位置减缓血流;在减缓步骤之后,从该消融元件向该靶标神经传输消融能量;并运用该消融能量消融该靶标神经的至少一部分。222.一种经血管对靶标神经进行消融的装置包括:一种递送装置,可以与一种可伸长的套管相连,该套管可以伸入一条血管的管腔中,其中所述的递送装置可以:在沿该血管的某一位置缩小该内腔的尺寸或减缓血流,并传输适于对所述靶标神经进行消融的消融能量。223.根据实施例构想222中所述的装置,其中所述的递送装置可以至少在一种内腔中进行内腔缩减能量模式和消融能量模式的操作,在其中所述的内腔缩减能量模式中,该递送装置可以从一种能量传输元件中生成并传输一种第一种能量,并且在其中所述的消融能量模式中,该递送装置可以从这种能量传输元件或另一个能量传输元件中生成并传输一种不同于第一种能量的第二种能量。224.根据实施例构想223中所述的装置,其中所述可伸长的套管包括:由该套管一部分所携带的若干电极;并且该递送装置包括:一种能量供给源,可以向上述的若干电极供能;一种与该能量供给源连接的控制器,其中所述的控制器可以执行下列控制步骤:在该递送装置处于内腔缩减能量模式时,控制该能量供给源向上述若干电极中的一个传输该第一种能量,从而缩减该血管内腔的尺寸,并在该递送装置处于消融能量模式时,控制该能量供给源向上述若干电极中的一个传输该第二种能量,从而对所述的靶标神经进行消融。225.根据实施例构想224中所述的装置,其中所述可伸长的套管包括:由该套管一部分所携带的若干电极;和由另一套管的一部分所携带的另外若干电极;并且该递送装置包括:一种能量供给源,可以向上述的若干电极和另外的若干电极供能;一种与该能量供给源连接的控制器,其中所述的控制器可以执行下列控制步骤:在该递送装置处于内腔缩减能量模式时,控制该能量供给源向上述若干电极中的一个传输该第一种能量,从而缩减该血管内腔的尺寸,并在该递送装置处于消融能量模式时,控制该能量供给源向上述另外的若干电极中的一个或多个传输该第二种能量,从而对所述的靶标神经进行消融。226.根据实施例构想224或225中所述的装置,其中所述控制该能量供给源向上述若干电极中的一个传输该第一种能量,从而缩减该血管内腔尺寸的过程,包括向上述若干电极传输一种电信号来产生下列一个或几个效果:将该电极表面加热到一定的预设温度,并从该电极释放一种刺激信号来导致该血管的收缩。227.根据实施例构想224、225或226中所述的装置,其中所述其中所述控制该能量供给源向上述若干电极中的一个传输该第一种能量,从而缩减该血管内腔尺寸的过程,包括传输射频电流。228.根据实施例构想225中所述的装置,并结合实施例构想226到227中任何一项的内容,其中所述控制该能量供给源向上述的若干电极中的一个或多个传输该第二种能量,从而对所述的靶标神经进行消融的过程,包括传输消融射频电流。229.根据实施例构想226中所述的装置,并结合实施例构想227到228中任何一项的内容,其中所述控制该能量供给源向上述另外的若干电极中的一个或多个传输该第二种能量,从而对所述的靶标神经进行消融的过程,包括传输消融射频电流。230.根据实施例构想228或229中所述的装置,其中所述第二种能量的消融射频电流在传输时比第一种能量的消融射频电流的功率低并时长长。231.根据实施例构想230中所述的装置,其中所述的第一种能量是功率在10到20w、时长在5到15秒范围内的射频能量,而第二种能量是功率在2到10w、时长在1到2分钟范围内的射频能量。232.根据实施例构想226到231中任何一项所述的装置,与实施例构想225相结合,其中所述的能量供给源可以向相同的电极以某种序列方式传输第一种和第二种能量,或者其中所述的若干电极包括至少一个血管收缩元件和至少一个消融元件,进一步而言其中所述的能量供给源可以向该血管收缩元件传输第一种能量并向该消融元件传输第二种能量。233.根据实施例构想226到232中任何一项所述的装置,与实施例构想226相结合,其中所述的该可伸长的套管和该另外的可伸长的套管可以彼此耦合,并且该可伸长的套管可以相对于该另外的可伸长的套管滑移,或者该可伸长的套管可以在该另外的可伸长的套管内滑移,对于由该另外的套管所携带的另外的若干电极可以位于该套管所携带的该若干电极一定距离之外。234.根据实施例构想224到233中任何一项所述的装置,其中所述的能量供给源可以以某种序列方式先传输第一种能量,然后再传输第二种能量,从而可以先阻塞或部分阻塞所述的血管内腔,然后消融所述的靶标神经。235.根据实施例构想224中所述的装置,其中所述的可伸长的套管包括:由该套管一部分所携带的若干电极,在该可伸长套管伸入该血管内腔时,该若干电极可以位于该靶标神经附近;并且该递送装置包括:可以向该若干电极供能的能量供给源;一种流体流通管道,可以与一种流体源相连,该流体源可以是下列项目中的至少一项:一种真空源或一种血管收缩药物源,或是一种球囊填充液源;其中所述的管道有一个孔,位于该若干电极近端,或该管道可以向位于该若干电极近端的球囊进行供给;与该能量供给源和流体源相连的控制器可以执行下列控制步骤:在该递送装置处于内腔缩减能量模式时,控制该流体源分别进行如下项目中的一项:通过所述孔吸取流体来缩减该血管内腔的尺寸,或通过所述孔释放所述血管收缩药物来缩减该血管内腔的尺寸,或用填充液填充该球囊并阻塞该血管内腔;并在该递送装置处于消融能量模式时,控制该能量供给源向所述若干电极中的一个或多个传输一种能量,从而对所述的靶标神经进行消融。236.根据实施例构想235中所述的装置,其中所述的控制器可以以某种序列方式先控制所述的流体源,然后再控制该能量供给源,从而可以先进行下列项目中的一项:吸取流体,释放所述血管收缩药物或用填充液填充该球囊,然后向该若干电极传输能量,进而可以先阻塞或部分阻塞所述的血管内腔,然后消融所述的靶标神经。237.根据实施例构想235或236中所述的装置,其中所述控制该能量供给源向上述的若干电极中的一个或多个传输该能量,从而对所述的靶标神经进行消融的过程,包括传输消融射频电流。238.根据实施例构想235到237中任何一项所述的装置,其中所述可伸长套管的远端部分可以置于该血管内腔中,该若干电极包括至少一个与该能量供给源相连的消融元件,其中所述装置的孔可以通过该真空源吸引流体或可以通过该血管收缩药物源释放所述的血管收缩药物,该孔可以位于该可伸长套管上,其位置可以比该消融元件在该可伸长套管上更接近远端区域的位置;或者所述的球囊的位置可以比该消融元件在该可伸长套管上更接近远端区域的位置。239.根据实施例构想235到238中任何一项所述的装置,其中所述的管道可以与所述的球囊填充液流体源进行流体交互,并可以向位于该若干电极近端的球囊供给流体;进一步而言,其中所述的管道远端可以携带所述的球囊,该可伸长的套管可以套在所述的管道外滑移,或该可伸长套管与该管道都可以在一条公共引导套管中滑移,这样,该球囊就可以在距离由该可伸长套管携带所述若干电极的一定距离处放置,或者其中所述的球囊可以置于比所述若干电极更远端的位置。240.根据实施例构想224到239中任何一项所述的装置,其中所述的控制器可以进一步执行下列控制步骤:控制该能量供给源向所述的若干或另外的若干电极传输一种施加在该胸内脏神经的神经刺激信号,并且可以接收一种对应该刺激信号的生理反应的测量值,其中所述对应该刺激信号的生理反应的测量值可以利用所述的若干或另外的若干电极,通过该装置上的一种特定的传感器探测到。241.根据实施例构想225到240中任何一项所述的装置,其中所述的控制器可以进一步执行下列控制步骤:控制该能量供给源向所述的若干电极以不同时间间隔多次数的形式传输所述的能量,从而消融所述的靶标神经。242.根据实施例构想225到241中任何一项所述的装置包括一种温度传感器,位于该可伸长套管上所述若干电极的近端,或位于该另外的可伸长套管上所述另外若干电极的近端,其中所述的温度传感器与该控制器相连,并且其中所述的控制器可以执行下列控制步骤:从该温度传感器中接收一种温度探测信号,从所述的温度信号中判断该温度传感器附近的组织的实际温度,将该实际温度与一种靶标温度相比较,控制该能量供给源,在该递送装置处于消融能量模式时,向该若干电极或该另外的若干电极供能,特别是功率在5到15瓦的射频消融能量,知道该实际温度到达该靶标温度。243.根据实施例构想225到242中任何一项所述的装置,其中所述的可伸长的套管包括一种阻抗传感器,位于该可伸长套管上所述若干电极的近端,或位于该另外的可伸长套管上所述另外若干电极的近端,其中所述的阻抗传感器与该控制器相连,并且其中所述的控制器可以执行下列控制步骤:从该阻抗传感器中接收一种阻抗探测信号,从所述的阻抗信号中判断该阻抗传感器附近的组织的实际阻抗,将该实际阻抗与一种靶标阻抗相比较,控制该能量供给源或该流体源,在该组织的实际阻抗超过该靶标阻抗时,中断该血管收缩模式时,该靶标阻抗或可以在250到300欧范围内。244.根据实施例构想222到243中任何一项所述的装置,其中所述可伸长的套管的横截面最大半径不超过5毫米,最好是不超过3毫米。245.根据实施例构想222到244中任何一项所述的装置,其中所述可伸长的套管可以在一种套管内导向滑移。246.根据实施例构想222到245中任何一项所述的装置,其中所述可伸长的套管可以通过导丝引导。247.根据实施例构想222到246中任何一项所述的装置,其中所述的控制器可以是一种电控元件,可以执行一种存储在一种与该控制元件相连内存中的执行计算机程序。248.根据实施例构想222到247中任何一项所述的装置包括所述的可伸长的套管。249.根据实施例构想222到248中任何一项所述的装置包括所述的流体源。250.一种存储在内存中可以令计算机执行的程序,通过实施例构想245中装置的控制器执行时,所述的控制器可以执行实施例构想222到249中的任何步骤。251.一种在一条血管内进行经血管消融神经的计算机执行方法包括:存储在一种内存中并可以通过处理器执行的计算机执行方法,该计算机执行方法包括一种内腔收缩能量模式和一种消融能量模式,其中所述的内腔收缩能量模式,在启动时,可以生成第一种能量,并可以通过一种医疗装置上的能量传输元件传输,其中所述的消融能量模式,在启动时,可以生成第二种能量,并可以通过一种医疗装置上的第二个能量传输元件传输,该第二种能量传输元件可以是与第一种能量相同或不同的元件。252.实施例构想251中所述的方法进一步包括一种含有该内存的主机台。253.实施例构想252中所述的方法进一步包括一种携带能量传输元件的医疗装置,该计算机执行方法可以向该能量传输元件进行能量传输。254.实施例构想252中所述的方法,其中所述的消融能量模式包括一种低功率能量,并且其时长比内腔收缩能量模式长。255.实施例构想254中所述的方法,其中所述内腔收缩模式传输的射频功率在10到20瓦范围内,时长在5到15秒范围内,而消融能量模式传输的射频功率在2到10瓦范围内,时长在1到2分钟范围内。256.实施例构想255中所述的系统,其中所述的消融能量模式进一步包括首先传输功率在5到15瓦范围内的射频能量,直到达到靶标温度。257.实施例构想252中所述的方法,其中所述的内腔收缩能量模式可以根据上升的组织阻抗,或可在150到250或300欧姆范围内,来中止能量传输。258.实施例构想252中所述的方法,其中所述的计算机执行方法根据接收到的一种输入信号来启动消融能量模式。259.实施例构想252中所述的方法,其中所述的计算机执行方法可以进一步根据接收到的一种输入信号停止该内腔收缩能量模式,并也可以自动启动该消融能量模式。260.一种胸内脏神经或胸内脏神经根的血管内消融系统包括:携带至少一个电极的消融导管;一种消融能量台,可以连接并操纵该至少一个电极;一种生理监控器,可以输出第一组输出信号来探测该患者的呼吸周期;一种计算机控制器,可以接收第一组信号并生成第二组信号;并且其中所述的第二种信号可以与该消融能量从该消融台同步传输到该消融导管电极。261.一种胸内脏神经或胸内脏神经根的血管内消融系统包括:一种消融能量台,可以连接并操纵该至少一个电极,可以由导入血管内位于该胸内脏神经或胸内脏神经根近端的消融导管携带;一种生理监控器,可以输出第一组输出信号来探测该患者的呼吸周期;一种计算机控制器,可以接收第一组信号并生成第二组信号;并且其中所述的第二种信号可以与该消融能量从该消融台同步传输到该消融导管电极。262.一种消融系统包括:一种信号生成器,可以与一种消融导管连接,该信号生成器包括:一种适配器,允许该信号生成器与该消融导管之间进行电交流;和一种存储计算机执行方法的内存;一种与该内存连接的控制器,该控制器可以执行该计算机执行方法,其中所述的计算机执行方法包括下列步骤:通过该信号生成器接收一种阻抗测量信号,根据该信号判断肺是否处于敏感区域以外或与该导管所携带消融元件保持安全距离,在判断肺处于敏感区域以外或与该导管所携带消融元件保持安全距离时,生成一定消融级别的消融信号,反复进行该判断,在判断肺处于敏感区域以内或与该导管所携带消融元件没有保持安全距离时暂停该消融信号,反复进行该判断步骤,暂停步骤之后的一定时间内,在判断肺处于敏感区域以外或与该导管所携带消融元件保持安全距离后再次生成一种消融级别的消融信号。263.实施例构想262中所述的消融系统,其中所述的控制器作用在与该导管上一种消融元件相连的能量供给源上,其中所述消融信号的生成或暂停可以控制该能量供给源相应地发送或停止发送消融能量。264.实施例构想262到263中所述的消融系统进一步包括一种消融导管。附图说明图1是人体内分布到器官的交感神经纤维的解剖示意图。图2是失代偿性心力衰竭的机制流程图。图3是表示心衰时内脏间隔血流量分布的部分流程图。图4是表示通过所述方法治疗心衰时的效果部分流程图。图5是急性失代偿性心力衰竭病理生理学示意图。图6a和6b是一些血管、内脏神经和其它解剖结构的解剖关系示意图。图7是通过使用适用于进行刺激和消融的血管内导管对右tsn消融的奇静脉特征的解剖示意图。图8是通过使用适用于进行刺激和消融的血管内导管对左tsn消融的奇静脉特征的解剖示意图。图9是通过使用适用于进行刺激和消融的血管内导管对左tsn消融的半奇静脉特征的解剖示意图。图10是通过使用适用于进行刺激和消融的血管内导管对右tsn消融的半奇静脉特征的解剖示意图。图11a和11b是右tsn穿过该奇静脉到达后肋间静脉的特征解剖示意图。图12是该奇静脉和内脏大神经及其附近结构的解剖示意图,可以使一种适用于进行刺激和消融的血管内导管可部署的结构经静脉递送。图13是动物实验中主动脉和心室血压对应一条gsn电刺激的示意图。图14表示了一种可以在一条tsn和交感神经链附近的一条肋间静脉内适用于进行刺激和消融的导管。图15a和15b表示了对应于交感神经链(图15a)和gsn(图15b)刺激的不同的生理反应。图15c和15d是表示一种可以刺激靶标神经同时避免刺激疼痛神经的电刺激信号电场强度的有限元模型。图16表示一种映射算法,可以根据刺激传输后记录的平均动脉压(meanarterialpressure,map)来对电极对进行优选。图17a到17d表示了患者在阻隔某神经后的反应。图18是对一条消融后的神经进行刺激时平均动脉压随时间变化的示意图。图19是从甄选患者到消融治疗的流程图。图20a和20b是一种消融导管远端部分的示意图。图21、22a和22b是在一名患者体内将一种消融导管递送到一种肋间静脉内对靶标神经进行消融的示意图。图23表示了某患者胸腔的正面横截面中第8和第9肋骨附近潜在的靶标肋间静脉。图24a表示一种带呼吸反馈和控制功能的tsn消融系统。图24b表示一种带有组织阻抗和温度反馈与控制功能的tsn消融系统。图25a和25b表示了置于一条肋间静脉中用来探测肺组织与消融区域接近程度的一种tsn消融导管。图26表示了用来对靶标神经进行消融同时避免对肺组织造成损伤的一种经静脉tsn消融系统。图27表示了用来识别一种生理阻抗敏感区域内复杂阻抗参数的两个频率。图28是一种进行消融和肺组织探测的计算机算法流程图。图29a到29d是表示肺组织是否位于生理阻抗敏感区域内的阻抗和相差异的频率信息资料。图30表示了射频电压从消融级模式到非消融级模式的幅度差。图31a和31b表示了双电极和三电极阻抗测量模型示意图。图32是某患者的横截面示意图,表示了将一种消融导管递送入一条肋间静脉中对靶标神经进行消融。图33a和33b是某患者的横截面示意图,表示了将一种带有超声成像传感器的消融导管递送入一条肋间静脉中对靶标神经进行消融。图34和35是使用一种带有多个消融元件的tsn消融导管的示意图。图36是在一种可部署螺旋结构上带有多个消融元件的tsn消融导管示意图。图37带有一种超声消融传感器的tsn消融导管示意图。图38a到38e是一种tsn消融导管示意图,通过对靶标神经进行经血管消融后,对位于某消融区域远端的肋间静脉进行闭合。图38f表示的有限元模型描述了位于某消融区域附近奇静脉血流的效应。图38g是通过一种套管递送的tsn消融导管示意图。图39a是一种能量传输导管的示意图,该导管可以可以降低从某一奇静脉到某一肋间静脉接口的血流量。图39b是一种能量传输导管的示意图,该导管可以临时阻塞靶标肋间静脉的一段,降低从某一奇静脉到某一肋间静脉接口的血流量,并传输能量对靶标神经进行刺激或消融。图40是一种能量传输导管的示意图,该导管包括一种静脉闭合段和一种刺激或消融段。图41a和41b是一种导管的示意图,该导管包括多个能量传输元件,并且表示了在向靶标神经传输消融能量前在位于该能量传输元件附近的其中所述的肋间静脉内的使用方法。图42a和42b表示了在接近某静脉和接下来的消融过程中,功率、组织阻抗和监测温度随时间的曲线图。图42c和42d表示了增加能量传输时间的效果的有限元模型。图42e是一种有限元模型的示意图,表示在某一闭塞静脉内进行消融和在某一非闭塞静脉进行消融相比较的效果。图42f是一种有限元模型的示意图,表示在某一闭塞静脉内进行消融和在某一非闭塞静脉利用一种灌输电极进行消融相比较的效果。图43a是一种导管的示意图,该导管可以将一条靶标肋间静脉接口与一条奇静脉耦合。图43b到43f是一种tsn消融导管的示意图,该导管可以在与该接口耦合时,将消融元件朝靶标神经方向排列。图44、45和46是一种系统的示意图,该系统可以缩减某一血管的内腔并进行神经消融。具体实施方式本发明公布了通过增加静脉容量,减轻肺淤血和增加利尿反应机制来治疗心脏病、心功能障碍和心衰,特别是hfpef或可测量的例如呼吸困难等心脏病症状的医疗装置、方法和系统。该治疗方法也可以治疗伴随血流量重新分布的其它相关疾病,例如高血压、心肾综合征、门静脉高压、三尖瓣返流,或该胸内脏神经相关的其它症状,例如顽固性腹痛(如癌症患者)或利尿剂抵抗。这种治疗方法可以通过消融靶标神经的至少一部分来实现,通过运用一种在血管(例如奇静脉系统、肋间静脉或所选的一些肋间静脉)内递送的医疗装置对包括胸内脏神经(例如,内脏大神经、内脏小神经、内脏细小神经、内脏神经根、内脏神经)的靶标神经进行消融,从而阻碍或停止在该消融神经上的信号交流,这样可以对与心血管健康直接或间接相关神经因素的生理反应带来影响。本发明的一个实施例构想包括一种导管或其它可伸长医疗装置,可以通过患者的血管系统递送进入该奇静脉系统中的一条血管,来对一条右边或左边胸内脏神经进行消融。该导管可以包括一种消融元件(例如射频电极、低温加载器、化学介质递送针、超声传感器、激光发生器),并可以判断与靶标神经,例如某一条胸内脏神经或tsn神经根,或非靶标神经结构(例如电刺激电极、低温加载器、化学介质递送针、例如不透射线或回声发生标记装置的可视化设备)的接近程度。该导管可以是系统中的一部分,该系统也包括其他辅助该导管的设备。例如,该系统可以包括一种消融能量源(例如射频信号发生器、低温控制台、超声信号发生器、化学介质源或泵、激光发生器),一种内置软件算法的信号输入控制器和放大器、或一种计算机用户界面。为了消融靶标神经的一部分,该消融能量源可以从一种位于患者血管(例如奇静脉、肋间静脉或半奇静脉)内靠近该靶标神经的消融元件释放消融能量。该消融能量从该消融元件向该靶标神经传输。为了确认与靶标或非靶标神经结构的接近程度,可以通过递送一种刺激介质,例如一种电势场或一种激活交感神经的药物,来临时激活或阻隔神经活动,并且可以监控与该神经刺激或阻隔相关的某一生理反应。类似地,可以通过对该靶标神经的电刺激并观测器生理反应,包括对比消融前后的生理反应或应该出现而实际未出现的生理反应,来确认消融是否成功。在某些实施例构想中,可以探测一些非靶标解剖结构,例如肺,是否处于消融区域,或者利用例如组织电或声学阻抗信号来自动探测。■结构解剖图6a(矢状截面图)和6b(位于横膈膜向上2到3级脊椎骨范围内,例如t10级,的横截面图)表示了一些血管和内脏神经的解剖关系。该奇静脉41沿该胸脊柱(包括图7中从t1到t12的胸脊柱55)向上,向上腔静脉42和下腔静脉方向分布。该奇静脉系统包括该奇静脉41、半奇静脉43和半奇静脉附属静脉44(如图7)。该奇静脉41的支流包括后肋间静脉(这里也由肋间静脉40表示),在该肋间空间内分布。该半奇静脉和其附属静脉的分支包括左后肋间静脉(在此也由肋间静脉40表示)。这些静脉,特别是该肋间静脉40,从该内脏神经束中(例如内脏大神经45、内脏小神经46、内脏细小神经47、内脏大神经神经根48)中靶标神经至少一部分的接近处通过。由于该gsn45以gsn神经根48(与腹腔神经节50相关联)的形式形成于与该交感神经干49相连的节前纤维中,所有位于该交感神经干49和腹腔神经节50之间形成gsn45的节前纤维在此都简称gsn。类似地,所有位于该交感神经干49和腹腔神经节50之间形成该胸内脏神经,包括内脏大神经、内脏小神经和内脏细小神经,的节前纤维在此都简称胸内脏神经。图6b中所示一条肋间静脉40中位于该奇静脉41和肋椎关节54之间的一部分150与该gsn45和gsn神经根48很接近(例如距离为1到5毫米范围内)。该交感神经干在该肋椎关节54或肋骨颈63附近。主动脉51和横膈膜52在图6a中也有所表示。图6b也表示了食道56、胸导管57、迷走神经58、肋骨59、壁胸膜60、脏胸膜61、肺胸膜腔62和肺65。本发明的内容中,tsn可以代表右侧或左侧胸内脏神经及其神经分支,并且可以从该奇静脉或肋间静脉中的一条或两条中接近右侧胸内脏神经,或从该半奇静脉或肋间静脉中接近左侧胸内脏神经,或从其相应的分支,来进行经血管消融或刺激,或可以从该奇静脉和半奇静脉以及其分支中同时接近左右两侧胸内脏神经,并同时进行治疗。对tsn(不包括其神经根)及其神经根中的一条或多条进行消融比只消融tsn或只消融tsn神经根由更明显的效果。人类可以由2到7根gsn神经根。通常,最高位的神经根在t5或t6脊椎附近,但是在少数情况下可以在t3的高度附近。■生理学背景身体约5%的水分以血液的形式存在于血管中。静脉中约有总血量的70%,并且比动脉系统的顺应性高约30倍。静脉的顺应性可以表示环状器官或血管在内压(例如dp/dv)增加后,膨胀或流量增加的能力。在流量调节中涉及到许多机制,最重要的就是神经系统。动脉方面,通过阻力血管对流量和阻力进行调节。交感神经系统通过启动和停止心肺和动脉压力反射,并通过去肾上腺素的循环,在决定系统血管阻力(svr)中起到重要作用。血容量是衡量静脉功能的指标,而较高的血容量可以使更更多的血液贮存在对应的血管结构里。自主神经系统是血管血容量的主要调节机制。循环的血液分布于两个生理上的但是并不是解剖学分离的部分中:静脉池和有效循环量。“静脉池”一词(或“无反应性容量”)涉及到的血流量主要存储于内脏血管床,而并不影响有效的循环量。该静脉池也与“无反应性容量”或“血管容量”相关,可以通过一些机制收集,例如通过对交感神经系统的刺激、药物或荷尔蒙作用等。“有效血循环量”一词(或“反应性容量”)与主要在动脉系统和非内脏静脉血管内的血液有关,并且是心脏预载量的主要决定因素。该反应性血容量和系统血压是通过部分交感神经系统中的自主神经系统进行调节的。该无反应性血容量大多存储于该内脏血管池或“内脏血管床”中。该内脏血管池由内支气管的血管系统组成,包括肝脏、脾脏、大小肠和胰脏。由于较低的血管阻力和较高的容量,该内脏血管床可以吸收25%的co,并且该内脏静脉可以存储20%到50%范围内的总血量。继而,该内脏血管床起到一种主要的血液存储池的作用,在循环血流量发生任何变化时,主动或被动补充或释放所需血液量的大部分。通过在患有hf的患者、尸体和动物实验,本发明的作者可以:(a)通过对gsn进行选择性消融或刺激从而调整并修正该静脉池,并且(b)即使位于体内深处,也可以从浅静脉通过该静脉系统接近该gsn,例如,人类和一些动物中包括肋间静脉的奇静脉系统。内脏静脉与四肢静脉相比更加具有顺应性。动物和人类实验表明内脏血管池不仅可以存储大量血液,而且可以相应于流回到心脏的血量变化和心脏预加载的生理需求,从中主动或被动地向循环系统供血。启动该供给的决定因素之一是交感神经活动(sympatheticnerveactivity,sna),可以通过荷尔蒙和神经传导、肾上腺素和非肾上腺素的调节导致静脉收缩,从而降低内脏血管的容量并提高循环量的效果。这可以通过该内脏血管系统中大量肾上腺素受体对内脏神经系统变化的敏感性来解释。与动脉相比,内脏静脉含有的肾上腺素终端密集程度为动脉系统的5倍。该内脏血管床很适于顺应并存储大量血液,并可以向循环系统中供给血液,这样自然起到了临时存血的作用。这样的高血管容量可以使该内脏血管床保持心脏的预加载量,并继而保持动脉血压和全身范围内的co2变化量。当到达内脏血管床的存储量时,以增加的心脏预加载量并超过生理所需的形式表达总体液的升高,并且血管外水肿和肺内特定的体液堆积最终形成了hf的通常症状。对该交感神经系统(sympatheticnervoussystem,sns)刺激的增强和伴随体液升高以及含盐量升高的神经激素激活是导致hf的原因。之前的研究建议,在hf中,由于内脏血管床中sna提高而导致血管顺应性和容量的降低,内脏血管池的重新分流响应于由于总含盐量和体液没有升高而升高的心内填充压(预加载量)。hf由sns和该神经激素轴的慢性过度活跃来表现。目前的见解是sna和神经激素的活动导致血管张力的升高,并继而降低内脏血管床血管的可容量。与健康调控机制下的情况相比,外围血管的可容量在hfpef和hfref中基本无变化,该内脏血管的可容量可以显著降低。所谓的“急性hf”是由心脏和血管两种途径的组合形式引发的。该“心脏途径”通常由低心力储备引发,而“血管途径”在急性hf(ahf)中比较常见,表现为心力储备一定量的降低。在急性失代偿性心力衰竭(acutedecompensatedheartfailure,adhf)中,通常以下列症状的恶化为特征:典型气短(呼吸困难)、水肿和疲劳,在这心脏疾病的患者中,心脏填充压在诊断的5天前就开始升高。即使这种现象可以是随总体液累积后血管淤血的反应,近50%的患者在就诊前的一星期内体重变化很小(<1kg)。这表示约50%的病例中,失代偿性hf不是由从外界增加的体液导致的,而是淤血的症状和表现,完全可以由当前血管内流量的重新分布来解释。交感神经张力的急性升高是由于多种已知因素引发,例如心肌缺血、心律失常、炎症活动和应激反应,并且其它未知诱发因素可以干扰机体平衡并导致体液从该内脏血管池转移到实际循环中。这样导致了预加载量和血管淤血的升高。这就解释了舒张压的升高发生在hfref和hfpef中adhf之前。在许多hfpef患者中,舒张压/预加载量的小幅上升可以导致由于心室舒张功能受损的失代偿。这样,hfpef的患者会对内在或外在的体液转移更加敏感。慢性chf表现为长期存在的血管淤血和神经激素作用的升高。与急性心衰类似,该内脏血管床被认为是hf病理生理学的主要因素。血管顺应性和容量的慢性疾病导致人类身体更加可能复发急性失代偿性心衰,继而导致内脏间隔内显著的慢性淤血。当该内脏血管间隔适于进行急性体液转移时(例如姿势与体位的变化、运动和饮食摄入的水分),该内脏血管床的调节作用在伴有总体液和内脏血管压升高的慢性疾病情况下会变得失去适应性。临床观察的hf药物方案效果,例如硝化甘油和血管紧张素转换酶抑制剂,表现出其在治疗hf中的积极效果,可以通过内脏血管容量的升高来继而将血液转移到该静脉池中,从而降低左心室舒张压。在提及左心室舒张压时,可以是指左心室舒张末期压力(leftventricularenddiastolicpressure,lvedp),并且由于lvedp很难测量,也可以是指肺毛细血管楔形压力(pulmonarycapillarywedgepressure,pcwp),并且pcwp是lvedp的常用指标。一种体位性应激测试(倾斜测试)或一种简单的“抬腿”测试可以帮助区分正常和低的血管容量。体位应激性可以使血液从应激量变化为无应激量。四肢的静脉与内脏静脉相比顺应性较低,并且因此其中的血液量池也比较小。未广泛了解的是在身体倾斜或站立时,血液大多进入内脏间隔,这样会导致左右边心脏预加载量的降低。对主动脉和颈动脉压力感受器的刺激可以导致交感神经张力的上升,从而导致内脏血管收缩。这种补偿性机制是重要的,可以快速将血量从非应激间隔转移到有效循环中。由于在直立姿势时没有足够的外围血池,这种血流动力学对慢性hf倾斜测试的反应是非典型的。在这里假设该内脏血管间隔容量的降低起到了交感神经张力响应于该内脏血管系统的标记。急性口服和输液也可以当作内脏血管容量的测试方法。该血管系统的容量决定了非应激容量池(血管池)的“满”的程度和还能容纳的量,来缓冲有效循环(应激量)的升高。体液的变化可以通过测量i.v.灌输心脏填充压中的流体团,来测试该容量。患者血管池“充满”(血管池容量低)的情况下,即使患者的血管池容量较高,无法缓冲流体团的血流动力学作用。这回显示出同样增加量的情况下,血压较大的提升。因此,hf、hfpef和sna升高的患者将更有可能据此产生不相称的心脏填充压升高反应。这可以作为筛选患者和监测治疗是否成功的方法。类似地,hfpef的患者对轻微运动,例如抓握或骑乘固定自行车,在呼吸压和pwcp方面有非正常的升高。这种反应是由于患者无法顺应从非应激量向以交感内脏神经为中介的循环量释放血流。血流动力学可以是选择合适的患者并测试消融效果的另一种方法。图1是通向人体器官交感神经纤维的解剖示意图。该sns是该自主神经的一部分,该自主神经还包括副交感神经系统。该sns激活所谓的战斗或逃跑反应。类似于该神经系统的其它部分,该交感神经系统通过一系列内部相连的神经发挥作用。交感神经通常被认为是外围神经系统的一部分,尽管其中有许多位于中央神经系统当中。该脊髓(cns的一部分)中的交感神经元通过一系列交感神经节与外围交感神经元进行信息交流。在这些神经节中,脊髓交感神经元通过化学神经突触与外围交感神经元连接。脊髓交感神经元因此称作突触前(或节前)神经元,而外围交感神经元则成为突触后(或节后)神经元。在该交感神经节中的突触处,节前交感神经元可以释放乙酰胆碱,一种可以结合并激活节后神经元烟碱乙酰胆碱受体的化学信息。对应于该刺激的反应,节后神经元主要释放去肾上腺素(降肾上腺素)。延长的激活作用可以引起肾上腺髓质释放肾上腺素。一旦释放,去肾上腺素和肾上腺素可以结合外围组织中的肾上腺素受体。与肾上腺素受体结合可以引起战斗或逃跑反应的效果。这些包括瞳孔放大,出汗增多,心率加快和血压上升。交感神经起源于脊柱内,向脊髓中部的中间外侧细胞柱(或侧角)分布,从脊髓的第一胸段开始经过并延伸到第二或第三肺段。由于这些细胞源于脊髓的胸段和肺段,该sns是一种所谓的胸腰椎外流的形态。胸内脏神经(例如内脏大神经、内脏小神经、内脏细小神经),由于其突触在椎前神经节中,成为这种治疗方法的特选目标神经。越来越多的证据表明,血管内流体分布的流体平衡和控制在hf患者中被干扰。不仅仅在慢性hf中,而且在adhf中也发现有这种心血管调节功能失调的情况。随之而来的是,该自主神经系统的阻断可以改变人体内流体的分布情况,从而可以当做一种治疗发明。另外,对hf病理生理学的传统理解强调低效的顺流(例如低co流)可以导致神经元介质或交感神经系统(sympatheticnervoussystem,sns)的上调。然而,新的证据强调了hf病理生理学和疾病进程中的回流并发症(例如系统淤血)。肾功能不全与利尿受阻会使hf治疗复杂化,并经常在心脏填充压上升的患者中发生。慢性淤血性心力衰竭(chroniccongestiveheartfailure,chf)的特征是长期存留的静脉淤血和神经激素活动的增多。关键很重要的是对该内脏血管床,相当于一种血池的主要轮廓和心脏生理学,的识别。新的对交感神经系统,包括该内脏血管床,进行阻断和调节的方法和装置在治疗心脏病方面很有创新。特别的是,对控制内脏血管壁平滑肌的交感神经有了更好的了解。在这些神经过度兴奋的情况中,这些神经成为了治疗chf的主要目标。图2表示了失代偿性心力衰竭的机制流程。在此说明了静脉池的移动101中交感神经激活100对有效循环量102的作用,并导致失代偿103。相反,至少部分地,通过对内脏大神经进行消融,对内脏神经的交感神经激活可以缓解hf症状,提升运动能力并降低衰弱中的心脏上的载荷。人体内的一个兴趣部位是该内脏间隔、内脏血管床或内脏血管池,包括有内脏器官,例如肝脏、脾脏、大小肠、胃和胰脏,的血管系统。该内脏静脉床起到一种主要的血液存储作用,并可以在胸内脏神经,特别是该内脏大神经(gsn)激活(例如刺激)和抑制(例如阻断或消融)作用的影响下,导致静脉放松,移动,从内脏血管床中释放或向其中注入静脉血,以及循环血量的重要变化。该tsn,特别是gsn,至少可以控制内脏静脉的顺应性和容量。chf患者的这种血容量降低,并且特别是一部分交感神经活性提高的难治的hfpef患者。在控制内脏静脉收缩的内脏大神经束中的交感神经纤维是所提出消融治疗方法的靶标。内脏淤血105和高血管内压对肾功能会造成不良影响,并在肝肾综合征104中可以导致利尿剂抵抗作用。本发明的作者相信作提出的消融方法可以减轻这种症状,提高肾功能并使利尿剂发挥作用(例如恢复对利尿剂的反应)。图3和图4表示了提升交感神经系统活性,包括该gsn的自然反应(例如放点速率和与放电相关的输出交感神经纤维数量),和在该内脏血管床中血存量的相互关系。如图3中所述,中央sna114的升高可以表明,至少部分表明,在所有种类hf中活性升高的gsn,使内脏血管的容量降低,并有可能使内脏血管床硬化而变得顺应性降低,并且局部反应包括降低该内脏静脉的存血量和从该内脏静脉向周围内脏器官(例如肝脏、脾脏、胰脏、胃和肠道)110的供血量,并提高中央(和肺)静脉112中的血量。内脏静脉或该内脏血管床111中的血量可以称为“血管池量”或“无反应性容量”,并表示未参与到有效循环量中的血量,而且因此不参与循环或可以是血流动力学隐藏血量。中央静脉113中的血量可以称为“有效循环血量”或“反应性容量”,并表示主要在非内脏静脉中的血量,而且是心脏预加载量的主要决定因素,并且在chf中可以导致血管淤血、高肺循环血压和严重的呼吸困难。相反的,如图4中所示,交感神经系统活性降低或对内脏血管床进行tsn消融可以导致该内脏血管床产生顺应性,可以使其从“僵硬”或收缩状态中恢复或放松,并且对运动导致的血量重新分布作出较轻的反应。对靶标内脏神经进行消融可以降低位于该内脏血管床中静脉壁上通向平滑肌输出交感神经的张力,并可以称为内脏血管“静脉扩张”,可以使该内脏血管床122中的存血量上升121,并使该中央静脉124中的血量下降123,降低运动反应时血液从无反应性容量向系统循环量的调动,或总体上降低交感神经系统活性。tsn消融的其它效果可以包括肺血管血压和肺毛细血管楔压的降低,这些是左心室舒张末期压的指标,并且是治疗hf中重要的可测量的改善指标。理解并应用这些关系是本发明公布的实施例构想中一些首要的目标。特别是提升内脏血管系统的顺应性和容量。图5表示了一种可能的临床情况,其中该内脏大神经中交感神经的过度兴奋126导致了hfpef患者的流体加速过载127和肺静脉淤血。可以通过相应于导致“努力呼吸困难”运动而升高的肺血压情况来判断hf患者是否需要住院。这种情况可以通过患者对运动中血液转移到肺循环系统和左心房中而引起静脉血量和压力突然升高的适应能力来判断。■血管内消融运用一种通过血管递送的导管或其它可伸长医疗装置进行的血管内神经消融或神经结构消融,特别是对邻近血管(例如距离血管内壁通常不超过5毫米,但是最远可以不超过10到20毫米)的深部内脏神经进行消融,可以比手术切除或手术消融更加有优势。例如,血管内消融可以造成更少创伤,更快捷,并可以加快患者的恢复。“消融”一词(或相关词汇)在此表示造成不可逆的组织损伤。由于介入静脉比介入动脉更加安全,因此利用患者的静脉系统进行消融更加有优势。静脉血压比较低,并可以限制出血的风险,而且消融产生的杂物和阻塞物在静脉中更加安全,因为静脉止于肺,而肺可以起到血液过滤的作用。而且静脉更加具有弹性,并可以对其进行阻塞和拉伸,从而使得消融装置可以更好地固定或相对靶标神经定位。特别是奇静脉、半奇静脉或甚至是此案例中的肋间静脉,在静脉系统中有相对较大的冗余性,因而对这些静脉的阻塞不会给患者带来危险。与其它动脉的情况相反,当阻塞一些动脉时,会给患者带来伤害或风险,而利用静脉可以尽可能避免或降低这些风险。有一些可以接受的通过血管壁对神经进行消融的方法,例如利用电阻加热进行的射频消融、微波消融、低温消融、超声加热消融、光能或激光消融、直接热消融和注射神经阻断介质(例如注射专门用来造成神经损伤的化学介质的形式,即所谓的“神经破坏”)消融,例如酒精或更确切的是像胍乙啶、肉毒杆菌(即肉毒杆菌毒素a)和其它的交感神经阻断介质。先前大量的经血管神经消融的方法和装置集中于消融位于靶标血管动脉外膜和血流量相对较大的靶标血管(例如肾、肺、颈部、肝等部位的血管)内的神经结构。而本发明公布的方法和装置,是针对位于距离靶标血管0到5毫米,或在某些患者中是0到8毫米的靶标神经。并且,这里的靶标血管可以是奇静脉系统中或更确切地说是肋间静脉这样的静脉,这些静脉尺寸更小,其中的血流量很低。这就需要独特的装置或操作方法来进行。运用一种位于奇静脉会肋间静脉中的消融导管对内脏大神经进行消融的方法和装置可以避免对非靶标神经和结构造成伤害。例如,腹腔神经节位于该内脏大神经附近。对横膈膜略向上位置(例如位于t11或t12处或以上)的奇静脉或肋间静脉附近的tsn,布置一种消融元件,可以造成例如5毫米直径大小的损伤,来永久损伤该tsn,这样可以保护腹腔神经节不被消融。腹腔神经节位于腹腔中横膈膜下方邻近处。因此,对所选靶标神经进行消融可以适用于不同情况下的hf患者。图7中的例子是从左锁骨下静脉130(或通向该锁骨下静脉的左桡静脉,未显示)介入到一条奇静脉41中的合适位置对右tsn45进行消融。如图所示,该医疗装置的工作末端头置于奇静脉41内。图8中的例子是从左锁骨下静脉130,通过奇静脉41介入到一条半奇静脉43中的合适位置对左tsn53进行消融。如图所示,该医疗装置的工作末端头置于半奇静脉43内。图9中的例子是从一条半奇静脉附属静脉44,通过与半奇静脉相连的一条静脉介入到该半奇静脉43中对左侧tsn进行消融。如图所示,该医疗装置的工作末端头置于半奇静脉43内。图10中的例子是从一条半奇静脉附属静脉44,介入到一条奇静脉41中进行消融。如图所示,该医疗装置的工作末端头置于奇静脉41内。血管内接近该奇静脉系统的方法可以包括介入该血管系统内,例如桡静脉、臂静脉、锁骨下静脉、颈静脉或股静脉等静脉中。利用导丝可以辅助导管10在曲折的血管内递送。该导管可以包括一种可伸长的管状部件或有内腔的套管,可以在其中使用导丝或注入药物或放射对照物。可以根据患者解剖结构对诊断刺激或治疗的反应情况,进行双侧或单侧的tsn消融(左右侧同时,或左右侧分别)。图7到11b中所示的该导管10或132,每一个包括至少一个消融元件14或22,用来进行消融治疗,和至少一个刺激元件23或32,用来确认靶标神经,例如gsn的消融或非靶标结构。图7到10b中的该导管10可以是系统中的一部分,该系统包括其它辅助该导管的部件。该系统可以包括一种消融能量源16(例如射频信号发生器、低温控制台、超声信号发生器、化学介质源或泵、激光能量发生器、微波信号发生器),一种电刺激信号源18、一种内置逻辑算法的计算机控制器15、一种与该计算机控制器连接的呼吸监控装置21,可以与消融进行同步,在呼气时避免对肺和胸膜造成医源性损伤,和一种带有手动控制器和屏幕19的用户界面17。一种控制台20可以容纳该消融能量源16、该电刺激能量源18、该计算机控制器15、用户界面17、一种或包括的肺探测系统或呼吸监控装置21、或若干屏幕。或可包括的呼吸监控装置21可以用作肺探测监控装置,来探测肺是否位于该消融区域附近。呼吸监控装置和肺探测装置以及相关进程可以在此任何实施例构想中成为或选项目,即使没有特别指出这些信息。在一个实施例构想中,如图11a所示,在导管10的远端部分至少有一个消融元件22和或至少一个刺激元件23或呼吸监控装置或肺探测元件25,该导管置于gsn45和交感神经干附近的一条肋间静脉40中。该消融元件22和刺激元件23可以是电极,用来刺激神经并测量阻抗。本例中的设备导入一条左侧锁骨下静脉130,或左侧桡静脉(未显示)中,从该奇静脉41中横穿进入位于t9处的后肋间静脉40。其它设备也可以通过合适的静脉。左侧或右侧的以及位于其它级处(例如横膈膜以上,或t9、t10或t11处)的其它肋间静脉,或者在多个肋间静脉内同时或相继进行消融的方法也在本发明涉及到的治疗方法中有所包含。一种从腹股沟进入股静脉,如图11b所示,和从上肢进入桡静脉的方法是很重要并且很有优势的,而且可以提高患者的舒适度。在这些方法中,可以通过导丝131递送一种导管(见图11b)。一种导管可以包括至少一个传输消融能量的消融元件,至少一个确认是否在靶标神经(例如gsn)或非靶标神经结构附近的电刺激元件,和一种肺探测装置(例如阻抗监控元件、超声传感器)中几项的任意组合形式。一种导管10或132可以是一种系统中的一部分,该系统包括辅助该导管进行消融的其它部件。该系统可以包括一种计算机控制器,在其内存中存储着一种计算机算法,并可以通过处理器执行指令,来与一种消融能量源16进行信息交流,一种电刺激控制器18,一种带有例如阻抗、温度、超声传感器进行活体组织探测的交互界面,一种或可包括的肺探测或呼吸监控装置21,和一种用户交互界面17。另外,用来监测组织温度和阻抗的元件也可以包括在其中,来提高消融系统装置的操作性能和安全性能。在一种实施例构想中,如图12所示,一种导管140上的消融元件141放置于一条奇静脉41内邻近一条内脏大神经45的位置。该导管140可以包括一种位于其远端部分的可部署结构143。该可部署结构143包括至少一个消融元件141(例如射频电极、微波天线、超声传感器、电热元件、低温元件、光学元件),在该可部署结构143部署开或展开时,可以放置于该奇静脉41、一条半奇静脉或肋间静脉(未显示)壁上。该可部署结构143可以是,例如,不限于,一种球囊、笼结构、篮结构、两个或多个可伸展的曲线结构,或一种类似套环的预成型结构。该可部署结构143可以进一步包括至少一个刺激元件142(例如电刺激阴极或可选阳极)、一种可视化辅助设备(例如不透射线的标记、递送腔对比物)和一种肺探测装置(例如阻抗监控装置、超声传感器)中的至少一种。通过一条奇静脉41或半奇静脉到达一条后肋间静脉的静脉介入操作中,可以使一种导管接近该胸内脏神经,特别是该内脏大神经(gsn)的附近区域。在动物实验和人类尸体实验中,本发明的作者成功地将一种导管递送入一条横膈膜某处的奇静脉中接近该gsn的区域,其中的电极位于足够近的位置,可以对该内脏大神经进行电刺激和消融。在动物实验中,gsn的介入操作在右侧进行。从该奇静脉释放的电脉冲对内脏大神经进行刺激,通过观测其对血流动力学影响可以确认相关生理现象。本作者还进行了通过手术实施的实验,对gsn进行了接近、观察、刺激并随后切除,并通过使用可视化胸腔镜手术进行消融。■神经刺激确认的实施例构想在不考虑消融的具体形式时,装置、系统和方法的实施例构想可以进一步通过在某一消融步骤之前或之后确认安全性和有效性,来辅助消融进程。安全性的确认可以包括探测非靶标神经、器官或解剖结构,或探测消融能量传输范围内没有这些结构。有效性的确认可以包括在某一消融步骤之前探测靶标神经位于消融能量传输范围内,以及在该消融步骤之后探测不到靶标神经的信号。有效性的确认可以包括临时阻隔靶标神经信号传输,来评估导致的生理反应是否对应于一种治疗进程中的理想的临床反应。为了辅助进程的有效性,在一种实施例构想中可以涉及到确认该消融损伤会发生在一个理想的位置,并且在传输消融能量前确认该靶标神经位于消融能量传输的范围内,以免对靶标神经造成不可挽回的损伤或对非靶标区域造成损伤。这可以通过从至少一个,例如,刺激电极传输一种电信号,对该刺激电极附近的神经进行刺激,并观测其生理反应来实现,这些生理反应包括血流动力学的变化或患者上腹部的感觉,这些可以表示一条靶标胸内脏神经位于该刺激电极的消融区域。该刺激电极可以是一对包括阴极和阳极的电极,一种与弥散地极配合的单极电极,用于传输电消融能量,例如射频或电穿孔,的同一电极,或位于消融元件附近合适距离范围内(例如4毫米以内)的另一个电极或电极对。刺激电极也可以位于与携带传输消融能量元件的装置不同的装置上。图13描述了在一例动物实验中,对位于横膈膜以上某一级位置的gsn进行刺激146后的反应。主动脉和左心室血压升高的波形反应了对该gsn进行电刺激后的生理反应。类似的升高结果也出现在中央静脉压、右房压和肺动脉压中,可以由训练有素的心脏病专家在任何完备的现代化实验室中进行实时测量和监控。在一个实施例构想中,其中的刺激电极或电极对与消融元件不同,它们可以位于导管上的不同位置,从而使该刺激区域(例如在此区域中,从该刺激电极释放的刺激信号的强度足以引起某一条神经的反射)与消融区域(例如在此区域中,从该消融电极释放的消融能量的强度足以导致神经组织不可逆或长期的损伤)相对分开。一种刺激信号可以通过一种计算机控制器20(如图7到10b)或此处描述的另一台控制器进行控制,并可以包括一种信号信息来辅助确认技术上的有效定位。该计算机控制器20可以包括访问非临时内存存储指令的处理器,来控制该控制器生成刺激信号。例如,刺激区域(释放电流刺激该靶标神经的区域)的大小可以与振幅和信号有关。该控制器可以通过传输振幅变化(例如线性变化、逐级变化、交互变化)或频率变化的信号能量对该区域进行刺激。观测到的对应于某一振幅的反应可以表示靶标神经与消融元件的距离,并且可以调节消融能量(例如手动或自动)的传输来创造一种相对于刺激区域的有效的消融区域。例如,可以选用一种不同的能量传输电极,或该导管可以重新定位。另一实施例中的信号包括具有一定持续时长的打开和关闭信号(例如可以是振幅足够产生刺激和不足够产生刺激级别的能量),这样可以使某生理反应响应于该信号,来消除错误的正负评估反馈。在一种实施例构想中,一种对神经进行经静脉的电刺激,其传输的电流在0.5到15ma范围内,频率在1到50hz范围内,并且脉宽在50到500微妙范围内,适用于该神经是否在靶标距离附近,例如,并不局限于,约5毫米范围内。可以使用镇静剂来避免患者的疼痛。如果产生了某种生理反应,该阴极电极很有可能位于靶标神经1到5毫米范围内,并且这个区域内的消融很有可能对该神经造成永久损伤,同时保留该消融区域,在某些实施例构想中具有一定靶标尺寸的消融区域,例如约5毫米大小,以外的神经。可以预料到的是,在该靶标神经45附近的区域33和相对应的电极34(见图14)将可以产生一种低能量(例如神经映射)下的反应。例如,该消融元件可以是一种射频电极(例如包括面积约5到15mm2的裸露表面),可以是单级形式与患者皮肤上的弥散地极配合来形成闭合电路。消融能量可以是射频电流,频率在200到3000khz范围内,功率在1到100w范围内(例如最好是5到50w)。射频能量的传输可以通过一种配有计算机控制器20的能量传输控制台16进行控制(见图10),可以利用射频电极带有的温度传感器接收温度反馈。温度反馈可以包括一种温度传感器,例如一种t形热电偶、热敏电阻或热敏电阻桥,并配在每个消融元件上。该传感器可以包裹在该电极内,并由绝缘环氧树脂覆盖,来将从消融电路到温度测量电路之间的电影响最小化。或者,该温度传感器可以暴露在外部环境中(例如放置于一种凹槽或开口),从而可以读取附近组织的温度。这样,该温度传感器可以包裹在绝热环氧树脂材料内,来将从该电极金属或从其它位于该电极内结构元件(例如线圈)中的热影响最小化。对某一生理反应的观测可以涉及到测量该反应的设备(例如已知的测量或监控血流动力学参数,例如血压和心率的设备,或者配备传感器的导管或系统),可以提供该参数的指标。生理学监控设备是导管实验室中常见的设备,并且或可以与该计算机控制台20、该刺激能量源18或该计算机控制器进行信息交流。或者,监控设备可以与该控制器集成,来节省空间并提高反应度和可靠性。有效放置的确认可以通过医生实时观测该参数的测量手动完成。或者,该确认可以通过计算机系统控制台20自动进行,该控制台20可以接收来自生理监控设备的数据并将其与一种刺激信号(自动映射)作比较。该自动映射或确认评估可以进一步选择或辅助选择一种合适的消融能量传输模式。在一种实施例构想中,一种导管或其它医疗装置可以用来监控某一神经刺激下的生理反应,并在该导管上包括一种血压传感器,在一条血管内可以与一种消融元件和一种刺激元件共同放置。该装置或系统可以进一步包括第二个血压传感器,可以放置于该循环系统的不同位置(例如股动脉或桡动脉等动脉系统,肺动脉等肺循环系统,腔静脉或右心房等中央静脉系统,或肺动脉等内脏循环系统或肺循环系统),来比较不同位置测量的血压,并对这些神经(例如内脏神经、靶标神经或附近的非靶标神经)刺激反应的变化进行评估。为了确保进程的安全,一种实施例构想可以包括确认该消融损伤不会给重要的非靶标神经带来伤害,例如腹腔神经节,在消融能量传输之前可以选择进行该判断。可以通过用同样或不同的电极对附近神经进行电刺激,并观测相关生理反应(例如心率或像是血压或血流量等的血流动力学)来实现。在一个实施例构想中,可以利用与上述类似的原理和装置,其中的刺激区域和消融区域相关联,但是观测到的生理反应可以表示重要的非靶标神经刺激后的反应。对靶标神经的刺激可以引起意料中或意料外的生理反应。在这两种情况下,来自重要的非靶标神经的反应可以表示消融位置不安全。例如,中央静脉血压(cvp)或肺动脉血压(pap)的升高以及伴随其发生的心率下降可以表示理想中的反应;然而,伴随心率的升高,则可以表示一种重要的非靶标神经出现在了该刺激区域和相应的消融区域(例如支配肾上腺的神经),并需要将该消融元件和相应的刺激元件重新定位,并且再次进行安全性和有效性的确认。如果靶标神经和重要的非靶标神经同时接受了刺激信号,那么这些神经可能互相很接近,此时传输消融能量则不安全。为了避免伤害该重要的非靶标神经,该消融元件和刺激元件可以一边移动一边进行刺激,反复进行,直到找到一个安全而有效的位置。例如,可以将该导管,或该导管上所选的不同电极沿该奇静脉、半奇静脉或肋间静脉放置,并可以沿,穿过或横穿该gsn和交感神经干递送(见图14)。或者,一种导管可以包括若干消融元件和相应的在导管远端部分沿长度方向排列的刺激元件,或可在这些位置中所选的位置进行刺激。或者,可以根据一种刺激方案缩减该刺激区域,来识别一个适合对靶标神经而不是非靶标神经进行消融的位置。在另一种实施例构想中,一种导管可以包括一种刺激元件(例如至少一个电极或电极对),该元件包括一种与消融区域由空间关联的刺激区域,并且额外包括至少一个第二刺激元件,与该消融元件距离足够远,使得该第二刺激区域在该消融区域以外。在这个实施例构想中,由该第二刺激元件,而不是由与消融元件相关联的第一个刺激元件引起的生理反应可以表示是一个安全的位置。在一种实施例构想中,其中的消融元件可以是一种低温消融元件,一种低温映射技术可以用来冷却该区域,并临时阻断神经传导,而不会对神经造成永久伤害。例如,该低温映射技术可以包括从该低温消融元件中传输冷冻能量,其时长和温度仅仅是临时阻断神经传导。靶标神经或非靶标神经临时阻断神经传导的生理反应可以与神经刺激的生理反应不同。临时阻断靶标神经的反应可以类似于神经消融短期内的反应。图14是一种血管内导管30的示意图,其包括若干消融元件151和若干刺激元件32,它们在空间上间隔交互轴向排列于导管30上。或者,该刺激元件32也可以用作消融元件,例如射频电极。该导管经过一条奇静脉41放置于一条肋间静脉40内。该导管可以从一条股静脉或桡静脉进入该奇静脉41,并可以通过导丝递送。该消融元件151和刺激元件32可以在该导管的表面,并可以在该导管30的远端部分以一定距离差沿长度方向排列。该导管的远端部分132可以导入横膈膜以上胸椎处(例如横膈膜以上2到3级,可以是t9、t10或t11的位置)的奇静脉和肋间静脉空间内,如图11b所示。该导管的远端区域132与该gsn45和该交感神经干49距离较近。该导管电极所在部分的直径可以是2到6毫米,并几乎可以阻塞甚至撑起该肋间静脉40。一种导管可以发生相应的形变或包括阻尼元件,使其适于定位于静脉壁。可以利用所选电极组成阴阳极,通过对沿该导管远端部分的神经进行电刺激,并观测其生理反应来识别该靶标神经。或者,可以对所有或任何数量的经过该肋间静脉或相关静脉的靶标区域内的神经进行消融。图15a和15b表示了动物实验中,分别对应刺激该交感神经干49和gsn45而产生的生理反应。在动物实验中,通过位于一条肋间静脉内的导管对左侧交感神经干进行刺激。在对该交感神经干49进行刺激时,心率(hr)和平均动脉压(map)有所上升,如图15a所示。框155中表示x轴上刺激能量时长在60到90秒之间的时间。肺动脉压(pap)和右房压(rap)的变化可以确认心脏的预加载量由于该刺激而升高。在另一个实验中,选择了一种位于胸段处gsn45的环状电极对该右侧gsn45进行刺激。图15b表示了其结果。在图中框156中所示的gsn刺激时间段内,股动脉内测量的平均收缩压(meansystolicpressure,msp)在心率hr下降时有所上升。hr的降低有可能是由在探测到心搏量上调时动脉压力反射的常规代偿性反应导致。本作者确认在下腔静脉血流上升时,心输出量相对保持稳定。图15b中的ped跟踪线表示相应于从静脉储备中血流移动而发生的左心室舒张末期压(lvedp)上升。为了辅助推进临床有效进程,在一种实施例构想中,可以确认患者在传输消融能量之前是否有关于消融的生理反应。可以用电、药物或低温临时阻断神经并通过观察生理反应(例如血流动力学)来实现。或者,可以首先进行血管神经映射或技术有效性定位,来表示靶标神经是否在消融区域内,或确认定位的安全性,来说明重要的非靶标神经不在该消融区域内,然后对神经进行临时阻断,来评估临床成功率。如果评估临床成功率时如预期发生了相关生理反应,那么可以接着传输消融能量以实现永久或长期的,类似于临时临床效果的临床疗效。相反地,如果临时阻断引发的生理反应不理想,医师可以决定不进行消融。可以选用另一套刺激和消融元件来进行确认步骤,从而找到另一个位置或停止该进程。为了辅助推进技术和临床有效性进程,在一种实施例构想中,可以确认消融的成功与否,即在传输消融能量后观测靶标神经是否没不再进行神经信号传导。这可以通过使用相同或不同的常见元件传输刺激信号并观测相关生理反应(例如血流动力学)来实现。由于该内脏大神经通常沿该奇静脉延伸分布一段距离(例如上至3到5厘米),可以对消融端远端的内脏大神经进行刺激,并观测是否有该血流动力学反应。一种用来对消融端远端的神经进行刺激的装置可以包括一种刺激元件,其刺激区域与一种消融区域相关联,并且一种刺激元件位于该消融元件远端距离足够远并在消融区域之外。一种实施例构想可以包括一种映射算法,可以在传输消融能量或从一组消融与刺激元件中选择合适的消融元件和相应的出元件之前,确认消融元件和靶标神经(在此为胸内脏神经)的安全位置和技术有效性。一种典型的映射算法,如图16所示,包括以下步骤:(i)选择电极对(例如横膈膜以上2到3个脊椎处或在此处沿所选肋间静脉上,并且距离奇静脉或半奇静脉分支0到5厘米范围内,距离奇静脉或半奇静脉分支0到3厘米范围内,在肋椎关节和奇静脉或半奇静脉分支接口之间)。电极对更适合进行双极刺激或消融,而在单级消融或刺激时可以选择一个电极。(ii)记录一个所选的血流动力学参数(例如map、cvp、pap、rap)来建立基准线。例如,见图17a到17d中“gsn隔断”之前的部分。(iii)传输电流(i)、脉宽(pw)、频率(f)和周期(d)分别在0到10ma、100到1000us、20到40hz、以50%的程度进行20到60s范围内的刺激脉冲。开启后在至少20到60s后关闭。(如图18)(iv)记录选择的血流动力学一个参数(例如map、cvp、pap、rap),例如见图17a到17d中“gsn隔断”之后的部分。(v)如果该血流动力学参数超过基准线20%,则允许其回归到基准线并重复进行。(vi)取例如3次刺激时测量的平均值,如果标准差在+/-10%范围内,则所选血流动力学参数的变化被认为是具有参考价值的。另一个在参数消融能量前确认适合进行消融和刺激的方法包括一种刺激测试,在该测试中选用特定的一种电流、频率和脉宽(例如一种手动或自动的计算机算法),并且在电极对之间接触静脉壁的位置进行刺激。当该电势场足以激活tsn时,平均动脉压(map)、cvp或pap的急剧升高以及其它血流动力学变化可以在几秒时间内发生,并且可以以图像的形式记录下来和进行比较,来评估消融元件的位置。在超声消融能量后确认技术上是否成功的方法,或换句话说确认靶标神经是否成功消融的方法,可以包括在消融后使用相同或类似的电极进行参数相同或类似的电刺激。或者或另外可以从位于消融区域(靠近脑或交感神经干)近端刺激电极传输电刺激,该位置在消融前已产生相应的生理反应。神经反应的消失或显著降低可以表示消融技术上的成功。为了证明该理论,图18表述了一种动物实验,在其中,血流动力学可以响应于内脏大神经的刺激,并可以通过局部注射利多卡因,一种神经阻断剂,来阻隔神经。x轴上的时间以分钟为单位。y轴代表动脉压,以毫米汞柱mmhg为单位。左边第一个箭头157表示注射利多卡因的时间。第二个箭头158表示向该神经阻断近端处内脏大神经释放电刺激的时间。“近端”一词表示神经上更靠近发源地,例如脑、脊髓、交感神经干或身体中心,的某处,并且“远端”一词更远离发源地或更接近所支配的外围器官,例如内脏血管床、肝脏、脾脏等,的某处。在该神经阻断157近端的第一刺激158之后,在此图中没有观测到或观测到非常轻微的主动脉压,或其它相关生理参数的生理反应。第三个箭头159表示在该内脏大神经上利多卡因阻断位置远端处进行电刺激。相关生理反应体现在平均动脉压和其它此处涉及到的血流动力学参数的升高。该实验通过手术方法,利用合适的工具和递送成像技术,可以重复进行血管内消融。例如,可以沿奇静脉或肋间静脉,将刺激电极移动到该消融损伤处的近端和远端区域,来确认消融的有效性。或者,可以在沿该导管长度方向排列的多个电极之间转换(如图14)。可以用一种简单的自动装置来测试不同的电极对,并观测反应,然后在用户界面上生成报告。或者,可以在肋间静脉(例如t9、t10和t11)内放置多个导管,沿该tsn的长度方向的不同位置进行刺激。荧光镜成像中利用了例如脊椎、心脏、静脉和横膈膜等身体内标识物,可以利用这种成像方法辅助导管上消融元件或刺激元件的定位。如果该神经成功消融,并可以由刺激消融位置近端内脏大神经而引起的血流动力学积极的反应所证实,那么可以反复进行更高能量级的消融,不同位置的消融或同位置的进一步消融。值得注意的是之前所述的map监测是一方面的例子,而血流动力学监测并不一定需要创伤性的监测手段,并且可以通过低创伤的血压监测来实现,例如在一些医院中运用nexfin或clearsight装置(edwards)对血流动力学进行连续监测。clearsight系统可以快速地在患者手指上覆盖一种可填充包裹装置。该clearsight系统可以进行无创评估并提供实时分钟时间内血流动力学信息,包括:sv、co、svr或持续血压(continuousbloodpressure,cbp)这样的监控装置可以与一种计算机控制台相连并与其进行生理反应信息交流,这样可以根据该生理反应判断刺激或消融参数。一种系统的实施例构想可以包括一种消融导管,带有至少一个消融元件(例如射频电极)和至少一个配套的刺激元件(例如刺激电极),一种可以生成并控制刺激信号向该刺激元件传输的计算机控制台,和一种可以生成并控制消融信号(例如射频电流)向该消融元件传输的计算机控制台。该刺激控制台和消融控制台可以是不同的设备或集成于一体,并可以互相交流。该系统可以进一步包括供给该消融能量所需的部件,例如,如果该消融能量时射频电流,那么该系统可以进一步包括一种弥散地极垫;如果该消融能量是一种化学介质,那么该系统可以进一步包括用来注入该介质的手动操作注射器或自动控制泵。该系统可以进一步包括一种血流动力学监控装置,可以与该刺激控制台或消融控制台进行信息交流,来提供响应于刺激或消融的血流动力学反馈信息。这些计算机控制台可以包括一个或多个存储在内存中的算法,并通过处理器执行,从而辅助对刺激和血流动力学反应进行分析。例如,一种算法可以根据反应时间、反复性和相对基准线的偏移量,来计算相应于一种刺激的血流动力学反应是否显著。在一些实施例构想中,其中的导管可以包括多个消融元件和相应的刺激元件,见图14和18,包括一种算法,可以辅助选择最优的消融元件,例如根据刺激时的最强或最快反应,并可以向所选的消融元件或刺激元件传输消融能量。一种控制台可以包括一种用户交互界面,可以提供直观的图像或信息,来帮助用户了解刺激反应的分析情况。图19中的例子是从甄选患者165,到执行对tsn的消融166,到完成成功消融167的治疗心衰的流程图。对甄选适合于tsn消融治疗患者的步骤168中包括对内脏血管容量的评估。可以利用一种体位应激测试(倚靠桌子测试)、溶液冲击测试、运动测试或合适的药物测试来帮助区分正常的和低的血管顺应性。其它测试包括在自行车或跑步机上的运动测试,或简单的握力测试。体位应激可以导致血流从该反应性容量转移到非反应性容量。在健康人体中,为了适应该容量的转移,局部交感神经张力会升高,导致内脏血管收缩和血液从非反应性区域向该活动的循环区域快速转移。类似的运动可以导致血液从非反应性容量向循环区域释放。这种对应于倾斜或运动的血流动力学反应在慢性chf中时非典型的,是因为在站立姿势时没有足够的外围血池可以表示减少的内脏血管容量。急性口服或静脉注射是评估内脏血管容量的另一种测试方法。一种溶液冲击测试可以通过测量心脏填充时的某一流体团和肺血压,来测出该容量。内脏血管池容量低的患者将无法顺应该流体团带来的血流动力学影响。hf、hfpef的患者和sna升高的患者会更有可能对该溶液冲击测试作出反应,其心脏填充压以及其它相关可测量的生理参数会产生不成比例的升高。这种反应可以表示该患者有可能是tsn消融治疗的候选人或不是候选人173。在判断患者是消融治疗的候选人后,接下来的第一步是识别适合进行消融的靶标神经169。判断靶标神经或非靶标神经以及相关结构知否位于消融能量(映射)范围内,对消融进程的安全性和有效性是很重要的。图15a和15b表述了使用电刺激识别靶标神经(例如gsn、交感神经干)或附近非靶标神经的不同的生理反应。医师可以根据映射信息和患者个人的反应与需要来选择治疗方案。例如,不同于低血压患者,一名患有严重慢性hr或bp(高血压)的hfpef患者可能需要对不同的靶标结构进行治疗。在识别169和选择靶标神经后,或可以进行治疗有效性确认170,例如可以暂时阻断该靶标神经的神经传导,并在相关临床影响下评估是否有连续的相关反应。在确认识别靶标神经后,该非靶标神经或其它结构可以确保在消融范围之外,并可以确认治疗进程的有效性;则可以开始进行消融治疗166。确认消融进程的技术有效性和是否成功170可以通过在消融位置近端传输电刺激来实现,该位置在消融前有一定的生理反应。相关反应的消失或减弱可以表示消融进程的技术成功(见图18)。另一个确认技术成功的例子可以是评估内脏血管的容量(例如倚靠桌子或溶液冲击测试),并与进程之前的结果相比较。如果消融进程是成功的171,则不需要进行其它项目,并且可以结束该消融治疗167。如果进程不成功,该医师或可以在同一位置额外进行消融治疗172,并/或重复进行对额外靶标神经的识别160(例如双侧消融),并进行之前所述的消融治疗166。可以对刺激信号的波形进行调整,使在tsn刺激下产生最优的生理反应,同时将疼痛反应最小化。下文表1表示针对c类纤维,通常与疼痛神经纤维类似,的基强度(124v/m)和时间常量(1ms)。经过比较,tsn的时间常量与a类纤维相近,在0.12ms左右。相应的是,tsn的基强度比疼痛纤维要低很多。这样,高转换速率和低振幅的波形更有可能捕获tsn,而不会引起患者的疼痛。表1:在恒定电势场内a类纤维与c类纤维刺激阈值的参数参数a类纤维c类纤维senn-等同的纤维直径(μm)201基强度(v/m)6.15124τe(μs),恒定电势场120.71000senn时间比例因子18.29根据强度-时间公式,刺激脉冲在时间d内的振幅i,足以捕获一条神经,为:i=irh*(1+τ/d)其中irh是基强度,τ是时间常量或时值。在一种实施例构想中,用来刺激靶标神经(例如tsn)的电流时长很短,在相应时值的范围,并可以生成一种电势场,其最小强度等于:etsn=6.15v/m*(1+0.12ms/0.12ms)=12.3v/m为了生成这样的电势场,可以使用一种3f或8f的导管,其中带有一种单极或双极的刺激电极。该电极的长度可以在0.5到4毫米范围内。如果是双极刺激,该电极的分开距离可以在0.5到20毫米范围内。一种典型的刺激阻抗在200到1000欧范围内,引起的刺激电流可以在0.1到5ma范围内,由下列公式为例可以计算:相应的是,刺激电压可以在0.05到5v范围内。值得注意的是,以上表述参数下的刺激电流不足以捕获疼痛神经纤维。实际上,时长为0.12ms的刺激脉冲,像在上述例子中没有任何内在限制时,可以刺激疼痛神经纤维的电势场强度为:epain=124v/m*(1+1ms/0.12ms)=1157.3v/m该数值可以提供94倍于刺激tsn所需强度的缓冲边界带值。这样,例如可以使用强度在30到500v/m范围内,脉冲时长为0.12ms的电势场来对靶标tsn安全地进行刺激,而不引起患者的疼痛。这样的电势场可以由上述的一些与常用的刺激仪器相连的导管生成,这些仪器可以是外置起搏器或tens设备,这些设备的输出适于血管内电极的信息交流。图15c和15d所示的有限元模型包括在某一条肋间静脉内相距8mm的双极电极(例如4mm长2mm直径),并该肋间静脉距离靶标tsn4mm以外。如图15c所示,9.6ma的刺激电流,其相应的电压为1.5v,程度为0.0123v/mm(即12.3v/m)的独立电势场轮廓,足以包括该靶标tsn。在相同刺激电流参数下,图15d表示了程度为1.157v/mm(即1157v/m)的独立电势场轮廓,可以引起对疼痛纤维的刺激。假设该疼痛纤维在靶标tsn附近,图15d表示,由上述双极刺激产生的该电势场强度足以引起疼痛。事实上,强度约为0.6v/mm,需要其强度的一半来引起疼痛反应,的电势场几乎不会超越该肋间静脉壁的范围。■消融导管实施例构想下列关于消融的方法、系统和装置中的任何一项可以与所述关于进行刺激确认的任何方法、系统和装置结合使用。图20a表示了一种导管180的远端部分180,包括一种可部署的球囊181(或气体可部署结构),该球囊包含多个表面电极182,可以在某一条血管(例如图20a所示的奇静脉41或图20b中所示的肋间静脉40)内对一条神经(例如gsn45)进行经血管刺激和射频消融。该装置可以与血流动力学监测器配合使用,对该内脏大神经进行定位,为消融电极182确认安全而有效的位置,对该内脏大神经45进行消融,并在收回该装置前确认消融的技术有效性,并且闭合该静脉开口。在这个实施例构想中,该导管套管180与一种可部署结构,例如一种球囊181,相连,或辅助其递送,如一条奇静脉41或肋间静脉40中放置的情况,或使该静脉突起来将消融电极182和刺激电极184放置于该静脉壁上。如果该静脉被阻塞或突起,则不需要大量的消融能量。该球囊上的刺激电极184对其所接触静脉壁内周释放刺激程度的电流(能量)时同时观测相关生理反应,从而可以确认内脏大神经在该静脉内周的位置。如果该刺激电极产生的刺激电流电场引起了相关的血流动力学反应,与之相应的径向消融电极185可以释放消融程度的能量来产生消融损伤。向该电极184传输刺激电流在递送消融能量之后,同时观测相关生理反应,这样可以确认技术成功性,与消融之前相比,相关生理反应的消失或减弱可以表示该神经的成功消融。在一个实施例构想中,该导管可以经由心血管系统递送,特别是通过股静脉、桡静脉或颈内静脉向该奇静脉或肋间静脉递送。可以想象的是,可以通过或不通过导丝183的帮助,对该消融元件进行放置。理想情况是使用一种中空、多孔的导管来维持血管内一定程度的血流量。用来确认消融元件位置或确认技术或临床成功性的刺激元件可以包括一个、两个或多个电极,可以环形或纵向地排列分布,可以根据选择需要来提供足够强的、优化的或特定情形下所需的电信号量。在这些实施例构想中,该刺激元件也可以包括多个电极,通过探测相关血流动力学反应,可以首先用来对奇静脉、肋间静脉或其它合适的静脉内的适合位置进行映射成像,该内脏大神经在其中距离约1到5毫米范围,或经过该静脉(力距离该静脉壁约1到3毫米)内延伸1到5厘米。在一些实施例构想例子中,一种导管和控制台系统包括一种多电极导管,这些电极沿一种柔性套管分布,该套管包括一种远端部分,可以置于患者的某一肋间静脉内(如图14所示)。该控制台可以生成并控制消融信号(例如高能射频电脉冲)和电刺激信号(例如低能低频电脉冲)的传输。这些低能电信号频率在5到50hz范围内,而高能信号频率在350到500khz范围内。选择该低能信号是用来刺激该活跃电极附近的神经,而该高能信号是用来对电极附近的神经进行消融。该信号可以传输到该导管远端部分的电极上。该控制台可以选择性地将低级别或高级别的能量释放到该电极上,例如连续向所有电极释放低能脉冲,并向所选的电极释放高能脉冲,用来对附近范围内的,通过该低能刺激信号和相关生理反应识别的靶标神经进行消融。该控制台可以与一种控制器相连,该控制器,例如内置一种或多种算法,可以选择并激活一个或一组电极(单级和/或多极的),并选择传输高能或低能。一种选择消融电极和传输信号的方法可以包括一种转换机制或程序逻辑。该控制台可以包括生理反应监控装置或与该控制台可以进行信息交流的装置,该生理反应监控装置可以包括位于该导管上的传感器,以无创的形式位于患者的血管系统内。这种控制台上的计算机控制器可以执行一些软件和逻辑程序,这些算法包括辅助对例如血流动力学和来自患者监控装置或来自与该控制台连接装置的生理参数进行分析。血流动力学和生理参数的例子有瞳孔放大、出汗增加、心率加快、血压升高、平均动脉压升高和以上任何的组合形式。该一种或多种的算法通过自动探测至少一项所选的血流动力学或生理参数,可以确认在该肋间静脉内该导管上电极相对靶标神经的位置,这些参数可以由该导管上电极释放的电脉冲引起。该算法可以首先包括对该血流动力学参数的基准线进行记录。之后,该算法可通过该导管上的一个或多个电极向个肋间静脉释放刺激脉冲。该刺激脉冲的电流(i)、脉冲宽(pw)、频率(f)和周期(d)可以分别在0到10ma、100到100us、20到40hz和半周期在20到60s范围内。在释放每一个刺激脉冲时,该算法对所选的血流动力学或生理参数进行记录。该导管上的每一个电极对该刺激脉冲的释放和由此相关参数的记录可以按照某一种序列进行。所记录的参数值可以用来帮助选择所要接收消融能量脉冲的电极。所选的电极可以是产生与基准线偏差最大的参数情况下的电极。进一步而言,这种选择方法可以在释放该刺激脉冲的同时,用来识别足以造成超过一定阈值的参数变化,例如与基准线相差20%,的电极。为了确保可靠的参数值,该刺激脉冲可以反复释放多次,例如每个电极释放3次。在每次刺激脉冲释放时记录该参数。每个电极释放刺激脉冲对应的参数值的平均数可以作为参考数值,来选择消融脉冲电极。并且,可以检查该参数值,来确认其在一定范围内,例如彼此相差不超过10%。如果任何数值不在该范围内,可以额外释放刺激脉冲,来决定该平均值,或该控制台可以向该治疗师发出一个警报信号。执行该算法后,可以用该计算机控制器通过一种自动算法程序来在传输消融能量前确认患者是否愿意经受这种消融产生的理想生理反应。这样的算法包括:通过一种刺激信号临时阻断靶标神经,在阻断时记录生理反应,并评估该生理反应,从而判断是否可以对该患者进行通过消融靶标神经附近的肋间静脉而消融靶标神经的治疗方法。临床效果是通过比较记录的生理反应和理想生理反应来判断的。该理想的反应可以是血压(例如map、pap和lvedp)的明显降低。该靶标神经也可以通过药物方法或低温方法进行临时阻断。如果临时阻断没有达到预期效果,该医师可以决定不继续进行消融,选择该导管上的另一个电极释放刺激信号,并在此后释放消融信号,或者在该肋间静脉内旋转或纵向移动该导管及其电极。通过该计算机控制器执行的算法也可以确认消融进程的技术有效性或成功与否。该确认步骤在经肋间静脉神经消融之后。该确认步骤可以包括通过该导管向该肋间静脉内与消融位置相同或其近端的位置进行电刺激。记录该患者对应该电刺激的反应(生理或血流动力学),并将其与消融前的反应相比较。如果该比较结果表示反应的消失或减弱,那么该算法可以表示该消融进程取得了技术成功。如果该比较结果表示消融进程不成功,该医师或其他治疗师可以在相同位置进行反复消融,或对其它神经目标进行反复消融,可以包括将该消融元件在不同的肋间静脉内重新定位或进行双侧消融。该控制台可以包括一种图像交互界面,用来表示来自该生理信号的信息,其中的信息是相应于传输低和/或高能量后(例如5到60秒)的生理反应,并且用来比较该生理信号和预存在内存中基准线数值的算法可以提供自动选择合适的电极并/或进行合适的能量传输。在此表述了一些形式的电极,或电极序列/系列,但是并不局限于在此表述的某一种形式或排列形式。图21的横截面图表示了患者一条肋间静脉40内一种消融导管190的位置情况,而图11b和14使其额冠状面视图。在这个实施例构想中,该消融导管190通过导丝191递送,该导丝穿过该导管的内腔。一种通过导丝递送的导管可以是一种otw(overthewire)消融导管。通过导丝递送消融导管已经是一种常见的方法。通过使用造影剂(包括或不包括对比剂的使用)可以在肋间静脉40从该奇静脉41分叉出的地方找到合适的位置,并且可以将该导丝191伸入到所选肋间静脉40内的理想深度位置,来确保对该导管190的操作。导丝可以包括一种无创端头192,来避免对血管造成损伤。导管190可以在理想的肋间静脉40内沿该导丝191进行滑移,来对靶标神经(例如gsn45)进行定位和消融,该靶标神经经过该肋间静脉40并位于该胸膜壁层193和该肋间静脉40之间。该静脉40和该神经45相互交叉之间的距离在约为1到3毫米范围内,这样有利于在约5毫米范围内通过某种消融模式,例如射频消融,生成一种消融区域来进行消融。图21表述了在一条所选肋间静脉40内,一种otw消融导管190的位置。该所选的静脉可以位于该横膈膜以上并尽可能靠近的地方,并且根据一种静脉造影照片和通过导丝191的探索结果可以将该导管从静脉中插入。根据发明者的经验,在t8到t10脊椎位置的肋间静脉是放置该导管的候选位置,而神经的组成部分可以在高如t6的位置处找到。该靶标神经可以是与所选肋间静脉交汇的tsn、组成该tsn的神经(例如神经根)或交感神经链神经干。可以对多个神经进行靶向定位和消融(例如gsn45、gsn神经根48、交感神经干49)。如图20b和21b所示,对肋间静脉内神经进行消融的方法包括对不支配该静脉的神经组织进行消融,并且该神经通常以非平行于该肋间静脉腔的角度延伸。在一些实施例构想中,对靶标神经(例如tsn、tsn神经根)进行消融的方法和使用此处表述导管的方法包括以下步骤:介入心衰患者的静脉系统(例如通过股静脉、桡静脉、四肢静脉、锁骨下静脉、颈静脉);将该导丝191伸入下腔静脉或上腔静脉42,并到达在该左右无名静脉分支处紧邻的下方处的奇静脉41;如果是沿着右侧结构进行,将该导丝191沿该奇静脉41向下递送到横膈膜52的位置处,t10到t11脊椎55的附近,或尽可能邻近该横膈膜以上的尾向方向,并进入邻近的一条肋间静脉40中;将该消融导管沿该导丝递送进入该肋间静脉,来传输消融能量;利用该导丝来引导、介入邻近的肋间静脉,从而将该导管递送到正确的位置;如果是沿左侧结构进行,将该导丝介入该半奇静脉43,该半奇静脉位于t8脊椎附近,并利用该导丝介入肋间静脉40,来进行消融。另外,该tsn可以像穿过脊椎那样穿过该半奇静脉。或者,可以考虑在此处沿该半奇静脉进行消融,但是要注意不要伤及同样横穿该半奇静脉的胸导管57或下行主动脉51。对于这些步骤,需要考虑到奇静脉和半奇静脉许多不同的解剖结构。考虑到解剖结构的多样性,从左侧进行要比从右侧进行更加有难度。在此所述的一些实施例构想中,该肋间静脉和靶标神经交汇处的确切位置可以通过电流刺激映射出来。或者,如图22a和22b所示,可以在沿一条肋间静脉40的一部分150形成的轨迹创造一长条损伤201。如果该损伤为3到5厘米长,并且从该肋间静脉40的接口64,从该奇静脉41分出的位置,向远端延伸,那么这样的损伤很有可能就包含了该靶标神经或一些靶标神经(例如gsn45和gsn神经根48),从而可以被该导管的能量传输元件202,可以是一种射频电极,沿该肋间静脉40形成的轨迹所截断。在该实施例构想中,一种otw消融导管203可以沿一种导丝204向远端递送,并且之后可以在释放消融能量和沿该轨迹消融后,缓慢地收回。由于该tsn从与腹腔神经节相关的该交感神经干中汇出的节前纤维开始形成,该长条形损伤只需要向远端伸到该交感神经干处,来对该tsn或该tsn神经根进行消融。该交感神经链49与脊柱平行排列,并位于肋椎关节或连接处的肋骨颈63,该肋骨头辐射状韧带侧边。此处的解剖学特征标记可以作为远端边界,而从该奇静脉41分支出的肋间静脉40的接口64可以作为近端边界,而该损伤在这两个边界之间延伸。可以通过x光、ct或核磁共振(mri)对该解剖学特征标记进行成像,例如,可以结合荧光镜或荧光技术与相关软件,来跟踪置于某空间内的装置,从而指导消融进程。在将该装置203伸到已知或理想深度150时,如图22a所示(在传输消融能量之前),可以通过一种电机元件以一定速率或根据来自该装置的反馈数据而定的速率自动进行回收动作,来保证向组织释放足够的能量,从而消融靶标神经。该理想深度150可以包括在该肋间静脉内从该接口64到该奇静脉的深度,并延伸到该肋椎关节54处的深度。或者,该理想深度150可以是一种预定深度,通过一条胸内脏神经经过该靶标肋间静脉的位置而决定。例如,在大多数人体中,该胸内脏神经位于t6到t8级处右侧5厘米范围内或左侧3厘米范围内,或者位于t9级2厘米范围内,或t10级1厘米范围内,或t11级0.5厘米范围内。或者,可以运用一种手动机械装置通过一种棘轮或螺旋手柄以一定速率回收该导管。一种控制系统可以包括根据温度或阻抗变化的反馈机制,该温度可以通过一种温度传感器205测量,该阻抗变化是电极202与患者皮肤上(未显示)弥散地极之间的消融时的阻抗变化。可以利用这种信息为消融提速或减速,或停止进行消融。传输消融能量可以使得该静脉40变形,如图22b所示,例如收缩、密封、凝结或阻塞。这样并不会给患者带来很大的风险,因为静脉系统通常有几条多于的通路,并且旁路静脉在打开后可以维持肋间肌肉的血液流通。该阻抗和温度变化与静脉收缩同时发生,可以判断某处的消融是否成功。这样的反馈信号可以触发自动回收机制,或为操作者通过一种记号,来将该消融元件移动到新的位置。对消融导管的回收也可以由操作者手动进行。例如,一名操作者可以手动抽出或递送该消融导管,并进行一系列消融操作。另一种方法是可以通过该消融导管手柄上的触发器,将该装置收回一定距离,来保证更佳的消融覆盖率。例如,回收的每一步距离可以是该电极长度的50%。在另一种实施例构想中,可以在某一目标范围150内移动该消融元件(例如,在一条肋间静脉内的奇静脉接口和肋椎关节之间约0到5毫米范围内,或从该奇静脉接口向该肋间静脉内延伸1.5到5厘米范围内),并反复消融。例如,可以将该导管或该导管上所选的不同电极递送到沿该目标范围150内横穿该靶标神经(例如gsn45、gsn神经根48、内脏小神经46或交感神经链49)的位置。或者,一种导管可以包括多个沿该导管远端部分分布(例如约1到5厘米长度范围内)的消融元件210,可以将消融能量以某一种顺序或同时传输到每一个消融元件中,来创造一种长条形的覆盖该目标范围150的损伤,如图21所示。■关于为了减少由血流和非控制下血管封闭导致的多变性的导管实施例构想本章节涉及到的任何方法、系统和装置可以与确认刺激和消融相关方法、装置与系统中任何一项相结合。此处所述的用来消融胸内脏神经的血管内实施方法可以包括通过该患者的的血管系统在血管腔内某位置递送至少一个导管消融元件或其它医疗装置,该位置可以是消融能量释放到的靶标神经附近的某一合适的血管腔内的位置。肋间静脉相对特别狭窄(例如其内径通常在2到3.5毫米范围内),并可以在传输消融能量而释放热量时径向收缩,这样可以产生多种电学和热学特征,从而增加能量传输控制系统工作的不稳定性,妨碍在靶标神经上进行精准消融,进而降低有效性好安全性。在血管腔内该位置处的血流也可以与传输的消融能量发生反应,在传输消融能量时产生多种电学和热学特征,妨碍在靶标神经上进行精准消融。流经血管腔(例如肋间静脉)内该位置处的血流可以对该消融元件、静脉壁和静脉壁附近的组织,有可能包括靶标区域,产生流动冷却效果。根据此处血流的容积流率情况,流动冷却效果有可能会使在靶标神经上创造的损伤不够深,从而影响消融的有效性。一种结合了能量传输算法的系统包括一个或多个根据例如阻抗和温度等参数的反馈机制,这些参数是由于能量传输元件附近的静脉闭合而引起的,该算法是减轻这样非精准消融的一种方法案例。另一些减轻这种非精准效果并提高神经消融有效性的装置和方法的实施例构想在此包括且不仅限于在传输消融能量时降低或避免经过该静脉腔内位置处的血流,传输消融能量时控制该静脉腔内位置处的流体灌输,控制对能量传输电极的闭环灌洗,以及在该静脉腔内位置处部署一种球囊导管,来阻塞血流(例如,降低或避免产生血流),并将消融传输元件置于此区域内。降低或避免在消融元件周围的血流也可以提高神经消融进程的安全性。例如,一种像是射频电极的消融元件可以包括一种温度传感器,可以测量该电极附近或表面的温度。在一中血流冷却的环境中,该电极周围消融区域内的组织中温度最高的部位可以位于距该电极一定距离的位置处,这样该电极上的温度传感器表示的温度有可能比最高温度点的温度低。而在一种不是由血流或灌输流体冷却的环境中,该电极上的温度传感器表示的温度可以就是该消融区域内最高温度点的温度,或者至少是距离该最热温度点很近位置的温度。可以以一种控制温度的模式或限制温度的模式传输消融能量,在这种模式下,精准反映出的最热温度点温度可以辅助创造大小合适的损伤。如果最热温度点的温度未知,有可能创造过大的损伤,从而给附近例如肺薄壁组织或脏胸膜带来不必要的伤害。■血管腔的人为闭缩以及随后的tsn消融一种降低由于血流和血管(例如肋间静脉)内放置区域的收缩导致电学和热学特征多变性的案例方法可以是在向靶标神经传输消融能量前人为地将该处血管闭缩。因为多条旁路冗余静脉的存在,将某些肋间静脉阻塞,甚至永久阻塞,不会给患者带来伤害。可以通过,例如加热某处静脉壁,施加电信号或通过其它形式的灌输方法使该静脉壁上的平滑肌收缩,施加真空效果,或向该血管释放一种血管收缩剂,等方法将该静脉的某一部分进行人为地闭合。在此所述的胸内脏神经经血管消融的方法可以包括人为地闭合一条肋间静脉的一部分,或者阻塞附近奇静脉系统的一部分,然后向靶标神经传输消融能量。例如,将该肋间静脉的一部分闭合可以包括闭合放置消融元件位置上游的肋间静脉的一部分;或者闭合附近奇静脉的一部分可以包括闭合放置消融元件位置附近奇静脉与肋间静脉的接口(例如可以在闭合该肋间静脉之后),或者闭合该静脉上直到或邻近该接口的部分(例如距离该接口1到5毫米);并可以在该闭合步骤之后向该靶标神经传输消融能量。在这些方法中,血流在肋间静脉内放置装置区域的上下游部位都被阻塞,并且也避免了从该接口流经该奇静脉的血流。在某些患者中,某一条靶标内脏神经有可能很接近该接口处,因而流经此处的血流可以对血管外约5毫米范围内的组织进行冷却,并有可能妨碍对靶标神经的热消融。避免该接口处的血流流通可以帮助对此处附近靶标神经进行更有效的消融。在肋间静脉中放置装置的位置处,可以包括该接口区域,阻塞血流时,可以使消融能量在一种变化更小的环境中传输。或者,该肋间静脉中放置装置的区域可以保持通畅、进行灌输或也可以是在消融元件周围封闭的。或者,该消融能量可以包括射频电流(例如单级模式或双极模式)。或者,该消融能量的功率可以相对较低而时长可以相对较长。以下任何关于静脉闭合或阻塞(完全或部分)的装置与系统可以根据任何关于静脉闭合或阻塞(完全或部分)的方法来使用。■在静脉中用来对消融区域远端处的静脉部分进行闭合的tsn消融导管不仅仅限于此处的说明内容,在放置装置的位置处降低血流的一种形式可以是相该静脉壁释放足量的热能量,来使其闭合,例如通过使该静脉壁内的胶原纤维变性或刺激该静脉壁中的平滑肌使其收缩。以其它目的而闭合静脉的系统和方法在此之前有过相关表述。例如,专利us3301258说明了治疗静脉曲张的系统。其中表述的系统在组织中传导电流,该组织邻近于两个电极之间的静脉,这两个电极位于一种静脉内探针上,其中所述的电流可以在该静脉内产生足够的热量,来闭合该静脉。然而,该系统没有专门说明可以对神经进行治疗,消融组织或提供神经调节治疗,或者没有相关表述。事实上,这个us3301258的专利中指出由于释放热能而对周围神经功能造成的损伤只是临时的,这与本发明表述的治疗方法相左。因而,在专利us3301258中表述的治疗方法是允许这些神经在治疗之后恢复功能的。图38a到38e是一些方法和装置的示意图。在图38a到38e中,血管内导管361包括一种能量传输元件362,并且其中所述的能量传输元件可以用作消融元件和静脉闭合元件。或者,该能量传输元件362也可以用作神经刺激元件。或者,一种血管内导管可以包括一种不同的神经刺激元件。或者,该能量传输元件362可以包括多个消融元件,例如该能量传输元件362可以在该导管套管的表面,并可以沿该导管远端部分的长度方向以一定距离(例如相同距离间隔、电极间距离范围在4到6毫米)排列。在另一个实施例构想中,如图38g所示,该能量传输元件362可以在导管365上递送,该导管可以通过一种套管379递送,例如可以通过该套管的管腔从其远端的开口384处伸出。在图38a到38e中,该导管361的远端部分可以被引导进入奇静脉41和肋间静脉(例如位于胸椎t5到t11处的一条肋间静脉)中,如图38a,其中所述该导管的能量传输元件与该靶标神经足够接近,可以有效地向该靶标神经传输消融能量。这些电极的直径在2到6毫米范围内,并几乎可以阻塞甚至撑起该肋间静脉。可以通过沿该导管对该神经的电刺激来识别该靶标神经,运用所选的电极作为阴阳极并可以监测神经刺激的生理反应。一种消融控制台363可以是一种计算机控制的射频消融发生器。或者,该消融控制台363也可以传输神经刺激信号。该导管361可以向该消融元件放置区域30远端处(例如上游部分)的静脉壁释放闭合能量,将其加热并使该管腔闭合或直径显著缩减,从而将血流减缓到一定程度,在低流速环境下的控制算法控制释放消融能量时(例如图42b所示的一种能量释放控制算法),可以对靶标神经进行有效地消融。不仅仅局限于的是,通过导管361释放的静脉闭合能量或消融能量可以是射频形式、微波、超声、直接热消融、光学形式(例如激光)或可以引起静脉闭合的其它能量形式,例如加热该静脉壁。图38a到38e表述了一种实施例构想,该静脉闭合能量包括单级形式释放的射频能量,其中所述的射频电回路是从一种射频消融控制台363向该能量传输元件362施加的,并可以穿过患者的身体与弥散电极364相连。由导管361携带的能量释放元件362的长度可以在2到10毫米范围内,直径在4到10f范围内。或者,可以在此情况下有效地使用双极射频的形式。或者,可以有效地利用多电极导管。例如,不仅仅局限于的是,一种柔性装置(例如导管、导丝、套管等)可以带有一个、两个或多个电极元件,用来传输消融或刺激能量。这些电极可以以一定间隔的形式分布在该柔性装置的远端部分。该柔性装置可以由电绝缘材料制成,例如,但是不仅仅局限于,聚氨酯或塑料。该柔性装置可以携带不同直径或相同直径的电极,并沿长度方向分布。这些电极由电导材料制成(例如pt、ptir、不锈钢、au等)。或者,这些电极可以由球囊状有导电材料面的材料制成。该柔性装置可以是可操控的或可以有一种管腔,允许通过导丝递送。对静脉壁的加热有可能需要在多个部位进行,从而有效地降低血流。图38a到38e描述了在放置区域30,即向靶标神经45释放消融能量的区域,远端处的两个位置释放热能的步骤方法。闭合或缩减该静脉腔的能量可以是较高能量而时长较短的形式,从而可以快速实现理想的静脉壁收缩效果。进一步而言,闭合静脉的能量可以在该静脉壁上产生热量(例如在63℃以上、在60到80℃范围内、在63到75℃范围内),同时可以避免从该静脉壁外侧向附近1毫米范围以外的组织释放或传导热量,并同时避免对血液的过度加热而产生沸腾或产生蒸汽。或者,静脉闭合能量可以以热能的形式闭合或缩减该静脉腔的一部分,同时避免对该静脉之外或附近的组织,例如肺薄壁组织或脏胸膜,造成热损伤。图38a表示了整个方法示例的第一步,其中所述的导管361在一条奇静脉41中递送(例如与一条肋间静脉相连的奇静脉系统,例如一条奇静脉、半奇静脉或半奇静脉附属静脉),该导管的消融部分365包括该能量传输元件362,递送进入一条奇静脉40中装置放置区域30远端并接近一条靶标神经45的位置。例如该消融部分365或可以通过导丝366递送。在闭合该静脉之前,血流367可以从该肋间静脉40流向该奇静脉41。可以从该能量传输元件362向血管释放闭合能量将该静脉腔闭合或缩减。或者,可以在该肋间静脉内装置放置区域远端处的多个位置释放闭合能量,辅助实现足够程度的血流减缓效果。图38b表示了第二步骤,该步骤为或选步骤,其中的能量传输元件362从该静脉的闭合位置被回收了一段距离,该位置是图38a中电极放置的位置,并仍为装置放置位置30的远端区域。可以在此时的位置释放静脉闭合能量来进一步闭合静脉。或者,经过一条奇静脉的血流也可以在消融靶标神经之前被阻塞。减缓奇静脉血流的效果和实施方法在此有更详细的陈述,并可以与本文涉及到的任何方法相结合。图38c表示闭合了该肋间静脉40内装置放置区域30远端处的部分369和368,并且奇静脉血流370从接口64处转移到其它地方。该能量传输元件362已被收回到了该装置放置区域30并且穿过该血管壁向周围组织(例如距离该静脉壁5毫米范围内)释放消融能量来创造损伤371。或者,可以在释放消融能量之前释放一个神经刺激信号,来确认靶标神经的接近情况,例如此处提及的示例。可以在神经刺激成像表示的一条或几条靶标神经附近对该区域30内的一部分进行消融。或者,如果没有进行神经刺激(也可以是神经成像)的话,可以沿该区域30进行整体消融,从而对所有的靶标神经进行消融。在此实施例构想中,可以通过回收该电极的同时进行多次消融。图38d表示在第一消融损伤371处附近操作第二个消融损伤372,其中所述的第二个损伤与第一个损伤有部分重叠,例如通过将该能量传输元件362回收等同于该电极长度的一段距离(例如约4毫米),产生20%的重叠部分。图38e表示了覆盖全部装置放置区域30的多个消融损伤371、372、373和374。可以创造4个以上的损伤来覆盖该区域30,并在其它实施例构想中,可以从该区域30的一部分释放消融能量。图38f的有限元模型表示释放射频能量后产生的热效应,其中该奇静脉内的血流具有很强的对流冷却效果,从而影响靶标神经消融的有效性。尤其是当该奇静脉与靶标神经距离较近时,例如距离0到5毫米范围内,会有影响。该有限元模型包括静脉腔内的一个2毫米的射频电极,可以通过血流冷却到体温的距离该电极5毫米范围内的一条奇静脉,和从该静脉到组织内部约4毫米的55℃等温线。该模型表示了射频能量以功率为11.7w的单级形式在组织上持续传输120秒,并产生187欧的阻抗。或者,此处所述的任何方法中,该奇静脉41内的血流370可以暂时从该肋间静脉40与该奇静脉连接的接口64处转移开。从该接口64临时转移血流370可以包括例如阻塞该靶标肋间静脉远端处(例如上游)的奇静脉,该靶标肋间静脉远端和近端处(例如上下游)的奇静脉,阻塞该接口64,或这几项的组合形式。或者,该奇静脉内的血流370,可以经过该奇静脉,但是并不经过该接口,或不经过距离该接口(64)5毫米范围内的近端或远端区域。一种导管446的实施例构想中,该导管可以阻塞该靶标肋间静脉40远端处的奇静脉血流,如图43a所示,其中所述的球囊445部署在该奇静脉41内,至少可以阻塞血流370的一部分。可以运用球囊、支架、导管或基于导丝等相关原理来达到这一目的。例如,但是不仅仅局限于,专利us6165172描述的可扩张元件,例如球囊结构,可以用来阻塞静脉中的血流。这种可扩张的结构也可以用在本发明中来实现部分效果。例如,可以将一种柔性引导装置从上腔静脉递送到该奇静脉内,并到达该靶标肋间静脉接口的远端处。该柔性装置的阻塞部件可以在此后进行扩张,来阻塞流经该奇静脉的血流。一种用来传输能量来将该肋间静脉的一部分进行闭合或缩减并可以对靶标神经进行消融的导管,或本发明涉及到的任何其它消融导管,可以在此后另外进行插入,例如图43a和43b所示。或者,该导管和该阻塞部件可以结合成为一体的装置形式。针对本发明和任何在此涉及到的方法,理想的情况是在该靶标肋间静脉接口近端处的一个位置对该奇静脉内的血流进行阻塞,也可以包括该接口处,例如额外阻塞该接口远端处的血流。即使将远端处的血流阻塞后,来自靶标接口上方(例如下游处)肋间静脉的血液回流有可能仍然会带来对流冷却的效果影响,从而影响神经消融的有效性。可以运用一种更长的可扩张部件来阻塞位于靶标接口近端和远端处的血流,例如图43a中所示的但是更长的部件。或者,可以通过使用携带两个可扩张部件的柔性装置,例如双球囊结构,来实现其有效性。图43a和43b,以及图38a到38e表示了一种将奇静脉血流从该接口转移开,但不对其进行阻塞的方法和导管的实施例构想。这些方法和装置可以与本发明涉及到的任何其它方法和装置结合使用。在这些实施例构想中,一种导管或其它可伸长的医疗装置可以包括一种分叉结构,可以与该接口64耦合,并可以向该导管产生一种轻微的向前的作用力,可以将该导管套管的一部分推向抵在该接口处。这样,血流依旧可以在该奇静脉内流通,但不会流经该接口处。抵在该接口处的导管部分的尺寸可以足够大,来覆盖整个接口,例如直径可以在2到3.5毫米,同时足够狭窄,可以在直径为9毫米的奇静脉内递送。例如,抵在肋间静脉接口处的导管部分的直径可以在4到8毫米范围内。此实施例可以阻塞血流或将血流减缓到足够的程度以下,来实现对该接口64附近0大5毫米范围内靶标神经的热消融。图39a表示了在奇静脉中阻塞血液流经接口64的另一种方法,以及运用在该方法中的装置的一个实施例。可以将一种递送套管379从患者血管系统中插入到一条奇静脉41内,例如通导丝递送。可以通过该套管379递送一种导管360,该导管可以包括一种安装在其上的或由该导管360上的一种可伸长管结构359携带的顺应性球囊377。在该管结构359上该球囊377内可以布置一个填充口378,并可以与该导管近端处的填充口,例如罗尔接头,进行流体交流。可以通过该填充口378,将气体或流体,例如纯净水或溶液,填充到该球囊内,使其膨胀。该管结构可以包括一种内腔358,从该球囊经过,并可以使一种套管365在其中滑移。该套管365可以连接或携带一种能量传输元件362,该能量传输元件可以作为神经刺激电极、静脉闭合电极或经血管消融电极中的至少一种,如图38a到38e所示。该能量传输元件362可以在该球囊377保持不动的情况下移动。例如,可以将能量传输元件362移动到消融区域30远端处,来闭合或缩减该静脉368和369,然后在回收到该区域30,或可以传输神经刺激信号或对靶标神45经进行消融。或者,套管365可以包括一种内腔376,与该套管365的远端末端和该导管的近端部分相连。内腔376可以将该装置通导丝递送,或可以用来注射不透射线对比剂,来评估该静脉的阻塞情况。为了移除该导管360,可以通过该注入口378移除该球囊377内的气体或流体,并可以与该导管360上的能量传输元件362通过该递送套管379一同移除。图39b表示了与图39a中所示类似的实施例构想,可以与本发明涉及到的任何其它实施例构想相结合,然而,不同于通过向静脉壁释放热能来使其闭合或收缩来达到闭合该静脉40的目的的是,通过管腔376可以递送安装有封闭球囊411的套管412,并在该静脉内将该球囊411填充。该能量传输元件362可以在该区域30内滑移,同时给球囊411和球囊377可以保持不动。这种阻塞方法至少可以阻塞该静脉的一部分。■包括另一种静脉闭合元件和消融元件的tsn消融导管图40表示了一种导管的实施例构想,包括一个或多个静脉闭合电极和一个或多个不同的消融电极。导管404包括一个或多个轴向分布的静脉闭合电极405,以及一个或多个不同的经血管消融电极406。可以在一条靶标静脉内放置该静脉闭合电极,例如在一条如图所示的肋间静脉40中或区域30的远端部分。可以从该静脉闭合电极405中传输能量(例如射频能量),来在该血管壁上产生热能效应,例如使用如图42a所示的能量传输模式来将电极405周围的血管腔闭合或缩减。在进行消融时,可以将该电极405保留在原位,从而可以帮助实现血管的阻塞效果。该消融电极406也可以作为神经刺激电极,来呈现该区域30内靶标神经位置的图像。该静脉闭合电极可以与一种套管407相连,或由其携带,并且该消融电极406可以可以与一种套管408相连,或由其携带,而该消融电极406可以在区域30内滑移,同时该静脉闭合电极可以保持在原位。例如,如图所示的套管407可以穿过消融电极406和套管406的内腔。可以通过在该导管远端处对该套管408进行推拉的操作来移动该消融电极406。例如,该套管408可以连接在操控该套管408的手柄的触发器上,并且电极406的递进步伐可以约等于消融电极406自身的长度,这样可以在神经刺激成像时辅助覆盖区域30并辅助进行多次消融。在消融之后,可以将该导管从该血管中移除,同时从部分闭合的静脉内移除该静脉闭合电极,从而使得血液可以在即使部分闭合的静脉中流通。或者,该导管404可以包括一种导丝腔411,并可以通过导丝410递送。可以将不透射线对比剂,例如通过导丝腔,注入到该肋间静脉远端处(上游)的阻塞区域,来确认是否有效地阻塞了该静脉40。或者,可以通过所示的递送套管409递送该导管404。或者,如在此所述,可以将该奇静脉41内的血流阻塞或从该接口64处转移开。或者,如图43所示,可以通过该导管440侧面的一个开口441,将该导管404递送出,来形成一种导管分叉,与该接口64相配合。■在静脉消融区域内对能量传输元件周围的静脉进行闭合的tsn消融导管图41a和41b表述了另一种实施例构想,一种tsn消融进程可以包括在经过区域30的靶标神经附近放置一种能量传输元件417(图41a),在该区域30内的一条静脉壁上传输能量来产生热能效应,来首先将该能量传输元件417周围的静脉闭合,然后从能量传输元件向周围或区域30附近的组织释放消融能量(图41b),来创造多个可以覆盖该区域30整个长度的损伤418,从而消融靶标神经45。将消融区域30处的静脉40闭合可以减缓或避免该电极周围的血流影响,从而辅助实现创造损伤时对靶标神经45消融的安全性和有效性。在传输能量消融靶标神经之前闭合该消融区域的静脉也可以提供该能量传输元件417与该静脉壁周向的良好固定作用,这样可以辅助进行围绕该静脉的连续的周向消融,进而提高有效性。适用于该方法的一种导管可以包括一种长度约等于该区域30长度(例如约3到4厘米、约3厘米、约1.5厘米、约1到3厘米)的能量传输元件。如图所示,该能量传输元件417包括多个射频电极,轴向分布于套管419上。该多电极可以实现单级或双极模式的功能。在单级模式下,多个电极可以按照一定顺序,例如运用静脉闭合的能量传输模式,释放射频能量,随后再进行消融,如图42a和42b所示。射频电极可以作为神经刺激电极,来评估某一消融进程的技术有效性。该能量传输元件可以是柔性的,来适应曲折的血管系统。或者,该能量传输元件可以包括一种单长柔性电极,例如一种金属线圈或激光切割金属管。或者,可以用一种能量传输元件传输其它能量模式,来产生热能效应,例如直接加热,微波或光能。■用来闭合静脉和进行经血管神经消融的射频传输模式在从邻近的奇静脉到肋间静脉接口(或)以及到靶标肋间静脉的血流减缓或阻塞时,可以进行对靶标静脉结构的消融步骤。如图42a和42b表示了控制能量传输功率的的实施例构想,可以根据闭合肋间静脉的一部分(图42a)和靶标神经经血管消融(图42b)为目而传感的温度和阻抗来进行。例如,如图42a结合图38a到38e所示,传输的射频能量功率380可以是以功率不变(例如在10到20w范围内)的形式,直到相关阻抗381升高(例如从150欧升高到250到300欧范围内),表示该肋间静脉40在该消融电极362周围已足够闭合383,或收缩。相应的,如果该消融导管361配备了一种温度传感器375,探测到的温度382将会升高(例如从体温升到70到85℃范围内),而通过血流367经过该肋间静脉40造成的对流冷却效果将会降低,或消除。如之前所论或如图38a、38b和38c所示,可以反复进行这一步,直到闭合或收缩了足够长度部分(例如从该接口64到该肋间静脉内3厘米深的区域30,从该接口64到该肋间静脉中邻近肋椎关节的区域30)的靶标肋间静脉。对靶标神经的消融可以通过运用温控模式释放能量来实现,如图42b结合图38a到38e所示。直到到达该目标温度386,该消融控制台363可以释放更高功率387的能量(例如在5到15w范围内)。然而,当探测的温度388到达或接近目标温度386时,可以在某时间点将功率降低(例如约2到10w范围内)。可以继续进行消融并持续进行更长一段时间,使该损伤扩张,并超过该靶标神经45的位置。图42c和42d所示的有限元分析(finiteelementanalysis,fea)结果表示该损伤的深度可以随消融时长而继续加深。图42c是60秒时长的fea,而图42d是相能量传输同参数下120秒之后的fea,同时显示了从一个电极396延伸凹一条肋间静脉壁397的55℃等温线395。或者,可以进行功率不变的能量传输。在一个实施例构想中,可以通过温度传感来指导能量的传输。或者,如果在特定的消融区域中的热力学情况得到了很好的控制(例如血流被阻塞),那么长时间地(例如30到240秒)施加低功率(例如2到20w)能量也可以达到理想的临床效果。长时间地传输低功率的消融能量可以通过电阻产生足够的热量来加热靶标tsn,同时由于代谢作用的冷却效果,电极附近的其它组织,例如肋间静脉或肺组织,可以收到较少的热量,因为这些组织与靶标神经或其周围脂肪相比更容易散热,并因此可以避免对侧伤害。■用来冷却血管壁的灌输导管在一些示例中,将流经该靶标肋间静脉或流经该奇静脉的血流减缓到一定程度或许是实现不了的或不是理想的。例如,为了在之后可以反复进行消融,理想情况或许是将靶标肋间静脉的一部分或进行可逆的闭合或缩减内腔的直径。在其它情况下,该静脉从尺寸或许较大,而完全闭合就不现实。在这些情况中,为了抵消血流造成的冷却效果,可以使用更高的功率。然而,为了避免该消融电极上炭化和凝结物的累积,可以运用灌输的方法。该灌输方法包括注入生理学相容的无菌流体,例如0.9%的生理盐水,可以以开环或闭环的形式进行。在一种开环的方法中,该灌输液可以冷却该能量传输元件,并可以在此后融入患者的血液循环中。在一种闭环的方法中,该灌输介质在能量传输元件内部循环。在使用开环方法时,需要注意注入患者体内灌输介质的容积流率。根据具体情况,一些患者的循环系统没有能力承受大量额外的灌输介质。这样,在使用开环灌输消融系统时,最好以低流速进行操作,例如2到10ml/min。图42e和42f中的有限元模型表示了这样的原理。图42e表示了两个有限元模型,比较而言,左边的情况中,一条肋间静脉中的血流被阻塞,而在右边的情况中,血流流到电极处,抑制了该电极以及周围组织温度的上升。在这两种情况中,使用了相同功率(10.5w)、相同的组织阻抗(167欧)以及相同的时长(120秒)。将距离该电极4毫米处的一条靶标tsn加热到55℃以上时可以表示在左边的情况下进行了有效的消融。在右边的情况下,如果该靶标tsn没有被加热到这样高的温度,则有可能没有完成有效的消融。图42f表示了两个有限元模型,并进行了比较,左边的模型中,一条肋间静脉内的血流被阻塞,而右边的模型中,血流流到了该电极处,并且该电极通过一种流体,例如闭环方法中温度为32℃的生理盐水,进行灌洗。例如,该灌洗液的初始温度可以是室温,并且在该流体流经患者体内的导管时,可以提高一定的温度。因此,该视频电极后来的温度会比室温高一些,但是比体温低一些,在32℃左右。使用温度在4到35℃范围内的灌洗液也可以起到这样的效果。在两种情况中都可以应用同样的组织阻抗(167欧)和时长(120秒),但是在左边的情况中使用的功率为10.5瓦,而在右边的情况中使用的功率较高,为16.3瓦。在灌洗环境中,该靶标tsn被加热到55℃以上后可以表示成功消融。另外,与该灌洗电极接触的静脉壁可以保持在较低的温度中,这样可以避免在传输消融能量时静脉的闭合。■用来保持血管打开并阻塞血流的球囊导管图43a到43f表示了一种tsn消融导管的另一种实施例构想。图43b表示了安装在一种可部署球囊448上的多电极形式的能量传输元件447。该球囊448的直径可以约等于肋间静脉40内某一靶标区域30的内径(例如2毫米、2.5毫米、3毫米、3.5毫米),并且在扩充状态下可以填满或稍微撑起该静脉,这样可以避免血流流经该能量传输元件447,可以将该能量传输元件牢固地布置在静脉壁上,从而避免该血管的萎陷,并可以将能量传输元件进一步向该靶标神经靠近。这些可以减轻在能量传输使多变热效应和多变电特性带来的影响,从而辅助进行更加精准、安全而有效的神经消融。进一步而言,在血管保持张开的情况下,血流可以在移除该装置后继续流通,并如果在此后需要再次进行消融时,可以将装置递送到患者的血管内。如图所示,该球囊448相对较为细长,并且可以将能量传输电极447放置在该区域30范围内,该区域也是靶标神经经过的区域。例如,该球囊448的长度在2.5到4毫米范围内(例如约3毫米)。用来制作球囊导管的材料和方法在相关资料中有所提及。该球囊可以安装在或由一种套管449携带,该套管上有一个位于该球囊内的填充口450,可以与其内腔和该导管的近端部分进行流体互通,来注入或排出气体或流体,例如用来填充该球囊的生理盐水。或者,该套管449可以包括一种导丝腔466。该内腔466也可以用来向该肋间静脉40内注射不透射线造影剂,来评估该球囊448是否有效阻塞了该静脉。如图所示,该能量传输元件447可以包括多个安装在该球囊448表面的电极(例如制造成一种柔性电回路)。这些电极可以排列在该球囊448的一侧,从而可以朝向该靶标神经45的方向451(例如同向或径向相互呈0到45度范围内),如图43c所示是图43b中43c-43c横截面的示意图。或者,该能量传输元件是由多个能量传输元件组成,可以进行双极、多极或多相的射频能量传输。或者,该能量传输元件可以包括一种单长柔性多极。或者,电极可以环绕分布在该球囊上,形成一种圆周消融形式。该能量传输元件447可以与通向该导管近端部分的发生器电路连接,并在该近端部分可以与一种计算机消融控制台相连,该计算机控制台也可以控制向该能量传输元件447传输神经刺激信号。或者,可以用循环液填充该球囊448,该循环液可以冷却该电极447或组织的细小区域,例如静脉壁,从而可以传输更大量的能量,来增加消融区域的深度,这样可以为靶标肋间静脉40和靶标神经45距离更远的患者带来益处。可以通过位于奇静脉系统中的某一静脉内的递送套管或通过导丝将该球囊导管递送到某一肋间静脉40中。或者如图43b所示,可以通过运用一条与接口64耦合的母级导管446,将该球囊导管递送进入一条肋间静脉40中。该母级导管446可以通过一个侧口452递送该球囊导管,并可以使这些电极447相对于该母级导管466保持一致的排列情况,从而使得电极可以瞄准靶标神经。例如,在图43a、43b和43d中,该母级导管466包括一个朝右侧的侧口452;该球囊上的电极总是相对于该母级导管向前(朝向页面外)的朝向排列,因为其包括的一种套管454至少一部分是方形的,或是可以在母级导管套管456内与配合的管腔455旋转受限的其它形状,如图43e所示。在从该侧口452递送该球囊导管时,这些电极447可以保持朝前(朝向页面外)的排列情况。在患者右侧的肋间静脉40中,这些电极477可以朝向前方,并朝向靶标神经。在一种实施例构想中,只有将能量传输元件朝向靶标神经排列,才有可能使用少量能量实现有效消融,从而减少伴随的损伤(例如,可以减轻痛苦或加速愈合),可以通过最小化消融区域457来提高安全性。曲折的通向该靶标肋间静脉的血管系统可以增大沿导管向远端精准传导扭矩从而使能量传输元件对准靶标神经的难度。然而,相对容易的是通过导管446向远端部分458传导扭矩,从而在肋间静脉40内布置该侧口452,因为该导管446可以拥有更大的直径(例如15到18fr),在奇静脉内有更多的调整空间,并且与用于肋间静脉内的导管相比,曲折程度更小。该导管446可以进一步包括一种套管459部分,可以从该侧口伸出(例如长度约为1到2厘米),如图43a、43c和43d所示。当该球囊导管453,或在其它实施例构想中的导丝或其它消融导管从该侧口452部署进入肋间静脉40内,并在该导管446收到向前的轻微作用力461时,套管459的部分与侧伸出的导管(例如图43b中的453或图43a中的导丝460)形成了一种分叉结构,可以与接口64相互耦合或可以抵在该接口64的内边缘462(图43a)。这种结构可以在能量传输过程中提供一种固定位置的作用力。进一步而言,该构造可以将导管446的套管抵在该接口64处,将该奇静脉内的血流从该接口处分流开。或者,如图43a所示,导管446可以包括一种管腔,可以从中递送一种球囊导管445,将该奇静脉41内该靶标肋间静脉40的上游阻塞。■可以进行不同的能量传输模式的控制台和控制器此处公布的方法和装置可以,在一些实施例构想中,在传输能量之前降低某一条静脉内的血流。在这些实施例构想中的任何一项中,在患者体外可以有一台控制台或其它设备,与一种血管内装置进行信息交流。该控制台可以包括一种存储在内存中的计算机执行方法(例如一种算法)并可以有一种处理器执行,该计算机执行方法包括一种内腔缩减能量模式和一种消融能量模式,其中的内腔缩减模式是,在启动时,可以生成第一种能量并可以从一种医疗装置的能量传输元件中传输,而其中所述的消融能量模式是,在启动时,可以生成第二种能量并可以从该医疗装置上的第二种能量传输元件中传输,该第二种能量与第一种不同,而该医疗装置上的第一种能量传输元件可以与第二种能量传输元件相同或不同。这两种不同的能量可以分别用来执行内腔缩减步骤和消融步骤。一种外置装置,例如一种控制台,可以与该血管内装置(例如本文涉及到的任何一种导管)进行信息交流,该装置可以携带一个或多个能量传输元件,其中所述的计算机执行的方法可以向该一个或多个能量传输元件传输能量。该消融能量模式可以包括一种与内腔缩减模式相比低功率时长长的能量模式。例如,该内腔缩减模式的射频能量传输功率可以在10到20w范围内,时长在5到15秒范围内,而该消融能量模式的射频能量功率在2到10w范围内,时长在1到2分钟范围内。该消融能量模式可以进一步包括一种视频能量启动传输模式,在达到目标温度前的功率可以在5到15w范围内。该内腔缩减能量模式可以相应于组织阻抗的升高来终止或启动对能量传输的终止,例如阻抗在250到300欧范围内。该计算机执行方法根据接收到的数据可以启动该消融能量模式。该计算机执行方法也可以进一步根据接收到的数据终止该内腔缩减能量模式,并或可自动启动该消融能量模式。在一种实施例构想中,如图44中所示的系统470,包括一种计算机控制台471,其包括一种处理器472、一种包含计算机执行方法的内存装置473。该计算机执行方法包括一种内腔缩减能量模式和一种消融能量模式,其中所述的内腔缩减能量模式在启动后可以生成第一种能量,并可以由一种医疗装置475上的能量传输元件474传输,而其中所述的消融能量模式在启动后可以生成第二种能量,并可以由该医疗装置上的第二种能量传输元件476传输,第二种能量与第一种不同,而这两种能量传输元件可以是相同或不同的。该医疗装置和控制台可以相互连接,例如通过一种电连接线477连接,该连接线的连接器与该控制台的接线口478可以相互配合。该医疗装置和控制台之间的连接可以传导内腔缩减能量和消融能量,并可以传导来自该医疗装置的反馈信号,例如温度或阻抗的反馈信号,并且或可传递神经刺激信号。该控制台可以进一步与一种弥散电极垫480相连,该弥散电极可以帮助在神经刺激或射频能量传输时形成电回路。该控制台可以进一步包括用户输入触发器481和482,例如按键、旋扭、触摸屏或踏板,可以触发内腔缩减模式或消融模式。该控制台可以进一步包括一种图像用户界面483,来向用户显示,例如该结节执行方法的状态、反馈信号、误差或提示,等信息。图45展示了系统490的另一种实施例构想。该系统包括一种医疗装置,例如一种携带一个或多个电极493的导管或可伸长套管491,以及一种控制台或传输装置492。该传输装置可以包括一种能量源494,用来向所述的电极提供能量;包括一种与该能量源相连的控制器495,该控制器可以执行如下控制步骤:在该传输装置处于内腔缩减能量模式时控制该能量源向一个或多个电极传输第一种能量,来缩减该血管腔的尺寸,并在消融能量模式时控制该能量源向一个或多个电极传输第二种能量,来对靶标神经进行消融。该医疗装置491可以包括一种可以进一步伸长的套管496以及由该套管携带的另外一些电极497;并且该传输装置可以包括一种能量源,可以向所述的电极与所述的另外的电极供能;一种与该能量源相连的控制器,可以执行如下控制步骤:在该传输装置处于内腔缩减能量模式时控制该能量源向一个或多个电极传输第一种能量,来缩减该血管腔的尺寸;并在消融能量模式时控制该能量源向所述的一个或多个另外的电极传输第二种能量,来对靶标神经进行消融。该第一种用来缩减血管腔尺寸的能量可以包括向所述的电极传输一种电信号,导致如下结果中的一项或几项:加热该血管壁到一定温度,并且热量有可能回传到该电极表面(例如一种射频能量信号);并可以从该电极释放一种刺激信号来收缩该血管。该第二种能量可以对靶标神经进行消融,可以包括传输消融射频电流。或者,如图46所示的系统可以通过运用药物、吸或运用一种球囊缩减或阻塞靶标血管。该医疗装置或可伸长套管可以包括一种与一种流体源507相连的管道506,至少包括以下项目中的一项:一种真空泵源或一种血管收缩剂源,或一种球囊填充液源。该源可以是该控制台的一部分或可以与之相连接,并且该控制台中的控制器可以控制该源。该管道可以包含一种孔508,位于这些电极或给管道的附近,来为这些电极附近的球囊提供填充液。该系统505可以包括一种与该能量源511和液源相连的控制器510,所述的控制器可以执行如下控制步骤:在传输装置处于内腔缩减能量模式时,控制该源来分别进行这些项目中的一项:通过所述孔径吸引流体,来缩减该血管腔的尺寸,或者通过所述孔径传输所述的血管收缩剂,来缩减该血管腔的尺寸;在该传输装置处于消融能量模式时,控制该能量源向一个或多个所述的电极供能,从而对所述的靶标神经进行消融。该控制器可以以一定的序列控制所述的源,然后控制该能量源首先进行流体的吸引或传输所述的血管收缩剂或球囊填充液,并在此之后向这些电极供能,先阻塞或部分阻塞所述的血管腔,然后决定是否对靶标神经进行消融。该消融能量可以是例如射频、超声或微波的形式。■对肺部和脏胸膜的保护措施选择接近横膈膜的一条肋间静脉作为靶标静脉的原因之一是可以将消融能量(例如热能)对肺部造成的伤害最小化。如图6b所示,该靶标神经被周围的一项器官和组织所包围。其中一些,例如脊椎骨、骨骼肌、横膈膜和壁胸膜60,可以通过高血流免于热伤害,或可以承受一定的伤痕而不会对健康和生命造成风险。然而,肺组织的散热性能较差,而且不能有效地消散或传导热量。肺被一种称为脏胸膜61的薄膜所包裹。如果脏胸膜受损或因消融的热量而穿破,气体就可以进入胸膜空间62内,并有可能导致气胸。在临床实验中,气胸可以通过布置胸管来缓和病症,但是总体来讲还是要尽量避免气胸。在一些实施例构想中,通过对肺组织的回拉和在胸膜形成的隐窝可以保护肺部免于消融靶标神经(例如tsn或tsn神经根)时带来的以外伤害。该隐窝是胸腔内的一个潜在空间,通过对肺组织的吸引并使得该壁胸膜60折叠后的效果。胸膜腔62可以有四处隐窝,在胸骨和肋软骨后方的称作肋纵隔隐窝,在横膈膜和胸壁之间的称为肋隔隐窝,在横膈膜和纵膈膜之间的称为膈纵隔隐窝,而在脊椎体和纵膈膜之间的称作椎骨纵膈隐窝。后两个隐窝是比较适合于目前情况的隐窝,因为可以利用它们保护肺部免于消融靶标神经(例如tsn或tsn神经根)时产生的热能对其造成的意外消融损伤。如图23所示,肋膈隐窝66,又称为膈肋窦,是胸腔62中的一个潜在空间,在该胸腔的最后部,位于该壁胸膜的肋部结构67和横膈膜结构68的交汇的肋膈角处。其纵向长度接近5厘米,并沿腋中线从第八肋骨208延伸到第十肋骨210。在站立位时,胸膜积液累积在该肋膈隐窝66中。在深呼吸时,肺部组织会填充该胸膜腔,但是在平静的呼吸作用下,肺组织不会占据这些胸膜腔的所有空间。在肺组织不完全占据这些胸膜空间时,该壁胸膜的一部分可以与该胸膜隐窝接触。在用力呼气时,这些隐窝会进一步扩张。通常将胸膜穿刺术运用于患者全力呼气作用时,因为这样可以降低肺穿刺和导致气胸的风险。类似地,可以在呼气作用使得胸膜隐窝扩大的时候,在肺组织移开的时机进行消融。在正常呼吸运动中,横膈膜的偏移在1到2厘米范围内,但是在患者全力呼气并闭气时的偏移可以高达5到8厘米。这样会使肺移动到t10之上。可以在进行消融之前或之时让患者闭气。这种方法的有效性会受限于哮喘或copd的患者,或者女性患者。该肋膈隐窝66是一种细缝形状的间隔,位于每一边的该肋部位67和壁胸膜横膈膜部分68之间。在吸气和呼气作用时,该肋膈隐窝随肺在其间的进出交替着变小和变大。肋纵膈隐窝是沿该胸膜前部区域分布的潜在空间。在这里,该肋部分和该壁胸膜的纵膈部分互相接触。由于在左肺心包前部有一种心切迹的半圆缺口,所以左边的隐窝稍大一些。该肋纵膈隐窝位于第四和第五级肋间空间的前端。在吸气和呼气时,左肺边缘一种舌头形状的结构,称作左肺小舌,可以在左侧肋纵膈隐窝中进出。图23进一步表述了一种治疗方法的实施例构想是如何在呼吸循环中利用胸膜隐窝保护肺65或脏胸膜61不收伤害。图中表示了在呼气作用时对肺的回收作用,或是在平静呼吸时位移到第八级的肋间空间211区域。在邻近第九肋骨209的肋间静脉212处进行神经消融是安全的,因为此处的肋膈隐窝66中不含有肺组织。靠近第八肋骨208的肋间静脉213与肺65和脏胸膜61比较接近,在这条肋间静脉213处进行消融可能会增加医源性损伤从而导致气胸的风险。可以将一种用来探测肺组织是否处于消融区域或消融区域之外的安全区域的tsn消融导管(例如此处所述的导管)放置于靠近胸膜隐窝的一条血管中,如图23所示,来帮助判断安全位置,或探测肺运动,从而进行安全的消融。图24是一种系统220的示意图,该系统可以利用呼气作用时的肺回缩作用提高tsn消融的安全性。图中表示了通过患者腹股沟处的一个切口,将一种消融导管221插入一条股静脉69中,沿下腔静脉进入奇静脉,并进一步进入所选的肋间静脉中。该导管配备一种能量传输元件222,可以是一种以单级或双极的形式传输射频能量的,与一种外置射频发生器223相连的电极。呼吸传感器,例如一种呼吸带224、加速器226或其它例如基于阻抗或超声的设备,可以与放大器225和一种计算机控制器227相连,该控制器227可以进行实时信息处理和分析,并判断患者何时呼气或开始吸气。可以控制能量的传输与呼气作用同步,或控制在仅仅发生于呼气作用时,或发生在相关呼气作用的间隔期间。该系统也可以知道患者在消融期间进行最大力度的呼气作用来提高安全性。在限制呼吸时,有可能是频率变化的,该消融系统可以调整功率或消融时间,来保证全部能量的传输。如图24b所示的系统230通过消融导管231(例如单级、双极、或在一种消融导管单级与外置元件之间)所测量的阻抗可以判断与肺组织接近的程度。可以通过电阻抗,或与阻抗相关的参数,例如该导管电极232与弥散电极233之间或者第一电极与第二电极之间的相或频率参数,来预测肺组织是否存在于该消融区域。阻抗(z)是一种交流电流(ac)回路中对电流阻碍程度的测量量,并由与其相关的三个独立因子决定:电阻(r)、电感(l)与电容(c),其关系式是:z=r+j(ωl-1/ωc)ω代表电流的角频率,j是(-1)的平方根。阻抗也可以理解为交流电相关的电阻(r),类似于直流电(dc)电路中的电阻(r=v/i),也可以用欧姆表示。阻抗测量或“生物阻抗”是一种复杂的变量,反应了交流电路中组织的电阻和电容。是一种激励频率在测量阻抗时的函数。跨越若干频率或频率范围测量的阻抗称为阻抗谱。任一种材料都有特定的电阻,并在相关文献中频繁运用。可以运用一种电极校准常量来校正电极之间的物理偏差。细胞个体和生理组织都可以被视作一种简单的电路模型,并通过细胞外电阻(re)、细胞内流体电阻(ri)和细胞膜电容(cm)表示。电流和电压的实时单独测量可以测出不同频率中的电阻和电容。在一些文献中很好地表述过了这些电路和算法,并且此处的“阻抗”也表示了这些测量方法。组织和体液有其特定范围的阻抗值。该原理适用于不同的组织,并可以确认穿刺和探针的解剖学位置。在之前的文章中,许多装置都利用了阻抗探测技术在探针尖端位于理想组织中时,来引导手术的穿刺或探针的启动(例如释放消融能量或注射药剂)。最常见的例子包括向肿瘤释放热能,因为其阻抗不同于周围的肝脏、肾脏或肺组织。在这些应用中,该探针递送到理想的位置,同时在预估的范围内监测阻抗。到达靶标位置时,可以固定该探针并进行消融。在之前利用了连续的组织阻抗监测,来引导射频能量进行组织消融。例如,1995年九月5日申请的美国专利us5447529,“利用心脏内阻抗来判断电极与组织的接触情况,判断进行心律失常消融和加热组织合适位置的方法”,利用了组织阻抗随加热而降低的实际特性。2003年五月27日申请的美国专利us6569160,“探测电极与组织接触情况的系统和方法”,公布了一种利用闭合回路阻抗以及相关电极来监测电极与组织接触情况的系统。该系统包括一种带有位置传感器和远端电极的导管。该导管包括一种防止与组织接触的对照电极。该系统进一步包括一种信号发生器,向该远端部分和对照电极传输测试信号。组织接触的探测情况是通过对比该远端电极与回路电极间信号和该对照电极与回路电极间信号来实现的。如果探测到电极与组织已经接触,则可以向该远端电极传输消融能量。可以根据阻抗的变化来执行自动终止组织消融的进程。2008年五月6日francischelli等人申请的美国专利us7367972,“消融系统”,公布了一种通过创造损伤来进行消融并可以评估其完成度或透壁性的系统。对损伤消融透壁性的评估可以通过监测所要进行消融的组织的阻抗来实现。损伤消融的完成是通过探测阻抗在一定时长内保持在一个稳定值来反映的,相当于一种阻抗平台,而并不是尝试探测到一个回落或升高的阻抗值。基于阻抗信号的自动监测和行动(一定功率范围)也可以保障经血管神经消融的安全性,同时保护非靶标组织。例如,ballakur等人在2016年五月24日申请的美国专利us9345530,“对神经调治疗进行评估和反馈的装置、系统与方法”,和wu等人在2016年五月24日申请的美国专利us9345900,“通过热能进行肾神经调节的方法和系统”。kimura在1994年六月于《chest》(105(6):1679-82)杂志上发表的文章《applicationofelectricalimpedanceanalysisfordiagnosisofapulmonarymass》阐述了微分测量肺组织电阻和电容的方法并与其它组织和血液进行了比较。在频率为10khz的情况下测量了健康肺组织,其阻抗为6581欧,电容为893pf,而肌肉的电阻为2252欧,电容为2366pf。在其它资料中,100khz频率下测量的肺组织电阻为1400ohmxcm,肌肉电阻为225ohmxcm。由于消融的区域有可能会包括肌肉、薄膜(例如胸膜)、血管、脂肪和肺薄壁组织,可以利用自然或控制下呼吸时的数据来对该系统进行校准。本文的作者提出了在经血管神经消融过程中利用生物阻抗测量的方法来探测肺组织是否处于消融区域中的创新方法,并可以根据探测结果来控制消融能量的传输,来避免对患者随呼吸而进出消融区域的肺组织造成伤害。如图25a所示的实施例构想,将一种消融导管通过该静脉系统(例如从股静脉进入并经过一条腔静脉70朝向一条上腔静脉42,进入一条奇静脉41或奇静脉系统中)向靠近靶标神经(例如gsn45)的位置递送。所述的位置可以在位于一个胸膜隐窝311附近的肋间静脉40之后的位置。该消融导管310可以包括一种消融元件312,例如一种射频电极,电极周围的消融区域可以是半径约5毫米的范围。肺组织轮廓处的非靶标肺组织316或脏胸膜有可能会处于该消融区域313内,或者会在该消融区域内进出。该导管310包括一种种阻抗测电极314,可以感应生理阻抗感应区315内围绕该阻抗监测电极314的组织。只有在肺组织不处于该消融区域内时传输消融能量。该阻抗监测电极314可以位于该导管上相对于该消融电极312的某一位置处,这样当该导管的远端部分处于血管内对靶标神经进行消融时,对生理阻抗感应区315内肺组织的探测可以提供肺组织316在消融区域313内的准确信息,或表示其是否位于该消融区域313之外的安全区域中。例如,该生理阻抗感应区315可以位于该消融区域313附近,与该消融区域重合或不重合。如图25b,导管310的一个阻抗监测电极314可以位于消融元件312的远端,这样该生理阻抗感应区315接近于消融区域313而不与之重合,在位于一条肋间静脉内时,该肺317的位移与该肋间静脉基本垂直,在该生理阻抗感应区314内出现的肺组织也会出现在该消融区域312内。例如,一种导管的消融区域半径可以为5毫米,其感应区域的半径可以为10毫米,可以包括该消融电极和阻抗监测电极之间至少15毫米的距离(例如约15到20毫米范围内)。由于组织阻抗会随着加热或变干燥而变化,这样的情况不会被消融区域内组织加热的情况影响,从而可以更加精确地探测肺组织是否处于该感应区域中。在这种情况下,虽然消融区域与感应区域不重叠,在该导管处于一条与肺位移基本垂直的肋间静脉中,如果探测到肺组织处于该感应区中,也有可能表示此时传输消融能量时不安全的。或者,可以沿经过该消融区域的一条矢量方向来测量该生理阻抗感应区,这样获得的信息可以反映肺组织伸入该消融区域内的可能性情况。由于呼吸是周期性的,并且肺有可能移动进入或移出给消融区域,可以重复进能量传输,直到靶标神经有效消融,同时可以保护非靶标组织(例如肺或脏胸膜)。生理阻抗监测和控制消融的应用对探测靠近的肺组织是十分有优势的,因为肺中充满了空气,并且与纤维组织、肌肉、组织液和血液相比,其阻抗相对较高。通常来讲,阻抗测量的容量敏感度是已知组织体积内电流密度平方的函数。在单级测量中使用一个电极,最高的电流密度位于活跃电极表面附近的组织中。这样,测量的阻抗主要反映了该电极附近的组织阻抗,并且取决于该电极的表面积和尺寸。阻抗数据将会反映出主导感应区空间内组织的平均阻抗。活跃电极的表面积越小,获得的空间分辨率越高。例如,媒介各向同性的半圆电极测量出的阻抗,有90%是取决于该电极半径10倍半径范围内的空间大小。这里公布的单级结构的阻抗监测电极(例如经过组织通向患者皮肤上弥散电极的电回路)的直径可以在1.5到2.5毫米范围内。在此情况中,测量的阻抗主要反映了该电极周围约10倍半径范围内的组织阻抗。这里所说的区域就是一种“感应区域”。消融区域,或高温导致组织永久损伤的半径区域中,tsn的射频消融实施例构想可以在该消融电极表面5毫米范围内。因此,该感应区域笔盖消融区域更大,并且该阻抗监测方法应当可以探测出在肺组织接近该消融区域时,肺组织是否处于该感应区域,并在肺组织进入该消融区域前停止传输消融能量。如图25a和25b所示的导管包括一种消融元件312。而该消融元件可以是单级形式的射频电极、双极形式的射频电极对、或者是单级或多极形式的多个射频电极,可以置于tsn位置附近的范围内,一种滑动射频电极可以沿该导管在tsn位置范围内滑移,同时该生理阻抗测量电极314可以保持在原位,可以将一个或多个射频电极展开成为一种部署结构,例如曲线形、球形、螺旋形或撑开的形状,如图34、35和36所示,或者,其它形式的消融元件可以是例如一种超声传感器、低温发生器或化学物质注射针。图26表述了一种经血管tsn消融系统的实施例构想,可以在肺位移中探测接近肺组织的安全性,并可以在肺组织距离消融区域安全距离时传输消融能量。根据之前所述的进程,导管325被递送进入该肋间静脉40中。导管325携带有若干电极:生理阻抗电极e1和e2、生理阻抗参考通道电极e3和e4、以及消融元件(例如射频消融电极ea,与患者体内的弥散电极334形成电回路)。为了阐述根据与肺相关生理阻抗反馈进行的消融能量调节的原理,本段表述了一种双极阻抗测量分系统,可以控制一种单级消融源。通过运用与测量单级阻抗相同的原理,或控制双极消融能量源或装置,本文阐述了在不违背本质原理情况下如何应用本发明。同时,在阐述双电极阻抗测量技术时,也可以运用三或四电极阻抗测量技术。另外,该消融元件ea也可以是,例如一种单级射频电极的形式、射频电极对的双极形式、在tsn区域313范围内的多个射频电极的单级或双极形式,沿该导管套管在tsn区域范围内可以滑移的射频电极,同时该生理阻抗测量电极314可以保持不动,可以将一个或多个射频电极展开成为一种部署结构,例如曲线形、球形、螺旋形或撑开的形状,如图34、35和36所示,或者,其它形式的消融元件可以是例如一种超声传感器、低温发生器或化学物质注射针。可以通过isource(+)与isource(-)之间的常量电流驱动电极e1和e2。最好是该电源可以提供两种不同频率的电流波形,f1和f2。例如,f1和f2可以分别在500到1000khz和10到100khz范围内。也可以在其它范围内。例如,运用范围在5khz到5mhz范围内的f1和f2也可以起到与目前实施例构想中相同的效果。可以以一定的序列(例如频率f1超前于频率f2)或同时施加电流波形f1和f2。如果以一定序列施加,如图27所示,重要的一点是要保证波形在f1与f2之间的变换要在零点处。这样可以使得全程的电流波形的平均值在零点,即使在很短一段时间内。从而可以在波形转换点处将对组织和心脏的刺激最小化。或者,如果不使用频率值非连续的波形,图26中表示的电源isource(图26中的isource-与isource+)可以覆盖例如上述操作频率值的范围。为了保障或者的安全,限制施加电流强度在国际医疗安全规定的范围内是很重要的,例如iec60601-1。例如,如果f1=1000khz,相应的电流强度可以是10ma。在f2=100khz时,相应的电流可以是1ma。经过e1和e2(如图26)的电压可以通过感测vsense(见图26和27)的值来测量。vsense是经过一种数据采集系统(daq)和cpu处理的,在生理阻抗电极e1和e2上感测的电压。这种感测电压是经过放大和一定处理过的。例如,可以运用一种两种通频带的带通过滤器,一个对应于f1另一个对应于f2。该过滤器可以作为一种模拟过滤器,与vsense放大器的输出相连。或者,可以使用只有一种较宽带宽的模拟过滤器,与vsense放大器的输出相连,允许f1和f2通过,但是可以过滤掉更高或更低的频率。在这种情况下,可以利用数字过滤器提取f1和f2携带的信息。也可以运用其它过滤技术,例如锁相回路、基于fft的过滤器等。当然,任何这样的数字过滤元件可以位于该数据采集(daq)元件之后,可以将处理过的vsense数字化。之后,这些数据将会被传输到一种处理器(cpu)中,进行进一步的处理并且利用此处所述的任何探测算法。例如,该cpu可以提取电极e1与e2之间复合阻抗的强度(幅度)、zmag、和相角度之后zmag和的变化可以在f1和f2处计算出来。在利用多于两种频率的情况下,可以在所有使用频率或子频率范围内利用该技术。如果是运用覆盖频率的情况,zmag和是在该覆盖频率范围的基础上计算的。处理器cpu可以用这些信息与已知探测阈值331进行比较,如图28所示。或者,可以用一种等同的阻抗测量模块来提取zref和e3与e4之间复合阻抗的信息。类似的,复合阻抗zref的幅度和相可以通过控制元件cpu来处理和计算。e3和e4电极是最为暴露在流经奇静脉或其它邻近静脉,例如另一条肋间静脉,血流的电极。可以预料到的是,在进程过程中,zref会相应于该患者摄入的流体来表现出一下变化。另外,zref也会受到使用麻醉剂的影响。可以根据zref幅度和相判断的相关变化来调节该探测阈值330(如图28)。例如,如果因为灌输液的摄入而导致zref的幅度下降了10%,与zmag相应的阈值或许会降低10%。为了区分肺排气(例如空气较少时)与肺充气(例如空气较多时)的状态,这里利用了一些阈值或一些数值的结合。为了判定阈值328(如图28),可以将一条导管放置于靶标tsn神经附近的血管中(例如一条奇静脉40附近范围150内),并在患者进行深呼吸时测量并记录阻抗,从而判断呼吸运动中阻抗的变化,并利用阻抗的测量值判断感应区域内是否有肺组织。或者,医疗成像可以根据与肺接近的情况来确认该阈值的数值。例如,可以将不透射线造影剂注入感应区域或消融区域中的胸膜腔内(例如,利用经皮穿刺针或一种从消融导管部署出来的针),通过肺运动的荧光镜成像可以确认肺组织安全离开该消融区域或确认阻抗的测量来判断肺组织是否在该感应区域。肺探测阈值可以包括相同或相等的阻抗阈值z_thr1和z_thr2,或阻抗相阈值例如,由于空气与生理活体组织相比有较低的导电性,如果zmag超过了z_thr1,则可以判断肺正在进入吸气过程。相反,如果zmag低于z_thr2,该肺可能进入了呼气阶段。z_thr1可以等于或大于z_thr2。z_thr1与z_thr2取决于电极的几何形状、分开的距离和f1与f2的使用值,并应该在500到2000欧范围内。或者,或进一步而言,可以将与相关阈值进行比较。例如,在呼气时应是负值或者比在吸气使得绝对值小。例如,肺中空气较少时(例如消融安全状态),可以在-5°到-25°范围内,而在肺中空气较多时(例如消融非安全状态),可以在-30°到-50°范围内。或者,或进一步而言,肺中空气较少时(例如消融安全状态),zmag(在图29a和29b中标记为zf,并以实线表示)的频率可以表现为s形的曲线273,如图29a所示。肺中空气较多时(例如消融非安全状态),如图29b所示,zmag的频率曲线表现得更加平缓273。如图29a所示,在由消融电极测量的生理阻抗实施例情况中,或在生理阻抗探测区域与消融区域重叠时,在传输消融能量之前或之后,zmag也可以用来评估的消融效果,并与之前的情况进行比较。消融组织的zmag频率特征(虚线274)与正常组织的zmag频率特征(实线273)相比更加平缓,虽然不像图29b中充满空气的肺的特征线那样平缓。通常来讲,消融组织会表现出比正常健康或非消融组织更低的zmag值。或者,或进一步而言,肺中空气较少时(例如消融安全状态),正常组织的阻抗相频率(在图29c和29d中标记为并以实线表示),是曲线形276的,如图29c所示。肺中空气较多时(例如消融非安全状态),如图29d所示,的频率曲线表现得更加平缓278。如图29c所示,也可以评估消融的效果。消融组织的频率特征(虚线277)与正常组织的频率特征(实线276)相比更加平缓,虽然不像充满空气的肺的特征线那样平缓。消融与非消融,或者正常组织都会表现为负的阻抗相,表明细胞膜的电容特征。然而,通常来讲,由于消融带来的细胞热损伤,消融组织与正常健康或非消融组织相比,其相表现出更低的绝对值。图29a和29c中的虚线捕捉到了这些信息。取决于实际运用的生理阻抗电极,zmag和的值有可能是变化的,但是它们的值在肺中充满空气和缺少空气的情况下是明显不同的。实际值是可以通过经验或试验来确定。当确定下来后,实际值会在该控制元件cpu中进行处理。该cpu通过运用一个或多个上述探测项目或者其组合来判断肺是处于消融安全状态333还是非消融安全状态332(图28)。根据该判断,该cpu可以操作该消融源来向该消融电极ea分别传输消融级别或非消融级别的能量。如图30所示,为了将非目标组织最少化,或将心脏刺激最小化,在零点处转换消融波形是非常重要的。图28是tsn计算算法的流程图,用来探测消融区域内的肺组织,并控制向靶标神经传输的消融能量,同时避免对肺组织的伤害。该cpu可以通过生理阻抗电极传输的多个频率计算出附和阻抗,来生成肺探测阈值328或探测状态。这些可以在引导患者做深呼吸时进行,或通过进行tsn消融的导管325来控制排气(图26)。该肺探测阈值或状态328可以包括多个决定因素,从而提高特别是的存在来自其它组织或能量源造成干扰下的安全性。该操作者可以通过按下用该控制元件户界面上的按钮来启动消融进程329。该控制器可以连续或周期性地检查状态并根据阻抗参考通道330的信息进行修改。该参考通道可以显示通过zref电极测量的血液阻抗,并且如果在该进程中发生了变化(例如由于加载灌输液或由于麻醉的影响),该突刺阈值可以适当作出调整。生理阻抗参数是计算出的,并与该肺探测阈值或状态331进行比较。如果判断为是不安全的状态,可以将消融能量调到非消融级别332,其值可以为零或非常小,并且该算法可以继续监测zref和生理阻抗,直到判断为安全状态为止。例如,如果消融能量是在安全状态下以消融能量级进行传输,并且该算法判断出进入了非安全状态,将消融能量调整为非消融级别332的过程可以包括降低功率而非终止能量,并且幅度的变化可以包括零点处的变化,如图30所示。如果判断为安全状态,可以将消融能量调整为消融级别333,可以包括开启消融能量或者将消融能量的功率从非消融级别提高到消融级别。在本发明中,非消融级别的消融能量可以定义为消融区域内在一段时间中(例如3秒内)不足以对肺组织或脏胸膜造成热损伤的能量级别。或者,如果探测到非安全状态持续超过一段时间(例如3秒),可以进一步降低或关闭消融能量,或在显示屏上向用户发出警告。如上所论,从非消融级向消融级转换可以包括在零点处的转换,如图30所示。该算法可以计算出累积的消融剂量是否足以对靶标神经334进行消融,可以是时间、温度以及之前消融能量传输量的函数。如果该消融剂量足以消融靶标神经,则终止335该消融进程。如果该消融剂量不足以消融靶标神经,该算法可以继续监测zref和生理阻抗,来探测肺组织的干涉与否,并在安全状态下传输消融能量。可以运用生理阻抗来评估是否达到理想的消融效果。例如,在肺中没有多少空气时,zmag和在非消融和消融组织中的测量值会表现出不同的特征值。例如,虽然zmag仍然大于z_thr1,在肺中没有多少空气时,如果消融剂量足够,zmag可能小于z_thr3(zmag<z_thr3)。类似的是,在消融剂量足够时,会表现出平缓的频率特征,但是在肺中没有空气时会保持在一定数值范围内。或者,或进一步而言,可以根据通过该导管携带温度传感器测量的温度来判断消融剂量是否充足。如果测量的温度到达了有效治疗点(例如55到75℃),并持续了一段充足的时间(例如10到60秒),那么可以认为消融有效,并可以停止能量传输。或者,一种算法可以探测肺与消融区域的相对运动,仅当肺移出或不在消融区域内时传输消融能量。向移动的肺组织传输消融能量可以安全地避免消融能量传输到大面积的组织中并有充足的时间可以使热能消散。可以通过电极极化阻抗(electrodepolarizationimpedance,epi)来影响阻抗测量。特别是针对小电极的情况。可以通过提高阻抗测量的激活频率来降低epi。例如,高于10mhz或更高的频率,而epi对50khz的频率影响较小。阻抗测量电极的实施例构想在图31a和31b中有所展示。图31a表示了一种双电极单级阻抗测量的设置,在导管340上安装有一种小型启动阻抗测量电极342,而一种较大中性电极341可以是贴在皮肤上的弥散电极垫。图中也表示了一个另外的消融电极343。在这种情况下,运用所述的两个电极342和341可以释放电流并感测电压。该logic元件可以继而根据释放的电流和感测的电压来计算该阻抗。在某些情况下,该技术更受到epi工件情况的影响。相比而言,图31b表示了一种三电极单级测量的原理图。与图31a中所示类似,电流在该启动阻抗测量电极352和弥散电极354之间流通。然而,在此情况下,感测的电压是在电极353和354之间测量的。通过这样做,epi或其它与小电极352相关工件带来的影响会被降低。该系统的阻抗监测通道355也在该框部分表示出。一种模块图示表示了一种信号源356和一种启动操作放大器357。元件357可以测量353和354之间的感测电压。由于没有电流通过该导管电极353,该epi和其它干扰可以从该测量中排除,并且可以由该启动电极352和其周围组织的特性来主导该测量进程。一种经血管tsn消融和生理阻抗监测系统或可以包括如图31a所示的双电极单级结构,或图31b所示的三电极单级结构。其它文献中提及的系统结构也可以用在此以实现相同的作用效果。例如,可以通过运用四电极阻抗测量结构来达到类似的作用。所涉及到的电极可以排列在同一或不同的导管上。上述结构的组合形式的应用也可以起到相同的作用。一种系统可以包括一种基于软件逻辑的计算机控制器,可以集成多种算法,来适用于消融中呼吸信号的选通。一个呼吸循环包括吸气、呼气和呼吸之间的停顿。在吸气中,肺中逐步充气,并可能进入消融导管的消融区域,在这种情况下消融或许是不安全的。在呼气时,肺可以回收并移出该消融区域,此时传输消融能量或许是安全的。一些已知的可以实时测量肺容量的方法也可以用在此处:经胸阻抗、呼吸带测量、加速度计、呼吸气流测速计或其它方法。测量初期的校准可以包括让患者自主进行深呼吸并进行闭气。一种可以根据肺组织的运动来选通消融能量传输的计算机控制器可以进一步计算对靶标神经进行消融的热效应。运用射频当作消融能量的热治疗方法可以是功率、功率增速和能量传输时长、非能量传输时长或为避免伤及肺组织而减少时长的函数。例如,理想情况是可以运用预先设定的热能剂量,该剂量可以是组织温度和时长的函数,或者是高于体温情况下温度时间曲线的积分。热剂量的概念可以帮助在研究中更好的理解施加在生理组织上变化的热量带来的影响。该概念也有局限性,取决于加热时的情况和加热速率。可以参考试验和动物实验等可以反映能量传输一定情况范围并包括反映呼吸周期的休息期数据来进行计算。例如,传输能量可以进行0.5到10秒,相应的休息期时长在0.5到10秒范围内,来模拟呼吸周期,来理解休息期对加热血管的影响,如何实现组织坏死,并得出关系式,从而使该计算机控制器可以在传输消融能量时根据不同的呼吸情况进行应用。图22a和22b所示的实施例构想可以用来监测组织阻抗,从而判断肺组织或脏胸膜的接近程度,并或可根据安全情况来传输消融能量。该电极202可以用来传输消融射频能量,并也可以监测组织阻抗。在图32所示的另一种实施例构想中,一种tsn消融导管300包括一对以双极模式传输消融射频能量的电极301和302,以及另一个位于该双极射频电极消融区域304之外的阻抗监测电极303,来提供更加准确的阻抗测量信息,适用于肺组织探测,因为在消融期间,如果这种升温或脱水,组织阻抗会发生变化。该组织阻抗监测电极303可以与位于患者皮肤上的弥散电极形成电回路。如图所示,该导管300可以通过一条导丝306递送。为了保持消融电极301和302以及阻抗监测电极303之间的相对位置,这些电极可以制作成合适的尺寸并紧凑地分布于一条肋间静脉40内。例如,其之间可以是约3毫米。或者,如图30所示,该电极的尺寸可以小人与一条肋间静脉的内径(例如1.5到2毫米),并且该导管300的远端可以包括一种可弯曲部分305,在弯曲时,可以将电极301、302和303以一定曲线的形式排布在该血管壁上。该可弯曲部分305可以在3到5厘米长度范围内,在其最大弯曲形态下可以包括一段平缓的大半径的弯曲部分,使该弯曲部分的远端部分偏移约1厘米。在血管(例如一条肋间静脉40)内并通过导丝306引导的情况下,这样的弯曲可以将该可弯曲部分305弯向一定方向307,从而可以在消融以及阻抗电极301、302和303与该血管壁之间产生一定压力。该弯曲可以通过一种拉线来操作,该拉线从体外的导管手柄伸到该导管的内腔中。或者,一种导管可以包括位于远端处的阻抗监测电极,可以通过一个射频电极来进行单级射频消融,如图22a所示,或进行多极射频电极消融,如图20所示。图33a和33b表示了一种实施例构想,其中运用了一种血管内成像技术,可以判断从该肋间静脉40到肺65之间的距离241。在该实施例构想中的消融导管242包括一种集成超声成像传感器243或一系列传感器,来观测软组织。肺的超声影像是一片易识别的黑暗区域,因为空气避讳吸收超声能量,并且位于靠近该静脉(例如肋间静脉40)朝向该靶标神经(例如gsn45)的方向。该超声成像传感器或传感器系列243可以与一种超声成像计算机控制台以及显示器250进行电信号交流(例如通过穿过该导管套管的导电材料或电线),可以与一种计算机消融控制台251集成,在成像分析算法判断肺或脏胸膜与该消融元件245距离一定的安全距离246时,可以自动控制消融能量的传输。或者,用户可以观察该成像控制台的显示器250,来识别靠近一个胸膜隐窝的合适的血管,如图23所示,或可以评估肺组织的接近程度并仅在肺或脏胸膜处于安全距离246时传输消融能量,来避免消融导致的医源性损伤。位于该导管套管圆周区域的一系列超声成像传感器可以生成传感器系列243周围的平面244一定半径范围内(例如约1到3厘米)的组织影像,可以辅助该导管的放置,并可以无需扭转该导管来将某一侧面朝向某一方向。或者,图24a或24b所示的系统可以结合阻抗测量运用该成像信息来探测肺的接近程度,或进行呼吸作用分析以及预测,来判断肺是否与该消融元件245保持一定的安全距离,从而安全地传输消融能量而不伤及肺。例如,如图33a所示,通过该传感器系列243生成的影像平面244可以显示包裹在脏胸膜61内的肺65的轮廓,在消融以及245的消融区域247内,距离该传感器系列243的第一距离241可以表示此时传输消融能量时不安全的。如果肺65的轮廓从该消融区域移开(例如当患者呼气,闭气,或在使用一种医疗设备将空气从肺中排出时),如图中虚线所示的脏胸膜248,并且该脏胸膜距该传感器系列243更远的距离246,处于该消融区域247之外时,通过该传感器系列生成的影响可以表示此时传输消融能量是安全的。在另一个实施例构想中,该系统可以测量该静脉和肺之间的距离241或246,并且可以调节造成损伤的消融能量来避免伤及肺部。例如,该距离241或246可以通过从该超声传感器自动生成的影像来测量,并进行图像处理或对成像进行分析。例如可以通过参考已知导管的尺寸来决定图像的比例尺。其中所述的消融元件是射频,对其调节涉及到能量振幅的变化、斜率和时间。其中所述的消融元件可以用来聚焦或分散高频或低频超声波,对其调节涉及到能量振幅的变化、时间、聚焦距离或频率。在另一种实施例构想中,该系统可以指导医师引导患者进行用力的呼气。通过与消融导管结合的超声成像传感器进行的血管内成像技术可以用于确认是否将消融能量引导离开其它敏感旁路结构,例如脊椎55、胸导管57、食道56、主动脉51或横膈膜52。在进行治疗旁边的肺可以选择性地进行插管或放气,从而消除气胸的风险,但是一种复杂的操作,涉及到多种规则,并附带可以对患者造成的其它风险。胸膜二氧化碳注入术是一种已知的技术,可以应用在胸腔镜检查进程中,来帮助压缩肺薄壁组织并对胸膜下的组织进行清除,而且可以在结合患者姿势变化时当作一种回收器使用。传统的充气方法可以与基于血管的消融治疗方法结合,来保护肺部,但是这也会带来很多副作用,并且会给患者健康带来风险。图34表示了一种实施例构想,在内置一种消融导管257的一条肋间静脉40附近,消融了足够长度的组织,并且有可能接触或封闭了该静脉内的加热部分,从而可以消融经过该静脉的靶标神经45和48,该位置在接口64和肋椎关节54之间的某一范围150中。在这个实施例中,从一种导管套管255中部署出了一种四电极系统256,并向该肋间静脉内的远端方向递送了3到10厘米。如之前所示,可以将该套管255通过导丝(未显示)插入并放置,并且当该套管位于理想的血管内时(例如肋间静脉40),可以将该导丝替换成该消融导管257。或者,可以通过导丝递送导管257,并通过一种递送套管。这些电极256安装在曲线条259上,可以将电极抵在该静脉40的血管壁上,进而提高能量传输的效率并减少与靶标神经的距离。可以连续或间隔地传输能量,并且该导管电极形态可以在缓慢收回的同时沿该静脉的壁释放能量。或者,可以在回收该导管的同时以一种螺旋方式缓慢扭转该导管。该电极256可以是单级电极,以平行或序列的形式相连,或是双极电极,与单级电极相比可以更集中地造成消融损伤。在确定消融轨迹后,经过该轨迹的靶标神经(例如45和48)可以被消融。该肋间静脉40可以是通过进程中的热量和封闭技术封闭的或是直径缩减的状态。这与其它类似设计可以结合成像与阻抗监测一并应用,来确保肺组织不在该轨迹附近出现。例如棘轮和电机驱动的回收机械装置可以避免手动回收时的不连续动作。该套管255保持在原位,并且其内腔时润滑的,从而可以进一步辅助进行连续的电极回收操作。可以理解的是,表述回收的另一种方式可以是向远端递送该电极系统,而并局限于回收的动作。虽然表述过了位于曲线条259上的四个电极256,可以理解到的是,使用一个电极也可能是足够的,或者是其它组合应用的形式,例如双电极、三电极或多电极的形式。例如,在一种装置的实施例构想中,可以是四个曲线条259的结构,并在其末端是球形的电极256,如图27。该电极可以与血管壁接触,通过该血管壁向靶标神经传输消融能量。该装置上的曲线条可以具有足够的柔性,从而可以使该电极与直径为3到6毫米范围内静脉的壁接触,并可以是可扩张的。该套管255可以独立地来回移动,来对该曲线条进行压缩,将其收入该套管内,从而可以进行安全移除或在定位,这对辅助该电极组装系统在该患者静脉系统内的导航是很重要的。或者,可以在一种球囊表面安装电极(例如图12所示),来确相对该静脉壁的良好位置,并且该球囊可以安装在一种otw型导管的远端,来简化放置和回收操作。运用图34所示装置的方法的一种实施例构想包括:通过一种套管255向一条借助解剖标志(例如肋椎关节54)识别的消融轨迹150远端轮廓附近的一条肋间静脉40内递送该消融导管257;回收该套管255从而部署包括消融电极256的曲线条259;通过阻抗测量来确认消融电极与血管壁之间的接触情况;以及以恒定速率缓缓地回拉该电极组装装置,例如每秒约1毫米,同时传输消融能量来制造一种延长的损伤,或者通过短暂递进的方式制造多个定点损伤,例如多个5毫米大小的重叠损伤。在传输消融能量时,温度或阻抗的变化可以表示已完成损伤,并且可以进入回收步骤。该曲线条可以由超弹材料制成,例如镍钛诺,并可以顺应弯曲的血管壁轮廓。每一个电极表面可以有各自的温度传感器。可以在不同的静脉内对该系统进行部署、回收、移动和反复部署的操作。或者,电极可以是半圆形态的,可以更好地叠入更小的套管内。曲线条的长度可以不同,从而在它们收集到该套管内后可以收入到更小的装置内。图35是一种消融导管265的示意图,其带有的消融电极266可以与该血管(例如肋间静脉40)内不同的圆周部分接触,以及另一个电极267,可以测量组织阻抗,从而探测肺的接近程度。如图所示,两个电极266可以分别在第一纵向位置和第二纵向位置与该血管内壁的对立侧接触。或者,多个电极可以与该血管内壁不同的圆周区段接触(例如,三电极可以与2到4毫米内径的血管周壁进行110°到130°的接触,四电极可以进行80°到100°的周壁接触),或者甚至可以用一个尺寸合适的电极接触全部或大部分(例如至少60%)的周壁范围,甚至可以扩张该血管壁。位于该消融电极一定距离之外的阻抗监测电极267(例如在消融区域之外,距离该消融电极5毫米之外,在该消融电极远端约10毫米处)可以更加精准地监测阻抗,或受到更少的由消融能量传输(例如射频)或加热组织产生的干扰。这样可以得到更精准的阻抗测量值,来探测肺的接近程度。如图28所示,该消融电极266可以从该导管套管的侧面部署出来,例如,它们之间可以通过弹性元件268相连,例如预成型的镍钛诺线圈,其形状在不受递送套管269压缩的状态下,可以将该电极266从该导管套管径向向外推出。或者,该导管265可以通过导丝270递送。图36表示了一种消融导管280的另一种实施例构想,其中的电极281按照螺旋序列安装在一种弹簧282上。该螺旋结构可以从一种引导导管套管或滑动机制283中伸出或收回其中,并可以通过使用位于该导管280手柄285上的触发机制284,将其部署在该肋间静脉40中。可以将电流以单级或多极的形式同时,或以单级的形式以一定的顺序施加在多个电极中,来对该肋间静脉的一段长度进行消融。如果需要,可以将该导管进行快速多次的再定位,来制造密实的损伤。图37是一种消融导管290的一种实施例构想,在不知道神经确切的位置时,可以在一条静脉内靶标消融区域的一段范围内进行一定长度的消融(例如2.5到5厘米范围内,3到5厘米范围内,3到4厘米范围内,约3厘米),包括使用一种治疗超声消融元件291。该导管290的远端部分可以通过导丝292递送到一条理想的血管内(例如肋间静脉40),并可以向远端递送进入该血管。之后可以用流体(例如纯净水、溶液)来填充一种球囊293。该球囊293包含的流体可以保持该治疗元件的工作稳定,并也可以提供从该超声消融元件291向该血管壁以及之外的靶标组织传输超声能量的固定介质。该治疗超声传感器291可以是高频、低频、扁平、凹或凸形的,坐落于一条独立的轨道294上,可以使其在该球囊长度范围内来回滑移,从而可以在整个该范围150上进行简易而快速的消融,而并不需要移动整个导管,而且也需要对该球囊进行填充或排泄,以便重新定位。医师可以通过手柄中的一种触发器或通过一种自动控制电机运载装置回收该超声传感器。或者,该导管291可以利用此处表示的阻抗监测器295来探测肺组织的接近程度。尽管本文公开了本发明的至少一个示例性实施例,但应了解任何对其中内容的修改、替换以及替代,对于本领域的技术人员是显而易见的,并且可以在不超越本发明范围下进行。图式中所描述并说明的每个实施例也许使用了重复的元件符号示出,但应了解的是每个实施例可以看作是彼此独立的。本公开发明意图涵盖示例性实施例的任何修改或变化的实施例。另外,在本发明中,术语“包含(comprise/comprising)”并非不包括其它要素或步骤,术语“一(a/one)”并非不包括复数个数目,并且术语“或”的意思是任一者或两者都。此外,除非本发明或上下文另外说明,本发明已描述的特征或步骤也可以与其它特征或步骤组合,并以任何次序使用出现。本说明书将其宣称优先权权益的专利或申请的全部公开内容通过引用结合于此。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1