作为肽类GLP1/胰高血糖素/GIP受体激动剂的新化合物的制作方法
本发明涉及作为glp-1/胰高血糖素/gip受体三重激动剂的新的化合物和它们的用途,例如,在代谢综合征的病症包括糖尿病和肥胖症治疗中的用途,以及用于减少过量食物摄取。本发明的化合物在结构上衍生自毒蜥外泌肽-4并且在抗微生物防腐剂如间甲酚或苯酚存在下在酸性条件下显示出高溶解度和稳定性,这使它们尤其适用于与其他抗糖尿病化合物组合。
发明背景
bhat等(diabetologia2013,56,1417–1424),bhat等(biochempharmacol.2013,85,1655-62),gault等(jbiolchem.2013,288,35581-91)以及finan等(natmed.2015,21,27-36)描述了胰高血糖素样肽-1(glp-1)、胰高血糖素和葡萄糖依赖性促胰岛素多肽(gip)受体的三重激动剂,例如通过在一个分子中组合glp-1、胰高血糖素和gip的作用,这导致具有抗糖尿病作用的治疗原则和比纯glp-1激动剂更卓越的显著的减重效果,除了其它原因,这是由于胰高血糖素受体介导的增加的饱腹感和能量消耗以及gip受体介导的增加的胰岛素分泌。
glp-1(7-36)-酰胺的氨基酸序列如seqidno:1所示。
haegtftsdvssylegqaakefiawlvkgr-nh2
利拉鲁肽是一种上市的经化学修饰的glp-1类似物,其中除了其他修饰之外,将一脂肪酸与位置20中的赖氨酸连接,导致延长的作用持续时间(drucker等,nat.rev.drugdisc.2010,9,267-268;buse等.,lancet2009,374,39-47)。
利拉鲁肽的氨基酸序列如seqidno:2所示。
haegtftsdvssylegqaak((s)-4-羧基-4-十六烷酰基氨基-丁酰基)efiawlvrgrg-oh
胰高血糖素是29个氨基酸的肽,其在循环葡萄糖低时被释放至血流中。胰高血糖素的氨基酸序列如seqidno:3所示。
hsqgtftsdyskyldsrraqdfvqwlmnt-oh
在低血糖其间,当血糖水平跌至正常以下时,胰高血糖素向肝脏发出信号以分解糖原并释放葡萄糖,引起血糖水平升高达到正常水平。最近的出版物提出胰高血糖素此外还对降低体脂质量、减少食物摄取和增加能量消耗具有有益效果(heppner等,physiology&behavior2010,100,545–548)。
gip(葡萄糖依赖性促胰岛素多肽)是42个氨基酸的肽,其在食物摄取之后从小肠k细胞释放。gip和glp-1是两种肠内分泌细胞衍生的激素,引起肠促胰岛素(incretin)作用,其占到响应口服葡萄糖挑战的胰岛素的超过70%(baggio等gastroenterology2007,132,2131–2157)。
gip的氨基酸序列如seqidno:5所示。
yaegtfisdysiamdkihqqdfvnwllaqkgkkndwkhnitq-oh
基于glp-1或胰高血糖素的结构并结合和激活glp-1、胰高血糖素和gip受体的肽已经记载在专利申请wo2010/011439,wo2010/148089,wo2012/088116,wo2013/192129,wo2013/192130,wo2014/049610和wo2015/067716中。基于毒蜥外泌肽-4的其他三特异性激动剂已经记载在wo2014/096145,wo2015/086731,wo2015/086732,wo2015/086733,wo2015/155141,和pct/ep2016/063332中。此处描述的化合物已经被证明导致改善的血糖控制、可能的胰岛和β-细胞保存和增加的体重损失。
作为毒蜥外泌肽-4的类似物设计并用脂肪酸侧链取代的结合并激活gip和glp-1受体二者的肽记载在专利申请wo2014/096145a1,wo2014/096150a1,wo2014/096149a1,和wo2014/096148a1中。
毒蜥外泌肽-4是39个氨基酸的肽,其通过毒蜥(gilamonster)(钝尾毒蜥(helodermasuspectum))的唾液腺产生。毒蜥外泌肽-4是glp-1受体的激活剂,而其对gip受体显示较低的活化并且不激活胰高血糖素受体(参见表1)。
表1:在逐渐增加的浓度下并如方法中所述测量形成的camp得到的毒蜥外泌肽-4对人glp-1、gip和胰高血糖素受体的效力(以pm表示)
毒蜥外泌肽-4的氨基酸序列如seqidno:4所示。
hgegtftsdlskqmeeeavrlfiewlknggpssgappps-nh2
毒蜥外泌肽-4共享许多用glp-1观察到的糖调节作用。临床和非临床研究已经显示毒蜥外泌肽-4具有多种有益的抗糖尿病性质,包括葡萄糖依赖性胰岛素合成和分泌的提高、葡萄糖依赖性胰高血糖素分泌抑制、减缓胃排空、减少食物摄取和体重,以及增加β-细胞质量和β-细胞功能的标志物。
这些作用可能不仅对糖尿病有益,还对患有肥胖症的患者有益。肥胖症的患者具有更高的患上糖尿病、高血压、高脂血症、心血管和肌肉骨骼疾病的风险。
相对于glp-1,毒蜥外泌肽-4对二肽基肽酶-4(dpp4)的切割有抗性,导致在体内更长的半衰期和作用持续时间(engj.,diabetes,1996,45(suppl2):152a(abstract554))。
毒蜥外泌肽-4还被证明在与glp-1、胰高血糖素或泌酸调节素相比时对中性内肽酶(nep)的降解稳定得多(druce等.,endocrinology,2009,150(4),1712-1722)。然而,毒蜥外泌肽-4在化学上不稳定,这是由于位置14的甲硫氨酸氧化(hargrove等.,regul.pept.,2007,141,113-119)以及位置28的天冬酰胺的脱酰胺化和异构作用(wo2004/035623)。
bloom等(wo2006/134340)公开了结合并激活胰高血糖素和glp-1受体二者的肽能够被构建成来自胰高血糖素和毒蜥外泌肽-4的杂合分子,其中n-末端部分(例如残基1-14或1-24)源自胰高血糖素,而c-末端部分(例如残基15-39或25-39)源自毒蜥外泌肽-4。这些肽在位置10-13包含胰高血糖素的氨基酸基序ysky。krstenansky等(biochemistry,1986,25,3833-3839)显示了胰高血糖素的这些残基10-13对其受体相互作用和腺苷酸环化酶激活的重要性。
与glp-1、胰高血糖素和泌酸调节素相比,毒蜥外泌肽-4具有有益的理化性质,如在溶液中和在生理条件下的溶解度和稳定性(包括对于酶如dpp4或nep的降解的酶稳定性),这导致在体内更长的作用持续时间。
尽管如此,毒蜥外泌肽-4也被证明在化学上不稳定,这是因为在位置14的甲硫氨酸氧化以及在位置28的天冬酰胺的去酰胺化和异构作用。稳定性可通过取代位置14的甲硫氨酸和避免已知有藉由天冬酰亚胺形成特别是位置28和29处的asp-gly或asn-gly而降解的倾向的序列来改善。
技术实现要素:
在本发明的化合物中,一些基础残基(underlyingresidue)不同于胰高血糖素和wo2006/134340中描述的肽。具体而言胰高血糖素的残基tyr10和tyr13已知促成了原纤维化(fibrillation)(jspedersen等.,biochemistry,2006,45,14503-14512),将其由leu替代。这种替代,特别是与位置23的异亮氨酸和位置24的谷氨酸组合,导致毒蜥外泌肽-4衍生物具有潜在改善的生物物理性质如在溶液中的溶解度或聚集表现。在毒蜥外泌肽-4类似物的位置13中用脂肪族氨基酸对芳族氨基酸进行的非保守替代导致肽具有对胰高血糖素和gip受体二者的高活性,保持它们对glp-1受体的活性。
天然毒蜥外泌肽-4是一种纯glp-1受体激动剂,对胰高血糖素受体不具备活性,并对gip受体具有低活性。本发明的化合物基于天然毒蜥外泌肽-4的结构,但是与seqidno:4相比在十四个或更多个位置处不同,其中所述不同促成对胰高血糖素受体和gip受体的激动活性提高。除了其他取代之外,位置14的甲硫氨酸由侧链中携带–nh2基团的氨基酸替代,其进一步由亲脂残基取代(例如与接头组合的脂肪酸)取代。进一步的,在位置13,19,20,32,34,35和39处对毒蜥外泌肽-4氨基酸进行取代,在位置13用leu,在位置19用gln,在位置20用aib或lys氨基酸,在位置34用aib,在位置32用pro,并在位置35和39用lys,导致对胰高血糖素以及gip受体二者的高活性,同时保持对gip-1受体的高活性。这些肽还显示出在酸性ph值下如ph4.5下的高化学稳定性、溶解度和物理稳定性。
本发明的化合物具有式i,或其盐或溶剂合物:
h2n-his-aib-gln-gly-thr-phe-thr-ser-asp-leu-ser-lys-leu-x14-glu-x16-gln-arg-gln-aib-glu-phe-ile-glu-trp-leu-lys-ala-x29-gly-x31-pro-ser-aib-lys-pro-pro-pro-lys-r1i
其中
x14代表具有官能化的-nh2侧链基团的氨基酸残基,其选自由lys、orn、dab或dap组成的组,其中所述-nh2侧链基团是由-z-c(o)-r5官能化的,其中
z在全部立体异构形式中代表接头,并且
r5是包含多至50个碳原子和选自n和o的杂原子的部分,
x16代表选自lys和glu的氨基酸残基,
x29代表选自d-ala和gly的氨基酸残基,
x31代表选自his和pro的氨基酸残基,
r1是nh2或oh。
本发明的化合物是glp-1,胰高血糖素和gip受体激动剂,如通过在方法中描述的测定体系中观察到它们能够刺激胞内camp形成所确定的。
根据本发明的化合物的另一实施方案,本发明的化合物,特别是在位置14具有进一步用亲脂残基取代的赖氨酸,与glp-1(7-36)酰胺对glp-1受体的相比展现出至少0.1%(即ec50<700pm),更优选1%(即ec50<70pm),更优选5%(即ec50<14pm),并且甚至更优选10%(即ec50<7pm)的相对活性。另外,本发明的化合物与天然胰高血糖素对胰高血糖素受体的相比展现出至少0.1%(即ec50<500pm),更优选0.25%(即ec50<200pm),更优选0,4%(<125pm)并且甚至更优选1%(即ec50<50pm)的相对活性。另外,本发明的化合物与天然gip对gip受体的相比展现出至少0.1%(即ec50<400pm),更优选0.4%(即ec50<100pm),更优选1%(<40pm)并且甚至更优选2%(即ec50<20pm)的相对活性。
术语“活性”如用于本文优选指化合物激活人glp-1受体、人胰高血糖素受体和人gip受体的能力。更优选地,术语“活性”如用于本文指化合物刺激胞内camp形成的能力。术语“相对活性”如用于本文被理解为指化合物与另一受体激动剂相比或与另一受体相比以某种比例激活某个受体的能力。激动剂对受体的激活(例如通过测量camp水平)如本文所述测定,例如如实施例中所述。
本发明的化合物优选对于hglp-1受体具有450pm或更低,优选200pm或更低,更优选100pm或更低,更优选50pm或更低,更优选25pm或更低,更优选10pm或更低,更优选8pm或更低,并且更优选5pm或更低的ec50,并且对于h胰高血糖素受体具有450pm或更低,优选200pm或更低,更优选100pm或更低,更优选50pm或更低的ec50,并且对于hgip受体具有450pm或更低,优选200pm或更低,更优选100pm或更低,更优选50pm或更低,更优选25pm或更低的ec50。对于hglp-1受体,h胰高血糖素受体和hgip受体的ec50可以如本文方法中所述来测定,并且用于生成实施例中描述的结果。
式i的化合物,特别是在位置14具有进一步用亲脂残基取代的赖氨酸的那些,显示了与在位置14具有原始甲硫氨酸(来自毒蜥外泌肽-4)或亮氨酸的衍生物(还参见wo2014/056872)相比增加的胰高血糖素受体激活。另外,不再可能有甲硫氨酸的(体外或体内)氧化。
式i的化合物不仅显示出对胰高血糖素受体还同样对gip受体显示出高活性。对gip受体的额外的高活性旨在用于与纯glp-1受体激动相比对血糖控制的提高效力,以及降低glp-1相关的副作用的可能性,如胃肠不适,因为glp-1部分的贡献可以被降低。额外的gip受体活性也意图用于抗衡因为胰高血糖素受体激活产生的潜在的葡萄糖增加,因此允许更高的胰高血糖素受体活性,如在式i化合物中观察到的(finan等natmed.2015,21,27-36)。
在一个实施方案中,本发明的化合物在酸性和/或生理ph值下在抗微生物防腐剂如苯酚或间甲酚存在下,例如在酸度范围ph4至5,特别是ph4.5和/或ph6至8的更生理性范围,特别是ph7.4处于25℃或40℃,具有高溶解度,在另一实施方案中至少为1mg/ml,并且在特定实施方案中至少为5mg/ml。
另外,本发明的化合物优选当储存在溶液中时在抗微生物防腐剂如苯酚或间甲酚存在下具有高稳定性。用于测定稳定性的优选测定条件是在25℃或40℃在酸度范围ph4至5,特别是ph4.5的溶液中储存28天。肽的稳定性通过方法中的色谱分析测定。优选地,在40℃在ph4.5的溶液中28天之后,纯度损失不超过20%,更优选不超过15%,更优选不超过12%并且甚至更优选不超过10%。
在一个实施方案中,本发明的化合物在≥1mg/ml的浓度下,在抗微生物防腐剂如苯酚或间甲酚存在下,例如,在ph4至5的酸性范围在25℃,特别是ph4.5在25℃,显示出5nm或更小的流体动力学半径rh,如通过方法中描述的动态光散射测定的。
在一个实施方案中,本发明的化合物使用硫黄素t作为荧光探针在3mg/ml的浓度下,在抗微生物防腐剂如苯酚或间甲酚存在下,例如,在ph4至5的酸性范围,特别是ph4.5在37℃超过5小时,更优选超过10小时,更优选超过20小时,更优选超过30小时,更优选超过40小时并且甚至更优选超过45小时,不显示荧光强度的增加,如通过方法中描述的tht测定所测定的。
在一个实施方案中,本发明的化合物对中性内肽酶(nep)和二肽基肽酶-4(dpp4)的切割更具抗性,导致当与天然glp-1和胰高血糖素相比时在体内更长的半衰期和作用持续时间。
在一个实施方案中,本发明的化合物包含肽部分,其为39个氨基羧酸(具体来说是通过肽即甲酰胺键连接的α-氨基羧酸)的线性序列。
在一个实施方案中,r1为nh2。
-z-c(o)-r5基团的具体的优选实例列于下表2,其选自
(s)-4-羧基-4-十六烷酰基氨基-丁酰基-,(s)-4-羧基-4-十八烷酰基氨基-丁酰基-,(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基,(4s)-羧基-[2-(2-{2-[(4r)-5-羧基-4-十六烷酰基氨基-戊酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-丁酰基,(4s)-羧基-[2-(2-{2-[(4r)-5-羧基-4-十六烷酰基氨基-戊酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-丁酰基,(2-{2-[2-(2-{2-[(4s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基,(2-{2-[2-(2-{2-[(4s)-4-羧基-4-十八烷酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基,[2-(2-{2-[2-(2-{2-[2-(2-十八烷酰基氨基-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基-。
其他优选的是立体异构体,特别是这些基团的对映异构体,或者为s-或者为r-对映异构体。表2中的术语“r”旨在意指肽骨架中-z-c(o)-r5的附接位点,例如lys的ε-氨基。
表2
进一步的实施方案涉及式i的化合物,其中
x14代表lys,其中所述-nh2侧链基团用-z-c(o)r5基团官能化,其中
z代表选自gglu,gglu-gglu,gglu-aeeac-gaaa-,gglu-gglu-aeeac,aeeac-aeeac-gglu和aeeac-aeeac-aeeac的基团;并且
r5代表选自十五烷基或十七烷基的基团。
进一步的实施方案涉及式i的化合物,其中
x14代表lys,其中所述-nh2侧链基团用-z-c(o)r5基团官能化,其中
z代表选自gglu,gglu-gglu,gglu-aeeac-gaaa-和gglu-gglu-aeeac;并且
r5代表选自十五烷基或十七烷基的基团。
进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团用(s)-4-羧基-4-十六烷酰基氨基-丁酰基-,(s)-4-羧基-4-十八烷酰基氨基-丁酰基-,(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-,(2-{2-[2-(2-{2-[(4s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基,(2-{2-[2-(2-{2-[(4s)-4-羧基-4-十八烷酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基,[2-(2-{2-[2-(2-{2-[2-(2-十八烷酰基氨基-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基氨基}-乙氧基)-乙氧基]-乙酰基-官能化,
r1代表nh2。
进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团用(s)-4-羧基-4-十六烷酰基氨基-丁酰基-,(s)-4-羧基-4-十八烷酰基氨基-丁酰基-,(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-,(2-{2-[2-(2-{2-[(4s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基,(2-{2-[2-(2-{2-[(4s)-4-羧基-4-十八烷酰基氨基-丁酰基氨基]-乙氧基}-乙氧基)-乙酰基氨基]-乙氧基}-乙氧基)-乙酰基官能化,
r1代表nh2。
进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-官能化,
x16代表选自glu和lys的氨基酸残基,
x29代表选自d-ala和gly的氨基酸残基,
x31代表选自his和pro的氨基酸残基,
r1代表nh2。
进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-官能化,
x16代表选自glu和lys的氨基酸残基,
x29代表gly,
x31代表选自his和pro的氨基酸残基,
r1代表nh2。
进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团通过(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-,(s)-4-羧基-4-十八烷酰基氨基-丁酰基-官能化,
x16代表glu,
x29代表选自d-ala和gly的氨基酸残基,
x31代表his,
r1代表nh2。
进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-,(s)-4-羧基-4-十八烷酰基氨基-丁酰基-官能化,
x16代表glu,
x29代表gly,
x31代表选自his和pro的氨基酸残基,
r1代表nh2。
进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-,(s)-4-羧基-4-十八烷酰基氨基-丁酰基-官能化,
x16代表lys,
x29代表选自d-ala和gly的氨基酸残基,
x31代表选自his和pro的氨基酸残基,
r1代表nh2。
进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-,(s)-4-羧基-4-十八烷酰基氨基-丁酰基-官能化,
x16代表选自glu和lys的氨基酸残基,
x29代表选自d-ala和gly的氨基酸残基,
x31代表pro,
r1代表nh2。
进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-,(s)-4-羧基-4-十八烷酰基氨基-丁酰基-官能化,
x16代表lys,
x29代表选自d-ala和gly的氨基酸残基,
x31代表pro,
r1代表nh2。
更进一步的实施方案涉及式i的化合物,或其盐或溶剂合物,其中
x14代表lys,其中所述-nh2侧链基团用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-官能化,
x16代表lys,
x29代表d-ala,
x31代表选自his和pro的氨基酸残基,
r1代表nh2。
式i化合物的具体实例是seqidno:6-23的化合物,以及其盐或溶剂合物。
式i化合物的具体实例是seqidno:6,9和11的化合物,以及其盐或溶剂合物。
式i化合物的具体实例是seqidno:6的化合物,以及其盐或溶剂合物。
式i化合物的具体实例是seqidno:9的化合物,以及其盐或溶剂合物。
式i肽化合物的具体实例是seqidno:11的化合物,以及其盐或溶剂合物。
在更进一步的方面,本发明涉及包含与载体混合的本发明的化合物的组合物。在优选的实施方案中,所述组合物是可药用组合物,并且所述载体是可药用载体。本发明的化合物可以是盐的形式,例如可药用盐或溶剂合物,例如水合物。在更进一步的实施方案中,本发明涉及组合物,其用于医学治疗方法中,特别是在人用医药(humanmedicine)中。
式i的化合物适用于在没有额外治疗有效剂的情况下用于人的治疗。然而,在其他实施方案中,所述化合物可以与至少一种额外的治疗活性剂一起使用,如“联合疗法”中所述。
式i的化合物特别适用于治疗或预防因糖和/或脂质代谢紊乱导致的、与糖和/或脂质代谢紊乱相关的和/或伴有糖和/或脂质代谢紊乱的疾病或病症,例如用于治疗或预防高血糖症,2型糖尿病,葡萄糖耐量降低,1型糖尿病,肥胖症和代谢综合征。此外,本发明的化合物可适用于治疗或预防退行性疾病,特别是神经退行性疾病。
描述的化合物可用于预防体重增加或促进体重损失等方面。“预防”意指当与不存在治疗时相比的抑制或降低,并且不必然意图暗示疾病的完全停止。
本发明的化合物可以引起食物摄取的减少和/或能量消耗的增加,导致观察到的对体重的作用。
独立于它们对体重的作用,本发明的化合物可能对循环胆固醇水平具有有益效果,能够改善脂质水平,特别是ldl,以及hdl水平(例如增加hdl/ldl比例)。
因此,本发明的化合物可用于由多余体重引起的或表征的任何状况的直接或间接治疗,如治疗和/或预防肥胖症,病态肥胖症,肥胖症相关炎症,肥胖症相关胆囊疾病,肥胖症引起的睡眠呼吸暂停。它们还可以用于治疗和预防代谢综合征,糖尿病,高血压,致动脉粥样硬化性血脂异常,动脉粥样硬化,动脉硬化,冠心病或中风。它们在这些状况中的效果可能是它们对体重的效果的结果或与之相关,或者可能与其是独立的。
医学用途包括延缓或预防2型糖尿病的疾病进展,治疗代谢综合征,治疗肥胖症或预防超重,减少食物摄取,增加能量消耗,降低体重,延缓葡萄糖耐量受损(igt)向2型糖尿病的进展;延缓2型糖尿病向胰岛素需求性糖尿病的进展;和肝脂肪变性。
定义
本发明的氨基酸序列含有常规的用于天然存在的氨基酸单字母和三字母编码,以及普遍接受的用于其他氨基酸的三字母编号,如aib(α-氨基异丁酸)。
术语“天然毒蜥外泌肽-4”指具有序列hgegtftsdlskqmeeeavrlfiewlknggpssgappps-nh2(seqidno:4)的天然毒蜥外泌肽-4。
本发明涉及式i定义的肽化合物。
本发明的化合物包含通过肽即甲酰胺键连接的氨基羧酸线性骨架。优选地,氨基羧酸是α-氨基羧酸,并且更优选l-α-氨基羧酸,除非另行定义。所述肽化合物优选包含39个氨基羧酸的骨架序列。
肽部分(式i)内的氨基酸可以被认为是以常规的n-末端至c-末端方向从1至39连续编号。对肽部分i内“位置”的提述应当被相应地理解,就如应当提及天然毒蜥外泌肽-4和其他分子内的位置时一样,例如,在毒蜥外泌肽-4中,his在位置1,gly在位置2,……,met在位置14,……并且ser在位置39。
具有-nh2侧链基团的氨基酸残基,例如lys,orn,dab或dap,是官能化的,其中所述-nh2侧链基团的至少一个h原子被-z-c(o)-r5替代,其中r5包含亲脂部分,例如无环直链或支链(c8-c30)饱和或不饱和烃基,其为未取代的或取代的,例如,由卤素(f,cl,br,j),-oh和/或co2h取代,并且z在全部立体异构形式中包含接头,例如包含一个或多个接头,例如1至5个,优选1、2或3个氨基酸接头基团,所述氨基酸接头基团选自基团γ-谷氨酸(gglu),gaaa和aeeac。优选的基团r5包含亲脂部分,例如非环状直链或支链(c12-c20)饱和或不饱和烃基,例如十五烷基,十六烷基或十七烷基,其未被取代或被co2h取代,更优选十五烷基或十七烷基。在一个实施方案中,氨基酸接头基团选自gglu,gglu-gglu,gglu-gglu-aeeac,gglu-aeeac-gaaa,aeeac-aeeac-gglu和aeeac-aeeac-aeeac。在另一实施方案中,氨基酸接头基团是gglu。在另一实施方案中所述氨基酸接头基团是gglu-gglu。在另一实施方案中所述氨基酸接头基团是gglu-gglu-aeeac。在另一实施方案中所述氨基酸接头基团是gglu-aeeac-gaaa。在另一实施方案中所述氨基酸接头基团是aeeac-aeeac-gglu。在另一实施方案中所述氨基酸接头基团是aeeac-aeeac-aeeac。
在进一步的方面,本发明涉及包含与载体混合的、如本文所述的本发明化合物或其盐或溶剂合物的组合物。
本发明还涉及使用本发明的化合物用作药物,特别是用于治疗本说明书所述的状况。
本发明还涉及组合物,其中所述组合物是可药用组合物,并且所述载体是可药用载体。
肽合成
本领域技术人员知晓多种制备肽的不同方法。这些方法包括但不限于合成方法和重组基因表达。因此,一种制备这些肽的方法是在溶液中或在固体支持物上合成,以及后续的分离和纯化。不同的制备肽的方法是在已经引入了编码肽的dna序列的宿主细胞中进行基因表达。或者,基因表达能够在不利用细胞系统的情况下实现。上述方法也可以以任何方式组合。
优选的制备本发明化合物的方法是在合适的树脂上的固相合成。固相肽合成是充分确立的方法学(参见例如:stewartandyoung,solidphasepeptidesynthesis,piercechemicalco.,rockford,ill.,1984;e.athertonandr.c.sheppard,solidphasepeptidesynthesis.apracticalapproach,oxford-irlpress,newyork,1989)。固相合成通过将n-末端受到保护的氨基酸的羧基末端附接到携带可切割接头的惰性固相支持物上来起始。这种固相支持物可以是任何允许初始氨基酸偶联的聚合物,例如三苯甲基树脂,氯三苯甲基树脂,wang树脂或rink树脂,其中羧基基团(或就rink树脂而言为甲酰胺)与树脂的连接对酸敏感(当使用fmoc策略时)。所述聚合物支持物在肽合成期间在用于脱保护α-氨基基团的条件下必需是稳定的。
在将n-末端受到保护的第一个氨基酸偶联至所述固相支持物之后,将这个氨基酸的α-氨基保护基团去除。然后将剩余的受保护的氨基酸一个接一个或与预先形成的二肽、三肽或四肽按照肽序列呈现的顺序使用适当的酰胺偶联试剂偶联起来,所述酰胺偶联试剂例如bop,hbtu,hatu或dic(n,n'-二异丙基碳二亚胺)/hobt(1-羟基苯丙三唑),其中bop,hbtu和hatu与叔胺碱一起使用。或者,释放的n-末端可以用氨基酸之外的基团官能化,例如羧酸等。
通常,将氨基酸的反应性侧链基团用合适的封闭基团保护。这些保护基团在组装好期望的肽之后被去除。他们伴随着在相同条件下从树脂切割期望的产品而被去除。保护基团和引入保护基团的流程可以在protectivegroupsinorganicsynthesis,3ded.,greene,t.w.andwuts,p.g.m.,wiley&sons(newyork:1999)中找到。
在一些情况下,具有能够被选择性去除的侧链保护基团同时保持其他侧链保护基团完整可能是理想的。在这种情况下,释放的官能性可以被选择性官能化。例如,赖氨酸可以用ivdde([1-(4,4-二甲基-2,6-二氧代环亚己-1-基)-3-甲基丁基)保护基(s.r.chhabra等.,tetrahedronlett.39,(1998),1603)保护,其对非常亲核碱基而言不稳定,例如dmf(二甲基甲酰胺)中的4%肼不稳定。因此,如果n-末端氨基基团和全部侧链官能性受到酸不稳定性保护集团的保护,那么ivdde基团可以使用dmf中的4%肼选择性地去除,然后可以进一步修饰(例如通过酰化)相应的游离氨基基团。或者,可以将赖氨酸与受保护的氨基酸偶联,然后将这个氨基酸的氨基基团去保护,产生另一个游离的氨基基团,其可以被酰基化或附接至其他氨基酸。或者,在肽合成中侧链(如表2中所述)可以与赖氨酸一起引入,使用预先官能化的构建模块(buildingblock),例如(2s)-6-[[(4s)-5-叔丁氧基-4-[[(4s)-5-叔丁氧基-4-(十六烷酰基氨基)-5-氧代-戊酰基]氨基]-5-氧代-戊酰基]氨基]-2-(9h-9-芴甲氧羰基氨基)己酸作为偶联配偶体。
最后,将肽从树脂切下。这可以使用king氏鸡尾酒混合物(d.s.king,c.g.fields,g.b.fields,int.j.peptideproteinres.36,1990,255-266)实现。如有必要的话,随后可以通过色谱例如预制rp-hplc进行纯化。
效力
如本文所述,术语“效力”或“体内效力”是在基于细胞的测定中化合物激活针对glp-1,胰高血糖素或gip的受体的能力的量度。在数值上,其表示为“ec50值”,其为在剂量响应实验中化合物引起最大响应增加值(例如胞内camp的形成)的一半的有效浓度。
治疗用途
代谢综合征是一种医学病症的组合,当所述医学病症一起发生时,增加了形成2型糖尿病,以及动脉粥样硬化性血管病,如心脏病和中风的风险。针对代谢综合征定义的医学参数包括糖尿病、葡萄糖耐量受损、升高的空腹葡萄糖、胰岛素抗性、尿白蛋白分泌、中央肥胖、高血压、升高的甘油三酯、升高的ldl胆固醇和降低的hdl胆固醇。
肥胖是一种医学状况,其中过多的身体脂肪积累到了其可能对健康和预期寿命有负面影响的程度,并且由于其在成年人和儿童逐渐升高的流行程度,其已经成为现代世界中重要的可预防死亡原因之一。其增加了多种其他疾病的可能性,包括心脏病、2型糖尿病、阻塞性睡眠呼吸暂停、某些类型的癌症以及骨关节炎,并且其最经常由过量食物摄取、降低的能量消耗以及遗传易感性的组合引起。
糖尿病(diabetesmellitus),通常简称为糖尿病(diabetes),是其中的人具有高血糖水平的一组代谢疾病,其或者是因为身体无法产生足够的胰岛素,或者是因为细胞对产生的胰岛素不应答。最常见的糖尿病类型是:(1)1型糖尿病,其中身体无法产生胰岛素;(2)2型糖尿病(t2dm),其中身体无法正确利用胰岛素,随着时间伴有胰岛素缺乏的增加,和(3)妊娠糖尿病,其中女性因为她们怀孕而形成糖尿病。糖尿病的全部形式都增加了长期并发症的风险,其通常在数年之后形成。这些长期并发症中的大多数基于血管损伤,并且能够分成两类,由较大血管的动脉粥样硬化引起的“大血管”病,和由小血管损伤引起的“微血管”病。大血管病状况的实例是缺血性心脏病、心肌梗死、中风和外周血管疾病。微血管病的实例是糖尿病性视网膜病、糖尿病性肾病以及糖尿病性神经病。
glp-1和gip以及胰高血糖素的受体是7-跨膜、异三聚体g蛋白偶联受体家族的成员。他们在结构上彼此相关并且不仅享有显著的序列同一性水平,还具有相似的配体识别机制和胞内信号传导途径。
类似地,肽glp-1,gip和胰高血糖素享有高序列同一性/相似性的区域。glp-1和胰高血糖素产生自共同的前体,前原胰高血糖素,其以一种组织特异性方式得到区别性加工以产生例如肠内分泌细胞中的glp-1和胰岛α-细胞中的胰高血糖素。gip源自较大的原gip激素原前体,并且从位于小肠中的k-细胞合成并释放。
肽类肠促胰岛素激素glp-1和gip由小肠内分泌细胞响应于食物分泌,并且占到餐食刺激的胰岛素分泌的高达70%。有证据提示glp-1分泌在葡萄糖耐量受损或2型糖尿病受试者中降低,而对glp-1的响应在这些患者中仍然得到了保留。因此,用合适的激动剂靶向glp-1受体为代谢病症包括糖尿病的治疗提供了一种有吸引力的方式。glp-1的受体分布广泛,主要发现于胰岛、脑、心脏、肾和胃肠道中。在胰脏中,glp-1以一种严格的葡萄糖依赖性方式通过增加胰岛素从β细胞的分泌发挥作用。这种葡萄糖依赖性证明了glp-1受体的激活不太可能导致低血糖。gip的受体也在外周组织包括胰岛,脂肪组织,胃,小肠,心脏,骨,肺,肾,睾丸,肾上腺皮质,垂体,内皮细胞,气管,脾,胸腺,甲状腺和脑中广泛表达。与其作为肠促胰岛素激素的生物学功能一致的是,胰脏β细胞在人体中表达最高水平的gip受体。
存在一些临床证据显示gip-受体介导的信号传导可能在患有t2dm的患者中受损,然而gip-作用的受损被证明是可逆的,并且可以随着糖尿病状态的改善而重建。值得注意的是,通过肠促胰岛素激素gip和glp-1二者对胰岛素分泌的刺激严格呈葡萄糖依赖性,确保了与低血糖的低风险相关的故障安全机制(afail-safemechanism)。
在β细胞水平,glp-1和gip被证明促进了葡萄糖敏感,新生,增殖,胰岛素原转录和肥大,以及抗凋亡。可以预见同时具有对glp-1和gip受体的激动活性的肽具有加合性或协同性抗胰岛素效益。glp-1在胰腺之外的其他相关效果包括延缓胃排空,增加饱腹感,减少食物摄取,减轻体重,以及神经保护和心脏保护作用。在患有2型糖尿病的患者中,考虑到高比例的并发症如肥胖症和心血管疾病,这些胰腺之外的效果可能尤其重要。外周组织中超出胰腺之外的其他gip作用包括增加的骨形成和减少的骨吸收以及神经保护作用,其可能对治疗骨质疏松和认知缺陷如阿尔茨海默病有益。
胰高血糖素是一种29个氨基酸的肽激素,其通过胰腺α细胞产生并在循环胰岛素较低时释放至血流中。胰高血糖素的一个重要生理学功能是刺激肝脏中的葡萄糖产出,其是在维持体内葡萄糖稳态方面提供针对胰岛素的主要反调节机制的过程。
然而,胰高血糖素受体也在肝脏外的组织如肾,心脏,脂肪细胞,成淋巴细胞,脑,视网膜,肾上腺和胃肠道中表达,提示除了葡萄糖稳态之外更广泛的生理学功能。因此,最近的研究报道了胰高血糖素对能量管理具有治疗上的正面作用,包括刺激能量消耗和热量产生,伴有食物摄取的减少和体重损失。总而言之,刺激胰高血糖素受体可能在治疗肥胖症和代谢综合征中是有用的。
泌酸调节素是一种肽激素,由胰高血糖素和包含c-末端延伸的八个氨基酸组成。像glp-1和胰高血糖素一样,其作为前原胰高血糖素预先形成,并且以组织特异性的方式通过小肠中的内分泌细胞切割和分泌。已知泌酸调节素刺激glp-1和胰高血糖素受体二者,并且因此是双重激动剂的原型(参见pocai,molecularmetabolism2013;3:241-51)。
像glp-1和gip的抗糖尿病作用为人所知一样,glp-1和胰高血糖素二者都因其抑制食物摄取的作用为人所知,胰高血糖素还是额外能量消耗的调节剂,可以想见将三种激素的活性组合到一个分子中能够生成一种强力的药物用于治疗代谢综合征并且特别是其组成部分糖尿病和肥胖症。
因此,本发明的化合物可以用于治疗葡萄糖不耐受,胰岛素抵抗,前驱糖尿病,空腹葡萄糖增加(高血糖),2型糖尿病,高血压,血脂异常,动脉硬化,冠心病,外周动脉疾病,中风或这些单独疾病组分的任何组合。
此外,它们可以用于控制食欲,进食和卡路里摄入,增加能量消耗,预防体重增加,促进体重损失,减少过度体重以及综合起来治疗肥胖,包括病态肥胖。
本发明的化合物是glp-1、gip和胰高血糖素受体的激动剂(例如“三重激动剂”)并且可以提供治疗效益通过允许同时治疗糖尿病和肥胖来解决针对代谢综合征的临床需求。
可以使用本发明的化合物治疗的其他疾病状态和健康状况是肥胖相关炎症,肥胖相关胆囊疾病和肥胖诱导的睡眠呼吸暂停。
尽管全部这些状况可能直接或间接与肥胖相关,但是本发明的化合物的效果可能全部或部分经由对体重的效果来介导,或与之独立。
另外,待治疗的疾病可以是神经退行性疾病如阿尔茨海默病或帕金森病,或其他如上所述的退行性疾病。
在一个实施方案中,化合物在治疗或预防高血糖、2型糖尿病和/或肥胖中是有用的。
本发明的化合物可以具有降低患者的肠道通过,增加患者的胃内容物和/或减少患者的食物摄取的能力。本发明的化合物的这些活性可以在技术人员已知并且也记载在本文的方法中的动物模型中评价。
本发明的化合物具有降低患者血糖水平和/或降低患者hba1c水平的能力。本发明的化合物的这些活性可以在技术人员已知并且也记载在本文的方法中和实施例中的动物模型中评价。
本发明的化合物可以具有降低患者体重的能力。本发明的化合物的这些活性可以在技术人员已知并且也记载在本文的方法中和实施例中的动物模型中评价。
本发明的化合物在脂肪肝变性,优选非酒精性肝脏疾病(nafld)和非酒精性脂肪性肝炎(nash)的治疗或预防中可能是有用的。
药物组合物
术语“药物组合物”表示含有在混合时可以兼容的并且可以施用的成分的混合物。药物组合物可以包括一种或多种医学药物。另外,药物组合物可以包括载体,缓冲液,酸化剂,碱化剂,溶剂,佐剂,张力调节剂,润滑剂(emollient),膨胀剂,防腐剂,物理和化学稳定剂例如表面活性剂,抗氧化剂和其他组分,无论这些被认为是活性或非活性成分。在制备药物组合物方面针对技术人员的指导可以在例如remington:thescienceandpracticeofpharmacy,(20thed.)ed.a.r.gennaroa.r.,2000,lippencottwilliams&wilkins和在r.c.rowe等(ed),handbookofpharmaceuticalexcipients,php,may2013更新版中找到。
本发明的毒蜥外泌肽-4肽衍生物或其盐可以与作为药物组合物的部分的可药用载体,稀释剂或赋形剂联合施用。
“可药用载体”是生理上可接受的(例如生理上可接受的ph)同时保持与其一起施用的物质的治疗性质的载体。标准可接受药学载体和它们的制剂是本领域技术人员已知的并且记载在例如remington:thescienceandpracticeofpharmacy,(20thed.)ed.a.r.gennaroa.r.,2000,lippencottwilliams&wilkins和在r.c.rowe等(ed),handbookofpharmaceuticalexcipients,php,may2013更新版中。一种示例性可药用载体是生理盐水溶液。
在一个实施方案中,载体选自下组:缓冲剂(例如柠檬酸盐/柠檬酸,乙酸盐/乙酸),酸化剂(例如盐酸),碱化剂(例如氢氧化钠),防腐剂(例如苯酚,间甲酚),共溶剂(例如聚乙二醇400),张力调节剂(例如甘露醇,甘油),稳定剂(例如表面活性剂,抗氧化剂,氨基酸)。
使用的浓度在生理可接受的范围内。
可接受的药学载体或稀释剂包括在适合口服,直肠,鼻部或胃肠外(包括皮下,肌肉内,静脉内,皮内和经皮)施用的制剂中使用的那些。本发明的化合物将通常胃肠外施用。
术语“可药用盐”意指安全并有效地用于哺乳动物中的用途的本发明的化合物的盐。
术语“溶剂合物”意指本发明的化合物或其盐与溶剂分子,例如有机溶剂分子和/或水的复合物。
在药物组合物中,毒蜥外泌肽-4衍生物可以是单体或寡聚形式。
术语“治疗有效量”的化合物指非毒性但足以提供期望的效果的量的化合物。实现期望的生物学效果所必需的式i的化合物的量依赖于多种因素,例如选择的具体化合物,意图的用途,施用的模式和患者的临床状况。在任何独立的情况下合适的“有效”量可以由本领域普通技术人员施用常规实验方法测定。例如,式i化合物的“治疗有效量”为约0.01至50mg/剂,优选0.02至1mg/剂。
本发明的药物组合物是适合胃肠外(例如皮下,肌肉内,皮内或静脉内),直肠,局部(topical)和经口(例如舌下)施用的那些,尽管大多数合适的施用模式在每个独立情况下取决于待治疗的状况的性质和严重性,还取决于在每种情况下使用的式i化合物的性质。在一个实施方案中,施用是胃肠外的,例如,皮下的。
在胃肠外施用的情况下,相应的制剂包括至少一种抗微生物防腐剂从而抑制微生物和细菌在施用之间生长可能是有利的。优选的防腐剂是苯甲醇或酚类化合物如苯酚或间甲酚。已有记载这些成分可以诱导肽和蛋白质的聚集,导致制剂中的溶解度和稳定性较低(参见r.l.bis等.,int.j.pharm.472,356–361,2014;t.j.kamerzell,adv.drugdeliv.rev.,63,1118-1159,2011)。
合适的药物组合物可以是单独单位的形式,例如胶囊,片剂和小瓶或安瓿中的粉末,其中的每一种含有限定量的所述化合物;作为粉末或颗粒;作为水性或非水性液体中的溶液或悬液;或作为水包油或油包水乳剂。其可以以单次或多次剂量可注射形式提供,例如,以笔的形式。正如已经提到的,所述组合物可以通过任何合适的药学方法制备,所述方法包括在其中使活性成分和载体(其可以由一种或多种额外的成分组成)接触的步骤。
在某些实施方案中,所述药物组合物可以与施用装置一起提供,例如与注射器,注射笔或自我注射器一起。这些装置可以与药物组合物单独提供或者预填充有所述药物组合物。
施用单位,药包,笔类装置和施用
本发明的化合物可以制备用于在合适的药物组合物中使用。合适的药物组合物可以是一个或多个施用单位的形式。
所述组合物可以通过任何合适的药学方法制备,所述方法包括在其中将本发明的化合物和载体(其可以由一种或多种额外成分组成)接触的步骤。
所述施用单元可以是例如胶囊,片剂,糖衣丸,颗粒小药囊,滴剂,溶液,混液,冻干剂和粉膜,其中每一种含有限定量的本发明的化合物。
本发明的化合物或本发明的药物组合物的上述施用单位中的每一种(施用单位)可以以药包提供以便运输和储存。施用单位包装在标准单剂量或多剂量包装中,其形式,材料和形状取决于制备的单位的类型。
例如,片剂和固体施用单位的其他形式可以包装在单个单位中,并且单个包装的单位可以包装在多包装容器中。
液体制剂可以包装在单个单位中,如例如小瓶,药筒,注射器/预填充注射器,输液袋,可折叠塑料袋,输液瓶,充气密封瓶或输液管,或以单或多剂量的可注射形式包装,例如,以笔装置,泵或注射器的形式,并且单个包装单位可以包装在多包装容器中。单个包装可以包含仅一个或多个施用单位。包装可以例如由纸,硬纸板(cardboard),纸板(paperboard),塑料,金属;纸,塑料和金属中的一种或多种的组合或层压材料;或玻璃制成。示例性实施方案是泡罩包装,其含有例如片剂或胶囊,其继而可以在硬纸板盒中提供;铝阻隔层压袋,其含有例如粉末、玻璃或塑料瓶,其中含有例如片剂或溶液;或含有溶液或悬液的小瓶,药筒,注射器,输液袋,输液瓶,输液管或安瓿。
在某些实施方案中,施用单元可以与施用装置一起提供,例如与注射器、注射笔或自我注射器一起。这些装置可以与药物组合物单独提供或用所述药物组合物预填充。
“笔型注射装置”通常简称为“注射笔”,通常是一种具有类似于书写用水笔的细长形状的注射装置。尽管这样的笔经常具有管状横截面,但是它们可以轻易地具有不同的横截面如三角形、矩形或正方形,或任何围绕这些几何形状的变型。通常而言,笔型注射装置包含三个主要元件:包括药筒(通常容纳在壳体或支持物(holder)中)的药筒部分;与药筒部分的一端连接的针组件;和与药筒部分另一端连接的给药部分。药筒通常称为“安瓿”,其通常包括填充有药物的储液罐、位于药筒储液罐一端的可移动的橡胶型塞或栓,和位于另一端(通常为收缩的)具有可穿透的橡胶密封件的顶部。通常使用卷曲的环形金属带将橡胶密封件固定就位。虽然药筒壳体通常可以由塑料制成,但是药筒储液器历来由玻璃制成。
联合疗法
本发明的化合物,即glp-1,gip和胰高血糖素受体的三重激动剂,可以广泛地与其他药理学活性化合物组合,如roteliste2016中提到的全部药物,例如与roteliste2016第一章中提到的全部减重剂或食欲抑制剂,roteliste2016第58中提到的全部降脂剂,roteliste2016中提到的全部抗高血压药和肾保护药,或roteliste2015第36章中提到的全部利尿剂。
活性成分组合可以特别用于作用上的协同性改进。它们可以通过向患者分开施用活性成分或以组合产品的形式来施用,所述组合产品中多种活性成分作为一个药物制备物存在。当活性成分通过分开施用活性成分施用时,这可以同时或相继进行。
适用于这些组合的其他活性物质尤其包括例如在提及的一种适应症方面强化一种或多种活性物质的治疗效果的那些和/或允许一种或多种活性物质的剂量降低的那些。
适合于组合的治疗剂包括例如抗糖尿病药,如:
胰岛素和胰岛素衍生物,例如:甘精胰岛素/
glp-1,glp-1类似物和glp-1受体激动剂例如:利西拉来/ave0010/zp10/lyxumia,艾塞那肽/毒蜥外泌肽-4/byetta/bydureon/itca650/ac-2993,利拉鲁肽/victoza,semaglutide,taspoglutide,syncria/albiglutide,dulaglutide,r毒蜥外泌肽-4,cjc-1134-pc,pb-1023,ttp-054,efpeglenatide/hm-11260c,cm-3,glp-1eligen,ormd-0901,nn-9924,nn-9926,nn-9927,nodexen,viador-glp-1,cvx-096,zyog-1,zyd-1,gsk-2374697,da-3091,mar-701,mar709,zp-2929,zp-3022,zp-di-70,tt-401,mk-8521,medi0382,bhm-034,hm12525a,mod-6030,cam-2036,da-15864,ari-2651,ari-2255,ly3298176,nn1177,艾塞那肽-xten和胰高血糖素-xten,nn9030。
dpp-4抑制剂,例如:alogliptin/nesina,trajenta/linagliptin/bi-1356/ondero/trajenta/tradjenta/trayenta/tradzenta,saxagliptin/onglyza,sitagliptin/januvia/xelevia/tesave/janumet/velmetia,galvus/vildagliptin,anagliptin,gemigliptin,teneligliptin,melogliptin,曲格列汀,da-1229,奥格列汀/mk-3102,km-223,evogliptin,ari-2243,pbl-1427,pinoxacin。
sglt2抑制剂,例如:invokana/canaglifozin,forxiga/dapagliflozin,remoglifozin,sergliflozin,empagliflozin,ipragliflozin,tofogliflozin,luseogliflozin,sotagliflozin(lx-4211),ertuglifozin/pf-04971729,ro-4998452,bexagliflozin(egt-0001442),kga-3235/dsp-3235,lik066,sbm-tfc-039,henagliflozin(shr3824),janagliflozin,tianagliflozin,ast1935,jrp493,hec-44616。
双胍类(例如二甲双胍,丁双胍,苯乙双胍),噻唑烷二酮(例如吡格列酮,rivoglitazone,罗格列酮,troglitazone),双重ppar激动剂(例如aleglitazar,muraglitazar,tesaglitazar),磺酰脲类(例如tolbutamide,glibenclamide,glimepiride/amaryl,glipizide),meglitinides(例如nateglinide,repaglinide,mitiglinide),α-葡糖苷酶抑制剂(例如阿卡波糖,米格列醇,伏格列波糖),胰淀素和胰淀素类似物(例如普兰林肽,symlin)。
gpr119激动剂(例如gsk-263a,psn-821,mbx-2982,apd-597,zyg-19,ds-8500),gpr40激动剂(例如fasiglifam/tak-875,tug-424,p-1736,jtt-851,gw9508)。
其他合适的联用伙伴是:cycloset,11-β-hsd抑制剂(例如ly2523199,bms770767,rg-4929,bms816336,azd-8329,hsd-016,bi-135585),葡萄糖激酶激活剂(例如ttp-399,amg-151,tak-329,gkm-001),dgat抑制剂(例如lcq-908),蛋白质酪氨酸磷酸酶抑制剂1(例如trodusquemine),葡萄糖-6-磷酸酶抑制剂,果糖-1,6-二磷酸酶抑制剂,糖原磷酸化酶抑制剂,磷酸烯醇式丙酮酸羧基激酶抑制剂,糖原合酶激酶抑制剂,丙酮酸脱氢酶抑制剂,α2拮抗剂,ccr-2拮抗剂,sglt-1抑制剂(例如lx-2761)。
一种或多种降脂剂作为联用伙伴也是合适的,如例如:hmg-coa-还原酶抑制剂(例如辛伐他汀,阿托伐他汀),贝特类(例如苯扎贝特,非诺贝特),烟酸及其衍生物(例如烟酸),
ppar-(α,γ或α/γ)激动剂或调节剂(例如aleglitazar),
ppar-δ激动剂,acat抑制剂(例如阿伐西米),胆固醇吸收抑制剂(例如依泽替米贝),胆汁酸结合物质(例如胆甾酪胺),回肠胆汁酸转运抑制剂,mtp抑制剂或pcsk9调节剂。
升hdl化合物如:cetp抑制剂(例如torcetrapib,anacetrapid,dalcetrapid,evacetrapid,jtt-302,drl-17822,ta-8995)或abc1调节剂。
其他合适的联用伙伴是一种或多种用于治疗肥胖的活性物质,如例如:西布曲明,特索芬辛,奥利司他,大麻素-1受体拮抗剂,mch-1受体拮抗剂,mc4受体激动剂,npy5或npy2拮抗剂(例如velneperit),β-3-激动剂,瘦蛋白或瘦蛋白模拟物,5ht2c受体激动剂(如lorcaserin),或如下组合,bupropione/纳曲酮,bupropione/zonisamide,bupropione/phentermine或普兰林肽/美曲普汀。
其他合适的联用伙伴是:
其他胃肠肽,如肽yy3-36(pyy3-36)或或其类似物,胰腺多肽(pp)或其类似物。
胰高血糖素受体激动剂或拮抗剂,gip受体激动剂或拮抗剂,生长素释放肽(ghrelin)拮抗剂或反向激动剂,xenin及其类似物。
另外,与影响高血压、慢性心力衰竭或动脉粥样硬化的药物的组合如例如:血管紧张素ⅱ受体拮抗剂(例如替米沙坦,坎地沙坦,缬沙坦,氯沙坦,依普罗沙坦,厄贝沙坦,奥美沙坦,他索沙坦,阿齐沙坦),ace抑制剂,ece抑制剂,利尿剂,β-受体阻滞剂,钙拮抗剂,中枢作用高血压(centrallyactinghypertensives),α-2-肾上腺素能受体拮抗剂,中性内肽酶抑制剂,血小板聚集抑制剂等及其组合是合适的。
在另一方面,本发明涉及本发明的化合物或其生理上可接受的盐与至少一种作为联用伙伴的上述活性物质组合用于制备药物的用途,所述药物适用于治疗或预防能够通过结合至glp-1和胰高血糖素的受体并通过调节它们的活性而被影响的疾病或状况。这优选是在代谢综合征背景下的疾病,特别是上文所列的疾病或状况之一,最特别是糖尿病或肥胖或其并发症。
根据本发明的化合物或其生理上可接受的盐与一种或多种活性物质组合的使用可以同时,单独或顺序进行。
本发明的化合物或其生理上可接受的盐与另一活性物质组合的使用可以同时或以间隔的时间,但是具体来说在小段间隔的时间内进行。如果它们同时施用,那么将两种活性物质一起给予患者;如果它们以间隔的时间使用,那么将两种活性物质在一段少于或等于12小时,但是具体来说少于或等于6小时的时间内给予患者。
因此,在另一方面,本发明涉及药物,其包含本发明的化合物或这样的化合物的生理学可接受盐和至少一种上文作为联用伙伴描述的活性物质,任选地与一种或多种惰性载体和/或稀释剂一起。
本发明的化合物或其生理学可接受的盐或溶剂合物,以及与之组合的其他活性物质,均可以存在于一个制剂中,例如片剂或胶囊,或单独在两个相同的或不同的制剂中,例如所谓的套盒部件(kit-of-parts)。
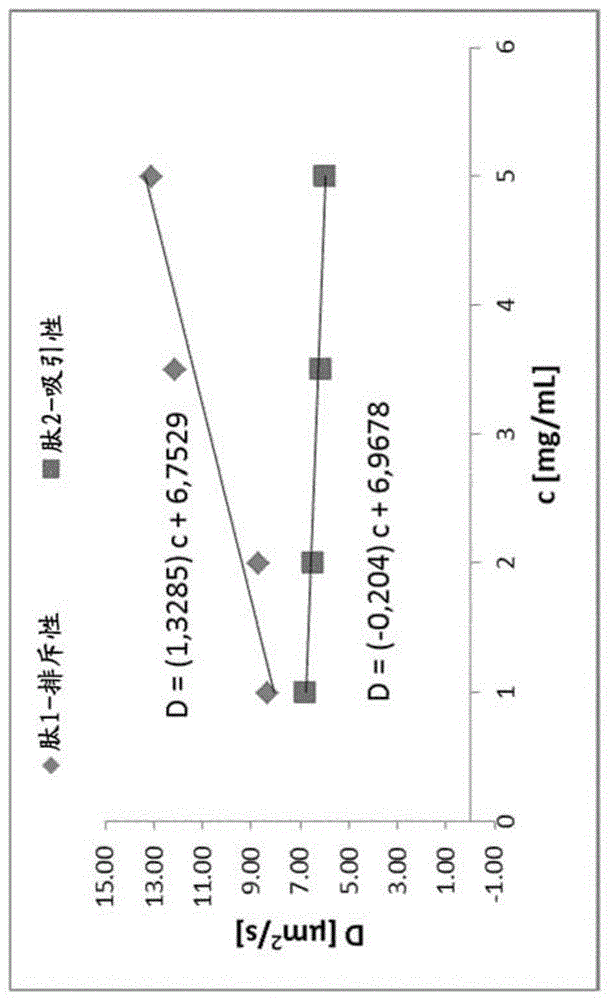
附图说明
图1.展现出可逆的自我结合(吸引人的相互作用)和排斥性维里相互作用(virialinteraction)的肽制剂的动态德拜图(dynamicdebyeplot)的比较。
图2.seqidno:6,seqidno:7——喂食的dio小鼠在第一次治疗之后的血糖曲线。
图3.seqidno:6,seqidno:7——dio小鼠的体重。
图4.seqidno:6,seqidno:7——dio小鼠的体重变化。
图5.seqidno:6,seqidno:7——dio小鼠的全身脂肪重量变化(n=8只/组,n=7dio-运载体)。
图6.seqidno:6,seqidno:7——dio小鼠的终末肝质量。
图7.seqidno:6,seqidno:7——dio小鼠的终末血浆白蛋白氨基转移酶(alat)浓度(n=8只/组,n=7dio-运载体)。
图8.seqidno:6,seqidno:7——dio小鼠的终末总血浆胆固醇浓度。
图9.seqidno:6,seqidno:7——dio小鼠的终末血浆胰岛素浓度。
图10.seqidno:6,seqidno:7——喂食的db/db小鼠在单次治疗后的血糖曲线。
图11.seqidno:6,seqidno:7——喂食的db/db小鼠的血糖的曲线下面积(auc).
图12.seqidno:8,seqidno:9,seqidno:10——喂食的dio小鼠第一次治疗后的血糖曲线。
图13.seqidno:8,seqidno:9,seqidno:10——dio小鼠的体重。
图14.seqidno:8,seqidno:9,seqidno:10——dio小鼠的体重变化。
图15.seqidno:8,seqidno:9,seqidno:10——dio小鼠的全身脂肪质量变化。
图16.seqidno:8,seqidno:9,seqidno:10——dio小鼠的终末肝脏质量。
图17.seqidno:8,seqidno:9,seqidno:10——dio小鼠的终末血浆白蛋白氨基转移酶浓度。
图18.seqidno:8,seqidno:9,seqidno:10——dio小鼠的终末总血浆胆固醇浓度。
图19.seqidno:8,seqidno:9,seqidno:10——dio小鼠的终末血浆胰岛素浓度。
图20.seqidno:13——喂食的db/db小鼠中单次治疗后的血糖曲线。
图21.seqidno:13——喂食的db/db小鼠中血糖的曲线下面积(auc)。
方法
采用的缩写如下:
aa氨基酸
aeeac(2-(2-氨基乙氧基)乙氧基)乙酰基
aibα-氨基-异丁酸
camp环腺苷单磷酸
boc叔丁氧基羰基
bop(苯并三唑-1-基氧基)三(二甲基氨基)膦六氟磷酸
bsa牛血清白蛋白
tbu叔丁基
dalad-丙氨酸
dcm二氯甲烷
dde1-(4,4-二甲基-2,6-二氧代环亚己基)-乙基
ivdde1-(4,4-二甲基-2,6-二氧代环亚己基)-3-甲基-丁基
dicn,n'-二异丙基碳化二亚胺
dipean,n-二异丙基乙胺
dmemdulbecco氏改良型eagle氏培养基
dmf二甲酰胺
dms二甲基硫醚
edt乙二硫醇
fa甲酸
fbs胎牛血清
fmoc芴基甲基氧基羰基
gaaaγ-氨基己二酸
ggluγ-谷氨酸(γe)
hatuo-(7-偶氮苯并三唑-1-基)-n,n,n′,n′-四甲基脲六氟磷酸
hbsshanks氏平衡盐溶液
hbtu2-(1h-苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸
hepes2-[4-(2-羟乙基)哌嗪-1-基]乙磺酸
hobt1-羟基苯丙三唑
hosun-羟基琥珀酰亚胺
hplc高效液相色谱
htrf均相时间分辨荧光
ibmx3-异丁基-1-甲基黄嘌呤
lc/ms液相色谱/质谱
mmt单甲氧基-三苯甲基
palm棕榈酰
pbs磷酸盐缓冲盐水
peg聚乙二醇
pk药代动力学
rp-hplc反向高效液相色谱
stea硬脂酰
tfa三氟乙酸
trt三苯甲基
uv紫外线
肽化合物的通用合成
材料
将不同的rink-酰胺树脂(4-(2’,4’-二甲氧基戊基-fmoc-氨基甲基)-苯氧基乙酰氨基-正亮氨酰氨基甲基树脂,merckbiosciences;4-[(2,4-二甲氧基戊基)(fmoc-氨基)甲基]苯氧基乙酰氨基甲基树脂,agilenttechnologies)用于合成肽酰胺,加载两在0.2-0.7mmol/g范围内。
fmoc保护的天然氨基酸购自proteintechnologiesinc.,sennchemicals,merckbiosciences,novabiochem,irisbiotech,bachem,chem-impexinternational或matrixinnovation。在整个合成过程中使用以下标准氨基酸:fmoc-l-ala-oh,fmoc-arg(pbf)-oh,fmoc-l-asn(trt)-oh,fmoc-l-asp(otbu)-oh,fmoc-l-cys(trt)-oh,fmoc-l-gln(trt)-oh,fmoc-l-glu(otbu)-oh,fmoc-gly-oh,fmoc-l-his(trt)-oh,fmoc-l-ile-oh,fmoc-l-leu-oh,fmoc-l-lys(boc)-oh,fmoc-l-met-oh,fmoc-l-phe-oh,fmoc-l-pro-oh,fmoc-l-ser(tbu)-oh,fmoc-l-thr(tbu)-oh,fmoc-l-trp(boc)-oh,fmoc-l-tyr(tbu)-oh,fmoc-l-val-oh。
另外,以下特殊氨基酸购自与上文相同的供应商:fmoc-l-lys(ivdde)-oh,fmoc-l-lys(mmt)-oh,fmoc-aib-oh,fmoc-d-ser(tbu)-oh,fmoc-d-ala-oh,boc-l-his(boc)-oh(可以作为甲苯溶剂合物获得)和boc-l-his(trt)-oh。
另外,可以应用构建模块(2s)-6-[[(4s)-5-叔丁氧基-4-[[(4s)-5-叔丁氧基-4-(十六烷酰基氨基)-5-氧代-戊酰基]氨基]-5-氧代-戊酰基]氨基]-2-(9h-芴-9-基甲氧羰基氨基)己酸和boc-l-his(trt)-aib-oh。两种构建模块均单独合成。
固相肽合成例如在prelude肽合成仪(proteintechnologiesinc)或类似的自动化合成仪上使用标准fmoc化学法和hbtu/dipea活化进行。使用dmf作为溶剂。脱保护:20%哌啶/dmf,进行2x2.5min。清洗:7xdmf。偶联2:5:10200mmaa/500mmhbtu/2mdipea于dmf2x中持续20min。清洗:5xdmf。
在lys侧链被修饰的情况下,在相应的位置使用fmoc-l-lys(ivdde)-oh或fmoc-l-lys(mmt)-oh。在合成完成之后,根据经过修改的文献流程(s.r.chhabra等.,tetrahedronlett.,1998,39,1603)去除ivdde基团,使用dmf中4%的水合肼。通过用acoh/tfe/dcm(1/2/7)在rt进行15分钟的重复处理去除mmt基团,然后用dcm,dcm中的5%dipea和dcm/dmf中的5%dipea重复清洗树脂。
通过用期望的酸的n-羟基琥珀酰亚胺酯处理树脂或使用如hbtu/dipea或hobt/dic的偶联试剂进行以下酰化。
将全部已经合成的肽使用king氏切割鸡尾酒混合物(由2.5%tfa,5%苯酚,5%水,5%茴香硫醚,2.5%edt组成)从树脂切下。然后使粗制肽在二乙基或二异丙基醚中沉淀,离心,并冻干。通过分析型hplc分析肽并通过esi质谱检查。粗制肽通过常规制备型rp-hplc纯化流程纯化。
可供选择地,将肽通过手动合成流程合成:
将0.3g脱水rink酰胺mbha树脂(0.66mmol/g)置于配备有聚丙烯过滤器的聚乙烯容器中。使树脂在dcm(15ml)中膨胀1h并在dmf(15ml)中膨胀1h。将树脂上的fmoc基团通过用20%(v/v)哌啶/dmf溶液处理它两次5和15min来脱保护。将树脂用dmf/dcm/dmf(各为6:6:6次)清洗。使用kaiser检测(定量方法)确认fmoc从固相支持物的去除。将干dmf中的c-末端fmoc-氨基酸(对应于树脂加载量的5当量过量)添加至脱保护的树脂,并且用5当量过量的dmf中的dic和hobt起始接下来的fmoc-氨基酸的偶联。反应混合物中每种反应物的浓度约为0.4m。将混合物在室温下在旋转器中旋转2小时。将树脂过滤并用dmf/dcm/dmf(各为6:6:6次)清洗。在偶联完成后对肽树脂等分试样的kaiser检测为阴性(树脂上无颜色)。在第一个氨基酸附接之后,树脂中未反应的氨基基团(若有)使用乙酸酐/吡啶/dcm(1:8:8)加帽20分钟以避免任何序列的缺失。加帽之后,用dcm/dmf/dcm/dmf(各为6/6/6/6次)清洗树脂。将c-末端氨基酸附接的肽树脂的fmoc基团通过用20%(v/v)哌啶/dmf溶液5和15min处理两次来脱保护。将树脂用dmf/dcm/dmf(各为6:6:6次)清洗。在fmoc脱保护完成后对肽树脂等分试样的kaiser检验为阳性。
将rink酰胺mbha树脂上靶序列中的剩余氨基酸使用fmocaa/dic/hobt方法使用对应于树脂加载量5当量过量在dmf中按顺序偶联。反应混合物中的每种反应物的浓度约为0.4m。将混合物在室温在旋转器上旋转2小时。将树脂过滤并用dmf/dcm/dmf(各为6:6:6次)清洗。每个偶联步骤和fmoc脱保护步骤之后,进行kaiser检测来确认反应的完成。
在线性序列完成之后,将作为分支点或修饰点使用的赖氨酸的ε-氨基基团使用dmf中的2.5%水合肼持续15minx2脱保护,并用dmf/dcm/dmf(各为6:6:6次)清洗。将谷氨酸的γ-羧基端使用fmoc-glu(oh)-otbu用dic/hobt方法(相对于树脂加载量使用5当量过量)在dmf中附接至lys的ε-氨基基团。将混合物在旋转器上在室温旋转2h。将树脂过滤并用dmf/dcm/dmf(每种6x30ml)清洗。将谷氨酸上的fmoc基团通过用20%(v/v)哌啶/dmf溶液处理它5和15min的两次(每次25ml)来脱保护。将树脂用dmf/dcm/dmf(各为6:6:6次)清洗。在fmoc脱保护完成后对肽树脂等分试样的kaiser检测为阳性。
如果侧链分支还含有一个γ-谷氨酸,使用第二个fmoc-glu(oh)-otbu用dic/hobt方法(相对于树脂加载量使用5当量过量)在dmf中附接至γ-谷氨酸的游离氨基基团。将混合物在旋转器上在室温旋转2h。将树脂过滤并用dmf/dcm/dmf(每种6x30ml)清洗。将γ-谷氨酸上的fmoc基团通过用20%(v/v)哌啶/dmf溶液处理它5和15min的两次(25ml)来脱保护。将树脂用dmf/dcm/dmf(各为6:6:6次)清洗。在fmoc脱保护完成后对肽树脂等分试样的kaiser检测为阳性。
将棕榈酸和硬脂酸附接至谷氨酸的侧链:
向γ-谷氨酸的游离氨基基团添加溶解于dmf中的棕榈酸或硬脂酸(5当量),并且通过添加dmf中的dic(5当量)和hobt(5当量)起始偶联。将树脂用dmf/dcm/dmf(各为6:6:6次)清洗。
肽从树脂的最终切割:
将通过手动合成而合成的肽树脂用dcm(6x10ml),meoh(6x10ml)和乙醚(6x10ml)清洗并在真空干燥器中干燥过夜。肽从固相支持物的切割通过用试剂鸡尾酒混合物(80.0%tfa/5%茴香硫醚/5%苯酚/2.5%edt,2.5%dms和5%dcm)在室温处理所述肽-树脂3h来实现。通过过滤收集切割混合物,并且用tfa(2ml)和dcm(2x5ml)清洗树脂。将过量的tfa和dcm在氮气下浓缩成小体积,并且向残余物添加小量dcm(5-10ml)并在氮气下蒸发。将该过程重复3-4次以去除大部分的挥发性杂质。将残余物冷却至0℃,并且添加无水乙醚以沉淀肽。将沉淀的肽离心并去除上清液乙醚,并向肽添加新鲜的乙醚并且再离心。粗制样品用制备型hplc纯化并冻干。肽的身份通过lcms确认。
另外,使用了一种不同的路径用于引入赖氨酸侧链,其应用其中侧链已经附接至赖氨酸预先官能化的构建模块(例如(2s)-6-[[(4s)-5-叔丁氧基-4-[[(4s)-5-叔丁氧基-4-(十六烷酰基氨基)-5-氧代-戊酰基]氨基]-5-氧代-戊酰基]氨基]-2-(9h-9-芴甲氧羰基氨基)己酸)作为肽合成中的偶联伙伴。将0,67mmol携带氨基基团的肽树脂用20ml的二甲基甲酰胺清洗。将2,93g的(2s)-6-[[(4s)-5-叔丁氧基-4-[[(4s)-5-叔丁氧基-4-(十六烷酰基氨基)-5-氧代-戊酰基]氨基]-5-氧代-戊酰基]氨基]-2-(9h-9-芴甲氧羰基氨基)己酸连同310mg的羟基苯丙三唑水合物和0,32ml的二异丙基碳化二亚胺溶解在20ml的二甲基甲酰胺中。在搅拌5分钟后,将所述溶液添加至树脂。将树脂搅拌20h,然后每次用20ml的二甲基甲酰胺清洗三次。取小量树脂样品并进行kaiser检测和chloranil检测(e.kaiser,r.l.colescott,c.d.bossinger,p.i.cook,anal.biochem.1970,34,595-598;chloranil-test:t.vojkovsky,peptideresearch1995,8,236-237)。这种流程避免了对非常后期的合成中间产物进行选择性脱保护步骤以及选择性附接侧链构建模块的需要。
分析型hplc/uplc
方法a:在210-225nm的检测
柱:watersacquity
梯度:80:20(0min)至80:20(3min)至25:75(23min)至2:98(23.5min)至2:98(30.5min)至80:20(31min)至80:20(37min)
任选使用质量分析仪:lctpremier,电喷雾阳离子模式
方法b:在214的检测
柱:watersacquity
梯度:80:20(0min)至80:20(3min)至25:75(23min)至2:98(23.5min)至2:98(30.5min)至80:20(31min)至80:20(37min)
任选使用质量分析仪:agilent6230accurate-masstof,dualagilentjetstreamesi
方法c:在214nm的检测
柱:watersacquity
梯度:80:20(0min)至80:20(3min)至25:75(23min)至2:98(23.5min)至2:98(30.5min)至80:20(31min)至80:20(38min)
任选使用质量分析仪:agilent6230accurate-masstof,agilentjetstreamesi
方法d:在220nm的检测
柱:watersacquitybehc18(2.1x100mmx1.7μm),温度:40℃
aries肽xbc18(4.6x250mmx3.6μm),温度:40℃
溶剂:h2o+0.1%甲酸(缓冲液a):acn+0.1%甲酸(流速1ml/min)(缓冲液b)
梯度:用2%缓冲液b平衡柱,并通过2%至70%缓冲液b的梯度在15min过程中洗脱??
方法e:在215nm的检测
柱:watersacquity
溶剂:h2o+0.05%tfa:acn+0.035%tfa(流速0.5ml/min)
梯度:80:20(0min)至80:20(3min)至25:75(23min)至5:95(23.5min)至5:95(25.5min)至80:20(26min)至80:20(30min)
通用制备型hplc纯化流程
将粗制肽或者在
毒蜥外泌肽-4衍生物的溶解度评价
在对肽批次进行溶解度测量之前,通过uplc/ms测定其纯度。
对于溶解度测试,目标浓度为10mg纯化合物/ml。因此基于先前测定的%纯度在缓冲体系中制备浓度为10mg/ml化合物的来自固体样品的溶液:
溶解度缓冲体系a)乙酸盐缓冲液ph4.5,100mm乙酸钠三水合物,2.7mg/ml间甲酚
溶解度缓冲体系b)磷酸盐缓冲液ph7.4,100mm磷酸氢钠,2.7mg/ml间甲酚
溶解度缓冲体系c)柠檬酸盐缓冲液ph6.0,柠檬酸100mm,2,7mg/ml间甲酚
在从上清液轻柔搅拌1小时后进行uplc-uv,所述上清液在15分钟的2500rcf(相对离心速度)离心之后获得。
通过将稀释1:10的缓冲样品的2μl-注射物的uv峰面积与具有已知浓度的参照肽的标准曲线比较来确定溶解度。样品和参照肽的不同的uv吸光系数基于不同的氨基酸序列计算并在浓度计算中加以考虑。
毒蜥外泌肽-4衍生物的化学稳定性评价
在对肽批次进行化学稳定性测量之前,通过uplc/ms测定其纯度。对于稳定性检测,目标浓度为1mg纯化合物/ml。因此基于先前测定的%纯度在缓冲体系中制备浓度为1mg/ml化合物的来自固体样品的溶液:
化学稳定性缓冲体系a)25mm乙酸盐缓冲液ph4.5,3mg/mll-甲硫氨酸,2.7mg/ml间甲酚,18mg/ml甘油85%
化学稳定性缓冲体系b)25mm磷酸盐缓冲液ph6.0,3mg/mll-甲硫氨酸,2.7mg/ml间甲酚,18mg/ml甘油85%
将肽溶液通过0.22μm孔径过滤并且在无菌条件下填充至等分试样。在起始点处,通过注射2μl的未经稀释的样品来进行uplc-uv。
对于化学稳定性检测,将等分试样储存在5和40℃28天。在这段时间之后,将样品在2500rcf离心15min。然后用uplc-uv分析2μl未经稀释的上清液。
化学稳定性通过如下等式计算的纯度的相对损失来评级:
[(起始点处的纯度)-(在x℃28天之后的纯度)]/(起始点处的纯度)]*100%
x=5或40℃
纯度如下计算
[(峰面积肽)/(总的峰面积)]*100%
用于评价物理稳定性的动态光散射(dls)
使用一种单色和相干光束(激光)来照亮液体样品。动态光散射(dls)测量来自进行布朗运动的颗粒(1nm≤半径≤1μm)散射出的光。这种运动由颗粒和溶剂分子之间的碰撞引发,所述颗粒和溶剂分子本身因为其热能量而运动。颗粒的扩散运动导致散射光的时间波动[pecora,r.dynamiclightscattering:applicationsofphotoncorrelationspectroscopy,plenumpress,1985]。
记录散射光的强度波动并转化成自相关函数。通过将自相关曲线拟合成指数函数,可以导出溶液中颗粒的扩散系数d。然后使用扩散系数通过斯托克斯-爱因斯坦方程假设为球形颗粒来计算流体动力学半径rh(或表观斯托克斯半径)。这种计算定义在iso13321和iso22412中[国际标准iso13321,用于测定颗粒尺寸分布的方法第8部分:光子相关光谱,国际标准化组织(iso)1996;国际标准iso22412颗粒尺寸分析——动态光散射,国际标准化组织(iso)2008]
在多分散样品的情况下,自相关函数是对应于每个种类(species)的指数衰减的总和。然后可以使用散射光的时间波动来测定颗粒部分(fraction)或家族的尺寸分布概况。一阶结果是作为颗粒尺寸的函数的散射光的强度分布。强度分布根据每个颗粒部分或家族的散射强度自然加权。对于生物材料或聚合物,颗粒散射强度与分子量的平方成正比。因此,小量的聚集物/团块或存在较大颗粒种类可以支配强度分布。然而,这种分布可以用作样品中较大材料存在的灵敏检测者。强度分布可以使用mie理论在特定假设下转换成颗粒尺寸的体积或质量分布。与强度分布相反,质量分布最好用于比较目的,并且绝不应被认定为绝对的(由于作为基础的假设)。
dls技术产生具有固有峰展宽的分布。多分散指数%pd是颗粒尺寸分布宽度的量度,并通过iso13321和iso22412[国际标准iso13321,用于测定颗粒尺寸分布的方法第8部分:光子相关光谱,国际标准化组织(iso)1996;国际标准iso22412颗粒尺寸分析——动态光散射,国际标准化组织(iso)2008]中描述的标准方法计算。
dls相互作用参数(kd)
dls相互作用参数(kd)是描述颗粒间相互作用的量度,其中所述颗粒是折叠的蛋白质或肽[sandeepyadav等(2009)jpharmsc,vol99(3),pp1152-1168;briand.connolly等(2012)biophysicaljournalvolume103,pp69–78]。
参数kd由扩散系数d的浓度依赖性导出,扩散系数d通过浓度c的幂的扩大给出:
d(c)=d0(1+kdc+kidc2+kjdc3+…)
忽略高阶项,即kid=kjd=…=0,该数据可以被线性拟合,并且kd从曲线d=d0(1+kdc)和d0的斜率获得。d0是0浓度时的扩散系数。可以使用参数kd来描述蛋白质或肽分子或寡聚物与它们自身和它们在溶液中的环境的相互作用,并且在理论上与维里系数b22相关,如例如由harding和johnson所述,其中ms是摩尔质量,ks是沉降速度的一阶浓度系数,并且υ是部分比容(partialspecificvolume)[hardingse,johnsonp.(1985)biochemj,231,pp543–547]。
kd=2b22m-ks-υ
正b22值表明在自我结合时倾向于拯救(salvation)的样品,而负b22值表明优选自我结合的样品。从实际角度看,kd在其含义上与b22类似,并且提供关于分子之间的净力的信息。高值表明强的净排斥性相互作用,而低值表明净吸引力。因此,kd可以用于相对的、定性比较(参见图1)。
对于每种肽溶液,流体动力学半径rh和扩散常数d(经由斯托克斯-爱因斯坦方程关联)作为三次重复的平均值测定。两个参数均在不同浓度下(例如,rh1和d1:1mg/ml,以及rh5和d5:5mg/ml)在相同缓冲体系中测定。这些参数在低和高肽浓度之间的差异是dls相互作用参数kd的替代者。rh5<rh1或d5>d1对应于kd>0,并且因此对应于排斥性颗粒间相互作用,其导致改进的物理(或胶体)稳定性。
dls缓冲体系a)25mm乙酸盐缓冲液ph4.5,3mg/mll-甲硫氨酸,2.7mg/ml间甲酚,18mg/ml甘油85%
dls缓冲体系b)25mm磷酸盐缓冲液ph6.0,3mg/mll-甲硫氨酸,2.7mg/ml间甲酚,18mg/ml甘油85%
dls方法a:dls测量在w130i装置(avidnanoltd,highwycombe,uk)上并使用小容量一次性比色皿(uvette,eppendorfag,hamburg,germany)进行。数据使用avidnano提供的i-size3.0处理。颗粒尺寸分布的参数使用非负约束的最小二乘(nnls)法使用dynals算法测定。测量在25℃使用660nm激光光源和90°的角度取得。
dls方法b:dls测量在nanosizerzs(malverninstruments,malvern,uk)上并使用一次性uv比色皿(brandmacro,2,5ml和brandsemi-micro1,5ml,brandgmbh+cokg,wertheim,germany)进行。数据使用malvernzetasizer软件7.10或7.01版本处理。颗粒尺寸分布的参数使用非负约束的最小二乘(nnls)法测定。测量在25℃使用633nm激光光源以nibs(非侵入性后向散射)模式以173°的角度取得。
dls方法c:dls测量在dynaproplatereaderii(wyatttechnology,santabarbara,ca,us)上并使用以下黑色、小容量且未经处理的平板之一进行:具有透明底部的聚苯乙烯384测定平板(corning,ny,us),具有透明底部的聚苯乙烯96测定平板(corning,ny,us),具有透明底部的环烯烃聚合物(cop)384测定平板(aurora,mt,us)或具有透明底部的聚苯乙烯384测定平板(greinerbio-one,germany)。数据使用wyatttechnology提供的dynamics软件处理。颗粒尺寸分布的参数使用非负约束的最小二乘(nnls)法使用dynals算法测定。测量在25℃使用830激光光源以158°的角度取得。
用于评价物理稳定性的tht测定
肽溶液的低物理稳定性可能导致淀粉样原纤维的形成,其作为样品中有序的、线状大分子结构被观察到,最终可能导致凝胶形成。硫黄素t(tht)被广泛用于使错误折叠的蛋白质聚集物可见并量化[biancalana等(2010)biochimicaetbiophysicaacta.1804(7):1405–1412.]。当其与原纤维(如在淀粉样聚集物中的那些)结合时,染料展现出不同的荧光签名[naiki等(1989)anal.biochem.177,244-249;levine(1999)methods.enzymol.309,274-284]。用于原纤维形成的时间进程通常按照s型曲线的特征形状并且可以分成三个区域:停滞期、快速生长期和平台期。
典型的原纤维形成过程开始于停滞期,其中转化为原纤维的部分折叠的肽的量没有显著到足以被检测到。停滞期对应于核的临界质量被建立的时间。之后,剧烈的延伸期随之而来,原纤维浓度迅速增加。
通过在fluoroskanascentfl内以37℃振荡进行了研究以测定应激条件下的原纤维化趋势。
对于fluoroskanascentfl中的检测,将200μl样品置于96孔微量滴定板ps,平底,greinerfluotrac号655076。将平板用scotchtape(quiagen)密封。将样品通过在37℃在960rpm的10s振荡和50s休整期的连续循环使样品应激。动力学通过每20分钟测量荧光强度来监测。
将肽在缓冲体系中稀释至终浓度为3mg/ml。将20μlh2o中的10.1mmtht溶液添加至2ml肽溶液以得到100μmtht的终浓度。对于每种样品,检测了八个重复。
tht缓冲体系a)100mm乙酸盐ph4.5,包括间甲酚(100mmnatriumacetattrihydrat,ph调节使用2nch3cooh,2.7mg/ml间甲酚)
tht缓冲体系b)100mm柠檬酸盐缓冲液ph6.0
用于glp-1,胰高血糖素和gip受体效力的体外细胞测定
化合物对受体的激动性通过测量稳定表达人glp-1,gip或胰高血糖素受体的hek-293细胞系的camp应答的功能性测定来测定。
细胞的camp含量使用来自cisbiocorp.的试剂盒(目录号62am4pej)基于htrf(均相时间分辨荧光)测定。对于制备,将细胞分入t175培养摇瓶并过夜培养至在培养基(dmem/10%fbs)中接近汇合。然后将培养基去除并用不含钙和镁的pbs清洗细胞,然后使用accutase(sigma-aldrich目录号a6964)进行蛋白酶处理。对分离的细胞进行清洗并重悬在测定缓冲液(1xhbss;20mmhepes,0.1%bsa,2mmibmx)中,并且测定细胞密度。然后将它们稀释至400000个细胞/ml并且将25μl的等分试样分配至96孔板的孔中。对于测量,将25μl测定缓冲液中的检测化合物添加至孔,之后在室温温育30分钟。在添加了稀释在裂解缓冲液(试剂盒组分)中的htrf试剂之后,将平板温育1小时,之后在665/616nm测量荧光比例。激动剂的体内效力通过测定引起最大应答的50%激活的浓度(ec50)来定量。
用于定量小鼠和猪中的毒蜥外泌肽-4衍生物的生物分析筛选方法
为小鼠皮下(s.c.)给药1mg/kg。处死小鼠并在施用后0.25,0.5,1,2,4,8,16和24小时之后收集血样。在经由液相色谱质谱(lc/ms)的蛋白质沉淀之后分析血浆样品。pk参数和半衰期使用winonlinversion5.2.1(非隔室模型)计算。
为雌性哥廷根小型猪(
雌性饮食诱发肥胖(dio)c57bl/6小鼠中皮下处理之后对葡萄糖、身体质量、全身脂肪含量和进食消耗的急性和慢性作用
雌性c57bl/6nhsd小鼠从envigormsinc.以成组圈养的方式订购,成组圈养运输并保持成组圈养直到给药前期(predosephase)的第38天,其中运输的同笼伙伴在带有木屑铺垫的鞋盒笼中。在研究开始时,小鼠为25-26周龄。
将小鼠圈养在人工饲养条件(vivariumcondition)下,所述条件包括12h光照/黑暗循环(光照期04:00am-4:00pm),23-26℃的室温和30-70%的相对湿度。在药理学干预(给药期)之前所有动物自由接触水和高脂肪饮食(td97366)16周。将饲料每周用新鲜饲料替代直到给药前期的第38天并且在给药前期的第38天进行最后一次。在后续给药期期间,去除大约50%的剩余饲料,用新鲜饲料替代,并且每周一次将小颗粒混合均匀。
在给药前第38天,将肥胖小鼠分配至治疗组(n=8)以在全部dio组之间匹配评价身体质量。将一个自由接触啮齿动物维持饮食(tekladglobaldietsrodent2014,颗粒化)的年龄匹配组包括在研究中作为瘦对照组。在给药前期第32至38天,将全部动物用运载体(磷酸盐缓冲盐水,pbs,gibco,不含cacl2和mgcl2)处理,每天一次(皮下约0.2ml/小鼠)。
在给药前期的第37天,将测试品用pbs稀释至100μg/ml的浓度,并且将这种储备溶液的等分试样储存在大约≤-60℃。将储备等分试样解冻用于每周施用,其后储存在约4℃的冰箱中。在每个给药日通过用pbs稀释储备溶液达到期望的浓度来制备一次新鲜的注射的测试品溶液。
将小鼠每日两次用皮下注射的pbs-运载体或测试品处理,持续28天。晨间给药在06:00和07:30am之间开始并完成,下午给药在2:00和3:30pm之间开始并完成。在给药期的第28天,仅施用晨间剂量。施用的体积为5ml/kg,并且相对于每个个体最近的身体质量记录来调节剂量。
1)在进食的、雌性dio小鼠中对血糖概貌的急性作用:
在实验期间动物对水和饲料具有不受限制的接触。在给药期的第1天,在pbs-运载体或测试品的第一皮下剂量之前的第0小时以及给药后第1,2,3,4,6和24小时经由剪尾收集约5μl的血液。动物在第一剂量之后8小时接受pbs-运载体或测试品的第二皮下剂量。在第2天的给药之前,进行血糖概貌的24小时血液收集。葡萄糖测量在全血中并且以一式两份或一式三份使用aviva血糖仪进行。
2)在进食的、雌性dio小鼠中对身体质量的慢性作用:
从给药前期的第32天至第38天并且在整个给药期的28天中每天在大约06:00-07:30am之间测量身体质量。在给药期期间,将小鼠每天两次用pbs-运载体或测试品的皮下注射处理。
3)在进食的、雌性dio小鼠中对全身脂肪质量的慢性作用:
为了测定全身脂肪质量,在给药前第3天和给药期的第26天进行quantitativenuclearmagneticresonance(定量核磁共振)(qnmr)测量。在给药期期间,将小鼠每天两次用pbs-运载体或测试品的皮下注射处理。
4)在雌性dio小鼠中对饲料消耗的慢性作用:
饲料消耗基于06:00-07:30am之间对每个笼子的喂食器重量的每日评价。每个笼子圈养4只小鼠,并且在整个给药期的28天期间计算饲料消耗。在给药期期间,将小鼠每天两次用pbs-运载体或测试品的皮下注射处理。
5)在非空腹、雌性dio小鼠中的终末血浆参数:
在第28天,在任何其他生活活动之前收集血液用于测定血浆胰岛素浓度。然后施用晨间剂量,给药后4小时进行解剖。为了这一目的,用异氟醚麻醉动物并通过眼眶采血收集血液。
5)在非空腹、雌性dio小鼠中的终末肝脏质量:
在第28天且在晨间剂量之后4小时,从如上所述在异氟醚麻醉下的小鼠收集血液。然后杀死小鼠并收集肝脏并称重。
6)肝脏脂肪的定量
将肝脏的等分试样与二氯甲烷:甲醇(2:1)一起温育。将亲脂和亲水相通过添加dh2o和后续的离心来分开。收集底部的亲脂相,并且对剩余的疏脂层和肝脏组织重复该过程。接下来将亲脂相合并,并且使溶剂蒸发。在60℃和连续振荡下,随后将样品与2-丙醇一起温育。用商业试剂盒根据制造商的说明酶促法定量胆固醇、三酰甘油和磷脂浓度。
7)统计学分析:
数据按照平均值±sem描绘。统计学分析用sigmaplot12.5进行。使用单因素anova和图基检验来对全部组(n=8/组,标明了组大小的偏差)进行配对多重比较。当两个组的平均值差异大于0.05时,它们被认为是统计学上有显著差异。瘦的-运载体组数据充当非肥胖状态的参照数据组。
在非空腹、雌性、糖尿病db/db小鼠中皮下治疗之后对血糖浓度的急性作用
将雌性健康的瘦bks.cg-(瘦)/olahsd和糖尿病易感型、肥胖bks.cg-+leprdb/+leprdb/olahsd小鼠从envigormsinc.以成组圈养的方式订购,成组圈养运输并保持成组圈养在带有木屑铺垫的鞋盒笼中,直到给药前期的第15天。在研究开始时,小鼠约为12周龄。
将小鼠圈养在人工饲养条件下,所述条件包括12h光照/黑暗循环(光照期04:00am-4:00pm),23-26℃的室温和30-70%的相对湿度。所有动物自由接触水和purinafomulabdiet5008。
在给药前第9天,进行血糖和身体质量(约在08:00-10:00am之间)以及hba1c测量。在给药前期的第15天,将动物分配至治疗组(n=8)并且分配至新的笼子以在全部db/db组之间匹配平均hba1c和身体质量。将年龄匹配的瘦组包括在研究中作为健康的瘦参照。
在给药期的第1天之前,将测试品用磷酸盐缓冲盐水(pbs,gibco,不含cacl2和mgcl2)稀释至1mg/ml的浓度并且将这种储备溶液的等分试样储存在大约≤-60℃。在给药期的第1天,将储备等分试样解冻并通过用pbs稀释以达到期望的浓度来制备注射的测试品溶液。
在给药期的第1天,将db/db小鼠用皮下注射的pbs-运载体或30μg/kg测试品处理一次。瘦参照组用皮下注射的pbs-运载体处理一次。给药在08:00和10:00am之间开始并完成。施用的体积为5ml/kg,并且相对于每个个体最近的身体质量记录来调节剂量。
1)在非空腹动物中对血糖概貌的急性作用
在实验期间动物对水和饲料具有不受限制的接触。在给药期的第1天,在任何其他生活活动之前-30分钟和0分钟经由剪尾收集约5μl的血液。在第0分钟,小鼠接受pbs-运载体或30μg/kg测试品的皮下剂量。在给药后0.25,0.5,1,1.5,2,3,4,6,8和24小时收获进一步的血样。使用alphatrak血糖仪进行全血中的葡萄糖测量。如果两次测量的葡萄糖浓度差异超过20mg/dl,记录第三个值。血糖的曲线下面积(auc)经由梯形法并对于给药后24小时的时间段计算。
2)统计学分析:
3)数据按照平均值±sem描述。统计学分析用sigmaplot12.5进行。使用单因素anova和图基检验来对全部组(n=8/组,标明了组大小的偏差)进行配对多重比较。当两个组的平均值差异大于0.05时,它们被认为是统计学上有显著差异。来自非糖尿病-运载体组的数据充当正常血糖、瘦的状态的参照数据组。
实施例
本发明通过以下实施例进一步阐释。
实施例1:
seqidno:6的合成
在novabiochemrink-酰胺树脂(4-(2’,4’-二甲氧基戊基-fmoc-氨基甲基)-苯氧基乙酰氨基-正亮氨酰氨基甲基树脂)、100-200目、0.43mmol/g的加载量上进行了如方法中所述的固相合成。fmoc合成策略与hbtu/dipea活化一起应用。在固相合成方案中使用了位置14中的fmoc-lys(mmt)-oh和位置1中的boc-his(trt)-oh。按照方法中所述将mmt基团从树脂上的肽上切下。此后采用dipea作为碱将palm-gglu-gglu-osu偶联至释放的氨基基团。用king氏鸡尾酒混合物(d.s.king,c.g.fields,g.b.fields,int.j.peptideproteinres.1990,36,255-266)将肽从树脂切下。将粗制产物经由制备型hplc在waters柱(sunfireprepc18odb5μm50x150mm)上使用乙腈/水梯度(两种缓冲液均含0.1%tfa)纯化。将纯化的肽通过lcms分析(方法b)。
去卷积停留时间9.824分钟的峰下发现的质量信号揭示了肽质量4839.67,其与预期值4839.67一致。
实施例2:
seqidno:7的合成
在novabiochemrink-酰胺树脂(4-(2’,4’-二甲氧基戊基-fmoc-氨基甲基)-苯氧基乙酰氨基-正亮氨酰氨基甲基树脂)、100-200目、0.43mmol/g的加载量上进行了如方法中所述的固相合成。fmoc合成策略与hbtu/dipea活化一起应用。在固相合成方案中使用了位置14中的fmoc-lys(mmt)-oh和位置1中的boc-his(trt)-oh。按照方法中所述将mmt基团从树脂上的肽上切下。此后采用dipea作为碱将palm-gglu-gglu-osu偶联至释放的氨基基团。用king氏鸡尾酒混合物(d.s.king,c.g.fields,g.b.fields,int.j.peptideproteinres.1990,36,255-266)将肽从树脂切下。将粗制产物经由制备型hplc在waters柱(sunfireprepc18odb5μm50x150mm)上使用乙腈/水梯度(两种缓冲液均含0.1%tfa)纯化。将纯化的肽通过lcms分析(方法b)。
在停留时间9.935分钟的峰下发现的质量信号的去卷积揭示了肽质量4853.73,其与预期值4853.67一致。
实施例3:
seqidno:11的合成
在novabiochemrink-酰胺树脂(4-(2’,4’-二甲氧基戊基-fmoc-氨基甲基)-苯氧基乙酰氨基-正亮氨酰氨基甲基树脂)、100-200目、0.43mmol/g的加载量上进行了如方法中所述的固相合成。fmoc合成策略与hbtu/dipea活化一起应用。在固相合成方案中使用了位置14中的fmoc-lys(mmt)-oh和位置1中的boc-his(trt)-oh。按照方法中所述将mmt基团从树脂上的肽上切下。此后采用dipea作为碱将palm-gglu-gglu-osu偶联至释放的氨基基团。用king氏鸡尾酒混合物(d.s.king,c.g.fields,g.b.fields,int.j.peptideproteinres.1990,36,255-266)将肽从树脂切下。将粗制产物经由制备型hplc在waters柱(sunfireprepc18odb5μm50x150mm)上使用乙腈/水梯度(两种缓冲液均含0.1%tfa)纯化。将纯化的肽通过lcms分析(方法b)。
在停留时间9.828分钟的峰下发现的质量信号的去卷积揭示了肽质量4894.63,其与预期值4894.64一致。
以类似的方式,合成并表征了表3中所列的其它肽。
表3:合成的肽的列表以及分子量计算值和实测值的比较。
实施例4:稳定性
按照方法中所述在化学稳定性缓冲体系a中制备了肽样品并评价了化学稳定性。结果在表4中给出。
表4:稳定性
实施例5:溶解度
按照方法中所述在溶解度缓冲体系a中制备了肽样品并评价了溶解度。结果在表5中给出。
表5:溶解度
实施例6:通过dls相互作用参数评价的稳定性
肽样品的流体动力学半径rh在不同的肽浓度(1mg/ml和5mg/ml)下在dls缓冲体系a中使用dls方法c按照方法中所述测定,作为对dls相互作用参数kd的替代。结果在表6中给出。
表6:在1mg/ml和5mg/ml的肽浓度下的流体动力学半径rh。在较高肽浓度下rh的增加表明由于排斥性颗粒间相互作用导致的较高的物理稳定性。
实施例7:在tht测定法中评价稳定性
在对肽样品的硫黄素t(tht)测定中以小时计的迟滞时间按照方法中所述在tht缓冲体系a中测定。结果在表7中给出。
表7:硫黄素t(tht)测定中以小时计的迟滞时间
实施例8:对于人glp-1,胰高血糖素和gip受体的体外数据
肽化合物对glp-1,胰高血糖素和gip受体的效力按照方法中所述通过使表达人胰高血糖素受体(h胰高血糖素r),人gip受体(hgip-r)或人glp-1受体(hglp-1r)的细胞暴露于渐增浓度的所列化合物并且测量形成的camp来测定。
结果示于表8。
表8.毒蜥外泌肽-4衍生物对人glp-1,胰高血糖素和gip受体的ec50值(以pm表示)
实施例9:在雌性饮食诱导肥胖(dio)的c57bl/6nhsd小鼠中在皮下治疗之后seqidno:6和seqidno:7对血糖和体重的急性和慢性作用
将瘦的和饮食诱导肥胖的、25-26周龄、雌性c57bl/6nhsd小鼠每日两次用皮下注射的pbs,30μg/kgseqidno:6或30μg/kgseqidno:7处理,持续28天。晨间给药在06:00至07:30am之间开始并完成,并且下午给药在14:00和15:30pm之间开始并完成。施用的体积为5ml/kg并且将剂量根据每个个体最近的身体质量记录来调整。
1)葡萄糖概貌
在实验期间动物对水和饲料具有不受限制的接触。在给药期的第1天,在pbs-运载体、30μg/kgseqidno:6或30μg/kgseqidno:7的第一皮下剂量之前的第0小时以及给药后第1,2,3,4,6和24小时经由剪尾收集约5μl的血液。动物在第一剂量之后8小时接受pbs-运载体、30μg/kgseqidno:6或30μg/kgseqidno:7的第二皮下剂量。在第2天的给药之前,进行血糖概貌的24小时血液收集。葡萄糖测量在全血中并且以一式两份或一式三份使用aviva血糖仪进行。
在24小时血糖概貌期间,30μg/kgseqidno:6和30μg/kgseqidno:7二者均介导了相当的使血糖浓度低于在dio对照小鼠中观察到的浓度的减少(图2)。
2)身体质量
每日测定身体质量。在给药期,将小鼠每日两次用皮下注射的pbs-运载体、30μg/kgseqidno:6或30μg/kgseqidno:7处理。
使用seqidno:6或seqidno:7的长期(chronic)、每日两次的治疗导致在28天的给药期之内身体质量降低,与dio-运载体组的动物相反(图3)。用30μg/kgseqidno:6或seqidno:7长期治疗dio动物诱导了与dio-运载体组相比统计学显著的身体质量降低(单因素anova和图基检验,图4,表9)。
3)全身脂肪质量
全身脂肪质量经由核磁共振(qnmr)在给药前期测定一次,并且每日在给药期第26日测定一次。在给药期,将小鼠每日两次用皮下注射的pbs-运载体、30μg/kgseqidno:6或30μg/kgseqidno:7处理。
使用seqidno:6或seqidno:7的长期(chronic)、每日两次的治疗导致在28天之内与dio-运载体组相比统计学显著的全身脂肪质量降低(单因素anova和图基检验,图5,表9)。
4)终末肝脏质量
在第28天,在晨间剂量之后4小时将小鼠安乐死并收集肝脏。
对dio动物使用30μg/kgseqidno:6或30μg/kgseqidno:7的每日两次的、长期治疗导致在给药期的第28天与用运载体处理的dio动物相比统计学显著更低的肝脏质量(单因素anova和图基检验,图6,表9)。
5)终末血浆白蛋白氨基转移酶(alat)浓度
在第28天并且在晨间剂量之后4小时,从麻醉的、非空腹小鼠通过眼眶采血收集血液。
对dio动物使用30μg/kgseqidno:6或30μg/kgseqidno:7的每日两次的、长期治疗导致在给药期的第28天与用运载体处理的dio动物相比统计学显著更低的血浆白蛋白氨基转移酶浓度,提示肝脏功能的改善(单因素anova和图基检验,图7,表9)。
6)终末血浆总胆固醇
在第28天并且在晨间剂量之后4小时,从麻醉的、非空腹小鼠通过眼眶采血收集血液。
对dio动物使用30μg/kgseqidno:6或30μg/kgseqidno:7的每日两次的、长期治疗导致在给药期的第28天与用运载体处理的dio动物相比统计学显著的血浆总胆固醇浓度降低(单因素anova和图基检验,图8,表9)。
7)终末血浆胰岛素
在第28天并且在晨间剂量之后4小时,从麻醉的、非空腹小鼠通过眼眶采血收集血液。
对dio动物使用30μg/kgseqidno:6或30μg/kgseqidno:7的每日两次的、长期治疗导致与用运载体处理的dio动物相比统计学显著的血浆胰岛素浓度的降低,提示高脂肪饮食诱导的胰岛素抗性的改善(单因素anova和图基检验,图9,表9)。
8)统计学分析
数据按照平均值±sem描述。统计学分析用sigmaplot12.5进行。使用单因素anova和图基检验来对全部组(如标明的n=7-8/组)进行配对多重比较。当两个组的平均值差异大于0.05时,它们被认为是统计学上有显著差异。在图中示出瘦的-运载体组数据充当非肥胖状态的参照数据组。
表9.在进食的、雌性饮食诱导肥胖(dio)c57bl/6小鼠中由使用seqidno:6和seqidno:7的28天qd给药研究产生的效果。数据为平均值±sem。单因素anova和图基检验,n=8/组,除了dio-运载体为n=7。
实施例10:在非空腹、雌性、糖尿病db/db小鼠中在皮下治疗之后seqidno:6和seqidno:7对血糖浓度的急性作用
将雌性、12周龄、健康的瘦bks.cg-(瘦)/olahsd或易患糖尿病的、肥胖bks.cg-+leprdb/+leprdb/olahsd小鼠用皮下注射的pbs,30μg/kgseqidno:6或30μg/kgseqidno:7治疗一次。给药在08:00至10:00am之间开始并完成。施用的体积为5ml/kg,并且相对于每个个体最近的身体质量记录来调节剂量。糖尿病db/db小鼠是hba1c-并且身体质量匹配的。瘦的参照组用皮下注射的pbs-运载体治疗一次。
1)血糖概貌
在实验期间动物对水和饲料具有不受限制的接触。在给药期的第1天,在任何其他生活活动之前-30分钟和0分钟经由剪尾收集约5μl的血液。在第0分钟,小鼠接受pbs-运载体或30μg/kgseqidno:6或seqidno:7的皮下剂量。在给药后15,30,60,90,120,150,180,240,360和480分钟收获进一步的血样。使用alphatrak血糖仪进行全血中的葡萄糖测量。如果两次测量的葡萄糖浓度差异超过20mg/dl,记录第三个值。血糖的曲线下面积(auc)经由梯形法并对于给药后24小时的时间段计算。
seqidno:6或seqidno:7治疗的动物展现出血糖浓度相当的(comparable)、急剧降低,并且在给药后大约8小时达到最低水平(图10)。所有治疗的动物的给药后24小时平均血糖浓度处于或接近基线(图10)。用30μg/kgseqidno:6或30μg/kgseqidno:7对糖尿病db/db小鼠的单次治疗导致了与糖尿病-运载体组相比血糖auc的统计学显著降低(单因素anova和图基检验,图11,表10)。
2)统计学分析
数据按照平均值±sem描述。统计学分析用sigmaplot12.5进行。使用单因素anova和图基检验来对全部组(n=8/组)进行配对多重比较。当两个组的平均值差异大于0.05时,它们被认为是统计学上有显著差异。瘦的-运载体组数据在图中描绘充当非肥胖状态的参照数据组。
表10.在进食的、雌性db/db小鼠中由单剂量seqidno:6和seqidno:7产生的效果。数据为平均值±sem。单因素anova和图基检验,n=8/组。
实施例11:在雌性、饮食诱导肥胖(dio)的c57bl/6nhsd小鼠中在皮下治疗之后seqidno:8,seqidno:9和seqidno:10对血糖和体重的急性和慢性作用
将瘦的和饮食诱导肥胖的、25-26周龄、雌性c57bl/6nhsd小鼠每日两次用皮下注射的pbs,30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10处理,持续28天。晨间给药在06:00和07:30am之间开始并完成,下午给药在14:00和15:30pm之间开始并完成。施用的体积为5ml/kg,并且相对于每个个体最近的身体质量记录来调节剂量。
1)葡萄糖概貌
在实验期间动物对水和饲料具有不受限制的接触。在给药期的第1天,在pbs-运载体,30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10的第一皮下剂量之前的第0小时以及给药后第1,2,3,4,6和24小时经由剪尾收集约5μl的血液。动物在第一剂量之后8小时接受pbs-运载体,30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10的第二皮下剂量。在第2天的给药之前,进行血糖概貌的24小时血液收集。葡萄糖测量在全血中并且以一式两份或一式三份使用aviva血糖仪进行。
30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10在24小时血糖概貌期间介导了相当的血糖浓度降低至在dio对照小鼠中观察到的浓度以下的降低(图12)。
2)身体质量
每日测定身体质量。在给药期,将小鼠每日两次用皮下注射的pbs-运载体、30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10处理。
使用seqidno:8,seqidno:9或seqidno:10的长期、每日两次的治疗导致在28天的给药期之内身体质量降低,与dio-运载体组的动物相反(图13)。用30μg/kgseqidno:8,seqidno:9或seqidno:10长期处理dio动物诱导了与dio-运载体组相比统计学显著的身体质量降低(单因素anova和图基检验,图14,表11)。
3)全身脂肪质量
全身脂肪质量经由核磁共振(qnmr)在给药前期测定一次,并且每日在给药期第26日测定一次。在给药期,将小鼠每日两次用皮下注射的pbs-运载体、30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10处理。
使用seqidno:8,seqidno:9或seqidno:10的长期、每日两次的治疗导致在28天之内与dio-运载体组相比统计学显著的全身脂肪质量降低(单因素anova和图基检验,图15,表11)。
4)终末肝脏质量
在第28天,在晨间剂量之后4小时将小鼠安乐死并收集肝脏。
对dio动物使用30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10的每日两次的、长期治疗导致在给药期的第28天与用运载体处理的dio动物相比统计学显著更低的肝脏质量(单因素anova和图基检验,图16,表11)。
5)终末血浆氨基转移酶浓度
在第28天并且在晨间剂量之后4小时,从麻醉的、非空腹小鼠通过眼眶采血收集血液。
对dio动物使用30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10的每日两次的、长期治疗导致在给药期的第28天与用运载体处理的dio动物相比统计学显著更低的血浆白蛋白氨基转移酶浓度,提示肝脏功能的改善(单因素anova和图基检验,图17,表11)。
6)终末血浆总胆固醇
在第28天并且在晨间剂量之后4小时,从麻醉的、非空腹小鼠通过眼眶采血收集血液。
对dio动物使用30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10的每日两次的、长期治疗导致与用运载体处理的dio动物相比统计学显著的血浆总胆固醇浓度降低(单因素anova和图基检验,图18,表11)。
7)终末血浆胰岛素
在第28天并且在晨间剂量之后4小时,从麻醉的、非空腹小鼠通过眼眶采血收集血液。
对dio动物使用30μg/kgseqidno:8,30μg/kgseqidno:9或30μg/kgseqidno:10的每日两次的、长期治疗导致与用运载体处理的dio动物相比统计学显著的血浆胰岛素浓度的降低,提示高脂肪饮食诱导的胰岛素抗性的改善(单因素anova和图基检验,图19,表11)。
8)统计学分析
数据按照平均值±sem描述。统计学分析用sigmaplot12.5进行。使用单因素anova和图基检验来对全部组(如标明的n=7-8/组)进行配对多重比较。当两个组的平均值差异大于0.05时,它们被认为是统计学上有显著差异。在图中示出瘦的-运载体组数据充当非肥胖状态的参照数据组。
表11.在进食的、雌性糖尿病诱导肥胖(dio)c57bl/6小鼠中用seqidno:8,seqidno:9或seqidno:10的28天qd给药研究产生的效果。数据为平均值±sem。单因素anova和图基检验,n=8/组。
实施例12:在非空腹、雌性、糖尿病db/db小鼠中在皮下治疗之后seqidno:13对血糖浓度的急性作用
将雌性、12周龄、健康的瘦bks.cg-(瘦)/olahsd或易患糖尿病的、肥胖bks.cg-+leprdb/+leprdb/olahsd小鼠用皮下注射的pbs,30μg/kgseqidno:13治疗一次。给药在08:00至10:00am之间开始并完成。施用的体积为5ml/kg,并且相对于每个个体最近的身体质量记录来调节剂量。糖尿病db/db小鼠是hba1c-并且身体质量匹配的。瘦的参照组用皮下注射的pbs-运载体治疗一次。
1)血糖概貌
在实验期间动物对水和饲料具有不受限制的接触。在给药期的第1天,在任何其他生活活动之前-30分钟和0分钟经由剪尾收集约5μl的血液。在第0分钟,小鼠接受pbs-运载体或30μg/kgseqidno:13的皮下剂量。在给药后15,30,60,90,120,150,180,240,360和480分钟收获进一步的血样。使用alphatrak血糖仪进行全血中的葡萄糖测量。如果两次测量的葡萄糖浓度差异超过20mg/dl,记录第三个值。血糖的曲线下面积(auc)经由梯形法并对于给药后24小时的时间段计算。
seqidno:13治疗的动物展现出血糖水平的急剧降低,并且在给药后大约8小时达到最低水平(图20)。用seqidno:13治疗的动物的给药后24小时平均血糖浓度接近基线(图20)。用30μg/kgseqidno:13对糖尿病db/db小鼠的单次治疗导致了与糖尿病-运载体组相比血糖auc的统计学显著降低(单因素anova和图基检验,图21,表12)。
2)统计学分析
数据按照平均值±sem描述。统计学分析用sigmaplot12.5进行。使用单因素anova和图基检验来对全部组(n=8/组)进行配对多重比较。当两个组的平均值差异大于0.05时,它们被认为是统计学上有显著差异。瘦的-运载体组数据在图中描绘充当非肥胖状态的参照数据组。
表12.在进食的、雌性db/db小鼠中由单剂量seqidno:13产生的效果。数据为平均值±sem。单因素anova和图基检验,n=8/组。
表13.序列
序列表
<110>赛诺菲
<120>作为肽类glp1/胰高血糖素/gip受体激动剂的新化合物
<130>de2016/078wopct
<160>23
<170>patentin版本3.5
<210>1
<211>30
<212>prt
<213>智人(homosapiens)
<220>
<221>mod_res
<222>(30)..(30)
<223>酰胺化
<400>1
hisalagluglythrphethrseraspvalsersertyrleuglugly
151015
glnalaalalysglupheilealatrpleuvallysglyarg
202530
<210>2
<211>31
<212>prt
<213>人工序列
<220>
<223>利拉鲁肽
<220>
<221>mod_res
<222>(20)..(20)
<223>lys在n6用(s)-4-羧基-4-十六烷酰基氨基-丁酰基衍生化
<400>2
hisalagluglythrphethrseraspvalsersertyrleuglugly
151015
glnalaalalysglupheilealatrpleuvalargglyarggly
202530
<210>3
<211>29
<212>prt
<213>智人(homosapiens)
<400>3
hisserglnglythrphethrserasptyrserlystyrleuaspser
151015
argargalaglnaspphevalglntrpleumetasnthr
2025
<210>4
<211>39
<212>prt
<213>钝尾毒蜥(helodermasuspectum)
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>4
hisglygluglythrphethrseraspleuserlysglnmetgluglu
151015
glualavalargleupheileglutrpleulysasnglyglyproser
202530
serglyalaproproproser
35
<210>5
<211>42
<212>prt
<213>智人(homosapiens)
<400>5
tyralagluglythrpheileserasptyrserilealametasplys
151015
ilehisglnglnaspphevalasntrpleuleualaglnlysglylys
202530
lysasnasptrplyshisasnilethrgln
3540
<210>6
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>6
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaglyglypropro
202530
serxaalysproproprolys
35
<210>7
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(29)..(29)
<223>xaa=dala
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>7
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaxaaglypropro
202530
serxaalysproproprolys
35
<210>8
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-
丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>8
hisxaaglnglythrphethrseraspleuserlysleulysgluglu
151015
glnargglnxaaglupheileglutrpleulysalaglyglyhispro
202530
serxaalysproproprolys
35
<210>9
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-
丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>9
hisxaaglnglythrphethrseraspleuserlysleulysgluglu
151015
glnargglnxaaglupheileglutrpleulysalaglyglypropro
202530
serxaalysproproprolys
35
<210>10
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-
丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(29)..(29)
<223>xaa=dala
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>10
hisxaaglnglythrphethrseraspleuserlysleulysgluglu
151015
glnargglnxaaglupheileglutrpleulysalaxaaglypropro
202530
serxaalysproproprolys
35
<210>11
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-
丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(29)..(29)
<223>xaa=dala
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>11
hisxaaglnglythrphethrseraspleuserlysleulysgluglu
151015
glnargglnxaaglupheileglutrpleulysalaxaaglyhispro
202530
serxaalysproproprolys
35
<210>12
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-
丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>12
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaglyglyhispro
202530
serxaalysproproprolys
35
<210>13
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-((s)-4-羧基-4-十六烷酰基氨基-丁酰基氨基)-
丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(29)..(29)
<223>xaa=dala
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>13
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaxaaglyhispro
202530
serxaalysproproprolys
35
<210>14
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-十六烷酰基氨基-丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>14
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaglyglypropro
202530
serxaalysproproprolys
35
<210>15
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(s)-4-羧基-4-十八烷酰基氨基-丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>15
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaglyglypropro
202530
serxaalysproproprolys
35
<210>16
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用[[(4s)-4-羧基-4-[[(4s)-4-羧基-4-[[2-[2-[2-(十六烷酰基氨基)乙氧基]乙
氧基]乙酰基]氨基]丁酰基氨基]-丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>16
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaglyglyhispro
202530
serxaalysproproprolys
35
<210>17
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用衍生化
[[(4s)-4-羧基-4-[[(4s)-4-羧基-4-[[2-[2-[2-(十六烷酰基氨基)
乙氧基]乙氧基]乙酰基]氨基]丁酰基氨基]-丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(29)..(29)
<223>xaa=dala
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>17
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaxaaglyhispro
202530
serxaalysproproprolys
35
<210>18
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用衍生化
[[(4s)-4-羧基-4-[[(4s)-4-羧基-4-[[2-[2-[2-(十六烷酰基氨基)
乙氧基]乙氧基]乙酰基]氨基]丁酰基氨基]-丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>18
hisxaaglnglythrphethrseraspleuserlysleulysgluglu
151015
glnargglnxaaglupheileglutrpleulysalaglyglyhispro
202530
serxaalysproproprolys
35
<210>19
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用衍生化
[[(4s)-4-羧基-4-[[(4s)-4-羧基-4-[[2-[2-[2-(十六烷酰基氨基)
乙氧基]乙氧基]乙酰基]氨基]丁酰基氨基]-丁酰基-衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(29)..(29)
<223>xaa=dala
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>19
hisxaaglnglythrphethrseraspleuserlysleulysgluglu
151015
glnargglnxaaglupheileglutrpleulysalaxaaglyhispro
202530
serxaalysproproprolys
35
<210>20
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(4s)-羧基-[2-(2-{2-[(4r)-5-羧基-4-十六烷酰基氨基-戊酰基氨基]-
乙氧基}-乙氧基)-乙酰基氨基]-丁酰基衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>20
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaglyglyhispro
202530
serxaalysproproprolys
35
<210>21
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(4s)-羧基-[2-(2-{2-[(4r)-5-羧基-4-十六烷酰基氨基-戊酰基氨基]-
乙氧基}-乙氧基)-乙酰基氨基]-丁酰基衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(29)..(29)
<223>xaa=dala
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>21
hisxaaglnglythrphethrseraspleuserlysleulysglulys
151015
glnargglnxaaglupheileglutrpleulysalaxaaglyhispro
202530
serxaalysproproprolys
35
<210>22
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(4s)-羧基-[2-(2-{2-[(4r)-5-羧基-4-十六烷酰基氨基-戊酰基氨基]-
乙氧基}-乙氧基)-乙酰基氨基]-丁酰基衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>22
hisxaaglnglythrphethrseraspleuserlysleulysgluglu
151015
glnargglnxaaglupheileglutrpleulysalaglyglyhispro
202530
serxaalysproproprolys
35
<210>23
<211>39
<212>prt
<213>人工序列
<220>
<223>毒蜥外泌肽-4衍生物
<220>
<221>misc_feature
<222>(2)..(2)
<223>xaa=aib
<220>
<221>mod_res
<222>(14)..(14)
<223>lys在n6用(4s)-羧基-[2-(2-{2-[(4r)-5-羧基-4-十六烷酰基氨基-戊酰基氨基]-
乙氧基}-乙氧基)-乙酰基氨基]-丁酰基衍生化
<220>
<221>misc_feature
<222>(20)..(20)
<223>xaa=aib
<220>
<221>misc_feature
<222>(29)..(29)
<223>xaa=dala
<220>
<221>misc_feature
<222>(34)..(34)
<223>xaa=aib
<220>
<221>mod_res
<222>(39)..(39)
<223>酰胺化
<400>23
hisxaaglnglythrphethrseraspleuserlysleulysgluglu
151015
glnargglnxaaglupheileglutrpleulysalaxaaglyhispro
202530
serxaalysproproprolys
35
- 还没有人留言评论。精彩留言会获得点赞!