用于核酸和蛋白质有效负载递送的方法和组合物与流程
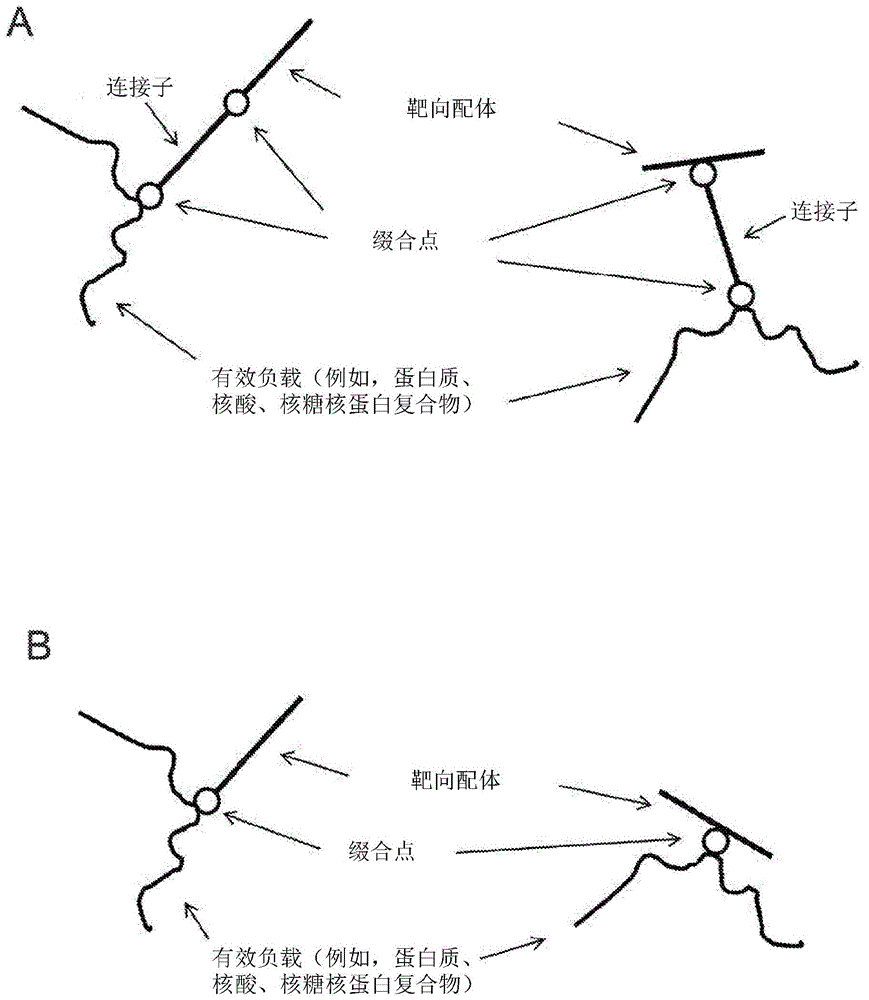
交叉引用本申请要求于2016年12月14日提交的美国临时专利申请第62/434,344号、于2017年6月9日提交的美国临时专利申请第62/517,346号、于2017年1月6日提交的美国临时专利申请第62/443,567号以及于2017年1月6日提交的美国临时专利申请第62/443,522号的权益,所述申请均通过引用以其全文并入本文。通过引用作为文本文件提供的序列表并入序列表在本文中作为于2017年12月14日创建并且大小为54kb的文本文件“lgdl-003seqlist_st25.txt”提供。文本文件的内容通过引用以全文并入本文。引言尽管最近在配体靶向治疗领域取得了进展,但是用于递送细胞内活性有效负载的方法,例如用于基因治疗应用的核酸疗法仍然受到限制。主要障碍是为给定治疗应用产生匹配的靶向配体的能力,所述给定治疗应用涉及将细胞内活性有效负载来回运送到其适当的细胞内微环境。已经进行了一些研究,目的是产生用于裸核酸(例如与n-乙酰半乳糖胺(galnac)共价结合用于肝脏靶向的化学修饰的sirna分子)或基于纳米颗粒的药物/基因递送(例如,前列腺特异性膜抗原(psma)-靶向的多西他赛纳米颗粒)的高亲和力靶向技术。然而,目前可用的方法没有考虑到将核酸、蛋白质和/或核糖核蛋白有效负载有效地靶向递送到细胞所涉及的许多注意事项。本公开解决了这些问题并且提供了相关的优点。技术实现要素:提供了用于将核酸、蛋白质和/或核糖核蛋白有效负载递送到细胞的方法和组合物。还提供了递送分子,所述递送分子包含与蛋白质或核酸有效负载(例如,sirna分子)缀合或与带电聚合物多肽结构域(例如,如9r等聚精氨酸或如6h等聚组氨酸等)缀合的肽靶向配体。所述靶向配体提供(i)与细胞表面蛋白的靶向结合以及(ii)长内体再循环途径的接合。因此,当所述靶向配体与所述预期的细胞表面蛋白接合时,所述递送分子进入细胞(例如,通过内吞作用)但优先地被引导成远离溶酶体降解途径。在一些情况下,所述靶向配体提供与细胞表面蛋白的靶向结合,但不一定提供长内体再循环途径的接合。在一些情况下,当所述靶向配体与带电聚合物多肽结构域缀合时,所述带电聚合物多肽结构域与如sirna或质粒dna或mrna等核酸有效负载相互作用(例如,与其缩合)。在一些情况下,当所述靶向配体与带电聚合物多肽结构域缀合时,所述带电聚合物多肽结构域与蛋白质有效负载相互作用(例如,与其缩合)。在一些情况下,受试者递送分子的所述带电聚合物多肽结构域与有效负载(例如,核酸和/或蛋白质)相互作用并且存在于具有阴离子聚合物的组合物中(例如,所述递送分子可以与有效负载和阴离子聚合物都缩合)。在一些情况下,当所述靶向配体与带电聚合物多肽结构域缀合时,所述带电聚合物多肽结构域与纳米颗粒的带电稳定层(如二氧化硅、类肽、多半胱氨酸或磷酸钙涂层)例如以静电方式相互作用。附图说明当结合附图阅读时,从以下详细描述中可以最好地理解本发明。应强调的是,根据惯例,附图的各种特征不是按比例的。相反,为了清楚起见,各种特征的尺寸被任意扩大或缩小。附图中包含以下图:图1(图a-f)提供了受试者递送分子的示例配置的示意图。应注意,靶向配体可以在n-末端或c-末端(每个图的左侧)处缀合,但也可以在内部位置(每个图的右侧)处缀合。图a、c和e中的分子包含连接子而图b、d和f中的分子则不包含连接子。(图a-b)递送分子,其包含与有效负载缀合的靶向配体。(图c-d)递送分子,其包含与带电聚合物多肽结构域缀合的靶向配体,所述带电聚合物多肽结构域与纳米颗粒的带电稳定层以静电方式相互作用。(图e-f)递送分子,其包含与带电聚合物多肽结构域缀合的靶向配体,所述带电聚合物多肽结构域与核酸有效负载缩合。图2(图a-d)提供了受试者递送分子的示例配置的示意图。所描绘的靶向配体是毒蜥外泌肽(exendin)(具有s11c取代),参见seqidno:2)。示出了具有不同的缀合化学、具有及不具有连接子并且(通过连接子)与同纳米颗粒的带电稳定层(“阴离子型纳米颗粒表面”)以静电方式相互作用的带电聚合物多肽结构域缀合的实例。图2、图a提供了利用可还原的可切割二硫键毒蜥外泌肽-4(1-39)[cys11](seqidno:2)与核酸、蛋白质或核糖核蛋白缀合的缀合策略的实例。图2、图b提供了利用胺反应性键毒蜥外泌肽-4(1-39)[cys11]与核酸、蛋白质或核糖核蛋白缀合的缀合策略的实例。图2、图c提供了通过可还原的可切割二硫键毒蜥外泌肽-4(1-39)[cys11]与连接子缀合的缀合策略的实例,所述连接子与核酸、蛋白质或核糖核蛋白缀合(通过胺反应性结构域)。图2、图d提供了通过可还原的可切割二硫键毒蜥外泌肽-4(1-39)[cys11]与连接子缀合的缀合策略的实例,所述连接子与带电聚合物多肽结构域(描绘了9r序列)缀合,所述带电聚合物多肽结构域然后通过与纳米颗粒的带电稳定层(例如,二氧化硅、类肽、聚胱氨酸或磷酸钙涂层)以静电方式相互作用来涂覆纳米颗粒表面。图3提供了家族bgpcr的示意图,突出了在评估靶向配体时要考虑的单独结构域,例如,用于与变构/亲和力n-末端结构域和正构内体-分选/信号传导结构域结合。(图改编自siu,faiyiu等人,《自然(nature)》499.7459(2013):444-449)。图4提供了鉴别用于靶向配体的插入和/或取代(例如,用半胱氨酸残基)的内部氨基酸位置,使得维持亲和力并且靶向配体接合促进核酸释放并限制核酸降解的长内体再循环途径的实例。在这种情况下,靶向配体是毒蜥外泌肽-4并且氨基酸位置10、11和12被鉴别为用于可能的插入和/或取代(例如,用半胱氨酸残基,例如,s11c突变)的位点。图示出了模拟的毒蜥外泌肽-4(seqidno:1)与胰高血糖素-gcgr(4ers)以及glp1-glp1r-ecd复合物(pdb:3iol)的已知晶体结构的比对以及在3维空间中旋转的pdb渲染。图5示出了作为三元fgf2-fgfr1-肝素复合物(pdb上的1fq9)的一部分的tbfgf片段。确定cknggfflrihpdgrvdgvreks(突出显示的)(seqidno:43)对于fgfr1的亲和力是重要的。图6提供了用于确定hfkdpk(seqidno:5)是可以用于配体-受体正构活性和亲和力的肽的比对和pdb3d渲染。图7提供了用于确定lesnnynt(seqidno:6)是可以用于配体-受体正构活性和亲和力的肽的比对和pdb3d渲染。图8提供了具有有效负载:具有肽核酸(pna)结合位点的vwf-egfppdna的纳米颗粒上的缩合曲线。图9提供了具有有效负载:与hbbgrna复合的nls-cas9-nlsrnp的纳米颗粒上的缩合曲线。图10提供了具有有效负载:hbbgrna的纳米颗粒上的缩合曲线。图11提供了具有有效负载:hbbgrna的纳米颗粒上的缩合曲线。图12提供了具有有效负载:与hbbgrna复合的nls-cas9-nlsrnp的纳米颗粒上的缩合曲线。图13提供了具有有效负载:具有肽核酸(pna)结合位点的vwf-egfppdna的纳米颗粒上的缩合曲线。图14提供了具有有效负载:具有肽核酸(pna)结合位点的vwf-egfppdna的纳米颗粒上的缩合曲线。图15提供了具有有效负载:具有hbbgrna的nls-cas9-nls的rnp的纳米颗粒上的缩合曲线。图16提供了具有有效负载:具有肽核酸(pna)结合位点的vwf-egfppdna的纳米颗粒上的缩合曲线。图17提供了具有有效负载:cy5_egfpmrna的纳米颗粒上的缩合曲线。图18提供了具有有效负载:block-italexafluor555sirna的纳米颗粒上的缩合曲线。图19提供了具有有效负载:与hbbgrna复合的nls-cas9-egfprnp的纳米颗粒上的缩合曲线。图20提供了当使用具有alexa555block-itsirna作为有效负载的纳米颗粒时收集的数据。图21提供了当使用由nls-cas9-gfp和hbb引导rna形成的核糖核蛋白(rnp)作为有效负载的纳米颗粒时收集的数据。图22提供了当使用具有cy5egfpmrna作为有效负载的纳米颗粒时收集的数据。图23提供了当使用具有有效负载:具有cy5标记的肽核酸(pna)结合位点的vwf-egfppdna的纳米颗粒时收集的数据。图24提供了来自示出了通过加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100并且通过进一步向rnp中加入阳离子多肽来降低荧光强度的sybrgold排斥测定的数据。图25提供了来自示出了通过加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100并且通过进一步向sirna中加入阳离子多肽并且进一步加入sybrgold而引起的荧光强度变化的sybrgold排斥测定的数据。图26提供了来自示出了通过加入阳离子多肽组蛋白肽h2a,然后加入cd45_msiglec_(4gs)2_9r_c,并且通过进一步向具有hbbgrna和sybrgold的nls-cas9-egfp的rnp中加入ple100而引起的荧光强度变化的sybrgold排斥测定的数据。图27提供了来自示出了通过一起加入阳离子多肽组蛋白肽h4和cd45_msiglec_(4gs)2_9r_c,并且通过进一步向具有hbbgrna和sybrgold的nls-cas9-egfp的rnp中加入ple100而引起的荧光强度变化的sybrgold排斥测定的数据。图28提供了来自示出了通过加入阳离子多肽cd45_msiglec_(4gs)2_9r_c并且通过进一步向mrna中加入ple100而引起的荧光强度变化的sybrgold排斥测定的数据。图29提供了来自示出了通过加入组蛋白h4并且通过进一步向mrna中加入cd45-msiglec-(4gs)2_9r_c和ple100而引起的荧光强度变化的sybrgold排斥测定的数据。图30提供了来自示出了通过加入组蛋白h2a并且通过进一步向mrna中加入cd45-msiglec-(4gs)2_9r_c和ple100而引起的荧光强度变化的sybrgold排斥测定的数据。图31提供了来自示出了通过加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100而引起的荧光强度变化的来自嵌入vwf_egfppdna的sybrgold排斥测定的数据。图32提供了来自示出了通过加入组蛋白h4,然后加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100而引起的荧光强度变化的来自嵌入vwf_egfppdna的sybrgold排斥测定的数据。图33提供了来自示出了通过加入组蛋白h4,然后加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100而引起的荧光强度变化的来自嵌入vwf_egfppdna的sybrgold排斥测定的数据。图34(图a-c)提供了与复合物大小分布、二氧化硅涂覆大小和ζ电位分布以及配体涂覆的/官能化的颗粒大小和ζ电位分布有关的数据。图35提供了与支化组蛋白肽缀合物先导颗粒有关的数据。图36提供了与项目hsc.001.001(参见表4)相关的数据。图37提供了与项目hsc.001.002(参见表4)相关的数据。图38提供了与项目hsc.002.01(靶向配体-esellg_mesel_(4gs)2_9r_n)(参见表4)相关的数据。图39提供了与项目hsc.002.02(靶向配体-esellg_mesel_(4gs)2_9r_c)(参见表4)相关的数据。图40提供了与项目hsc.002.03(靶向配体-cd45_msiglec_(4gs)2_9r_c)(参见表4)相关的数据。图41提供了与项目hsc.002.04(靶向配体-cy5mrna-sio2-peg)(参见表4)相关的数据。图42提供了与项目blood.002.88(靶向配体-cd45_msiglec_(4gs)2_9r_c)(参见表4)相关的数据。图43提供了与项目blood.002.89(靶向配体-cd45_msiglec_(4gs)2_9r_c)(参见表4)相关的数据。图44提供了与项目blood.002.90(参见表4)相关的数据。图45提供了与项目blood.002.91(plr50)(参见表4)相关的数据。图46提供了与项目blood.002.92(靶向配体-cd45_msiglec_(4gs)2_9r_c)(参见表4)相关的数据。图47提供了与项目tcell.001.1(参见表4)相关的数据。图48提供了与项目tcell.001.3(参见表4)相关的数据。图49提供了与项目tcell.001.13(参见表4)相关的数据。图50提供了与项目tcell.001.14(参见表4)相关的数据。图51提供了与项目tcell.001.16(参见表4)相关的数据。图52提供了与项目tcell.001.18(参见表4)相关的数据。图53提供了与项目tcell.001.28(参见表4)相关的数据。图54提供了与项目tcell.001.29(参见表4)相关的数据。图55提供了与项目tcell.001.31(参见表4)相关的数据。图56提供了与项目tcell.001.33(参见表4)相关的数据。图57提供了与项目tcell.001.43(参见表4)相关的数据。图58提供了与项目tcell.001.44(参见表4)相关的数据。图59提供了与项目tcell.001.46(参见表4)相关的数据。图60提供了与项目tcell.001.48(参见表4)相关的数据。图61提供了与项目tcell.001.58(参见表4)相关的数据。图62提供了与项目tcell.001.59(参见表4)相关的数据。图63提供了与项目cynobm.002.82(参见表4)相关的数据。图64提供了与项目cynobm.002.83(参见表4)相关的数据。图65提供了与项目cynobm.002.84(参见表4)相关的数据。图66提供了与项目cynobm.002.85(参见表4)相关的数据。图67提供了与项目cynobm.002.86(参见表4)相关的数据。图68提供了与项目cynobm.002.76(参见表4)相关的数据。图69提供了与项目cynobm.002.77(参见表4)相关的数据。图70提供了与项目cynobm.002.78(参见表4)相关的数据。图71提供了与项目cynobm.002.79(参见表4)相关的数据。图72提供了与项目cynobm.002.80(参见表4)相关的数据。图73提供了与cynobm.002样品的未转染对照相关的数据。图74提供了与nls-cas9-egfpbcl11agrnarnp的脂质体crisprmax递送相关的数据。图75提供了与项目cynobm.002rnp-仅对照相关的数据(参见表4)。图76提供了与项目cynobm.002.82相关的数据(参见表4)。图77提供了与项目cynobm.002.83相关的数据(参见表4)。图78提供了与项目cynobm.002.84相关的数据(参见表4)。图79提供了与项目cynobm.002.85相关的数据(参见表4)。图80提供了与项目cynobm.002.86相关的数据(参见表4)。图81提供了与项目cynobm.002.75相关的数据(参见表4)。图82提供了与项目cynobm.002.76相关的数据(参见表4)。图83提供了与项目cynobm.002.77相关的数据(参见表4)。图84提供了与项目cynobm.002.78相关的数据(参见表4)。图85提供了与项目cynobm.002.79相关的数据(参见表4)。图86提供了与项目(参见表4)cynobm.002.80相关的数据。图87提供了与项目cynobm.002.81(参见表4)相关的数据。图88提供了cynobm.002rnp-仅对照的定性图像。图89提供了与项目hsc.004(参见表4)高含量筛选相关的数据。图90提供了与项目tcell.001(参见表4)高含量筛选相关的数据。图91提供了与项目tcell.001(参见表4)脂质体crisprmax对照相关的数据。图92提供了与项目tcell.001.1(参见表4)相关的数据。图93提供了与项目tcell.001.2(参见表4)相关的数据。图94提供了与项目tcell.001.3(参见表4)相关的数据。图95提供了与项目tcell.001.4(参见表4)相关的数据。图96提供了与项目tcell.001.5(参见表4)相关的数据。图97提供了与项目tcell.001.6(参见表4)相关的数据。图98提供了与项目tcell.001.7(参见表4)相关的数据。图99提供了与项目tcell.001.8(参见表4)相关的数据。图100提供了与项目tcell.001.9(参见表4)相关的数据。图101提供了与项目tcell.001.10(参见表4)相关的数据。图102提供了与项目tcell.001.11(参见表4)相关的数据。图103提供了与项目tcell.001.12(参见表4)相关的数据。图104提供了与项目tcell.001.13(参见表4)相关的数据。图105提供了与项目tcell.001.14(参见表4)相关的数据。图106提供了与项目tcell.001.15(参见表4)相关的数据。图107提供了与项目tcell.001(参见表4)的阴性对照相关的数据。图108提供了与项目blood.002(参见表4)相关的数据。图109提供了与项目tcell.001.27(参见表4)相关的数据。图110描绘了crisprrnp(可能的有效负载)的电荷密度图,其允许确定是否应添加阴离子或阳离子肽/材料以在蛋白质表面上形成稳定的带电层。图111描绘了睡美人转座子(sleepingbeautytransposons)(可能的有效负载)的电荷密度图,其允许确定是否应添加阴离子或阳离子肽/材料以在蛋白质表面上形成稳定的带电层。图112描绘了在(2)加入阳离子锚作为(2a)锚-连接子-配体或独立的阳离子锚,添加或不添加(2b)后续多层化学、多种核酸或带电治疗剂的共递送或通过交联进行层稳定之前的(1)锚定到crisprrnp表面上的阳离子位点的示例性阴离子肽(9-10个氨基酸长,大约按比例缩放到10nm直径的crisprrnp)。图113描绘了基于可以包含cas9rnp或任何均匀或两性离子带电表面的核心模板的添加顺序和静电基质组合物的实例。图114提供了与il2r结合的il2的模型结构。图115提供了单链cd3抗体片段的模型结构。图116提供了与n-乙酰神经氨酸(neu5ac)络合的唾液酸粘附素n-末端的模型结构。图117提供了干细胞因子(scf)的模型结构。图118提供了在ckit受体片段的合理设计期间产生的示例图像。图119提供了在ckit受体片段的合理设计期间产生的示例图像。图120提供了在ckit受体片段的合理设计期间产生的示例图像。图121提供了来自分析合理设计的ckit受体片段的圆二色性数据。图122描绘了合理设计的ckit受体片段的稳定构象的模型。图123描绘了其中htp与阳离子聚合物主链的侧链缀合的支化组蛋白结构的实例。右侧的聚合物代表前体主链分子并且左侧的分子是支化结构的片段的实例。具体实施方式如上所概述的,提供了用于将核酸、蛋白质和/或核糖核蛋白有效负载递送到细胞的方法和组合物。所提供的递送分子包含与蛋白质或核酸有效负载(例如,sirna分子)缀合或缀合到带电聚合物多肽结构域(例如,如9r等多聚精氨酸或如6h等多聚组氨酸等)的肽靶向配体。所述靶向配体提供(i)与细胞表面蛋白的靶向结合以及(ii)长内体再循环途径的接合。在描述本发明的方法和组合物之前,应理解本发明不限于所描述的特定方法或组合物,因此当然可以改变。还应理解,本文所使用的术语仅出于描述特定实施例的目的,而不旨在是限制性的,因为本发明的范围将仅由所附的权利要求限制。在提供了值的范围的情况下,应理解,也具体地公开了所述范围的上限与下限之间的至下限的第十个单位(除非上下文明确另外指出)的每个中间值。在所陈述的范围内的任何所述值或中间值与所陈述的范围内的任何其它所陈述的值或中间值之间的每个较小范围包含在本发明内。这些较小范围的上限和下限可独立地包含或排除在所述范围内,并且在较小的范围内包含任一限制、不包含两个限制或包含两个限制的每个范围也包含在本发明内,遵从在所述范围中任何具体排除的限制。在所陈述的范围包含限制中的一者或两者的情况下,排除了那些所包含限制中的任一者或两者的范围也包含在本发明之内。除非另外定义,否则本文使用的所有技术术语和科学术语具有与本发明所属领域的普通技术人员通常所理解的含义相同的含义。虽然类似或等效于本文所描述的那些方法和材料的任何方法和材料均可以用于实践或测试本发明,但是现在描述了一些潜在的以及优选的方法和材料。本文所提及的所有公开是通过引用并入本文,以公开和描述与所引用的公开相关的方法和/或材料。应理解,在存在矛盾的情况,本公开取代并入的出版物的任何公开内容。如对于本领域技术人员而言将显而易见的是,在阅读本公开时,本文所描述和展示的单独实施例中的每一个都具有离散的组成部分和特征,所述组成部分和特征可以在不偏离本发明的范围或精神的情况下易于与任何其它一些实施例的特征分离或组合。任何叙述的方法可以以所叙述事件的顺序或以逻辑上可能的任何其它顺序进行。必须注意,除非上下文另外明确指示,否则如在本文和所附权利要求书中所使用的,单数形式“一个/一种(a/an)”和“所述(the)”包含复数指代物。因此,例如,提及“细胞”时包含多个这种细胞并且提及“所述核酸内切酶”时包含提及本领域技术人员已知的一个/种或多个/种核酸内切酶及其等同物等。应当进一步指出,权利要求书可以撰写成排除任何要素(例如,任何任选的要素)。因此,该陈述旨在用作使用与权利要求要素的叙述有关的如“单独”、“仅”等排他性术语或者使用“否定型”限制的前置基础。本文所讨论的出版物仅被提供用于在本申请的提交日之前对其进行公开。本文中的任何内容都不应被解释为承认本发明无权先于该出版物公开。进一步地,所提供的出版日期可能与实际的出版日期不同,实际的出版日期可能需要独立地确认。方法和组合物一旦内吞,跨膜细胞表面蛋白可以通过至少两种不同的路径返回细胞表面:直接通过“短循环”分选核内体或者间接穿过构成“长循环”的核周再循环内体。因此,至少三种不同的途径从核内体区室分散到不同的目的地:溶酶体(降解途径)、核周再循环区室(‘长循环’;或‘长’、‘间接’或‘慢’核内体再循环途径)或者直接到血浆膜(‘短循环’;或‘短’、‘直接’、或‘快’核内体再循环途径)。迄今为止,尚未注意到(a)结合亲和力;(b)信号传导偏差/功能选择性以及(c)特定核内体分选途径在选择用于介导有效递送以及例如细胞内核酸的表达的适当的靶向配体时的组合作用。提供了递送分子,其包含与蛋白质或核酸有效负载缀合或者与带电聚合物多肽结构域缀合的肽靶向配体。所述靶向配体提供(i)与细胞表面蛋白的靶向结合以及(ii)长内体再循环途径的接合。在一些情况下,当所述靶向配体与带电聚合物多肽结构域缀合时,所述带电聚合物多肽结构域与核酸有效负载相互作用(例如,与所述核酸有效负载缩合)。在一些情况下,所述靶向配体通过间插连接子缀合。关于不同可能的缀合策略(即,受试者递送分子的组分的不同可能的布置)的实例参照图1和图2。在一些情况下,所述靶向配体提供与细胞表面蛋白的靶向结合,但不一定提供长内体再循环途径的接合。因此,还提供了递送分子,其包含与蛋白质或核酸有效负载缀合或者与带电聚合物多肽结构域缀合的肽靶向配体,其中靶向配体提供与细胞表面蛋白的靶向结合(但不一定提供长内体再循环途径的接合)。在一些情况下,本文公开的递送分子被设计成使得核酸或蛋白质有效负载到达其细胞外靶标(例如,通过提供与细胞表面蛋白的靶向结合)并且优先地不在溶酶体内被破坏或者被螯合到‘短’内体再循环核内体中。相反,本公开的递送分子可以提供“长”(间接/慢)内体再循环途径的接合,所述长内体再循环途径的接合可以允许内体逃逸和/或与细胞器的内体融合。例如,在一些情况下,β-抑制蛋白被接合成介导七-跨膜gpcr的切割(mcgovern等人,《实验药理学手册(handbexppharmacol)》2014;219:341-59;goodman等人,《自然》1996年10月3日;383(6599):447-50;zhang等人,《生物化学期刊(jbiolchem)》1997年10月24日;272(43):27005-14)和/或来自肌动蛋白细胞骨架的单跨膜受体酪氨酸激酶(rtk)(例如,在内吞作用期间)触发期望的内体分选途径。因此,在一些实施例中,本公开的递送分子的靶向配体在结合所述细胞表面蛋白时提供β-抑制蛋白的接合(例如,以提供信号传导偏差并且通过正构结合后的内吞作用促进内化)。靶向配体各种各样的靶向配体可以用作受试者递送分子的一部分,并且设想了多种不同的靶向配体。在一些实施例中,所述靶向配体是野生型蛋白质的片段(例如,结合结构域)。例如,受试者递送分子的肽靶向配体可以具有4-50个氨基酸(例如,4-40个、4-35个、4-30个、4-25个、4-20个、4-15个、5-50个、5-40个、5-35个、5-30个、5-25个、5-20个、5-15个、7-50个、7-40个、7-35个、7-30个、7-25个、7-20个、7-15个、8-50个、8-40个、8-35个、8-30个、8-25个、8-20个或8-15个氨基酸)的长度。靶向配体可以是野生型蛋白质的片段,但在一些情况下,所述靶向配体相对于野生型氨基酸序列具有突变(例如,插入、缺失、取代)(即,相对于对应的野生型蛋白质序列的突变)。例如,靶向配体可以包含增加或减少与靶细胞表面蛋白的结合亲和力的突变。在一些情况下,靶向配体可以包含添加半胱氨酸残基的突变,所述突变可以促进与连接子、蛋白质或核酸有效负载和/或带电聚合物多肽结构域缀合的策略。例如,半胱氨酸可以用于通过巯基化学(例如,二硫键)和/或胺反应性化学与核酸(例如,sirna)和蛋白质交联(缀合)。在一些情况下,靶向配体包含内部半胱氨酸残基。在一些情况下,靶向配体在n-末端和/或c-末端处包含半胱氨酸残基。在一些情况下,为了包含半胱氨酸残基,靶向配体相对于对应的野生型序列发生突变(例如,插入或取代)。因此,使用半胱氨酸残基(例如,内部、n-末端或c-末端的插入或用半胱氨酸残基取代),本文所描述的任何靶向配体可以用上文的任何插入和/或取代进行修饰。所谓“对应的”野生型序列是指从中衍生或可能已经衍生出受试者序列的野生型序列(例如,与目的序列具有高度序列同一性的野生型蛋白质序列)。例如,对于具有一个或多个突变(例如,取代、插入)但反之与野生型序列高度相似的靶向配体,与所述靶向配体最相似的氨基酸序列可以被视作是对应的野生型氨基酸序列。对应的野生型蛋白质/序列不必是100%相同的(例如,可以是85%或更多相同的、90%或更多相同的、95%或更多相同的、98%或更多相同的、99%或更多相同的等)(在被修饰的一个或多个位置的外部),但靶向配体以及对应的野生型蛋白质(例如,野生型蛋白质的片段)可以与预期的细胞表面蛋白结合,并且保持足够使它们可以被视作是同源的序列同一性(被修饰的区域的外部)。可以使用任何方便的方法(例如,使用如blast、muscle、t-coffee等任何方便的序列比较/比对软件)鉴别/评估“对应的”野生型蛋白质序列的氨基酸序列。可以用作受试者递送分子的一部分的靶向配体的实例包含但不限于表1中列出的那些靶向配体。可以用作受试者递送分子的一部分的靶向配体的实例包含但不限于表2中列出的那些靶向配体(表2中列出的多个序列包含通过连接子(例如,ggggsggggs)与阳离子多肽结构域(例如,9r、6r等)缀合的靶向配体(例如,第2行的snrwldvk)。可以包含在靶向配体中的氨基酸序列的实例包含但不限于:npkltrmltfkfy(seqidno:xx)(il2)、tsvgkypntgyygd(seqidno:xx)(cd3)、snrwldvk(siglec)、ekfilkvrpafkav(seqidno:xx)(scf);ekfilkvrpafkav(seqidno:xx)(scf)、ekfilkvrpafkav(seqidno:xx)(scf)、snysiidklvnivddlvecvkens(seqidno:xx)(ckit)和ac-snysaibadkaibanaibaddaibaeaibakens(seqidno:xx)(ckit)。因此,在一些情况下,靶向配体包含与npkltrmltfkfy(seqidno:xx)(il2)、tsvgkypntgyygd(seqidno:xx)(cd3)、snrwldvk(siglec)、ekfilkvrpafkav(seqidno:xx)(scf);ekfilkvrpafkav(seqidno:xx)(scf)、ekfilkvrpafkav(seqidno:xx)(scf)或snysiidklvnivddlvecvkens(seqidno:xx)(ckit)具有85%或更高(例如,90%或更高、95%或更高、98%或更高、99%或更高或者100%)的序列同一性的氨基酸序列。表1.靶向配体的实例受试者递送分子的靶向配体可以包含氨基酸序列rgd和/或与seqidno:1-12中任一个所示氨基酸序列具有85%或更高的序列同一性(例如,90%或更高、95%或更高、97%或更高、98%或更高、99%或更高、99.5%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,受试者递送分子的靶向配体包含氨基酸序列rgd和/或seqidno:1-12中任一个所示氨基酸序列。在一些实施例中,受试者递送分子的靶向配体可以包含半胱氨酸(内部、c-末端或n-末端),并且还可以包含氨基酸序列rgd和/或与seqidnos:1-12中的任一个所示氨基酸序列具有85%或更高的序列同一性(例如,90%或更高、95%或更高、97%或更高、98%或更高、99%或更高、99.5%或更高或者100%的序列同一性)的氨基酸序列。本文使用术语“靶标”和“靶向结合”以指代特异性结合。术语“特异性结合(specificbinding)”、“特异性结合(specificallybinds)”等是指相对于溶液或反应混合物中的其它分子或部分的与分子的非共价或共价优先结合(例如,特异性结合相对于其它可用多肽的特定多肽的抗体或特异性结合相对于其它可用受体的特定受体的配体)。在一些实施例中,一个分子对其特异性结合的另一个分子的亲和力由10-5m或更低(例如,10-6m或更低、10-7m或更低、10-8m或更低、10-9m或更低、10-10m或更低、10-11m或更低、10-12或更低、10-13或更低、10-14或更低、10-15或更低或10-16m或更低)的kd(离解常数)表征。“亲和力”是指结合强度,增加的结合亲和力与较低的kd相关。在一些情况下,所述靶向配体提供与选自家族bg-蛋白偶联受体(gpcr)、受体酪氨酸激酶(rtk)、细胞表面糖蛋白以及细胞-细胞粘附分子的细胞表面蛋白的靶向结合。在受体对接时考虑配体的空间布置可以用于实现适当的期望的功能选择性和内体分选偏差,例如,使得配体与靶标之间的结构功能关系不会由于靶向配体与有效负载或带电聚合物多肽结构域的缀合而被破坏。例如,与核酸、蛋白质、核糖核蛋白或带电聚合物多肽结构域缀合可能潜在地干扰一个或多个结合裂缝。因此,在一些情况下,当与其配体结合的期望靶标(细胞表面蛋白)的晶体结构可用时(或者当这种结构可用于相关蛋白质时),可以使用3d结构建模和序列线程来可视化在配体与靶标之间相互作用的位点。这可以促进例如选择内部位点以放置(例如,半胱氨酸残基的)取代和/或插入。作为实例,在一些情况下,所述靶向配体提供与家族bg蛋白偶联受体(gpcr)(也称为‘分泌素家族’)的结合。在一些情况下,所述靶向配体提供与家族bgpcr的变构-亲和结构域和正构结构域的结合以分别提供靶向结合和长内体再循环途径的接合(参见,例如,下文的实例部分以及图3和图4)。g蛋白偶联受体(gpcr)共享共同的分子结构(具有七个推定的跨膜片段)和共同的信号传导机制,因为所述g蛋白偶联受体与g蛋白(异源三聚体gtp酶)相互作用以调节如环amp、肌醇磷酸盐、二酰基甘油和钙离子等细胞内第二信使的合成。gpcr的家族b(分泌素受体家族或‘家族2’)是小的但结构和功能多样化的蛋白质组,所述gpcr的家族b包含多肽激素的受体和被认为介导质膜处的细胞间相互作用的分子(参见,例如,harmar等人,《基因组生物学(genomebiol)》2001;2(12):reviews3013)。与分泌素受体家族的成员有关的结构生物学已经取得了重要的进展,所述进展包含其n-末端的若干个晶体结构的发表、有或没有结合配体,这些工作扩展了对配体结合的理解并且为基于结构的配体设计提供了有用平台(参见例如,poyner等人,《英国药理学杂志(brjpharmacol)》2012年5月;166(1):1-3)。例如,通过使用毒蜥外泌肽-4配体或其衍生物,可能期望使用受试者递送分子靶向胰腺细胞表面蛋白glp1r(例如,靶向β-胰岛)。在这种情况下,可以通过使用pdb3维渲染比对毒蜥外泌肽-4氨基酸序列(hgegtftsdlskqmeeeavrlfiewlknggpssgappps(seqidno.1))与胰高血糖素-gcgr(4ers)和glp1-glp1r-ecd复合物(pdb:3iol)的晶体结构来鉴别用于半胱氨酸取代和/或插入(例如,用于缀合到核酸有效负载)的氨基酸,所述pdb3维渲染可以在3d空间中旋转以预测交联的复合物必须面向以免破坏所述两个结合裂缝的方向(参见例如,下文的实例部分以及图3和图4)。当靶向配体(靶向家族bgpcr)的理想交联位点(例如,用于半胱氨酸残基的取代/插入的位点)与对应受体的两个结合裂缝充分正交时,高亲和力结合可以发生以及伴随着长内体再循环途径螯合(例如,用于最佳的有效负载释放)。在一些情况下,受试者递送分子包含靶向配体,所述靶向配体包含与毒蜥外泌肽-4氨基酸序列(seqidno:1)具有85%或更高(例如,90%或更高、95%或更高、98%或更高、99%或更高或者100%)的同一性的氨基酸序列。在一些这种情况下,所述靶向配体在对应于seqidno:1所示氨基酸序列的l10、s11和k12的一个或多个位置处包含半胱氨酸取代或插入。在一些情况下,所述靶向配体在对应于seqidno:1所示氨基酸序列的s11的位置处包含半胱氨酸取代或插入。在一些情况下,受试者递送分子包含靶向配体,所述靶向配体包含具有毒蜥外泌肽-4氨基酸序列(seqidno:1)的氨基酸序列。作为另一个实例,在一些情况下,根据本公开的靶向配体提供与如成纤维细胞生长因子(fgf)受体(fgfr)等受体酪氨酸激酶(rtk)的结合。因此,在一些情况下,所述靶向配体是fgf的片段(即,包括fgf的氨基酸序列)。在一些情况下,所述靶向配体与在正构结合期间被占据的所述rtk的片段结合(例如,参见以下的实例部分)。在一些情况下,所述靶向配体结合所述rtk的肝素-亲和结构域。在一些情况下,所述靶向配体提供与fgf受体的靶向结合并且包括与氨基酸序列knggfflrihpdgrvdgvreks(seqidno:4)具有85%或更高的序列同一性(例如,90%或更高、95%或更高、97%或更高、98%或更高、99%或更高、99.5%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,所述靶向配体提供与fgf受体的靶向结合并且包括如seqidno:4所示氨基酸序列。在一些情况下,占据rtk的正构位点的小结构域(例如,长度为5-40个氨基酸)可以用于接合与rtk的核分选(例如,fgfr)相关的内吞途径而不接合细胞增殖以及原始致癌信号级联,所述小结构域可以是天然生长因子配体所特有的。例如,截短的bfgf(tbfgf)肽(a.a.30-115)含有bfgf受体结合位点和肝素结合位点的一部分,并且该肽可以在不刺激细胞增殖的情况下有效地结合细胞表面上的fgfr。tbfgf的序列是krlycknggfflrihpdgrvdgvreksdphiklql-qaeergvvsikgvcanrylamkedgrllaskcvtdecffferlesnnynty(seqidno:13)(参见例如,cai等人,《国际药学杂志(intjpharm)》2011年4月15日;408(1-2):173-82)。在一些情况下,所述靶向配体提供与fgf受体的靶向结合并且包括氨基酸序列hfkdpk(seqidno:5)(参见,例如,下文的实例部分)。在一些情况下,所述靶向配体提供与fgf受体的靶向结合,并且包括氨基酸序列lesnnynt(seqidno:6)(参见,例如,下文的实例部分)。在一些情况下,根据本公开的靶向配体提供与细胞表面糖蛋白的靶向结合。在一些情况下,所述靶向配体提供与细胞-细胞粘附分子的靶向结合。例如,在一些情况下,所述靶向配体提供与cd34的靶向结合,cd34是作为细胞-细胞粘附因子起作用的细胞表面糖蛋白,并且是在造血干细胞(例如,骨髓)上发现的蛋白质。在一些情况下,所述靶向配体是如e-选择蛋白、l-选择蛋白或p-选择蛋白等选择蛋白的片段(例如,在选择蛋白的前40个氨基酸中发现的信号肽)。在一些情况下,受试者靶向配体包含选择蛋白(例如,e-选择蛋白、l-选择蛋白、p-选择蛋白)的sushi结构域。在一些情况下,所述靶向配体包括与氨基酸序列miasqflsaltlvllikesga(seqidno:7)具有85%或更高的序列同一性(例如,90%或更高、95%或更高、97%或更高、98%或更高、99%或更高、99.5%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,所述靶向配体包括如seqidno:7所示氨基酸序列。在一些情况下,所述靶向配体包括与氨基酸序列mvfpwrcegtywgsrnilklwvwtllccdflihhgthc(seqidno:8)具有85%或更高的序列同一性(例如,90%或更高、95%或更高、97%或更高、98%或更高、99%或更高、99.5%或更多或者100%的序列同一性)的氨基酸序列。在一些情况下,所述靶向配体包括如seqidno:8所示氨基酸序列。在一些情况下,所述靶向配体包括与氨基酸序列mifpwkcqstqrdlwnifklwgwtmlccdflahhgtdc(seqidno:9)具有85%或更高的序列同一性(例如,90%或更高、95%或更高、97%或更高、98%或更高、99%或更高、99.5%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包括如seqidno:9所示氨基酸序列。在一些情况下,靶向配体包括与氨基酸序列mifpwkcqstqrdlwnifklwgwtmlcc(seqidno:10)具有85%或更高的序列同一性(例如,90%或更高、95%或更高、97%或更高、98%或更高、99%或更高、99.5%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包括如seqidno:10所示氨基酸序列。可以用作受试者靶向配体的选择蛋白的片段(例如,在选择蛋白的前40个氨基酸中发现的信号肽)可以在一些情况下获得与特异性修饰的唾液酸蛋白的强结合,例如,各种唾液酸化的路易斯x修饰/细胞外cd34的o-唾液酸化可以导致p-选择蛋白、l-选择蛋白和e-选择蛋白对骨髓、淋巴、脾和扁桃体区室的不同亲和力。相比之下,在一些情况下,靶向配体可以是cd34的细胞外部分。在一些这种情况下,可以利用配体的唾液酸化的修饰将靶向配体差异地靶向到各种选择蛋白。在一些情况下,根据本公开的靶向配体提供与转铁蛋白受体的靶向结合。在一些这种情况下,所述靶向配体包括与氨基酸序列thrppmwspvwp(seqidno:11)具有85%或更高的序列同一性(例如,90%或更高、95%或更高、97%或更高、98%或更高、99%或更高、99.5%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包括如seqidno:11所示氨基酸序列。在一些情况下,根据本公开的靶向配体提供与整合蛋白(例如,α5β1整合蛋白)的靶向结合。在一些这种情况下,所述靶向配体包括与氨基酸序列rretawa(seqidno:12)具有85%或更高的序列同一性(例如,90%或更高、95%或更高、97%或更高、98%或更高、99%或更高、99.5%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,靶向配体包括如seqidno:12所示氨基酸序列。在一些情况下,所述靶向配体包括氨基酸序列rgd。还提供了具有两种不同肽序列的递送分子,所述递送分子一起构成靶向配体。例如,在一些情况下,靶向配体是二价的(例如,异二价的)。在一些情况下,细胞穿透肽和/或硫酸肝素蛋白多糖结合配体与本公开的任何靶向配体一起用作异二价内吞触发物。异二价靶向配体可以包含来自靶向配体中的一个靶向配体的亲和序列以及来自不同靶向配体的正构结合序列(例如,已知与期望的内吞运输途径接合的一个正构结合序列)。缀合伙伴/有效负载核酸有效负载在一些实施例中,本公开的递送分子的靶向配体与核酸有效负载缀合(参见,例如,图1、图a-b)。在一些实施例中,本公开的递送分子与核酸有效负载缩合(以静电方式相互作用)。核酸有效负载可以是任何目的核酸,例如,核酸有效负载可以是线性的或环状的,并且可以是质粒、病毒基因组、rna、dna等。在一些情况下,核酸有效负载是rnai剂或编码rnai剂的dna模板,其中所述rnai剂可以是例如shrna或sirna。在一些情况下,核酸有效负载是sirna分子。在一些实施例中,本公开的递送分子的靶向配体与蛋白质有效负载缀合,并且在一些情况下,所述靶向配体与核糖核蛋白复合物缀合(例如,通过与蛋白质组分缀合或者与复合物的rna组分缀合)。缀合可以通过任何方便的技术完成并且多种不同的缀合化学将是本领域普通技术人员所知晓的。在一些情况下,缀合是通过巯基化学(例如,二硫键)。在一些情况下,使用胺反应性化学完成缀合。在一些情况下,靶向配体包含半胱氨酸残基并且通过半胱氨酸残基与核酸有效负载缀合。术语“核酸有效负载”包含修饰的核酸。同样,术语“rnai剂”和“sirna”包含修饰的核酸。例如,核酸分子可以是模拟物;可以包含修饰的糖骨架、一个或多个修饰的核苷间连接(例如,一个或多个硫代磷酸酯和/或杂原子核苷间连接)、一个或多个修饰的碱基等。受试者核酸有效负载(例如,sirna)可以具有吗啉代骨架结构。在一些情况下,受试者核酸有效负载(例如,sirna)可以具有一个或多个锁核酸(lna)。合适的糖取代基包含甲氧基(-o-ch3)、氨基丙氧基(--och2ch2ch2nh2)、烯丙基(-ch2-ch=ch2)、-o-烯丙基(--o--ch2—ch=ch2)以及氟(f)。2'-糖取代基可以在阿拉伯糖(上)位置或核糖(下)位置。合适的碱基修饰包含合成核碱基和天然核碱基,如5-甲基胞嘧啶(5-me-c);5-羟甲基胞嘧啶;黄嘌呤;次黄嘌呤;2-氨基腺嘌呤;腺嘌呤和鸟嘌呤的6-甲基和其它烷基衍生物;腺嘌呤和鸟嘌呤的2-丙基和其它烷基衍生物;2-硫尿嘧啶;2-硫代胸腺嘧啶和2-硫胞嘧啶;5-卤代尿嘧啶和胞嘧啶;5-丙炔基(-c=c-ch3)尿嘧啶和胞嘧啶以及其它嘧啶碱基的炔基衍生物;6-偶氮尿嘧啶;胞嘧啶和胸腺嘧啶;5-尿嘧啶(假尿嘧啶);4-硫尿嘧啶;8-卤素;8-氨基;8-硫醇;8-硫代烷基;8-羟基和其它8-取代腺嘌呤和鸟嘌呤;5-卤基尤其是5-溴、5-三氟甲基和其它5-取代尿嘧啶和胞嘧啶;7-甲基鸟嘌呤和7-甲基腺嘌呤;2-f-腺嘌呤;2-氨基腺嘌呤;8-氮鸟嘌呤和8-氮杂腺嘌呤;7-脱氮鸟嘌呤和7-脱氮腺嘌呤;以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。进一步修饰的核碱基包含三环嘧啶,如吩恶嗪胞苷(1h-嘧啶并(5,4-b)(1,4)苯并恶嗪-2(3h)-酮);吩噻嗪胞苷(1h-嘧啶并(5,4-b)(1,4)苯并噻嗪-2(3h)-酮);g-钳位,如取代的吩恶嗪胞苷(例如9-(2-氨基乙氧基)-h-嘧啶并(5,4-(b)(1,4)苯并恶嗪-2(3h)-酮);咔唑胞苷(2h-嘧啶并(4,5-b)吲哚-2-酮);吡啶并吲哚胞苷(h-吡啶并(3',2':4,5)吡咯并(2,3-d)嘧啶-2-酮)。在一些情况下,核酸有效负载可以包含缀合物部分(例如,增强寡核苷酸的活性、细胞分布或细胞摄取的一个缀合物部分)。这些部分或缀合物可以包含与如伯羟基基团或仲羟基基团等官能团共价结合的缀合物基团。缀合物基团包含但不限于嵌入剂、报告分子、聚胺、聚酰胺、聚乙二醇、聚醚、提高寡聚物的药效性质的基团以及提高寡聚物的药代动力学性质的基团。合适的缀合物基团包含但不限于胆固醇、脂质、磷脂、生物素、吩嗪、叶酸、菲啶、蒽醌、吖啶、荧光素、罗丹明、香豆素以及染料。提高药效性质的基团包含改善摄取、提高抗降解性和/或增强与靶核酸的序列特异性杂交的基团。增强药代动力学性质的基团包含改善受试者核酸的摄取、分布、代谢或排泄的基团。带电聚合物多肽结构域在一些情况下,受试者递送分子的靶向配体与带电聚合物多肽结构域(阳离子锚定结构域)缀合(参见,例如,图1、图c-f)。带电聚合物多肽结构域可以包含重复的阳离子残基(例如,精氨酸、赖氨酸、组氨酸)。在一些情况下,阳离子锚定结构域的长度范围为3到30个氨基酸(例如,3-28个、3-25个、3-24个、3-20个、4-30个、4-28个、4-25个、4到24个或4-20个氨基酸;或例如,4-15个、4-12个、5-30个、5-28个、5-25个、5-20个、5-15个、5-12个氨基酸)。在一些情况下,阳离子锚定结构域的长度范围为4到24个氨基酸。带电聚合物多肽结构域的合适的实例包含但不限于:rrrrrrrrr(9r)(seqidno:15)和hhhhhh(6h)(seqidno:16)。带电聚合物多肽结构域(阳离子锚定结构域)可以是任何方便的阳离子带电结构域。例如,这种结构域可以是组蛋白尾肽(htp)。在一些情况下,所述带电聚合物多肽结构域包含组蛋白和/或组蛋白尾肽(例如,阳离子多肽可以是组蛋白和/或组蛋白尾肽)。在一些情况下,所述带电聚合物多肽结构域包含含有nls的肽(例如,阳离子多肽可以是含有nls的肽)。在一些情况下,所述带电聚合物多肽结构域包含含有线粒体定位信号的肽(例如,阳离子多肽可以是包含线粒体定位信号的肽)。在一些情况下,受试者递送分子的带电聚合物多肽结构域用作递送分子与有效负载(例如,核酸有效负载和/或蛋白质有效负载)相互作用(例如,以静电方式相互作用,例如,用于缩合)的途径。在一些情况下,受试者递送分子的带电聚合物多肽结构域用作锚以用递送分子涂覆纳米颗粒表面,例如,使得靶向配体用于将纳米颗粒靶向到期望的细胞/细胞表面蛋白质(参见,例如,图1、图c-d)。因此,在一些情况下,带电聚合物多肽结构域与纳米颗粒的带电稳定层以静电方式相互作用。例如,在一些情况下,纳米颗粒包含被稳定层(例如,二氧化硅、类肽、多半胱氨酸或磷酸钙涂层)包围的核心(例如,包含核酸、蛋白质和/或核糖核蛋白复合物有效负载)。在一些情况下,稳定层具有负电荷并且因此带正电荷的聚合物多肽结构域可以与稳定层相互作用,有效地将递送分子锚定到纳米颗粒并且用受试者靶向配体涂覆纳米颗粒表面(参见,例如,图1、图c和d)。缀合可以通过任何方便的技术完成并且多种不同的缀合化学将是本领域普通技术人员所知晓的。在一些情况下,缀合是通过巯基化学(例如,二硫键)。在一些情况下,使用胺反应性化学完成缀合。在一些情况下,靶向配体和带电聚合物多肽结构域由于是相同多肽的一部分而缀合。在一些情况下,带电聚合物多肽结构域(阳离子)可以包含选自以下的聚合物:聚(精氨酸)(pr)、聚(赖氨酸)(pk)、聚(组氨酸)(ph)、聚(鸟氨酸)、聚(瓜氨酸)及其组合。在一些情况下,给定的阳离子氨基酸聚合物可以包含精氨酸、赖氨酸、组氨酸、鸟氨酸和瓜氨酸残基的混合(以任何方便的组合形式)。聚合物可以作为l-异构体或d-异构体的聚合物存在,其中d-异构体在靶细胞中更稳定,因为它们需要更长的时间来降解。因此,包含d-异构体聚(氨基酸)延迟了降解(以及随后的有效负载释放)。因此有效负载释放速率可以被控制并且与d-异构体的聚合物与l-异构体的聚合物的比例成比例,其中d-异构体与l-异构体的较高比例增加了有效负载释放的持续时间(即,降低释放速率)。换句话说,d-异构体和l-异构体的相对量可以调节释放动力学以及对降解和有效负载释放的酶促敏感性。在一些情况下,阳离子聚合物包含阳离子氨基酸聚合物(例如,聚(精氨酸)(pr)、聚(赖氨酸)(pk)、聚(组氨酸)(ph)、聚(鸟氨酸)、聚(瓜氨酸))的d-异构体和l-异构体。在一些情况下,d-异构体与l-异构体的比例范围为10:1-1:10(例如,8:1-1:10、6:1-1:10、4:1-1:10、3:1-1:10、2:1-1:10、1:1-1:10、10:1-1:8、8:1-1:8、6:1-1:8、4:1-1:8、3:1-1:8、2:1-1:8、1:1-1:8、10:1-1:6、8:1-1:6、6:1-1:6、4:1-1:6、3:1-1:6、2:1-1:6、1:1-1:6、10:1-1:4、8:1-1:4、6:1-1:4、4:1-1:4、3:1-1:4、2:1-1:4、1:1-1:4、10:1-1:3、8:1-1:3、6:1-1:3、4:1-1:3、3:1-1:3、2:1-1:3、1:1-1:3、10:1-1:2、8:1-1:2、6:1-1:2、4:1-1:2、3:1-1:2、2:1-1:2、1:1-1:2、10:1-1:1、8:1-1:1、6:1-1:1、4:1-1:1、3:1-1:1或2:1-1:1)。因此,在一些情况下,阳离子聚合物包含第一阳离子聚合物(例如,氨基酸聚合物),所述第一阳离子聚合物是d-异构体的聚合物(例如,选自聚(d-精氨酸)、聚(d-赖氨酸)、聚(d-组氨酸)、聚(d-鸟氨酸)和聚(d-瓜氨酸));并且包含第二阳离子聚合物(例如,氨基酸聚合物),所述第二阳离子聚合物是l-异构体的聚合物(例如,选自聚(l-精氨酸)、聚(l-赖氨酸)、聚(l-组氨酸)、聚(l-鸟氨酸)和聚(l-瓜氨酸))。在一些情况下,第一阳离子聚合物(d-异构体)与第二阳离子聚合物(l-异构体)的比例范围为10:1-1:10(例如,8:1-1:10、6:1-1:10、4:1-1:10、3:1-1:10、2:1-1:10、1:1-1:10、10:1-1:8、8:1-1:8、6:1-1:8、4:1-1:8、3:1-1:8、2:1-1:8、1:1-1:8、10:1-1:6、8:1-1:6、6:1-1:6、4:1-1:6、3:1-1:6、2:1-1:6、1:1-1:6、10:1-1:4、8:1-1:4、6:1-1:4、4:1-1:4、3:1-1:4、2:1-1:4、1:1-1:4、10:1-1:3、8:1-1:3、6:1-1:3、4:1-1:3、3:1-1:3、2:1-1:3、1:1-1:3、10:1-1:2、8:1-1:2、6:1-1:2、4:1-1:2、3:1-1:2、2:1-1:2、1:1-1:2、10:1-1:1、8:1-1:1、6:1-1:1、4:1-1:1、3:1-1:1或2:1-1:1)。在一些实施例中,阳离子聚合物包含(例如,除阳离子聚合物的任何前述实例之外或代替阳离子聚合物的任何前述实例)聚(乙烯亚胺);聚(酰氨基胺)(pamam);聚(天冬酰胺);多肽(例如,用于形成用于核心缩合的“蜘蛛网”状支);电荷官能化聚酯;阳离子多糖;乙酰化氨基糖;脱乙酰壳多糖或包括其任何组合的阳离子聚合物(例如,以线性或支化的形式)。在一些实施例中,阳离子聚合物可以具有的分子量范围为1-200kda(例如,1-150kda、1-100kda、1-50kda、5-200kda、5-150kda、5-100kda、5-50kda、10-200kda、10-150kda、10-100kda、10-50kda、15-200kda、15-150kda、15-100kda或15-50kda)。作为实例,在一些情况下,阳离子聚合物包含例如分子量为约29kda的聚(l-精氨酸)。作为另一个实例,在一些情况下,阳离子聚合物包含分子量为约25kda(pei)的线性聚(乙烯亚胺)。作为另一个实例,在一些情况下,阳离子聚合物包含分子量为约10kda的支化聚(乙烯亚胺)。作为另一个实例,在一些情况下,阳离子聚合物包含分子量为约70kda的支化聚(乙烯亚胺)。在一些情况下,阳离子聚合物包含pamam。在一些情况下,阳离子氨基酸聚合物包含半胱氨酸残基,所述半胱氨酸残基可以促进例如与连接子、nls和/或阳离子多肽(例如,组蛋白或htp)的缀合。例如,半胱氨酸残基可以用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。因此,在一些实施例中,阳离子聚合物组合物的阳离子氨基酸聚合物(例如,聚(精氨酸)(pr);聚(赖氨酸)(pk);聚(组氨酸)(ph);聚(鸟氨酸)和聚(瓜氨酸);聚(d-精氨酸)(pdr);聚(d-赖氨酸)(pdk);聚(d-组氨酸)(pdh);聚(d-鸟氨酸)和聚(d-瓜氨酸);聚(l-精氨酸)(plr);聚(l-赖氨酸)(plk);聚(l-组氨酸)(plh);聚(l-鸟氨酸)和聚(l-瓜氨酸))包含半胱氨酸残基。在一些情况下,所述阳离子氨基酸聚合物在n-末端和/或c-末端上包含半胱氨酸残基。在一些情况下,所述阳离子氨基酸聚合物包含内部半胱氨酸残基。在一些情况下,所述阳离子氨基酸聚合物包含(和/或缀合)核定位信号(nls)(在下文更详细地描述)。因此,在一些实施例中,阳离子氨基酸聚合物(例如,聚(精氨酸)(pr);聚(赖氨酸)(pk);聚(组氨酸)(ph);聚(鸟氨酸)和聚(瓜氨酸);聚(d-精氨酸)(pdr);聚(d-赖氨酸)(pdk);聚(d-组氨酸)(pdh);聚(d-鸟氨酸)和聚(d-瓜氨酸);聚(l-精氨酸)(plr);聚(l-赖氨酸)(plk);聚(l-组氨酸)(plh);聚(l-鸟氨酸)和聚(l-瓜氨酸))包含一个或两个(例如,两个或更多个、三个或更多个或者四个或更多个)nls。在一些情况下,所述阳离子氨基酸聚合物在n-末端和/或c-末端上包含nls。在一些情况下,所述阳离子氨基酸聚合物包含内部nls。组蛋白尾肽(htp)在一些实施例中,带电聚合物多肽结构域包含组蛋白肽或如n-末端组蛋白尾(例如,h1;h2(例如,h2a、h2ax、h2b);h3或h4组蛋白蛋白质的组蛋白尾)。组蛋白蛋白质的尾部片段在本文中称为组蛋白尾肽(htp)。因为这种蛋白质(组蛋白和/或htp)可以作为主体递送分子的一部分与核酸有效负载缩合,所以包含一个或多个组蛋白或htp的带电聚合物多肽结构域在本文中有时称为核小体模拟物结构域。组蛋白和/或htp也可以作为单体包含在内,并且在一些情况下,当缩合核酸有效负载时,可以形成二聚体、三聚体、四聚体和/或八聚体。在一些情况下,htp不但能够通过各种组蛋白修饰去质子化,如在组蛋白乙酰转移酶介导的乙酰化的情况下,还可以介导核心组分的有效核特异性解包(例如,释放有效负载)。在一些实施例中,受试者带电聚合物多肽结构域包含具有h2a、h2ax、h2b、h3或h4蛋白质的氨基酸序列的蛋白质。在一些情况下,受试者带电聚合物多肽结构域包含具有对应于组蛋白蛋白质的n-末端区的氨基酸序列的蛋白质。例如,片段(htp)可以包含组蛋白蛋白质的前5个、前10个、前15个、前20个、前25个、前30个、前35个、前40个、前45个或前50个n-末端氨基酸。在一些情况下,受试者htp包含来自组蛋白蛋白质的n-末端区的5-50个氨基酸(例如,5-45个、5-40个、5-35个、5-30个、5-25个、5-20个、8-50个、8-45个、8-40个、8-35个、8-30个、10-50个、10-45个、10-40个、10-35个或10-30个氨基酸)。在一些情况下,受试者阳离子多肽包含5-150个氨基酸(例如,5-100个、5-50个、5-35个、5-30个、5-25个、5-20个、8-150个、8-100个、8-50个、8-40个、8-35个、8-30个、10-150个、10-100个、10-50个、10-40个、10-35个或10-30个氨基酸)。在一些情况下,带电聚合物多肽结构域的阳离子多肽(例如,组蛋白或htp,例如,h1、h2、h2a、h2ax、h2b、h3或h4)包含翻译后修饰(例如,在一些情况下,对一个或多个组氨酸、赖氨酸、精氨酸或其它互补残基进行修饰)。例如,在一些情况下,阳离子多肽甲基化(和/或易于甲基化/去甲基化);乙酰化(和/或易于乙酰化/去乙酰化);巴豆酰化(和/或易于巴豆酰化/去巴豆酰化);泛素化(和/或易于泛素化/去泛素化);磷酸化(和/或易于磷酸化/去磷酸化);sumo化(和/或易于sumo化/去sumo化);法尼基化(和/或易于法尼基化/去法尼基化);硫酸化(和/或易于硫酸化/脱硫)或以其它方式被翻译后修饰。在一些情况下,带电聚合物多肽结构域的阳离子多肽(例如,组蛋白或htp,例如,h1、h2、h2a、h2ax、h2b、h3、或h4)是p300/cbp底物(例如,参见以下的示例htp)。在一些情况下,带电聚合物多肽结构域的阳离子多肽(例如,组蛋白或htp,例如,h1、h2、h2a、h2ax、h2b、h3或h4)包含一个或多个硫醇残基(例如,可以包含硫酸化或易于硫酸化的半胱氨酸和/或甲硫氨酸残基)(例如,作为硫代硫酸盐硫转移酶底物)。在一些情况下,阳离子多肽的阳离子多肽(例如,组蛋白或htp,例如,h1、h2、h2a、h2ax、h2b、h3或h4)在c-末端上酰胺化。组蛋白h2a、h2b、h3和h4(和/或htp)可以在其任何赖氨酸处单甲基化、二甲基化或三甲基化以促进或抑制转录活性并且改变核特异性释放动力学。阳离子多肽可以用期望的修饰合成或者可以在体外反应中被修饰。可替换的是,可以在细胞群中表达阳离子多肽(例如,组蛋白或htp)并且可以分离/纯化期望的修饰蛋白。在一些情况下,受试者纳米颗粒的带电聚合物多肽结构域包含甲基化htp,例如包含h3k4(me3)的htp序列-包含如seqidno:75或88)所示氨基酸序列。在一些情况下,带电聚合物多肽结构域的阳离子多肽(例如,组蛋白或htp,例如,h1、h2、h2a、h2ax、h2b、h3或h4)包含c-末端酰胺。组蛋白和htp的实例实例包含但不限于以下序列:h2asgrgkqggkarakaktrssr(seqidno:62)[1-20]sgrgkqggkarakaktrssraglqfpvgrvhrllrkggg(seqidno:63)[1-39]msgrgkqggkarakaktrssraglqfpvgrvhrllrkgnyaervgagapvylaavleyltaeilelagnaardnkktriiprhlqlairndeelnkllgkvtiaqggvlpniqavllpkkteshhkakgk(seqidno:64)[1-130]h2axckatqasqey(seqidno:65)[134–143]kktsatvgpkapsggkkatqasqey(seqidno:66)[kk120-129]msgrgktggkarakaksrssraglqfpvgrvhrllrkghyaervgagapvylaavleyltaeilelagnaardnkktriiprhlqlairndeelnkllggvtiaqggvlpniqavllpkktsatvgpkapsggkkatqasqey(seqidno:67)[1-143]h2bpepa-k(cr)–sapapk(seqidno:68)[1-11h2bk5(cr)][cr:巴豆酰化(crotonylated)(巴豆酰化)(crotonylation)]pepaksapapk(seqidno:69)[1-11]aqkkdgkkrkrsrke(seqidno:70)[21-35]mpepaksapapkkgskkavtkaqkkdgkkrkrsrkesysiyvykvlkqvhpdtgisskamgimnsfvndiferiageasrlahynkrstitsreiqtavrlllpgelakhavsegtkavtkytssk(seqidno:71)[1-126]h3artkqtar(seqidno:72)[1-8]art-k(me1)-qtarks(seqidno:73)[1-8h3k4(me1)]art-k(me2)-qtarks(seqidno:74)[1-8h3k4(me2)]art-k(me3)-qtarks(seqidno:75)[1-8h3k4(me3)]artkqtark-ps-tggka(seqidno:76)[1-15h3ps10]artkqtarkstggkaprkwc-nh2(seqidno:77)[1-18wc,酰胺]artkqtarkstgg-k(ac)-aprkq(seqidno:78)[1-19h3k14(ac)]artkqtarkstggkaprkql(seqidno:79)[1-20]artkqtar-k(ac)-stggkaprkql(seqidno:80)[1-20h3k9(ac)]artkqtarkstggkaprkqla(seqidno:81)[1-21]artkqtar-k(ac)-stggkaprkqla(seqidno:82)[1-21h3k9(ac)]artkqtar-k(me2)-stggkaprkqla(seqidno:83)[1-21h3k9(me1)]artkqtar-k(me2)-stggkaprkqla(seqidno:84)[1-21h3k9(me2)]artkqtar-k(me2)-stggkaprkqla(seqidno:85)[1-21h3k9(me3)]art-k(me1)-qtarkstggkaprkqla(seqidno:86)[1-21h3k4(me1)]art-k(me2)-qtarkstggkaprkqla(seqidno:87)[1-21h3k4(me2)]art-k(me3)-qtarkstggkaprkqla(seqidno:88)[1-21h3k4(me3)]artkqtar-k(ac)-ps-tggkaprkqla(seqidno:89)[1-21h3k9(ac),ps10]art-k(me3)-qtar-k(ac)-ps-tggkaprkqla(seqidno:90)[1-21h3k4(me3),k9(ac),ps10]artkqtarkstggkaprkqlac(seqidno:91)[1-21cys]artkqtar-k(ac)-stggkaprkqlatka(seqidno:92)[1-24h3k9(ac)]artkqtar-k(me3)-stggkaprkqlatka(seqidno:93)[1-24h3k9(me3)]artkqtarkstggkaprkqlatkaa(seqidno:94)[1-25]art-k(me3)–qtarkstggkaprkqlatkaa(seqidno:95)[1-25h3k4(me3)]tkqtar-k(me1)-stggkapr(seqidno:96)[3-17h3k9(me1)]tkqtar-k(me2)-stggkapr(seqidno:97)[3-17h3k9(me2)]tkqtar-k(me3)-stggkapr(seqidno:98)[3-17h3k9(me3)]kstgg-k(ac)–aprkq(seqidno:99)[9-19h3k14(ac)]qtarkstggkaprkqlask(seqidno:100)[5-23]aprkqlatkaarksapatggvkkph(seqidno:101)[15-39]atkaarksapatggvkkphryrpg(seqidno:102)[21-44]kaarksapa(seqidno:103)[23-31]kaarksapatgg(seqidno:104)[23-34]kaarksapatggc(seqidno:105)[23-34cys]kaar-k(ac)-sapatgg(seqidno:106)[h3k27(ac)]kaar-k(me1)-sapatgg(seqidno:107)[h3k27(me1)]kaar-k(me2)-sapatgg(seqidno:108)[h3k27(me2)]kaar-k(me3)-sapatgg(seqidno:109)[h3k27(me3)]at-k(ac)–aarksapstggvkkphryrpg(seqidno:110)[21-44h3k23(ac)]atkaark-ps–apatggvkkphryrpg(seqidno:111)[21-44ps28]artkqtarkstggkaprkqlatkaarksapatggv(seqidno:112)[1-35]stggv-k(me1)-kphry(seqidno:113)[31-41h3k36(me1)]stggv-k(me2)-kphry(seqidno:114)[31-41h3k36(me2)]stggv-k(me3)-kphry(seqidno:115)[31-41h3k36(me3)]gtvalreirryq-k(ac)-stellir(seqidno:116)[44-63h3k56(ac)]artkqtarkstggkaprkqlatkaarksapatggvkkphryrpgtvalre(seqidno:117)[1-50]tellirklpfqrlvreiaqdf-k(me1)-tdlrfqsaai(seqidno:118)[h3k79(me1)]eiaqdfktdlr(seqidno:119)[73-83]eiaqdf-k(ac)-tdlr(seqidno:120)[73-83h3k79(ac)]eiaqdf-k(me3)-tdlr(seqidno:121)[73-83h3k79(me3)]rlvreiaqdfktdlrfqssav(seqidno:122)[69-89]rlvreiaqdfk-(me1)-tdlrfqssav(seqidno:123)[69-89h3k79(me1),酰胺]rlvreiaqdfk-(me2)-tdlrfqssav(seqidno:124)[69-89h3k79(me2),酰胺]rlvreiaqdfk-(me3)-tdlrfqssav(seqidno:125)[69-89h3k79(me3),酰胺]krvtimpkdiqlarrirgera(seqidno:126)[116-136]martkqtarkstggkaprkqlatkvarksapatggvkkphryrpgtvalreirryqkstellirklpfqrlmreiaqdfktdlrfqssavmalqeacesylvglfedtnlcvihakrvtimpkdiqlarrirgera(seqidno:127)[1-136]h4sgrgkgg(seqidno:128)[1-7]rgkggkglgkga(seqidno:129)[4-12]sgrgkggkglgkggakrhrkv(seqidno:130)[1-21]kglgkggakrhrkvlrdnwc-nh2(seqidno:131)[8-25wc,酰胺]sgrg-k(ac)-gg-k(ac)-glg-k(ac)-gga-k(ac)–rhrkvlrdngsgsk(seqidno:132)[1-25h4k5,8,12,16(ac)]sgrgkggkglgkggakrhrk-nh2(seqidno:133)[1-20h4prmt7(蛋白质精氨酸甲基转移酶7)底物,m1]sgrg-k(ac)–ggkglgkggakrhrk(seqidno:134)[1-20h4k5(ac)]sgrgkgg–k(ac)-glgkggakrhrk(seqidno:135)[1-20h4k8(ac)]sgrgkggkglg-k(ac)-ggakrhrk(seqidno:136)[1-20h4k12(ac)]sgrgkggkglgkgga-k(ac)-rhrk(seqidno:137)[1-20h4k16(ac)]kglgkggakrhrkvlrdnwc-nh2(seqidno:138)[1-25wc,酰胺]msgrgkggkglgkggakrhrkvlrdniqgitkpairrlarrggvkrisgliyeetrgvlkvflenvirdavtytehakrktvtamdvvyalkrqgrtlygfgg(seqidno:139)[1-103]因此,受试者带电聚合物多肽结构域的阳离子多肽可以包含具有seqidno:62-139中的任一个所示氨基酸序列的氨基酸序列。在一些情况下,受试者带电聚合物多肽结构域的阳离子多肽包含与seqidno:62-139中任一个所示氨基酸序列具有80%或更高的序列同一性(例如,85%或更高、90%或更高、95%或更高、98%或更高、99%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,受试者带电聚合物多肽结构域的阳离子多肽包含与seqidno:62-139中任一个所示氨基酸序列具有90%或更高的序列同一性(例如,95%或更高、98%或更高、99%或更高或者100%的序列同一性)的氨基酸序列。阳离子多肽可以包含任何方便的修饰,并且上文讨论了多种这种设想的修饰,例如甲基化、乙酰化、巴豆酰化、泛素化、磷酸化、sumo化、法尼基化、硫酸化等。在一些情况下,带电聚合物多肽结构域的阳离子多肽包含与seqidno:94所示氨基酸序列具有80%或更高的序列同一性(例如,85%或更高、90%或更高、95%或更高、98%或更高、99%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,带电聚合物多肽结构域的阳离子多肽包含与seqidno:94所示氨基酸序列具有95%或更高的序列同一性(例如,98%或更高、99%或更高或者100%的序列同一性)的氨基酸序列。在一些情况下,带电聚合物多肽结构域的阳离子多肽包含seqidno:94所示氨基酸序列。在一些情况下,带电聚合物多肽结构域的阳离子多肽包含由h3k4(me3)(seqidno:95)表示的序列,所述阳离子多肽包括人组蛋白3蛋白的前25个氨基酸,并且在赖氨酸4上三甲基化(例如,在一些情况下在c-末端上酰胺化)。在一些实施例中,带电聚合物多肽结构域的阳离子多肽(例如,组蛋白或htp,例如,h1、h2、h2a、h2ax、h2b、h3或h4)包含半胱氨酸残基,所述半胱氨酸残基可以促进与:阳离子(或者在一些情况下为阴离子)氨基酸聚合物、连接子、nls和/或其它阳离子多肽的缀合(例如,在一些情况下形成支化组蛋白结构)。例如,半胱氨酸残基可以用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。在一些情况下,所述半胱氨酸残基是内部的。在一些情况下,所述半胱氨酸残基定位于n-末端和/或c-末端处。在一些情况下,带电聚合物多肽结构域的阳离子多肽(例如,组蛋白或htp,例如h1、h2、h2a、h2ax、h2b、h3或h4)包含添加半胱氨酸残基的突变(例如,插入或取代)。包含半胱氨酸的htp的实例包含但不限于:ckatqasqey(seqidno:140)-来自h2axartkqtarkstggkaprkqlac(seqidno:141)-来自h3artkqtarkstggkaprkwc(seqidno:142)kaarksapatggc(seqidno:143)-来自h3kglgkggakrhrkvlrdnwc(seqidno:144)–来自h4martkqtarkstggkaprkqlatkvarksapatggvkkphryrpgtvalreirryqkstellirklpfqrlmreiaqdfktdlrfqssavmalqeacesylvglfedtnlcvihakrvtimpkdiqlarrirgera(seqidno:145)–来自h3在一些实施例中,带电聚合物多肽结构域的阳离子多肽(例如,组蛋白或htp,例如,h1、h2、h2a、h2ax、h2b、h3或h4)与阳离子(和/或阴离子)氨基酸聚合物缀合。作为实例,组蛋白或htp可以通过半胱氨酸残基与阳离子氨基酸聚合物(例如,包含聚(赖氨酸)的聚合物)缀合,例如,其中用与组蛋白或htp的半胱氨酸键合的二硫化物取代聚合物的一个或多个赖氨酸的一个或多个吡啶基二硫化物基团。修饰的/支化结构在一些实施例中,带电聚合物多肽结构域具有线性结构。在一些实施例中,带电聚合物多肽结构域具有支化结构。例如,在一些情况下,阳离子多肽(例如,htp;例如,具有半胱氨酸残基的htp)与阳离子聚合物(例如,聚(l-精氨酸)、聚(d-赖氨酸)、聚(l-赖氨酸)、聚(d-赖氨酸))的末端(例如,在其c-末端处)缀合,从而形成延伸的线性多肽。在一些情况下,一个或多个(两个或更多个、三个或更多个等)阳离子多肽(例如,htp;例如具有半胱氨酸残基的htp)与阳离子聚合物(例如,聚(l-精氨酸)、聚(d-赖氨酸)、聚(l-赖氨酸)、聚(d-赖氨酸))的一个或多个末端(例如,在其c-末端处)缀合,从而形成延伸的线性多肽。在一些情况下,阳离子聚合物具有范围为4,500-150,000da)的分子量。作为另一个实例,在一些情况下,一个或多个(两个或更多个,三个或更多个等)阳离子多肽(例如,htp;例如具有半胱氨酸残基的htp)与阳离子聚合物(例如,聚(l-精氨酸)、聚(d-赖氨酸)、聚(l-赖氨酸)、聚(d-赖氨酸))的侧链(例如,在其c-末端处)缀合,从而形成支化结构(支化多肽)。支化结构的形成可以在一些情况下增加可以实现(例如,核酸有效负载量)的缩合量。因此,在一些情况下,期望使用形成支化结构的组分。支化结构的各种类型是目的支化结构,并且可以产生的支化结构的实例(例如,使用如htp等受试者阳离子多肽;例如,具有半胱氨酸残基的htp;类肽;聚酰胺等)包含但不限于:刷状聚合物;网状(例如蜘蛛网);接枝聚合物;星形聚合物;梳状聚合物;聚合物网络;树状聚合物等。作为实例,图123描绘了刷状类型支化结构。在一些情况下,支化结构包含2-30个阳离子多肽(例如,htp)(例如,2-25个、2-20个、2-15个、2-10个、2-5个、4-30个、4-25个、4-20个、4-15个或4-10个阳离子多肽),其中每个阳离子多肽可以与支化结构的其它阳离子多肽相同或不同(参见,例如,图123)。在一些情况下,阳离子聚合物具有的分子量范围为4,500-150,000da。在一些情况下,阳离子聚合物(例如,聚(l-精氨酸)、聚(d-赖氨酸)、聚(l-赖氨酸)、聚(d-赖氨酸))的5%或更多(例如,10%或更多、20%或更多、25%或更多、30%或更多、40%或更多或者50%或更多)的侧链与受试者阳离子多肽(例如,htp;例如,具有半胱氨酸残基的htp)缀合。在一些情况下,阳离子聚合物(例如,聚(l-精氨酸)、聚(d-赖氨酸)、聚(l-赖氨酸)、聚(d-赖氨酸))的高达50%(例如,高达40%、高达30%、高达25%、高达20%、高达15%、高达10%或高达5%)的侧链与受试者阳离子多肽(例如,htp;例如,具有半胱氨酸残基的htp)缀合。因此,htp可以从如阳离子氨基酸聚合物等聚合物的主链中分支出来。在一些情况下,可以使用如类肽(多肽)、聚酰胺、树状聚合物等组分促进支化结构的形成。例如,在一些情况下,类肽(例如,多肽)用作具有受试者递送分子的组合物的一部分,例如,以产生网状(例如,蜘蛛网状)结构,所述网状结构在一些情况下可以促进缩合。本文中的一个或多个天然或修饰的多肽序列可以用末端或间断的精氨酸、赖氨酸或组氨酸序列修饰。在一个实施例中,每个多肽包含在纳米颗粒核心内的相等的胺摩尔浓度中。在该实施例中,每个多肽的c-末端可以用5r(5个精氨酸)修饰。在一些实施例中,每个多肽的c-末端可以用9r(9个精氨酸)修饰。在一些实施例中,每个多肽的n-末端可以用5r(5个精氨酸)修饰。在一些实施例中,每个多肽的n-末端可以用9r(9个精氨酸)修饰。在一些情况下,h2a、h2b、h3和/或h4组蛋白片段(例如,htp)各自与fkfl组织蛋白酶b蛋白水解切割结构域或rgffp组织蛋白酶d蛋白水解切割结构域串联桥接。在一些情况下,h2a、h2b、h3和/或h4组蛋白片段(例如,htp)可以由5r(5个精氨酸)、9r(9个精氨酸)、5k(5个赖氨酸)、9k(9个赖氨酸)、5h(5个组氨酸)或9h(9个组氨酸)阳离子间隔结构域串联桥接。在一些情况下,一个或多个h2a、h2b、h3和/或h4组蛋白片段(例如,htp)在其n-末端处与鱼精蛋白二硫键合。为了说明如何产生支化组蛋白结构,提供了制备的示例方法。这种方法的一个实例包含以下:共摩尔比例的组蛋白h2ax[134-143]、组蛋白h3[1-21cys]、组蛋白h3[23-34cys]、组蛋白h4[8-25wc]以及sv40t-ag衍生的nls的共价修饰可以在与10%吡啶基二硫化物修饰的聚(l-赖氨酸)[mw=5400、18000或45000da;n=30、100或250]的反应中进行。在典型的反应中,可以将29μl、700μm的cys-修饰的组蛋白/nls(20nmol)水溶液加入到57μl、0.2m的磷酸盐缓冲液(ph8.0)中。其次,然后可以将14μl、100μm的吡啶基二硫化物保护的聚(赖氨酸)溶液添加到组蛋白溶液中以使最终体积达到100μl,其中吡啶基二硫化物基团与半胱氨酸残基的比例为1:2。该反应可以在室温下进行3小时。所述反应可以重复四次并且可以通过在343nm处的吡啶-2-硫酮的吸光度来确定缀合度。作为另一个实例,摩尔比为0:1、1:4、1:3、1:2、1:1、1:2、1:3、1:4或1:0的组蛋白h3[1-21cys]肽、组蛋白h3[23-34cys]肽的共价修饰可以在与10%吡啶基二硫化物修饰的聚(l-赖氨酸)或聚(l-精氨酸)[mw=5400、18000或45000da;n=30、100或250]的反应中进行。在典型的反应中,可以将29μl、700μm的cys-修饰的组蛋白(20nmol)水溶液加入到57μl、0.2m的磷酸盐缓冲液(ph8.0)中。其次,然后可以将14μl、100μm的吡啶基二硫化物保护的聚(赖氨酸)溶液添加到组蛋白溶液中以使最终体积达到100μl,其中吡啶基二硫化物基团与半胱氨酸残基的比例为1:2。该反应可以在室温下进行3小时。所述反应可以重复四次并且可以通过在343nm处的吡啶-2-硫酮的吸光度来确定缀合度。在一些情况下,所述带电聚合物多肽结构域与核酸有效负载缩合(参见,例如,图1、图e-f)。在一些情况下,所述带电聚合物多肽结构域与蛋白质有效负载缩合。在一些情况下,所述带电聚合物多肽结构域与二氧化硅、盐和/或阴离子聚合物共缩合以提供更多的内体缓冲能力、稳定性和例如可选的定时释放。如上文所提到的,在一些情况下,受试者递送分子的带电聚合物多肽结构域是例如在一些长度为约4-25个氨基酸或者长度为4-15个氨基酸上的一段重复的阳离子残基(如精氨酸、赖氨酸和/或组氨酸)。这种结构域可以允许递送分子与阴离子可脱落基质(例如,共缩合的阴离子聚合物)以静电方式相互作用。因此,在一些情况下,受试者递送分子的受试者带电聚合物多肽结构域是一段重复的阳离子残基,所述一段重复的阳离子残基与阴离子可脱落基质以及核酸和/或蛋白质有效负载(例如,以静电方式)相互作用。因此,在一些情况下,受试者递送分子与有效负载(例如,核酸和/或蛋白质)相互作用并且作为具有阴离子聚合物的组合物的一部分存在(例如,与有效负载以及阴离子聚合物共缩合)。阴离子可脱落基质的阴离子聚合物(即,与受试者递送分子的带电聚合物多肽结构域相互作用的阴离子聚合物)可以是任何方便的阴离子聚合物/聚合物组合物。实例包含但不限于:聚(谷氨酸)(例如,聚(d-谷氨酸)[pde];聚(l-谷氨酸)[ple];各种期望比例的pde和ple等)。在一些情况下,pde用作阴离子可脱落基质。在一些情况下,ple用作阴离子可脱落基质(阴离子聚合物)。在一些情况下,pde用作阴离子可脱落基质(阴离子聚合物)。在一些情况下,ple和pde都用作阴离子可脱落基质(阴离子聚合物),例如,以1:1的比例(50%pde、50%ple)。阴离子聚合物阴离子聚合物组合物可以包含一种或多种阴离子氨基酸聚合物。例如,在一些情况下,受试者阴离子聚合物组合物包含选自以下的聚合物:聚(谷氨酸)(pea)、聚(天冬氨酸)(pda)及其组合物。在一些情况下,给定的阴离子氨基酸聚合物可以包含天冬氨酸和谷氨酸残基的混合。每种聚合物可以作为l-异构体或d-异构体的聚合物存在于组合物中,其中d-异构体在靶细胞中更稳定,因为它们需要更长的时间来降解。因此,包含d-异构体聚(氨基酸)可以延迟降解以及随后的有效负载释放。因此有效负载释放速率可以被控制并且与d-异构体的聚合物与l-异构体的聚合物的比例成比例,其中d-异构体与l-异构体的较高比例增加了有效负载释放的持续时间(即,降低释放速率)。换句话说,d-异构体和l-异构体的相对量可以调节纳米颗粒核心的定时释放动力学以及对降解和有效负载释放的酶促敏感性。在一些情况下,阴离子聚合物组合物包含阴离子氨基酸聚合物(例如,聚(谷氨酸)((pea)和聚(天冬氨酸)(pda))的d-异构体的聚合物和l-异构体的聚合物。在一些情况下,d-异构体与l-异构体的比例范围为10:1-1:10(例如,8:1-1:10、6:1-1:10、4:1-1:10、3:1-1:10、2:1-1:10、1:1-1:10、10:1-1:8、8:1-1:8、6:1-1:8、4:1-1:8、3:1-1:8、2:1-1:8、1:1-1:8、10:1-1:6、8:1-1:6、6:1-1:6、4:1-1:6、3:1-1:6、2:1-1:6、1:1-1:6、10:1-1:4、8:1-1:4、6:1-1:4、4:1-1:4、3:1-1:4、2:1-1:4、1:1-1:4、10:1-1:3、8:1-1:3、6:1-1:3、4:1-1:3、3:1-1:3、2:1-1:3、1:1-1:3、10:1-1:2、8:1-1:2、6:1-1:2、4:1-1:2、3:1-1:2、2:1-1:2、1:1-1:2、10:1-1:1、8:1-1:1、6:1-1:1、4:1-1:1、3:1-1:1或2:1-1:1)。因此,在一些情况下,阴离子聚合物组合物包含第一阴离子聚合物(例如,氨基酸聚合物),所述第一阴离子聚合物是d-异构体的聚合物(例如,选自聚(d-谷氨酸)(pdea)和聚(d-天冬氨酸)(pdda));并且包含第二阴离子聚合物(例如,氨基酸聚合物),所述第二阴离子聚合物是l-异构体的聚合物(例如,选自聚(l-谷氨酸)(plea)和聚(l-天冬氨酸)(plda))。在一些情况下,第一阴离子聚合物(d-异构体)与第二阴离子聚合物(l-异构体)的比例范围为10:1-1:10(例如,8:1-1:10、6:1-1:10、4:1-1:10、3:1-1:10、2:1-1:10、1:1-1:10、10:1-1:8、8:1-1:8、6:1-1:8、4:1-1:8、3:1-1:8、2:1-1:8、1:1-1:8、10:1-1:6、8:1-1:6、6:1-1:6、4:1-1:6、3:1-1:6、2:1-1:6、1:1-1:6、10:1-1:4、8:1-1:4、6:1-1:4、4:1-1:4、3:1-1:4、2:1-1:4、1:1-1:4、10:1-1:3、8:1-1:3、6:1-1:3、4:1-1:3、3:1-1:3、2:1-1:3、1:1-1:3、10:1-1:2、8:1-1:2、6:1-1:2、4:1-1:2、3:1-1:2、2:1-1:2、1:1-1:2、10:1-1:1、8:1-1:1、6:1-1:1、4:1-1:1、3:1-1:1或2:1-1:1)。在一些实施例中,阴离子聚合物组合物包含(例如,除阴离子聚合物的任何前述实例之外或代替阴离子聚合物的任何前述实例)糖胺聚糖、糖蛋白、多糖、聚(甘露糖醛酸)、聚(古洛糖醛酸)、肝素、硫酸肝素、软骨素、硫酸软骨素、角质素、硫酸角质素、聚集蛋白聚糖、聚(葡糖胺)或包括其任何组合的阴离子聚合物。在一些实施例中,阴离子聚合物可以具有的分子量范围为1-200kda(例如,1-150kda、1-100kda、1-50kda、5-200kda、5-150kda、5-100kda、5-50kda、10-200kda、10-150kda、10-100kda、10-50kda、15-200kda、15-150kda、15-100kda或15-50kda)。作为实例,在一些情况下,阴离子聚合物包含分子量约为15kda的聚(谷氨酸)。在一些情况下,阴离子氨基酸聚合物包含半胱氨酸残基,所述半胱氨酸残基可以促进例如与连接子、nls和/或阳离子多肽(例如,组蛋白或htp)的缀合。例如,半胱氨酸残基可以用于通过巯基化学(例如,二硫键)和/或胺反应性化学进行交联(缀合)。因此,在一些实施例中,阴离子聚合物组合物的阴离子氨基酸聚合物(例如,聚(谷氨酸)(pea)、聚(天冬氨酸)(pda)、聚(d-谷氨酸)(pdea)、聚(d-天冬氨酸)(pdda)、聚(l-谷氨酸)(plea)、聚(l-天冬氨酸)(plda))包含半胱氨酸残基。在一些情况下,所述阴离子氨基酸聚合物在n-末端和/或c-末端上包含半胱氨酸残基。在一些情况下,所述阴离子氨基酸聚合物包含内部半胱氨酸残基。在一些情况下,所述阴离子氨基酸聚合物包含(和/或缀合)核定位信号(nls)(在下文更详细地描述)。因此,在一些实施例中,阴离子聚合物组合物的阴离子氨基酸聚合物(例如,聚(谷氨酸)(pea)、聚(天冬氨酸)(pda)、聚(d-谷氨酸)(pdea)、聚(d-天冬氨酸)(pdda)、聚(l-谷氨酸)(plea)、聚(l-天冬氨酸)(plda))包含一个或多个(例如,两个或更多个、三个或更多个或者四个或更多个)nls(和/或与其缀合)。在一些情况下,所述阴离子氨基酸聚合物在n-末端和/或c-末端上包含nls。在一些情况下,所述阴离子氨基酸聚合物包含内部nls。在一些情况下,阴离子聚合物与靶向配体缀合。连接子在一些实施例中,根据本公开的靶向配体通过间插连接子与有效负载(例如,蛋白质有效负载或如sirna等核酸有效负载)缀合(例如,参见图1和图2)。连接子可以是蛋白质连接子或非蛋白质连接子。靶向配体与连接子、连接子与有效负载(例如,核酸或蛋白质有效负载)或者连接子与带电聚合物多肽结构域的缀合可以以多种不同的方式完成。在一些情况下,缀合是通过巯基化学(例如,二硫键;例如,在两个半胱氨酸残基之间;例如,参见图2)。在一些情况下,使用胺反应性化学完成缀合。在一些情况下,靶向配体包含半胱氨酸残基并且通过半胱氨酸残基与连接子缀合。在一些情况下,连接子是肽连接子并且包含半胱氨酸残基。在一些情况下,靶向配体和肽连接子由于是相同多肽的一部分而缀合。在一些情况下,受试者连接子是多肽并且可以称为多肽连接子。应理解,虽然考虑了多肽连接子,但在一些情况下使用非多肽连接子(化学连接子)。例如,在一些实施例中,连接子是聚乙二醇(peg)连接子。合适的蛋白质连接子包含长度介于4个氨基酸与40个氨基酸之间(例如,4-30个、4-25个、4-20个、4-15个、4-10个、6-40个、6-30个、6-25个、6-20个、6-15个、6-10个、8-30个、8-25个、8-20个或8-15个氨基酸)的多肽。在一些实施例中,受试者连接子是刚性的(例如,包含一个或多个脯氨酸残基的连接子)。刚性连接子的一个非限制性实例是gapgapgap(seqidno:17)。在一些情况下,多肽连接子在n-末端和/或c-末端处包含c残基。因此,在一些情况下,刚性连接子选自:gapgapgapc(seqidno:18)和cgapgapgap(seqidno:19)。可以使用具有一定柔性的肽连接子。因此,在一些情况下,受试者连接子是柔性的。连接肽实际上可以具有任何氨基酸序列,记住:柔性连接子将具有产生一般柔性肽的序列。使用如甘氨酸和丙氨酸等小型氨基酸在产生柔性肽方面是有用的。这种序列的产生对于本领域技术人员来说是常规的。各种各样不同的连接子是可商购的并且被认为是适合使用的。连接子多肽的实例包含甘氨酸聚合物(g)n;甘氨酸-丝氨酸聚合物(包含例如(gs)n、gsggsn(seqidno:20)、ggsggsn(seqidno:21)和gggsn(seqidno:22),其中n是至少为一的整数);甘氨酸-丙氨酸聚合物;丙氨酸-丝氨酸聚合物。示例连接子可以包括氨基酸序列,包含但不限于ggsg(seqidno:23)、ggsgg(seqidno:24)、gsgsg(seqidno:25)、gsggg(seqidno:26)、gggsg(seqidno:27)、gsssg(seqidno:28)等。普通技术人员将认识到,与上文描述的任何要素缀合的肽的设计可以包含完全或部分柔性的连接子,使得所述连接子可以包含柔性连接子以及赋予较少柔性结构的一个或多个部分。柔性连接子的另外的实例包含但不限于:gggggsggggg(seqidno:29)和gggggsggggs(seqidno:30)。如上文所提到的,在一些情况下,多肽连接子在n-末端和/或c-末端处包含c残基。因此,在一些情况下,柔性连接子包含选自以下的氨基酸序列:gggggsgggggc(seqidno:31)、cgggggsggggg(seqidno:32)、gggggsggggsc(seqidno:33)和cgggggsggggs(seqidno:34)。在一些情况下,受试者多肽连接子是内体溶解的。内体溶解多肽连接子包含但不限于:kala(seqidno:35)和gala(seqidno:36)。如上文所提到的,在一些情况下,多肽连接子在n-末端和/或c-末端处包含c残基。因此,在一些情况下,受试者连接子包含选自以下的氨基酸序列:ckala(seqidno:37)、kalac(seqidno:38)、cgala(seqidno:39)和galac(seqidno:40)。巯基偶联反应的说明性实例(例如,通过巯基化学的缀合,例如,使用半胱氨酸残基)(用于将靶向配体缀合到有效负载;将靶向配体缀合到带电聚合物多肽结构域;将靶向配体缀合到连接子;将连接子缀合到有效负载;将连接子缀合到带电聚合物多肽结构域等)。二硫键在还原状态下包含游离巯基的半胱氨酸残基在典型的二硫化物交换反应中容易与受保护的硫醇形成二硫键。硫醚/硫酯键半胱氨酸的巯基与马来酰亚胺和酰卤基团反应,分别形成稳定的硫醚和硫酯键。马来酰亚胺酰卤叠氮化物-炔烃环加成通过使半胱氨酸残基包含炔键的化学修饰或通过在合成肽制剂中使用l-炔丙基半胱氨酸(如下图所示)来促进这种缀合。然后借助cu促进的点击化学实现偶联。递送分子和组分的说明性实例(0a)半胱氨酸缀合锚1(cca1)[带电聚合物多肽结构域-连接子(gapgapgap)-半胱氨酸]rrrrrrrrrgapgapgapc(seqidno:41)(0b)半胱氨酸缀合锚2(cca2)[半胱氨酸-连接子(gapgapgap)-带电聚合物多肽结构域]cgapgapgaprrrrrrrrr(seqidno:42)(1a)α5β1配体[带电聚合物多肽结构域-连接子(gapgapgap)-靶向配体]rrrrrrrrrgapgapgaprretawa(seqidno:45)(1b)α5β1配体[靶向配体-连接子(gapgapgap)-带电聚合物多肽结构域]rretawagapgapgaprrrrrrrrr(seqidno:46)(1c)α5β1配体-cys左cgapgapgap(seqidno:19)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca1(参见上文)或缀合到核酸有效负载(例如,sirna)。(1d)α5β1配体-cys右gapgapgapc(seqidno:18)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca2(参见上文)或缀合到核酸有效负载(例如,sirna)。(2a)rgdα5β1配体[带电聚合物多肽结构域-连接子(gapgapgap)-靶向配体]rrrrrrrrrgapgapgaprgd(seqidno:47)(2b)rgda5b1配体[靶向配体-连接子(gapgapgap)-带电聚合物多肽结构域]rgdgapgapgaprrrrrrrrr(seqidno:48)(2c)rgd配体-cys左crgd(seqidno:49)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca1(参见上文)或缀合到核酸有效负载(例如,sirna)。(2d)rgd配体-cys右rgdc(seqidno:50)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca2(参见上文)或缀合到核酸有效负载(例如,sirna)。(3a)转铁蛋白配体[带电聚合物多肽结构域-连接子(gapgapgap)-靶向配体]rrrrrrrrrgapgapgapthrppmwspvwp(seqidno:51)(3b)转铁蛋白配体[靶向配体-连接子(gapgapgap)-带电聚合物多肽结构域]thrppmwspvwpgapgapgaprrrrrrrrr(seqidno:52)(3c)转铁蛋白配体-cys左cthrppmwspvwp(seqidno:53)cpthrppmwspvwp(seqidno:54)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca1(参见上文)或缀合到核酸有效负载(例如,sirna)。(3d)转铁蛋白配体-cys右thrppmwspvwpc(seqidno:55)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca2(参见上文)或缀合到核酸有效负载(例如,sirna)。(4a)e-选择蛋白配体[1-21][带电聚合物多肽结构域-连接子(gapgapgap)-靶向配体]rrrrrrrrrgapgapgapmiasqflsaltlvllikesga(seqidno:56)(4b)e-选择蛋白配体[1-21][靶向配体-连接子(gapgapgap)-带电聚合物多肽结构域]miasqflsaltlvllikesgagapgapgaprrrrrrrrr(seqidno:57)(4c)e-选择蛋白配体[1-21]-cys左cmiasqflsaltlvllikesga(seqidno:58)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca1(参见上文)或缀合到核酸有效负载(例如,sirna)。(4d)e-选择蛋白配体[1-21]-cys右miasqflsaltlvllikesgac(seqidno:59)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca2(参见上文)或缀合到核酸有效负载(例如,sirna)。(5a)fgf片段[26-47][带电聚合物多肽结构域-连接子(gapgapgap)-靶向配体]rrrrrrrrrgapgapgapknggfflrihpdgrvdgvreks(seqidno:60)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca1(参见上文)或缀合到核酸有效负载(例如,sirna)。(5b)fgf片段[26-47][靶向配体-连接子(gapgapgap)-带电聚合物多肽结构域]knggfflrihpdgrvdgvreksgapgapgaprrrrrrrrr(seqidno:61)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca1(参见上文)或缀合到核酸有效负载(例如,sirna)。(5c)fgf片段[25-47]-左边的半胱氨酸是天然的。cknggfflrihpdgrvdgvreks(seqidno:43)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca1(参见上文)或缀合到核酸有效负载(例如,sirna)。(5d)fgf片段[26-47]-cys右knggfflrihpdgrvdgvreksc(seqidno:44)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca2(参见上文)或缀合到核酸有效负载(例如,sirna)。(6a)毒蜥外泌肽(s11c)[1-39]hgegtftsdlckqmeeeavrlfiewlknggpssgappps(seqidno:2)注意:这可以通过巯基化学(例如,二硫键)或胺反应性化学缀合到cca1(参见上文)或缀合到核酸有效负载(例如,sirna)。多价组合物在一些情况下,受试者组合物包含递送分子的群组,使得所述组合物是多价的(即,具有多于一个靶标,例如,由于具有多个靶向配体)。在一些情况下,这种组合物包含提供与cd34和硫酸肝素蛋白多糖的靶向结合的靶向配体的组合。例如,聚(l-精氨酸)可以用作这种组合物的一部分以提供与硫酸肝素蛋白多糖的靶向结合。并且也通过包含多于一种靶向配体作为相同递送分子的一部分来实现多价。以下描述旨在适用于两种情况(其中组合物包含多于一种递送分子,并且其中递送分子具有多于一种靶向配体)。在一些实施例中,受试者组合物包括(两种或更多种)靶向配体的群组,其中第一配体和第二配体具有不同的靶标,并且因此受试者组合物是多价的。多价受试者组合物是包含两种或更多种靶向配体(例如,包含不同配体的两种或更多种递送分子)的组合物。多聚体(在这种情况下为三聚体)受试者组合物的实例是包含靶向配体干细胞因子(scf)(其靶向c-kit受体,也称为cd117)、cd70(其靶向cd27)和含sh2结构域蛋白1a(sh2d1a)(其靶向cd150)的组合物。例如,在一些情况下,对于靶向造血干细胞(hsc)[kls(c-kit+lin-sca-1+)和cd27+/il-7ra-/cd150+/cd34-],受试者组合物包含表面层,所述表面层包含分别靶向c-kit、cd27和cd150的靶向配体scf、cd70和含sh2结构域蛋白1a(sh2d1a)的组合物(参见,例如,表1)。在一些情况下,这种组合物可以选择性地靶向其它淋巴和骨髓祖细胞上的hspc和长期hsc(c-kit+/lin-/sca-1+/cd27+/il-7ra-/cd150+/cd34-)。在一些示例实施例中,所有三种靶向配体(scf、cd70和sh2d1a)是受试者组合物的一部分。例如,(1)靶向多肽scf(其靶向c-kit受体)可以包含xmegicrnrvtnnvkdvtklvanlpkdymitlkyvpgmdvlpshcwisemvvqlsdsltdlldkfsniseglsnysiidklvnivddlvecvkensskdlkksfkspeprlftpeeffrifnrsidafkdfvvasetsdcvvsstlspekdsrvsvtkpfmlppvax(seqidno:xx),其中x是带电聚合物多肽结构域(例如,如6h等聚组氨酸、如9r等聚精氨酸等),例如,x在某些情况下可以存在于n-末端和/或c-末端处或者可以嵌入多肽序列中;(2)靶向多肽cd70(其靶向cd27)可以包含xpeegsgcsvrrrpygcvlraalvplvaglviclvvciqrfaqaqqqlpleslgwdvaelqlnhtgpqqdprlywqggpalgrsflhgpeldkgqlrihrdgiymvhiqvtlaicssttasrhhpttlavgicspasrsisllrlsfhqgctiasqrltplargdtlctnltgtllpsrntdetffgvqwvrpx(seqidno:xx),其中x是带电聚合物多肽结构域(例如,如6h等聚组氨酸、如9r等聚精氨酸等),例如,x在某些情况下可以存在于n-末端和/或c-末端处或者可以嵌入多肽序列中;以及(3)靶向多肽sh2d1a(其靶向cd150)可以包含xssglvprgshmdavavyhgkisretgeklllatgldgsyllrdsesvpgvyclcvlyhgyiytyrvsqtetgswsaetapgvhkryfrkiknlisafqkpdqgiviplqypvekkssarstqgttgiredpdvclkap(seqidno:xx),其中x是带电聚合物多肽结构域(例如,如6h等聚组氨酸、如9r等聚精氨酸等),例如,x在某些情况下可以存在于n-末端和/或c-末端处或者可以嵌入多肽序列(例如,如mgssxssglvprgshmdavavyhgkisretgeklllatgldgsyllrdsesvpgvyclcvlyhgyiytyrvsqtetgswsaetapgvhkryfrkiknlisafqkpdqgiviplqypvekkssarstqgttgiredpdvclkap(seqidno:xx))中。如上文所提到的,本公开的组合物可以包含多种靶向配体以靶向期望的细胞类型,或者以靶向期望的细胞类型的组合。(小鼠和人造血细胞谱系的)目的靶向配体的各种组合的实例包含但不限于:[小鼠](i)cd150;(ii)sca1,ckit,cd150;(iii)cd150和cd49b;(iv)sca1、ckit、cd150和cd49b;(v)cd150和flt3;(vi)sca1、ckit、cd150和flt3;(vii)flt3和cd34;(viii)flt3、cd34、sca1和ckit;(ix)flt3和cd127;(x)sca1、ckit、flt3和cd127;(xi)cd34;(xii)ckit和cd34;(xiii)cd16/32和cd34;(xiv)ckit、cd16/32和cd34;和(xv)ckit;以及[人](i)cd90和cd49f;(ii)cd34,cd90和cd49f;(iii)cd34;(iv)cd45ra和cd10;(v)cd34,cd45ra和cd10;(vi)cd45ra和cd135;(vii)cd34、cd38、cd45ra和cd135;(viii)cd135;(ix)cd34、cd38和cd135;和(x)cd34和cd38。因此,在一些情况下,受试者组合物包含提供与表面蛋白或表面蛋白的组合的靶向结合的一种或多种靶向配体,所述一种或多种靶向配体选自:[小鼠](i)cd150;(ii)sca1,ckit,cd150;(iii)cd150和cd49b;(iv)sca1、ckit、cd150和cd49b;(v)cd150和flt3;(vi)sca1、ckit、cd150和flt3;(vii)flt3和cd34;(viii)flt3、cd34、sca1和ckit;(ix)flt3和cd127;(x)sca1、ckit、flt3和cd127;(xi)cd34;(xii)ckit和cd34;(xiii)cd16/32和cd34;(xiv)ckit、cd16/32和cd34;和(xv)ckit;以及[人](i)cd90和cd49f;(ii)cd34,cd90和cd49f;(iii)cd34;(iv)cd45ra和cd10;(v)cd34,cd45ra和cd10;(vi)cd45ra和cd135;(vii)cd34、cd38、cd45ra和cd135;(viii)cd135;(ix)cd34、cd38和cd135;和(x)cd34和cd38。因为受试者组合物可以包含多于一种靶向配体,并且因为一些细胞包含重叠标记,所以可以使用递送分子和/或靶向配体的组合靶向多种不同的细胞类型,例如,在一些情况下,组合物可以靶向一种特定细胞而在其它情况下,组合物可以靶向多于一种特定细胞类型(例如,2种或更多种、3种或更多种、4种或更多种细胞类型)。例如,可以靶向造血谱系内的细胞的任何组合。作为说明性实例,靶向cd34(使用提供与cd34的靶向结合的靶向配体)可以导致将有效负载递送到造血谱系内的若干不同细胞。有效负载本公开的递送分子可以与有效负载缀合,或者可以在一些情况下与有效负载以静电方式相互作用(例如,缩合)。有效负载可以由核酸和/或蛋白质制成。例如,在一些情况下,受试者递送分子用于递送核酸有效负载(例如,dna和/或rna)。核酸有效负载可以是任何目的核酸,例如,核酸有效负载可以是线性的或环状的,并且可以是质粒;病毒基因组;rna(例如,如mrna等编码rna或如引导rna、短干扰rna(sirna)、短发夹rna(shrna)、微rna(mirna)等非编码rna);dna等。在一些情况下,所述核酸有效负载是rnai剂(例如,shrna、sirna、mirna等)或编码rnai剂的dna模板。在一些情况下,所述核酸有效负载是sirna分子(例如,靶向mrna的sirna分子,靶向mirna的sirna分子)。在一些情况下,所述核酸有效负载是lna分子(例如,靶向mirna的lna分子)。在一些情况下,所述核酸有效负载是mirna。在一些情况下,所述核酸有效负载包含编码目的蛋白质(例如,一种或多种重编程和/或转分化因子,如oct4、sox2、klf4、c-myc、nanog和lin28;例如,单独或以任何期望的组合,如(i)oct4,sox2,klf4和c-myc;(ii)oct4,sox2,nanog和lin28;等;基因编辑核酸内切酶;治疗性蛋白质;等)的mrna。在一些情况下,所述核酸有效负载包含非编码rna(例如,rnai剂、crispr/cas引导rna等)和/或编码非编码rna的dna分子。在一些实施例中,核酸有效负载包含编码il2rα和il12rγ的核酸(dna和/或mrna)(例如,以调节靶细胞的行为或存活)。在一些实施例中,核酸有效负载包含编码bcl-xl的核酸(dna和/或mrna)(例如,以防止由于fas或tnfα受体的接合而导致的靶细胞凋亡)。在一些实施例中,核酸有效负载包含编码foxp3的核酸(dna和/或mrna)(例如,以促进靶向t细胞中的免疫效应表型)。在一些实施例中,核酸有效负载包含编码scf的核酸(dna和/或mrna)。在一些实施例中,核酸有效负载包含编码hoxb4的核酸(dna和/或mrna)。在一些实施例中,核酸有效负载包含编码sirt6的核酸(dna和/或mrna)。在一些实施例中,核酸有效负载包含靶向(降低微rna的表达)如mir-155等微rna的核酸分子(例如,sirna、lna等)(参见,例如,mir库(base)登录号:mi0000681和mi0000177)。在一些实施例中,核酸有效负载包含靶向ku70的sirna和/或靶向ku80的sirna。术语“核酸有效负载”包含修饰的核酸。同样,术语“rnai剂”和“sirna”包含修饰的核酸。例如,核酸分子可以是模拟物;可以包含修饰的糖骨架、一个或多个修饰的核苷间连接(例如,一个或多个硫代磷酸酯和/或杂原子核苷间连接)、一个或多个修饰的碱基等。在一些实施例中,受试者有效负载包含三链形成肽核酸(pna)(参见,例如,mcneer等人,《基因疗法(genether.)》2013年6月;20(6):658-69)。因此,在一些情况下,受试者核心包含pna。在一些情况下,受试者核心包含pna和dna。受试者核酸有效负载(例如,sirna)可以具有吗啉代骨架结构。在一些情况下,受试者核酸有效负载(例如,sirna)可以具有一个或多个锁核酸(lna)。合适的糖取代基包含甲氧基(-o-ch3)、氨基丙氧基(--och2ch2ch2nh2)、烯丙基(-ch2-ch=ch2)、-o-烯丙基(--o--ch2—ch=ch2)以及氟(f)。2'-糖取代基可以在阿拉伯糖(上)位置或核糖(下)位置。合适的碱基修饰包含合成核碱基和天然核碱基,如5-甲基胞嘧啶(5-me-c);5-羟甲基胞嘧啶;黄嘌呤;次黄嘌呤;2-氨基腺嘌呤;腺嘌呤和鸟嘌呤的6-甲基和其它烷基衍生物;腺嘌呤和鸟嘌呤的2-丙基和其它烷基衍生物;2-硫尿嘧啶;2-硫代胸腺嘧啶和2-硫胞嘧啶;5-卤代尿嘧啶和胞嘧啶;5-丙炔基(-c=c-ch3)尿嘧啶和胞嘧啶以及其它嘧啶碱基的炔基衍生物;6-偶氮尿嘧啶;胞嘧啶和胸腺嘧啶;5-尿嘧啶(假尿嘧啶);4-硫尿嘧啶;8-卤素;8-氨基;8-硫醇;8-硫代烷基;8-羟基和其它8-取代腺嘌呤和鸟嘌呤;5-卤基尤其是5-溴、5-三氟甲基和其它5-取代尿嘧啶和胞嘧啶;7-甲基鸟嘌呤和7-甲基腺嘌呤;2-f-腺嘌呤;2-氨基腺嘌呤;8-氮鸟嘌呤和8-氮杂腺嘌呤;7-脱氮鸟嘌呤和7-脱氮腺嘌呤;以及3-脱氮鸟嘌呤和3-脱氮腺嘌呤。进一步修饰的核碱基包含三环嘧啶,如吩恶嗪胞苷(1h-嘧啶并(5,4-b)(1,4)苯并恶嗪-2(3h)-酮);吩噻嗪胞苷(1h-嘧啶并(5,4-b)(1,4)苯并噻嗪-2(3h)-酮);g-钳位,如取代的吩恶嗪胞苷(例如9-(2-氨基乙氧基)-h-嘧啶并(5,4-(b)(1,4)苯并恶嗪-2(3h)-酮);咔唑胞苷(2h-嘧啶并(4,5-b)吲哚-2-酮);吡啶并吲哚胞苷(h-吡啶并(3',2':4,5)吡咯并(2,3-d)嘧啶-2-酮)。在一些情况下,核酸有效负载可以包含缀合物部分(例如,增强核酸有效负载的活性、稳定性、细胞分布或细胞摄取的一个缀合物部分)。这些部分或缀合物可以包含与如伯羟基基团或仲羟基基团等官能团共价结合的缀合物基团。缀合物基团包含但不限于嵌入剂、报告分子、聚胺、聚酰胺、聚乙二醇、聚醚、提高寡聚物的药效性质的基团以及提高寡聚物的药代动力学性质的基团。合适的缀合物基团包含但不限于胆固醇、脂质、磷脂、生物素、吩嗪、叶酸、菲啶、蒽醌、吖啶、荧光素、罗丹明、香豆素以及染料。提高药效性质的基团包含改善摄取、提高抗降解性和/或增强与靶核酸的序列特异性杂交的基团。增强药代动力学性质的基团包含改善受试者核酸的摄取、分布、代谢或排泄的基团。任何方便的多核苷酸都可以用作受试者核酸有效负载。实例包含但不限于:rna和dna的种类,其包含mrna、m1a修饰的mrna(在腺苷的位置1处的单甲基化)、sirna、mirna、适配子、shrna、aav衍生的核酸和支架、吗啉代rna、类肽和肽核酸、cdna、dna折纸、具有合成核苷酸的dna和rna、具有预定义二级结构的dna和rna、前述的多聚体和寡聚体以及其序列可以编码如期望表达的任何蛋白质或多肽等其它产物的有效负载。在一些情况下,受试者递送分子的有效负载包含蛋白质。蛋白质有效负载的实例包含但不限于:可编程基因编辑蛋白(例如,转录激活因子样(tal)效应子(tale);tale核酸酶(talen);锌指蛋白(zfp);锌指核酸酶(zfn);如格氏嗜盐碱杆菌argonaute(ngago)等dna引导的多肽;如cas9、casx、casy、cpf1等crispr/casrna引导的多肽等);转座子(例如,i类或ii类转座子-例如,piggybac、睡美人、tc1/mariner、tol2、pif/harbinger、hat、mutator、merlin、transib、helitron、maverick、青蛙王子、minos、himar1等);大范围核酸酶(例如,i-scei、i-ceui、i-crei、i-dmoi、i-chui、i-diri、i-flmui、i-flmuii、i-anil、i-sceiv、i-csmi、i-pani、i-panii、i-panmi、i-sceii、i-ppoi、i-sceiii、i-ltri、i-gpii、i-gzei、i-onui、i-hjemi、i-msoi、i-tevi、i-tevii、i-teviii、pi-mlei、pi-mtui、pi-pspi、pi-tlii、pi-tliii、pi-scev等);megatals(参见,例如,boissel等人,《核酸研究(nucleicacidsres)》2014年2月;42(4):2591–2601);scf;bcl-xl;foxp3;hoxb4;以及sirt6。对于以上任何蛋白质,受试者递送分子的有效负载可以包含编码蛋白质的核酸(dna和/或mrna)和/或可以包含实际蛋白质。基因编辑工具在一些情况下,核酸有效负载包含或编码基因编辑工具(即,基因编辑系统,例如,如可编程基因编辑系统等位点特异性基因编辑系统的组分)。例如,核酸有效负载可以包含以下一种或多种:(i)crispr/cas引导rna;(ii)编码crispr/cas引导rna的dna;(iii)编码如锌指蛋白(zfp)(例如,锌指核酸酶-zfn)、转录激活因子样效应子(tale)蛋白(例如,融合到核酸酶-talen)、如格氏嗜盐碱杆菌argonaute(ngago)等dna引导的多肽和/或crispr/casrna引导的多肽(例如,cas9、casx、casy、cpf1等)等可编程基因编辑蛋白的dna和/或rna;(iv)dna供体模板;(v)编码位点特异性重组酶(例如,cre重组酶、dre重组酶、flp重组酶、kd重组酶、b2重组酶、b3重组酶、r重组酶、hin重组酶、tre重组酶、phic31整合酶、bxb1整合酶、r4整合酶、λ整合酶、hk022整合酶、hp1整合酶等)的核酸分子(dna,rna);(vi)编码解离酶和/或转化酶(例如,gln、hin、γδ3、tn3、sin、beta等)的dna;以及(vii)转座子和/或衍生自转座子(例如,如tn3、tn5、tn7、tn9、tn10、tn903、tn1681等细菌转座子;如tc1/mariner超家族转座子、piggybac超家族转座子、hat超家族转座子、piggybac、睡美人、青蛙王子、minos、himar1等真核转座子)的dna。在一些情况下,受试者递送分子用于递送蛋白质有效负载,例如,如zfp(例如,zfn)、tale(例如,talen)、如格氏嗜盐碱杆菌argonaute(ngago)等dna引导的多肽和/或crispr/casrna引导的多肽(例如,cas9、casx、casy、cpf1等)等基因编辑蛋白;位点特异性重组酶(例如,cre重组酶、dre重组酶、flp重组酶、kd重组酶、b2重组酶、b3重组酶、r重组酶、hin重组酶、tre重组酶、phic31整合酶、bxb1整合酶、r4整合酶、λ整合酶、hk022整合酶、hp1整合酶等);解离酶/转化酶(例如,gln、hin、γδ3、tn3、sin、beta等);和/或转座酶(例如,与转座子相关的转座酶,如细菌转座子,如tn3、tn5、tn7、tn9、tn10、tn903、tn1681等;或者如tc1/mariner超家族转座子、piggybac超家族转座子、hat超家族转座子、piggybac、睡美人、青蛙王子、minos、himar1等真核转座子)。在一些情况下,递送分子用于递送核酸有效负载和蛋白质有效负载,并且在一些这种情况下,有效负载包含核糖核蛋白复合物(rnp)。根据系统的性质和期望的结果,基因编辑系统(例如,如可编程基因编辑系统等位点特异性基因编辑系统)可以包含单个组分(例如,zfp、zfn、tale、talen、位点特异性重组酶、解离酶/整合酶、转座酶、转座子等)或者可以包含多种组分。在一些情况下,基因编辑系统包含至少两种组分。例如,在一些情况下,基因编辑系统(例如可编程基因编辑系统)包含(i)供体模板核酸;以及(ii)基因编辑蛋白(例如,可编程基因编辑蛋白,如zfp、zfn、tale、talen;如格氏嗜盐碱杆菌argonaute(ngago)等dna引导的多肽;如cas9、casx、casy或cpf1等crispr/casrna引导的多肽)或编码基因编辑蛋白的核酸分子(例如,如质粒或mrna等dna或rna)。作为另一个实例,在一些情况下,基因编辑系统(例如,可编程基因编辑系统)包含(i)crispr/cas引导rna,或编码crispr/cas引导rna的dna;以及(ii)crispr/casrna引导的多肽(例如,cas9、casx、casy、cpf1等),或编码rna引导的多肽的核酸分子(例如,如质粒或mrna等dna或rna)。作为另一个实例,在一些情况下,基因编辑系统(例如可编程基因编辑系统)包含(i)ngago类似的引导dna;以及(ii)dna引导的多肽(例如,ngago),或编码dna引导的多肽的核酸分子(例如,如质粒或mrna等dna或rna)。在一些情况下,基因编辑系统(例如可编程基因编辑系统)包含至少三种组分:(i)供体dna模板;(ii)crispr/cas引导rna,或编码crispr/cas引导rna的dna;以及(iii)crispr/casrna引导的多肽(例如,cas9、casx、casy、cpf1),或编码rna引导的多肽的核酸分子(例如,如质粒或mrna等dna或rna)。在一些情况下,基因编辑系统(例如可编程基因编辑系统)包含至少三种组分:(i)供体dna模板;(ii)ngago类似的引导dna,或编码ngago类似的引导dna的dna;以及(iii)dna引导的多肽(例如,ngago),或编码dna引导的多肽的核酸分子(例如,如质粒或mrna等dna或rna)。在一些实施例中,受试者递送分子用于递送基因编辑工具。换句话说,在某些情况下,有效负载包含一个或多个基因编辑工具。本文中使用的术语“基因编辑工具”指的是基因编辑系统的一个或多个组分。因此,在一些情况下,有效负载包含基因编辑系统并且在一些情况下,有效负载包含基因编辑系统的一个或多个组分(即,一个或多个基因编辑工具)。例如,靶细胞可能已经包含基因编辑系统的组分中的一个组分并且用户只需要添加其余的组分。在这种情况下,受试者递送分子的有效负载不一定包含给定基因编辑系统的所有组分。因此,在一些情况下,有效负载包含一个或多个基因编辑工具。作为说明性实例,靶细胞可能已经包含基因编辑蛋白(例如,zfp;tale;dna引导的多肽(例如,ngago);crispr/casrna引导的多肽,如cas9、casx、casy、cpf1等;如cre重组酶、dre重组酶、flp重组酶、kd重组酶、b2重组酶、b3重组酶、r重组酶、hin重组酶、tre重组酶、phic31整合酶、bxb1整合酶、r4整合酶、λ整合酶、hk022整合酶、hp1整合酶等位点特异性重组酶;如gin、hin、γδ3、tn3、sin、beta等溶解酶/转化酶;转座酶等)和/或编码所述蛋白质的dna或rna,并且因此有效负载可以包含以下中的一个或多个:(i)供体模板;以及(ii)crispr/cas引导rna,或编码crispr/cas引导rna的dna;或ngago类似的引导dna。同样地,靶细胞可能已经包含crispr/cas引导rna和/或编码引导rna的dna或ngago类似的引导dna,并且有效负载可以包含以下中的一个或多个:(i)供体模板;以及(ii)crispr/casrna引导的多肽(例如,cas9、casx、casy、cpf1等),或编码rna引导的多肽的核酸分子(例如,如质粒或mrna等dna或rna);或dna引导的多肽(例如,ngago),或编码dna引导的多肽的核酸分子。如本领域普通技术人员将理解的,基因编辑系统不需要是“编辑”核酸的系统。例如,应充分认识到,基因编辑系统可以用于以多种方式修饰靶核酸(例如,dna和/或rna),而不会在靶dna中产生双链断裂(dsb)。例如,在一些情况下,双链靶dna被切口(一条链被切割),并且在一些情况下(例如,在基因编辑蛋白缺乏核酸酶活性的一些情况下,例如,crispr/casrna引导多肽可能在催化核酸酶结构域中具有突变),靶核酸根本未被切割。例如,在一些情况下,具有或不具有核酸酶活性的crispr/cas蛋白(例如,cas9、casx、casy、cpf1)与异源蛋白结构域融合。异源蛋白结构域可以为融合蛋白提供活性,如(i)dna修饰活性(例如,核酸酶活性、甲基转移酶活性、去甲基化酶活性、dna修复活性、dna损伤活性、脱氨活性、歧化酶活性、烷基化活性、脱嘌呤活性、氧化活性、嘧啶二聚体形成活性、整合酶活性、转座酶活性,重组酶活性,聚合酶活性、连接酶活性、解旋酶活性、光解酶活性或糖基化酶活性);(ii)转录调节活性(例如,与转录抑制因子或激活因子的融合);或(iii)修饰与靶dna缔合的蛋白质(例如组蛋白)的活性(例如甲基转移酶活性、去甲基化酶活性、乙酰转移酶活性、脱乙酰酶活性、激酶活性、磷酸酶活性、泛素连接酶活性、去泛素化活性、腺苷酸化活性、去腺苷酸化活性、sumo化活性、去sumo化活性、核糖基化活性、去核糖基化活性、豆蔻酰化活性或去豆蔻酰化活性)。因此,基因编辑系统可以用于以不切割靶核酸的方式修饰靶核酸的应用中,并且还可以用于调节来自靶dna的转录的应用中。有关可编程基因编辑工具的另外的信息(例如,如cas9、casx、casy和cpf1等crispr/casrna引导的蛋白;如锌指核酸酶等锌指蛋白;如talen等tale蛋白;crispr/cas引导rna等等)参照例如dreier等人,(2001)《生物化学杂志(jbiolchem)》276:29466-78;dreier等人,(2000)《生物化学杂志》303:489-502;liu等人,(2002)《生物化学杂志》277:3850-6);dreier等人,(2005)《生物化学杂志》280:35588-97;jamieson等人,(2003)《自然评论药物发现(naturerevdrugdiscov》2:361-8;durai等人,(2005)《核酸研究》33:5978-90;segal,(2002)《方法(methods)》26:76-83;porteus和carroll,(2005)《自然生物技术(natbiotechnol)》23:967-73;pabo等人,(2001)《生物化学年鉴(annurevbiochem)》70:313-40;wolfe等人,(2000)《生物物理和生物分子结构年鉴(annrevbiophysbiomolstruct)》29:183-212;segal和barbas,(2001)《生物技术新见(curropinbiotechnol)》12:632-7;segal等人,(2003)《生物化学(biochemistry)》42:2137-48;beerli和barbas,(2002)《自然生物技术》20:135-41;carroll等人,(2006)《自然实验手册(natureprotocols)》1:1329;ordiz等人,(2002)《美国国家科学院院刊(proc.natl.acad.sci.usa)》99:13290-5;guan等人,(2002)《美国国家科学院院刊》99:13296-301;sanjana等人,《自然实验手册》,7:171-192(2012);zetsche等人,《细胞(cell)》2015年10月22日;163(3):759-71;makarova等人,《自然评论微生物学(natrevmicrobiol.)》2015年11月;13(11):722-36;shmakov等人,《分子细胞(molcell)》2015年11月5日;60(3):385-97;jinek等人,《科学(science)》2012年8月17日;337(6096):816-21;chylinski等人,《rna生物学(rnabiol.)》2013年5月;10(5):726-37;ma等人,《生物医学国际化研究(biomedresint.)》2013;2013:270805;hou等人,《美国科学院院报(procnatlacadsciusa.)》2013年9月24日;110(39):15644-9;jinek等人,《elife》2013;2:e00471;pattanayak等人,《自然生物技术》2013年9月;31(9):839-43;qi等人,《细胞》2013年2月28日;152(5):1173-83;wang等人,《细胞》2013年5月9日;153(4):910-8;auer等人,《基因组研究(genomeres.)》2013年10月31日;chen等人,《核酸研究》2013年11月1日;41(20):e19;cheng等人,《细胞研究(cellres.)》2013年10月;23(10):1163-71;cho等人,《遗传学(genetics)》2013年11月;195(3):1177-80;dicarlo等人,《核酸研究》2013年4月;41(7):4336-43;dickinson等人,《自然方法(natmethods)》2013年10月;10(10):1028-34;ebina等人,《科学报告(scirep.)》2013;3:2510;fujii等人,《核酸研究》2013年11月1日1;41(20):e187;hu等人,《细胞研究》2013年11月;23(11):1322-5;jiang等人,《核酸研究》2003年11月1日;41(20):e188;larson等人,《自然实验手册》2013年11月;8(11):2180-96;mali等人,《自然方法》2013年10月;10(10):957-63;nakayama等人,《遗传学》2013年12月;51(12):835-43;ran等人,《自然实验手册》2013年11月;8(11):2281-308;ran等人,《细胞》2013年9月12日;154(6):1380-9;upadhyay等人,《g3(bethesda)》2013年12月9日;3(12):2233-8;walsh等人,《美国科学院院报》2013年9月24日;110(39):15514-5;xie等人,《分子植物(molplant)》2013年10月9日;yang等人,《细胞》2013年9月12日;154(6):1370-9;briner等人,《分子细胞》2014年10月23日;56(2):333-9;burstein等人,《自然》2016年12月22日-印刷前的电子出版物;gao等人,《自然生物技术》2016年7月,34(7):768-73;以及国际专利申请公开第wo2002099084号;第wo00/42219号;第wo02/42459号;第wo2003062455号;第wo03/080809号;第wo05/014791号;第wo05/084190号;第wo08/021207号;第wo09/042186号;第wo09/054985号;和第wo10/065123号;美国专利申请公开第20030059767号、第20030108880号、第20140068797号;第20140170753号;第20140179006号;第20140179770号;第20140186843号;第20140186919号;第20140186958号;第20140189896号;第20140227787号;第20140234972号;第20140242664号;第20140242699号;第20140242700号;第20140242702号;第20140248702号;第20140256046号;第20140273037号;第20140273226号;第20140273230号;第20140273231号;第20140273232号;第20140273233号;第20140273234号;第20140273235号;第20140287938号;第20140295556号;第20140295557号;第20140298547号;第20140304853号;第20140309487号;第20140310828号;第20140310830号;第20140315985号;第20140335063号;第20140335620号;第20140342456号;第20140342457号;第20140342458号;第20140349400号;第20140349405号;第20140356867号;第20140356956号;第20140356958号;第20140356959号;第20140357523号;第20140357530号;第20140364333号;第20140377868号;第20150166983号;和第20160208243号;以及美国专利第6,140,466号;第6,511,808号;第6,453,242号;第8,685,737号;第8,906,616号;第8,895,308号;第8,889,418号;第8,889,356号;第8,871,445号;第8,865,406号;第8,795,965号;第8,771,945号;和第8,697,359号;这些文献中的全部内容通过引用以其全文并入本文。递送提供了将核酸、蛋白质或核糖核蛋白有效负载递送到细胞的方法。这种方法包含使细胞与受试者递送分子接触的步骤。所述细胞可以是包含由本公开的递送分子的靶向配体靶向的细胞表面蛋白的任何细胞。在一些情况下,所述细胞是哺乳动物细胞(例如,啮齿动物细胞、大鼠细胞、小鼠细胞、猪细胞、牛细胞、马细胞、羊细胞、兔细胞、豚鼠细胞、犬细胞、猫细胞、灵长类动物细胞、非人灵长类动物细胞、人细胞等)。这种方法可以包含使细胞与受试者递送分子接触的步骤。受试者递送分子可以用于将有效负载递送到任何期望的真核靶细胞。在一些情况下,靶细胞是哺乳动物细胞(例如,啮齿动物、小鼠、大鼠、有蹄动物、牛、羊、猪、马、骆驼、兔子、犬(狗)、猫科动物(猫)、灵长类动物、非人类灵长类动物或人的细胞)。任何细胞类型都可以被靶向,并且在一些情况下,特定细胞的特异性靶向取决于靶向配体的存在,例如作为递送分子的一部分,其中靶向配体提供与特定细胞类型的靶向结合。例如,可以靶向的细胞包含但不限于骨髓细胞、造血干细胞(hsc)、长期hsc、短期hsc、造血干细胞和祖细胞(hspc)、外周血单核细胞(pbmc)、骨髓祖细胞、淋巴祖细胞、t细胞、b细胞、nkt细胞、nk细胞、树突细胞、单核细胞、粒细胞、红细胞、巨核细胞、肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、中性粒细胞、巨噬细胞、红系祖细胞(例如,hudep细胞)、巨核细胞-红系祖细胞(mep)、共同髓系祖细胞(cmp)、多能祖细胞(mpp)、造血干细胞(hsc),短期hsc(st-hsc)、it-hsc、长期hsc(lt-hsc)、内皮细胞、神经细胞、星形胶质细胞、胰腺细胞、胰岛β细胞、肌细胞、骨骼肌细胞、心肌细胞、肝细胞、脂肪细胞、肠细胞、结肠细胞和胃细胞。各种应用(例如,用于靶向神经细胞、胰腺细胞、造血干细胞和多能祖细胞等)的实例有很多。例如,可以靶向造血干细胞和多能祖细胞以进行体内基因编辑(例如,插入)。甚至在体内编辑1%的骨髓细胞(约150亿个细胞)将比离体治疗(约100亿个细胞)靶向更多的细胞。作为另一个实例,可以靶向胰腺细胞(例如,β胰岛细胞),例如,以治疗胰腺癌、治疗糖尿病等。作为另一个实例,可以靶向如神经细胞等大脑中的体细胞,(例如,以治疗如亨廷顿病、帕金森病(例如,lrrk2突变)和als(例如,sod1突变)等适应症)。在一些情况下,这可以通过直接颅内注射来实现。作为另一个实例,可以用受试者递送分子靶向内皮细胞和造血系统的细胞(例如,巨核细胞和/或巨核细胞上游的任何祖细胞,如巨核细胞-红系祖细胞(mep)、共同髓系祖细胞(cmp)、多能祖细胞(mpp)、造血干细胞(hsc)、短期hsc(st-hsc)、it-hsc、长期hsc(lt-hsc))以治疗冯·维勒布兰德氏病。例如,可以靶向在编码冯·维勒布兰德因子(vwf)的基因中具有突变的细胞(例如,内皮细胞;巨核细胞和/或巨核细胞上游的任何祖细胞,如mep、cmp、mpp、hsc(如st-hsc、it-hsc和/或lt-hsc))以引入活性蛋白(例如,通过递送功能性vwf蛋白和/或编码功能性vwf蛋白的核酸)和/或以编辑突变基因,例如,通过引入替代序列(例如,通过递送基因编辑工具并且递送dna供体模板)。在以上一些情况下(例如,在与治疗冯维勒布兰德氏病相关的情况下;在与靶向在编码vwf的基因中具有突变的细胞相关的情况下),受试者靶向配体提供与e-选择蛋白的靶向结合。作为另一个实例,可以用受试者递送分子(或受试者病毒或非病毒递送载体)靶向干细胞谱系的细胞(例如,造血谱系的干细胞和/或祖细胞,例如,gmp、mep、cmp、mlp、mpp和/或hsc)以增加细胞中干细胞因子(scf)的表达,其因此可以驱动靶细胞的增殖。例如,受试者递送分子可以用于将scf和/或编码scf的核酸(dna或mrna)递送到靶细胞。本公开的方法和组合物可以用于治疗任何数量的疾病,包含与例如基因组中的突变等已知致病突变相关的任何疾病。例如,本公开的方法和组合物可以用于治疗镰状细胞病、β地中海贫血、hiv、骨髓增生异常综合征、jak2介导的真性红细胞增多症、jak2介导的原发性骨髓纤维化、jak2介导的白血病以及各种血液病。作为另外的非限制性实例,本公开的方法和组合物还可以用于b细胞抗体产生、免疫疗法(例如,递送检查点阻断试剂)以及干细胞分化应用。如上文所提到的,在一些实施例中,靶向配体提供与klscd27+/il-7ra-/cd150+/cd34-造血干细胞和祖细胞(hspc)的靶向结合。例如,可以引入基因编辑工具(本文其它地方所描述的)以破坏bcl11a转录因子的表达并且因此产生胎儿血红蛋白。作为另一个实例,可以直接靶向β-珠蛋白(hbb)基因以用对应的同源定向修复供体模板校正改变的e7v取代。作为一个说明性实例crispr/casrna引导的多肽(例如,cas9,casx,casy,cpf1)可以与适当的引导rna一起递送,使得其将与hbb基因上的位点结合并且在基因组中产生双链或单链断裂,启动基因组修复。在一些情况下,引入dna供体模板(单链或双链)(作为有效负载的一部分)。在一些情况下,有效负载可以包含用于ku70或ku80的sirna,例如,所述sirna可以用于促进同源定向修复(hdr)并且限制插入缺失形成。在一些情况下,用于sirt6的mrna在14-30d内释放以在核酸酶介导的位点特异性切割之后促进hdr驱动的供体链的插入。在一些实施例中,靶向配体提供与cd4+或cd8+t细胞、造血干细胞和祖细胞(hspc)或外周血单核细胞(pbmc)的靶向结合,以修饰t细胞受体。例如,可以引入一个或多个基因编辑工具(本文其它地方所描述的)以修饰t细胞受体。可以直接靶向并且用对应的同源定向修复供体模板取代t细胞受体以形成新型t细胞受体。作为一个实例,crispr/casrna引导的多肽(例如,cas9,casx,casy,cpf1)可以与适当的引导rna一起递送,使得其将与tcr基因上的位点结合并且在基因组中产生双链或单链断裂,启动基因组修复。在一些情况下,引入用于hdr的dna供体模板(单链或双链)(作为有效负载的一部分)。对于技术人员而言将显而易见的是,可以根据本公开使用其它crispr引导rna和hdr供体序列、靶向β-珠蛋白、ccr5、t细胞受体或任何其它目的基因和/或其它表达载体。在一些情况下,接触是体外的(例如,细胞处于培养中),例如,细胞可以是已建立的组织培养细胞系的细胞。在一些情况下,接触是离体的(例如,细胞是从个体(例如患者)分离的原代细胞(或近后代)。在一些情况下,细胞是体内的并且因此在生物体的(部分的)内部。作为体内接触的实例,在一些情况下,接触步骤包含向个体施用递送分子(例如,缀合到核酸或蛋白质有效负载的靶向配体、用受试者靶向配体涂覆的纳米颗粒、缀合到与核酸有效负载缩合的带电聚合物多肽结构域的靶向配体等)。可以经由以下途径中的任何途径将受试者递送分子引入到受试者(即,向个体施用):全身的、局部的、肠胃外的、皮下的(s.c.)、静脉内的(i.v.)、颅内的(i.c.)、脊柱内的、眼内的、皮内的(i.d.)、肌肉内的(i.m.)、淋巴管内的(i.l.)或进入脊髓液。可以通过注射(例如,全身注射、直接局部注射、局部注射到或接近肿瘤和/或肿瘤切除部位等)导管等引入受试者递送分子。用于局部递送(例如,递送到肿瘤和/或癌症部位)的方法的实例包含例如通过推注,例如,通过注射器,例如,注射到关节、肿瘤或器官中,或者在关节、肿瘤或器官附近;例如,通过连续输注,例如,通过插管,例如,用对流(参见,例如,美国申请第20070254842号,通过引用并入本文)。对受试者的治疗施用次数可以变化。将受试者递送分子引入个体可以是一次性事件;但在某些情况下,这种治疗可能会在一段有限的时间内引起改善并且需要进行一系列持续的重复治疗。在其它情况下,在观察到效果之前,可能需要多次施用受试者递送分子。如本领域普通技术人员将容易理解的,确切的方案取决于疾病或病症、疾病的阶段和所治疗的个体的参数。“治疗有效剂量”或“治疗剂量”是足以产生期望的临床结果(即,实现治疗效果)的量。治疗有效剂量可以以一次或多次施用进行施用。出于本公开的目的,受试者递送分子的治疗有效剂量是当向个体施用时,足以减轻、改善、稳定、逆转、防止、减缓或延迟疾病状态/病痛的进展的量。除了去除已经整合到宿主基因组中的任何逆转录病毒dna之外,示例治疗性干预是产生对hiv感染的抗性的干预。t细胞直接受hiv影响并且因此可以探索cd34+和cd45+细胞的混合血液靶向策略以递送双引导核酸酶。通过同时靶向hsc和t细胞并且通过多个引导核酸酶(例如,在单个颗粒内)向ccr5-δ32和gag/rev/pol基因递送消融,可以通过患者生命的持久性产生通用的hiv疗法。受试者递送分子可以被修饰,例如,出于各种目的结合到各种各样的其它寡肽或蛋白质。例如,翻译后修饰,例如通过异戊烯化、乙酰化、酰胺化、羧化、糖基化、聚乙二醇化(聚乙二醇(peg)聚合物链的共价连接)等。这种修饰也可以包含糖基化的修饰,例如在它的合成或处理或进一步的处理步骤期间通过修饰多肽的糖基化模式做出的修饰;例如,通过将递送分子暴露于影响糖基化的酶,例如哺乳动物糖基化或去糖基化酶。在一些实施例中,受试者递送分子具有一个或多个磷酸化氨基酸残基,例如磷酸酪氨酸、磷酸丝氨酸或磷酸苏氨酸。在一些其它实施例中,可以修饰本公开的递送分子以提高对蛋白水解降解的抗性或优化溶解性特性或使其更适合作为治疗剂。例如,本公开的递送分子可以包含含有除了天然存在的l-氨基酸,例如d-氨基酸或非天然存在的合成氨基酸之外的残基的类似物。可以用所述氨基酸残基中的一些或所有氨基酸残基取代d-氨基酸。在一些情况下,可以将受试者递送分子嵌入表面(例如,以盘/板的格式),例如代替抗体用于生物传感应用。在一些情况下,可以将受试者递送分子添加到纳米钻石(例如,可以用于涂覆纳米钻石)。试剂盒也在本公开的范围内。例如,在一些情况下,受试者试剂盒可以包含以下(以任何组合)中的一个或多个:(i)靶向配体;(ii)连接子;(iii)与连接子缀合的靶向配体;(iv)与带电聚合物多肽结构域缀合的靶向配体(例如,有或没有连接子);(v)sirna或用于sirna或shrna的转录模板;以及(iv)用作阴离子纳米颗粒稳定涂层的试剂。在一些情况下,受试者试剂盒可以包含使用说明。试剂盒通常包含指示试剂盒内容物的预期用途的标签。术语标签包含在试剂盒上或与试剂盒上一起提供的任何书写或记录材料,或者以其它方式随附于试剂盒的书写或记录材料。本公开的示例性非限制性方面上文描述的本主题的方面(包含实施例)可以单独地有益或与一个或多个其它方面或实施例组合地有益。在不限制前述描述的情况下,下文提供了编号为1-50(集a)和1-59(集b)的本公开的某些非限制性方面。如对于本领域普通技术人员将显而易见的是,在阅读本公开时,每个单独编号的方面可以与前面或后面的任何单独编号的方面一起使用或组合。这旨在为所述方面的所有这种组合提供支持并且不限于下文明确提供的方面的组合:集a1.一种递送分子,其包括与蛋白质或核酸有效负载缀合或与带电聚合物多肽结构域缀合的肽靶向配体,其中所述靶向配体提供(i)与细胞表面蛋白的靶向结合以及(ii)长内体再循环途径的接合。2.根据1所述的递送分子,其中所述靶向配体包括内部半胱氨酸残基。3.根据1或2所述的递送分子,其中相对于对应的野生型氨基酸序列,所述靶向配体在一个或多个内部氨基酸位置处包括半胱氨酸取代或插入。4.根据1到3中任一项所述的递送分子,其中所述靶向配体在n-末端和/或c-末端处包括半胱氨酸残基。5.根据4所述的递送分子,其中在所述n-末端和/或所述c-末端处的所述半胱氨酸残基是相对于对应的野生型氨基酸序列的取代或插入。6.根据1到6中任一项所述的递送分子,其中所述靶向配体具有5-50个氨基酸的长度。7.根据1到6中任一项所述的递送分子,其中所述靶向配体是野生型蛋白质的片段。8.根据1到7中任一项所述的递送分子,其中所述靶向配体提供与选自家族bg-蛋白偶联受体(gpcr)、受体酪氨酸激酶(rtk)、细胞表面糖蛋白以及细胞-细胞粘附分子的细胞表面蛋白的靶向结合。9.根据8所述的递送分子,其中所述靶向配体提供与家族bgpcr的变构-亲和结构域和正构结构域的结合以分别提供靶向结合和长内体再循环途径的接合。10.根据9所述的递送分子,其中靶向配体包括与毒蜥外泌肽-4氨基酸序列:hgegtftsdlskqmeeeavrlfiewlknggpssgappps(seqidno.1)具有85%或更高同一性(例如,100%同一性)的氨基酸序列。11.根据10所述的递送分子,其中所述靶向配体在与seqidno:1)所示氨基酸序列的l10、s11和k12相对应的位置中的一个或多个位置处包括半胱氨酸取代。12.根据9所述的递送分子,其中所述靶向配体包括氨基酸序列:hgegtftsdlckqmeeeavrlfiewlknggpssgappps(seqidno.2)。13.根据8所述的递送分子,其中所述靶向配体提供与rtk的靶向结合。14.根据13所述的递送分子,其中所述rtk是成纤维细胞生长因子(fgf)受体。15.根据14所述的递送分子,其中所述靶向配体是fgf的片段。16.根据14或15所述的递送分子,其中所述靶向配体与在正构结合期间被占据的所述rtk的片段结合。17.根据13到16中任一项所述的递送分子,其中所述靶向配体与所述rtk的肝素-亲和结构域结合。18.根据13到17中任一项所述的递送分子,所述靶向配体提供与fgf受体的靶向结合,并且其中所述靶向配体包括与氨基酸序列knggfflrihpdgrvdgvreks(seqidno:4)具有85%或更高同一性(例如,100%同一性)的氨基酸序列。19.根据13到17中任一项所述的递送分子,所述靶向配体提供与fgf受体的靶向结合,并且其中所述靶向配体包括氨基酸序列hfkdpk(seqidno:5)。20.根据13到17中任一项所述的递送分子,所述靶向配体提供与fgf受体的靶向结合,并且其中所述靶向配体包括氨基酸序列lesnnynt(seqidno:6)。21.根据8所述的递送分子,其中所述靶向配体提供与细胞表面糖蛋白和/或细胞-细胞粘附因子的靶向结合。22.根据21所述的递送分子,其中所述靶向配体是e-选择蛋白、l-选择蛋白或p-选择蛋白的片段。23.根据21所述的递送分子,其中所述靶向配体包括与氨基酸序列miasqflsaltlvllikesga(seqidno:7)具有85%或更高同一性(例如,100%同一性)的氨基酸序列。24.根据21所述的递送分子,其中所述靶向配体包括与氨基酸序列mvfpwrcegtywgsrnilklwvwtllccdflihhgthc(seqidno:8)、mifpwkcqstqrdlwnifklwgwtmlccdflahhgtdc(seqidno:9)和/或mifpwkcqstqrdlwnifklwgwtmlcc(seqidno:10)具有85%或更高同一性(例如,100%同一性)的氨基酸序列。25.根据8所述的递送分子,其中所述靶向配体提供与细胞-细胞粘附分子的靶向结合。26.根据1到7中任一项所述的递送分子,其中所述靶向配体提供与转铁蛋白受体的靶向结合,并且其中所述靶向配体包括与氨基酸序列thrppmwspvwp(seqidno:11)具有85%或更高同一性(例如,100%同一性)的氨基酸序列。27.根据1到7中任一项所述的递送分子,其中所述靶向配体提供与α5β1整合蛋白的靶向结合。28.根据27所述的递送分子,其中所述靶向配体包括氨基酸序列rretawa(seqidno:12)。29.根据27所述的递送分子,其中所述靶向配体包括氨基酸序列rgd。30.根据1到29中任一项所述的递送分子,其中所述靶向配体在与所述细胞表面蛋白结合时提供β-抑制蛋白的接合(例如,以提供信号传导偏差并且通过正构结合后的内吞作用促进内化)。31.根据1到30中任一项所述的递送分子,其中所述靶向配体与核酸有效负载缀合。32.根据31所述的递送分子,其中所述核酸有效负载是rnai剂。33.根据32所述的递送分子,其中所述rnai剂是sirna分子。34.根据1到30中任一项所述的递送分子,其中所述靶向配体与蛋白质有效负载缀合。35.根据1到30中任一项所述的递送分子,其中所述有效负载是核糖核蛋白复合物并且所述靶向配体与所述复合物的核酸或蛋白质组分缀合。36.根据1到30中任一项所述的递送分子,其中所述靶向配体与带电聚合物多肽结构域缀合。37.根据36所述的递送分子,其中所述带电聚合物多肽结构域与核酸有效负载缩合。38.根据36所述的递送分子,其中所述递送分子的所述带电聚合物多肽结构域与纳米颗粒的带电稳定层以静电方式相互作用。39.根据36到38中任一项所述的递送分子,其中所述带电聚合物多肽结构域是选自rrrrrrrrr(9r)(seqidno:15)和hhhhhh(6h)(seqidno:16)的阳离子结构域。40.根据1到39中任一项所述的递送分子,其中所述靶向配体包括半胱氨酸残基并且通过所述半胱氨酸残基与所述有效负载缀合。41.根据1到40中任一项所述的递送分子,其中所述靶向配体通过巯基或胺反应性化学与所述有效负载缀合。42.根据1到41中任一项所述的递送分子,其中所述靶向配体通过间插连接子与所述有效负载缀合。43.根据42所述的递送分子,其中靶向配体包括半胱氨酸残基并且通过所述半胱氨酸残基与所述连接子缀合。44.根据42或43所述的递送分子,其中所述连接子通过巯基或胺反应性化学与所述靶向配体和/或所述有效负载缀合。45.根据42到44中任一项所述的递送分子,其中所述连接子是刚性的。46.根据42到44中任一项所述的递送分子,其中所述连接子是柔性的。47.根据42到44中任一项所述的递送分子,其中所述连接子是内体溶解的。48.根据42到47中任一项所述的递送分子,其中所述连接子是多肽。49.根据42到47中任一项所述的递送分子,其中所述连接子不是多肽。50.一种将核酸、蛋白质或核糖核蛋白有效负载递送到细胞的方法,所述方法包括:使细胞与1到49中任一项所述的递送分子接触。51.根据50所述的方法,其中所述细胞是哺乳动物细胞。52.根据50或51所述的方法,其中所述细胞在体外或是离体的。53.根据50或51所述的方法,其中所述细胞在体内。集b1.一种递送分子,其包括与蛋白质或核酸有效负载缀合或与带电聚合物多肽结构域缀合的肽靶向配体,其中所述靶向配体提供与细胞表面蛋白的靶向结合。2.根据1所述的递送分子,其中所述靶向配体包括内部半胱氨酸残基。3.根据1或2所述的递送分子,其中相对于对应的野生型氨基酸序列,所述靶向配体在一个或多个内部氨基酸位置处包括半胱氨酸取代或插入。4.根据1到3中任一项所述的递送分子,其中所述靶向配体在n-末端和/或c-末端处包括半胱氨酸残基。5.根据4所述的递送分子,其中在所述n-末端和/或所述c-末端处的所述半胱氨酸残基是相对于对应的野生型氨基酸序列的取代或插入。6.根据1到5中任一项所述的递送分子,其中所述靶向配体具有5-50个氨基酸的长度。7.根据1到6中任一项所述的递送分子,其中所述靶向配体是野生型蛋白质的片段。8.根据1到7中任一项所述的递送分子,其中所述靶向配体提供与选自家族bg-蛋白偶联受体(gpcr)、受体酪氨酸激酶(rtk)、细胞表面糖蛋白以及细胞-细胞粘附分子的细胞表面蛋白的靶向结合。9.根据8所述的递送分子,其中所述靶向配体提供与家族bgpcr的变构-亲和结构域和正构结构域的结合以分别提供靶向结合和长内体再循环途径的接合。10.根据9所述的递送分子,其中靶向配体包括与毒蜥外泌肽-4氨基酸序列:hgegtftsdlskqmeeeavrlfiewlknggpssgappps(seqidno.1)具有85%或更高同一性(例如,100%同一性)的氨基酸序列。11.根据10所述的递送分子,其中所述靶向配体在与seqidno:1)所示氨基酸序列的l10、s11和k12相对应的位置中的一个或多个位置处包括半胱氨酸取代。12.根据9所述的递送分子,其中所述靶向配体包括氨基酸序列:hgegtftsdlckqmeeeavrlfiewlknggpssgappps(seqidno.2)。13.根据8所述的递送分子,其中所述靶向配体提供与rtk的靶向结合。14.根据13所述的递送分子,其中所述rtk是成纤维细胞生长因子(fgf)受体。15.根据14所述的递送分子,其中所述靶向配体是fgf的片段。16.根据14或15所述的递送分子,其中所述靶向配体与在正构结合期间被占据的所述rtk的片段结合。17.根据13到16中任一项所述的递送分子,其中所述靶向配体与所述rtk的肝素-亲和结构域结合。18.根据13到17中任一项所述的递送分子,所述靶向配体提供与fgf受体的靶向结合,并且其中所述靶向配体包括与氨基酸序列knggfflrihpdgrvdgvreks(seqidno:4)具有85%或更高同一性的氨基酸序列。19.根据13到17中任一项所述的递送分子,所述靶向配体提供与fgf受体的靶向结合,并且其中所述靶向配体包括氨基酸序列hfkdpk(seqidno:5)。20.根据13到17中任一项所述的递送分子,所述靶向配体提供与fgf受体的靶向结合,并且其中所述靶向配体包括氨基酸序列lesnnynt(seqidno:6)。21.根据8所述的递送分子,其中所述靶向配体提供与细胞表面糖蛋白和/或细胞-细胞粘附因子的靶向结合。22.根据21所述的递送分子,其中所述靶向配体是e-选择蛋白、l-选择蛋白或p-选择蛋白的片段。23.根据21所述的递送分子,其中所述靶向配体包括与氨基酸序列miasqflsaltlvllikesga(seqidno:7)具有85%或更高同一性的氨基酸序列。24.根据21所述的递送分子,其中所述靶向配体包括与氨基酸序列mvfpwrcegtywgsrnilklwvwtllccdflihhgthc(seqidno:8)、mifpwkcqstqrdlwnifklwgwtmlccdflahhgtdc(seqidno:9)和/或mifpwkcqstqrdlwnifklwgwtmlcc(seqidno:10)具有85%或更高同一性的氨基酸序列。25.根据8所述的递送分子,其中所述靶向配体提供与细胞-细胞粘附分子的靶向结合。26.根据1到7中任一项所述的递送分子,其中所述靶向配体提供与转铁蛋白受体的靶向结合,并且其中所述靶向配体包括与氨基酸序列thrppmwspvwp(seqidno:11)具有85%或更高同一性的氨基酸序列。27.根据1到7中任一项所述的递送分子,其中所述靶向配体提供与α5β1整合蛋白的靶向结合。28.根据27所述的递送分子,其中所述靶向配体包括氨基酸序列rretawa(seqidno:12)。29.根据27所述的递送分子,其中所述靶向配体包括氨基酸序列rgd。30.根据1到29中任一项所述的递送分子,其中所述靶向配体在与所述细胞表面蛋白结合时提供β-抑制蛋白的接合。31.根据1到30中任一项所述的递送分子,其中所述靶向配体与核酸有效负载缀合。32.根据31所述的递送分子,其中所述核酸有效负载是rnai剂。33.根据32所述的递送分子,其中所述rnai剂是sirna分子。34.根据1到30中任一项所述的递送分子,其中所述靶向配体与蛋白质有效负载缀合。35.根据1到30中任一项所述的递送分子,其中所述有效负载是核糖核蛋白复合物并且所述靶向配体与所述复合物的核酸或蛋白质组分缀合。36.根据1到30中任一项所述的递送分子,其中所述靶向配体与带电聚合物多肽结构域缀合。37.根据36所述的递送分子,其中所述带电聚合物多肽结构域与核酸有效负载缩合。38.根据36或37所述的递送分子,其中所述带电聚合物多肽结构域与蛋白质有效负载以静电方式相互作用。39.根据36到38所述的递送分子,其中所述递送分子存在于包括阴离子聚合物的组合物中。40.根基39所述的递送分子,其中所述组合物包括至少一种选自以下的阴离子聚合物:聚(谷氨酸)和聚(天冬氨酸)。41.根据36所述的递送分子,其中所述递送分子的所述带电聚合物多肽结构域与纳米颗粒的带电稳定层以静电方式相互作用。42.根据36到41中任一项所述的递送分子,其中所述带电聚合物多肽结构域是选自rrrrrrrrr(9r)(seqidno:15)和hhhhhh(6h)(seqidno:16)的阳离子结构域。43.根据36到42中任一项所述的递送分子,其中所述带电聚合物多肽结构域包括组蛋白尾肽(htp)。44.根据1到43中任一项所述的递送分子,其中所述靶向配体包括半胱氨酸残基并且通过所述半胱氨酸残基与所述有效负载缀合。45.根据1到44中任一项所述的递送分子,其中所述靶向配体通过巯基或胺反应性化学与所述有效负载缀合。46.根据1到45中任一项所述的递送分子,其中所述靶向配体通过间插连接子与所述有效负载缀合。47.根据46所述的递送分子,其中靶向配体包括半胱氨酸残基并且通过所述半胱氨酸残基与所述连接子缀合。48.根据46或47所述的递送分子,其中所述连接子通过巯基或胺反应性化学与所述靶向配体和/或所述有效负载缀合。49.根据46到48中任一项所述的递送分子,其中所述连接子是刚性的。50.根据46到48中任一项所述的递送分子,其中所述连接子是柔性的。51.根据46到48中任一项所述的递送分子,其中所述连接子是内体溶解的。52.根据46到51中任一项所述的递送分子,其中所述连接子是多肽。53.根据46到51中任一项所述的递送分子,其中所述连接子不是多肽。54.根据1到53中任一项所述的递送分子,其中所述靶向配体提供长内体再循环途径的接合。55.一种将核酸、蛋白质或核糖核蛋白有效负载递送到细胞的方法,所述方法包括:使细胞与1到54中任一项所述的递送分子接触。56.根据55所述的方法,其中所述细胞是哺乳动物细胞。57.根据55或56所述的方法,其中所述细胞在体外或是离体的。58.根据55或56所述的方法,其中所述细胞在体内。59.根据55到58中任一项所述的方法,其中所述细胞是选自以下的细胞:t细胞、造血干细胞(hsc)、骨髓细胞和血细胞。对于本领域普通技术人员而言将显而易见的是,可以在不脱离本发明的精神或范围的情况下对本发明进行各种改变和修改。实验提出以下实例以便向本领域普通技术人员提供如何制造和使用本发明的完整公开和描述,并且不旨在限制本发明的范围,它们也不旨在表示以下实验是进行的全部或仅有的实验。虽然已努力确保关于使用的数字(例如,量、温度等)的准确性,但是应当对一些实验误差和偏差进行解释。除非另外指明,否则部分是重量部份,分子量是重量平均分子量,温度是摄氏度,并且压力是处于大气压或接近大气压。本说明书中所引用的所有出版物和专利申请都通过引用并入本文,如同每个单独的出版物或专利申请被具体地和单独地指示通过引用并入本文。已经按照发现或提出的包括用于实施本发明的优选模式的特定实施例描述了本发明。本领域技术人员将理解的是,鉴于本公开,在不脱离本发明的预期范围的情况下,可以对例示的特定实施例进行多种修改和改变。例如,由于密码子冗余,可以在不影响蛋白质序列的情况下在底层dna序列中进行改变。此外,由于生物功能等效性的考虑,可以在不影响生物作用的种类或数量的情况下在蛋白质结构中进行改变。所有这种修改旨在包含在所附权利要求书的范围内。实例1:提供与家族bgpcr的靶向结合的靶向配体图3提供了家族bgpcr的示意图,突出了在评估靶向配体时要考虑的单独结构域,例如,用于结合变构/亲和力n-末端结构域和正构内体-分选/信号传导结构域。(图改编自siu,faiyiu等人,《自然(nature)》499.7459(2013):444-449)。当在靶向配体毒蜥外泌肽-4内选择用于半胱氨酸取代的位点时,考虑这种结构域。在图4中,半胱氨酸11取代(s11c)被鉴别为一种可能的氨基酸修饰,用于使毒蜥外泌肽-4与sirna、蛋白质或带电聚合物多肽结构域缀合,以这种方式保持亲和力并且还接合促进核酸释放和限制核酸降解的长内体再循环途径。在模拟的毒蜥外泌肽-4(seqidno:1)与胰高血糖素-gcgr(4ers)以及glp1-glp1r-ecd复合物(pdb:3iol)的已知晶体结构的比对之后,pdb渲染在3维空间中旋转以预测交联的复合物必须面对的方向以免破坏两个结合裂缝。当分泌素-家族配体的交联位点与对应的分泌素-家族受体的两个结合裂缝充分正交时,于是确定高亲和力结合可以发生以及伴随着用于最佳的有效负载释放的长内体再循环途径螯合。使用该技术,毒蜥外泌肽-4的氨基酸位置10、11和12被鉴别为用于插入半胱氨酸残基或被半胱氨酸残基取代的位置。实例2:提供与rtk的靶向结合的靶向配体图5示出了作为三元fgf2-fgfr1-肝素复合物(pdb上的1fq9)的一部分的tbfgf片段。确定cknggfflrihpdgrvdgvreks(突出显示的)(seqidno:14)对于fgfr1的亲和力是重要的。图6示出了hfkdpk(seqidno:5)被确定是用于配体-受体正构活性和亲和力的肽。图7示出了lesnnynt(seqidno:6)也被确定是用于配体-受体正构活性和亲和力的肽。实例3表2-表4提供了以下实验中使用的组分的指南(例如,缩合数据、生理化学数据以及流式细胞术和成像数据)。表2.在以下实验中使用的递送分子的特征。靶向配体名称/命名格式:a_b_c_d_e_f其中a=受体名称:受体配体的名称是靶向的;b=靶向配体来源:靶向受体的配体名称(如果配体不是野生型,则修饰前缀为“m”或“rm”);c=连接子名称;d=带电多肽名称;e=基于b的连接子末端;以及f=版本号(以区分来自相同wt但aa序列不同的两种修饰的靶向配体);表3.以下实验中使用的有效负载。表4用于以下实验中使用的组分的指南关键:关键:n=“纳米颗粒”cat.=“阳离子”;an.=“阴离子”;spec.=“种类”;c:p=“羧基:磷酸盐”;纳米颗粒调配物中使用的*亚细胞运输肽是与某些有效负载(例如,“nls_cas9......”)缀合的核定位信号肽纳米颗粒调配物中使用的*阳离子种类与靶向配体(tl)缀合为氨基酸长度为9(9r)的聚(精氨酸)链。无靶向配体的纳米颗粒包含长度为10的非缀合阳离子种类聚(精氨酸)aa链(plr10)或aa链长度为10的聚乙二醇化聚(赖氨酸)。表中所有阳离子种类的l:d异构体比例为1:0。*hsc=造血干细胞;bm=骨髓细胞;tcell=t细胞;血=全血;cynobm=食蟹猴骨髓材料与方法配体合成大多数靶向配体序列由内部设计并且由第3方提供商定制。肽配体衍生自天然多肽序列并且在一些情况下突变以提高结合亲和力。通过使用罗塞塔(rosetta)软件实现结合动力学的计算分析和最佳突变的确定。在其中在内部制造靶向配体的情况下,方法和材料如下:使用标准的基于fmoc的固相肽合成(spps)合成肽。在rink-酰胺(amide)am树脂上合成肽。用o-(1h-6-氯苯并三唑-1-基)-1,1,3,3-四甲基脲六氟磷酸盐(hctu)偶联剂和n-甲基吗啉(nmm)在二甲基甲酰胺(dmf)中进行氨基酸偶联。用三氟乙酸(tfa)、三异丙基硅烷(tips)和水进行肽的脱保护和切割。通过反相hplc(rp-hplc)纯化粗肽混合物。将纯肽段冷冻并冻干以得到纯化的肽。纳米颗粒合成纳米颗粒在室温37℃或37℃和室温的温差下在阳离子与阴离子组分之间合成。在阳离子与阴离子组分混合期间利用天然静电相互作用在水性缓冲液中制备溶液。开始时,将阴离子组分溶于tris缓冲液(30mm-60mm;ph=7.4-9)或hepes缓冲液(30mm,ph=5.5)中,同时将阳离子组分溶于hepes缓冲液(30mm-60mm,ph=5-6.5)中。具体地,有效负载(例如,遗传物质(rna或dna),遗传物质-蛋白质-核定位信号多肽复合物(核糖核蛋白)或多肽)在碱性、中性或酸性缓冲液中重构。出于分析的目的,有效负载被制造成与荧光团共价标记或者遗传性地编码荧光团。利用pdna有效负载,对tatata串联重复具有特异性的cy5标记的肽核酸(pna)用于荧光标记荧光报告载体和荧光报告-治疗基因载体。也可以充当带负电荷的缩合种类(例如聚(谷氨酸))的定时释放组分也在碱性、中性或酸性缓冲液中重构。具有与连接子-锚序列缀合的野生型衍生或野生型突变靶向肽的靶向配体在酸性缓冲液中重构。在纳米颗粒中包含另外的缩合种类或核定位信号肽的情况下,这些也在作为阳离子种类的0.03%w/v和阴离子种类的0.015%w/v的工作溶液的缓冲液中重构。还用用于阳离子物质的0.1%w/v和用于阴离子物质的0.1%w/v的工作溶液进行实验。除了与遗传物质络合的那些多肽外,对所有多肽进行十分钟的超声处理以提高溶解性。然后将纳米颗粒的每个单独重构的组分以所研究的添加顺序混合。所研究的不同添加顺序包含:1)有效负载<阳离子种类2)有效负载<阳离子种类(锚)<阳离子种类(锚-连接子-配体)3)有效负载<阴离子种类<阳离子种类4)有效负载<阳离子种类<阴离子种类5)有效负载<阳离子种类(锚)<阳离子种类(锚-连接子-配体)<阴离子种类6)有效负载<阴离子种类<阳离子种类(锚)+阳离子种类(锚-连接子-配体)7)有效负载+阴离子种类<阳离子种类(锚)+阳离子种类(锚-连接子-配体)8)有效负载1(核糖核蛋白或其它遗传/蛋白质物质)<阳离子种类(组蛋白片段、nls或无连接子-配体的带电多肽锚)<阴离子种类9)有效负载1(核糖核蛋白或其它遗传/蛋白质物质)<阳离子种类(组蛋白片段、nls或无连接子-配体的带电多肽锚)<阴离子种类<阳离子种类(组蛋白片段、nls或有或没有连接子-配体的带电多肽锚)10)有效负载1(核糖核蛋白或其它遗传/蛋白质物质)<阳离子种类(组蛋白片段、nls或无连接子-配体的带电多肽锚)<有效负载2/3/4(一种或多种有效负载)<阳离子种类(组蛋白片段、nls或有或没有连接子-配体的带电多肽锚)11)有效负载1(核糖核蛋白或其它遗传/蛋白质物质)<阳离子种类(组蛋白片段、nls或无连接子-配体的带电多肽锚)<有效负载2/3/4(一种或多种有效负载)+阴离子种类<阳离子种类(组蛋白片段、nls或有或没有连接子-配体的带电多肽锚)12)有效负载1/2/3/4(一种或多种核糖核蛋白、蛋白质或核酸有效负载)+阴离子种类<阳离子种类(组蛋白片段、nls或有或没有连接子-配体的带电多肽锚)13)有效负载1/2/3/4(一种或多种核糖核蛋白、蛋白质或核酸有效负载)<阳离子种类(组蛋白片段、nls或有或没有连接子-配体的带电多肽锚)细胞培养t细胞转染前24小时,将含有20m人原代pan-t细胞(干细胞#70024)的冷冻管解冻并且以200μl和75,000个细胞/孔(1.5e6细胞/ml)接种于4个96孔板的4x66孔中。细胞在补充有10%fbs和l-谷氨酰胺的无抗生素的rpmi1640培养基(赛默飞世尔#11875119)中培养,并且通过每2天更换培养基来维持。造血干细胞(hsc)转染前24小时,将含有500k人原代cd34+细胞(干细胞#70002)的冷冻管解冻并且以200μl和10-12k个细胞每孔接种于96孔板的48个孔中。培养基由补充有10%的fbs、25ng/ml的tpo、50ng/ml的flt-3配体和50ng/ml的scf的stemspansfemii(干细胞#09605)组成并且通过每2天更换培养基来维持细胞。食蟹猴骨髓(hsc)转染前48小时,将含有1.25m食蟹猴骨髓细胞(iq生命科学#iqb-mnbm1)的冷冻管解冻并且以200μl和~30k个细胞/孔接种于圆底96孔板的48个孔中。细胞在补充有12%fbs的无抗生素的rpmi1640培养基中培养,并且通过每2天更换培养基来维持。人全血通过静脉穿刺抽取5ml全血。将1ml全血与14ml的pbs混合。将纳米颗粒直接转染到15ml管中,或者在纳米颗粒转染之前将100μl的血滴定到96孔板的每个孔中。转染在形成纳米颗粒的储备溶液后,在96孔板的每个孔中加入10μl纳米颗粒并且在不改变细胞培养条件或培养基的补充物的情况下进行孵育(参见表5)。在活细胞成像期间,在co2和温度控制的环境下,通过biotekcytation5来维持96孔板。表5.分析缩合和包合曲线通过将含有0.0044ug/μl的血红蛋白β亚基(hbb)grna或具有pdna结合位点或mrna或sirna的冯维勒布兰德因子(vwf)-egfp-pdna的50μl溶液与悬浮于30mmtris缓冲液(ph=7.4-8.5)中的1μl的sybr0.4x混合来产生缩合曲线。hbbgrna在rnp中被络合而存在。在单独添加ple20、ple35、ple100或ple100:pde100(1:1的d:l比率)之前和之后监测来自嵌入的sybrgold的荧光发射,其中羧酸盐与磷酸盐(c:p)之比的范围在1与150之间。然后,加入阳离子种类以达到期望的胺与磷酸盐(n:p)或胺与磷酸盐+羧酸盐[n:(p+c)]的比例。代表性的阳离子种类包含plr10;plr50;plr150、锚-连接子肽;与缀合到带电聚(精氨酸)链的ggggsggggs(seqidno:146)连接子缀合的各种突变靶向配体(即,内部名称:scf_mckit_(4gs)2_9r_c);组蛋白_h3k4(me3)肽[1-22](mh3_k4me3_1);组蛋白_h4k16(ac)肽[1-20](mh4_k16ac_1);组蛋白_h2a肽[1-20](mh2a_1),对应于不同的正负电荷比(cr)。在一些实验中,根据上述说明,在阴离子种类之前加入阳离子种类。在将稀释于30mmtris缓冲液(ph=7.4)中的sybrgold0.2x多次添加到悬浮于含有包封在不同的纳米颗粒调配物中的vwf-egfp-pdna、grnahbb、alexa555block-it-sirna的已知量(100至600ng)的60mmhepes(ph=5.5)溶液中的纳米颗粒后获得包合曲线。使用synergyneo2hybrid多模式读数器(伯腾仪器有限公司(biotek),美国)或clariostar微孔板读数器(bmg,德国)在平底半区96孔板中记录来自gfp通道中的嵌入的sybrgold的荧光发射。纳米颗粒跟踪分析(ζ)使用zetaview仪器(particlemetrix,德国),通过纳米颗粒跟踪分析研究纳米颗粒调配物的流体动力学直径和ζ电位。在注入仪器之前,将样品在pbs(1:12)中以1:100稀释。为了获得测量结果,在分析之前将相机设置调整到最佳的灵敏度和粒子/帧(~100-150)。荧光显微镜-biotekcytation5在通过流式细胞术评估之前,使用cytation5高含量筛选活细胞成像显微镜(伯腾仪器有限公司,美国)对转染效率进行成像。简而言之,在转染前对细胞进行成像,转染后4小时以15m的增量成像,并且然后在接下来的12小时内,利用gfp和/或cy5通道以及10x物镜下的明视场以2h的增量进行成像。随后收集图像作为连续动力学或离散的1-18、24、36或48小时时间点的代表。流式细胞数进行细胞标记实验,进行洗涤步骤以移除细胞培养基,然后在室温下用溶于pbs的zombienir活性试剂盒染色(zombienirviabilitykitstain)和/或celleventtm半胱天冬酶-3/7green(英杰(invitrogen),usa)孵育细胞30分钟。活性标记混合物的总体积为每孔25μl。然后将一板荧光第一抗体添加到混合物中(每孔0.25μl每种抗体)并且保持孵育15分钟。使用ultracompebeads补偿珠粒和阴性珠粒或活细胞的cy5核染色产生阳性对照和阴性单通道对照。所有孵育步骤都在旋转振荡器上和黑暗中进行。在已应用不同通道之间的适当补偿后,使用attunenxt流式细胞仪(赛默飞世尔(thermofisher),美国)对活细胞进行attune多参数流式细胞术测量。通过选择适当的正向和侧向散射强度门来选择代表性的细胞群。继续检测细胞荧光,直到收集至少10000个事件。结果/数据图8-图33:缩合数据图8.(a)sybrgold排斥测定示出荧光强度变化作为含有具有最初嵌入sybrgold的pna有效负载的vwf-egfppdna的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加阳离子plr150来增加cr。观察到的荧光的减少示出了通过添加plr150来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,缩合保持一致。空白溶液在没有有效负载的情况下包含sybrgold。(b)荧光强度变化作为无ple100的纳米颗粒中的正负电荷比(cr)的函数。图9.sybrgold排斥测定示出荧光强度变化作为含有最初嵌入sybrgold的nls-cas9-nlsrnp络合的w/hbbgrna有效负载的纳米颗粒中的正负电荷比(cr*)的函数。另外,cr*的确定不包含通过与cas9络合而屏蔽的grna的带负电荷的部分。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加阳离子plr150来增加cr。空白溶液在没有有效负载的情况下包含sybrgold。观察到的荧光的减少示出了通过添加plr150来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,缩合保持一致。图10.sybrgold排斥测定示出荧光强度变化作为含有最初嵌入sybrgold的grnahbb有效负载的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加plr150来增加cr。空白溶液在没有有效负载的情况下包含sybrgold。观察到的荧光的减少示出了通过添加plr150来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,关于cr的缩合保持一致。表6:在缩合端点处测量一些调配物的流体动力学直径和ζ电位并且在下表中进行了报告。有效负载c:p流体动力学直径[nm]ζ电位[mv]pdna0120±49-hbbgrna099±326.7±0.6rnp(nls-cas9-nls和hbbgrna)090±36-0.6±0.9rnp(nls-cas9-nls和hbbgrna)15110±4926.7±1pdna1588±4911.7±0.6图11-图13:使用肽scf_rmac-ckit_(4gs)2_9r_c作为阳离子材料的缩合曲线图11.(a)(b)sybrgold排斥测定示出荧光强度变化作为含有最初嵌入sybrgold的hbbgrna有效负载的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加与缀合到带正电荷的聚(精氨酸)的(gggs)2连接子缀合的阳离子突变ckit靶向配体(内部配体名称:scf_rmac-ckit_(4gs)2_9r_c)来增加cr。观察到的荧光的减少示出了通过添加scf_rmac-ckit_(4gs)2_9r_c来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,缩合保持一致。空白溶液在没有有效负载的情况下包含sybrgold。图12.(a)(b)sybrgold排斥测定示出荧光强度变化作为含有最初嵌入sybrgold的nls-cas9-nlsrnp络合的w/hbbgrna有效负载的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加与缀合到带正电荷的聚(精氨酸)的(gggs)2连接子缀合的阳离子突变ckit靶向配体(内部配体名称:scf_rmac-ckit_(4gs)2_9r_c)来增加cr。观察到的荧光的减少示出了通过添加scf_rmac-ckit_(4gs)2_9r_c来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,缩合保持一致。空白溶液在没有有效负载的情况下包含sybrgold。图13.(a)(b)sybrgold排斥测定示出荧光强度变化作为含有具有最初嵌入sybrgold的pna有效负载的vwf-egfppdna的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加与缀合到带正电荷的聚(精氨酸)的(gggs)2连接子缀合的阳离子突变ckit靶向配体(内部配体名称:scf_rmac-ckit_(4gs)2_9r_c)来增加cr。观察到的荧光的减少示出了通过添加scf_rmac-ckit_(4gs)2_9r_c来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,缩合保持一致。空白溶液在没有有效负载的情况下包含sybrgold。图14-图15:组蛋白h3k4me作为阳离子材料的缩合曲线图14.sybrgold排斥测定示出荧光强度变化作为含有具有最初嵌入sybrgold的pna有效负载的vwf-egfppdna的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加阳离子突变组蛋白_h3k4(me3)肽[1-22](内部肽名称mh3_k4me3_1)来增加cr。观察到的荧光变化示出了在ple100存在下,通过添加mh3_k4me3_1来增加cr,不能充分地使sybr从有效负载中移位。空白溶液在没有有效负载的情况下包含sybrgold。图15.(a)sybrgold排斥测定示出荧光强度变化作为含有最初嵌入sybrgold的nls-cas9-nlsrnp络合的w/hbbgrna有效负载的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加阳离子突变组蛋白_h3k4(me3)肽[1-22](内部肽名称mh3_k4me3_1)来增加cr。观察到的荧光变化示出了在ple100存在下,通过添加mh3_k4me3_1来增加cr,不能始终导致sybr从有效负载中移位。然而,在不存在阴离子多肽的情况下,当cr≤8:1时,组蛋白_h3k4(me3)被示出为有效缩合剂。图16-图19:使用肽cd45_asiglec_(4gs)2_9r_c作为阳离子材料的缩合曲线图16.sybrgold排斥测定示出荧光强度变化作为含有具有最初嵌入sybrgold的pna有效负载的vwf-egfppdna的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加与缀合到带正电荷的聚(精氨酸)的(gggs)2连接子缀合的阳离子突变cd45受体靶向配体(内部配体名称:cd45_msiglec_(4gs)2_9r_c)来增加cr。空符号代表在没有有效负载的情况下,空白溶液包含sybrgold。观察到的荧光的减少示出了通过添加cd45_msiglec_(4gs)2_9r_c来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,缩合保持一致。图17.sybrgold排斥测定示出荧光强度变化作为含有最初嵌入sybrgold的cy5-egfpmrna有效负载的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加与缀合到带正电荷的聚(精氨酸)的(gggs)2连接子缀合的阳离子突变cd45受体靶向配体(内部配体名称:cd45_msiglec_(4gs)2_9r_c)来增加cr。观察到的荧光的减少示出了通过添加cd45_msiglec_(4gs)2_9r_c来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,缩合保持一致。图18.sybrgold排斥测定示出荧光强度变化作为含有最初嵌入sybrgold的block-italexafluor555sirna有效负载的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加与缀合到带正电荷的聚(精氨酸)的(gggs)2连接子缀合的阳离子突变cd45受体靶向配体(内部配体名称:cd45_msiglec_(4gs)2_9r_c)来增加cr。观察到的荧光的减少示出了通过添加cd45_msiglec_(4gs)2_9r_c来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,缩合保持一致。图19.(a)sybrgold排斥测定示出荧光强度变化作为含有与最初嵌入sybrgold的hbbgrna有效负载络合的nls-cas9-egfprnp的纳米颗粒中的正负电荷比(cr)的函数。图例中显示的羧酸盐与磷酸盐(c:p)的比率基于在阴离子多肽种类(ple100)上的羧酸盐基团与在有效负载的遗传物质上的磷酸基团的纳米颗粒的比率。通过逐步添加与缀合到带正电荷的聚(精氨酸)的(gggs)2连接子缀合的阳离子突变cd45受体靶向配体(内部配体名称:cd45_msiglec_(4gs)2_9r_c)来增加cr。填充符号代表在没有有效负载的情况下,空白溶液包含sybrgold。观察到的荧光的减少示出了通过添加cd45_msiglec_(4gs)2_9r_c来增加cr导致sybr在颗粒缩合时从有效负载中移位。另外,在各种c:p比例下,缩合保持一致。(b)无ple并且电荷比=22的纳米颗粒的流体动力学直径分布的代表性图像。平均直径<d>=134nm±65。表7:在缩合端点处测量一些调配物的流体动力学直径和ζ电位并且在下表中进行了报告。图20-图23:包合曲线图20.sybrgold包合测定示出作为向所有含有150ngblock-italexafluor555sirna有效负载的不同纳米颗粒调配物中逐步添加sybr的函数的荧光强度变化。从0μl到50μl的sybr的荧光的δ变化指示纳米颗粒调配物的稳定性。调配物缩合的越不稳定,sybrgold嵌入遗传有效负载的可能性越大。脂质体rnaimax在此用作阳性对照。表2-4.图21.sybrgold包合测定示出作为向所有含有300nghbbgrna有效负载的不同纳米颗粒调配物中逐步添加sybr的函数的荧光强度变化。从0μl到50μl的sybr的荧光的δ变化指示纳米颗粒调配物的稳定性。调配物缩合的越不稳定,sybrgold嵌入遗传有效负载的可能性越大。脂质体crisprmax在此用作阳性对照。表2-4.图22.sybrgold包合测定示出作为向所有含有cy5egfpmrna有效负载的不同纳米颗粒调配物中逐步添加sybr的函数的荧光强度变化。从0μl到50μl的sybr的荧光的δ变化指示纳米颗粒调配物的稳定性。调配物缩合的越不稳定,sybrgold嵌入遗传有效负载的可能性越大。脂质体信使max在此用作阳性对照。表2-4.图23.sybrgold包合测定示出作为向所有含有600ng的具有cy5标记的肽核酸(pna)结合位点有效负载的vwf-egfppdna的不同纳米颗粒调配物中逐步添加sybr的函数的荧光强度变化。从0μl到50μl的sybr的荧光的δ变化指示纳米颗粒调配物的稳定性。调配物缩合的越不稳定,sybrgold嵌入遗传有效负载的可能性越大。脂质体3000在此用作阳性对照。表2-4.图24-图33:tc.001上的sybr包合/缩合分析(参见表2-4)这些数据显示,实验tc.001中使用的调配物是稳定的,而且所述数据显示,与h3不同,h2a和h4组蛋白尾肽本身就是用于所有列出的有效负载的有效缩合剂。所述数据还显示,h2a和h4可以进一步与锚-连接子-配体结合。最后,证据表明,随后添加阴离子聚合物(在该实施例中为ple100)不影响颗粒稳定性,或者如通过在添加到阴离子聚合物之前在与核酸或核糖核蛋白缀合的各种锚-连接子-配体肽上测量的大小和ζ电位所证明的增强稳定性。图24.sybrgold排斥测定示出了通过加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100并且通过进一步向rnp中加入阳离子多肽来降低荧光强度。由于来自rnp的gfp荧光引起的荧光背景信号id。图25.sybrgold排斥测定示出了通过加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100并且通过进一步向sirna中加入阳离子多肽并且进一步加入sybrgold引起的荧光强度变化。图26.sybrgold排斥测定示出了通过加入阳离子多肽组蛋白肽h2a,然后加入cd45_msiglec_(4gs)2_9r_c,并且通过进一步向具有hbbgrna和sybrgold的nls-cas9-egfp的rnp中加入ple100而引起的荧光强度变化。图27.sybrgold排斥测定示出了通过一起加入阳离子多肽组蛋白肽h4和cd45_msiglec_(4gs)2_9r_c,并且通过进一步向具有hbbgrna和sybrgold的nls-cas9-egfp的rnp中加入ple100而引起的荧光强度变化。图28.sybrgold排斥测定示出了通过加入阳离子多肽cd45_msiglec_(4gs)2_9r_c并且通过进一步向mrna中加入ple100而引起的荧光强度变化。图29.sybrgold排斥测定示出了通过加入组蛋白h4并且通过进一步向mrna中加入cd45-msiglec-(4gs)2_9r_c和ple100而引起的荧光强度变化。图30.sybrgold排斥测定示出了通过加入组蛋白h2a并且通过进一步向mrna中加入cd45-msiglec-(4gs)2_9r_c和ple100而引起的荧光强度变化。图31.来自嵌入vwf_egfppdna的sybrgold排斥测定示出了通过加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100而引起的荧光强度变化。图32.来自嵌入vwf_egfppdna的sybrgold排斥测定示出了通过加入组蛋白h4,然后加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100而引起的荧光强度变化。图33.来自嵌入vwf_egfppdna的sybrgold排斥测定示出了通过加入组蛋白h4,然后加入阳离子多肽cd45_msiglec_(4gs)2_9r_c,然后加入ple100而引起的荧光强度变化。图34-图72:物理化学数据颗粒大小和ζ电位是用于表征胶体纳米材料的常规测量。这些测量主要通过如dls(动态光散射)等光散射技术获得。纳米颗粒跟踪分析(nta)利用激光散射显微镜和图像分析来获得具有高分辨率的颗粒大小和ζ电位的测量结果。分析分散度是样品异质性的量度并且由分布确定分散度,其中低标准差和单峰指示颗粒均匀性。通过固相肽合成来合成由具有配体的多肽组成的靶向配体、(ggggs)2连接子和静电锚结构域并且用于使携带pegfp-n1质粒dna有效负载的颗粒的二氧化硅表面(可脱落层)官能化。使用zetaview仪器(particlemetrix,德国),通过纳米颗粒跟踪分析获得所产生的颗粒大小和ζ电位分布。图34.(a)核心复合物大小分布,由与h3k4(me3)和聚(l-精氨酸)(29kd,n=150)络合的pegfp-n1质粒组成。(b)图34a的具有二氧化硅可脱落层的复合物表现出特性负ζ电位和124nm的平均颗粒大小。(c)具有n末端锚和甘氨酸-丝氨酸连接子((ggggs)2)的e选择蛋白配体涂覆在图34b中所示的颗粒上。图35.支化的组蛋白肽缀合物先导颗粒。具有c-末端半胱氨酸的组蛋白h3肽与具有10%侧链硫醇取代的48kd聚(l-赖氨酸)缀合。通过离心过滤和分子量排斥而纯化的最终产物用于络合质粒dna(pegfp-n1)。图35描绘的所产生的测量结果显示了较窄的大小分布。与质粒dna(pegfp-n1)络合的h3-聚(l-赖氨酸)缀合物的大小分布对于图36-72,数据由实验编号(项目代码)索引。在多种情况下,这可以与表4的项目代码交叉参考(hsc=造血干细胞;bm=骨髓细胞;tcell=t细胞;blood=全血;cynobm=食蟹猴骨髓)。图36提供了与项目hsc.001.001相关的数据。图37提供了与项目hsc.001.002相关的数据,其使用与pna标记的pdna和e-选择蛋白靶向肽(esellg_mesel_(4gs)2_9r_n)络合的的h3-聚(l-赖氨酸)缀合物。图38-图41提供了实验数据,其中将各种靶向配体或隐形分子涂覆于二氧化硅涂覆的颗粒和二氧化硅涂覆的纳米钻石上(用于诊断的增强型荧光应用)。大小和ζ电位分布与相关统计一起呈现。靶向配体分别是esellg_mesel_(4gs)2_9r_n、esellg_mesel_(4gs)2_9r_c、cd45_msiglec_(4gs)2_9r_c和cy5mrna-sio2-peg。在随后的所有数据中,纳米调配物和靶向配体的性能显著改善-通过各种有效负载和配体-靶向方法,消除了二氧化硅层并且用带电阴离子可脱落多肽基质替代显著提高了纳米颗粒在所有调配物中的转染效率。然而,以上数据中使用的多层技术,以及与支化组蛋白络合物的增强型缩合和随后的肽基质工程化(工作实例在tcell.001、hsc.004、cynobm.002和blood.002中呈现)证明了技术(例如,多层化)和核心生物材料的灵活性(例如,参见本公开整体和随后的实验)。本文描述的所有技术可以应用于任何颗粒核心,无论是诊断的还是治疗的,以及自组装的材料。例如,支化组蛋白可以与连接子-配体结构域缀合或与多个实施例及其用途共缩合。图42-图46描绘了携带cy5-egfpmrna有效负载的颗粒,所述颗粒与可脱落聚(谷氨酸)表面基质以及cd45配体络合。使用该调配物生产的纳米颗粒的颗粒大小和ζ电位是高度均匀的。在siglec衍生的肽与mrna缔合(blood.002.88)后加入具有聚(谷氨酸)的颗粒比在siglec衍生的肽与mrna和聚(谷氨酸)缔合之前加入具有聚(谷氨酸)的颗粒更稳定和单分散化,指示特定的加入顺序可以有助于形成更稳定的颗粒。另外,由不含含磷酸核酸的siglec衍生肽与聚(谷氨酸)络合形成的颗粒是高度阴离子单分散的(blood.002.92)。在plr与mrna缔合后加入的plr50与ple100形成的颗粒是高度稳定的、单分散的、阳离子化的(blood.002.91)。相反,在ple100添加之前plk-peg与mrna的缔合导致具有异质电荷分布的非常小的颗粒。通过流式细胞术数据证明了这些添加顺序和siglec衍生肽的功效,其中配体靶向的siglec衍生颗粒导致全血细胞中的cy5强度增加了近两个数量级,尽管与聚乙二醇化对照的转染效率相似。图42提供了来自blood.002.88的数据。纳米颗粒的ζ电位为-3.32+/-0.29mv,其中90%的直径小于180nm。根据流式细胞术数据,这些纳米颗粒在全血中产生58.6%的有效cy5_egfp_mrna摄取。窄而均匀的峰是极好的电荷分布的示例性典范并且在tcell.001.18中形成净阴离子颗粒时是可再现的。这证明了siglec衍生靶向肽对于全身递送的广泛适用性(例如,参见以下的流式细胞术和成像数据)。图43提供了来自blood.002.89的数据。纳米颗粒的ζ电位为-0.25+/-0.12mv,其中90%的直径小于176nm。根据流式细胞术数据,这些纳米颗粒分别在全血中产生58.6%的有效cy5_egfp_mrna摄取。这证明了siglec衍生靶向肽对于全身递送的广泛适用性(例如,参见以下的流式细胞术和成像数据)。图44提供了来自blood.002.90的数据。纳米颗粒的ζ电位为2.54+/-0.03mv,其中90%的直径小于99nm。根据流式细胞术数据,这些纳米颗粒分别在全血中产生79.9%的有效cy5_egfp_mrna摄取(例如,参见以下的流式细胞术和成像数据)。图45提供了来自blood.002.91的数据。纳米颗粒的ζ电位为27.10fwhm18.40mv,其中90%的直径小于130nm。根据流式细胞术数据,这些纳米颗粒分别在全血中产生96.7%的有效cy5_egfp_mrna摄取(例如,参见以下的流式细胞术和成像数据)。强正电荷的ζ电位导致全血细胞上cy5+信号的高效率和强度。简而言之,在该实施例中,将较大剂量的plr50(15μlplr500.1%w/v溶液)加入到具有2.5ugcy5mrna的100μl、ph5.5、30mm的hepes中(trilink)。在37℃下5分钟后,向溶液中加入1.5μl的0.1%ple100。相比之下,其它实验涉及将相对较大体积(总溶液体积的5-20%)的ple100加入到预形成的阳离子聚合物+阴离子材料核心。图46提供了来自blood.002.92的数据。纳米颗粒的ζ电位为-22.16fwhm18.40mv,其中90%的直径小于130nm。根据流式细胞术数据,这些纳米颗粒不会导致全血中可检测到的cy5_egfp_mrna摄取,因为它们未用荧光团标记(例如,参见以下的流式细胞术和成像数据)。没有有效负载(载体)的这些纳米颗粒的有效缩合也对非遗传物质有效负载的递送,如带电聚合物与小分子或化学治疗剂的缀合有影响。图47-图62描绘了用于表征含有crispr核糖核蛋白(rnp)(tcell.001.01-tcell.001.15)、mrna(tcell.001.16-tcell.001.30)、质粒dna(tcell.001.31-tcell.001.45)和sirna(tcell.001.46-tcell.001.60)的代表性颗粒的实验结果并且在对应的组中用相同的配体图案化。图47提供了来自tcell.001.1的数据。纳米颗粒的ζ电位为-3.24+/-0.32mv,其中90%的直径小于77nm。根据流式细胞术数据,这些纳米颗粒分别在活的cd4+和cd8a+pant细胞中产生99.16%和98.47%的有效crispr-gfp-rnp摄取(例如,参见以下的流式细胞术和成像数据)。这些调配物还反映了所有cynobm.002.75的物理化学性质,以及充当用于cynobm.002.82-cynobm.002.85中后续分层的基质的核心,其中plr10涂覆的颗粒与一个或多个阴离子多肽的可脱落阴离子涂层、核酸和/或一系列d:l比例、分子量和组合物的带电大分子络合。随后在cynobm.002.82-cynobm.002.85中加入带电聚合物或带电锚-连接子-配体之前,将ple100+mrna涂覆于tcell.001.1。图48提供了来自tcell.001.3的数据。纳米颗粒的ζ电位为-0.98+/-0.08mv,其中90%的直径小于65nm。尽管大小范围是理想的,但是根据流式细胞术数据,与tcell.001.1中在相同细胞群中达到约99%的效率的强阴离子相似大小的颗粒相比,这些纳米颗粒分别在活的cd4+和cd8a+pant细胞中产生11.6%和13.2%的有效crispr-gfp-rnp摄取。通过本文描述的实验显示,粒子大小与稳定的负ζ电位的关系及其方法和用途是可预测的约束条件。理想的纳米颗粒具有大部分<70nm、ζ电位<-5mv的粒子,并且本文所描述的可脱落阴离子涂层方法以及cynobm.002中描述的用于共递送的多级分层可脱落基质实现了来自人和食蟹猴血液、骨髓和上文所提及的具体细胞的敏感原代细胞的稳定且极其高效的转染。tcell.001.3的降低的效率与tcell.01.27的结果形成鲜明对比,其中相比用于该特定crispr调配物的配体,相同的配体在改变的胺与磷酸盐与羧酸盐的比例下实现了mrna的稳定缩合,而不是用于该mrna(例如,参见下文的流式细胞术和成像数据)。图49提供了来自tcell.001.13的数据。纳米颗粒的ζ电位为2.19+/-0.08mv,其中90%的直径小于101nm。参见以下的流式细胞术/成像数据以获得活cd4+和cd8a+pant细胞中crispr-gfp-rnp摄取的效率。图50提供了来自tcell.001.14的数据。纳米颗粒的ζ电位为-9.37+/-0.16mv,其中90%的直径小于111nm。根据流式细胞术数据,这些纳米颗粒分别在活的cd4+和cd8a+pant细胞中产生25.7%和28.6%的有效crispr-gfp-rnp摄取。(例如,参见以下的流式细胞术和成像数据)。图51提供了来自tcell.001.16的数据。图52提供了来自tcell.001.18的数据。这些颗粒的大小和ζ电位显示了平均颗粒大小为80.9nm、ζ电位为-20.26+/-0.15mv并且90%的颗粒的直径为39.2-129.8nm,指示在1.35的羧酸盐比磷酸盐(c:p)以及0.85的胺比磷酸盐的比例下的颗粒具有强稳定性,其中在包合阳离子锚-连接子-配体后加入聚(谷氨酸)。请参考tcell.001.2、tcell.001.18和cynobm.002的所有ζ电位、大小、流式细胞数和显微镜数据,以获得与获得高效原代细胞转染相关的其它一般模式、工程约束、观察结果和经验测量(例如,参见表4和以下的流式细胞术和成像数据)。图53提供了来自tcell.001.28的数据。图54提供了来自tcell.001.29的数据。图55提供了来自tcell.001.31的数据。图56提供了来自tcell.001.33的数据。图57提供了来自tcell.001.43的数据。图58提供了来自tcell.001.44的数据。图59提供了来自tcell.001.46的数据。图60提供了来自tcell.001.48的数据。图61提供了来自tcell.001.58的数据。图62提供了来自tcell.001.59的数据。图63-图72描绘了表征食蟹猴骨髓细胞中使用的调配物的结果。图63提供了来自cynobm.002.82的数据。如通过3%的活细胞中的胎儿血红蛋白表达所证明的,颗粒成功地删除了在整个骨髓红系祖细胞中的bcl11a红系增强子。cynobm.002.82纳米颗粒的ζ电位为2.96+/-0.14mv,其中90%的直径小于132nm并且50%的颗粒的直径小于30nm。根据流式细胞术数据,这些纳米颗粒分别在活的cd3+、cd45+和cd34+骨髓亚群中产生~48%、~53%和~97%的crisprrnp和cy5mrna的有效rispr-gfp-rnp+cy5_egfp_mrna的共定位摄取,尽管仅有11.4%的总体骨髓活亚群靶向。相比之下,具有由plr10、ple100、pde100和cas9rnp组成的相同核心模板但没有mrna共递送组分或plr50的附加层的cynobm.002.75,根据流式细胞术数据,分别在活cd3+、cd45+和cd34+骨髓亚群中展示出约20%、~14%和~100%的有效crispr-gfp-rnp摄取,以及18.0%的总体骨髓活亚群靶向。利用这些数据,可以推断出即使在看到混合骨髓原代群内的总体转染效率有微小增强的情况下,较大的颗粒可能也不太经得起选择性靶向的检验。颗粒的双模分布对原代细胞培养转染的影响仍有待确定。在先前的工作中,发现成骨细胞高效地内吞150-200nm的颗粒。显著地,大多数具有cynobm.002.82的颗粒群处于85nm的峰值以下,与tcell.001.1类似,但是在底层的ple、pde、mrna和cas9rnp的多肽-核糖核蛋白-mrna-蛋白质基质周围围绕着plr50的带正电荷的基质。另外,3.0%的总活细胞对胎儿血红蛋白呈阳性,这些细胞中没有一个是cd34+,表现了cd34-红系祖细胞内的bcl11a红系祖细胞敲除群的成功的克隆扩增。(例如,参见以下的流式细胞术和成像数据)。结果还可能表示在内皮细胞、成骨细胞、破骨细胞和骨髓的其它细胞中的成功的靶向。图64提供了来自cynobm.002.83的数据。如通过1.9%的活细胞(这些细胞中没有一个是cd34+)中的胎儿血红蛋白表达所证明的,颗粒成功地删除了在整个骨髓红系祖细胞中的bcl11a红系增强子。纳米颗粒具有-2.47+/-0.33mv的ζ电位,其中90%具有小于206nm的直径,导致相对于具有相同的il2-模拟肽涂层的cynobm.002.03,转染效率提高。尾部大约-50mv和+25mv的大电荷分布指示多分散颗粒群具有颗粒稳定性的变化,与cynobm.002.83类似,并且与具有-18mv的稳定阴离子单峰ζ电位的cynobm.002.84形成对比并且与其它crispr+mrna共递送颗粒组(cynobm.002.82-cynobm.002.85)相比,细胞活力对应增加。就整体食蟹猴骨髓共递送而言,次佳纳米颗粒组是cynobm.002.86,其表现出相似的-20mv的高净负电荷ζ电位和对应的高效转染、cd34克隆扩增和来自bcl11a红系增强子敲除的胎儿血红蛋白生成。根据流式细胞术数据,这些纳米颗粒在混合细胞群以及8.1%的全骨髓活亚群内的活cd34+骨髓细胞中产生~100%的有效crispr-gfp-rnp+cy5_egfp_mrna摄取。流式细胞术数据指示在食蟹猴骨髓细胞中诱导选择性cd34+增殖,指示cd34-红系祖细胞内bcl11a红系祖细胞敲除群的成功的克隆扩增。(例如,参见以下的流式细胞术和成像数据)。结果还表示在内皮细胞、成骨细胞、破骨细胞和/或骨髓的其它细胞中的成功的靶向。图65提供了来自cynobm.002.84的数据。如在9.5%的活的全骨髓细胞中的胎儿血红蛋白蛋白质表达所证明的,颗粒成功地删除了全骨髓红系祖细胞中的bcl11a红系增强子,并且如通过每个选择性亚群中的cy5-mrna+和crispr-gfp-rnp+门所测量的,尽管转染效率中等,但cd34+、cd45或cd3+亚群中没有阳性的胎儿血红蛋白测量结果。cynobm.002.84纳米颗粒的ζ电位为-18.07+/-0.71mv,其中90%的直径小于205nm。高净负电荷指示稳定的颗粒形成。根据流式细胞术数据,这些纳米颗粒在活的cd3+、cd45+和cd34+骨髓细胞中分别产生76.5%、71%和~100%的有效crispr-gfp-rnp+cy5_egfp_mrna摄取,以及25.5%的全骨髓活亚群。另外,9.5%的总活细胞对胎儿血红蛋白呈阳性,这些细胞中没有一个是cd34+,这表现了cd34-红系祖细胞内的bcl11a红系祖细胞敲除群的成功的克隆扩增。(例如,参见以下的流式细胞术和成像数据)。结果还表示在内皮细胞、成骨细胞、破骨细胞和/或骨髓的其它细胞中的成功的靶向。图66提供了来自cynobm.002.85的数据。纳米颗粒的ζ电位为-12.54+/-0.25mv,其中90%的直径小于186nm。根据流式细胞术数据,这些纳米颗粒分别在活的cd3+、cd45+和cd34+骨髓细胞中产生~33%、~23%和~100%的有效crispr-gfp-rnp+cy5_egfp_mrna摄取。(例如,参见以下的流式细胞术和成像数据)。结果可能表示在内皮细胞、成骨细胞、破骨细胞和骨髓的其它细胞中的成功的靶向。颗粒大小和电荷分布与随后的cynobm.002组及其在食蟹猴骨髓crispr和/或mrna递送中的预期的生物学性能一致。图67提供了来自cynobm.002.86的数据。纳米颗粒的ζ电位为-20.02+/-0.10mv,其中90%的直径小于120nm。根据流式细胞术数据,这些纳米颗粒在活的食蟹猴骨髓中产生20.1%的crispr-gfp-rnp+cy5_egfp_mrna的有效共递送,具有~68%、70%和~97%的有效cd3+、cd45+和cd34+分别的靶向。(例如,参见以下的流式细胞术和成像数据)。结果可能表示在内皮细胞、成骨细胞、破骨细胞和骨髓的其它细胞中的成功的靶向。高负电荷的ζ电位和90%的颗粒计数<200nm预测了高效率。图68提供了来自cynobm.002.76的数据。纳米颗粒的ζ电位为-12.02+/-0.59mv,其中90%的直径小于135nm。根据流式细胞术数据,这些纳米颗粒分别在活的cd3+、cd45+和cd34+骨髓细胞中中产生18.4%、10.3%和100%的有效crispr-gfp-rnp摄取(例如,参见以下的流式细胞术和成像数据)。另外,如组蛋白模拟颗粒(如在cynobm.002.78中所见的,具有高负ζ电位、第10-第50百分位的颗粒大小为25.8-80.6nm、无大的聚合物)所期望的,颗粒展现出有限的毒性,在~500m处加入大体积峰的情况下,其展现出类似的ζ电位分布和大小。图69提供了来自cynobm.002.77的数据。90%的纳米颗粒的直径低于254nm,其中大部分在171-254nm范围内。(例如,参见以下的流式细胞术和成像数据)。另外,按数量计算的第10-到第50百分位的颗粒为70-172nm,指示该群内的颗粒大小分布合理。与其中溶液中存在大量>200nm和/或具有大的、分布的ζ电位和/或非阴离子ζ电位的颗粒的其它研究一致,这些颗粒导致显著的细胞死亡。这些纳米颗粒总体上导致高摄取百分比,但是大量细胞(>90%)已经死亡。最终,根据流式细胞术数据,颗粒在活的cd3+、cd45+和cd34+骨髓细胞中、在crispr-gfp-rnp的检测限度下产生可忽略的摄取,并且在全骨髓活亚群中产生3.8%的crispr摄取。相反,具有相同表面涂层的90%的cynobm.002.83(crispr和mrna共递送变体)颗粒低于200nm,平均数为121nm。通过与tcell.001.01-tcell.001.15中具有相似调配物的颗粒不同的方法生产的cynobm.002.75-cynobm.002.81中的其它颗粒具有更有利的大小和ζ电位分布并且在活的人cd4+和cd8a+t细胞中产生高转染效率(高达99%)。图70提供了来自cynobm.002.78的数据。纳米颗粒的ζ电位为-11.72+/-0.79mv,其中90%的直径小于223nm。(例如,参见以下的流式细胞术和成像数据)。类似地,90%的具有相同表面涂层的cynobm.002.84(crispr和mrna共递送变体)颗粒低于200nm,其中平均数为125nm,尽管cynobm.002.84的ζ电位显著更负(-18.07mv对-11.72mv),指示利用阴离子可脱落层间台阶中间体增强稳定性,使初始cas9rnp电荷与plr10均匀化并且随后用配体或另外任选的分子量交错聚合物或多肽涂覆增强稳定性。这些单递送对共递送(或间层对配体与rnp的直接缀合)纳米颗粒的不同物理化学性质及其各自的大小范围与转染效率和毒性强相关。图71提供了来自cynobm.002.79的数据。纳米颗粒的直径小于200nm。这些纳米粒子导致骨髓中gfp-rnp的整体摄取非常低(3.7%),但培养基中的细胞保留了极高的活力(70.0%对阴性对照的71.6%)。尽管总体摄取非常低,但是根据流式细胞仪数据,颗粒显示对活的cd3+细胞的选择性摄取为~9.0%、活的cd45+细胞为约4.4%、活的cd34+细胞为约100%,这是cd34+亚群中用于细胞计数的检测极限。(例如,参见以下的流式细胞术和成像数据)。结果表示混合细胞群内的cd34+造血干细胞的特异性靶向。图72提供了来自cynobm.002.80的数据。纳米粒子的ζ电位为1.36+/-1.69mv。根据流式细胞术数据,这些纳米颗粒在活的cd34+骨髓细胞中产生8%的转染效率和~100%的有效crispr-gfp-rnp摄取,这是用于细胞计数的检测极限。(例如,参见以下的流式细胞术和成像数据)。结果可能表示在内皮细胞、成骨细胞、破骨细胞和骨髓的其它细胞中的成功的靶向。具有宽表面的~0mv处的均匀峰指示两性离子颗粒表面。高度的细胞活力指示该大小的颗粒具有良好的耐受性并且c-kit-受体-衍生的颗粒表面可能在细胞-细胞相互作用期间模拟骨髓内天然干细胞群表面标志物的呈递。图73-图109:流式细胞术和成像数据图73.在食蟹猴骨髓中的cynobm.002样品的未转染对照。显微镜图像-上图:数字相位对比;中图:gfp;下图:合并。流式细胞术数据-具有活力;cd34、cd3和cd45染色。图74.nls-cas9-egfpbcl11agrnarnp的脂质体crisprmax递送在活细胞中获得2.5%的转染效率并且造成显著的毒性,与食蟹猴骨髓中的阴性对照相比,cd45和cd3相对亚群的百分比显著降低。如通过剩余的cd3+细胞和可忽略不计的剩余的cd45+和cd34+的群的7.4%的有效靶向所例示的,脂质体crisprmax没有表现出细胞选择性。显微镜图像-上图:数字相位对比;中图:gfp;下图:合并。图75.cynobm.002rnp-仅对照示出了nls-cas9-egfpbcl11agrnarnp在没有递送载体但在转染前预先组合了两种有效负载的情况下在食蟹猴骨髓中获得可忽略的转染效率。尽管没有递送载体和最小事件,但是高度的共定位指示核糖核蛋白复合物与mrna的缔合,以及crisprrnp的阴离子官能化的示例。(在该实例下,mrna充当rnp的松散缔合的可脱落涂层并且可以进一步用阳离子材料分层)。计算共定位系数。x:活细胞中crispr摄取的%:y:活细胞中mrna摄取的%c:具有crispr和mrna的细胞的%z:x或y的值,哪个较大共定位系数=c/zcas9-mrna共定位系数:92.2%图76.cynobm.002.82显示,非特异性靶向的nls-cas9-egfp实现了将11.3%的有效mrna和11.4%的有效crispr递送到食蟹猴骨髓,其中共定位系数为98.9%。亚细胞定位显示,非特异性靶向的nls-cas9-egfpbcl11agrnarnp与cy5mrna共定位并且获得高转染效率。高度的共定位确定离散颗粒装有两种有效负载。另外,可以看到cas9整齐地定位于与mrna分离的区室中,其中mrna在核相关cas9周围形成环状结构。这指示了两种有效负载的细胞溶质(mrna)对核(crispr)定位。显微镜图像-上图:数字相位对比;中图:cy5mrna;下图:合并以及上图:cas9-gfprnp;下图:与cas9-gfprnp共定位的cy5mrna。物理化学参数和附加观察结果参见以上数据。cynobm.002.82的ζ电位为2.96+/-0.14mv,其中90%的直径小于132nm并且50%的颗粒的直径小于30nm。这些纳米颗粒在活的cd3+、cd45+和cd34+骨髓亚群中分别产生45.5%、56.0%和97.3%的有效crispr-gfp-rnp+cy5_egfp_mrna摄取,尽管仅有11.4%的全骨髓活亚群靶向。cas9-mrna共定位系数:94.8%。活的cd34+和crispr+:97.2%的活的cd34+。胎儿血红蛋白阳性:3.022%的活细胞图77.cynobm.002.83实现了将8.1%的有效mrna和8.1%的有效crispr递送到食蟹猴骨髓,其中共定位系数为93.0%。亚细胞定位显示,与nls-cas9-egfpbcl11agrnarnp缔合的il2衍生肽与cy5mrna共定位并且获得高转染效率。高度的共定位确定离散颗粒装有两种有效负载。另外,可以看到cas9整齐地定位于与mrna分离的区室中,其中mrna在核相关cas9周围形成环状结构。这指示了两种有效负载的细胞溶质(mrna)对核(crispr)定位。显微镜图像-上图:数字相位对比;中图:cy5mrna;下图:合并以及上图:cas9-gfprnp;下图:与cas9-gfprnp共定位的cy5mrna。物理化学参数和附加观察结果参见以上数据。这些纳米颗粒分别在活的cd3+、cd45+和cd34+骨髓细胞中产生~27%、41%和~100%的有效crispr-gfp-rnp+cy5_egfp_mrna摄取。cas9-mrna共定位系数:93.0%。胎儿血红蛋白阳性:1.9%的活细胞图78.如在9.5%的活的全骨髓细胞中的胎儿血红蛋白蛋白质表达所证明的,cynobm.002.84颗粒成功地删除了全骨髓红系祖细胞中的bcl11a红系增强子,并且如通过每个选择性亚群中的cy5-mrna+和crispr-gfp-rnp+门所测量的,尽管转染效率中等,但cd34+、cd45或cd3+亚群中没有阳性的胎儿血红蛋白测量结果。亚细胞定位显示,与nls-cas9-egfpbcl11agrnarnp缔合的e-选择蛋白衍生肽与cy5mrna共定位并且获得高转染效率。高度的共定位确定离散颗粒装有两种有效负载。另外,可以看到cas9整齐地定位于与mrna分离的区室中,其中mrna在核相关cas9周围形成环状结构。这指示了两种有效负载的细胞溶质(mrna)对核(crispr)定位。显微镜图像-上图:数字相位对比;中图:cy5mrna;下图:合并以及上图:cas9-gfprnp;下图:与cas9-gfprnp共定位的cy5mrna。物理化学参数和附加观察结果参见以上数据。根据流式细胞术数据,这些纳米颗粒在活的cd3+、cd45+和cd34+骨髓细胞中分别产生76.5%、71%和~100%的有效crispr-gfp-rnp+cy5_egfp_mrna共定位摄取,以及~25.5%的全骨髓活亚群。另外,9.5%的总活细胞对胎儿血红蛋白呈阳性,这些细胞中没有一个是cd34+、cd3+或cd45+,表现了cd34-红系祖细胞内的bcl11a红系祖细胞敲除群的成功的克隆扩增。cas9-mrna共定位系数:97.1%。胎儿血红蛋白(hbf)阳性:9.5%的活细胞14%的cd34+细胞;cd34+和hbf+的0%的共定位图79.cynobm.002.85实现了将5.2%的有效mrna和5.3%的有效crispr递送到食蟹猴骨髓,其中共定位系数为87.2%。尽管将5.3%的有效crispr递送到活细胞,但cynobm.002.85并未如在其它共递送实施例中所见的导致伴随而来的胎儿血红蛋白阳性细胞的增加。亚细胞定位显示,与nls-cas9-egfpbcl11agrnarnp缔合的scf衍生肽与cy5mrna共定位并且获得高转染效率。高度的共定位确定离散颗粒装有两种有效负载。另外,可以看到cas9整齐地定位于与mrna分离的区室中,其中mrna在核相关cas9周围形成环状结构。这指示了两种有效负载的细胞溶质(mrna)对核(crispr)定位。显微镜图像-上图:数字相位对比;中图:cy5mrna;下图:合并以及上图:cas9-gfprnp;下图:与cas9-gfprnp共定位的cy5mrna。附加物理化学特性参见以上数据。这些纳米颗粒分别在活的cd3+、cd45+和cd34+骨髓细胞中产生~33%、~23%和~100%的有效crispr-gfp-rnp+cy5_egfp_mrna摄取。cas9-mrna共定位系数:87.2%。胎儿血红蛋白阳性:0.9%的活细胞图80.cynobm.002.86实现了将20.1%的有效mrna和21.8%的有效crispr递送到食蟹猴骨髓,其中共定位系数为98.6%。亚细胞定位显示,异质三价靶向的il2-、e-选择蛋白和scf-衍生的nls-cas9-egfpbcl11agrnarnp与cy5mrna共定位并且获得高转染效率。高度的共定位确定离散颗粒装有两种有效负载。另外,可以看到cas9整齐地定位于与mrna分离的区室中,其中mrna在核相关cas9周围形成环状结构。这指示了两种有效负载的细胞溶质(mrna)对核(crispr)定位。显微镜图像-上图:数字相位对比;中图:cy5mrna;下图:合并以及上图:cas9-gfprnp;下图:与cas9-gfprnp共定位的cy5mrna;附加物理化学特性参见以上数据。cas9-mrna共定位系数:91.3%。胎儿血红蛋白阳性:7.6%的活细胞图81.cynobm.002.75显示,具有可脱落阴离子多肽涂层的非特异性靶向的nls-cas9-egfpbcl11agrnarnp在活的食蟹猴骨髓中获得了18.0%的转染效率。总体而言,20%的活的cd3+t细胞在本文的混合群食蟹猴骨髓培养模型中是crispr+,而在人原代pant细胞中97-99%的活的cd4和cd8at细胞是tcell.001中的crispr+。相同调配物的颗粒大小在tcell1中更小且更均匀,所述制剂通过流体处理机器人而不是通过手工合成。附加的定性和定量注释以及数据比较参见以上数据。上图:数字相位对比;中图:gfp;下图:合并。图82.cynobm.002.76显示,与食蟹猴骨髓中的阴性对照相比,双组蛋白片段缔合的和非特异性靶向的nls-cas9-egfpbcl11agrnarnp获得13.1%的转染效率和有限毒性。18%、10%和0%的cd3+、cd45+和cd34+活亚群是crispr+。附加物理化学特性和观察结果参见以上数据。上图:数字相位对比;中图:gfp;下图:合并。图83.cynobm.002.77显示,与食蟹猴骨髓中的阴性对照相比,与nls-cas9-egfpbcl11agrnarnp缔合的同质价态靶向的il2衍生肽获得3.8%的转染效率和增强的活力。~90%的转染细胞死亡。最终,颗粒在活的cd3+、cd45+和cd34+骨髓细胞中、在crispr-gfp-rnp的检测限度下产生可忽略的摄取,指示剩余的3.8%的活的crispr+细胞并非来自这些亚群。大小数据支持在大颗粒多分散性和~999nm的第90体积百分位颗粒大小中的毒性的致病作用。附加的物理化学性质参见以上数据。上图:数字相位对比;中图:gfp;下图:合并。图84.cynobm.002.78显示,与nls-cas9-egfpbcl11agrnarnp缔合的同质价态靶向的e-选择蛋白衍生肽获得~71%的总体转染效率(包含死细胞),仅有4.5%的活细胞仍在食蟹猴骨髓中转染。这指示了颗粒毒性并且可能与大尺寸分布相关,尽管以数量计,50%的颗粒为33.1-113.1nm。包括溶液中大部分颗粒质量和容量的>250nm的颗粒可能导致该实验的活力降低。在该实施例中,cd45+和cd3+亚群密度也是多方面减少的。更详细的比较来自相同转染的纳米颗粒组的物理化学特性和定性观察结果参见以上数据。上图:数字相位对比;中图:gfp;下图:合并。图85.cynobm.002.79显示,与食蟹猴骨髓中的阴性对照相比,与nls-cas9-egfpbcl11agrnarnp缔合的同质价态靶向的scf衍生肽获得3.7%的转染效率和极好的活力。这些纳米粒子导致骨髓中gfp-rnp的整体摄取非常低(3.7%),但培养基中的细胞保留了极高的活力(69.0%对阴性对照的71.6%)。尽管总体摄取非常低,但是颗粒显示对活的cd3+细胞的选择性摄取为~5%、活的cd45+细胞为约~4%并且活的cd34+细胞为约100%(后者在数值上处于检测极限)。高度的细胞活力加上呈强负性的ζ电位以及显著多于其它组的cd45+细胞,显示了了scf模拟颗粒表面在建立干细胞龛靶向和增殖和/或存活技术中的多因素作用。附加的物理化学参数参见以上数据。上图:数字相位对比;中图:gfp;下图:合并。。图86.cynobm.002.80显示,与nls-cas9-egfpbcl11agrnarnp缀合的同源价态靶向的c-kit-(cd117)衍生肽获得了8.097%的转染效率。转染效率分别为3.3%、2.4%,并且分别处于cd3+、cd45+和cd34+活亚群的检测极限,指示对cd3+和cd45+细胞的低选择性。更多的定量和定性数据参见以上数据。上图:数字相位对比;中图:gfp;下图:合并。(续):流式细胞术数据。图87.cynobm.002.81显示,异质三价靶向的il2-、e-选择蛋白-和scf衍生的nls-cas9-egfpbcl11agrnarnp在食蟹猴骨髓中获得5%的转染效率,尽管仅有0.48%的细胞是cd34+,但是~10%的转染细胞是活的cd34+细胞。这指示cd34+细胞的有效的选择性转染接近100%。上图:数字相位对比;中图:gfp;下图:合并。。图88.cynobm.002rnp-仅对照的定性图像示出了nls-cas9-egfpbcl11agrnarnp在没有递送载体的情况下在食蟹猴骨髓中获得轻度的阳性信号。上图:数字相位对比;中图:gfp;下图:合并。图89.hsc.004(纳米颗粒69-74,参见表4)高含量筛选。在原代人cd34+造血干细胞中转染后12-15小时的hsc.004cy5mrna递送的荧光显微图像(cy5mrna)。利用mrna调配物的这种特定实施例,用scf肽和e-选择蛋白进行异质双价靶向,以及用e-选择蛋白而不用scf肽进行同质价态靶向,实现比脂质体信使max更高的转染效率。hsc.001.69:a1–a6;hsc.001.70:b1–b6;hsc.001.71:c1–c6;hsc.001.72:d1–d6;hsc.001.73:e1–e6;hsc.001.74:f1–f6;hsc.004脂质体信使max剂量1:g1–g2和g4–g5;tc.001脂质体信使max剂量2:h1–h2和h4–h5;tc.001阴性:g3、g6、h3、h6图90.tcell.001(纳米颗粒1-15,参见表4)高含量筛选。对tc.001.1-tc.001.60实行机器人调配物,代表4个有效负载(crisprrnp、mrna、sirna和pdna)中的15个配体。示出了t细胞crispr递送和定性转染效率的实施例-复合显微镜下转染后12-15小时的tcell.001crispr-egfprnp递送到原代人pant细胞的缩略图。板布局:tc.001.1:a1–c1;tc.001.3:d1–f1;tc.001.4:a2–c2;tc.001.5:d2–f2;tc.001.6:a3–c3;tc.001.7:d3–f3;tc.001.8:a4–c4;tc.001.9:d4–f4;tc.001.10:a5–c5tc.001.11:d5–f5;tc.001.12:a6–c6;tc.001.13:d6–f6;tc.001.14:a7–a9;tc.001.15:b7–b9;tc.001.2:a10–a12;tc.001脂质体crisprmax剂量1:b10–b12;tc.001脂质体crisprmax剂量2:c7–c9;仅tc.001rnp:c10–c12;tc.001阴性:d7–e12。图91.tcell.001脂质体crisprmax。在转染后24小时,脂质体crisprmax在人原代pant细胞的活的cd4+和cd8a+亚群中分别获得4.7%和4.8%的nls-cas9-egfprnp的有效递送。总体而言,12.5%的crispr+细胞和65.9%的整体细胞是活的。图92:在转染后24小时,tcell.001.1在人原代pant细胞的活的cd4+和cd8a+亚群中分别表现出99.163%和98.447%的有效的非特异性靶向的crispr-gfp核糖核蛋白摄取。总体而言,60.2%的crispr+细胞和57.2%的整体细胞是有活力的。图93.在转染后24小时,tcell.001.2,非特异性靶向的聚乙二醇化对照,在人原代pant细胞的活的cd4+和cd8a+亚群中分别表现出5.5%和6.9%的有效的crispr-gfp核糖核蛋白摄取。总体而言,5.6%的crispr+细胞和40.5%的整体细胞是有活力的。图94.tcell.001.3显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的唾液酸粘附素衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生11.6%和13.2%的有效摄取。总体而言,40.0%的crispr+细胞和79.2%的整体细胞是活的。图95.tcell.001.4显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的cd80衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生6.8%和8.8%的有效摄取。总体而言,12.9%的crispr+细胞和60.2%的整体细胞是活的。图96.tcell.001.5显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的cd80衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生10.3%和10.9%的有效的crispr-gfp核糖核蛋白摄取。总体而言,48.3%的crispr+细胞和85.1%的整体细胞是活的。注意,在阴性对照的9个孔中(对于tcell.001流式细胞术,n=3阴性),活力分别为81.4%、84.7%和82.5%,这表明c末端锚定的、cd80衍生的cd28靶向肽可能对培养液中未转染的细胞有轻微的生存促进作用。相反,tcell.001.4,相同的n末端锚定肽,显示出明显的毒性,tc.001.6和tc.001.7也是如此,它们也是cd80衍生片段,具有针对cd28跨膜受体的不同变构。图97.tcell.001.6显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的cd86衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生1.7%和2.9%的有效摄取。总体而言,6.8%的crispr+细胞和69.1%的整体细胞是活的。图98.tcell.001.7显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的cd86衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生1.6%和2.1%的有效摄取。总体而言,10.3%的crispr+细胞和76.4%的整体细胞是活的。图99.tcell.001.8显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的cd86衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生14.5%和16.0%的有效摄取。总体而言,39.1%的crispr+细胞和76.3%的整体细胞是活的。图100.tcell.001.9显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的4-1bb衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生3.6%和3.2%的有效摄取。总体而言,27.5%的crispr+细胞和87.8%的整体细胞是活的。注意,在阴性对照的9个孔中(对于tcell.001流式细胞术,n=3阴性),活力分别为81.4%、84.7%和82.5%,这表明具有先天的t细胞生存信号的c末端锚定的、4-1bb衍生的cd137靶向肽可能对培养液中未转染的细胞有轻微的生存促进作用。图101.tcell.001.10显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的4-1bb衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生5.8%和5.4%的有效摄取。总体而言,30.8%的crispr+细胞和84.2%的整体细胞是活的。注意,在阴性对照的9个孔中(对于tcell.001流式细胞术,n=3阴性),活力分别为81.4%、84.7%和82.5%,这表明具有先天的t细胞生存信号的c末端锚定的、4-1bb衍生的cd137靶向肽在培养液中没有表现出总体毒性。图102.tcell.001.11显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的cd3-ab衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生12.9%和12.4%的有效摄取。总体而言,50.0%的crispr+细胞和77.6%的整体细胞是活的。图103.tcell.001.12显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的cd3-ab衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生9.0%和9.5%的有效摄取。总体而言,38.9%的crispr+细胞和80.7%的整体细胞是有活力的。图104.tcell.001.13显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的il2衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生25.7%和28.6%的有效摄取。总体而言,40.3%的crispr+细胞和68.1%的整体细胞是有活力的。图105.tcell.001.14显示,在转染后24小时,与crispr-gfp核糖核蛋白缀合的同质价态靶向的il2衍生肽在人原代pant细胞的活的cd4+和cd8a+亚群中分别产生24.9%和25.8%的有效摄取。总体而言,45.9%的crispr+细胞和70.1%的整体细胞是活的。图106.tcell.001.15,十二价态靶向的12配体变体,不会导致内吞摄取或crispr递送。总体而言,59.8%的整体细胞是活的。图107.tcell.001阴性对照。来自阴性(未转染)对照的9个孔中的一个孔的代表性结果。总体而言,细胞接种后52小时(转染后24小时),81.4%、84.7%和82.5%的整体细胞是活的。图108.通过利用siglec衍生物进行糖基化细胞表面标记物靶向,blood.002在人全血的淋巴细胞门中获得60%-97%的mrna递送效率;示出了通过attunenxt流式细胞仪测定的cy5标记的egfpmrna。与聚乙二醇化对照相比,配体靶向是细胞信号的显著增强子。预测纳米颗粒行为的附加的物理化学性质参见以上数据。blood.002对照:未转染。blood.002.88:cd45-和neu5ac靶向的siglec衍生物(在阴离子聚合物之前加入阳离子锚-连接子-配体肽)。blood.002.89:cd45-和neu5ac靶向的siglec衍生物(在阴离子聚合物之后加入阳离子锚-连接子-配体肽)。blood.002.90:聚乙二醇化对照(在阴离子聚合物之前加入阳离子锚-peg)。blood.002.91:非特异性靶向变体。blood.002.92:无有效负载的cd45-和neu5ac-靶向的siglec衍生物(锚-连接子-配体直接与阴离子聚合物缀合,阴性荧光对照)。图109.tcell.001.27显示,如通过流式细胞术所测量的,在转染后5小时,同质价态靶向的siglec衍生肽在人原代pant细胞的活的cd8a+和cd4+亚群中指导45%的有效cy5mrna摄取。这些颗粒的大小和ζ电位显示了平均颗粒大小为171nm、ζ电位为-25.5+/-0.15mv,指示在1.35的羧酸盐比磷酸盐(c:p)以及0.85的胺比磷酸盐的比例下的颗粒具有强稳定性,其中在包合阳离子锚-连接子-配体后加入聚(谷氨酸)。tcell.001.2和tcell.001.18的ζ电位和大小数据参见以上数据。附加的定量细节参见以上数据。右上:明视场;右中:cy5mrna;右下:合并上图:阴性对照的明视场;下图:阴性对照的cy5通道。实例4图110.用于核糖核蛋白和蛋白质递送的基本原理。crisprrnp的电荷密度图允许确定是否应添加阴离子或阳离子肽/材料以在蛋白质表面上形成稳定的带电层。在一个实施例中,暴露的核酸(阴离子)和阴离子电荷袋在加入带电阴离子之前充当带电阳离子的强静电锚定位点,或者充当它们自己的配体-连接子阴离子锚。比例尺:电荷。图111.用于核糖核蛋白和蛋白质递送的基本原理。睡美人转座子的电荷密度图允许确定是否应添加阴离子或阳离子肽/材料以在蛋白质表面上形成稳定的带电层。在另一个实施例中,阳离子电荷袋在加入带电阳离子之前充当带电阴离子的强静电锚定位点,或者作为它们自己的配体-连接子-阴离子锚定结构域。比例尺:电荷。图112.在(2)加入阳离子锚作为(2a)锚-连接子-配体或独立的阳离子锚,添加或不添加(2b)后续多层化学、多种核酸或带电治疗剂的共递送或通过交联进行层稳定之前的(1)锚定到crisprrnp表面上的阳离子位点的示例性阴离子肽(9-10个氨基酸长,大约按比例缩放到10nm直径的crisprrnp)。手绘图从左到右转换为文本:‘阳离子锚’。‘间隔区’。‘配体’。‘和/或’。‘2d’。‘阳离子聚合物和/或多肽’。‘2b然后是层间化学’。图113.用于有效负载与带电蛋白质核心模板的共递送的基本原理。基于可以包含cas9rnp或任何均匀或两性离子带电表面的核心模板的添加顺序和静电基质组合物的实例。示出了用于使用各种聚合物均化两性离子表面电荷的方法。由与grna结合的crispr-cas9rnp组成的~10nm核心颗粒与两性离子结构域一起示出。简而言之,在加入带相反电荷的聚合物之前,可以加入阳离子聚合物或阴离子聚合物以使表面电荷均匀化。阴离子成分的交错分子量被证明可以提高具有rnp核心和mrna-ple层间的颗粒的转染效率和基因编辑效率,其中cynobm.002.82-cynobm.002-86中的多个表面涂层对cynobm.002.75-cynobm.002.81中的单个有效负载递送变体。带电核心模板实施例包括任何带电表面,所述带电表面包含带电树枝状大分子或寡糖-树枝状大分子、重组或合成组蛋白二聚体/三聚体/四聚体/八聚体、纳米钻石、金纳米颗粒、量子点、mri造影剂或其与以上的组合。手绘图从左到右转换为文本:‘带负电荷的涂层可以用阳离子聚合物或锚-连接子-配体层压,其中锚是阳离子的。’‘氨基糖’。‘带电糖胺聚糖’。‘pdna’。‘共递送’。‘暴露的grna’。‘净负可脱落聚合物涂层’。‘聚糖’。‘cas9上的阳离子蛋白质结构域’。‘~10nm的cas9rnp’。‘cas9上的阳离子蛋白质结构域’。‘plr’。‘pde(5-100)’。‘ple(5-100)’。‘cas9上的阴离子蛋白质结构域’。‘mrna’。‘糖肽上的支化阳离子聚合物’。‘组蛋白’。‘sirna’。‘带负电荷的涂层也可以是阴离子锚-连接子-配体或独立的阴离子基质组合物的结构域’。一致聚合物的交错mw提高了胶体稳定性和基因编辑效率。实例5图114.肽工程-用于il2r靶向的新型il2模拟片段。白细胞介素-2(左)与白细胞介素-2受体(右)结合(pdb:1z92)选自il2(pdb1z92)的序列asn(33)-pro(34)-lys(35)-leu(36)-thr(37)-arg(38)-met(39)-leu(40)-thr(41)-phe(42)-lys(43)-phe(44)-tyr(45)与il2受体α链的活性结合区域相关。通过选择il2r与il2的相互作用基序来工程化互补的结合:此处,为来自il2受体的两个结合基序选择序列cys(3)-asp(4)-asp(5)-asp(6)-met(25)-leu(26)-asn(27)-cys(28)-glu(29)。图115:肽工程-cd3概念下的新型抗体衍生的“活性结合袋”工程验证。选自cd3抗体(pdb1xiw)的序列thr(30)-gly(31)-asn(52)-pro(53)-tyr(54)-lys(55)-gly(56)-val(57)-ser(58)-thr(59)-tyr(101)-tyr(102)-gly(103)-asp(104)与cd3ε和δ链的活性结合区域相关。氨基酸的顺序被重布置成反映结合袋中肽的2维平面的结合动力学,所述肽不再具有由较大蛋白质维持的三级结构。这种数据降维导致:thr(59)-ser(58)-val(57)-gly(56)-lys(55)-tyr(54)-pro(53)-asn(52)-thr(30)-gly(31)-tyr(101)-tyr(102)-gly(103)-asp(104).图116:肽工程-用于cd45糖基化靶向的新型siglec衍生物。与n-乙酰神经氨酸(neu5ac)络合的唾液酸粘附素n-末端的pdb渲染(rcspdb1oda)。在渲染中位于唾液酸粘附素近侧的唾液酸粘附素片段用于靶向糖基化的cd45和其它络合的细胞表面糖蛋白。它在tcell.001.3中成功靶向具有crisprrnp的t细胞以及在blood.002.1-blood.002.2中成功靶向全血淋巴细胞门中的mrna。配体序列为snrwldvk(seqidno:xx)。图117:肽工程-用于c-kit靶向的新型scf片段。虚线圆圈-干细胞因子(rcspdb1scf)的信号肽结构域代表c-kit活性所必需的二聚体结构域。可以在在cynobm.002.79(~5%的效率)和cynobm.002.85(~56%的效率)之间比较和对比配体呈现对由于特定纳米颗粒表面大小+scf涂层密度引起的细胞摄取的影响。另外,人cd34+造血干细胞转染的定性图像显示了对比,其中e-选择蛋白+scf片段(hsc.004.73)实现了高效率,但scf片段本身未实现高效率(hsc.004.74)。行为的显着差异表明二聚体肽在产生内吞线索和随后核靶向核酸和/或核糖核蛋白材料中的特定作用。配体序列为ekfilkvrpafkav(seqidno:xx)(mscf);和ekfilkvrpafkav(seqidno:xx)(rmscf)。图118:肽工程-用于膜结合scf靶向的新型ckit受体片段。干细胞因子靶向肽的合理设计衍生自c-kit,以模拟内皮细胞和骨髓细胞上的造血干细胞滚动行为的行为并且提高系统转染效率(参见cynobm.002.80)。评估折叠的序列:名称scfn,序列:rrrrrrrrrggggsggggsegicrnrvtnnvkdvtklvanlpk(seqidno:xx)。用rosetta和namd模拟包评估序列-rosetta结果:将缩短的序列放置于rosetta中用于从头折叠(ggsegicrnrvtnnvkdvtklvanlpk)(seqidno:xx)。图119:肽工程-ckit受体片段(续)。用分子动力学模拟的锚定-连接子-配体的锚片段保持在适当位置以允许模拟如将在纳米颗粒表面上呈现的熵有利的构象。每个结果含有相同的评分因子,这意味着很难确定这些结构中的任何结构是否是优选的。rosetta也不进行折叠动力学,因此很可能这些序列不会折叠成螺旋状结构。namd结果:因为rosetta不进行折叠动力学,所以检查完整序列是否会快速折叠成二级结构。在namd中使用副本交换分子动力学(remd)在介于300-500k之间的16或32个副本上进行模拟并且在每个复制品上模拟10ns。锚部分(聚-r)被固定成线性以模拟蛋白质与颗粒的结合。示出了最低能量快照。对衍生自kit的序列的进一步分析显示,它可能不具有大量固有顺序。橙色卡通部分属于最初从kit中选择的序列。图120:肽工程-ckit受体片段(续)。通过用氨基异丁酸修饰关键疏水性结构域,将具有强配体-连接子的稳定化随机卷曲肽自折叠成稳定的螺旋肽,用于有效的配体呈现。蓝色链代表kit中存在的更有序的螺旋,范围从残基71到94:snysiidklvnivddlvecvkens。具有锚和连接子的kit残基71到94的namd模拟:rrrrrrrrrggggsggggssnysiidklvnivddlvecvkens聚合成其中链与连接子残基在很大程度上相互作用的结构。对于残基71到94,存在通过与klt中的其它两个螺旋相互作用来稳定螺旋的疏水性残基。疏水性残基以红色示出(下划线):snysiidklvnivddlvecvkens。改变序列以移除疏水性残基并且用氨基异丁酸(aib)取代,帮助诱导螺旋折叠,以得到以下序列:kit7194_aib1:snysaibadkaibanaibaddaibaeaibakens.含有aib的序列在rink树脂上合成并且在游离胺和酰化胺(ac)上分离。通过圆二色性检查二级结构。图121:肽工程-ckit受体片段(续)scf_mckit_(4gs)2_9r_n和scf_mckit(ac)_(4gs)2_9r_n的圆二色性。配体末端的乙酰化可以用于中和带电多肽末端的电荷。上图:kit7194_aib1的cd在222附近略有下降并且在208附近大幅下跌,与包含aib单元的α-螺旋和螺旋的二级结构一致。下图:kit7194_aib1_ac示出了与kit7194_aib1相似的cd。有时酰化可以帮助折叠,但似乎没有必要。乙酰化也可以帮助配体相互作用,因为终端胺需要是中性的而不是带电荷的。完整锚-连接子-kit7194_aib1构建体:rrrrrrrrr-ggggsggggs-snysaibadkaibanaibaddaibaeaibakens.图122:肽工程-ckit受体片段。在用氨基异丁酸修饰关键疏水残基后,scf_mckit(ac)_(4gs)2_9r_n的稳定构象。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1