重组单克隆抗TNFα抗体的水性药用组合物的制作方法
发明的
技术领域:
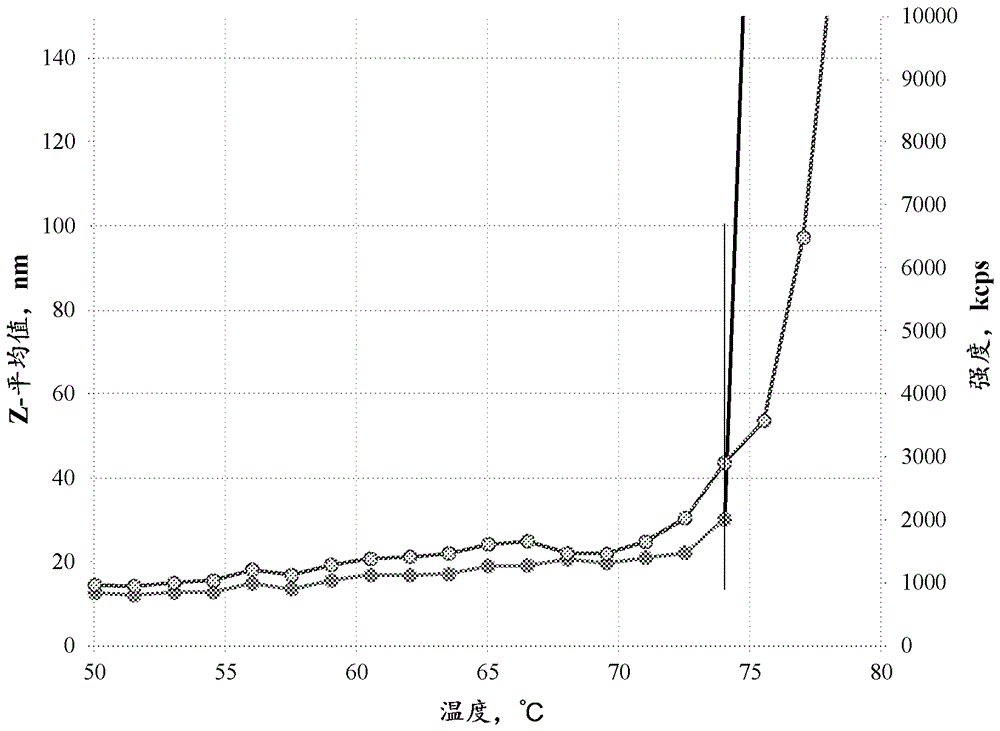
本发明涉及医学药理学,并且特别是涉及特异性地结合或中和tnfα的人抗体的水性药用组合物及其用途。发明背景肿瘤坏死因子α(tnfα)为天然存在的哺乳动物细胞因子,其由各种类型的细胞(包括单核细胞和巨噬细胞)响应内毒素或其他刺激而产生。tnfα为炎性、免疫和病理生理反应的主要介质(grell,м.,etаl.(1995)cell,83:793-802)。可溶性tnfα通过裂解前体跨膜蛋白形成(kriegler,etal.(1988)cell53:45-53),并且17千道尔顿(kda)的分泌型多肽聚集形成可溶性同源三聚体复合物(smith,etal.(1987),j.biol.chem.262:6951-6954;butler,etal.(1986),nature320:584;old(1986),science230:630)。然后这些复合物与多种细胞上发现的受体结合。结合产生许多促炎作用,包括(i)释放其他促炎细胞因子,比如白细胞介素(il)-6、il-8和il-1,(ii)释放基质金属蛋白酶,和(iii)上调内皮细胞粘附分子表达,通过将白细胞吸引到血管外组织中进一步扩大炎性和免疫级联。存在许多与tnfα水平升高相关的障碍。例如,已显示tnfα表达在许多人类疾病中上调,包括慢性疾病,比如类风湿性关节炎(ra)、炎性肠病(包括克罗恩病和溃疡性结肠炎)、脓毒症、充血性心力衰竭、支气管哮喘和多发性硬化。tnfα也称为促炎细胞因子。在生理学上,tnfα还与预防特定感染有关(cerami.etal.(1988),immunol.today9:28)。tnfα由已被革兰氏阴性细菌的脂多糖激活的巨噬细胞释放。因此,tnfα似乎是一种非常重要的内源性介质,其参与与细菌性脓毒症相关的内毒素性休克的发展和发病机制。阿达木单抗(abbvie,inc.)为对人类tnf特异性的人重组单克隆igg1抗体。该抗体也称为d2e7。阿达木单抗由1330个氨基酸组成,在us6090382(wo9729131)中描述并获得专利,阿达木单抗的描述特此通过参考以其全部结合。阿达木单抗一般地通过重组dna技术在哺乳动物细胞表达系统(比如中国仓鼠细胞)中产生。阿达木单抗特异性地与tnf结合并通过阻断其与细胞表面上的tnf受体p55和p75的相互作用来中和tnf生物学功能。多种阿达木单抗制剂为本领域已知的(参见例如wo2004016286和wo2012065072)。wo2004016286描述了用于稳定用于治疗tnfα介导的疾病的抗体的液体组合物,其包含抗体比如阿达木单抗、缓冲系统、聚山梨醇酯和溶液等渗剂例如甘露醇和氯化钠。组合物使用柠檬酸盐-磷酸盐缓冲液(humira制剂1)。以上制剂具有许多缺点:1)高浓度抗体的胶体稳定性不足,2)热应激条件下的稳定性不足,和3)长期储存期间的聚集。wo2012065072描述了用于稳定用于治疗tnfα介导的疾病的抗体的液体组合物,其包含抗体比如阿达木单抗以及甘露醇、聚山梨醇酯80(humira制剂2)。以上制剂具有许多缺点:1)明显的冷冻和解冻不稳定性,和2)聚集温度低。因此,需要提供一种新的药物,其包含结合tnfα的抗体,比如阿达木单抗。本发明涉及包含阿达木单抗的稳定的水性组合物,使其能够长期储存,并且还具有对冷冻-解冻和热应激的良好耐受性。发明概述一方面,本发明涉及用于静脉内、皮下或肌内给予的水性药用组合物,其包含重组单克隆抗tnfα抗体、基于乙酸根离子的缓冲剂(或缓冲系统)、海藻糖或脯氨酸或其组合或者海藻糖和精氨酸、聚山梨醇酯20、聚山梨醇酯80或泊洛沙姆188或其组合。在组合物的一些实施方案中,重组单克隆抗tnfα抗体为阿达木单抗。在组合物的一些实施方案中,单克隆抗体浓度为50-200mg/ml。在组合物的一些实施方案中,乙酸盐缓冲溶液浓度为1-100mm。在一些实施方案中,组合物的ph为4-7。在组合物的一些实施方案中,海藻糖浓度为25-150mg/ml。在组合物的一些实施方案中,脯氨酸浓度为5-40mg/ml。在组合物的一些实施方案中,精氨酸浓度为0.05-1.0mg/ml。在组合物的一些实施方案中,聚山梨醇酯20浓度为0.05mg/ml-10mg/ml。在组合物的一些实施方案中,聚山梨醇酯80浓度为0.05mg/ml-10mg/ml。在组合物的一些实施方案中,泊洛沙姆188浓度为0.05mg/ml-10mg/ml。在组合物的一些实施方案中,重组单克隆抗tnfα抗体为阿达木单抗。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯80。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、0.1mg/ml的精氨酸盐酸盐、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯80。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、27mg/ml的脯氨酸、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯80。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、40mg/ml的海藻糖二水合物、13.5mg/ml的脯氨酸、冰乙酸(直至ph5.5)、0.5mg/ml聚山梨醇酯80。在一些实施方案中,组合物包含50-200mg/ml的重组单克隆抗tnfα抗体、0.4-1.2mg/ml的乙酸钠三水合物、25-150mg/ml的海藻糖和/或5-40mg/ml的脯氨酸或25-150mg/ml的海藻糖和0.05-1.0mg/ml的精氨酸、冰乙酸(直至ph5.0-6.0)、0.1mg/ml-1mg/ml的聚山梨醇酯80。在一些实施方案中,组合物包含50-200mg/ml的重组单克隆抗tnfα抗体、0.4-1.2mg/ml的乙酸钠三水合物、25-150mg/ml的海藻糖和/或5-40mg/ml的脯氨酸或25-150mg/ml的海藻糖和0.05-1.0mg/ml的精氨酸、冰乙酸(直至ph5.5)、0.1mg/ml-1mg/ml的聚山梨醇酯20。在组合物的一些实施方案中,重组单克隆抗tnfα抗体为阿达木单抗。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯20。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、0.1mg/ml的精氨酸盐酸盐、冰乙酸(直至ph5.5)、0.5mg/ml聚山梨醇酯20。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、27mg/ml的脯氨酸、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯20。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、40mg/ml海藻糖二水合物、13.5mg/ml的脯氨酸、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯20。在一些实施方案中,组合物包含50-200mg/ml的重组单克隆抗tnfα抗体、0.4-1.2mg/ml的乙酸钠三水合物、25-150mg/ml的海藻糖和/或5-40mg/ml的脯氨酸或25-150mg/ml海藻糖和0.05-1.0mg/ml的精氨酸、冰乙酸(直至ph5.0-6.0)、0.1mg/ml-1mg/ml的泊洛沙姆188。在组合物的一些实施方案中,重组单克隆抗tnfα抗体为阿达木单抗。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、冰乙酸(直至ph5.5)、1mg/ml的泊洛沙姆188。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、0.1mg/ml的精氨酸盐酸盐、冰乙酸(直至ph5.5)、1mg/ml的泊洛沙姆188。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、27mg/ml的脯氨酸、冰乙酸(直至ph5.5)、1mg/ml的泊洛沙姆188。在一些实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、40mg/ml的海藻糖二水合物、13.5mg/ml的脯氨酸、冰乙酸(直至ph5.5)、1mg/ml的泊洛沙姆188。一方面,本发明涉及用于治疗tnfα介导的疾病的方法,方法包括给予有效量的上述组合物。在治疗方法的一些实施方案中,tnfα介导的疾病选自活动性(中度至重度)类风湿性关节炎、活动性银屑病性关节炎、活动性强直性脊柱炎、慢性(中度至重度)斑块型银屑病、(中度至重度)溃疡性结肠炎、中轴型脊柱关节炎、活动性化脓性汗腺炎、幼年型特发性关节炎、(中度或重度)克罗恩病、葡萄膜炎、活动性附着点炎相关性关节炎。一方面,本发明涉及以上组合物用于治疗tnfα介导的疾病的用途。在用途的一些实施方案中,疾病选自活动性(中度至重度)类风湿性关节炎、活动性银屑病性关节炎、活动性强直性脊柱炎、慢性(中度至重度)斑块型银屑病、(中度至重度)溃疡性结肠炎、中轴型脊柱关节炎、活动性化脓性汗腺炎、幼年型特发性关节炎、(中度或重度)克罗恩病、葡萄膜炎、活动性附着点炎相关性关节炎。一方面,本发明涉及用于产生以上组合物的方法,方法包括向水相中加入乙酸盐缓冲剂,随后以任何顺序加入以下组分:渗透剂和/或稳定剂(选自海藻糖、脯氨酸或其组合)、重组单克隆抗tnfα抗体、表面活性物质(选自聚山梨醇酯20、聚山梨醇酯80、泊洛沙姆188或其组合)。附图简述图1.制备之后溶液在400nm处的光密度对peg6000浓度的依赖性。图2.制备之后溶液在400nm处的光密度对peg6000浓度的依赖性。图3.制备之后溶液在400nm处的光密度对peg6000浓度的依赖性。图4.乙酸盐缓冲溶液(ph5.0)中的阿达木单抗聚集点。tag74.0℃。深灰色:z-平均值,nm,浅灰色:强度,kcps。图5.柠檬酸盐缓冲溶液(ph5.0)中的阿达木单抗聚集点。tag69.5℃。深灰色:z-平均值,nm,浅灰色:强度,kcps。图6.组氨酸缓冲溶液(ph5.0)中的阿达木单抗聚集点。tag69.5℃。深灰色:z-平均值,nm,浅灰色:强度,kcps。图7.磷酸盐缓冲溶液(ph5.0)中的阿达木单抗聚集点。tag71.0℃。深灰色:z-平均值,nm,浅灰色:强度,kcps。图8.humira制剂1(ph5.0)中的阿达木单抗聚集点。tag69.5℃。深灰色:z-平均值,nm,浅灰色:强度,kcps。本发明的公开内容定义和一般方法本说明书中使用的术语在本发明的上下文中以及在其中使用每个术语的特定上下文中通常具有其本领域中的普通含义。在本文以下或其他地方,定义用于描述本发明的某些术语以为从业者提供用于描述本发明的附加指导。提供一些术语的同义词。一个或多个同义词的叙述不排除使用其他同义词。本说明书中任何地方的实例的使用,包括本文所述的任何术语的实例,仅为说明性的,并且不旨在限制本发明或任何示例性主题的范围和含义。本发明不限于本说明书中给出的各种实施方案。除非另外定义,否则本文使用的所有技术和科学术语具有与本发明所属领域的普通技术人员通常理解的相同的含义。在发生冲突的情况下,以本文件(包括定义)为准。术语“阿达木单抗”与中的活性药用成分以及被认为或旨在作为其生物相似或生物改良变体的蛋白质同义。阿达木单抗为对人类tnf特异性的人重组单克隆igg1抗体。阿达木单抗也称为d2e7。阿达木单抗包含两条轻链(每条分子量为约24kda)和两条igg1重链(每条分子量为约49kda)。每条轻链由214个氨基酸残基组成和每条重链由451个氨基酸残基组成。因此,阿达木单抗由1330个氨基酸组成。术语阿达木单抗还旨在包括市售可获得的中使用的所谓的生物相似或生物改良的阿达木单抗蛋白变体。例如,当市售的变体具有与市售可获得的基本上相同的药理作用时,即使其可能呈现出可能与类似(如果不相同)的某些物理性质(比如糖基化分布和酸碱分布),其也可为fda可接受的。为了本申请的目的,术语“阿达木单抗”还包括在氨基酸结构(包括氨基酸的缺失、添加和/或取代)或在糖基化特性和酸碱分布方面具有微小的修饰(这不会显著影响多肽的功能)的阿达木单抗。术语“阿达木单抗”包括的所有形式和制剂,包括(但不限于)浓缩制剂;可注射即用型制剂;用水、醇和/或其他成分重构的制剂等。术语“人类tnfα”,也称为htnfα或htnf或tnfα,意指以17kda分泌形式和26kda膜相关形式存在的人类细胞因子,其生物活性形式为由非共价结合的17kda分子的三聚体组成。tnfα的结构进一步描述于例如pennica,d.,etal.(1984)nature312:724-729;davis,j.m.,etal.(1987)biochemistry26:1322-1326;和jones,e.y.,etal.(1989)nature338:225-228中。术语人类rhtnfα旨在包括重组人tnfα,其可通过标准重组表达方法制备或商购(r&dsystems,catalog.no.210-ta,minneapolis,minn.)。本文使用的术语“抗体”是指由4条多肽链组成的免疫球蛋白型分子,两条重链(h)和两条轻链(l)通过内部二硫键相互连接。每条重链由重链可变区(本文缩写为hcvr或vh)和重链恒定区组成。重链恒定区由3个结构域(ch1、ch2和ch3)组成。每条轻链由轻链可变区(本文缩写为lcvr或vl)和轻链恒定区组成。轻链恒定区由一个结构域cl组成。vh和vl区可进一步细分为高变区,称为互补决定区(cdr),散布有更保守的区域,称为框架区(fr)。每个vh和vl由3个cdr和4个fr组成,按照以下顺序从n-末端到c-末端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在本发明的一个实施方案中,制剂包含具有类似于美国专利第6090382、6258562和8216583号所述的那些的cdr1、cdr2和cdr3序列的抗体。抗体或其抗原结合部分可为通过抗体或抗体部分与一种或多种其他蛋白质或肽的共价或非共价缔合形成的较大免疫粘附分子的一部分。这种免疫粘附分子的实例包括使用链霉亲和素核心区来制备四聚体scfv分子(kipriyanov,s.м.,etal.(1995)humanantibodiesandhybridomas6:93-101)和使用半胱氨酸残基、标志物肽和c-末端多聚组氨酸标签以制备二价和生物素化的scfv分子(kipriyanov,s.м.,etal.(1994)mol.immunol.31:1047-1058)。可分别使用常规方法(比如木瓜蛋白酶或胃蛋白酶消化)从全抗体制备抗体部分(比如全抗体的fab和f(ab')2片段)。进一步地,可使用本文所述的标准重组dna技术获得抗体、抗体部分和免疫粘附分子。本文使用的术语“分离的抗体”是指基本上不含具有不同抗原特异性的其他抗体的抗体(例如特异性地与tnfα结合的分离的抗体基本上不含特异性地与除tnfα以外的抗原结合的抗体)。然而,特异性地与tnfα结合的分离的抗体可能与其他抗原(比如来自其他物种的tnfα分子)具有交叉反应性。此外,分离的抗体可基本上不含其他细胞材料和/或化学品。术语“抗tnfα抗体”是指本文所述以及美国专利第6090382、6258562、6509015、7223394和6509015号所述的人抗tnfα抗体。本发明使用的术语抗tnfα抗体为抗tnfα抗体或其片段,包括英夫利昔单抗(johnsonandjohnson,描述于美国专利第5656272号中)、cdp571(人源化单克隆抗tnfαigg4抗体)、cdp870(人源化单克隆抗tnfα抗体片段)、抗tnfdab(peptech)、cnto148(戈利木单抗;centocor,参见wo02/12502和u.s.521206和u.s.7250165)和阿达木单抗(abbottlaboratories,一种人抗tnfmab,在us6090382中描述为d2e7)。可用于本发明的另外的抗tnf抗体描述于美国专利第6593458、6498237、6451983和6448380号中。在另一个实施方案中,tnfα抑制剂为tnf融合蛋白,例如依那西普(amgen;描述于wo91/03553和wo09/406476中)。在另一个实施方案中,tnfα抑制剂为重组tnf结合蛋白(r-tbp-i)(serono)。术语“长期储存”或“长期稳定性”应理解为意指药用组合物可储存3个月或更长时间、6个月或更长时间,和优选地为一年或更长时间,最优选地为至少两年的最低稳定保质期。通常,术语“长期储存”和“长期稳定性”进一步包括稳定的储存持续时间,其至少与目前可获得的阿达木单抗的市售制剂一般地需要的稳定保质期相当或更好,而不损失稳定性,这种损失将使得制剂不适合其预期的药用应用。长期储存也应理解为意指药用组合物以2-8℃的液体或者冷冻(例如在-18℃或更低温度下)储存。还预期组合物可冷冻和解冻一次以上。关于长期储存的术语“稳定状态”应理解为意指药用组合物中含有的阿达木单抗相对于储存开始时的组合物的活性不会损失超过20%,或更优选地15%,或者甚至更优选地10%,和最优选地5%的其活性。术语“赋形剂”或“添加剂”本文用于描述除了本发明先前所述的那些之外的任何成分。术语“糖”是指单糖、二糖和多糖或其混合物。糖的实例包括(但不限于)蔗糖、海藻糖、葡萄糖、右旋糖等。本文使用的术语“多元醇”是指具有多个羟基的赋形剂,并且包括糖醇和糖酸。多元醇的实例包括(但不限于)甘露醇、山梨醇等。本文使用的术语“缓冲剂(buffer)”、“缓冲剂组成”、“缓冲剂(bufferagent)”是指添加的组成,其使得液体抗体制剂能够一般地通过其酸碱共轭组分的作用来抵抗ph的变化。当提及缓冲剂的浓度时,旨在所述浓度代表缓冲剂的游离酸或游离碱形式的总摩尔浓度。本领域已知并且可在文献中找到的缓冲剂的实例包括(但不限于)组氨酸、柠檬酸盐、琥珀酸盐、乙酸盐、磷酸盐、磷酸盐缓冲盐水、柠檬酸盐-磷酸盐缓冲剂和基于氨丁三醇的缓冲剂等或其合适的混合物。本文使用的术语“张力剂”或“张力调节剂”以及“渗透剂(osmolyte)”或“渗透剂(osmoticagent)”是指可调节液体抗体制剂的渗透压的赋形剂。在某些实施方案中,张力剂可将液体抗体制剂的渗透压调节至等渗,使得抗体制剂在生理上与受试者的身体组织的细胞相容。在仍然另一个实施方案中,“张力剂”可有助于改善本文所述抗体的稳定性。“等渗”制剂为具有与人体血液相当的渗透压的制剂。等渗制剂通常具有约250-350mosm的渗透压。术语“低渗”描述渗透压低于人体血液的制剂。因此,术语“高渗”用于描述渗透压高于人体血液的制剂。等渗性可使用例如蒸气压或冰冻型渗透压计来测量。张力剂可以对映体(例如l-或d-对映体)或外消旋体形式、以异构体形式(比如α或β,包括α,α;或β,β;或α,β;或β,α)、以游离酸或游离碱形式、以盐形式、以水合形式(例如一水合物)或以无水形式存在。本文使用的术语“表面活性物质”(也称为表面活性剂或去污剂或sas)是指可改变液体抗体制剂的表面张力的赋形剂。在某些实施方案中,表面活性物质降低液体抗体制剂的表面张力。在其他实施方案中,“表面活性物质”可有助于改善制剂中任何抗体的胶体稳定性或溶解性。表面活性物质可减少所生成的抗体制剂的聚集和/或使制剂中的颗粒形成最小化和/或减少吸附。表面活性物质还可在冷冻/解冻循环期间和之后以及在振荡时改善抗体的稳定性。表面活性物质可为离子的或非离子的。可包含在本发明制剂中的示例性的非离子表面活性物质包括例如烷基聚(环氧乙烷)、烷基聚葡萄糖苷(例如辛基葡萄糖苷和癸基麦芽糖苷)、脂肪醇比如鲸蜡醇和油醇、椰油酰胺mea、椰油酰胺dea和椰油酰胺tea。可包含在本发明制剂中的特定非离子表面活性物质包括例如聚山梨醇酯,比如聚山梨醇酯20(tween20)、聚山梨醇酯28、聚山梨醇酯40、聚山梨醇酯60、聚山梨醇酯65、聚山梨醇酯80(tween80)、聚山梨醇酯81和聚山梨醇酯85;泊洛沙姆比如泊洛沙姆188(kolliphorp188)、泊洛沙姆407;聚乙二醇-聚丙二醇;或聚乙二醇(peg)、乙二醇-丙二醇共聚物(例如pluronicspf68等)。本文使用的术语“冻干的”是指已经历本领域称为冷冻干燥的过程的制剂,该过程包括使制剂冷冻并随后从冷冻的内容物中去除冰。本文使用的术语“氨基酸”表示氨基酸(游离氨基酸,即不是肽或蛋白质序列中的氨基酸)。本发明使用的氨基酸包括(但不限于)例如精氨酸、甘氨酸、赖氨酸、组氨酸、谷氨酸、天冬氨酸、异亮氨酸、亮氨酸、丙氨酸、苯丙氨酸、色氨酸、丝氨酸、半胱氨酸、甲硫氨酸和脯氨酸。“药用组合物”意指包含本发明的抗体和至少一种选自药学上可接受的和药理学上相容的赋形剂、溶剂、稀释剂、载体、添加剂、分散剂、传递剂、比如防腐剂、稳定剂、乳化剂、悬浮剂、增稠剂、延长传递调节剂的组分的组合物,其选择和比率取决于给予和给药的性质和方法。示例性的悬浮剂包括乙氧基化异硬脂醇、聚氧乙烯、山梨醇和山梨醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄蓍胶及其混合物。可用多种抗细菌剂和抗真菌剂例如尼泊金类、氯丁醇、山梨酸等提供免受微生物作用的保护。组合物还可包含等渗剂,例如糖类、氯化钠等。可用延迟活性剂吸收的试剂(例如单硬脂酸铝和明胶)提供组合物的延长作用。示例性的合适的载体、溶剂、稀释剂和传递剂包括水、乙醇、多元醇及其混合物、植物油(比如橄榄油)和可注射的有机酯(比如油酸乙酯)。示例性的赋形剂包括乳糖(lactose)、乳糖(milksugar)、柠檬酸钠、碳酸钙、磷酸钙等。活性剂(单独或与另一种活性剂组合)的用于口服、舌下、透皮、肌内、静脉内、皮下、局部或直肠给予的药用组合物,可作为与常规药用载体的混合物以单位剂型给予动物和人。合适的单位剂型包括非肠道形式、植入物和透皮系统。“药物(制剂)”为以片剂、胶囊剂、粉剂、冻干物、注射剂、输注剂、软膏剂形式及其他旨在恢复、矫正或改变人类和动物的生理功能,并提供疾病治疗和预防、诊断、麻醉、避孕、美容等的成品剂型存在的物质(或药用组合物形式的物质混合物)。“治疗(treat)”、“治疗(treating)”和“治疗(treatment)”是指用于减轻或消除生物学障碍和/或至少一种其伴随症状的方法。本文使用的“减轻”疾病、障碍或病症意指降低疾病、障碍或病症症状的严重性和/或频率。另外,本文提及“治疗”包括提及治愈性、姑息性和预防性治疗。一方面,待治疗的受试者或患者为哺乳动物,优选地为人类受试者。以上受试者可为任何年龄的雄性或雌性。术语“障碍”表示可通过本发明的治疗改善的任何病症。该术语的定义包括慢性和急性障碍或疾病,包括使哺乳动物易患所述障碍的病理状况。待治疗疾病的非限制性实例包括良性和恶性肿瘤;白血病和淋巴恶性肿瘤,特别是乳腺癌、卵巢癌、胃癌、子宫内膜癌、唾液腺癌、肺癌、肾癌、结肠癌、甲状腺癌、胰腺癌、前列腺癌或膀胱癌;神经、神经胶质、星形细胞、下丘脑和其他腺体、巨噬细胞、上皮、基质和囊胚腔障碍;炎性、血管生成和免疫障碍。根据本发明待治疗的优选障碍为自身免疫性疾病。术语“免疫应答”、“自身免疫应答”、“自身免疫性炎症”是指例如淋巴细胞、抗原呈递细胞、吞噬细胞、粒细胞和由以上细胞或肝细胞产生的可溶性大分子(包括由选择性损伤、破坏或消除人体的侵入性病原体、被病原体感染的细胞或组织、癌细胞、或者在自身免疫或病理性炎症的情况下的正常人细胞或组织产生的抗体、细胞因子和补体)的作用。本文使用的术语“自身免疫性疾病”意指发生并且针对个体中的自身(自己)抗原和/或组织的非恶性疾病或障碍。该定义包括(但不限于)类风湿性关节炎、关节病、幼年型慢性关节炎、脓毒性关节炎、莱姆氏关节病、银屑病性关节炎、反应性关节炎、脊柱关节病、系统性红斑狼疮、克罗恩病、溃疡性结肠炎、炎性肠病、糖尿病、甲状腺炎、哮喘、变态反应性疾病、银屑病、特应性皮炎、硬皮病、移植物抗宿主反应、移植排斥、与移植相关的急性或慢性免疫性疾病、结节病、川崎病、格雷夫病、肾病综合征、慢性疲劳综合征、韦格纳肉芽肿、亨-舍二氏紫癜、显微镜下肾血管炎、慢性活动性肝炎、uvenita、脓毒性休克、中毒性休克综合征、脓毒性综合征、恶病质、获得性免疫缺陷综合征、急性横贯性脊髓炎、亨廷顿氏舞蹈病、帕金森病、阿尔茨海默病、中风、原发性胆汁性肝硬化、溶血性贫血、成人(急性)呼吸窘迫综合征、脱发症、局灶性脱发、血清阴性关节病、关节病、莱特尔氏病、银屑病性关节病、与溃疡性结肠炎相关的关节病、特应性变态反应、自身免疫性大疱病、寻常型天疱疮、落叶型天疱疮、类天疱疮病、线性iga、自身免疫性溶血性贫血、coombs阳性溶血性贫血、恶性贫血、幼年型恶性贫血、关节炎、原发性硬化性甲型肝炎、隐源性自身免疫性肝炎、肺纤维化病、隐源性纤维性肺泡炎、炎症后间质性肺病、间质性肺炎、慢性嗜酸性肺炎、感染后间质性肺病、痛风性关节炎、自身免疫性肝炎、1型自身免疫性肝炎(经典自身免疫性肝炎或类脂)、2型自身免疫性肝炎、骨关节炎、原发性硬化性胆管炎、1型银屑病、2型银屑病、特发性白细胞减少症、自身免疫性中性粒细胞减少症、肾脏nos疾病、肾小球肾炎、显微镜下肾血管炎、盘状红斑狼疮、特发性或男性nos-生育力、[精子自身免疫性]、所有亚型的多发性硬化、交感性眼炎、与结缔组织病相关的继发性肺动脉高压、古德帕斯彻综合征、结节性多动脉炎的肺部表现、急性风湿热、类风湿性脊椎炎、强直性脊柱炎、斯提耳氏病、系统性硬化、斯耶格伦氏综合征、高安氏病、自身免疫性血小板减少症、原发性血小板增多症、自身免疫性甲状腺炎、甲状腺功能亢进、桥本氏病、自身免疫性萎缩性甲状腺功能减退、原发性粘液性水肿、晶状体源性葡萄膜炎、原发性血管炎、白癜风、急性肝病、慢性肝病、变态反应、哮喘、精神障碍(包括抑郁综合征和精神分裂症)、th2型和th1型介导的疾病、结膜炎、变应性接触性皮炎、变应性鼻炎、α-i抗胰蛋白酶缺乏症、肌萎缩性侧索硬化症、贫血、囊性纤维化、与细胞因子治疗相关的疾病、脱髓鞘病、皮炎、虹膜睫状体炎/葡萄膜炎/眼科神经炎、缺血再灌注损伤、缺血性中风、幼年型类风湿性关节炎、自身免疫性肠病、自身免疫性听力丧失、自身免疫性淋巴增生综合征、自身免疫性心肌炎、自身免疫性卵巢早衰和睑缘炎。抗体还可治疗以上列出的障碍的任何组合。本文使用的术语“其中tnfα活性有害的障碍”包括疾病和其他障碍,其中患有障碍的受试者中tnfα的存在已经显示或怀疑是造成障碍的病理生理学的原因或有助于障碍恶化的因素。因此,其中tnfα活性有害的障碍为预计抑制tnfα活性可减轻障碍的症状和/或进展的障碍。例如,可通过患有障碍的受试者的生物流体中的tnfα的浓度的增加(例如受试者的血清、血浆、滑液等中的tnfα的浓度的增加)来检测这种障碍,所述增加可例如使用如上所述的抗tnfα抗体检测。存在许多其中tnfα活性有害的障碍的实例。以下进一步讨论适合于障碍的抗体和抗体片段在特定障碍治疗中的用途:a.脓毒症肿瘤坏死因子在脓毒症的病理生理学中起着确定的作用,其生物学效应包括低血压、心肌抑制、血管渗漏综合征、器官坏死、刺激毒性二级介质释放和激活凝血级联(参见例如moellera.,etal.(1990),cytokine2:162-169;u.s.patentno.5231024moelleretat.;europeanpatentno.260610b1moellera.;traceyk.j.和ceramia.(1994)annu.rev.med.45:491-503;russeld.和thompsonr.c.(1993)curr.opin.biotech.4:714-721)。相应地,本发明的人抗体和抗体片段可用于治疗以其任何临床表现存在的脓毒症,包括脓毒性休克、内毒素性休克、由革兰氏阴性细菌引起的脓毒症和中毒性休克综合征。此外,对于脓毒症治疗,本发明的抗tnfα抗体和抗体片段可与一种或多种可进一步减轻脓毒症的治疗剂共同给予,比如白细胞介素-1抑制剂(描述于pct公开号wo92/16221和wo92/17583)、细胞因子白细胞介素-6(参见例如pct公开号wo93/11793)或血小板活化因子拮抗剂(参见例如欧洲专利申请号ep374510)。用于脓毒症治疗的其他联合治疗方法在以下第iii小节中讨论。另外,在一个优选的实施方案中,将本发明的抗tnfα抗体和抗体片段给予来自在治疗期间血清或血浆il-6浓度高于500pg/ml和更优选地1000pg/ml的脓毒症患者亚组的人(参见pct公开号wo95/20978daum,l.,etal.)。b.自身免疫性疾病已显示肿瘤坏死因子在多种自身免疫性疾病的病理生理学中起作用。例如,tnfα也参与激活组织炎症并引起类风湿性关节炎的关节破坏(参见例如moellera.etal.(1990),cytokine2:162-169;美国专利号5231024moelleretal.;欧洲专利号260610b1moellera.;traceyk.j.和ceramia.,同上;endw.p.和dayerj.m.(1995)ath.rheum.38:151-160;favar.a.etal.(1993)clin.exp.immunol.94:261-266)。tnfα还参与促进胰岛细胞的死亡和糖尿病中胰岛素抵抗的形成(参见例如tracey和cerami,同上;pctpublicationno.wo94/08609)。tnfα还参与少突胶质细胞的细胞毒性形成和多发性硬化的炎性斑块的诱导(参见例如tracey和cerami,同上)。嵌合和人源化鼠抗htnfα抗体已临床测试用于治疗类风湿性关节炎(参见例如elliotm.j.etal.(1994);lancet344:1125-1127;elliotm.j.etal.(1994)lancet344:1105-1110;rankine.c.etal.(1995)br.j.rheumatol.34:334-342)。本发明的人抗体和抗体片段可用于治疗自身免疫性疾病,特别是与炎症相关的那些疾病,包括类风湿性关节炎、类风湿性脊椎炎、骨关节炎和痛风性关节炎、变态反应、多发性硬化、自身免疫性糖尿病、自身免疫性葡萄膜炎和肾综合征。一般地,抗体或抗体片段全身给予,尽管对于某些障碍,在炎症部位局部给予抗体或抗体片段可能是有益的(例如在类风湿性关节炎中局部给予关节或局部给予糖尿病性溃疡,单独或与pct公开号wo93/19751中所述的环己烷-亚基衍生物组合)。本发明的抗体和抗体片段还可与一种或多种用于治疗自身免疫性疾病的另外治疗剂一起使用,如第iii小节进一步描述的那样。c.感染性疾病肿瘤坏死因子参与在多种感染性疾病中观察到的生物学效应的产生。例如,tnfα参与疟疾中脑炎症和毛细血管血栓形成和梗塞的发展。tnfα还参与脑炎症的发展、诱导血脑屏障破裂、脓毒性休克综合征的发展以及脑膜炎中的静脉梗塞的激活。tnfα还参与诱导恶病质、刺激病毒增殖和获得性免疫缺陷综合征(aids)中的中枢神经系统损伤的形成。相应地,本发明的抗体和抗体片段可用于治疗感染性疾病,包括细菌性脑膜炎(参见例如欧洲专利申请号ep585705)、脑型疟疾、aids和aids相关复合物(αc)(参见例如欧洲专利申请号ep230574)以及继发于移植的巨细胞病毒感染(参见例如fietze,e.,etal.(1994)transplantation58:675-680)。本发明的抗体和抗体片段还可用于减轻与感染性疾病相关的症状,包括由于感染(比如流感)引起的发热和肌痛以及继发于感染(例如继发于aids或αc)的恶病质。d.移植肿瘤坏死因子被认为是同种异体移植排斥和移植物抗宿主病(gvhd)以及当使用针对t细胞受体cd3复合物的大鼠抗体okt3抑制肾移植的排斥时观察到的不良反应形成中的关键介质(参见例如easonj.d.etal.(1995)transplantation59:300-305;suthanthiranm.和stromt.в.(1994)newengl.j.med.331:365-375)。相应地,本发明的抗体和抗体片段可用于抑制移植排斥(包括同种异体移植和异种移植排斥)和抑制gvhd。尽管抗体或抗体片段可单独使用,但更优选地,它们与一种或多种抑制针对同种异体移植的免疫应答或抑制gvhd的其他试剂组合使用。例如,在一个实施方案中,本发明的抗体或抗体片段与一种或多种针对参与免疫应答调节的其他靶标(比如细胞表面分子cd25(白细胞介素-2受体-β)、cd11a(lfa-1)、cd54(icam-1)、cd4、cd45、cd28/ctla4、cd80(в7-1)和/或cd86(b7-2))的抗体组合使用。在仍然另一个实施方案中,本发明的抗体或抗体片段与一种或多种一般免疫抑制剂(比如环孢菌素a或fk506)组合使用。e.恶性肿瘤肿瘤坏死因子参与诱导恶病质、刺激肿瘤生长、增强转移潜能和恶性肿瘤中细胞毒性的发展。相应地,本发明的抗体和抗体片段用于治疗恶性肿瘤、抑制肿瘤生长或转移和/或减轻继发于恶性肿瘤的恶病质。抗体或抗体片段可全身或局部给予肿瘤部位。f.肺部障碍肿瘤坏死因子参与成人呼吸窘迫综合征(αds)的病理生理学,包括刺激内皮白细胞激活、指导对肺细胞的细胞毒性和诱导血管渗漏综合征。相应地,本发明的抗体和抗体片段可用于治疗各种肺部障碍,包括成人呼吸窘迫综合征(参见例如pct公开号wo91/04054)、休克肺、慢性肺部炎性疾病、肺结节病、肺纤维化和矽肺病。本发明的抗体和抗体片段可与一种或多种用于治疗肺部障碍的另外的治疗剂一起给予,如以下第iii小节所述。g.肠道障碍肿瘤坏死因子参与炎性肠病的病理生理学(参见例如tracyk.j.,etal.(1986)science234:470-474;sunx-m.,etal.(1988)j.clin.invest.81:1328-1331;macdonaldt.t.,etal.(1990)clin.exp.immunol.81:301-305)。已临床测试了嵌合鼠抗tnfα抗体用于治疗克罗恩病(vandullemenh.m.etal.(1995)gastroenterology109:129-135)。本发明的人抗体或抗体片段还可用于治疗肠道障碍,比如特发性炎性肠病,其包括两种综合征(克罗恩病和溃疡性结肠炎)。本发明的抗体和抗体片段还可与一种或多种用于治疗肠道障碍的另外的治疗剂一起给予,如以下第iii小节所述。h.心脏障碍本发明的抗体或抗体片段还可用于治疗各种心脏障碍,包括心脏缺血(参见例如欧洲专利申请号ep453898)和心力衰竭(心肌无力)(参见例如pct公开号wo94/20139)。i.其他本发明的抗体或抗体片段也可用于治疗其中tnfα活性有害的各种障碍。其中tnfα活性参与病理生理学并且因此可使用本发明的抗体或抗体片段治疗的其他疾病和障碍的实例包括炎性骨病和骨重吸收疾病(参见例如bertolinid.r.,etal.(1986)nature319:516-518;koniga.,etal.(1988)j.boneminer.res.3:621-627;lerneru.h.和ohiina.(1993)j.boneminer.res.8:147-155;和shankag.和sternp.h.(1993)bone14:871-876)、肝炎(包括酒精性肝炎)(参见例如mcclainc.j.和cohend.a.(1989)hepatology9:349-351;felverm.e.etal.(1990)alcoholclin.exp.res.14:255-259;和hansenj.etal.(1994)hepatology20:461-474)、病毒性肝炎(sheronn.etal.(1991)j.hepatol.12:241-245;和hussainm.j.etal.(1994)j.clin.pathol.47:1112-1115)和暴发性肝炎;凝血障碍(参见例如vanderpollт.etal.(1990)n.engl.j.med.322:1622-1627;vanderpollт.etal.(1991)prog.clin.biol.res.367:55-60;烧伤(参见例如giroirb.p.etal.(1994)am.j.physiol.267:h118-124;liux.s.etal.(1994)burns20:40-44)、再灌注损伤(参见例如scalesw.e.etal.(1994)am.j.physiol.26:1122-1127;serrickс.etal.(1994)transplantation58:1158-1162;yaoy.m.etal.(1995)resuscitation29:157-168)、瘢痕疙瘩形成(参见例如mccauleyr.letal.(1992)j.clin.immunol.12:300-308)、瘢痕组织形成;过热;牙周病;肥胖和辐射毒性。“治疗有效量”认为是在治疗期间给予的治疗剂的量,其将在一定程度上缓解所治疗疾病的一种或多种症状。术语“慢性”给予是指与急性(短期)给予方式相反的药剂的连续(长期)给予,以便在一段延长的时间内保持初始治疗效果(活性)。“间歇性”给予是指不是未间断地连续进行的治疗,而是本质上是循环的。在本说明书和随后的权利要求中,除非上下文另外要求,否则词语“具有”、“包括”和“包含”或其变体,比如“具有(has)”、“具有(having)”、“包括(includes)”、“包括(including)”、“包含(comprises)”或“包含(comprising)”应理解为包括所述整数或整数组,但不排除任何其他整数或整数组。发明详述水性组合物本发明涉及新的改进的水性组合物,其可任选地冻干,包含在合适的缓冲液、一种或多种合适的稳定剂和选自合适的表面活性物质和等渗剂的其他赋形剂中的适当量的重组单克隆抗tnfα抗体。所述组合物防止蛋白质(抗体)聚集体的形成,并将治疗化合物的功效和稳定性保持期望的时间段。阿达木单抗和英夫利昔单抗为重组单克隆抗tnfα抗体的实例。英夫利昔单抗为嵌合抗体的一个实例。阿达木单抗为人抗体的一个实例。在一个优选的实施方案中,组合物中使用的抗体为人抗体。在一个更优选的实施方案中,组合物中使用的抗体为人类抗人tnfα抗体。在仍然另一个实施方案中,组合物包含d2e7和d2e7与其他抗体的组合。d2e7抗体,一般地称为阿达木单抗,具有与tnfα结合的高亲和力、低解离动力学和高中和能力。阿达木单抗可以商标在医药市场上获得。整个本说明书中使用的名称阿达木单抗和d2e7代表相同的人单克隆抗体。在一个优选的实施方案中,单克隆抗体为阿达木单抗或其抗原结合部分。在一些实施方案中,重组单克隆抗tnfα抗体或其抗原结合部分通常以至多200mg/ml的治疗量存在。在一个优选的实施方案中,治疗量为约1mg/ml-约150mg/ml。在一个更优选的实施方案中,治疗量为约1mg/ml-约100mg/ml。在一个更优选的实施方案中,治疗量为约50mg/ml-约100mg/ml。在一个甚至更优选的实施方案中,治疗量为约100mg/ml。所讨论的水性组合物包含合适的缓冲溶液与其他稳定药用制剂的药学上可接受的赋形剂的组合。可使用的合适的缓冲溶液选自本领域已知的组,并且可在文献中找到。在一个实施方案中,合适的缓冲溶液包含(但不限于)基于乙酸根离子的缓冲剂(或缓冲系统)。在一个优选的实施方案中,合适的缓冲剂包含乙酸盐缓冲剂。在一个甚至更优选的实施方案中,乙酸盐缓冲剂选自乙酸钠三水合物与乙酸的组合。缓冲溶液通常以约1mm-约100mm的浓度使用。在一个优选的实施方案中,缓冲剂浓度为约1mm-约50mm。在一个更优选的实施方案中,缓冲剂浓度为约1mm-约20mm。在一个甚至更优选的实施方案中,缓冲剂浓度为约5mm。在一些实施方案中,乙酸钠三水合物以至多1.2mg/ml的量存在。在一个优选的实施方案中,乙酸钠三水合物的量为约0.4mg/ml-约1.2mg/ml。在一个更优选的实施方案中,乙酸钠三水合物的量为约0.4mg/ml-约0.5mg/ml。在一个更优选的实施方案中,乙酸钠三水合物的量为0.436mg/ml。在一个实施方案中,液体组合物将ph保持在4.0-约7.0的范围内,这取决于所使用的单克隆抗体。在一个优选的实施方案中,所使用的缓冲剂将组合物的ph保持在约4.5-6.0的范围内。在一个更优选的实施方案中,ph保持在约5.0-6.0。在一个更优选的实施方案中,ph保持在约5.5。所述水性组合物包含合适的表面活性物质,其为药学上可接受的赋形剂,用于保护蛋白质组合物免受各种应激效应,比如搅拌、剪切、高温、冷冻等。合适的表面活性物质包括(但不限于)聚山梨醇酯或泊洛沙姆或者聚山梨醇酯和泊洛沙姆的组合。在一个优选的实施方案中,合适的表面活性物质为聚山梨醇酯。在一个优选的实施方案中,合适的表面活性物质为泊洛沙姆。在一个优选的实施方案中,合适的表面活性物质为聚山梨醇酯和泊洛沙姆的组合。在一个更优选的实施方案中,聚山梨醇酯为聚山梨醇酯20或聚山梨醇酯80(也以商标20或80分销)。在一个更优选的实施方案中,泊洛沙姆为泊洛沙姆188(也以商标kolliphor分销)。在另一个优选的实施方案中,合适的表面活性物质为聚山梨醇酯20/聚山梨醇酯80和泊洛沙姆188的组合。在一些实施方案中,聚山梨醇酯20以至多10mg/ml的量存在。在一个优选的实施方案中,聚山梨醇酯20的量为约0.05mg/ml-约10mg/ml。在一个更优选的实施方案中,聚山梨醇酯20的量为约0.1mg/ml-约1mg/ml。在一个更优选的实施方案中,聚山梨醇酯20的量为约0.5mg/ml。在一些实施方案中,聚山梨醇酯80以至多10mg/ml的量存在。在一个优选的实施方案中,聚山梨醇酯80的量为约0.05mg/ml-约10mg/ml。在一个更优选的实施方案中,聚山梨醇酯80的量为约0.1mg/ml-约1mg/ml。在一个更优选的实施方案中,聚山梨醇酯80的量为约0.5mg/ml。在一些实施方案中,泊洛沙姆188以至多10mg/ml的量存在。在一个优选的实施方案中,泊洛沙姆188的量为约0.05mg/ml-约10mg/ml。在一个更优选的实施方案中,泊洛沙姆188的量为约0.1mg/ml-约1mg/ml。在一个更优选的实施方案中,泊洛沙姆188的量为约0.5mg/ml。在一些实施方案中,聚山梨醇酯20/聚山梨醇酯80和泊洛沙姆188的组合为以至多10mg/ml的量存在的聚山梨醇酯80和以至多10mg/ml的量存在的泊洛沙姆188。在一个优选的实施方案中,泊洛沙姆188的量为约0.05mg/ml-约10mg/ml和聚山梨醇酯20/聚山梨醇酯80的量为约0.05mg/ml-约10mg/ml。在一个更优选的实施方案中,泊洛沙姆188的量为约0.1mg/ml-约1mg/ml和聚山梨醇酯20/聚山梨醇酯80的量为约0.1mg/ml-约1mg/ml。在一个更优选的实施方案中,聚山梨醇酯20/聚山梨醇酯80的量为约0.5mg/ml和泊洛沙姆188的量为约1.0mg/ml。水性组合物包含一种或多种合适的稳定剂,其为药学上可接受的赋形剂,并且在制造、储存和使用期间保护药用活性成分免受化学和/或物理降解。在一个实施方案中,稳定剂包括(但不限于)氨基酸、寡糖或其合适的衍生物或混合物。在另一个优选的实施方案中,合适的稳定剂为海藻糖。在另一个优选的实施方案中,合适的稳定剂为脯氨酸。在另一个优选的实施方案中,合适的稳定剂为海藻糖和脯氨酸的组合。在另一个优选的实施方案中,合适的稳定剂为海藻糖和精氨酸的组合。在另一个实施方案中,也可用作稳定剂的寡糖包括海藻糖。在一些实施方案中,海藻糖以至多150mg/ml的量存在。在一个优选的实施方案中,海藻糖的量为约25mg/ml-约150mg/ml。在一个更优选的实施方案中,海藻糖的量为约50mg/ml-约100mg/ml。在一个更优选的实施方案中,海藻糖二水合物的量为约80mg/ml。在另一个实施方案中,选择海藻糖和精氨酸的组合作为稳定剂。在一些实施方案中,海藻糖以至多150mg/ml的量存在,和精氨酸以至多1.0mg/ml的量存在。在一个优选的实施方案中,海藻糖的量为约25mg/ml-约150mg/ml,和精氨酸的量为0.05-1.0mg/ml。在一个更优选的实施方案中,海藻糖的量为约50mg/ml-约100mg/ml,和精氨酸的量为0.05-0.2mg/ml。在一个更优选的实施方案中,海藻糖二水合物的量为约80mg/ml,和精氨酸盐酸盐的量为约0.1mg/ml。在另一个这种实施方案中,可用作稳定剂的氨基酸为脯氨酸。在一些实施方案中,脯氨酸以至多40mg/ml的量存在。在一个优选的实施方案中,脯氨酸的量为约5mg/ml-约40mg/ml。在一个更优选的实施方案中,脯氨酸的量为约20mg/ml-约35mg/ml。在一个更优选的实施方案中,脯氨酸的量为约27mg/ml。在一些实施方案中,海藻糖和脯氨酸的组合为以至多150mg/ml的量存在的海藻糖和以至多40mg/ml的量存在的脯氨酸。在一个优选的实施方案中,海藻糖的量为约25mg/ml-约150mg/ml,和脯氨酸的量为约5mg/ml-约40mg/ml。在一个更优选的实施方案中,海藻糖的量为约20mg/ml-约50mg/ml,和脯氨酸的量为约10mg/ml-约20mg/ml。在一个更优选的实施方案中,海藻糖二水合物的量为约40mg/ml,和脯氨酸的量为约13.5mg/ml。在一些实施方案中,水性组合物包含50-200mg/ml的重组单克隆抗tnfα抗体、0.4-1.2mg/ml的乙酸钠三水合物、25-150mg/ml的海藻糖和/或5-40mg/ml的脯氨酸或25-150mg/ml的海藻糖和0.05-0.5mg/ml的精氨酸、冰乙酸(至ph5.0-6.0)、0.1mg/ml-1mg/ml的聚山梨醇酯20。在水性组合物的一个优选实施方案中,重组单克隆抗tnfα抗体为阿达木单抗。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯20。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、0.1mg/ml的精氨酸盐酸盐、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯20。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、27mg/ml的脯氨酸、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯20。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、40mg/ml的海藻糖二水合物、13.5mg/ml的脯氨酸、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯20。在一些实施方案中,水性组合物包含50-200mg/ml的重组单克隆抗tnfα抗体、0.4-1.2mg/ml的乙酸钠三水合物、25-150mg/ml的海藻糖和/或5-40mg/ml的脯氨酸或25-150mg/ml海藻糖和0.05-0.5mg/ml的精氨酸、冰乙酸(直至ph5.0-6.0)、0.1mg/ml-1mg/ml的聚山梨醇酯80。在水性组合物的一个优选实施方案中,重组单克隆抗tnfα抗体为阿达木单抗。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯80。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、0.1mg/ml的精氨酸盐酸盐、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯80。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、27mg/ml的脯氨酸、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯80。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、40mg/ml的海藻糖二水合物、13.5mg/ml的脯氨酸、冰乙酸(直至ph5.5)、0.5mg/ml的聚山梨醇酯80。在一些实施方案中,水性组合物包含50-200mg/ml的重组单克隆抗tnfα抗体、0.4-1.2mg/ml的乙酸钠三水合物、25-150mg/ml的海藻糖和/或5-40mg/ml的脯氨酸或25-150mg/ml海藻糖和0.05-0.5mg/ml的精氨酸、冰乙酸(直至ph5.0-6.0)、0.1mg/ml-1mg/ml的泊洛沙姆188。在一个优选的实施方案中,重组单克隆抗tnfα抗体为阿达木单抗。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、冰乙酸(直至ph5.5)、1mg/ml的泊洛沙姆188。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、80mg/ml的海藻糖二水合物、0.1mg/ml的精氨酸盐酸盐、冰乙酸(直至ph5.5)、1mg/ml的泊洛沙姆188。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗、0.436mg/ml的乙酸钠三水合物、27mg/ml的脯氨酸、冰乙酸(直至ph5.5)、1.0mg/ml的泊洛沙姆188。在一个更优选的实施方案中,组合物包含50-150mg/ml的阿达木单抗,0.436mg/ml的乙酸钠三水合物、40mgml的海藻糖二水合物、13.5mg/ml的脯氨酸、冰乙酸(直至ph5.5)、1.0mg/ml的泊洛沙姆188。进一步地,所述组合物可另外包含一种或多种本领域技术人员熟知的其他合适的赋形剂。以上组合物适合于静脉内、皮下或肌内给予。在一些实施方案中,液体组合物保持储存稳定性至以下效果:与零时的稳定性测量相比较,没有进一步的蛋白质聚集过程或修饰。水性组合物的治疗和使用方法在另一个实施方案中,本发明涉及用于治疗哺乳动物的方法,方法包括给予哺乳动物治疗有效量的本发明的药用组合物,其中哺乳动物可患有可用阿达木单抗有效治疗的疾病或障碍。在一个优选的实施方案中,哺乳动物为人。可用所提供的组合物治疗的疾病或障碍包括(作为非限制性实例)活动性(中度至重度)类风湿性关节炎、活动性银屑病性关节炎、活动性强直性脊柱炎、慢性(中度至重度)斑块型银屑病、(中度至重度)溃疡性结肠炎、中轴型脊柱关节炎、活动性化脓性汗腺炎、幼年型特发性关节炎、(中度或重度)克罗恩病、葡萄膜炎、活动性附着点炎相关性关节炎。可用本发明的组合物治疗的另外的疾病或障碍包括美国专利第6090382和8216583号中描述的那些,其相关部分通过参考结合至本文中。所提供的药用组合物可通过全身注射,例如通过静脉内或皮下,或通过肌内注射;或通过注射或应用于相关部位,例如通过在手术期间暴露部位时直接注射或直接应用于部位;或通过局部应用,给予需要治疗的受试者。在一个实施方案中,本发明涉及用于治疗和/或预防类风湿性关节炎的方法,方法包括给予需要它的哺乳动物治疗有效量的一种所提供的阿达木单抗组合物。所提供的组合物中的阿达木单抗的治疗有效量取决于待治疗的病症、病症的严重性、之前治疗和患者的病史以及对治疗剂的反应。可根据主治医师的判断调整合适的剂量,使得可以一次或经多次给予将其给予患者。在一个实施方案中,每个成人剂量的阿达木单抗的有效量为约1-500mg/m2、或约1-200mg/m2、或约1-40mg/m2、或约5-25mg/m2。或者,可给予固定剂量,其量可在2-500mg/剂、2-100mg/剂或约10-80mg/剂的范围内。如果剂量给予超过每周一次,则示例性的剂量范围与上述剂量范围相同或更低,并且优选地以25-100mg/剂的剂量范围给予每周两次或更多次。在另一个实施方案中,通过注射给予的可接受的剂量包含80-100mg/剂或者每剂包含80mg。剂量可每周一次、两周一次或分开几周(例如从2到8)给予。在一个实施方案中,通过单次皮下(sc)注射以40mg的剂量给予阿达木单抗。在一些情况下,通过每周1-3次给予至多约100mg药用组合物的剂量至少3周的时间段,可实现患者病症的改善。为了达到期望的改善水平,可能需要治疗更长时间段。对于无法治愈的慢性病症,治疗方案可无限期地继续进行。对于儿科患者(年龄4-17岁),合适的治疗方案可包括每周一次或多次给予0.4mg/kg-4mg/kg阿达木单抗的剂量。在另一个实施方案中,本发明的药用制剂可以本体制剂制备,并且因此,药用组合物的组分以高于给予所需的量存在,并在给予之前适当稀释。药用组合物可作为单一治疗剂或根据需要与另外的治疗剂组合给予。因此,在一个实施方案中,所提供的用于治疗和/或预防的方法与给予治疗有效量的另一种活性剂组合使用。可在给予本发明的药用组合物之前、期间或之后给予其他活性剂。其他活性剂可作为所提供的组合物的一部分,或者作为单独的制剂给予。所提供的药用组合物的给予可以各种方式进行,包括非肠道、口服、含服、鼻、直肠、腹膜内、皮内、透皮、皮下、静脉内、动脉内、心内、心室内、颅内、气管内、鞘内、肌内注射、玻璃体内注射和局部应用。本发明的药用组合物特别可用于非肠道给予,即皮下、肌内、静脉内、腹膜内、髓内、关节内、滑膜内和/或鞘内。非肠道给予可通过推注或连续输注进行。用于注射的药用组合物可以单位剂型存在,例如(但不限于)安瓿、小瓶、预填充注射器或含有添加的防腐剂的多剂量容器。另外,已开发了许多新近的药物传递方法,并且本发明的药用组合物适合于通过这些新方法给予,例如inject-注射器比如和无针装置比如和本发明的药用组合物还可适用于尚未发现的给予方式。还参见langer,1990,science,249:1527-1533。所提供的药用组合物也可配制成储库制剂。这种长效制剂可通过植入(例如皮下或肌内)或通过肌内注射给予。因此,例如,制剂可使用合适的聚合或疏水材料(例如作为可接受的油中的乳液)或离子交换树脂,或作为微溶性衍生物(例如作为微溶性盐)来改性。如果需要,药用组合物可以小瓶、包装或分配器装置提供,其可含有一个或多个包含活性成分的单位剂型。在一个实施方案中,分配器装置可包括注射器,注射器包含单一剂量的即用型注射液体制剂。注射器可附有给予说明。在另一个实施方案中,本发明提供含有本发明的水性药用组合物的试剂盒或容器。水性药用组合物中的多肽浓度可在宽的范围内变化,但通常在约1-约200mg/ml水性制剂的范围内。试剂盒还可附有使用说明。产生方法用于产生以上组合物的方法包括向水相中加入乙酸盐缓冲剂,随后以任何顺序加入以下组分:选自海藻糖、脯氨酸或其组合的渗透剂和/或稳定剂;重组单克隆抗tnfα抗体;选自聚山梨醇酯20、聚山梨醇酯80、泊洛沙姆188或其组合的表面活性物质。技术1.测试样品中的蛋白质浓度测定在uv分光光度法板中使用uv分光光度法在280nm波长处测定蛋白质浓度。用合适的空白对照剂溶液稀释每个样品至~0.5mg/ml的浓度。将150μl稀释的样品置于uv分光光度法板的孔中。使用读板器在280nm波长处测量板溶液的光密度。使用合适的空白对照剂溶液作为参考溶液。通过下式计算以mg/ml为单位的蛋白质浓度(c):а280为280nm波长处的光密度值;ε为研究蛋白的消光值;b为样品的总稀释比率;l为每个板孔的层厚度,对于150μl,l=0.42cm。2.缓冲液更换和样品浓度在压力下在stirredcell(millipore)浓缩池中进行样品的渗滤和浓缩。3.“peg聚集”peg6000溶液的制备制备在研究添加剂制剂中质量浓度为20-25%的peg6000溶液。将生成的溶液通过0.45μmdurapore过滤器过滤。将计算量的样品、添加剂溶液和20-25%peg6000溶液转移至96孔uv分光光度法板中,使得每孔的peg6000浓度为0-18%,并且每孔的蛋白质浓度为1mg/ml。将所有生成的孔中溶液通过吸液充分混合。接下来,目测评价溶液的浊度程度,并在400nm波长处测量溶液的光密度。样品越不稳定,越低的peg6000浓度将形成可见的聚集体(乳色)。还在溶液制备之后一天或多天后评估溶液的浊度程度。4.使用动态光散射(dls)技术测定蛋白质均匀性和聚集点在尺寸测量模式下于zetasizernanozsp上进行研究样品均匀性测定。为此目的,将0.05ml溶液置于无尘的一次性塑料比色皿中。·分析模型:蛋白质分析。·测量之前保持温度30秒。·在每个点,以3次重复进行平均13次测量。在zetasizernanozsp上进行研究蛋白质聚集点的测定。为此目的,将溶液置于石英无尘比色皿中,在仪器中逐渐加热,同时以温度趋势测量模式连续测量散射光的强度。·分析模型:蛋白质分析。·温度趋势,mod:蛋白质聚集点。以1.5℃的步距从50℃加热到85℃。·测量之前保持温度30秒。·在每个点,以1次重复进行平均15次测量。使用仪器软件绘制温度趋势,其自动计算蛋白质聚集点(聚集点)。5.通过“热应激50℃”技术测定热稳定性将测试样品分成2份并置于单独的管中:将1管每种制剂储存于+4℃的冰箱中,其余部分置于温育箱中并在50℃下温育指定的时间。在完成加热期后,从温育箱中取出管,在室温下静置约15分钟,并根据说明书进行分析。6.通过“振荡测试”技术测定胶体稳定性将测试样品分成2份,每份200μl,并置于玻璃小瓶中,将1小瓶每种制剂储存于+4℃的冰箱中,其余部分置于热振荡器中,并在2-8℃下以800rpm振荡指定的时间。在完成应激时,从热振荡器中取出管,并根据说明书进行分析。7.通过低温浓缩技术测定胶体稳定性将测试样品分成2份并置于聚合物管中:将1管每种制剂储存于+4℃的冰箱中,其余部分置于冷冻室中并在-16℃至20℃下储存指定的时间。在完成应激时,从冷冻室中取出管,在室温下静置直至内容物完全解冻,使用vortex将溶液混合并根据说明书进行分析。8.通过尺寸排阻高效液相色谱(se-hplc)技术测定样品纯度柱:tosohtsk-gelg3000swxl7.8mmid×30cm,cat.#08541。柱温:25℃。流动相流速:0.7ml/min。注射体积:20μl。样品浓度:5mg/ml。检测器波长:220nm。洗脱时间:23分钟。流动相:无水磷酸氢二钠:7.1mg/ml。氯化钠:17.54mg/ml。用正磷酸将流动相的ph调节至7.0。9.使用caliperlabchipgxii仪器测定样品酸碱分布9.1.样品制备将样品稀释至1mg/ml的浓度。将2μl的5mg/ml羧肽酶b(cpb)溶液加入到200μl生成的溶液中。将其搅拌并在37℃下温育2小时。将测试样品在amiconultra离心管中针对3次换水进行透析并浓缩至2mg/ml。9.2.工作溶液制备使用htproteinchargevariant标记试剂盒,根据制造商的程序制备工作溶液和具有测定样品的板。9.3.芯片制备使用来自proteinchargevariant缓冲液试剂盒的缓冲溶液,根据制造商的程序制备具有缓冲液的芯片和管。测定开始为标准操作。proteinchargevariant68s测定。10.使用caliperlabchipgxii仪器在还原和非还原条件下测定样品纯度10.1.测定样品制备在还原条件下补充有用于缓冲液的24.5μl1mdtt和在非还原条件下补充有用于缓冲液的24.5μl1miam的700μlht蛋白质表达样品缓冲液用于制备变性和还原溶液。将样品稀释至2mg/ml的浓度。为每个样品准备两个微管-向一个加入35μl变性缓冲液,向另一个加入35μl还原缓冲液。使样品在100℃下变性5分钟。涡旋管,然后向每个管中加入70μl水并混合。将44μl每种样品转移至96孔板中进行分析。10.2.工作溶液制备和芯片加载使用htproteinexpressreagent试剂盒,根据标准程序进行工作溶液和芯片制备。测定开始为标准操作。htproteinexpress200测定。11.使用离子交换(ie)hplc测定样品酸碱分布12.在还原和非还原条件下通过聚丙烯酰胺凝胶电泳(page)测定纯度pag在存在十二烷基硫酸钠的情况下于玻璃板中制备,其由4%page的浓缩层和对于还原条件为12.5%pag、对于非还原条件为8%pag的分离层组成。根据垂直电泳装置的操作手册组装和安装电泳室。通过用纯净水稀释样品至最终浓度为1mg/ml来制备样本。取出相当于40μg的体积,并将制备的测试样品的样本以3:1(v/v)的比率与含有2-巯基乙醇(还原条件)和不含2-巯基乙醇(非还原条件)的样品施加缓冲溶液混合,混合。将生成的溶液在(99±1)℃的温度下温育3分钟(含有2-巯基乙醇的样品)和在(99±1)℃的温度下温育1分钟(不含2-巯基乙醇的样品)。使溶液冷却至室温,混合并转移至运行缓冲溶液层下的pag孔中。使用水冷却系统以直流电模式运行电泳。电源参数设定如下:当染料前沿通过积层凝胶时,电压为110v。一旦染料前沿进入下部运行凝胶5-7mm,电压增加到180v。当染料前沿达到凝胶的下限时,关闭电源。一旦电泳结束,使凝胶与玻璃分离,并用固定液将蛋白质在室温下固定16-18小时。进一步地,将凝胶染色(在酸性蓝83溶液中)并洗涤直至条带的清晰视图。扫描凝胶。使用gelpro软件评估测试样品中的纯度和杂质。13.比活性测定通过特异性结合和中和tnfα的能力来评价样品比活性,该能力进而具有细胞毒性作用并导致wehi-13var培养物(纤维肉瘤,小家鼠)的死亡,wehi-13var培养物是一种在存在放线菌素d的情况下对tnfα的敏感性增加的培养物的变体。使用tecanevo200机器人工作站进行样品制备,rpmi1640、2mmgln、10%fbs、2.5μg/ml放线菌素d、5μg/ml庆大霉素用作qm(定量培养基)。将测试抗体样品用不超过20个稀释步骤稀释至50μg/ml并置于机器人工作站中。使用tecanevo200,在培养板中制备3种独立的rs和is稀释液,其范围为10000-0.5ng/ml,将500pg/ml的tnfα溶液加入到制备的稀释液中。搅拌生成的混合物并在室温下温育1小时。温育之后,加入(0.5±0.1)×106个细胞/ml的wehi-13var细胞悬浮液。将板置于co2温育箱中,并在(37±1)℃的温度下和5%co2的加湿空气中温育20-24小时。在温育期结束时,将活体染料阿尔玛蓝加入到培养板中,并将板在相同条件下温育直至显色。使用infinitem200pro读取装置在544/590nm的激发/发射波长下评估荧光强度。使用magellan7.2软件绘制荧光强度对蛋白质浓度曲线,评估生成的曲线的平行排列。测试样品的相对比活性作为参考样品ed50与测试样品ed50的比率确定,表示为百分比。提供以下实施例是为了最好地理解本发明。提供这些实施例仅用于说明目的,并且不应解释为以任何方式限制本发明的范围。本说明书中引用的所有出版物、专利和专利申请均通过参考包括在本文中。尽管为了清楚起见已通过说明和实施例较为详细地描述了以上发明,但是如本领域的技术人员基于本文公开的讲授将意识到的那样,可在不背离本发明所附实施方案的精神和范围的情况下进行某些变化和修改。实施例实施例1.缓冲溶液性质选择。研究制剂选择4种缓冲溶液用于该研究,并将初始humira制剂(对于蛋白质含量为50mg/ml和100mg/ml的制剂)用作对照。1.1.通过peg聚集测定胶体稳定性。对于每个样品,一式三份进行“peg聚集”测试。根据程序3进行分析。有关溶液平均光密度的数据如表1所示。结果也如图1所示。表1.制备之后溶液的平均光密度存在可见聚集。1.2.使用动态光散射(dls)技术通过蛋白质聚集点测定热稳定性。根据程序4进行分析。结果如表2和图4-8所示。1.3.使用热应激50℃方法测定长期暴露下的热稳定性。根据程序5进行分析。结果如表2所示。1.4.结果。表2.缓冲溶液性质选择的概述阳性结果阴性结果平均结果1.5.实施例1的结论。基于本研究的结果,推荐的储存制剂(不包括另外的添加剂)为:本制剂在所有测试样品中显示出最佳的稳定性能:热应激期间的杂质增加最少(与humira2制剂同等水平为0.02%)、在18%peg6000下不存在聚集和聚集温度最高(74℃)。humira1制剂的阿达木单抗具有比推荐的制剂更低的热稳定性。对于基于ph为5.0的5mm柠檬酸盐缓冲溶液的制剂,注意到最小的胶体和热稳定性。实施例2.组合物ph和缓冲容量优化。基于研究的第一部分的结果,阿达木单抗在ph5.0的乙酸盐缓冲溶液中显示出最佳稳定性。根据现有技术,包含阿达木单抗的药用组合物的大多数专利和专利申请保护ph为4.0-8.0的溶液。因此,本部分的目的为研究获得ph小于4的包含乙酸根离子的稳定组合物的可能性。研究制剂缩写浓度,mmрнacet5mmph656.0acet5mmph5.555.5acet5mmph555.0acet5mmph454.0acet5mmph3.7553.75acet5mmph3.553.5acet10mmph6106.0acet10mmph5.5105.5acet10mmph5105.0acet10mmph4104.0acet10mmph3.75103.75acet10mmph3.5103.5acet20mmph6206.0acet20mmph5.5205.5acet20mmph5205.0acet20mmph4204.0acet20mmph3.75203.75acet20mmph3.5203.52.1.通过peg聚集测定胶体稳定性。对于每个样品,一式三份进行“peg聚集”测试。根据程序3进行分析。有关溶液平均光密度的数据如表3所示。结果也如图2所示。表3.制备之后溶液的平均光密度(400nm)2.2.使用热应激50℃方法测定长期暴露下的热稳定性。根据程序5进行分析。2.3.通过“振荡测试”技术测定胶体稳定性。根据程序6进行分析。2.4.通过低温浓缩技术测定胶体稳定性。根据程序7进行分析。表4中提供了概述,其中证明了在热应激、振荡测试和低温浓缩前后的样品质量测量。2.5.结果。表4.应激前后的样本质量测量的概述阳性结果阴性结果平均结果/基线数据2.6.实施例2的结论。·研究表明,在空白对照剂的酸性溶液中存在阿达木单抗导致ph水平显著升高。另外,ph小于5.0的组合物表现出差的透析期间稳定性(在还原条件下labchipcaliper上的纯度低)和热应激(所用的所有测定方法在应激之后纯度低)。·所有研究中最稳定的样品为ph为5.0-6.0的5mm乙酸盐缓冲溶液中的阿达木单抗。它们证明了在应激期间的纯度和酸碱分布的变化最小。然而,为了产生阿达木单抗组合物,可用具有更大缓冲容量的溶液。实施例3.渗透剂和稳定剂选择。基于研究的第一部分的结果,阿达木单抗在ph5.0-6.0的乙酸盐缓冲溶液中显示出最佳稳定性。使用ph5.5的制剂作为渗透剂和稳定剂选择的基础。研究制剂3.1.通过peg聚集测定胶体稳定性。对于每个样品,一式三份进行“peg聚集”测试。根据程序3进行分析。有关溶液平均光密度的数据如表6所示。结果也如图3所示。表6.制备之后阿达木单抗溶液的平均光密度存在可见聚集。3.2.使用动态光散射(dls)技术通过蛋白质聚集点测定热稳定性。根据程序4进行分析。3.3.使用热应激50℃方法测定长期暴露下的热稳定性。根据程序5进行分析。3.4.结果。3.5.实施例3的结论。基于本研究的结果,用于阿达木单抗组合物的有希望的添加剂为海藻糖二水合物、甘氨酸、脯氨酸、甲硫氨酸和精氨酸盐酸盐。将聚山梨醇酯80、聚山梨醇酯20、泊洛沙姆188作为表面活性物质用于最终的药用组合物筛选。氯化钠、精氨酸、edta、赖氨酸、胍对阿达木单抗的胶体稳定性具有不利影响。氯化钠、赖氨酸、胍对阿达木单抗的热稳定性具有不利影响。制剂中含有的半胱氨酸导致抗体完全碎裂。当向制剂中加入edta添加剂时,注意到蛋白质酸碱分布的变化。实施例4.最终的药用组合物选择。基于研究的第三部分的结果,选择海藻糖二水合物、甘氨酸、脯氨酸、甲硫氨酸和精氨酸盐酸盐作为有希望的添加剂。将聚山梨醇酯80、聚山梨醇酯20、泊洛沙姆188作为表面活性物质用于最终的药用组合物筛选。研究制剂(mg/ml)4.1.使用热应激50℃方法测定长期暴露下的热稳定性。根据程序5进行分析。4.2.通过“振荡测试”技术测定胶体稳定性。根据程序6进行分析。4.3.通过低温浓缩技术测定胶体稳定性。根据程序7进行分析。表8和9中提供了概述,其中证明了在热应激、振荡测试和低温浓缩前后的样品质量测量。4.4.结果。4.4.实施例4的结论研究表明,humira制剂1中的阿达木单抗为所有测试样品中最不耐热的。在50℃下热应激120小时导致基于se-hplc的杂质增加最多(1.2%)和酸碱分布的变化最大(在labchipcaliper仪器上,所有部分的总绝对变化超过33%)。humira制剂1中样品的胶体稳定性与备选制剂相当。humira制剂2具有与备选制剂之一相当的热稳定性(在热应激期间纯度损失0.38%)。然而,在本发明制剂中的阿达木单抗的冷冻-解冻后,存在蛋白质的显著聚集:尺寸排阻hplc中聚集体的增加超过7%,这使得制剂在其意外冷冻的情况下不可用。使用dls还注意到在冷冻之后杂质显著增加。基于乙酸盐缓冲溶液并添加许多添加剂的备选制剂在应激期间显示出良好的热稳定性和胶体稳定性。尺寸排阻hplc显示本发明制剂中的杂质增加没有差异。而且,表面活性物质对15mg/ml浓度的阿达木单抗的稳定性没有显著影响。使用dls对应激样品的分析表明,制剂中存在精氨酸盐酸盐减少振荡测试期间的杂质增加,并且甲硫氨酸的存在增加振荡期间的杂质积累。注意到制剂12-29(含有海藻糖和精氨酸盐酸盐,和还含有l-脯氨酸的制剂)的酸碱分布的变化最小。基于本研究的结果,阿达木单抗的有希望的制剂为:实施例5.最终的高浓缩的阿达木单抗药用组合物确认。为了确认推荐的药用组合物的稳定性,使浓度为50mg/ml、100mg/ml和150mg/ml的阿达木单抗暴露于50℃下的热应激6天。研究制剂5.1.使用热应激50℃方法测定长期暴露下的热稳定性。根据程序5进行分析。5.2.结果。一般结论1.稳定的阿达木单抗药用组合物的筛选分几个阶段进行:缓冲溶液性质的选择、溶液的ph和缓冲容量的选择、渗透剂和稳定剂的选择、最终药用组合物的选择和最终的高浓缩的阿达木单抗药用组合物的确认。2.在研究期间,使用以下方法研究了超过90种制剂中的阿达木单抗的热稳定性和胶体稳定性:peg聚集、振荡测试、冷冻-解冻、热应激随后分析浊度的程度(uv分光光度法)、纯度(排阻hplc、动态光散射和凝胶电泳,包括使用labchip、caliper系统)和酸碱分布(labchip、caliper和离子交换hplc)。3.研究显示,与本发明的制剂相比较,用于阿达木单抗浓度为50mg/ml的市售制剂中的原始humira制剂(humira1)的热稳定性低。4.实验显示,与本发明的制剂相比较,在用于阿达木单抗100mg/ml的市售制剂中的原始humira制剂(humira2)中,冷冻和解冻过程对阿达木单抗聚集具有显著影响。5.补充有海藻糖二水合物、精氨酸盐酸盐、脯氨酸和选自聚山梨醇酯20、聚山梨醇酯80和泊洛沙姆188的表面活性物质的基于乙酸盐缓冲溶液的阿达木单抗药用组合物(ph5.0-6.0),与原始制剂相比较,在浓度为50-150mg/ml时呈现出更高的热稳定性和胶体稳定性,并且为本发明的主题。选择阿达木单抗的最佳添加剂制剂用于ph5.5的溶液。基于蛋白质浓度为50、100和150mg/ml的样品证实了阿达木单抗在ph范围为5.0-6.0的制剂中的稳定性。6.阿达木单抗浓度为150mg/ml的本发明药用组合物的制备方法使得能够浓缩达到200mg/ml而不损失蛋白质质量,以便在浓缩之后在加入sas并洗涤超滤装置时进行后续稀释。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1