一种包含脱细胞羊膜的复合膜及其制备方法与流程
本发明涉及生物医药技术领域,涉及一种包含脱细胞羊膜的复合膜、所述复合膜的用途,以及制备所述复合膜的方法。
背景技术:
羊膜(am)位于胎盘内层,呈半透明状,质地柔软,富含多种生长因子和细胞因子,目前已应用于一些软组织修复相关的临床治疗及动物实验中,例如用于皮肤移植、角膜表面重建、糖尿病溃疡的治疗等。羊膜的修复作用是主要通过释放相关因子,抑制炎症反应,促进再表皮化,抑制成纤维化以及减少瘢痕形成等实现的。最近的研究发现,羊膜可以通过调节炎症环境,促进m1型巨噬细胞向m2型巨噬细胞转变,抑制炎症反应,促进再生。这些特点表明,羊膜是用于软组织修复的理想组织工程材料。
新鲜的羊膜保持了优异的生物活性和结构,但新鲜羊膜保存和运输的费用昂贵,限制了其广泛应用。已有的羊膜保存方法包括湿法保存和干法保存,目前湿法保存的羊膜制品有
技术实现要素:
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所涉及的实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
本发明所述的羊膜是胎盘的最内层,是一种透明,无神经、血管、淋巴管,且具有韧性的组织。天然羊膜由上皮细胞层、基底膜、基质层、纤维母细胞层和海绵层组成。天然羊膜可以分成两面,具有上皮层的一面为上皮面(epithelialside)(除去上皮细胞层之后,就是具有基底膜的那一面),与之对应的另一面是基质面(stromalside),也就是具有海绵层的那一面。将天然羊膜进行处理,除去上皮细胞层,得到脱上皮细胞羊膜,其由基底膜、基质层、纤维母细胞层和海绵层组成;或者除去上皮细胞层和纤维母细胞层,得到全脱细胞羊膜,其由基底膜,基质层和海绵层组成。本发明所述的脱细胞羊膜(dam)包括脱上皮细胞羊膜和全脱细胞羊膜,所述脱细胞羊膜的基质面是指脱细胞羊膜上具有海绵层的一面。
如本文中使用的,术语“电纺丝”又称“静电纺丝”,是指利用聚合物溶液或熔体在高压电场的作用下形成纤维的过程,包括使带电荷的聚合物溶液或熔体在静电场中流动与变形,然后经溶剂蒸发或熔体冷却而使喷出的聚合物溶液束或熔体束固化,得到纤维。电纺丝可以得到纳米纤维或微米纤维。电纺丝的装置通常包括:高压电源、溶液储存装置、喷射装置和收集装置。传统的收集方式中,纤维以无规的方式散落在收集装置上,以非织造物的形式存在;而使用特定的收集方式,可以得到在一定程度上沿纤维轴向平行的纤维。
如本文中使用的,术语“纤维”是指长度与宽度之比高的(例如大于100)、相对柔韧的、相对均匀的物体,所述宽度是指垂直于其长度的横截面的直径。纤维的横截面可以是任何形状,例如圆形或非圆形。就非圆形横截面的纤维而言,术语“直径”是指最大的横截面尺寸。
如本文中使用的,术语“纳米纤维”在广泛意义上是指具有小于约5000nm、小于约1000nm、小于约800nm、小于约500nm或小于约100nm的直径的纤维。术语“微米纤维”是指具有小于约100μm、小于约80μm、小于约50μm或小于约10μm的直径的纤维。纳米或微米纤维可以是中空的,或沿其纵截面方向压扁的丝带状纤维。
本发明所述的“纤维层”主要由纤维构成,也可以含有其他物质(例如营养物质、细胞外基质、细胞因子和/或药物活性成分),所述纤维可以无规分布,或在一定程度上平行分布。纤维之间可以相互缠绕或搭接。
如本文中使用的,术语“纳米纤维层”是指由大比例纳米纤维构成的纤维层。大比例是指,例如,对于纳米纤维层来说,纤维层中大于约50%的纤维为纳米纤维,例如大于约60%,约70%,约80%,约90%,或甚至可包含100%的纳米纤维。
如本文中使用的,术语“微米纤维层”是指由大比例微米纤维构成的纤维层。大比例是指,例如,对于微米纤维层来说,纤维层中大于约50%的纤维为微米纤维,例如大于约60%,约70%,约80%,约90%,或甚至可包含100%的微米纤维。
如本文中使用的,术语“非织造物”是指包含多个基本上无规取向纤维的纤维网,其中通过肉眼不能分辨纤维排列中的总体重复结构。所述纤维可以彼此键合,或者可以是非键合的,并且缠结或搭接以赋予所述纤维网以强度和完整性。构成非织造物的纤维可以是短纤维或连续纤维,并且可包含单一材料或多种材料,也可以是不同纤维的组合或者是各自包括不同材料的类似纤维的组合。
如本文中使用的,术语“纳米纤维膜”是指主要由纳米纤维构成的膜。如本文中使用的,术语“微米纤维膜”是指主要由微米纤维构成的膜。纳米纤维膜或微米纤维膜中,纤维无规排列,或在一定程度上平行排列,纤维之间可以搭接。纳米纤维膜或微米纤维膜具有孔隙,可用于物质透过。形成纳米纤维膜或微米纤维膜的常见方法为电纺丝法,其他可能的方法还有热诱导相分离法、自组装法、模版法等,参见:1)carlos,a;etal.(2011).scaffoldsfortissueengineeringviathermallyinducedphaseseparation,advancesinregenerativemedicine.isbn978-953-307-732-1.2)martin,c;(1995).templatesynthesisofelectronicallyconductivepolymernanostructures.accchemres.1995,28(2):61–68.doi:10.1021/ar00050a002.3)zhang,c;etal.(2014)."self-assembledpeptidenanofibersdesignedasbiologicalenzymesforcatalyzingesterhydrolysis".acsnano.8(11):15–23.doi:10.1021/nn5051344.pmid25375351.
如本文中使用的,术语“聚合物”是指高分子量(例如大于1000)的天然来源或人工合成的有机化合物,其结构可通过重复单元表示,包括均聚物和共聚物。合成的聚合物通常通过单体加成或单体缩聚来形成。
如本文中使用的,术语“均聚物”是指由单一的重复单元(单体残基)形成的聚合物。
如本文中使用的,术语“共聚物”是指由两个或更多个不同重复单元(单体残基)形成的聚合物,包括但不限于交替共聚物、无规共聚物、嵌段共聚物和接枝共聚物。
如本文中使用的,“生物相容性”是指材料(及其可能的降解产物)对于细胞是无毒性的,并且在植入宿主(例如人体)后与宿主相容,不会造成显著的或者严重的副作用,例如,不会对宿主(例如人体组织)造成毒害作用,不会引起宿主的免疫排斥反应、过敏反应或炎症反应等等。
如本文中使用的,“生物可降解性”是指材料能够被细胞或生物体降解和吸收,并且其降解产物是生物相容性的。
如本说明书和所附权利要求书中使用的,单数形式“一个”、“一种”和“该/所述”包括复数的指示物,除非上下文另有明确规定。
如本文中使用的,术语“约”应该被本领域技术人员理解,并将随其所用之处的上下文而有一定程度的变化。如果根据术语应用的上下文,对于本领域技术人员而言,其含义不是清楚的,那么“约”的意思是偏离所述特定数值或范围不超过正负10%。
如本文中使用的,术语“治疗”是指治愈或至少部分阻止疾病的进展,或缓解疾病的症状。
为了解决现有技术中存在的问题,本申请的发明人将脱细胞羊膜与聚合物纤维制品进行复合,得到了包含脱细胞羊膜和聚合物纤维层的复合膜。本发明的复合膜容易保存,并且具有优于单纯羊膜的力学性能和可操作性,由此提供了下述发明:
在一个方面,本发明提供了一种复合膜,包含至少一个脱细胞羊膜和至少一个含有聚合物纤维的纤维层,所述纤维层附着在所述脱细胞羊膜上。
在某些实施方案中,所述纤维层附着在所述脱细胞羊膜的基质面上。
在某些实施方案中,所述纤维层直接附着在所述脱细胞羊膜上。优选地,所述纤维层与脱细胞羊膜之间没有人工添加的粘合层或具有粘合作用的物质。
在某些实施方案中,所述纤维层通过化学键附着在所述脱细胞羊膜上。
在某些实施方案中,所述纤维层为纳米纤维层或微米纤维层。
在某些实施方案中,所述复合膜的厚度为30μm-500μm,例如30μm-100μm、100μm-200μm、200μm-300μm、300μm-400μm或400μm-500μm,例如30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm、110μm、120μm、130μm、140μm、150μm、160μm、170μm、180μm、190μm、200μm、210μm、220μm、230μm、240μm、250μm、260μm、270μm、280μm、290μm、300μm、310μm、320μm、330μm、340μm、350μm、360μm、370μm、380μm、390μm、400μm、410μm、420μm、430μm、440μm、450μm、460μm、470μm、480μm、490μm或500μm。
在某些实施方案中,所述纤维层的厚度为10μm-300μm,例如10μm-100μm、100μm-200μm或200μm-300μm,例如10μm、20μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm、110μm、120μm、130μm、140μm、150μm、160μm、170μm、180μm、190μm、200μm、210μm、220μm、230μm、240μm、250μm、260μm、270μm、280μm、290μm或300μm。
在某些实施方案中,所述聚合物纤维的平均直径为200nm-5μm,例如200nm-500nm、500nm-1μm、1μm-2μm、2μm-3μm、3μm-4μm或4μm-5μm,例如200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1μm、1.1μm、1.2μm、1.3μm、1.4μm、1.5μm、1.6μm、1.7μm、1.8μm、1.9μm、2μm、2.1μm、2.2μm、2.3μm、2.4μm、2.5μm、2.6μm、2.7μm、2.8μm、2.9μm、3μm、3.1μm、3.2μm、3.3μm、3.4μm、3.5μm、3.6μm、3.7μm、3.8μm、3.9μm、4μm、4.1μm、4.2μm、4.3μm、4.4μm、4.5μm、4.6μm、4.7μm、4.8μm、4.9μm或5μm。
本发明的复合膜中,纤维层具有孔隙,以便于物质运输。在某些实施方案中,所述纤维层的孔隙率为50%-95%,例如50%-55%、55%-60%、60%-65%、65%-70%、70%-75%、75%-80%、80%-85%、85%-90%或90%-95%,例如50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%或95%。
在某些实施方案中,所述纤维层的比表面积为2m2/g-40m2/g,例如2m2/g-10m2/g、10m2/g-20m2/g、20m2/g-30m2/g或30m2/g-40m2/g,例如2m2/g、3m2/g、4m2/g、5m2/g、6m2/g、7m2/g、8m2/g、9m2/g、10m2/g、11m2/g、12m2/g、13m2/g、14m2/g、15m2/g、16m2/g、17m2/g、18m2/g、19m2/g、20m2/g、21m2/g、22m2/g、23m2/g、24m2/g、25m2/g、26m2/g、27m2/g、28m2/g、29m2/g、30m2/g、31m2/g、32m2/g、33m2/g、34m2/g、35m2/g、36m2/g、37m2/g、38m2/g、39m2/g或40m2/g。
在某些实施方案中,所述聚合物纤维能够通过电纺丝得到。
在某些实施方案中,所述脱细胞羊膜为脱上皮细胞羊膜或全脱细胞羊膜。
在某些实施方案中,用于制备所述脱细胞羊膜的羊膜是新鲜获得的。在某些实施方案中,用于制备所述脱细胞羊膜的羊膜来源于牛科动物、马科动物、猪科动物、犬科动物、猫科动物、啮齿类动物或灵长类动物,例如,来源于人。
本发明的复合膜中,所述聚合物纤维优选由具有生物相容性和/或生物可降解性的聚合物制得。
在某些实施方案中,所述聚合物为人工合成聚合物,例如,选自脂肪族聚酯、聚酯醚、聚膦腈、聚碳酸酯、聚氨基酸,以及其任意组合;或者,所述聚合物为天然聚合物,例如,选自胶原蛋白、纤维蛋白、壳聚糖、海藻酸盐、透明质酸、粘连蛋白、明胶、葡聚糖、弹性蛋白,以及其任意组合。
在某些实施方案中,所述聚合物选自聚乳酸(pla)及其共聚物、聚乙交酯(pga)及其共聚物、聚羟基烷酸酯类(phas)及其共聚物、聚己内酯(pcl)及其共聚物,粘连蛋白和胶原蛋白。
在某些实施方案中,所述聚合物选自聚乳酸(pla)、聚己内酯(pcl)、聚丙交酯-乙交酯共聚物(plga)和胶原蛋白。
在某些实施方案中,所述聚合物能够形成水凝胶纤维。能够形成水凝胶纤维的聚合物(例如胶原蛋白和粘连蛋白)可以通过电纺丝得到透明的纤维层,适合于透明软组织(例如角膜)的修复。
在某些实施方案中,所述纤维层为pcl纳米纤维层,其具有类似于细胞外基质的结构、高比表面积,并且具有多孔结构,利于细胞迁移和营养物质传输。pcl纳米纤维层轻薄柔软,可以很好地贴附于修复组织的表面,并且具有良好的抗拉性能。在某些实施方案中,所述pcl纳米纤维层的厚度为40μm-120μm。
在某些实施方案中,所述纤维层为胶原蛋白纤维层,其具有良好的透明性,适合于透明软组织(例如角膜)的修复。
在本发明的复合膜中,纤维层中的纤维可以各种分布形式存在,例如无规分布,形成类似于非织造物的结构,或者在一定程度上平行排列。
在某些实施方案中,本发明的复合膜包含至少两个纤维层,其中,每个层中的纤维在一定程度上平行排列。本发明所述的“在一定程度上平型排列”是指,例如,同一层纤维的平行角在0°至10°之间。在某些实施方案中,各个纤维层之间,纤维的朝向不同。不同纤维朝向的纤维的叠加,可以使复合膜在各个方向的力学性能得到优化。
在某些实施方案中,纤维层通过化学键(例如酰胺键或酯键)直接附着在脱细胞羊膜上。在某些实施方案中,所述聚合物纤维上带有反应性基团。在某些实施方案中,所述聚合物纤维上带有羧基。优选地,聚合物纤维上的羧基经过活化(例如,用n-羟基琥珀酰亚胺(nhs)活化)。在某些实施方案中,所述聚合物纤维上带有氨基。通过羧基与氨基的缩合反应,生成酰胺键,使纤维层与脱细胞羊膜紧密地结合在一起。在某些实施方案中,所述聚合物纤维上带有羟基。
本发明的复合膜中,聚合物纤维起到物理支持作用,赋予了复合膜优良的力学性能。
在某些实施方案中,复合膜的断裂应变(straintofailure)为5%-200%,例如5%-50%、50%-100%、100%-150%或150%-200%,例如5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、105%、110%、115%、120%、125%、130%、135%、140%、145%、150%、155%、160%、165%、170%、175%、180%、185%、190%、195%或200%。
在某些实施方案中,复合膜的弹性模量(elasticmodulus)为0.2mpa-1000mpa,例如0.2mpa-10mpa、10mpa-50mpa、50mpa-100mpa、100mpa-200mpa、200mpa-300mpa、300mpa-400mpa、400mpa-500mpa、500mpa-600mpa、600mpa-700mpa、700mpa-800mpa、800mpa-900mpa或900mpa-1000mpa,例如0.2mpa、1mpa、10mpa、30mpa、50mpa、100mpa、120mpa、150mpa、180mpa、200mpa、230mpa、250mpa、280mpa、300mpa、350mpa、370mpa、400mpa、430mpa、460mpa、480mpa、500mpa、530mpa、550mpa、570mpa、600mpa、630mpa、660mpa、680mpa、700mpa、730mpa、750mpa、800mpa、830mpa、860mpa、880mpa、900mpa、930mpa、950mpa或1000mpa。
在某些实施方案中,复合膜的韧度(toughness)为0.5mj/m3-50mj/m3,例如0.5mj/m3-1mj/m3、1mj/m3-5mj/m3、5mj/m3-10mj/m3、10mj/m3-20mj/m3、20mj/m3-30mj/m3、30mj/m3-40mj/m3或40mj/m3-50mj/m3,例如0.5mj/m3、1mj/m3、2mj/m3、3mj/m3、4mj/m3、5mj/m3、6mj/m3、7mj/m3、8mj/m3、9mj/m3、10mj/m3、11mj/m3、12mj/m3、13mj/m3、14mj/m3、15mj/m3、16mj/m3、17mj/m3、18mj/m3、19mj/m3、20mj/m3、21mj/m3、22mj/m3、23mj/m3、24mj/m3、25mj/m3、26mj/m3、27mj/m3、28mj/m3、29mj/m3、30mj/m3、31mj/m3、32mj/m3、33mj/m3、34mj/m3、35mj/m3、36mj/m3、37mj/m3、38mj/m3、39mj/m3、40mj/m3、41mj/m3、42mj/m3、43mj/m3、44mj/m3、45mj/m3、46mj/m3、47mj/m3、48mj/m3、49mj/m3或50mj/m3。
在一个方面,本发明提供了一种制备包含脱细胞羊膜的复合膜的方法,包括以下步骤:
(1)提供脱细胞羊膜;
(2)提供聚合物纤维片材,所述聚合物纤维片材的至少一个面带有反应性基团;
(3)将所述聚合物纤维片材的带有反应性基团的面与脱细胞羊膜贴合。
在某些实施方案中,所述方法还包括:对步骤(3)的产物进行冷冻干燥。
在某些实施方案中,步骤(1)中的脱细胞羊膜为脱上皮细胞羊膜或全脱细胞羊膜。
在某些实施方案中,步骤(1)中的脱细胞羊膜通过包含以下步骤的方法制得:
(1-1)使用蛋白酶溶液处理羊膜的上皮面;
(1-2)使用缓冲溶液对羊膜进行清洗;
(1-3)将羊膜的上皮细胞去除(例如,将羊膜的上皮细胞刮除);
(1-4)使用缓冲溶液对去除上皮细胞的羊膜进行清洗。
在某些实施方案中,步骤(1-1)中的羊膜是新鲜获得的。
在某些实施方案中,步骤(1-1)中的羊膜来源于牛科动物、马科动物、猪科动物、犬科动物、猫科动物、啮齿类动物或灵长类动物,例如,来源于人。
在某些实施方案中,步骤(2)中的聚合物纤维片材为非织造物,例如主要由纳米纤维或微米纤维构成的非织造物。
在某些实施方案中,所述聚合物纤维片材为纳米纤维膜或微米纤维膜。
在某些实施方案中,所述聚合物纤维片材能够通过电纺丝得到。
在某些实施方案中,所述聚合物纤维片材的厚度为10μm-300μm,例如10μm-100μm、100μm-200μm或200μm-300μm,例如10μm、20μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm、110μm、120μm、130μm、140μm、150μm、160μm、170μm、180μm、190μm、200μm、210μm、220μm、230μm、240μm、250μm、260μm、270μm、280μm、290μm或300μm。
在某些实施方案中,所述聚合物纤维片材中,纤维的平均直径为200nm-5μm,例如200nm-500nm、500nm-1μm、1μm-2μm、2μm-3μm、3μm-4μm或4μm-5μm,例如200nm、300nm、400nm、500nm、600nm、700nm、800nm、900nm、1μm、1.1μm、1.2μm、1.3μm、1.4μm、1.5μm、1.6μm、1.7μm、1.8μm、1.9μm、2μm、2.1μm、2.2μm、2.3μm、2.4μm、2.5μm、2.6μm、2.7μm、2.8μm、2.9μm、3μm、3.1μm、3.2μm、3.3μm、3.4μm、3.5μm、3.6μm、3.7μm、3.8μm、3.9μm、4μm、4.1μm、4.2μm、4.3μm、4.4μm、4.5μm、4.6μm、4.7μm、4.8μm、4.9μm或5μm。
在某些实施方案中,所述聚合物纤维片材的孔隙率为50%-95%,例如50%-55%、55%-60%、60%-65%、65%-70%、70%-75%、75%-80%、80%-85%、85%-90%或90%-95%,例如50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%或95%。
在某些实施方案中,所述聚合物纤维片材的比表面积为2m2/g–40m2/g,例如2m2/g-10m2/g、10m2/g-20m2/g、20m2/g-30m2/g或30m2/g-40m2/g,例如2m2/g、3m2/g、4m2/g、5m2/g、6m2/g、7m2/g、8m2/g、9m2/g、10m2/g、11m2/g、12m2/g、13m2/g、14m2/g、15m2/g、16m2/g、17m2/g、18m2/g、19m2/g、20m2/g、21m2/g、22m2/g、23m2/g、24m2/g、25m2/g、26m2/g、27m2/g、28m2/g、29m2/g、30m2/g、31m2/g、32m2/g、33m2/g、34m2/g、35m2/g、36m2/g、37m2/g、38m2/g、39m2/g或40m2/g。
在某些实施方案中,所述聚合物纤维能够通过电纺丝得到。
在某些实施方案中,所述聚合物纤维片材由生物相容性和/或生物可降解性的聚合物制得。
在某些实施方案中,所述聚合物为人工合成聚合物,例如,选自脂肪族聚酯、聚酯醚、聚膦腈、聚碳酸酯、聚氨基酸、以及其任意组合;或者,所述聚合物为天然聚合物,例如,选自胶原蛋白、纤维蛋白、壳聚糖、海藻酸盐、透明质酸、粘连蛋白、明胶、葡聚糖、弹性蛋白,以及其任意组合。
在某些实施方案中,所述聚合物选自聚乳酸(pla)及其共聚物、聚乙交酯(pga)及其共聚物、聚羟基烷酸酯类(phas)及其共聚物、聚己内酯(pcl)及其共聚物,粘连蛋白和胶原蛋白。
在某些实施方案中,所述聚合物选自聚乳酸(pla)、聚己内酯(pcl)、聚丙交酯-乙交酯共聚物(plga)和胶原蛋白。
在某些实施方案中,所述聚合物能够形成水凝胶纤维。能够形成水凝胶纤维的聚合物(例如胶原蛋白和粘连蛋白)可以通过电纺丝得到透明的纤维层,适合于透明软组织(例如角膜)的修复。
在某些实施方案中,聚合物纤维片材中的纤维可以各种分布形式存在,例如无规分布,或者在一定程度上平行排列。
在某些实施方案中,步骤(3)包括:将所述聚合物纤维片材的带有反应性基团的面与脱细胞羊膜的基质面贴合。
在某些实施方案中,所述聚合物纤维片材带有的反应性基团为羧基。优选地,所述羧基为活化的羧基(例如nhs活化的羧基)。在某些实施方案中,所述聚合物纤维片材带有的反应性基团为氨基。可以通过羧基与氨基的缩合反应,形成酰胺键,使聚合物纤维片材与脱细胞羊膜紧密结合。在某些实施方案中,所述聚合物纤维片材带有的反应性基团为羟基。
在某些实施方案中,所述纤维片材表面的反应性基团的浓度为0.05nmol/mm2-5nmol/mm2,例如0.05nmol/mm2-0.5nmol/mm2、0.5nmol/mm2-1nmol/mm2、1nmol/mm2-2nmol/mm2、2nmol/mm2-3nmol/mm2、3nmol/mm2-4nmol/mm2或4nmol/mm2-5nmol/mm2,例如0.05nmol/mm2、0.1nmol/mm2、0.2nmol/mm2、0.3nmol/mm2、0.4nmol/mm2、0.5nmol/mm2、0.6nmol/mm2、0.7nmol/mm2、0.8nmol/mm2、0.9nmol/mm2、1nmol/mm2、1.1nmol/mm2、1.2nmol/mm2、1.3nmol/mm2、1.4nmol/mm2、1.5nmol/mm2、1.6nmol/mm2、1.7nmol/mm2、1.8nmol/mm2、1.9nmol/mm2、2nmol/mm2、2.1nmol/mm2、2.2nmol/mm2、2.3nmol/mm2、2.4nmol/mm2、2.5nmol/mm2、2.6nmol/mm2、2.7nmol/mm2、2.8nmol/mm2、2.9nmol/mm2、3nmol/mm2、3.1nmol/mm2、3.2nmol/mm2、3.3nmol/mm2、3.4nmol/mm2、3.5nmol/mm2、3.6nmol/mm2、3.7nmol/mm2、3.8nmol/mm2、3.9nmol/mm2、4nmol/mm2、4.1nmol/mm2、4.2nmol/mm2、4.3nmol/mm2、4.4nmol/mm2、4.5nmol/mm2、4.6nmol/mm2、4.7nmol/mm2、4.8nmol/mm2、4.9nmol/mm2或5nmol/mm2。
优选地,步骤(3)在特定的压力和/或温度下进行,以使聚合物纤维片材与脱细胞羊膜的结合更加紧密。
在某些实施方案中,步骤(3)在4-25℃下进行,例如4℃-10℃、10℃-15℃、15℃-20℃或20℃-25℃,例如4℃、5℃、6℃、7℃、8℃、9℃、10℃、11℃、12℃、13℃、14℃、15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃或25℃。
在某些实施方案中,步骤(3)在1-10mp的压力下进行,例如1mp、2mp、3mp、4mp、5mp、6mp、7mp、8mp、9mp或10mp。
在某些实施方案中,步骤(3)进行1-24小时,例如1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时或24小时。
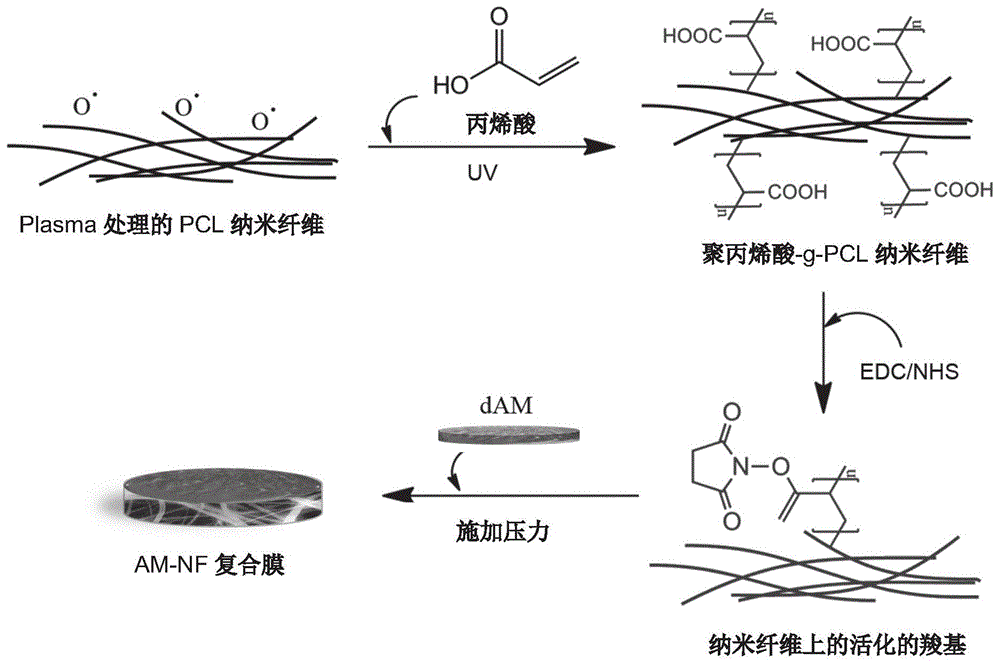
图1示例性地显示了复合膜的制备过程,包括:对聚合物纤维片材(例如pcl纳米纤维膜)进行处理,使纤维上带有羧基;对羧基进行活化;将带有活化羧基的聚合物纤维片材与脱细胞羊膜进行压缩,得到复合膜。
在某些实施方案中,本发明的方法还包括:将至少两个聚合物纤维片材进行叠加。在某些实施方案中,所述聚合物纤维片材中的纤维在一定程度上平行排列。在某些实施方案中,同一层片材中纤维的平行角在0°至10°之间。在某些实施方案中,各个片材之间,纤维的朝向不同。不同纤维朝向的纤维的叠加,可以使复合膜在各个方向的力学性能得到优化,提高复合膜的力学性能。图2示例性地显示了这一过程。
在一个方面,本发明提供了一种制品,其包含本发明的复合膜。在某些实施方案中,所述制品包含一层或多层本发明的复合膜。优选地,本发明的制品用于受损软组织(例如皮肤、皮下组织、肌肉、肌腱、韧带、关节囊、滑膜囊、神经、血管、角膜)的修复或眼科疾病的治疗。所述制品可以是敷料、支架或补片。所述制品也可以是组织或器官替代物,例如人工皮肤或人工管腔。
在一个方面,本发明提供了上述复合膜用于制备制品的用途。优选地,所述制品用于受损软组织(例如皮肤、皮下组织、肌肉、肌腱、韧带、关节囊、滑膜囊、神经、血管、角膜)的修复或眼科疾病的治疗。所述制品可以是敷料、支架或补片。所述制品也可以是组织或器官替代物,例如人工皮肤或人工管腔。
在一个方面,本发明提供了一种修复受试者的受损软组织(例如皮肤、皮下组织、肌肉、肌腱、韧带、关节囊、滑膜囊、神经、血管、角膜)的方法,包括将上述复合膜或制品施予受试者的受损软组织。
本发明还提供了一种治疗受试者的眼科疾病的方法,包括将上述复合膜或制品施予受试者的眼部患处。
在某些实施方案中,所述受试者为哺乳动物,例如牛科动物、马科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物;例如,所述受试者为人。
有益技术效果
本发明的复合膜同时拥有羊膜和聚合物纤维膜的优势,其保存了羊膜的结构和生物学功能,又同时具有聚合物纤维膜的物理支撑功能。本申请的复合膜可通过冷冻干燥保存,做成随时可取用的产品。
与新鲜的或者单纯脱水的羊膜相比,本发明的复合膜具有良好的力学性能,容易操作,可常温储存和运输,降低了生产、运输和使用成本,因此,具有非常好的应用转化潜能。本发明的复合膜可以用于外科手术,容易进行包括缝合在内的各种操作,在受损软组织(例如角膜损伤,糖尿病溃疡,动脉溃疡,下肢静脉溃疡,肌腱、肌肉以及神经组织的缺损等)的修复方面将有非常广泛的应用。
本发明制备复合膜的方法保留了羊膜基质层的天然结构,能够使脱细胞羊膜与纤维层稳定贴合,使得到的复合膜具有稳定的整合结构和优良的性能。
下面将结合附图和实施例对本发明的实施方案进行详细描述,但是,本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
图1示例性地显示了复合膜的制备过程,包括:对聚合物纤维片材(例如pcl纳米纤维膜)进行处理,使纤维上带有羧基;对羧基进行活化;将带有活化羧基的聚合物纤维片材与脱细胞羊膜进行压缩,得到复合膜。
图2示例性地显示了将不同纤维朝向的平行纤维片材进行叠加的过程。
图3显示了实施例1中,pcl纳米纤维在羧基化前及羧基化后的形态,图中的标尺为1μm。羧基化前后,纤维表面无明显变化。
图4显示了实施例1中,各纤维膜样品中tbo的含量。
图5显示了用光学显微镜和扫描电镜对脱细胞前后的羊膜进行观察的结果(标尺:20μm)。图5a和5d分别显示了脱细胞前后在普通光学显微镜下观察到的羊膜的表面形态。图5b和5e分别为脱细胞前后用荧光显微镜对羊膜观察的结果,图5b中的点为dapi染色的细胞核,图5e中观察不到细胞核。图5c和5f分别为脱细胞前后在扫描电镜下观察到的羊膜的表面形态。
图6显示了羊膜和脱细胞羊膜的dna含量,结果显示,脱细胞羊膜几乎不含dna。
图7示例性地显示了复合过程及所用的装置。
图8显示了实施例4中,pla纤维和plga纤维在羧基化前及羧基化后的形态,图中的标尺为10μm。如图所示,羧基化前后,pla纤维和plga纤维的表面无明显变化。
图9显示了实施例4中,未处理的pla纤维膜和plga纤维膜,以及羧基化后pla纤维膜和plga纤维膜中tbo的含量。
图10为实施例3、对比例1和对比例2制得的pcl-dam复合膜在冷冻干燥后的形态。结果说明,施加压力并对纤维膜表面进行处理,有利于纳米纤维膜与脱细胞羊膜之间的稳定贴附。
图11显示了脱细胞羊膜和不同厚度的pcl-dam复合膜在干燥和复水状态下的形态。如图所示,脱细胞羊膜在复水后粘附在一起,难以展开;而复合膜在复水之后很容易用镊子夹持,并呈伸展状态。
图12显示了脱细胞羊膜、pla-dam复合膜和plga-dam复合膜在干燥和复水状态下的形态,复合膜的厚度为80μm。如图所示,脱细胞羊膜在复水后粘附在一起,难以展开;而复合膜在复水之后很容易用镊子夹持,并呈伸展状态。
图13显示了脱细胞羊膜、pcl-dam复合膜(厚度:40μm,80μm,120μm)、表面羧基化处理的pcl纳米纤维膜(厚度:80μm)和未处理的pcl纳米纤维膜(厚度:80μm)的含水率。
图14显示了脱细胞羊膜、plga-dam复合膜、pla-dam复合膜和pcl-dam复合膜的应力应变曲线(stress-straincurve)。
图15显示了脱细胞羊膜、plga-dam复合膜、pla-dam复合膜和pcl-dam复合膜的力学测试结果:(a)弹性模量(elasticmodulus)、(b)最大应变(straintofailure)、(c)最大拉伸强度(ultimatetensilestrength)以及(d)韧度(toughness)。
图16显示了脱细胞羊膜(dam)、80μm厚pcl-dam复合膜(cm)和未处理的80μm厚pcl纳米纤维膜(nf)进行缝线延伸(sutureextension)测试结果。
图17显示了利用扫描电镜观察到的施加压力条件下和未施加压力条件下制得的pcl-dam复合膜的表面结构,图中标尺为10μm。如图所示,未施加压力制得的复合膜中,pcl纳米纤维膜(nf)虽然可以通过化学作用与脱细胞羊膜结合在一起,但是脱细胞羊膜表面并未呈现pcl纳米纤维的形态(图17a,17d),表明脱细胞羊膜与pcl纳米纤维膜结合较弱。施加压力制得的复合膜中,pcl纳米纤维的形态在脱细胞羊膜表面清晰可见(图17b,c,e,f),表明这脱细胞羊膜与pcl纳米纤维膜结合紧密,形成一个统一的复合结构。
图18显示了天然羊膜和pcl-dam复合膜的横切面。图18a-18c为横切面经h&e染色后的光学显微照片,图中标尺为20μm。图18a显示了,天然羊膜由一层表皮细胞以及海绵状的基质结构组成。图18b和18c显示了,复合膜的横切面上,pcl纳米纤维膜(nf)已并入脱细胞羊膜的基质中,羊膜和pcl纳米纤维膜交叠在一起。图18d-18f为横切面的扫描电镜照片,18d、18e和18f中的标尺分别为10μm、2μm、1μm。复合膜的超微结构显示,pcl纳米纤维膜与脱细胞羊膜的结合非常紧密(图18e,18f)。箭头处显示,脱细胞羊膜和pcl纳米纤维膜紧密结合在一起。结果表明,通过物理和化学的相互作用,pcl纳米纤维膜和脱细胞羊膜成功形成了复合膜。
图19显示了角膜成纤维细胞在脱细胞羊膜(dam)、pcl-dam复合膜(cm)和pcl纳米纤维膜(nf)上的生存率。结果显示,脱细胞羊膜、pcl-dam复合膜、pcl纳米纤维膜均无细胞毒性。
图20显示了在无血清及有血清的培养条件下,角膜成纤维细胞在脱细胞羊膜(dam)、pcl-dam复合膜(cm)、pcl纳米纤维膜(nf)以及tcps细胞培养板(tcps)上培养7天之后的形态,图中标尺为50μm。如图所示,在无血清的培养基中,细胞在脱细胞羊膜、pcl-dam复合膜和细胞培养板上呈现出常规的梭形,而在pcl纳米纤维膜上,细胞几乎未伸展开。在含血清的培养基中,细胞在脱细胞羊膜、pcl-dam复合膜以及细胞培养板上长满,形成细胞层。在pcl纳米纤维膜上,细胞未形成细胞层。这一结果表明,与脱细胞羊膜类似,本发明的复合膜为细胞生长提供了合适的贴附表面,利于细胞的粘附、伸展、生长。
图21显示了无血清培养条件下,细胞在脱细胞羊膜(dam)、pcl-dam复合膜(cm)、pcl纳米纤维膜(nf)和tcps细胞培养板(tcps)上的增殖情况。所有荧光检测数值均与第一天的数值相比。结果表明,本发明的复合膜很好地保留了羊膜中的营养物质,为细胞生长提供了营养物质。
图22显示了在不同浓度的炎症刺激因子的作用下,小鼠骨髓来源的巨噬细胞种植到脱细胞羊膜(dam)、pcl-dam复合膜(cm)、pcl纳米纤维膜(nf)以及tcps细胞培养板(tcps)上培养48小时后,m1型巨噬细胞和m2型巨噬细胞标志物的表达。图中结果显示几何平均值±标准偏差(sd)(样品数n为3)。*p<0.05,**p<0.01。结果表明,本发明的复合膜具有类似于羊膜的抗炎特性,可促进巨噬细胞从促炎症类型转变为抑制炎症的类型。
图23显示了edc交联的平行胶原纤维的表面形态,图23a为放大25倍的图像,图23b为放大100倍的图像。如图所示,胶原纤维表面规整,并且平行排布。
图24显示了胶原纤维膜、脱细胞羊膜和胶原-dam复合膜的透明度,图中膜的直径为8mm。如图所示,无论在干燥还是复水状态下,三种膜下的字母“jhu”都清晰可见。单纯胶原纤维膜的透明度甚至稍强于羊膜。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1pcl纳米纤维膜的制备和处理
1.制备pcl纳米纤维膜:制备12wt%的聚已酸内酯(pcl,mw70kda,sigma-aldrich)溶液。按需称取一定量pcl颗粒,溶解在二氯甲烷:甲醇=4:1的溶液中,终浓度为12%。将针筒中加入pcl溶液,放置27g针头。整个针管放置于电动注射泵上,以12kv电压,2.5ml/h的注射速度推进。锡箔纸接地线,接收喷射出的pcl纳米纤维,形成纳米纤维膜,膜厚度为80μm,pcl纳米纤维的平均直径为517nm(517±178nm)。
参照上述过程,可以制备厚度为40μm,80μm和120μm的pcl纳米纤维膜。
2.pcl纳米纤维膜的表面处理:过程如图1所示。
1)用等离子清洗机(plasmacleaner,harrickplasma)对pcl纳米纤维膜进行处理,用中等频率处理10分钟,以使纤维表面带有活性氧基团。
2)羧基化处理:用去离子水配制10%丙烯酸,并加入高碘酸钠(sodiumperiodate,naio4),高碘酸钠终浓度为0.5mm。将plasma处理过的pcl纳米纤维膜置于干净容器中,容器置于冰上。加入10%丙烯酸-0.5mmnaio4溶液,使其覆盖纤维膜。uv辐照2分钟(30-50mw/cm2)。
3)用去离子水清洗uv处理后的纤维膜,清洗3至5次,将残留的试剂完全清洗掉。室温避光干燥。
4)用扫描电镜观察羧基化前后的纤维膜,如图3所示,羧基化前后,纤维表面无明显变化。根据甲苯胺蓝反应(toluidineblueo,tbo),计算纤维膜中羧基的含量。图4显示了5个样品(厚度分别为70或80μm)中tbo的浓度。如图所示,纤维膜上tbo的平均浓度为0.19±0.027nmol/mm2。羧基与tbo复合物的比例为1:1。因此,纤维膜上的羧基浓度估算为0.19±0.027nmol/mm2。结果显示,pcl纤维表面成功羧基化。
5)对pcl纤维膜表面的羧基进行活化:根据羧基含量,计算反应所需nhs和n-(3-二甲基氨基丙基)-n-乙基碳酰二亚胺(edc)的质量(摩尔比cooh:nhs/edc=1:4)。称取相应质量的nhs(sigma)和edc(sigma),溶解到50%乙醇中,加到羧基化的纤维表面,室温避光处理5小时。
6)用70%乙醇清洗纤维膜两次。
实施例2羊膜的脱细胞处理
新鲜羊膜贴附在硝酸纤维素膜上,上皮面朝上。配制2.5%中性蛋白酶(dispase,millipore)溶液,溶解于dmem/f12无血清培养基(lifetechnology)中。酶溶液覆盖羊膜表面,4℃,处理4小时。pbs清洗3次。将羊膜放置于pbs溶液中,置于体视镜下观察。用虹膜铲从左至右,从上至下,刮除上皮细胞。镜下可见白色细胞碎片脱落至pbs溶液。用pbs溶液清洗羊膜3次。
测量得到脱细胞羊膜的厚度在20μm~40μm之间。用光学显微镜和扫描电镜对脱细胞前后的羊膜进行观察,结果见图5(标尺:20μm)。图5a和5d分别显示了脱细胞前后在普通光学显微镜下观察到的羊膜的表面形态。图5b和5e分别为脱细胞前后用荧光显微镜对羊膜观察的结果,图5b中的点为dapi染色的细胞核,图5e中观察不到细胞核。图5c和5f分别为脱细胞前后在扫描电镜下观察到的羊膜的表面形态。
如图所示,在处理之前,羊膜上皮细胞分布于整个表面,处理之后,羊膜表面几乎没有细胞残留,羊膜的上皮细胞被全部移除。
利用dna抽提试剂盒(
实施例3脱细胞羊膜-pcl纳米纤维复合膜(简称为“pcl-dam复合膜”)的制备
在超净工作台中,用pbs清洗pcl纳米纤维膜三次。将脱细胞羊膜的上皮面朝下,基质面朝上平铺于一片特氟龙(polytetrafluoroethene,ptfe)膜上。将pcl纳米纤维膜放置于羊膜的基质面。之后,在纳米纤维膜上放置另一片特氟龙膜。将叠放好的脱细胞羊膜、pcl纳米纤维膜和特氟龙膜放置于两片不锈钢板之间。将钢板放置于台钳中。施加5~7mp压力。放置于4℃反应12小时。pcl纳米纤维膜表面的羧基与脱细胞羊膜表面的氨基进行缩合反应,并利用台钳的挤压作用使反应更加充分。除去钢板和特氟龙膜之后,取出复合膜,冷冻干燥箱内冷冻干燥(labconcofreezone12lcascadefreezedrysystem),室温保存。
图7示例性地显示了复合过程及所用的装置。图中,脱细胞羊膜与带有活化羧基的pcl纳米纤维膜叠合,置于两片特氟龙膜之间,两片特氟龙膜的外侧各有一片不锈钢板,台钳对不锈钢板施压,得到复合膜。
使用不同厚度的pcl纳米纤维膜,可以得到不同厚度的复合膜。
对比例1:参照实施例3的过程,在不施加压力的条件下,将脱细胞羊膜与pcl纳米纤维膜进行复合。
对比例2:参照实施例1的过程,制备厚度为80μm的pcl纳米纤维膜,不对膜表面进行处理。参照实施例3的过程,在施加压力的条件下,与脱细胞羊膜进行复合。
实施例4脱细胞羊膜-pla纤维复合膜(简称为“pla-dam复合膜”)以及脱细胞羊膜-plga纤维复合膜(简称为“plga-dam复合膜”)的制备
1.制备聚乳酸(pla)纤维膜:制备9wt%的pla(pla,mw=78kda,mn=48kda,natureworksllc)溶液。按需称取一定量pla,溶解在三氯甲烷-二甲基甲酰胺的溶液中,终浓度为9%。将针筒中加入pla溶液,放置27g针头。整个针管放置于电动注射泵上,以16kv电压,0.5ml/h的注射速度推进。锡箔纸接地线,接收喷射出的pla纤维,形成纤维膜,厚度为80μm,纤维的直径为935nm(935±218nm)。
2.制备聚丙交酯-乙交酯共聚物poly(d,l-lactide-co-glycolide)(plga)纤维膜:制备15wt%的plga无规共聚物(重复单元个数比例:丙交酯:乙交酯=50:50,mw30-60kda,sigma-aldrich)溶液。按需称取一定量plga,溶解在1,1,1,3,3,3-六氟异丙醇中,终浓度为15%。将针筒中加入plga溶液,放置27g针头。整个针管放置于电动注射泵上,以6.8kv电压,0.5ml/h的注射速度推进。锡箔纸接地线,接收喷射出的plga纤维,形成纤维膜,厚度为80μm,纤维的直径为1260nm(1260±132nm)。
3.plga和pla纤维膜的表面处理过程同pcl纤维膜的过程。用扫描电镜观察羧基化前后的纤维膜,如图8所示,羧基化前后,pla和plga纤维表面无明显变化。
tbo检测测试不同纤维膜羧基化后的tbo浓度。结果如图9所示,羧基化后,厚度为80μm的pla纤维膜上tbo的平均浓度为0.22±0.031nmol/mm2,厚度为80μmplga纤维膜上tbo的平均浓度为0.21±0.018nmol/mm2。
实施例5复合膜的性能测试
(1)稳定性
图10为实施例3、对比例1和对比例2制得的pcl-dam复合膜在冷冻干燥后的形态。如图所示,实施例3制得的复合膜中,脱细胞羊膜和pcl纳米纤维膜非常紧密地结合在一起。在没有施加压力的条件下制得的复合膜(对比例1),在其边缘可见脱细胞羊膜从纳米纤维膜上脱离开。由未经处理的pcl纳米纤维膜制得的复合膜(对比例2),脱细胞羊膜很容易就可以从未处理的pcl纳米纤维膜上剥离下来。结果说明,施加压力并对纤维膜表面进行处理,有利于纳米纤维膜与脱细胞羊膜之间的稳定贴附。
(2)可操作性
复合膜的可操作性通过观察利用镊子夹住干燥或复水的膜时,复合膜所呈现的状态进行评价。
图11显示了脱细胞羊膜和不同厚度的pcl-dam复合膜在干燥和复水状态下的形态。图12显示了脱细胞羊膜,pla-dam复合膜复合膜和plga-dam复合膜在干燥和复水状态下的形态。如图所示,脱细胞羊膜在复水后粘附在一起,难以展开;而复合膜在复水之后很容易用镊子夹持,并呈伸展状态。
(3)亲水性
测试脱细胞羊膜、pcl-dam复合膜(厚度:40μm,80μm,120μm)、表面羧基化处理并活化的pcl纳米纤维膜(厚度:80μm)和未处理的pcl纳米纤维膜(厚度:80μm)的含水率,过程如下:剪取冷冻干燥后的膜,每个样品的尺寸为1cm×1cm。称重(wd)。之后放置于37℃的双蒸水中复水10分钟。贴附在载玻片上,竖直放置1min使表面水滴落。从载玻片上取下,再次称重(ws)。
按照以下公式计算含水率:watercontent(%)=[(ws–wd)/ws]×100。图13显示了测试结果。从图中可以看出,复合膜具有与脱细胞羊膜和表面羧基化处理的pcl纳米纤维膜(treatednf)相近的含水率,含水率均在80%左右,说明复合膜在复水时表现出了良好的亲水性。
(4)抗拉性和韧性
对脱细胞羊膜(dam)和厚度均为40μm的pcl-dam复合膜、pla-dam复合膜和plga-dam复合膜,进行应力应变曲线(stress-straincurve)测试。过程如下:剪取冷冻干燥后的膜,呈哑铃型,哑铃型膜的两端为1cm×1cm,中央为1mm×2mm。工字型膜的两端固定到力学测试仪(boseenduratecelf3200)的金属夹持钳上,磷酸缓冲液浸润膜2min后,以0.5mm/min的速度进行拉伸。测量可获得应力应变曲线,弹性模量(elasticmodulus),最大应变(straintofailure),最大拉伸强度(ultimatetensilestrength),以及韧度(toughness)。
脱细胞羊膜和复合膜的应力应变曲线(stress-straincurve)如图14所示。plga-dam复合膜的应力应变曲线陡峭上升和下降,曲线峰值最高;pla-dam复合膜的曲线缓慢上升和下降;pcl-dam复合膜的曲线更为缓慢地上升和下降,脱细胞羊膜的曲线缓慢上升,但曲线峰值显著低于三种复合膜。表明脱细胞羊膜具有较好的弹性,但最大拉伸强度最弱。
图15显示了其他力学测试结果:(a)弹性模量(elasticmodulus),(b)最大应变(straintofailure),(c)最大拉伸强度(ultimatetensilestrength),以及(d)韧度(toughness)。如图所示,与三种复合膜相比,复水后的脱细胞羊膜的弹性模量(elasticmodulus)最低,表明其弹性最大。但其最大拉伸强度(ultimatetensilestrength)及韧度(toughness)均为最低,且显著低于三种复合膜。表明复合膜的抗拉性能和韧性优于羊膜。
(5)抗缝线牵拉性
对脱细胞羊膜、80μm厚pcl-dam复合膜和未处理的80μm厚pcl纳米纤维膜进行缝线延伸(sutureextension)测试,过程如下:剪取冷冻干燥后的膜1cm×2cm。膜的一端固定到力学测试仪(boseenduratecelf3200)的金属夹持钳上,另一端在中央距边缘2mm处穿入7-0的尼龙缝线。缝线的一段固定到另一侧的金属夹持钳上。磷酸缓冲液浸润膜2min后,以0.2mm/s的速度对膜进行拉伸。
图16显示了测试结果。如图所示,单独的脱细胞羊膜在缝线位移不到2mm时就被缝线撕裂开;而对于pcl-dam复合膜(cm)和pcl纳米纤维膜(nf),随着缝线位移的增大,针孔越来越长,但并没有撕裂。结果表明,复合膜可以很好地抵抗缝线牵拉。
实施例6pcl-dam复合膜的微观形貌表征
图17显示了利用扫描电镜观察到的施加压力条件下和未施加压力条件下制得的pcl-dam复合膜的表面结构,图中标尺为10μm。如图所示,未施加压力制得的复合膜中,pcl纳米纤维膜(nf)虽然可以通过化学作用与脱细胞羊膜结合在一起,但是脱细胞羊膜表面并未呈现pcl纳米纤维的形态(图17a,17d),表明脱细胞羊膜与pcl纳米纤维膜的结合较弱。施加压力制得的复合膜中,pcl纳米纤维的形态在脱细胞羊膜表面清晰可见(图17b,c,e,f),表明脱细胞羊膜与pcl纳米纤维膜的结合紧密,形成一个统一的复合结构。
图18显示了天然羊膜和pcl-dam复合膜的横切面。图18a-18c为横切面经h&e染色后的光学显微照片,图中标尺为20μm。图18a显示了,天然羊膜由一层表皮细胞以及海绵状的基质结构组成。图18b和18c显示了,复合膜的横切面上,pcl纳米纤维膜(nf)已并入脱细胞羊膜的基质中,脱细胞羊膜和pcl纳米纤维膜交叠在一起。图18d-18f为横切面的扫描电镜照片,18d、18e和18f中的标尺分别为10μm、2μm、1μm。复合膜的超微结构显示,pcl纳米纤维膜与脱细胞羊膜的结合非常紧密(图18e,18f)。结果表明,通过物理和化学的相互作用,pcl纳米纤维膜和脱细胞羊膜成功形成了复合膜。
实施例7评估复合膜的安全性和对细胞形态和增殖的影响
(1)安全性测试
剪取脱细胞羊膜、实施例3制得的pcl-dam复合膜、pcl纳米纤维膜1cm×1cm。浸入200μlf12/dmem低糖培养基(含10%fbs和1%penicillin/streptomycin)中48小时,获得膜材料的浸出液。角膜成纤维细胞以103cells每孔的数量种植到96孔板中培养24小时。将细胞培养基替换为膜的浸出液,或新鲜的培养基(阳性对照),或5%的dmso(阴性对照)。培养72小时后,弃掉培养基,加入10%
(2)细胞形态检测
将角膜成纤维细胞种植到脱细胞羊膜、实施例3制得的pcl-dam复合膜、pcl纳米纤维膜和组织培养用聚苯乙烯(tcps)细胞培养板上。用无血清或者含10%的血清培养基进行培养。培养7天后,将用4%的多聚甲醛细胞固定10min。磷酸缓冲液清洗后,0.1%tritonx-100处理5min。磷酸缓冲液清洗后,加入fluorescentphallotoxins使用液(alexa
图20显示了在无血清及有血清的培养条件下,角膜成纤维细胞在脱细胞羊膜(dam)、pcl-dam复合膜(cm)、pcl纳米纤维膜(nf)以及tcps细胞培养板(tcps)上培养7天之后的形态,图中标尺为50μm。如图20所示,在无血清的培养基中,细胞在脱细胞羊膜、pcl-dam复合膜和细胞培养板上呈现出常规的梭形,而在pcl纳米纤维膜上,细胞几乎未伸展开。在含血清的培养基中,细胞在脱细胞羊膜、pcl-dam复合膜以及细胞培养板上长满,形成细胞层。在pcl纤维膜上,细胞未形成细胞层。这一结果表明,与脱细胞羊膜类似,本发明的复合膜为细胞生长提供了合适的贴附表面,利于细胞的粘附、伸展、生长。
(3)细胞增殖能力检测
研究无血清培养条件下,细胞在脱细胞羊膜、实施例3制得的pcl-dam复合膜、pcl纳米纤维膜和tcps细胞培养板上的增殖情况。
过程如下:
cellcrowntminsert购自sigma。将膜置于cellcrowntminsert的圆柱形支架和圆形卡套之间,制成圆筒状的膜支架。在无血清培养条件下,细胞以5×103cells/cm2的密度种植到不同膜支架上。分别在1天、3天、5天、7天对细胞的活性进行检测。弃掉培养基,加入10%
图21显示了无血清培养条件下,细胞在不同膜上的增殖情况。所有荧光检测数值均与第一天的数值相比。如图所示,无血清培养条件下,从培养第1天到第7天,培养在pcl纳米纤维膜(nf)和tcps细胞培养板(tcps)上,细胞活性逐渐下降。而培养在脱细胞羊膜(dam)表面时,从第1天到第3天,细胞活性升高。3天之后,开始下降。在pcl-dam复合膜(cm)上,与羊膜上类似,从第1天到第5天,细胞活性逐渐升高。5天之后,开始下降。7天之后已经没有净增长。这表明,本发明的复合膜很好地保留了羊膜中的营养物质,为细胞生长提供了营养物质。
实施例8评估复合膜的抗炎作用
进一步,复合膜的抗炎作用被评估,以检测复合膜是否具有与羊膜类似的促进巨噬细胞从m1型向m2型转变的作用,过程如下:
首先分离培养小鼠的骨髓间充质细胞来源的巨噬细胞,之后将巨噬细胞种植到脱细胞羊膜、实施例3制得的pcl-dam复合膜、pcl纳米纤维膜及tcps细胞培养板上,施加炎症刺激因子(lps和ifnγ))。48小时之后,用real-timeq-pcr方法检测m1和m2亚类巨噬细胞的标志物的表达。
图22显示了在不同浓度的炎症刺激因子的作用下,小鼠骨髓来源的巨噬细胞种植到脱细胞羊膜(dam)、pcl-dam复合膜(cm)、pcl纳米纤维膜(nf)以及tcps细胞培养板(tcps)上培养48小时后,m1型巨噬细胞和m2型巨噬细胞标志物的表达。如图所示,未添加刺激因子时(lps:0ng/ml;ifnγ:0ng/ml),m1和m2的标志物在不同的基质上具有类似的表达。添加刺激因子lps和ifnr后,m1标志物(il1b,il6,inos和cd86)随着刺激因子浓度的增高,表达量逐渐增高。m2标志物cd206的表达逐渐降低。
与培养在细胞培养板中的细胞相比,在低浓度的刺激因子作用下,培养在脱细胞羊膜和复合膜上的细胞的m1的标志物inos的表达显著降低。在高浓度的刺激因子作用下,m1标志物il1b,inos和cd86均显著性降低。无论在低浓度还是高浓度的刺激因子的作用下,较之培养在细胞培养板上,培养在脱细胞羊膜和复合膜上的细胞,m2的标志物arg1和cd206均显著上升。因此,在炎症环境下,脱细胞羊膜和pcl-dam复合膜能显著降低促炎症因子的表达,提高抗炎因子的表达。这表明,本发明的复合膜具有类似于羊膜的抗炎特性,可促进巨噬细胞从促炎症类型转变为抑制炎症的类型。
实施例9获得平行电纺丝凝胶纤维膜并制备脱细胞羊膜-胶原纤维复合膜(简称为“胶原-dam复合膜”)
与pcl纤维膜类似,凝胶电纺丝膜(比如电纺丝胶原纤维膜),也可以与脱细胞羊膜形成复合膜。将这些凝胶材料溶解于水溶性溶液中,然后进行电纺丝,在这一过程中加入交联剂进行交联。
以胶原为例。首先制备1%(wt%)的胶原(elastinproductscompany)溶液。按需称取一定量的胶原,溶解于75mm的柠檬酸溶液(ph=3.7)中。将胶原溶液加入到针筒中,放置27g针头。整个针管放置于电动注射泵上,喷出的电纺丝收集到盛有50mg/ml的edc交联剂的圆盘收集装置中。edc能快速地将分布在胶原上的氨基和羧基交联,进一步形成微米纤维。圆盘收集装置的旋转速度为50rpm。电动注射泵在电动平移台上移动,获得宽度为2cm的平行纤维膜。收集到的凝胶纤维膜通过一系列梯度浓度(0到100%)的脱水试剂(例如乙醇)脱水。
图23显示了edc交联的平行胶原纤维的表面形态,图23a为放大25倍的图像,图23b为放大100倍的图像。如图所示,胶原纤维表面规整,并且平行排布。
脱水后的胶原纤维膜用50mmedc/nhs室温处理2小时。之后,用pbs充分清洗。将脱细胞羊膜的上皮面朝下,基质面朝上平铺于特氟龙膜上。将胶原纤维膜放置于脱细胞羊膜的基质面。在胶原纤维膜上放置另一片特氟龙膜。将整个复合结构放置于2块钢板之间。将钢板放置于台钳的钳口中。转动钳杆,施加压力1mp。放置4℃反应12小时。移除钢板和特氟龙膜之后,对复合膜进行冷冻真空干燥。
实施例10胶原-dam复合膜的透明度检测
对胶原纤维膜、脱细胞羊膜和胶原-dam复合膜的透明度进行检测。如图24所示,无论在干燥还是复水状态下,三种膜下的字母“jhu”都清晰可见。单纯胶原纤维膜的透明度甚至稍强于羊膜。这表明,胶原纤维膜一方面对脱细胞羊膜起到了物理支持作用,同时也没有削弱羊膜的透明度。
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公开的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!