一种基于豆腐的组织工程3D支架及其制备方法和应用与流程
本发明属于组织工程技术领域。更具体地,涉及一种基于豆腐的组织工程3D支架及其制备方法和应用。
背景技术:
因组织或器官的损伤或缺失造成身体机能的异常是影响人类健康的重要原因。目前,能够满足临床需求的器官捐献量远远不够,自体移植和同种异体移植在临床上虽有一定成效,但对患者造成的不良反应长期存在,在临床上应用非常有限。随着医疗发展的需求,组织工程学应运而生,它应用生命科学和工程学的原理来研发损伤组织的功能性替代物从而实现机体功能的恢复。其研究的主要内容是要制备出能够模拟人体细胞外基质的生物支架,使细胞在其中生长并促进新组织形成。获得生物相容性良好、性能优异的生物支架是组织工程研究的基础。理想的生物支架能够为细胞提供生长繁殖的场所并能诱导形成具有特定几何形状的组织结构,植入体内后能提供一定的力学性能,并随新组织形成而逐渐降解。
目前用于制备组织工程支架的材料主要分为两大类,一类是人工合成材料,另一类是天然来源材料。人工合成可降解高分子材料是目前组织工程支架制备中的主体材料,其优势在于在合成过程中易于实现对其性能的调控,常见的包括聚氨酯、聚乳酸、聚己内酯等,但其性能可调控的范围有限,且价格昂贵,在体内降解的产物存在诱发炎症反应的风险,不利于细胞黏附生长。相比之下,许多天然来源的生物材料具有优异的生物相容性,利于细胞在其表面生长、繁殖和分化;同时,由于其来源广泛,易于加工成型,因此具有很大的应用前景。
目前,蛋白质类的明胶、蚕丝和多糖类的纤维素、壳聚糖等天然有机高分子由于具有良好的生物相容性,广泛地被用作组织工程支架的原材料。但这些支架都存在一些缺陷,比如壳聚糖的降解过程不易控制,机械性能欠佳;明胶存在着力学性能较差、质脆、耐水性差等缺点;蚕丝蛋白具有高的机械强度,但易于降解而不稳定。因此,本领域迫切需要提供一种简单易行、产品性能可靠的组织工程3D支架的制备方法。
技术实现要素:
本发明要解决的技术问题是克服上述现有技术的缺陷和不足,提供一种基于豆腐的组织工程3D支架及其制备方法和应用。本发明的组织工程3D支架具备多孔结构,基质内部结构疏松,相互连通的孔道多而明显,符合细胞生长对支架材料结构的要求,且其制备工艺简单,易于获得。
本发明的目的是提供一种基于豆腐的组织工程3D支架的制备方法。
本发明的另一个目的是提供利用上述方法制备得到的组织工程3D支架。
本发明的再一个目的是提供上述组织工程3D支架在体外进行细胞培养和扩增或在制备创伤修复材料方面的应用。
本发明的再一个目的是提供利用上述组织工程3D支架在体外进行细胞培养或扩增的方法。
本发明的目的通过下述技术方案来实现:
一种基于豆腐的组织工程3D支架的制备方法,将豆腐先预冻,再经冻干处理,即可得到所述基于豆腐的组织工程3D支架。
基于该方法制备的3D支架能够很好地支持细胞在其表面黏附和增殖,是一种良好的天然来源的组织工程支架,在组织工程领域具有很好的应用前景。
本发明所述的豆腐可按常规的豆腐食品制备工艺制得。豆腐来源丰富,含有丰富的蛋白质,可为细胞生长提供良好的营养环境,制成的3D支架的力学性能与生物性能均能满足细胞培养需要,对细胞的生长具有促进作用,可广泛应用于组织工程的研究中;而且相对于其他天然来源的生物材料,基于传统豆腐食品工艺的3D支架其制备工艺更简单,更容易获得。
具体优选地,所述豆腐由以下步骤制备得到:
S1.将大豆(黄豆)以去离子水浸泡发胀至少6h,沥干水后,室温下匀浆,得豆浆;
S2.向豆浆中加入1.5~2.5倍体积的90~100℃的去离子水进行稀释,得原浆稀释液;
S3.将原浆稀释液趁热过滤,向滤液中加入卤盐,析出豆腐花沉淀后,去除多余的水分,趁热压榨,即得豆腐。
优选地,步骤S3中所述卤盐的加入量占大豆用量的2.5%~4%。
优选地,制备好卤盐溶液后,将其直接加入到滤液中,直到出现80%~90%的豆腐花沉淀为止。
本发明采用的是天然大豆,不需要对大豆进行提纯,能够有效避免与有机试剂的接触,最大限度地保证材料的生物安全性,同时尽可能保留了大豆中的功能成分,获得的微观结构呈现不规则多孔状,益于细胞黏附和生长。
优选地,所述冻干处理的方式为真空冷冻干燥。
优选地,真空度控制为9~12Pa。
更优选地,真空度控制为10Pa。
优选地,冻干温度为-80℃~-40℃。
更优选地,冻干温度为-60℃~-50℃。
优选地,冻干时间至少为36h。如果冷冻干燥的时间不足,其中残余的冰会融化成水,容易导致支架内部坍塌,影响结构的均一性,后期影响细胞的分布均匀,不利于细胞的增殖。
更优选地,冻干时间为36~96h。
最优选地,冻干时间为48h。
优选地,预冻温度为-80℃~-0℃。此预冻温度下,能避免孔隙率过小和孔径过宽,同时保证3D支架的机械性能最佳,得到适合细胞生长的产品。
进一步优选地,预冻温度为-60℃~0℃。
更进一步优选地,预冻温度为-20℃。该条件下能最大限度的保证了结构均一,孔径大小合适,力学性能稳定,细胞增殖率相对最佳。
优选地,预冻时间为4~24h。此预冻时间下能使材料内部稳定形成三维多孔结构,得到尺寸稳定性好的产品。在未充分冻干之前,冻干的时间对支架的结构影响较大;未充分冻干前,冻干时间越长,残余的水分越少,孔隙结构越均一,越利于细胞均匀的分布和生长。
进一步优选地,预冻时间为6~12h。
更进一步优选地,预冻时间为12h。预冻时间过短会造成孔结构密度过低,机械性能下降,而预冻时间为12h能最大程度避免上述情况产生。
作为一种优选的方案:将豆腐先于-20℃预冻12h,然后在真空冷冻干燥48h。在此条件下,得到的基于豆腐的组织工程3D支架除了具有合适的孔径和孔隙率外,其机械性能较好、力学强度较大,产品性能可靠,能充分满足体外细胞生长的需要,可以满足组织工程临床应用的需求。
本发明还涉及了上述任一所述的制备方法制备得到的基于豆腐的组织工程3D支架。
三维多孔支架的结构、孔隙率、孔径及孔间的连通性都对细胞的迁移、生长、黏附、增殖、分化以及细胞外基质的分泌和分布都有重要的影响。
所述的组织工程3D支架内部为疏松多孔结构,细胞易于在支架内部黏附和增殖;孔洞之间相互连通,利于易于营养物质的输送和代谢废物的排出。
所述的组织工程3D支架的孔径为10~25μm;孔隙率为50%~80%。其中,孔隙率的定义为:多孔的固体材料如砖材、岩石、钢材、矽等内部孔隙的体积占材料总体积的百分数,表示的是材料孔隙的多少。该孔径和孔隙率适宜用于表皮创伤修复及成纤维细胞、内皮细胞或干细胞的体外培养扩增,其细胞增殖率达70%以上。
所述的组织工程3D支架的压缩模量为15~32Mpa,具备一定的力学强度,适用于创伤修复或在体外进行细胞培养和扩增。
在0.01M PBS中的降解实验表明,所述的组织工程3D支架三天后失重率在30%左右,再延长时间,失重率基本不变,降解缓慢。
本发明还提供了上述的基于豆腐的组织工程3D支架在体外进行细胞培养和扩增中的应用或在制备创伤修复材料方面的应用。豆腐支架的主体结构具有良好的生物相容性,同时,以传统豆腐制备工艺为基础的3D支架制备方法最大限度的保留了大豆中多种易于细胞生长的功能成分,如少量矿物质等,使得细胞在支架中能够很好的实现黏附、生长和增殖。
优选地,应用于制备软组织创伤修复材料。
更优选地,应用于制备表皮创伤修复材料(主要用作伤口敷料)。
更优选地,应用于成纤维细胞、内皮细胞或干细胞的体外培养或扩增。
另外,本发明还提供了一种细胞的体外培养方法,具体为:以上述任一所述的基于豆腐的组织工程3D支架为载体进行细胞培养或扩增。
优选地,所述培养方法为:将所述的基于豆腐的组织工程3D支架经洗涤除去溶出物后,先于-80℃~-20℃冰冻后,再转移至冻干机中进行冻干12~48h,环氧乙烷气体灭菌8~24h,再用于细胞培养或扩增。
更优选地,灭菌时间为24h。
优选地,洗涤剂为无菌PBS溶液或无血清的完全培养基(洗涤至培养基颜色不变为止)。
具体地,无血清的完全培养基是指高糖型DMEM培养基。
优选地,所述细胞包括但不限于成纤维细胞、内皮细胞或干细胞。
与现有技术相比,具有以下有益效果:
1、本发明以豆腐为原料制备组织工程3D支架,细胞在支架中能够很好的实现黏附、生长和增殖,对细胞的生长具有明显的促进作用。
2、本发明操作简易,条件易于实现,重复性良好,制备的产品综合性能稳定可靠,在组织工程领域具有广泛的应用前景。
附图说明
图1中A和B均为冻干后获得的基于豆腐的组织工程3D支架,呈疏松多孔结构。
图2中A为基于豆腐的组织工程3D支架的SEM图。
图3中A和B为基于豆腐的组织工程3D支架上培养3T3细胞后对细胞质和细胞核进行染色的结果,细胞形态良好。
图4为基于豆腐的组织工程3D支架进行活/死细胞染色的结果;其中,Scalebar=50μm,绿色代表活细胞,红色代表死细胞。
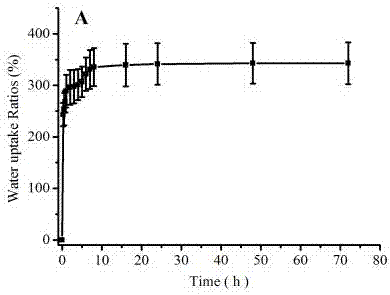
图5为基于豆腐的组织工程3D支架材料在0.01M PBS中随时间的吸水率变化。
图6为基于豆腐的组织工程3D支架材料在0.01M PBS中随时间的降解率变化。
具体实施方式
以下结合具体实施例来进一步说明本发明。以下实施例为本发明较佳的实施方式,但并不对本发明的保护范围做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1 一种基于豆腐的组织工程3D支架的制备及细胞培养
1、制备方法:
(1)制备豆腐:将大豆和水等原材料按传统工艺制备成豆腐;
(2)合成组织工程3D支架:将获得的豆腐切割成长、宽、高均为2cm的小立方体,先于-20℃预冻12h,然后于-60℃~-50℃下真空冻干48h(真空度控制为10Pa),即可获得基于豆腐的组织工程3D支架。
2、细胞培养
(1)将制备好的基于豆腐的组织工程3D支架用无菌PBS溶液洗涤2~3次,除去溶出物,先于-80℃冰冻后,转移至冻干机中进行冻干48h,环氧乙烷气体灭菌约24h;
(2)将薄层圆形切片转移到6孔板中,加入DMEM完全培养基润湿,以培养基洗涤2~3遍,将3T3细胞滴加于灭菌后的支架表面后,置于37℃培养箱中培养48h。
3、产品性能及特征
(1)本实施例制备的基于豆腐的组织工程3D支架如图1中A图所示。该支架呈疏松多孔结构,孔洞之间相互连通,而且材料内部微孔丰富,在形貌上保持了豆腐原有的天然结构并得到了适当的松散。
(2)由图2中A图可见,SEM观察下3D支架的表面形貌和内部的微观结构:3D支架表面呈多孔网络状,有大小不同的孔分布,内部结构疏松,相互连通的孔道多而明显,符合细胞生长对支架材料结构的要求。
(3)对细胞核和细胞质进行荧光标记,观察细胞的形态。如图3中A图所示,在该支架中有大量细胞贴附,细胞形态良好。
(4)如图4所示,活/死细胞染色时,只存在极少的死细胞(红色点点,白色箭头指向处),证明该支架生物安全性良好。
(5)如图5所示,在0.01M PBS中,的吸水实验表明,该组织工程3D支架材料10h后吸水率为350%,再延长时间,其吸水率基本不变;如图6所示,在0.01M PBS中的降解实验表明,该组织工程3D支架材料三天后失重率为30%,再延长时间,其失重率基本不变,降解缓慢。说明该支架材料耐水性好,性质稳定可靠。
实施例2 一种基于豆腐的组织工程3D支架的制备及细胞培养
1、制备方法:
(1)制备豆腐:将大豆以去离子水浸泡发胀6h,沥干水后,室温下匀浆,得豆浆;向豆浆中加入2倍体积的90℃的去离子水进行稀释,得原浆稀释液;将原浆稀释液趁热过滤,向滤液中加入卤盐(卤盐的加入量占大豆用量的2.5%~4%),析出豆腐花沉淀后,去除多余的水分,趁热压榨,即得豆腐。
(2)合成组织工程3D支架:同实施例1。
2、细胞培养方法同实施例1。
3、产品性能及特征
(1)本实施例制备的基于豆腐的组织工程3D支架如图1中B图所示。该支架呈疏松多孔结构,孔洞之间相互连通,而且材料内部微孔丰富,在形貌上保持了豆腐原有的天然结构并得到了适当的松散。
(2)该3D支架表面呈多孔网络状,有大小不同的孔分布,内部结构疏松,相互连通的孔道多而明显,符合细胞生长对支架材料结构的要求。
(3)对细胞核和细胞质进行荧光标记,观察细胞的形态。如图3中B图所示,在该支架材料中有大量细胞贴附,细胞形态良好。
(4)活/死细胞染色显示,该支架材料生物安全性良好。
(5)其吸水率和失重率随时间延长后基本不变,说明该支架材料耐水性好,产品性质稳定可靠。
实施例3 一种基于豆腐的组织工程3D支架的制备及细胞培养
1、制备方法:
其他条件同实施例1,不同之处在于:
将获得的豆腐切割后,先于0℃预冻24h,然后于-80℃~-70℃下真空冻干36h。
2、细胞培养方法同实施例1。
3、产品性能及特征
该支架在形貌上保持了豆腐原有的天然结构并得到了适当的松散;其表面呈多孔网络状,有大小不同的孔分布,内部结构疏松,相互连通的孔道多而明显;在该支架中有大量细胞贴附,细胞形态良好;且生物安全性良好、耐水性佳,产品性质稳定可靠。
实施例4 一种基于豆腐的组织工程3D支架的制备及细胞培养
1、制备方法:
其他条件同实施例1,不同之处在于:
将获得的豆腐切割后,先于-30℃预冻8h,然后于-60℃~-50℃下真空冻干36h。
2、细胞培养方法同实施例1。
3、产品性能及特征
该支架在形貌上保持了豆腐原有的天然结构并得到了适当的松散;其表面呈多孔网络状,有大小不同的孔分布,内部结构疏松,相互连通的孔道多而明显;在该支架中有大量细胞贴附,细胞形态良好;且生物安全性良好、耐水性佳,产品性质稳定可靠。
实施例5 一种基于豆腐的组织工程3D支架的制备及细胞培养
1、制备方法:
其他条件同实施例1,不同之处在于:
将获得的豆腐切割后,先于-50℃预冻12h,然后于-60℃~-50℃下真空冻干48h。
2、细胞培养方法同实施例1。
3、产品性能及特征
该支架材料在形貌上保持了豆腐原有的天然结构并得到了适当的松散;其表面呈多孔网络状,有大小不同的孔分布,内部结构疏松,相互连通的孔道多而明显;在该支架材料中有大量细胞贴附,细胞形态良好;且生物安全性良好、耐水性佳,产品性质稳定可靠。
实施例6 一种基于豆腐的组织工程3D支架的制备及细胞培养
1、制备方法:
其他条件同实施例1,不同之处在于:
将获得的豆腐切割后,先于-80℃预冻4h,然后于-50℃~-40℃下真空冻干96h。
2、细胞培养方法同实施例1。
3、产品性能及特征
该支架在形貌上保持了豆腐原有的天然结构并得到了适当的松散;其表面呈多孔网络状,有大小不同的孔分布,内部结构疏松,相互连通的孔道多而明显;在该支架中有大量细胞贴附,细胞形态良好;且生物安全性良好、耐水性佳,产品性质稳定可靠。
实施例7 预冻时间的优化
参考实施例1的方法,以预冻时间为单因素变量,研究预冻时间对所制备支架材料的性能影响。其中,预冻时间为1h时,支架材料的各性质数据如表1所示。
结果显示,不同预冻时间条件下制备得到的支架材料,其孔径、孔隙率、压缩模量、细胞增殖率都会有明显的改变。
综合各因素,预冻时间的优选范围为4~24h,最优选为6~12h。
实施例8 真空冻干温度的优化
参考实施例1的方法,以真空冻干温度为单因素变量,研究真空冻干温度对所制备支架材料的性能影响。
结果显示,不同真空冻干温度下制备得到的支架材料,其孔径、孔隙率、压缩模量、细胞增殖率都会有明显的改变。其中,冻干温度为0℃时,支架材料的各性质数据如表1所示。
综合各因素,真空冻干温度的优选范围为-80℃~-40℃,最优选为-50℃~-60℃。
实施例9 真空冻干时间的优化
参考实施例1的方法,以真空冻干时间为单因素变量,研究真空冻干时间对所制备支架材料的性能影响。其中,冻干时间为24h时,支架材料的各性质数据如表1所示。
结果显示,不同真空冻干时间条件下制备得到的支架材料,其孔径、孔隙率、压缩模量、细胞增殖率都会有明显的改变。
综合各因素,真空冻干时间的优选范围为不低于36h,优选为36~96h。
对各实施例产品进行性能测试,所得结果如下:
- 还没有人留言评论。精彩留言会获得点赞!