二甲双胍及联合二甲双胍与阿糖胞苷在清除骨髓微环境残留AML细胞的应用及药物组合物的制作方法
本发明涉及一种二甲双胍的新用途,特别涉及二甲双胍及联合二甲双胍与阿糖胞苷在清除骨髓微环境残留AML细胞的应用及药物组合物。
背景技术:
急性髓系白血病(acute myeloid leukemia,AML)是髓系原始细胞恶性克隆增殖性疾病,克隆性白血病细胞因为增殖失控、分化障碍、凋亡受阻等机制在骨髓和其他造血组织中大量增殖累积,并浸润其他非造血组织和器官,同时抑制正常造血功能。临床可见不同程度的贫血、出血、感染、发热以及肝、脾、淋巴结肿大和骨骼疼痛。AML发病率居成人白血病之首;随着我国老年化进程的加快,发病率逐年提高。近十年来随着新药的发现、化疗方案的优化和造血干细胞移植技术的发展,AML患者缓解率较前有明显提高,但长期无病生存时间并未得到明显改善。骨髓微环境中残留的、并受微环境保护的白血病细胞在AML复发和发生耐药中发挥重要作用。系列研究表明,骨髓微环境中基质细胞(如脂肪细胞、成骨细胞、间充质干细胞等)均可为血液肿瘤细胞提供大量信号支持,保护肿瘤细胞免遭化疗药物的杀伤。然而,骨髓微环境中基质细胞与AML细胞相互作用的机制非常复杂,迄今为止,尚未能完全阐明并且临床上仍然缺乏行之有效的可以清除骨髓微环境中AML细胞的治疗方案,因此,积极寻找能够增强微环境中AML细胞化疗药物敏感性的药物,从而结合常规化疗药物有效清除骨髓微环境中残留的AML细胞对于延长患AML者的无病生存时间、减少复发具有十分重要的现实意义。
二甲双胍(metformin,Met)是一种2型糖尿病患者的常用临床用药。近年来研究发现,Met不仅能够降低糖尿病患者的血糖水平,还能使癌症患者受益,但Met的具体抗癌机制尚未完全阐明。
技术实现要素:
本发明的目的在于克服现有技术的缺陷,解决现有技术中骨髓微环境中AML细胞化疗药物敏感性差、延长患AML者的无病生存时间、减少复发的技术问题,提供二甲双胍及联合二甲双胍与阿糖胞苷在清除骨髓微环境残留AML细胞的应用及药物组合物。
本发明通过以下技术方案予以实现。
二甲双胍在清除骨髓微环境残留急性髓系白血病细胞的应用。
联合二甲双胍与阿糖胞苷在清除骨髓微环境残留急性髓系白血病细胞的应用。
一种药物组合物,它包括二甲双胍与阿糖胞苷。
进一步地,所述二甲双胍的浓度为2~5mM,阿糖胞苷的浓度为5~50μM。
进一步地,所述药物组合物的剂型为片剂、糖衣丸、明胶胶囊、可注射制剂、可饮用混悬剂或者可崩解糊剂。
本发明与现有技术相比具有以下有益效果。
本发明提供的二甲双胍及联合二甲双胍与阿糖胞苷在清除骨髓微环境残留AML细胞的应用及药物组合物,能够抑制基质细胞向急性髓系白血病细胞传递线粒体导致的急性髓系白血病细胞线粒体数量的增加,增强微环境中急性髓系白血病细胞对化疗药物的敏感性,有利于清除骨髓微环境中残留的急性髓系白血病细胞尤其是白血病起始细胞,延长患AML者的无病生存时间、减少复发。
附图说明
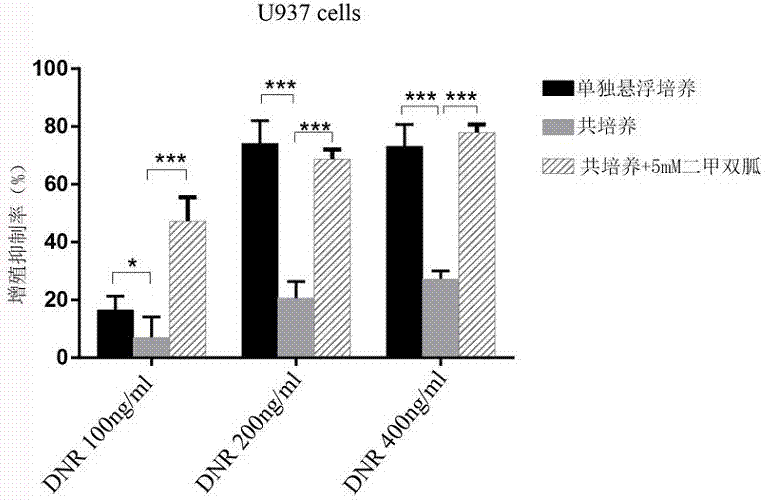
图1共培养体系中加入Met对U937细胞对阿糖胞苷敏感性影响的条形图。
图2共培养体系中加入Met对U937细胞对柔红霉素敏感性影响的条形图。
图3共培养体系中加入Met对HL-60细胞对阿糖胞苷敏感性影响的条形图。
图4共培养体系中加入Met对HL-60细胞胞对柔红霉素敏感性影响的条形图。
图5激光共聚焦显微镜检测HL-60细胞获取基质细胞线粒体示意图。
图6激光共聚焦显微镜检测U937细胞获取基质细胞线粒体示意图。
图7流式细胞仪检测二甲双胍对HL-60细胞线粒体数量影响示意图。
图8流式细胞仪检测二甲双胍对U937细胞线粒体数量影响示意图。
图9二甲双胍对HL-60细胞线粒体数量影响统计示意图。
图10二甲双胍对U937细胞线粒体数量影响统计示意图。
图11流式细胞仪检测二甲双胍对基质细胞-HL-60细胞线粒体传递影响示意图。
图12流式细胞仪检测二甲双胍对基质细胞-U937细胞线粒体传递影响示意图。
图13流式细胞仪检测二甲双胍对HL-60细胞-基质细胞线粒体传递影响示意图。
图14流式细胞仪检测二甲双胍对U937细胞-基质细胞线粒体传递影响示意图。
图15流式细胞仪检测二甲双胍联合阿糖胞苷对小鼠骨髓与脾脏中AML细胞线粒体数量影响示意图。
图16二甲双胍联合阿糖胞苷对小鼠骨髓与脾脏中AML细胞集落形成数量影响示意图。
图17二甲双胍联合阿糖胞苷对二代移植小鼠生存期影响示意图。
图中,*表示P<0.05,**表示P<0.01,***表示P<0.001。
具体实施方式
下面结合实施例对本发明做详细说明:本实施例是以本发明技术方案为前提进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下面的实施例。
本发明采用建立AML细胞与骨髓基质细胞的共培养体系、CCK-8细胞毒性试验、线粒体探针标记、流式细胞术、建立人AML小鼠模型等技术手段从体外到体内系统研究Met联合化疗药物对骨髓微环境中AML细胞的清除作用。研究主要分为以下三部分:①采用CCK-8细胞毒性实验检测AML细胞化疗敏感性,即将AML细胞粘附于基质细胞表面生长以建立共培养体系,共培养体系中加入或不加Met。共培养24h后,采用免疫磁珠分选共培养体系中的AML细胞,CCK-8检测共培养前后AML细胞对阿糖胞苷(cytosine arabinoside,Ara-C)与柔红霉素(daunorubicin,DNR)的药物敏感性;②采用不同线粒体荧光探针分别标记AML细胞与基质细胞,通过流式细胞术检测Met对共培养体系中AML细胞与基质细胞线粒体数量改变的影响,尤其是分析Met对AML细胞中来源于基质细胞线粒体数量的影响;③通过在免疫缺陷鼠NCG小鼠中建立人AML模型,观察Met联合化疗药物对体内微环境中AML细胞的清除作用。
本实施例的具体实验方法与结果如下:
1、CCK-8法细胞毒性实验检测Met对AML细胞化疗敏感性的影响:
①取对数生长期HS-5细胞。胰酶消化后记数1.0×105/ml接种6孔板,5%CO2饱和湿度培养箱培养48h;
②取对数生长期的AML细胞(HL-60与U937细胞),计数2.0×105/ml;
③建立共培养体系:待6孔板中HS-5细胞融合率达80%-90%后,弃掉培养基,PBS洗涤2次,每孔加入AML细胞,每孔1ml,5%CO2饱和湿度培养箱培养24h,在共培养体系中加入或不加入Met(2mM或5mM);
④分选AML细胞:CD45+免疫磁珠分选共培养体系中的AML细胞,计数1.0×105/ml接种96孔板,加入不同浓度Ara-C(5、10、50μM)),DNR(100、200、400ng/ml),每个浓度设3个复孔,并设空白对照组;5%CO2饱和湿度培养箱培养24h;
⑤加入CCK-8试剂10μl;
⑥通过酶标仪检测检测450nm和630nm双波长吸光度值(OD值):
⑦计算抑制率细胞增殖抑制率%=[(对照组平均OD值-试验组平均OD值)/(对照组平均OD值)]×100%,实验重复3次。
CCK-8细胞毒性实验结果表明:与骨髓基质细胞株HS-5细胞粘附共培养后,U937细胞与HL-60细胞对Ara-C与DNR的敏感性明显下降,Met可以增强共培养后AML细胞株的化疗敏感性。结果详见表1、表2与附图1-4。
表1共培养体系中加入Met对U937细胞对阿糖胞苷敏感性的影响
表2共培养体系中加入Met对U937细胞对柔红霉素敏感性的影响
表3共培养体系中加入Met对HL-60细胞对阿糖胞苷敏感性的影响
表4共培养体系中加入Met对HL-60细胞胞对柔红霉素敏感性的影响
2、激光共聚焦显微镜观察共培养体系中基质细胞-AML细胞间线粒体传递:
①取对数生长期HS-5细胞。胰酶消化后用MitoTracker Deep Red(20nM)标记30min,计数1.0×105/ml接种6孔板,每孔1ml,5%CO2饱和湿度培养箱培养48h;
②AML细胞(HL-60与U937细胞):取对数生长期的AML细胞,MitoTracker Green(20nM)标记30min,计数2.0×105/ml;
③建立共培养体系:待6孔板中HS-5细胞融合率达80%-90%后,弃掉培养基,PBS洗涤2次,每孔加入计数后的AML细胞,每孔1ml,5%CO2饱和湿度培养箱培养24h;
④分选AML细胞:CD45+免疫磁珠分选共培养体系中的AML细胞;
⑤于激光共聚焦显微镜下观察AML细胞中自身线粒体荧光MitoTracker Green(激发波长488±10nm,发射波长525±10nm),以及来源于基质细胞的线粒体荧光MitoTracker Deep Red(激发波长638±10nm,发射波长660±10nm)。激光共聚焦显微镜观察结果表明:U937细胞或HL-60细胞中除了有绿色标记的自身线粒体外,还有相当数量的呈现红色的来自HS-5细胞的线粒体,说明共培养后AML细胞从基质细胞中获取了相当数量的线粒体。
结果详见附图5:HL-60细胞中除了有绿色标记的自身线粒体外,还有相当数量的呈现红色的来自HS-5细胞的线粒体,说明共培养后HL-60细胞从基质细胞中获取了相当数量的线粒体;附图6:U937细胞中除了有绿色标记的自身线粒体外,还有相当数量的呈现红色的来自HS-5细胞的线粒体,说明共培养后U937细胞从基质细胞中获取了相当数量的线粒体。
3、流式细胞术检测共培养后AML细胞中线粒体数量的变化:
①取对数生长期HS-5细胞。胰酶消化后计数1.0×105/ml接种6孔板,每孔1ml,5%CO2饱和湿度培养箱培养48h;
②取对数生长期的AML(HL-60与U937细胞)细胞,计数2.0×105/ml;
③建立共培养体系:待6孔板中HS-5细胞融合率达80%-90%后,弃掉培养基,PBS洗涤2次,每孔加入计数后的AML细胞,每孔1ml,5%CO2饱和湿度培养箱培养24h,在共培养体系中加或不加Met(2mM或5mM);
④分选AML细胞:CD45+免疫磁珠分选共培养体系中的AML细胞;
⑤MitoTracker Green标记:计数单独悬浮培养的AML细胞1.0×106个以及在含或不含Met的共培养体系中培养后的AML细胞1.0×106个,MitoTracker Green(20nM)标记30min,以未经过MitoTracker Green标记的单独悬浮培养的AML细胞作为阴性对照,于流式细胞仪检测MitoTracker Green的平均荧光强度,流式细胞仪分析10000个细胞,检测FITC荧光通道平均荧光强度(Mean Fluorescence Intensity,MFI),实验重复3次。
AML细胞线粒体数量检测结果如下:
①单独悬浮培养的HL-60细胞MFI值为155307.5±10110,在不含有Met的共培养体系中的HL-60细胞MFI值为212976.4±9376,在含有2mM Met的共培养体系中的HL-60细胞的MFI值为179665.8±14582,表明与基质细胞共培养后,HL-60细胞中线粒体数量显著增加(P<0.01);在共培养体系中加入2mM Met,共培养后HL-60细胞的MFI值提高幅度明显减弱,详见图附图7、附图8。该结果表明,与基质细胞共培养后HL-60细胞线粒体数量增加,而Met能够显著降低共培养后HL-60细胞线粒体数量增加的幅度。
②单独悬浮培养的U937细胞MFI值为128621.0±9245,在不含有Met的共培养体系中的U937细胞MFI值为251028.1±38460,在含有5mM Met的共培养体系中U937细胞的MFI值为173121.7±18400,表明与基质细胞共培养后,U937细胞中的线粒体数量显著增加(P<0.01),在共培养体系中加入5mM Met,共培养后的U937细胞的MFI值提高幅度明显减弱(P<0.05),详见附图9、附图10。该结果表明,与基质细胞共培养后U937细胞线粒体数量增加,而Met能够显著降低共培养后HL-60细胞线粒体数量增加的幅度。
4、Met对基质细胞-AML细胞线粒体传递的影响:
①取对数生长期HS-5细胞。胰酶消化后用MitoTracker Deep Red(20nM)标记30min,计数1.0×105/ml,接种6孔板,每孔1ml,5%CO2饱和湿度培养箱培养48h;
②取对数生长期的AML细胞(HL-60与U937细胞),MitoTracker Green(20nM)标记30min,计数2.0×105/ml;
③建立共培养体系:待6孔板中HS-5细胞融合率达80%-90%后,弃掉培养基,PBS洗涤2次,每孔加入计数后AML细胞,每孔1ml,5%CO2饱和湿度培养箱培养24h,在共培养体系中加入或不加入Met(2mM或5mM);
④分选AML细胞:CD45+免疫磁珠分选共培养体系中的AML细胞;
⑤流式细胞仪检测AML细胞中来源于基质细胞的线粒体:无论AML细胞还是HS-5细胞都同时检测AML细胞线粒体标记MitoTracker Deep Red(APC)与HS-5细胞线粒体标记MitoTracker Green(FITC)的荧光强度。
结果如附图11、12所示,单独悬浮培养的AML细胞中几乎没有红色荧光,即Mitotracker Deep Red(APC)荧光;共培养后AML细胞中红色荧光明显增强,波峰显著右移,表明共培养体系中的AML细胞从HS-5细胞中获得了相当数量的线粒体;同时,共培养体系中加入Met后,波峰又出现明显左移,表明Met能够显著抑制HS-5细胞向AML细胞传递线粒体。如附图13、14所示,单独培养的HS-5细胞中几乎没有绿色荧光,即Mitotracker Green(FITC);与HL-60细胞共培养的HS-5细胞中绿色荧光略微增强,波峰稍微右移,提示HL-60可向HS-5细胞间传递很少量的线粒体,但程度远低于HL-60细胞从HS-5细胞获得的线粒体数量,而且Met可抑制这个传递过程;与U937共培养后的HS-5细胞中的绿色荧光强度没有明显改变,依旧极其微弱,说明在共培养体系中由HS-5细胞向白血病细胞传递的线粒体数量很少。
5、Met增强Ara-C对人AML小鼠模型脾脏、骨髓中AML细胞的清除:
①将4-5周龄的NCG小鼠接收亚致死剂量(200cGy)照射,随后尾静脉注射经磁珠分选的CD34+原代AML细胞,4-6周后眶下静脉采集外周血,流式细胞术检测外周血中CD45+细胞;
②待阳性小鼠濒死时,取脾脏、骨髓,分离脏器中CD34+细胞,将其尾静脉注射于亚致死剂量的NCG小鼠中,4-6周后外周血流式筛选阳性发病鼠,将发病鼠随机分成4组,分别为对照组、Met组、Ara-C组、Met联合Ara-C组,给药2周后处死小鼠,分离脾脏、骨髓细胞并固定股骨制成病理切片,流式细胞术测定各组小鼠脾脏、骨髓中CD45+细胞,分选各组骨髓和脾脏中CD34+细胞,进行体外集落培养和二次成瘤,观察Met与Ara-C联合对白血病起始细胞的清除作用。
与对照组、单药组相比,Met联合Ara-C组可有效清除AML小鼠模型中AML细胞,并能有效抑制AML小鼠模型中的白血病起始细胞。如附图15所示,与对照组、单药组相比,联合组小鼠脾脏、骨髓中人CD45+细胞比例明显下降;如附图16所示,CD34+细胞体外集落培养,集落数目明显减少;将各组小鼠体内分离的人CD34+细胞进行二次成瘤,观察小鼠生存期,结果显示联合组生存期与对照组、单药组相比显著延长,如附图17所示。
综上所述:Met以及Met联合Ara-C能够抑制基质细胞向AML细胞传递线粒体导致的AML细胞线粒体数量的增加,增强微环境中AML细胞对化疗药物的敏感性,有利于清除残留微环境中的AML细胞尤其是白血病起始细胞。
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!