基于多肽的重组高密度脂蛋白前体及其制备方法与应用与流程
本发明涉及医药技术领域,特别涉及重组高密度脂蛋白及其制备方法与应用。
背景技术:
随着我国经济发展,居民饮食结构、生活习惯和环境因素的改变,心血管疾病已成为我国居民健康的首要威胁。目前,心血管疾病死亡率占城乡居民总死亡原因的首位,今后十年心血管疾病患病人数仍将快速增长。动脉粥样硬化性心血管疾病是因动脉粥样硬化导致的一组累及全身的疾病总称,是心血管疾病致残致死的主要原因。在我国,动脉粥样硬化性心血管疾病及其并发症的防治费用已逾千亿元,大大加重了政府医疗投入,制约了社会和经济的发展。加强动脉粥样硬化性心血管疾病及其并发症的防治已成为我国重大疾病防治的主要任务。
动脉粥样硬化(atherosclerosis,as)是由于脂肪、血栓、结缔组织和碳酸钙在血管沉积所造成的动脉管壁增厚变硬、失去弹性和管腔缩小的一种动态且逐步发展的过程,主要累及大、中动脉。as的形成包括一系列病理过程:血管内皮细胞损伤,引起单核细胞为主的白细胞沿血管壁滚动,并粘附于血管内皮细胞、移向内皮细胞下间隙。存在于内皮细胞下的白细胞功能发生改变,摄取内皮细胞下沉积的脂质而转化成为巨噬细胞,巨噬细胞又通过其细胞膜上的清道夫受体摄取大量脂质,特别是摄取被修饰的氧化型低密度脂蛋白而形成泡沫细胞。内皮细胞下活化的单核细胞释放细胞因子,促使血管平滑肌细胞迁移和增殖,同时血管平滑肌本身也能摄入脂质而转化成为泡沫细胞。血管平滑肌的增殖使动脉粥样硬化壁变厚并可发生纤维化,最终形成斑块,导致as形成。
高胆固醇血症是as形成的主要原因。含胆固醇的脂蛋白诱导内皮细胞功能性障碍和巨噬细胞活化,巨噬细胞吸收含有胆固醇的脂蛋白促进泡沫细胞的形成,这是as发生发展的一个重要环节。基于动脉粥样硬化的病理过程和胆固醇脂蛋白的关键作用,3-羟基-3-甲基戊二酰辅酶a(3-hydroxy-3-methyl-glutaryl-coa,hmg-coa)还原酶抑制药,即他汀类药物成为目前临床上应用最为广泛的调血脂药物。他汀药物通过抑制hmg-coa还原酶,减少胆固醇合成治疗as。然而,他汀类药在阻断胆固醇合成的同时也抑制类异戊二烯衍生物的产生,这是许多蛋白质参与代谢和信号转导的重要集合点。因此他汀类药物也引起许多超出降低胆固醇作用的其他影响,如肝损伤,肌肉损伤,血糖增高及消化道、情绪异常等反应。
高密度脂蛋白(hdl)是所有血浆脂蛋白中体积最小,密度最高的脂蛋白,其水平与as和冠心病的发生及严重程度呈负相关。hdl抗as的一个重要机制就是参与胆固醇逆向转运,将肝外组织的过剩胆固醇移出并转移至肝脏进行转化、清除。除此之外,hdl还具有抗脂质氧化、抑制血小板聚集和粘附因子表达、影响细胞的增殖、保护内皮和促进血管扩张等作用,是极具前景的as治疗性分子。根据hdl的成熟过程,hdl可有前β,α-4,α-3,α-2及成熟的α-1五种类型,具有新生盘状和成熟球状两种形态。不成熟型hdl通过不断获取胆固醇变为成熟型hdl,其形状也由盘状逐渐发展为球状。不成熟型hdl主要由含载脂蛋白a-i(apolipoproteina-i,apoa-i)包围的磷脂双层膜组成;成熟型hdl由非极性的脂质核心及外周的单层磷脂膜和载脂蛋白组成。由于球状的成熟型hdl要经过体内代谢转化成盘状后才能发挥介导胆固醇流出的作用,因此利用apoa-i蛋白和磷脂在体外重组的盘状hdl(reconstitutedhdl,rhdl)已被用于治疗as,被认为是极具前景的临床干预as策略之一。经不同合成方法制备的、含有不同成分的hdl已进入临床试验阶段。
apoa-i全长蛋白造价昂贵,较难获得:高纯度的apoa-i全长蛋白造价过高,获得工艺复杂,生产周期较长,难以在实验室普遍应用或推广到临床使用。
传统方法合成rhdl步骤繁,成分多,耗时长,产量低:传统方法合成rhdl主要是将磷脂、胆固醇、甘油酯和胆固醇酯溶解于有机相(如乙醇、丙酮、氯仿、甲醇)中,在水相(如ph=8.0的缓冲液)中加入一种或多种表面活性剂(如十二烷基硫酸钠、去氧胆酸钠、胆酸钠、苯扎溴铵),采用乳化蒸发法制备,形成透明的混悬液,再将混悬液与载脂蛋白孵育,透析去除表面活性剂即得,如cn102178954a。整个合成过程需要数小时,并添加表面活性剂等物质增加蛋白与脂质的结合能力,合成产量约120毫升/22小时。
技术实现要素:
为了弥补以上领域的不足,本发明提供了用微流控技术来制备基于多肽的重组高密度脂蛋白前体。本发明采用的技术方案如下:
本发明所提供的重组高密度脂蛋白前体,由包含apoa-i功能多肽和磷脂的原料在微流控芯片中自组装制备而成。
所述重组高密度脂蛋白前体为盘状重组高密度脂蛋白。
所述重组高密度脂蛋白前体为粒径20纳米-40纳米的纳米颗粒。
所述微流控芯片为聚二甲基硅氧烷(pdms)微流控芯片。
所述apoa-i功能多肽是通过双通道流体注射泵泵传输至所述微流控芯片;所述磷脂是通过单通道流体注射泵传输至所述微流控芯片;所述单通道流体注射泵设置在所述双通道流体注射泵之间;
所述双通道流体注射泵与所述微流控芯片之间由聚四氟乙烯软(ptfe)导管连接;所述单通道流体注射泵与所述微流控芯片之间由聚四氟乙烯(ptfe)软导管连接;
所述apoa-i功能多肽与所述磷脂在所述微流控芯片上汇集,形成可调控的双微涡旋和雷诺系数在75~150的聚焦模式;
所述自组装为所述磷脂从有机相转变为水相,引发脂质体的形成;所述双微涡旋促使所述apoa-i功能多肽迅速掺入新生的脂质体中,瞬时形成高密度脂蛋白前体的纳米颗粒。
所述apoa-i功能多肽和所述磷脂分别以流速为2.5ml/min~10ml/min和0.5ml/min~2ml/min的速度灌流混合。
优选地,所述apoa-i功能多肽和所述磷脂分别以流速为5ml/min和1ml/min的速度灌流混合。
所述apoa-i功能多肽和所述磷脂的质量比为0.1-1.6:1。
优选地,所述apoa-i功能多肽和所述磷脂的质量比为0.4:1。
apoa-i全长蛋白中任意一个两亲性螺旋(全长蛋白中第1-10重复序列中的任意一个)或他们的多聚体形式,或与其类似的、可以模拟apoa-i蛋白功能的多肽序列都可作为合成本发明重组高密度脂蛋白前体的apoa-i功能多肽。
优选地,所述apoa-i功能多肽选自以下单体序列或所述单体序列以脯氨酸或丙氨酸连接形成的聚体形式或在所述功能多肽n端或c端连接荧光标签后形成的修饰多肽:
(1)dwlkafydkvaeklkeaf(序列表中序列12所示的氨基酸序列);和/或
(2)dwfkafydkvaekfkeaf(序列表中序列13所示的氨基酸序列);和/或
(3)dwfkafydkvaeklkeaf(序列表中序列14所示的氨基酸序列);和/或
(4)dwlkafydkvaekfkeaf(序列表中序列15所示的氨基酸序列);和/或
(5)dwlkafydkvfekfkeff(序列表中序列16所示的氨基酸序列);和/或
(6)dwlkafydkffekfkeff(序列表中序列17所示的氨基酸序列);和/或
(7)dwfkafydkffekfkeff(序列表中序列18所示的氨基酸序列);和/或
(8)fwlkafydkvaeklkeaf(序列表中序列19所示的氨基酸序列);和/或
(9)dflkafydkvaeklkeaf(序列表中序列20所示的氨基酸序列);和/或
(10)dwfrafydkvaekfreaf(序列表中序列21所示的氨基酸序列);和/或
(11)dwfkafydrvaerfkeaf(序列表中序列22所示的氨基酸序列)。
所述apoa-i功能多肽为如下(a)或(b)或(c)的多肽:
(a)序列表中序列1所示的氨基酸序列组成的多肽;
(b)在(a)中的氨基酸序列经过取代、缺失或添加一个或几个氨基酸且具有apoa-i蛋白功能的由(a)衍生的多肽;
(c)在所述(a)或(b)的多肽n端或c端连接荧光标签后形成的修饰多肽。
优选地,所述apoa-i功能多肽为序列表中序列1所示的氨基酸序列组成的多肽。
优选地,所述apoa-i功能多肽n端标记异硫氰酸荧光素(fluoresceinisothiocyanate,fitc)荧光标签,得到含fitc荧光标签的apoa-i功能多肽。
所述磷脂为天然磷脂或合成磷脂;所述天然磷脂选自大豆、蛋黄、脑或脊髓中天然磷脂成分;所述合成磷脂选自二肉豆蔻酰磷脂酰胆碱、二棕榈酰磷脂酰胆碱、二硬脂酰基磷脂酰胆碱、二油酰基卵磷脂或1-棕榈酰基-2-油酰基卵磷脂。
优选地,所述磷脂为二肉豆蔻酰磷脂酰胆碱(dmpc)。
所述重组高密度脂蛋白前体在制备治疗或预防动脉粥样硬化的药物中应用也属于本发明的保护范围。
所述重组高密度脂蛋白前体在制备介导胆固醇从动物或人的巨噬细胞或泡沫细胞中外流的药物中应用也属于本发明的保护范围。
所述巨噬细胞为thp-1人源单核细胞在10ng/mlpma(丙二醇甲醚醋酸酯)作用48小时后分化成的巨噬细胞或小鼠源巨噬细胞株raw264.7。
高密度脂蛋白前体的制备通过3个入口的平流面一步法自组装合成。三通道的微流控系统产生可调控的双微涡旋和一个雷诺系数在75-150左右的聚焦模式,液体会在通道内混合形成平流面,液体间可通过对流体的控制和加剧混合来迅速得到大小均一重复性好的纳米颗粒。自组装的发生是由于脂质从有机相转变为水相,从而引发脂质体的形成;两个微涡旋促使多肽迅速掺入新生的脂质体中,导致瞬时形成高密度脂蛋白前体的纳米颗粒。
在流体力学中,雷诺系数是流体惯性力与粘性力比值。在微流控芯片尺寸不变的情况下,雷诺系数主要与溶液浓度及流速正相关,与溶液粘度负相关。apoa-i全长蛋白作为生物大分子,分子量大、结构复杂,致使它们在溶液中的扩散系数小、粘度大。蛋白质大分子还易受外界温度、ph、有机溶剂的影响而发生变性,并引起结构改变,造成溶液粘度的变化,增加合成的不稳定性。相反,小分子多肽因分子量小,结构单一,故粘度小,有利于其与磷脂的结合。小分子多肽还不易受外界环境改变而发生变化,有利于合成的稳定性和可控性。
本发明的优势如下:
(1)使用具有37个氨基酸的apoa-i功能多肽替代含有243个氨基酸的apoa-i全长蛋白用于合成高密度脂蛋白前体,节约成本,降低产品造价;
(2)合成原料只需磷脂和多肽两种成分,产物简单,功能不变;
(3)微流控一步法合成,方法简单,耗时短,产量高,颗粒物均一性好,合成效果可重复性强。
附图说明
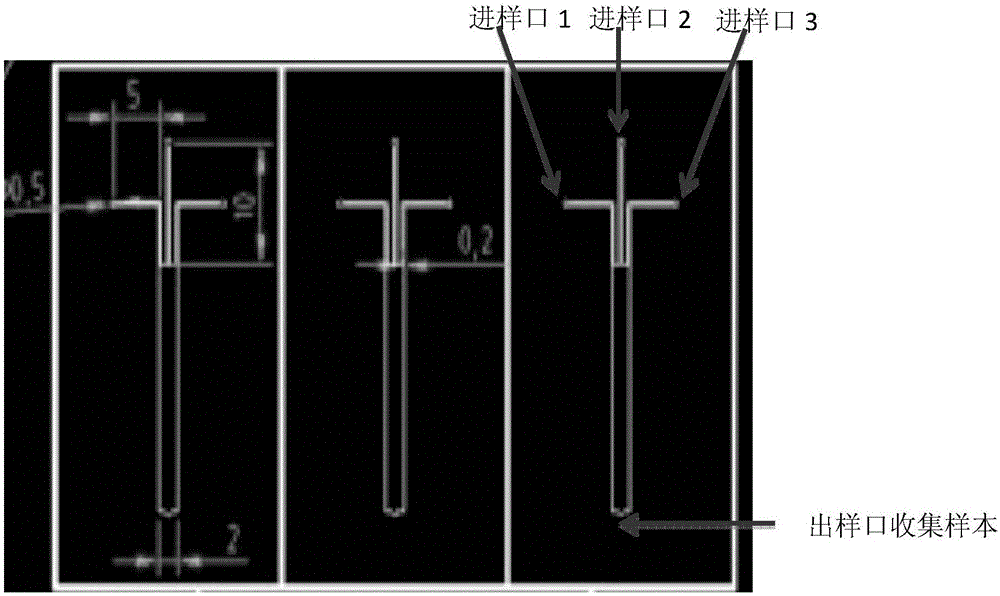
图1为三通道微流控系统合成基于多肽的盘状hdl(peptide-basedreconstitutedhdl,phdl)的示意图。
图2为采用透射电镜观察此微流控技术合成的phdl结果;其中:图2a为多肽不含fitc荧光标签合成的phdl形态与产量;图2b为多肽n端加入fitc荧光标签合成的phdl形态与产量。
图3为马尔文动态光散射仪分析合成产物;其中:图3a为粒径大小分析;图3b为粒径均一性分析;图3c为颗粒物表面电荷分析。
图4为基于巨噬细胞的胆固醇外流定量检测结果;其中:图4a为人源巨噬细胞作为检测对象;图4b为鼠源巨噬细胞作为检测对象。
图5为基于泡沫细胞的胆固醇外流定量检测结果;其中:图5a为人源泡沫细胞作为检测对象;图5b为鼠源泡沫细胞作为检测对象。
图6为单核细胞粘附于内皮细胞的定量检测结果。
具体实施方式
实施例1、利用apoa-i功能多肽和磷脂在体外重组phdl
一、模拟apoa-i全长蛋白功能的多肽序列:
模拟apoa-i全长蛋白的功能的二聚体序列如下:dwfkafydkvaekfkeafpdwfkafydkvaekfkeaf(序列表中序列1所示),其中dwfkafydkvaekfkeaf(序列表中序列13所示)是两亲性螺旋单体序列,两个单体序列之间加柔性脯氨酸p,有助于序列形成两亲性螺旋二聚体(由南京金斯瑞生物科技有限公司合成),得到apoa-i功能多肽。
apoa-i功能多肽的合成方法如下:
多肽是化学合成,使用fmoc基团保护alpha氨基。合成结束,切割掉侧链保护基团和树脂。树脂:氯树脂;合成方法:固相合成fmoc法;缩合试剂:dic+hobt;脱除fmoc试剂:pip。
多肽纯化:试剂:乙腈+去离子水,tfa作为缓冲剂;仪器:反相高效液相色;纯化方法:梯度洗脱。
将上述多肽n端标记异硫氰酸荧光素(fluoresceinisothiocyanate,fitc)荧光标签(由南京金斯瑞生物科技有限公司合成),得到含fitc荧光标签的apoa-i功能多肽。
fitc修饰在n端时,需要使用6-氨基己酸做linker,可以有效的减少副反应。
称取2mg上述apoa-i功能多肽溶于10ml去离子水中,apoa-i功能多肽的浓度为0.2mg/ml。
称取2mg上述含fitc荧光标签的apoa-i功能多肽溶于10ml去离子水中,含fitc荧光标签的apoa-i功能多肽的浓度为0.2mg/ml。
二、磷脂:
称取5mg二肉豆蔻酰磷脂酰胆碱(1,2-dimyristoyl-sn-glycero-3-phosphatidylcholine,dmpc)(购自avantipolarlipids,产品目录号为850345)溶于1ml无水乙醇中,dmpc的浓度为5mg/ml。
三、用微流控技术来制备的基于多肽的重组高密度脂蛋白前体
1、微流控系统建立(微流控芯片、导管与连接相关参数):
微流控系统主要由两部分组成:即流体注射泵及微流控芯片。本发明使用的两个流体注射泵均购置于保定雷弗流体科技有限公司,其中单通道流体注射泵货号为tyd01-01,双通道流体注射泵货号为tyd01-02。单通道流体注射泵用于传输磷脂成分,双通道流体注射泵用于传输多肽成分。流体注射泵主要用于控制向芯片传输合成材料的速度,使之均匀、平稳。pdms(聚二甲基硅氧烷)微流控芯片系苏州汶颢微流控技术股份有限公司依据图1所示的图纸铸造。该pdms(聚二甲基硅氧烷)微流控芯片的功能是使从微流控注射泵注入的磷脂与多肽汇集,形成微涡旋,引发自组装。微流控传输系统与微流控芯片之间由ptfe(聚四氟乙烯)软导管连接,由苏州汶颢微流控技术股份有限公司提供。
微流控装置的相关参数如下:
(1)su-8硅片模具,高度400μm;
(2)芯片由pdms铸成,厚度3mm;
(3)芯片进、出样口直径0.5mm;与芯片底部1mm厚度的玻璃片键合;
(4)进、出样口配不锈钢小管内径0.5mm,外径0.8mm;
(5)不锈钢小管另一端连接ptfe软导管,导管内径0.5mm,外径0.9mm;
(6)ptfe软导管另一端连接尺寸为21g的点胶螺口塑钢针头,其内径0.51mm,外径0.82mm,管长13mm,总长30mm。
2、采用如上所述三通道微流控系统合成phdl的方法:
(1)合成:三个微量注射通道的ptfe软导管长度一致,其进样设计分别为:两个外侧通道(进样口1与3)控制apoa-i功能多肽;中间通道(进样口2)为溶于无水乙醇的dmpc,外侧与中间通道分别以5ml/min和1ml/min的速度灌流混合,apoa-i功能多肽与dmpc的质量比为0.4:1,三通道的微流控系统产生可调控的双微涡旋和一个雷诺系数在75-150左右的聚焦模式,液体会在通道内混合形成平流面,液体间可通过对流体的控制和加剧混合来迅速得到大小均一重复性好的纳米颗粒。自组装的发生是由于磷脂从有机相转变为水相,从而引发脂质体的形成;两个微涡旋促使多肽迅速掺入新生的脂质体中,导致瞬时形成高密度脂蛋白前体的纳米颗粒,即得基于多肽的重组高密度脂蛋白(phdl)。从出样口收集合成产物。
(2)合成产物经milliporemwco=10k的截留管,4000xg,15分钟离心后,加入去离子水,重复上述“4000xg,15分钟离心,加入去离子水”步骤5次,以去除有机溶剂并使合成产物浓缩,4℃储存,以备后续实验使用。
(3)纯化、浓缩后的合成产物可通过普通蛋白浓度测定法,如bca法,分析phdl合成后的多肽浓度。
bca法测定蛋白浓度:使用碧云天公司的bca蛋白浓度测定试剂盒。第一步:根据样本数量,按50倍体积bca试剂a加1体积bca试剂(50:1)配制适量bca工作液,充分混匀。第二步:准备蛋白标准品,将bsa溶于去离子水,配置不同浓度的蛋白标准品,即0mg/ml,0.0625mg/ml,0.125mg/ml,0.25mg/ml,0.5mg/ml,1mg/ml,2mg/ml。第三步:将20μl蛋白标准品及待测样本加入96孔酶标板,再依次加入200μlbca工作液(见第一步),37℃放置30分钟。第四步:使用酶标仪测定吸光值a562。第五步:根据标注曲线计算样品的蛋白浓度。结果:制备得到的phdl合成后的多肽浓度为约1mg/ml。根据浓缩程度不同,所得浓度不同。
(4)纯化、浓缩后的phdl冰箱4℃保存,至少1个月内稳定。
用与上述相同的方法,用上述步骤一中溶于去离子水的含fitc荧光标签的apoa-i功能多肽和溶于无水乙醇的dmpc制备phdl,含fitc荧光标签的apoa-i功能多肽与dmpc的质量比为0.4:1,制备得到的phdl合成后的多肽浓度为约1mg/ml。,根据浓缩程度不同,所测得浓度不同。
3、合成产物phdl的分析:
(1)采用透射电镜观察(透射电镜使用jem-1230(jeol,tokyo,japan)加速电压40-120kv,点分辨率0.36nm,放大倍数50-60万倍连续可调)此微流控技术合成的phdl:phdl形态符合“前β-hdl”的盘状形态,粒径平均约30纳米,均一性好,如图2所示。因合成产量高,纯度高,图2中盘状phdl排列成串。图2a为apoa-i功能多肽不含fitc荧光标签合成的phdl形态与产量,图2b为apoa-i功能多肽n端加入fitc荧光标签合成的phdl形态与产量。由图2可见,含有fitc不影响phdl的形态与产量(以上述蛋白浓度测定为准)。
(2)采用马尔文激光粒度仪(马尔文zetasizernanozs90);马尔文激光粒度仪测量颗粒粒径采用动态光散射法,zeta电位测量采用电泳光散射法;单分散系样品误差为±2%,可重复性误差为±2%,采用633nm“红色”激光器,温度控制为25℃。分析微流控技术合成的phdl:phdl约为20-40纳米(图3a),均一性好,代表均一性的pdi=0.257(图3b),带负电(图3c),提示细胞毒性小。
(3)体外巨噬细胞胆固醇外流实验:采用thp-1人源单核细胞(购自atcc公司,货号atcctib-71)在10ng/mlpma(丙二醇甲醚醋酸酯,购自sigma公司,货号p8139)作用48小时后分化成的巨噬细胞为巨噬细胞模型一;采用小鼠源巨噬细胞株raw264.7(购自协和细胞资源中心,资源编号3111c0001ccc000057)为巨噬细胞模型二。两种巨噬细胞分别种于可用于荧光检测的96孔板中,使用biovision公司的胆固醇外流检测试剂盒,标记细胞内胆固醇,16小时后移除胆固醇标记物,清洗细胞后分别加入等量10μg/mlphdl(apoa-i功能多肽不含fitc荧光标签合成的phdl),人血浆hdl(hhdl)、人源apoa-i蛋白(hapoa-i)各10μl(人血浆hdl(hhdl)、人源apoa-i蛋白(hapoa-i)均购自北京协生生物科技有限公司)。6小时后分别检测上清及细胞裂解液中荧光标记的胆固醇含量。以上清荧光值/(上清荧光值+裂解液荧光值)x100%作为胆固醇外流量,进行比较。对照组(control)为等体积100μl细胞培养基。
结果:phdl较hhdl及hapoa-i具有更好的介导胆固醇从巨噬细胞外流的功能。如图4a所示,与对照组(control)相比,经phdl、hhdl及hapoa-i蛋白处理的人源巨噬细胞其胆固醇外流功能均有不同程度的增加,其中以phdl效果最好,高于hhdl20.32%,高于hapoa-i蛋白18.23%。如图4b所示,与对照组(control)相比,经phdl、hhdl及hapoa-i蛋白处理的小鼠源巨噬细胞其胆固醇外流功能均有不同程度的增加,其中以phdl效果最好,高于hhdl27.63%,高于hapoa-i蛋白29.33%。
(4)体外泡沫细胞胆固醇外流实验:采用thp-1人源单核细胞在10ng/mlpma作用48小时后分化成的巨噬细胞为巨噬细胞模型一;采用小鼠源巨噬细胞株raw264.7为巨噬细胞模型二。两种巨噬细胞分别种于可用于荧光检测的96孔板中,使用50μg/mlox-ldl(氧化型低密度脂蛋白,购自北京协生生物科技有限公司)作用于上述两种巨噬细胞,24小时后形成泡沫细胞,此细胞为动脉粥样硬化形成过程中标志性病理细胞。使用biovision公司的胆固醇外流检测试剂盒,标记细胞内胆固醇,16小时后移除胆固醇标记物,清洗细胞后分别加入等量10μg/mlphdl(apoa-i功能多肽不含fitc荧光标签合成的phdl),hhdl及hapoa-i各10μl。6小时后分别检测上清及细胞裂解液中荧光标记的胆固醇含量。以上清荧光值/(上清荧光值+裂解液荧光值)x100%作为胆固醇外流量,进行比较。对照组(control)为为等体积100μl细胞培养基。
结果:phdl较hhdl及hapoa-i具有更好的介导胆固醇从泡沫细胞外流的功能。如图5a所示,与对照组(control)相比,经phdl、hhdl及hapoa-i蛋白处理的人源泡沫细胞其胆固醇外流功能均有不同程度的增加,其中以phdl效果最好,高于hhdl16.31%,高于hapoa-i蛋白18.14%。如图5b所示,与对照组(control)相比,经phdl、hhdl及hapoa-i蛋白处理的小鼠源泡沫细胞其胆固醇外流功能均有不同程度的增加,其中以phdl效果最好,高于hhdl26.01%,高于hapoa-i蛋白27.11%。
(5)单核细胞粘附实验:人脐静脉内皮细胞(huvec细胞)(购自atcc,货号crl-1730)种于可用于荧光检测的96孔板中,2x104细胞/孔。待细胞贴壁后移除培养基,分别加入等量10μg/mlphdl(apoa-i功能多肽不含fitc荧光标签合成的phdl),人血浆hdl(hhdl)、人源apoa-i蛋白(hapoa-i)各50μl(人血浆hdl(hhdl)、人源apoa-i蛋白(hapoa-i)均购自北京协生生物科技有限公司)孵育。2小时后在相应孔中加入10μl、终浓度为100μg/ml的氧化型低密度脂蛋白(ox-ldl,购自北京协生生物科技有限公司),无ox-ldl组加入等体积10μl培养基,继续孵育。4小时后移除刺激物或培养基,使用pbs清洗一遍。将1μmcalcein-am(购于invitrogen公司,货号c3100mp)溶于无血清培养基,用于标记单核细胞thp-1(购自atcc公司,货号atcctib-71)。45分钟后使用pbs清洗被calcein-am标记的thp-1细胞以移除多余的calcein-am,并以106thp-1细胞/孔加至上述经ox-ldl处理的huvec细胞,使thp-1粘附于huvec细胞。30分钟后,移除未粘附的thp-1细胞,并使用pbs清洗3遍。采用酶标仪激发光波长506nm,发射光波长531nm检测calcein-am荧光值以代表粘附于huvec细胞的thp-1数量,即单核细胞粘附量。
结果:phdl较hhdl及hapoa-i具有更好的抑制单核细胞粘附的功能。如图6所示,与单纯ox-ldl处理的细胞相比,经phdl、hhdl及hapoa-i蛋白处理的raw264.7巨噬细胞其引起单核细胞粘附的程度均有不同程度的降低,其中以phdl的抑制效果最好,比hhdl少26.59%,比hapoa-i蛋白少21.61%。
进一步的实施例中,用与上述实施例1相同的方法,利用不同apoa-i功能多肽和磷脂在体外重组基于多肽的盘状hdl(peptide-basedreconstitutedhdl,phdl)。所用的不同多肽序列、不同磷脂、不同流速、以及多肽与磷脂之间不同的质量比如表1所示。
表1利用不同apoa-i功能多肽和磷脂在体外重组基于多肽的盘状hdl
表1中所用的模拟apoa-i全长蛋白的功能的二聚体均由南京金斯瑞生物科技有限公司合成;表1中所用的磷脂均购自avantipolarlipids。
对表1中制备得到的基于多肽的盘状hdl用与实施例1相同的方法进行分析,其形态、产量、粒径、均一性、细胞毒性、体外巨噬细胞胆固醇外流实验、体外泡沫细胞胆固醇外流实验、单核细胞粘附实验的结果均与实施例1无显著差异。
序列表
<110>中国中医科学院中医基础理论研究所
<120>基于多肽的重组高密度脂蛋白前体及其制备方法与应用
<130>p180027/zyk
<160>22
<170>patentinversion3.5
<210>1
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>1
asptrpphelysalaphetyrasplysvalalaglulysphelysglu
151015
alapheproasptrpphelysalaphetyrasplysvalalaglulys
202530
phelysglualaphe
35
<210>2
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>2
asptrpleulysalaphetyrasplysvalalaglulysleulysglu
151015
alapheproasptrpleulysalaphetyrasplysvalalaglulys
202530
leulysglualaphe
35
<210>3
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>3
asptrpphelysalaphetyrasplysvalalaglulysleulysglu
151015
alapheproasptrpphelysalaphetyrasplysvalalaglulys
202530
leulysglualaphe
35
<210>4
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>4
asptrpleulysalaphetyrasplysvalalaglulysphelysglu
151015
alapheproasptrpleulysalaphetyrasplysvalalaglulys
202530
phelysglualaphe
35
<210>5
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>5
asptrpleulysalaphetyrasplysvalpheglulysphelysglu
151015
phepheproasptrpleulysalaphetyrasplysvalpheglulys
202530
phelysgluphephe
35
<210>6
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>6
asptrpleulysalaphetyrasplysphepheglulysphelysglu
151015
phepheproasptrpleulysalaphetyrasplysphepheglulys
202530
phelysgluphephe
35
<210>7
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>7
asptrpphelysalaphetyrasplysphepheglulysphelysglu
151015
phepheproasptrpphelysalaphetyrasplysphepheglulys
202530
phelysgluphephe
35
<210>8
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>8
phetrpleulysalaphetyrasplysvalalaglulysleulysglu
151015
alapheprophetrpleulysalaphetyrasplysvalalaglulys
202530
leulysglualaphe
35
<210>9
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>9
asppheleulysalaphetyrasplysvalalaglulysleulysglu
151015
alapheproasppheleulysalaphetyrasplysvalalaglulys
202530
leulysglualaphe
35
<210>10
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>10
asptrppheargalaphetyrasplysvalalaglulyspheargglu
151015
alaphealaasptrppheargalaphetyrasplysvalalaglulys
202530
pheargglualaphe
35
<210>11
<211>37
<212>prt
<213>artificialsequence
<220>
<223>二聚体
<400>11
asptrpphelysalaphetyraspargvalalagluargphelysglu
151015
alaphealaasptrpphelysalaphetyraspargvalalagluarg
202530
phelysglualaphe
35
<210>12
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>12
asptrpleulysalaphetyrasplysvalalaglulysleulysglu
151015
alaphe
<210>13
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>13
asptrpphelysalaphetyrasplysvalalaglulysphelysglu
151015
alaphe
<210>14
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>14
asptrpphelysalaphetyrasplysvalalaglulysleulysglu
151015
alaphe
<210>15
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>15
asptrpleulysalaphetyrasplysvalalaglulysphelysglu
151015
alaphe
<210>16
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>16
asptrpleulysalaphetyrasplysvalpheglulysphelysglu
151015
phephe
<210>17
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>17
asptrpleulysalaphetyrasplysphepheglulysphelysglu
151015
phephe
<210>18
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>18
asptrpphelysalaphetyrasplysphepheglulysphelysglu
151015
phephe
<210>19
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>19
phetrpleulysalaphetyrasplysvalalaglulysleulysglu
151015
alaphe
<210>20
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>20
asppheleulysalaphetyrasplysvalalaglulysleulysglu
151015
alaphe
<210>21
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>21
asptrppheargalaphetyrasplysvalalaglulyspheargglu
151015
alaphe
<210>22
<211>18
<212>prt
<213>artificialsequence
<220>
<223>单体
<400>22
asptrpphelysalaphetyraspargvalalagluargphelysglu
151015
alaphe
- 还没有人留言评论。精彩留言会获得点赞!