可用于治疗类风湿性关节炎的聚合物纳米颗粒的制作方法
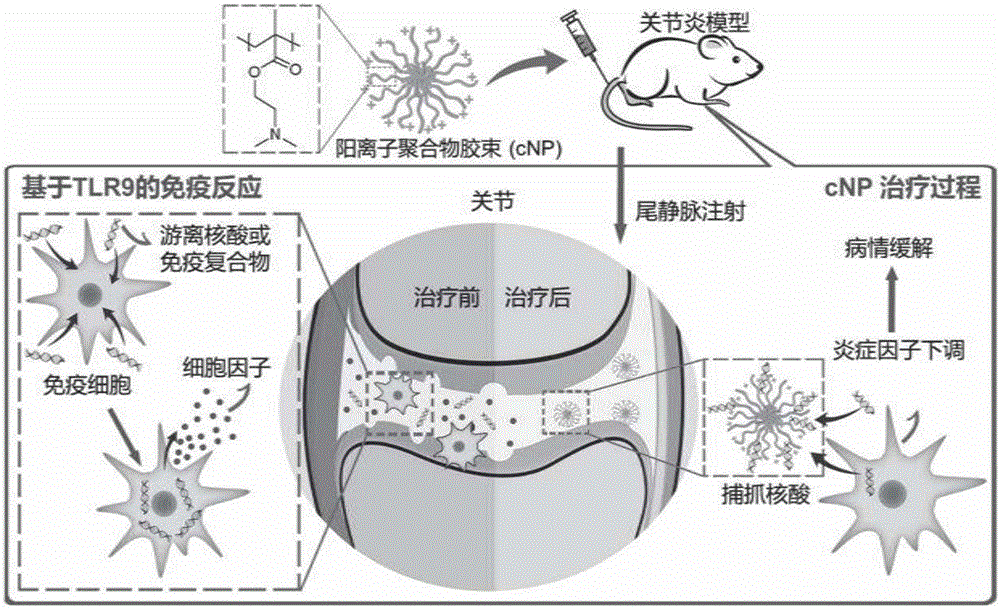
本发明属于高分子和生物医学材料领域,涉及一种可用于治疗类风湿性关节炎的聚合物纳米颗粒,特别涉及一种阳离子型聚合物胶束,制备所述聚合物胶束的方法,以及含有所述聚合物胶束的药物组合物。
背景技术:
类风湿性关节炎(ra)发病核心在于成纤维样滑膜细胞fls(synovialfibroblasts-like)的激活,以及关节部位的免疫细胞以及细胞因子的堆积。fls的激活导致特异性的基质降解酶(如基质金属蛋白酶mmp-3,mmp-14)、粘着因子(如cd130等)以及细胞因子的表达,使得软骨变形破坏。目前ra的临床治疗,常用tnf-α的抗体药物(如依那西普,阿达木单抗等),以及il-1、il-6以及b细胞靶向药物,这些药物对于40%左右的病人没有效果,而且长期进行tnf-α抗体药物治疗会导致ra转化为系统性红斑狼疮、i型糖尿病甚至是心血管疾病。
目前已有报道显示,高浓度的游离核酸(cf-dna)存在于许多疾病中,如癌症、动脉粥样硬化症、糖尿病、老年性退行性疾病、自身免疫疾病等等。已有研究表明,cf-dna与类风湿性关节炎非常相关。如类风湿因子(rf)和igg结合过程中,就有染色质的参与]。另外,也有研究表明,类风湿病人的血液及积液中含有的cf-dna的含量比正常人高很多。还有相关研究表明,对于小鼠,缺乏dna酶i会发展成类似人的类风湿的多发性关节炎。
技术实现要素:
本发明的发明人创造性地发现,阳离子型聚合物纳米胶束可作为核酸清除剂,通过静电作用来对带有负电的cf-dna进行吸附,从而减少免疫细胞的激活,降低与类风湿性关节炎相关的细胞因子和酶的浓度,缓解类风湿性关节炎的症状(参见图1),由此提供了下述发明:
在一个方面,本发明提供了一种聚合物胶束,所述聚合物胶束包含阳离子型两亲性嵌段共聚物,或由阳离子型两亲性嵌段共聚物组成;所述阳离子型两亲性嵌段共聚物包含亲水的阳离子聚合物链段和疏水的电中性聚合物链段;其中,所述阳离子聚合物链段选自以下一种或多种聚合物的链段:聚甲基丙烯酸2-(二甲氨基)乙酯(pdma)、聚α-氨基戊内酯、聚醚酰亚胺(pei)、聚(2-二甲氨基乙基硫)己内酯;所述电中性聚合物链段选自以下一种或多种聚合物的链段:聚乳酸-羟基乙酸无规共聚物(plga)、疏水性聚磷酸酯、疏水性聚碳酸酯、聚乙二醇、聚己内酯。
在某些实施方案中,所述阳离子聚合物链段的数均分子量为5k-500k,例如5k-10k、10k-20k、20k-30k、30k-40k、40k-50k、50k-60k、60k-70k、70k-80k、80k-90k、90k-100k、100k-150k、150k-200k、200k-250k、250k-300k、300k-350k、350k-400k、400k-450k或450k-500k。
在某些实施方案中,所述阳离子聚合物链段的重均分子量为5k-500k,例如5k-10k、10k-20k、20k-30k、30k-40k、40k-50k、50k-60k、60k-70k、70k-80k、80k-90k、90k-100k、100k-150k、150k-200k、200k-250k、250k-300k、300k-350k、350k-400k、400k-450k或450k-500k。
在某些实施方案中,所述阳离子聚合物链段的聚合物分散性指数(pdi)大于1且小于1.5,例如大于1且小于1.1、大于1且小于1.2、大于1且小于1.3或大于1且小于1.4。
在某些实施方案中,所述电中性聚合物链段的数均分子量为5k-500k,例如5k-10k、10k-20k、20k-30k、30k-40k、40k-50k、50k-60k、60k-70k、70k-80k、80k-90k、90k-100k、100k-150k、150k-200k、200k-250k、250k-300k、300k-350k、350k-400k、400k-450k或450k-500k。
在某些实施方案中,所述电中性聚合物链段的重均分子量为5k-500k,例如5k-10k、10k-20k、20k-30k、30k-40k、40k-50k、50k-60k、60k-70k、70k-80k、80k-90k、90k-100k、100k-150k、150k-200k、200k-250k、250k-300k、300k-350k、350k-400k、400k-450k或450k-500k。
在某些实施方案中,所述电中性聚合物链段的聚合物分散性指数(pdi)大于1且小于1.5,例如大于1且小于1.1、大于1且小于1.2、大于1且小于1.3或大于1且小于1.4。
在某些实施方案中,所述plga为酯基(例如c12h25coo-)封端的plga。
在某些实施方案中,所述聚乙二醇为甲氧基封端的聚乙二醇。
在某些实施方案中,所述阳离子聚合物链段为pdma链段。
在某些实施方案中,所述电中性聚合物链段为plga链段。
在某些实施方案中,所述电中性聚合物链段为c12h25coo-封端的plga链段。
在某些实施方案中,所述plga链段中,乳酸结构单元和羟基乙酸结构单元的个数比为90:10-10:90,例如90:10-50:50或50:50-10:90,例如90:10、75:25、50:50、25:70或10:90。
在某些实施方案中,所述plga链段中,乳酸结构单元的个数为10-100,例如10-20、20-30、30-40、40-50、50-60、60-70、70-80、80-90或90-100。
在某些实施方案中,所述plga链段中,羟基乙酸结构单元的个数为10-100,例如10-20、20-30、30-40、40-50、50-60、60-70、70-80、80-90或90-100。
在某些实施方案中,所述pdma链段的聚合度为200-500,例如200-250、250-300、300-350、350-400、400-450或450-500。
在某些实施方案中,所述阳离子型两亲性嵌段共聚物中,亲水的阳离子聚合物链段为pdma链段,疏水的电中性链段为c12h25coo-封端的plga链段,pdma链段的数均分子量为30k-80k(例如30k-40k、50k-60k或70k-80k),c12h25coo-封端的plga链段的数均分子量为10k-20k,其中,乳酸结构单元和羟基乙酸结构单元的个数各自独立地选自10-100的正整数。
在某些实施方案中,所述胶束的粒径为30nm-200nm,例如30nm-50nm、50nm-100nm、100nm-150nm或150nm-200nm,例如30nm、40nm、50nm、60nm、70nm、80nm、90nm、100nm、110nm、120nm、130nm、140nm、150nm、160nm、170nm、180nm、190nm或200nm。
在某些实施方案中,所述胶束的粒径的多分散指数为0.1-0.3,例如0.1、0.15、0.2、0.25或0.3。
在某些实施方案中,所述胶束的zeta电位为+10mv至+20mv(例如+10mv、+11mv、+12mv、+13mv、+14mv、+15mv、+16mv、+17mv、+18mv、+19mv或+20mv)。
在某些实施方案中,所述聚合物胶束为球形胶束。
在一个方面,本发明提供了制备如上任一项所述的聚合物胶束的方法,包括以下步骤:
步骤1:提供如上任一项所述的阳离子型两亲性嵌段共聚物;
步骤2:将所述阳离子型两亲性嵌段共聚物在溶液中进行自组装,形成聚合物胶束。
在某些实施方案中,所述步骤1包括:
步骤1-1:提供疏水的电中性聚合物;
步骤1-2:将所述疏水的电中性聚合物制成大分子引发剂;
步骤1-3:以步骤1-2得到的大分子引发剂引发单体进行聚合,得到阳离子型两亲性嵌段共聚物。
任选地,所述步骤1还包括对疏水的电中性聚合物、大分子引发剂或阳离子型两亲性嵌段共聚物进行分离和/或纯化的操作(例如萃取、洗涤、沉淀或干燥)。
在某些实施方案中,所述步骤2包括:
步骤2-1:将阳离子型两亲性嵌段共聚物溶于溶剂中,得到溶液a;
步骤2-2:将溶液a滴入酸性溶液中,进行自组装,得到溶液b;
步骤:2-3:对溶液b进行透析;
步骤2-4:对透析后的溶液b的ph进行调节,得到溶液c;
步骤2-5:对溶液c进行超滤浓缩。
在某些实施方案中,所述步骤2具有以下特征中的一个或多个:
(1)步骤2-1中的溶剂为四氢呋喃;
(2)步骤2-1中的a溶液的浓度为5mg/ml-15mg/ml;
(3)步骤2-2在超声作用下进行;
(4)步骤2-2中的酸性溶液为盐酸水溶液;
(5)步骤2-2中的酸性溶液的ph值为2.5-4.5;
(6)步骤2-2中溶液b的浓度为1mg/ml-5mg/ml;
(7)步骤2-3中,透析进行24h-48h;
(8)步骤2-3中,透析使用截留分子量为3000-4000(例如3500)的透析袋;
(9)步骤2-3中,透析在稀盐酸中进行;
(10)步骤2-3中,透析在ph值为2.5-4.5的稀盐酸中进行;
(11)步骤2-4中,使用磷酸二氢钾、磷酸氢二钠和任选的氢氧化钠对透析后的溶液b的ph进行调节;
(12)步骤2-4中,加入磷酸二氢钾和磷酸氢二钠至磷酸根离子总浓度为0.01m-0.05m(例如0.01m);
(13)步骤2-4中,溶液c的ph为7-8(例如7.4);
(14)步骤2-5中,将溶液c超滤浓缩至浓度为15mg/ml-30mg/ml;
(15)步骤2-5中,超滤浓缩的离心温度为0-5℃(例如4℃);和(16)步骤2-5中,超滤浓缩的离心速度为2000g/min-5000g/min(例如4000g/min)。
在某些实施方案中,所述步骤2包括:
s1.将阳离子型两亲性嵌段共聚物加入四氢呋喃中,溶解,配成5mg/ml-15mg/ml的溶液a;
s2.在超声破碎仪的超声作用下,将溶液a逐滴缓慢加入到稀盐酸水溶液中,自组装得到1mg/ml-5mg/ml的溶液b;
s3.将溶液b装入截留分子量为3500的透析袋,在稀盐酸中透析24h-48h;
s4.收集透析后的溶液b,往里面加入磷酸二氢钾、磷酸氢二钠、氢氧化钠,调节ph至7.4得c溶液;
s5.使用超滤离心管浓缩溶液c,浓缩到15-30mg/ml;
其中,s2、s3中,稀盐酸的ph值为2.5-4.5;
s4中,加入磷酸二氢钾和磷酸氢二钠至磷酸根离子总浓度为0.01m;
s5中,超滤浓缩的离心温度为4℃,离心速度为4000g/min。
在一个方面,本发明提供了一种组合物,其包含本发明的聚合物胶束。
在某些实施方案中,所述组合物还包含溶剂,例如水。
本发明提供的胶束可与cf-dna结合,降低与类风湿性关节炎相关的细胞因子(例如tnf-α、ifn-α、il-6等炎症细胞因子)和酶(例如基质金属蛋白酶,例如mmp-3)的表达,用于类风湿性关节炎的治疗。
因此,在一个方面,本发明提供了一种药物组合物,其包含本发明的聚合物胶束,以及一种或多种药学上可接受的辅料(例如赋形剂、载体、稳定剂或增溶剂)。
在一个方面,本发明提供了上述聚合物胶束在制备药物中的用途,所述药物用于治疗受试者的类风湿性关节炎。在某些实施方案中,所述药物用于静脉注射。
在一个方面,本发明提供了一种预防和/或治疗类风湿性关节炎的方法,包括向有此需要的受试者施用本发明的聚合物胶束或药物组合物。
在某些实施方案中,所述方法包括:将本发明的聚合物胶束或药物组合物通过静脉注射的方式施予所述受试者。
在某些实施方案中,所述方法包括:在出现初期类风湿性关节炎症状(例如开始出现关节肿胀)时,将本发明的聚合物胶束或药物组合物通过静脉注射的方式施予所述受试者。
在某些实施方案中,所述方法中,静脉注射使用的剂量为12.5mg/kg-25mg/kg。
在某些实施方案中,本发明的聚合物胶束或药物组合物在预防和/或治疗期间每天施用一次,连续给药10-15天。
在一个方面,本发明提供了一种减少受试者体内(例如血液或关节积液中)游离核酸的方法,包括给有此需要的受试者施予本发明的聚合物胶束或药物组合物。
在某些实施方案中,所述方法包括:将本发明的聚合物胶束或药物组合物通过静脉注射的方式施予所述受试者。
在一个方面,本发明提供了本发明的聚合物胶束在制备药物中的用途,所述药物用于减少受试者体内(例如血液或关节积液中)的游离核酸。在某些实施方案中,所述药物用于静脉注射。
在一个方面,本发明提供了一种试剂盒,其包含本发明的聚合物胶束,所述试剂盒用于降低或抑制细胞中的炎症细胞因子(例如tnf-α、ifn-α或il-6)和/或基质金属蛋白酶(例如mmp-3)的表达,任选地,所述试剂盒还包含使用说明。
在一个方面,本发明提供了一种降低或抑制细胞中的炎症细胞因子(例如tnf-α、ifn-α或il-6)和/或基质金属蛋白酶(例如mmp-3)的表达的方法,包括给所述细胞施用有效量的本发明的聚合物胶束。
在一个方面,本发明提供了本发明的聚合物胶束在制备制剂中的用途,所述制剂用于降低或抑制细胞中的炎症细胞因子(例如tnf-α、ifn-α或il-6)和/或基质金属蛋白酶(例如mmp-3)的表达。
在某些实施方案中,所述制剂用于体内或者体外施用。例如,所述制剂可被施用至受试者体内,以降低或抑制受试者体内细胞中的炎症细胞因子(例如tnf-α、ifn-α或il-6)和/或基质金属蛋白酶(例如mmp-3)的表达;或者,所述制剂可被施用至体外细胞(例如细胞系或者来自受试者的细胞,例如滑液单个核细胞(sfmc)或滑膜样细胞(fls)),以降低或抑制体外细胞中的炎症细胞因子(例如tnf-α、ifn-α或il-6)和/或基质金属蛋白酶(例如mmp-3)的表达。
本发明中,所述受试者优选哺乳动物,例如牛科动物、马科动物、猪科动物、犬科动物、猫科动物、啮齿类动物、灵长类动物,例如,人。
本发明的阳离子型聚合物胶束,表面富集正电荷,通过改变阳离子型聚合物的氮含量(例如改变阳离子链段的结构或长度)可以调控表面电荷,氮含量越高,所带正电荷越高;通过改变阳离子型聚合物的亲疏水链段长度比,可以改变胶束粒径的大小,例如,亲水链段的聚合度与疏水链段的聚合度的比越大,胶束的粒径越小。可以通过以上的两个调控因素来改变胶束对cf-dna的结合能力,来改变胶束对类风湿性关节炎的治疗效果。
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所涉及的实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
如本文中使用的,术语“聚合物胶束”是指两亲性聚合物(例如两亲性嵌段共聚物)在溶剂(例如,水)中,当其浓度超过某一临界值时,由于疏溶剂部分(例如,疏水部分)或亲溶剂部分(例如,亲水部分)相互吸引,而形成的具有实心核-壳结构的组合体,其核由分子的疏溶剂部分(例如,疏水部分)组成,其壳由分子的亲溶剂部分(例如,亲水部分)组成。可通过例如,溶液自组装的方法,形成聚合物胶束。
如本文中使用的,术语“纳米颗粒”是指尺寸(即颗粒的最长维度中的直径)在纳米级(例如不大于1,000nm、不大于500nm、不大于200nm或不大于100nm)的颗粒,不限定其形状和形态,可以是实心颗粒,也可以是胶束、囊泡、脂质体等。
如本文中使用的,术语“嵌段共聚物”是指由两种或两种以上结构不同的链段组成的线性聚合物。
术语“阳离子型两亲性嵌段共聚物”是指(主要)由亲水性链段和疏水性链段组成的带有正电荷的共聚物。
如本文中使用的,术语“粒径”是指“等效粒径”,是指当被测颗粒的某种物理特性或物理行为与某一直径的同质球体(或组合)最相近时,就把该球体的直径(或组合)作为被测颗粒的等效粒径(或粒度分布)。
如本文中使用的,术语“药学上可接受的辅料”是指在生产药品和调配处方时使用的,除活性成分以外,在安全性方面已进行了合理的评估的,包含在药物制剂中的物质,其可以具有赋形、充当载体、提高稳定性、增溶、助溶和缓控释等功能中的一种或多种。
如本文中使用的,术语“游离核酸(cf-dna)”是指游离于细胞外的微量内源性或外源性核酸片段,包括游离dna、游离rna和线粒体dna等。
发明的有益效果
本发明的阳离子型聚合物胶束可以与cf-dna结合,降低与类风湿性关节炎相关的细胞因子(例如tnf-α、ifn-α、il-6等炎症细胞因子)和酶(例如基质金属蛋白酶,例如mmp-3)的表达,对类风湿性关节炎有明显的治疗效果。相对于非胶束态的阳离子均聚物,本发明的阳离子型聚合物胶束具有更好的安全性和更优的治疗效果。
下面将结合附图和实施例对本发明的实施方案进行详细描述,但是,本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
图1示例性地描述了本发明的阳离子聚合物胶束治疗类风湿性关节炎的机理和过程,如图所示,本发明的阳离子型聚合物胶束可通过静脉注射入关节炎模型小鼠的体内,对关节内的cf-dna进行抓捕,减少免疫细胞的激活,降低细胞因子的浓度,缓解类风湿性关节炎的症状,起到治疗作用。
图2显示了两亲性嵌段共聚物plga-b-pdma463的1hnmr谱图(a)(以pdma470作为参照)及gpc流出时间曲线(b)。
图3显示了阳离子型聚合物胶束cnp463的粒径分布图(a)以及tem照片(b)。
图4显示了cnp463胶束的体外抑制炎症实验的结果。
图5显示了体内药效实验中,各组大鼠的足趾容量变化和前爪和后爪的评分结果。
图6显示了不同组别大鼠第一次免疫后第29天踝关节micro-ct图。
图7显示了不同组别大鼠第一次免疫后29天组织切片he染色图,*表示骨头侵蚀,单箭头表示炎症浸润,双箭头表示软骨破坏。
图8显示了不同组别大鼠在治疗后体内的游离核酸、炎症细胞因子tnf-α、ifn-α、il-6和基质金属蛋白酶mmp-3的变化。
图9显示了体内安全性评价实验中,连续每天注射cnp463(12.5mg/kg或25mg/kg)或pdma470(12.5mg/kg或25mg/kg)大鼠的生存率。
图10显示了体内安全性评价实验中,正常大鼠(空白组)、模型组大鼠、静脉注射cnp463或pdma470的大鼠的肝功能指标(alp、alt、ast)和肾功能指标(肌酐、尿素、尿酸)检测的结果。
图11显示了体内安全性评价实验中,正常大鼠(空白组)、静脉注射cnp463或pdma470大鼠的肺部解剖图(a)和肺部he染色图(b)。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1制备两亲性嵌段共聚物plga-b-pdma463及包含其的阳离子型聚合物胶束
本实施例中用于制备胶束的阳离子型两亲性嵌段共聚物为plga-b-pdma463,其结构式如下所示:
1、plga-b-pdma463的制备过程如下:
s1.向9g酯封端的plga(市售;mη=8000;以1hnmr计算的mn=12000,摩尔量为0.75mmol)中加入90ml甲苯,共沸除水;
s2.将除完水后的酯封端的plga冷却至室温,加入50mlch2cl2,0.08ml三乙胺(1.28mmol);取0.06ml2-溴代异丁酰溴(1.28mmol),用2.5mlch2cl2稀释,冰水浴冷却下,逐滴滴加到盛有plga和三乙胺的烧瓶中,滴完后4小时后撤走冰浴,反应48个小时;
s3.将s2得到的产物用1mol/l的稀盐酸萃取一次,用1mol/l的碳酸氢钠萃取两次,用饱和氯化钠溶液萃取1次,有机相用无水mgso4干燥后,旋蒸至20ml后在200ml冷乙醚与冷甲醇的混合沉淀剂中沉淀三次,沉淀物在真空烘箱内烘干,得到大分子引发剂plga-br;
s4.将0.55g的大分子引发剂plga-br(0.046mmol)与dma、pmdeta、cubr按照摩尔比1:520:1:1进行atrp反应,加入3.5ml甲苯,冷冻-抽真空-通氮气循环三次后封管,在70℃下无水无氧反应52h;
s5.将s4得到的产物用20ml四氢呋喃稀释后过碱性氧化铝柱子除铜,并加入500ml四氢呋喃继续洗脱,收集洗脱液并旋转蒸发至15ml,滴入150ml冷的正己烷中沉淀三次,将沉淀物放入真空烘箱内烘干得到阳离子型两亲性嵌段共聚物plga-b-pdma463,数均分子量为85000,聚合物分散性指数(pdi)为1.21,dma单体转化率为90%。
图2显示了plga-b-pdma463的核磁共振氢谱(1hnmr)谱图(以pdma470为参照,制备过程参见实施例4)和凝胶渗透色谱(gpc)流出时间曲线。如图2a所示,相对于pdma470,plga-b-pdma463的h1nmr谱图上出现了plga的信号;如图2b所示,plga-b-pdma463的分子量分布较窄。上述结果证明了嵌段共聚物的形成。
2、基于plga-b-pdma463的阳离子型聚合物胶束(cnp463)的制备过程如下:
s1.将50mgplga-b-pdma463用4ml四氢呋喃溶解,配成12.5mg/ml的聚合物溶液a;
s2.在超声破碎仪的超声作用下,将溶液a逐滴缓慢加入到ph=3的20ml的稀盐酸水溶液中,自组装得到2.5mg/ml的plga-b-pdma463胶束溶液b;
s3.将溶液b装入截留分子量为3500的透析袋,在ph=3的稀盐酸中透析24h;
s4.收集透析后的b溶液,往里面加入磷酸二氢钾、磷酸氢二钠、氢氧化钠并调节ph至7.4得溶液c;
s5.将溶液c加到截留量为100k的超滤离心管中,用4000g/min的转速在4℃下离心30min,浓缩到15-30mg/ml;
制备得到的阳离子型聚合物胶束cnp463平均粒径为44nm,zeta电位为+18mv。
图3a为cnp463通过动态光散射(dls)测得的粒径分布图,图3b为cnp463的透射电镜(tem)照片。如图所示,cnp463为球形胶束,粒径分布较为均一。
实施例2
参照实施例1的方法,制备两亲性嵌段共聚物plga-b-pdma347,其结构式如下所示:
参照实施例1的方法,基于plga-b-pdma347制备阳离子型聚合物胶束cnp347,其平均粒径为66nm,zeta电位为+14mv。
实施例3
参照实施例1的方法,制备两亲性嵌段共聚物plga-b-pdma202,其结构式如下所示:
参照实施例1的方法,基于plga-b-pdma202制备阳离子型聚合物胶束cnp202。其平均粒径为97nm,zeta电位为+11mv。
实施例4
参照文献macromolecules31,5167-5169(1998)的方法制备水溶性阳离子聚合物pdma470,其结构式如下所示:
核磁共振氢谱(1hnmr)谱图和凝胶渗透色谱(gpc)流出时间曲线见图2。
实验例1聚合物胶束cnp463的体外抑制炎症实验
实验(1):在96孔板里每孔铺5×104ramosbluetm细胞,不同浓度(0.25μg/ml、2.5μg/ml、25μg/ml)的cnp463与1μm的cpg2006混合之后加入到孔里,与孔内100μl完全培养基混匀,于37℃孵育24小时后,离心收集上清液,加入quanti-blue在37℃孵育,用酶标仪检测620nm的od值。另以pdma470替代cnp463,进行相同的实验。实验结果如图4a所示。
实验(2):在96孔板里每孔铺5×104ramosbluetm细胞,并先加入含有1μm的cpg2006的100μl完全培养基,于37℃孵育4小时后,去掉旧培养基,更换为含有不同浓度(25μg/ml、50μg/ml)的cnp463的新培养基继续孵育24小时,离心收集上清液,加入quanti-blue,在37℃孵育,用酶标仪检测620nm的od值。另以pdma470替代cnp463,进行相同的实验。实验结果如图4b所示。
实验(3):在96孔板里每孔铺5×104个ra病人滑液单个核细胞(sfmc细胞),并用lipofectamine2000将1μg病人积液里的cfdna转染进去。在37℃孵育4小时后去掉旧培养基,更换为含有25μg/mlcnp463的新培养基继续孵育24小时后,收集上清液并用elisa方法检测tnf-α的含量。另以pdma470替代cnp463,进行相同的实验。实验结果如图4c所示。
实验(4):在96孔板里每孔铺5×103个ra病人滑膜样细胞(fls),并用lipofectamine2000将1μg病人积液里的cfdna转染进去。在37℃孵育4小时后去掉旧培养基,更换为含有25μg/mlcnp463的新培养基,继续孵育24小时后,收集上清液并用elisa方法检测il-6的含量。另以pdma470替代cnp463,进行相同的实验。实验结果如图4c所示。
实验结果:
图4a显示了cnp463胶束及pdma470对被细胞外cpg-odn2006激活的ramos-blue细胞的tlr9的抑制效果。
图4b显示了cnp463胶束及pdma470对进入细胞内的cpg-odn2006激活ramos-blue细胞的tlr9的抑制效果。
图4c显示了cnp463胶束及pdma470对被cfdna刺激的原代sfmc细胞的tnf-α表达的下调作用。
图4d显示了cnp463胶束及pdma470对被cfdna刺激的原代fls细胞的il-6表达的下调作用。
图4a-4d中,*表示0.01<p<0.05,**表示0.001<p<0.01,***表示p<0.001,代表与其他组别有显著性差异。
体外细胞实验证明,阳离子聚合物胶束cnp463及阳离子聚合物pdma470都能有效阻断细胞外cpg-odn及已经入细胞内的cpg-odn对ramos-blue的tlr9的激活。如图4a和4b所示,本发明的阳离子聚合物胶束有更强的dna结合能力,其抑制tlr9激活的效果比聚合物pdma470更好。如图4c和4b所示,阳离子聚合物胶束cnp463及阳离子聚合物pdma470都可以抑制被游离核酸激活的人的原代滑液单个核细胞(sfmc)及滑膜样细胞(fls)的炎症反应,有效降低原代滑液单个核细胞的炎症因子tnf-α和滑膜样细胞的il-6的表达。
实验例2阳离子型聚合物胶束cnp463对胶原诱导性关节炎(cia)大鼠的体内药效实验
实验过程:
1、分组:将7周龄体重为200g的lewis雌性大鼠,分为1组模型组、1组对照组(正常大鼠)、1组低剂量给药组、2组高剂量给药组(分别进行前期+高峰期治疗性给药和高峰期治疗性给药),每组各10只。
2、造模:将2mg/ml牛ii型胶原(bovinecollii)与5mg/ml弗式完全佐剂(cfa)以12000rpm/min的速率乳化1小时,制得乳剂。配制10%的水合氯醛溶液,按100g每0.3ml的量腹腔注射麻醉大鼠。取乳剂,每只大鼠分三点皮内注射,背部(靠近尾部)左右两点分别注射0.2ml,尾根部3cm处注射0.1ml,第7日采用同样的方法,再次注射乳剂加强免疫一次。
3、给药:
前期+高峰期治疗性给药:在第一次免疫后的第13天,在cia大鼠出现初期关节炎症状(如关节肿胀)的时候,分别以低剂量(12.5mg/kg)或高剂量(25mg/kg)将cnp463胶束溶液通过尾静脉注射到大鼠体内;连续对大鼠通过尾静脉注射给药15天;
高峰期治疗性给药:在第一次免疫后的第21天,以高剂量(25mg/kg)将cnp463胶束溶液通过尾静脉注射到cia大鼠体内;连续对大鼠通过尾静脉注射给药7天;
对模型组大鼠通过尾静脉注射等体积的pbs作为对照。
对照组大鼠不做任何处理。
4、测量足趾容量、采血:在给药期间,每一天用足趾测量仪测量每一组大鼠的足趾容量,并对大鼠的前爪和后爪的足趾肿胀程度进行评分;在第一次免疫后的第12天、第15天、第17天、第19天、第22天、第25天、第28天采血,测量游离核酸含量;在免疫后的第29天处死大鼠,取胫骨提取足趾rna,并对ifn-α、tnf-α、il-6及mmp-3的mrna水平进行半定量分析。
5、microct表征和组织切片:在第一次免疫后第29天处死大鼠,对其关节组织进行microct表征和组织切片研究。
按照上述过程,分别用胶束cnp202、胶束cnp347和聚合物pdma470进行实验。
大鼠前爪和后爪的评分方法(评分标准):
每天观察大鼠足趾肿胀程度,按照参考文献acsnano7,50-57(2013)中的评分标准对前爪和后爪进行评分。其中,
0分:没有出现红斑及肿胀;
1分:出现红斑及轻度肿胀;
2分:红斑及轻度肿胀由踝关节蔓延至跗骨;
3分:红斑及中度肿胀由踝关节蔓延至跖关节;
4分:红斑及重度肿胀覆盖了踝关节、爪子和足趾或出现四肢关节僵硬。
此外每天还用足趾容量测量仪测量后爪的足趾容量并记录。
游离核酸和细胞因子的含量的测量方法:
在免疫后第12、15、17、19、22、25、28天分别对每组大鼠眼眶取血,离心取血浆,用
在免疫后第29天处死大鼠并取其胫骨浸泡于trizol试剂中,将其用分散机研磨成匀浆后,使用rneasy-universaltissuekit试剂盒提取rna,将rna逆转录为cdna后用rt-pcr方法对ifn-α、tnf-α、il-6及mmp-3的mrna水平进行半定量分析。
实验结果:
图5显示了各组大鼠的足趾容量变化和前爪和后爪的评分结果,其中:
图5a显示了对照组、模型组、pdma低剂量前期+高峰期治疗性给药组和cnp463低剂量前期+高峰期治疗性给药组在第一次免疫后的第13天至第28天的后爪足趾容量;
图5b显示了模型组、pdma低剂量前期+高峰期治疗性给药组和cnp463低剂量前期+高峰期治疗性给药组在第一次免疫后的第13天至第28天的后爪评分;
图5c显示了模型组、pdma低剂量前期+高峰期治疗性给药组和cnp463低剂量前期+高峰期治疗性给药组在第一次免疫后的第13天至第28天的前爪评分;
图5d显示了对照组、模型组、cnp463低剂量前期+高峰期治疗性给药组、cnp202高剂量前期+高峰期治疗性给药组、cnp347高剂量前期+高峰期治疗性给药组、cnp463高剂量前期+高峰期治疗性给药组、cnp463高剂量高峰期治疗性给药组在第一次免疫后的第13天至第28天的后爪足趾容量;
图5e显示了模型组、cnp463低剂量前期+高峰期治疗性给药组、cnp202高剂量前期+高峰期治疗性给药组、cnp347高剂量前期+高峰期治疗性给药组、cnp463高剂量前期+高峰期治疗性给药组、cnp463高剂量高峰期治疗性给药组在第一次免疫后的第13天至第28天的后爪评分;
图5f显示了模型组、cnp463低剂量前期+高峰期治疗性给药组、cnp202高剂量前期+高峰期治疗性给药组、cnp347高剂量前期+高峰期治疗性给药组、cnp463高剂量前期+高峰期治疗性给药组、cnp463高剂量高峰期治疗性给药组在第一次免疫后的第13天至第28天的前爪评分;
如图5所示,三种胶束对大鼠足趾肿胀都有明显的抑制作用;同等给药剂量和给药时间下,cnp463的治疗效果比pdma470的效果更明显,表现为大鼠足趾肿胀程度更轻。
图6显示了不同组别大鼠第一次免疫后第29天踝关节micro-ct图。如图所示,胶束治疗组骨头侵蚀情况较轻,和模型组的骨头侵蚀程度区别明显。同等给药剂量和给药时间下,cnp463治疗组的骨头侵蚀程度比pdma470治疗组的骨头侵蚀程度更轻。
图7显示了不同组别大鼠第一次免疫后29天组织切片he染色图,*表示骨头侵蚀,单箭头表示炎症浸润,双箭头表示软骨破坏。如图所示,使用本发明的胶束治疗类风湿性关节炎,若从初期开始给药,可以取得明显的治疗效果,炎症细胞浸润大大减少,关节间隙依然较宽;而从高峰期开始给药也有一定的缓解作用,与模型组相比炎症细胞浸润程度降低。
图8a显示了不同时间点各组大鼠体内血浆中游离核酸浓度的变化;图8b显示了在结束治疗后不同组别的大鼠组织中ifn-α、tnf-α、il-6及mmp-3的mrna相对水平。
综合图5-图8的结果,可以看出,对于前期治疗性给药,低剂量的cnp463比低剂量的pdma治疗效果要好,表现为足趾肿胀程度更小,骨头侵蚀少及炎症浸润少。此外,高剂量的cnp463比低剂量的cnp463治疗效果好,其足趾容量更小,肿胀更少,骨头完整性更好,软骨也保持完整,仅在滑膜处有少量炎症浸润。高峰期治疗性给药的cnp463组尽管只在第21天到第28天给药,也有很好的治疗效果。经过cnp463治疗后,大鼠体内血浆游离核酸浓度及组织炎症因子含量都明显低于pdma治疗组和模型组,而更接近于空白组。以上结果表明,阳离子型聚合物胶束的治疗效果要比单纯的阳离子均聚物治疗效果好。此外,从图5-图8的结果可以看出,对于本发明的阳离子聚合物的胶束,增加其正电链段pdma的长度,有利于提高治疗效果。
实验例3阳离子型聚合物胶束cnp463的体内安全性评价
实验(1):将cia大鼠分为四组,每组十只大鼠,从第一次免疫后第13天起,连续每天对四组大鼠分别注射25mg/kgcnp463、12.5mg/kgcnp463、25mg/kgpdma470、12.5mg/kgpdma470,记录每组大鼠每天的死亡大鼠只数,死亡率=已死亡老鼠数目/每组大鼠总数×100%。根据死亡率作出生存曲线图。在第一次免疫后第13天(治疗前)、29天(治疗15天)和60天(停药后31天)对模型组、对照组的大鼠进行眼眶取血,离心血液取上层血清送至金域医学检测机构测量反映肝功能的碱性磷酸酶(alp)、谷丙转氨酶(alt)、谷草转氨酶(ast)指标及反映肾功能的尿酸、尿素、肌酐指标。
实验(2):取正常大鼠分别注射25mg/kgcnp463和25mg/kgpdma470,观察大鼠的行动力变化及死亡情况,若大鼠在注射药物24小内死亡,则及时进行解剖,若大鼠未死亡,则在注射药物24小时后处死大鼠并对其进行解剖,取出肺部进行拍照,并做成冰冻切片进行he染色观察。
实验结果
图9显示了连续每天注射cnp463(12.5mg/kg或25mg/kg)或pdma470(12.5mg/kg或25mg/kg)大鼠的生存率。如图所示,pdma470在高剂量的时候能造成大鼠的急毒性死亡,而低剂量的时候也会有高达40%的死亡率,而cnp463仅在高剂量时会造成约20%的死亡率,低剂量没有明显毒性。
图10显示了对各组大鼠的包括alp、alt及ast在内的肝功能指标和包括肌酐、尿素和尿酸在内的肾功能进行检测的结果。
对于alp,在骨骼疾病患者中由于成骨细胞增殖会使血清alp升高,而alp偏低常见于慢性肾炎、贫血;对于alt,在急性肝损伤时alt显著升高;对于ast,ast偏高说明肝功能受到影响,偏低或与脂肪肝有关联;对于肌酐,偏低说明营养不良;对于尿酸,尿酸偏高可能有类似痛风的症状,偏低可能为摄取蛋白质物质太少导致;对于尿素,偏高常见于急性或慢性肾炎,偏低可能由于摄取的蛋白量太少。
如图所示,cnp463组的肝功能和肾功能都更接近于正常组的大鼠,而pdma组则离正常组大鼠的指标相差较远。结果说明cnp463比pdma的肝毒性、肾毒性小。
图11显示了对cnp463及pdma470造成的体内急毒的评价结果。大鼠在尾静脉注射25mg/kg的pdma470后10min死亡,对其进行解剖,发现其肺部积血(如图11a中间的图片所示),he切片染色也看到起肺泡充满了水肿液(如图11b中间的图片所示),说明pdma470聚集在肺部并导致肺水肿,造成了急毒死亡。大鼠在尾静脉注射25mg/kg的cnp463后未发生急毒死亡,在注射药物24小时后处死大鼠,对其进行解剖,发现其肺部情况与空白组大鼠的肺部情况接近。
上述结果说明,本发明的阳离子聚合物胶束的体内毒性小于其对应的阳离子均聚物,生物安全性更好。
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公开的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!