一种治疗非霍奇金氏淋巴瘤的药物组合物的制作方法
本发明涉及一种治疗非霍奇金氏淋巴瘤的药物组合物,特别涉及一种治疗b细胞非霍奇金氏淋巴瘤的药物组合物。
背景技术:
伯基特淋巴瘤(burkitt’slymphoma,bl)是一种高度侵袭性的b细胞非霍奇金氏淋巴瘤(non-hodgkin’slymphoma,nhl),占所有年龄组淋巴瘤的3-5%,占儿童淋巴瘤的40-50%,其特征在于高表达的c-myc靶标和生发中心相关的b细胞基因,以及低表达的mhc-i分子和nf-κb靶基因。成人bl患者对chop(环磷酰胺、多柔比星、长春新碱和泼尼松龙)为基础的治疗方案反应较差,2年和5年总生存率(os)约为50-65%,若波及到骨髓或中枢神经系统则进一步降低至30%以下。相比之下,强化短期化疗方案将儿童bl患者的存活率显着提高至超过90%,在成人bl患者中,类似的治疗方案提高存活率至70%以上。然而,这些治疗方案却不可避免地会遇到药物毒性和耐药性的障碍。
利妥昔单抗联合chop化疗(r-chop)可使弥漫性大b细胞淋巴瘤(dlbcl)患者的总生存率提高至少20%。同样,许多单臂临床试验测试并进一步证实了利妥昔单抗对于bl强化短期化疗方案的效果。最近的一项iii期临床试验表明,化疗加上利妥昔单抗比单独化疗可达到更高的3年无事件生存率(75%对62%,p=0.024)和3年总生存率(83%对70%,p=0.011)。因此,增加利妥昔单抗在未来bl治疗方案的设计中备受期待,从而在该治疗过程中对利妥昔单抗耐药性的产生也将与其治疗dlbcl一样,预期也会出现。
尽管利妥昔单抗在治疗各种各样的b细胞淋巴瘤方面取得了巨大的成功,然而对利妥昔单抗的耐药性却是复发/难治性患者的一大挑战,且仍然约有50%的患者对利妥昔单抗的治疗无反应,而最初有应答的患者最终会对进一步的利妥昔单抗的治疗产生耐药性。
通过与膜cd20结合,利妥昔单抗主要通过抗体依赖性细胞毒性(adcc)和补体依赖性细胞毒性(cdc)杀伤淋巴细胞。对adcc的耐药可能来源于iggfc受体fcgammariiia基因的内在多态性,而对cdc的耐药很可能归因于cd20的表达下调和膜补体调节蛋白(mcrps)特别是cd59的表达上调。
为了改善利妥昔单抗的治疗功效,本领域研究人员已经作出相当大的努力来提高cd20的表达,例如通过组蛋白脱乙酰酶抑制剂曲古抑菌素a或合成cpg寡脱氧核苷酸,或通过修饰的单克隆抗体或细菌毒素衍生的ilyd4抑制cd59的功能。然而,其中只有cpg寡脱氧核苷酸在临床试验(i期)中进一步评估其在b细胞nhl患者中的安全性,并且没有进一步的临床试验报道。因此,需要寻找替代的治疗策略。因此,一方面,为了提高利妥昔单抗的抗肿瘤效果,另一方面,为了逆转对利妥昔单抗的耐药,本领域技术人员致力于开发一种可与利妥昔单抗组合的促凋亡剂用于b细胞淋巴瘤的治疗。
技术实现要素:
有鉴于现有技术中存在的上述问题,本发明的目的是提供一种治疗复发/难治性非霍奇金氏淋巴瘤(特别是对利妥昔单抗耐药的非霍奇金氏淋巴瘤)的药物组合物。
为实现上述目的,本发明首先提供了一种治疗非霍奇金氏淋巴瘤的药物组合物,包括蛋白激酶c(pkc)抑制剂和利妥昔单抗。
进一步,本发明所述治疗非霍奇金氏淋巴瘤的药物组合物还包括药学上可接受的载体或赋形剂。
进一步,本发明所述蛋白激酶c抑制剂包括但不限于:星形孢菌素及其类似物、吲哚卡巴唑类化合物、双吲哚马来酰胺类化合物、双吲哚马来酰胺大环化合物、2-烷基吲哚马来酰亚胺类化合物、balanol类化合物、n-苯基-2-嘧啶胺类衍生物、rottlerin、h-series抑制剂、磺胺和磺酰苯甲酰衍生物、单吲哚马来酰胺衍生物、腺苷-5’-端羧酸肽衍生物。
优选地,所述蛋白激酶c抑制剂选自米哚妥林、其衍生物、其药学上可接受的盐、其溶剂合物和其前药。
米哚妥林(midostaurin)是一种广谱的pkc抑制剂(pkc412),其来自于被修饰的星形孢菌素,以提高对pkc的选择性,并且进一步可以抑制其它激酶如flt3、pdgfr、kit和vegfr2及其代谢物。在i期临床试验中,米哚妥林慢性口服治疗是安全和可耐受的,并且由fda在临床治疗中证实;其具有如下式i所示的化学结构:
2017年4月,米哚妥林被批准用于治疗伴flt3(fms样酪氨酸激酶3)突变的急性骨髓性白血病(aml)和晚期系统性肥大细胞增多症(sm)。
本发明人在研究中发现米哚妥林单独或与利妥昔单抗联合用药可用于bl患者的治疗,特别是用于复发/难治性bl患者的治疗,以及进一步可用于其它具有高度活化的pkc的非霍奇金氏淋巴瘤患者的治疗,特别是用于具有高度活化的pkc的复发/难治性b细胞非霍奇金氏淋巴瘤。
尽管利妥昔单抗对淋巴细胞直接诱导细胞毒性的作用有时是有争议的,但许多研究表明利妥昔单抗在各种nhl细胞中缺乏促凋亡能力。我们的一系列研究揭示利妥昔单抗在包括bl细胞在内的非霍奇金氏淋巴瘤中未能诱导细胞凋亡达到任何可检测的程度,因此,细胞凋亡在利妥昔单抗抗肿瘤活性中所起的作用非常有限。因此,我们尝试通过结合其它具有促凋亡效应的药物来提高利妥昔单抗疗法的敏感性。大分子试剂包括靶向trail-r1的人源化单克隆马帕木单抗(mapatumumab)、基因工程融合蛋白scfvrit:sfasl、apo2配体(apo2l)/trail(dulanermin)和抗cd20-白细胞介素-21,以及小分子试剂包括选择性nedd8活化酶(nae)抑制剂pevonedistat(mln4924)、mtor抑制剂temsirolimus和蛋白酶体抑制剂bortezomib,增强了利妥昔单抗对b细胞nhl细胞的抗肿瘤活性。然而,它们的疗效需要进一步证实,或在临床试验中被证实为无效。
最终,本发明人在研究中发现米哚妥林通过促进bl细胞中的细胞凋亡而强烈增强利妥昔单抗的细胞毒性作用。
考虑到pkc在耐药bl细胞中高度磷酸化,我们测试了米哚妥林在原始和利妥昔单抗耐药的bl细胞中对利妥昔单抗抗肿瘤活性的作用,实验结果证实其在体外和体内都能强烈增强利妥昔单抗的抗肿瘤活性(尤其是在妥昔单抗耐药bl细胞中),进一步我们发现米哚妥林是通过促进细胞凋亡来增强利妥昔单抗的细胞毒性的,其可能是通过改变下游信号传导通路(包括bad、bcl-2和nf-κb)的磷酸化来实现的。
基于上述研究结果,本发明还提供了一种治疗非霍奇金氏淋巴瘤的药物组合物,其包括不同规格单位制剂的利妥昔单抗和蛋白激酶c抑制剂及药学上可接受的载体或赋形剂,用于同时、分别或依次给药。
进一步,本发明提供了一种治疗非霍奇金氏淋巴瘤的药物组合物,包括蛋白激酶c抑制剂和药学上可接受的载体形成的第一制剂,及利妥昔单抗和药学上可接受的载体形成的第二制剂。
可选地,上述制剂的剂型为注射给药制剂、经胃肠道给药制剂、呼吸道给药制剂、皮肤给药制剂、粘膜给药制剂或腔道给药制剂。
其中,本发明所述注射给药制剂包括但不限于静脉注射、肌内注射、皮下注射、皮内注射及腔内注射等;本发明所述经胃肠道给药制剂是指经口服用后进入胃肠道,起局部或经吸收而发挥全身作用的药物剂型,包括但不限于散剂、片剂、颗粒剂、胶囊剂、溶液剂、乳剂、混悬剂等;本发明所述呼吸道给药制剂包括但不限于喷雾剂、气雾剂、粉雾剂等;本发明所述皮肤给药制剂包括但不限于外用溶液剂、洗剂、搽剂、软膏剂、硬膏剂、糊剂、贴剂等;本发明所述粘膜给药剂型包括但不限于滴眼剂、滴鼻剂、眼用软膏剂、含漱剂、舌下片剂、粘贴片及贴膜剂等;本发明所述腔道给药制剂包括但不限于栓剂、气雾剂、泡腾片、滴剂及滴丸剂等。
优选地,所述蛋白激酶c抑制剂选自米哚妥林、其衍生物、其药学上可接受的盐、其溶剂合物和其前药。
在本发明的一种优选实施方式中,所述米哚妥林为口服,每日1-3次,每次剂量为50-100mg,连续服用10-18天为一个疗程;更优选为每日口服2次,每次50-100mg,连续服用14天为一个疗程;进一步,所述米哚妥林的服用剂量为1-4mg/kg/天。
在本发明的另一种优选实施方式中,所述利妥昔单抗为静脉注射,350-400mg/m2体表面积,更优选为375mg/m2体表面积,每周注射一次,四周为一个疗程。
进一步,本发明还提供了蛋白激酶c抑制剂在治疗对利妥昔单抗耐药的非霍奇金氏淋巴瘤中的应用,以及在制备对利妥昔单抗耐药的非霍奇金氏淋巴瘤治疗药物中的应用。
进一步,本发明还提供了利妥昔单抗和蛋白激酶c抑制剂在治疗非霍奇金氏淋巴瘤中的应用,以及在制备非霍奇金氏淋巴瘤治疗联合用药物中的应用。
其中,所述非霍奇金氏淋巴瘤为b细胞非霍奇金氏淋巴瘤,或者所述非霍奇金氏淋巴瘤为对利妥昔单抗耐药的非霍奇金氏淋巴瘤,或者所述非霍奇金氏淋巴瘤为具有高度活化的pkc的非霍奇金氏淋巴瘤。
本发明人在研究中发现蛋白激酶c(pkc)在耐受利妥昔单抗的bl细胞中高度上调并活化,而广谱pkc抑制剂(pan-pkc抑制剂)单独使用或与利妥昔单抗联合使用,可有效触发bl细胞的细胞凋亡并显著改善总生存期,特别是在耐受利妥昔单抗的bl细胞中;该结果可进一步扩展至对利妥昔单抗耐药的非霍奇金氏淋巴瘤,或具有高度活化的pkc的非霍奇金氏淋巴瘤。因此,在本发明的上述结论支持单独或与利妥昔单抗组合使用蛋白激酶c以治疗复发/难治性非霍奇金氏淋巴瘤,我们呼吁对其疗效进行进一步的临床试验评估。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
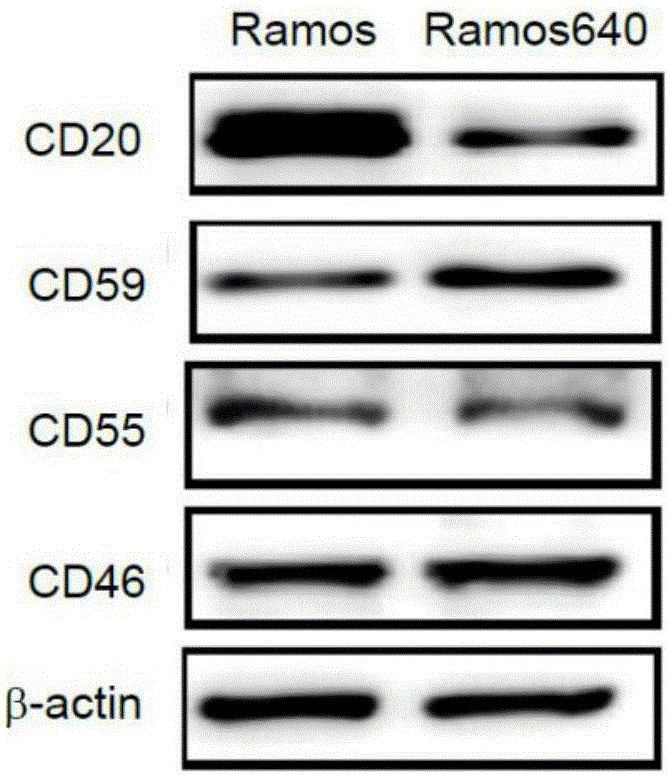
图1是ramos细胞和ramos640细胞中mcrps表达的western印迹图;
图2是ramos细胞和ramos640细胞中mcrps表达的facs分析比较结果:与原始细胞相比,ramos640细胞中cd20表达降低,cd59表达升高,cd55表达略有降低,cd46表达无差异,数据表示为平均值±sd,n=3,ns=无显著性差异,**p<0.01,***p<0.001,****p<0.0001;
图3是raji细胞和raji32细胞中mcrps表达的western印迹图;
图4是raji细胞和raji32细胞中mcrps表达的facs分析比较结果:与原始细胞相比,raji32细胞中cd20表达降低,cd59表达升高,cd55表达升高,cd46表达降低,数据表示为平均值±sd,n=3,**p<0.01,***p<0.001,****p<0.0001;
图5是pi3k抑制剂ipi-145(1μm)处理前后四组细胞中akt磷酸化水平和mcrps表达水平的western印迹图:与其原始细胞相比,ramos640细胞和raji32细胞中akt(s473)的磷酸化水平增加,其可被pi3k抑制剂ipi-145处理抑制,导致cd20和cd55的表达降低;
图6是在ramos细胞和ramos640细胞中加入ipi-145(1μm)对利妥昔单抗介导的cdc的影响:单独的ipi-145不能增加原始细胞和耐药细胞的细胞死亡率,在利妥昔单抗中添加ipi-145反而降低了原始细胞和耐药细胞中的利妥昔单抗介导的cdc,数据表示为平均值±sd,n=3,ns=无显著性差异,***p<0.001,并且****p<0.0001;rtx:利妥昔单抗(640μg/ml);nhs:正常人血清(20%v/v);
图7是在raji细胞和raji32细胞中加入ipi-145(1μm)对利妥昔单抗介导的cdc的影响:单独添加和在利妥昔单抗中添加ipi-145均增加了耐药细胞的细胞死亡率,但未增加原始细胞的细胞死亡率,这种联合用药显著增加了raji32细胞中利妥昔单抗介导的cdc,数据表示为平均值±sd,n=3,ns=无显著性差异,***p<0.001,并且****p<0.0001;rtx:利妥昔单抗(32μg/ml);nhs:正常人血清(20%v/v);
图8是在磷酸化抗体微阵列中上调大于1.5倍的磷酸化蛋白及其磷酸化位点的列图;
图9是图8中上调蛋白的ipa(ingenuitypathwayanalysis)分析结果,实线表示直接调节,虚线表示间接调节;
图10是ramos640细胞与ramos细胞rna-seq数据比较后获得的抗凋亡tnfs:nf-κb:bcl-2通路的gsea富集特征图,fdr<0.25被认为是显著的;
图11是ramos640细胞与ramos细胞rna-seq数据比较后获得的p53通路的gsea富集特征图,fdr<0.25被认为是显著的;
图12是pkcα/β1/β2/γ/η在四种bl细胞中表达及pkc与其下游的抗凋亡蛋白的磷酸化以及pck抑制剂米哚妥林(1μm)对它们影响的western印迹图,该图表明pkc亚型在耐药细胞中上调导致pkc磷酸化升高,并且激活了下游的抗凋亡蛋白,而米哚妥林抑制了pkc及其下游信号;
图13是ramos细胞和ramos640细胞中pan-pkc抑制剂米哚妥林诱导细胞凋亡的结果图,其中control:培养基对照,rtx:利妥昔单抗(640μg/ml),mido:米哚妥林(1μm);该图表明pan-pkc抑制剂有效地诱导了原始和耐药ramos细胞的细胞凋亡,并且将利妥昔单抗添加到米哚妥林中能显著增强ramos640细胞中的促凋亡效应,数据表示为平均值±sd,n=3,**p<0.01,***p<0.001和****p<0.0001;
图14是raji细胞和raji32细胞中pan-pkc抑制剂米哚妥林诱导细胞凋亡的结果图,其中control:培养基对照,rtx:利妥昔单抗(32μg/ml),mido:米哚妥林(1μm);该图表明pan-pkc抑制剂有效地诱导了原始和耐药raji细胞的细胞凋亡,数据表示为平均值±sd,n=3,**p<0.01,***p<0.001和****p<0.0001;
图15是pkc抑制剂米哚妥林(1μm)对四种细胞中mcrps表达影响的western印迹图,该图表明米哚妥林显著降低了原始和耐药细胞中的cd20表达以及耐药细胞中的cd59表达,但未改变原始细胞或耐药细胞中cd55和cd46的表达;
图16是pkc抑制剂米哚妥林对ramos细胞和ramos640细胞中利妥昔单抗介导的cdc的作用效果,其中control:培养基对照,rtx:利妥昔单抗(640μg/ml),mido:米哚妥林(1μm),nhs:正常人血清(20%v/v);该图表明在原始ramos细胞中,加入米哚妥林未能增强利妥昔单抗介导的cdc,然而在耐药细胞中增加了cdc,数据表示为平均值±sd,n=3,***p<0.001和****p<0.0001;
图17是pkc抑制剂米哚妥林对raji细胞和raji32细胞中利妥昔单抗介导的cdc的作用效果,其中control:培养基对照,rtx:利妥昔单抗(32μg/ml),mido:米哚妥林(1μm),nhs:正常人血清(20%v/v);该图表明在原始raji细胞中,加入米哚妥林未能增强利妥昔单抗介导的cdc,然而在耐药细胞中增加了cdc,数据表示为平均值±sd,n=3,***p<0.001和****p<0.0001;
图18是在接种raji32-luc细胞后第50天肿瘤的生长情况,肿瘤质量由萤火虫荧光素酶活性强度表示,rtx:利妥昔单抗,mido:米哚妥林;
图19是图18中总光子通量的定量结果,数据表示为平均值±sem(n=7),*p<0.05,**p<0.01和***p<0.001;
图20是在接种raji32-luc细胞后第70天肿瘤的生长情况,肿瘤质量由萤火虫荧光素酶活性强度表示,“x”代表小鼠死亡,rtx:利妥昔单抗,mido:米哚妥林;
图21是图19中总光子通量的定量结果,数据表示为平均值±sem(n=7),*p<0.05,**p<0.01和***p<0.001;
图22是在接种raji32-luc细胞后第90天肿瘤的生长情况,肿瘤质量由萤火虫荧光素酶活性强度表示,“x”代表小鼠死亡,rtx:利妥昔单抗,mido:米哚妥林;
图23是图21中总光子通量的定量结果,数据表示为平均值±sem(n=7),*p<0.05,**p<0.01和***p<0.001;
图24是接种raji32-luc细胞后用药物处理的不同组小鼠的存活曲线,数据表示为平均值±sem(n=7)。*p<0.05,**p<0.01和***p<0.001。
具体实施方式
实施例1对利妥昔单抗介导的cdc耐受的raji细胞和ramos细胞的构建
利妥昔单抗介导的adcc由个体患者的免疫细胞进行,其对adcc的耐受性由免疫细胞的内在特征引起,如fcγriiia基因多态性。而细胞凋亡在利妥昔单抗抗肿瘤活性中只起着微不足道的作用。因此,我们构建了两种bl细胞系ramos640和raji32,它们分别在利妥昔单抗浓度640和32μg/ml时对利妥昔单抗介导的补体依赖性细胞毒性耐受。其构建方法具体如下:
两种bl细胞系raji和ramos均购自美国模式培养物集存库(americantypeculturecollection,atcc)(manassas,va),细胞培养在含有10%(体积含量)胎牛血清(gibcobrl公司,grandisland,ny)和1%(体积含量)青霉素/链霉素(ambion公司,austin,tx)的rpmi1640培养基中。
作为补体资源,从10名健康人体中采集获得的正常人血清(nhs),合并后作为提供补体来源的试剂。上述血清等分后在-80℃下储存直至使用。另外,上述血清在65℃水浴中孵育30分钟制备的热灭活人血清(ihs)作为阴性对照。
用浓度逐渐升高的利妥昔单抗(roche公司,basel,switzerland)分别处理原始的raji细胞和ramos细胞。在20%(体积含量)nhs存在下,浓度分别从4或40μg/ml经依次以2倍浓度的倍数升高至32或640μg/ml,得到的耐药细胞分别被称为raji32和ramos640。它们每21天分别用含20%(体积含量)nhs的32μg/ml和640μg/ml的利妥昔单抗处理以维持对利妥昔单抗的耐药性。
实施例2免疫印迹分析和cdc效果测定
本发明根据标准方法进行了免疫印迹分析。
cdc效果用荧光激活细胞分选(facs)分析检测碘化丙啶(pi)染色阳性细胞来测定。具体地,用pbs洗涤后,将细胞与荧光素缀合的抗体温育30分钟,然后漂洗并重新悬浮于pbs中。流式细胞分析在cytomicsfc500mpl流式细胞仪(beckmancoulter公司,brea,ca)上进行并用flowjo软件(ashland公司,or)进行分析。我们用mofloxdp仪(beckmancoulter公司,brea,ca)根据相关的荧光进行细胞分选,使用pe膜联蛋白v凋亡检测试剂盒(bdpharmingen公司,sandiego,ca)按照其制造商的说明书进行细胞凋亡分析。
实施例3cd20下调和cd59上调导致bl细胞对利妥昔单抗介导的cdc的耐受
使用免疫印迹分析(图1和图3)和facs(图2和图4),我们发现与其原始细胞相比,在两种耐药细胞中cd20的表达都降低,而cd59的表达都升高(图1-图4)。然而,另外两种膜补体调节蛋白(mcrp)cd55和cd46在两种耐药细胞中的表达并不一致。cd55在ramos640中的表达降低,而在raji32中的表达升高;而cd46在ramos640中的表达没有改变,但在raji32中的表达下降(图1-图4)。这些结果与先前的报道一致,即降低的cd20表达和升高的cd59表达导致bl细胞对利妥昔单抗介导的cdc的耐受性。但是,由于前人在提高cd20表达和抑制cd59功能的研究中均未获得很好的结果,因此,本发明尝试了其他的治疗策略。
实施例4pi3k/akt通路的强烈富集,但对其的抑制未能逆转耐药性
本发明通过蛋白质信号通路分析对耐药机理做了进一步的研究,本实施例使用磷酸化抗体微阵列来识别在ramos640细胞中被激活的功能性蛋白质和信号传导通路。
我们用磷酸化抗体芯片(fullmoonmicrosystems,catalog#csp100,sunnyvale,ca)分析了蛋白的磷酸化,其中包含针对131个蛋白质磷酸化位点的269个抗体,并根据其建立的方法由wayen生物科技公司(上海,中国)进行分析。
荧光分析显示与ramos细胞相比,ramos640中35个蛋白的磷酸化水平上调(31/35)或下调(4/35)超过1.4倍。这些蛋白的kegg信号通路分析证明pi3k/akt信号传导通路含有最多的磷酸化蛋白位点,为13个,而细胞凋亡通路显示出最大的富集倍数为47.76(如表1所示)。
表1用磷酸化抗体微阵列测定的ramos640细胞相对于ramos细胞的富集通路
接下来,使用pi3k抑制剂ipi-145来鉴定对pi3k的抑制是否可以提高耐药bl细胞对利妥昔单抗治疗的敏感性。pi3k抑制剂ipi-145购自selleckchemicals公司(houston,tx)。
具体地,将原始细胞和耐药细胞以1×104个细胞/100μl/孔的密度接种到96孔板中,并分别分为四组,第一组用培养基培养48小时作为对照,第二组用含ipi-145浓度为1μm的培养基处理48小时,第三组用含20%(体积含量)nhs且利妥昔单抗浓度为640μg/ml或32μg/ml的培养基处理48小时,第四组用含20%(体积含量)nhs且利妥昔单抗浓度为640μg/ml或32μg/ml、ipi-145浓度为1μm的培养基处理48小时。
使用cytotox-glotm细胞毒性测定试剂盒(promega公司,madison,wi)根据其技术公报所述的步骤进行细胞毒性分析,并根据下式计算细胞毒性:
细胞毒性(%)=死细胞发光量/总发光量×100%
除非另有说明,本发明数据以平均值±标准差表示。两组之间的显著差异使用未配对数据的双尾学生t检验来确定。在所有分析中,p<0.05被认为是统计学显著的。
实验结果首先证实了pi3k/akt信号通路在ramos640和raji32细胞中与其原始细胞相比被激活,并且ipi-145有效地削弱了akt的磷酸化(s473)(图5)。然而,在原始细胞和耐药细胞中,ipi-145的处理明显抑制了cd20的表达,而其它三种mcrp包括cd59、cd55和cd46的表达几乎没有改变(图5)。这些结果随后导致ipi-145对原始和耐药细胞中利妥昔单抗介导的cdc无效甚至有略微相反的作用(raji32细胞除外)(图6和图7)。在raji32细胞中,单独或联合利妥昔单抗的ipi-145分别与对照或单独的利妥昔单抗相比略微增加了细胞的死亡率(图7)。这些结果表明,pi3k/akt可能不是促进利妥昔单抗治疗的有价值的药物靶标。
实施例5pkc介导的细胞凋亡通路在耐药性细胞中高度活化
考虑到利妥昔单抗诱导b-nhl(b细胞型非霍奇金氏淋巴瘤)细胞凋亡的效应可忽略不计,因此向利妥昔单抗添加可诱导细胞凋亡的试剂可能是一种理想的治疗策略。
尽管细胞凋亡通路在磷酸化抗体微阵列中被鉴定为富集倍数最高的通路,但该通路中仅包含6种蛋白(表1),这阻碍了通路调节剂的选择。因此,我们通过将磷酸化抗体微阵列中上调和下调的磷酸化蛋白位点的倍数变化提高到1.5倍来缩小查找范围,结果显示总共16个蛋白质位点上调了1.5倍(图8)。
通过david生物信息数据库筛选具有倍数变化>1.5的差异蛋白以进行功能注释。有趣的是,通过ipa通路分析软件(ingenuitypathwayanalysis)(qiagen公司,duesseldorf,germany)确定了所有这些上调的蛋白/位点都参与了细胞凋亡(图9);更重要的是,ipa还揭示了pkc(蛋白激酶c)信号调节所有这些上调蛋白,尽管pkc磷酸化的检测不包括在磷酸化抗体微阵列集中,通过ipa分析获得的pkc亚基与差异蛋白之间的相互作用网络如图9所示。
接着,我们用rna-seq对原始和耐药ramos细胞进行了rna测序并进一步做了基因富集分析。
rna测序方法:
用trizol试剂(invitrogen公司,grandisland,ny)分别从ramos和ramos640细胞中提取总rna。将各组中来自3个不同代细胞的总rna分别合并在一起。用生物分析仪2200(agilenttechnologies公司,santa,clara,ca)鉴定rna质量并保存在-80℃中。rna完整数(rin)>8.0的rna对于cdna文库构建是可接受的。由上海novelbio有限公司进行rna-seq的测序,使用iontatalrna-seq试剂盒v2.0(lifetechnologies公司,gaithersburg,md)为每个合并的rna样品构建cdna文库,然后进行质子测序过程。在读取映射之前,通过去除接头序列从原始读取结果中获得干净读取结果,然后使用mapsplice程序(v2.1.6)与人类基因组(版本:grch37ncbi)比对。我们应用deseq算法筛选差异表达基因,显著性分析和错误发现率(fdr)分析的标准如下:(1)倍数变化>1.5或<0.667;(2)fdr<0.05。
基因集富集分析方法:
本发明使用基因集富集分析gsea软件(麻省理工学院broad研究所)来鉴定rna-seq中发现的差异表达基因的功能。该软件的预定版本被用于鉴定显著富集的通路,并且fdr<0.25的富集通路被认为是显著的。本发明中使用的抗凋亡tnfs:nf-κb:bcl-2通路基因集由来自pathcards通路统一数据库(4.6.0.37版,weizmann科学院)中的“凋亡和存活抗凋亡tnfs:nf-κb:bcl-2通路superpath”的42个基因组成。本发明使用的p53通路基因集由来自pathcards通路统一数据库中的“p53通路(rnd)superpath”的132个基因组成。
通过rna-seq检测原始和耐药ramos细胞以及gsea分析,我们进一步发现,与ramos细胞相比,ramos640细胞中tnfs:nf-κb:bcl-2通路的基因显著升高,而p53通路的基因则显著降低(图10和图11)。它们还表明了抗凋亡基因上调而促凋亡基因下调。因此,这些数据表明pkc磷酸化多个下游蛋白,导致ramos640细胞中产生了抗细胞凋亡作用。
实施例6pan-pkc抑制剂米哚妥林(midostaurin)显著促进细胞凋亡
米哚妥林是一种多激酶抑制剂,最初旨在抑制pkc,目前已被批准用于伴flt3(fms样酪氨酸激酶3)突变的急性骨髓性白血病(aml)和晚期系统性肥大细胞增多症(sm)。本发明所用pkc抑制剂米哚妥林购自selleckchemicals公司(houston,tx)。
本实施例首先比较了原始bl细胞和耐药bl细胞中5种pkc亚型的表达水平,发现pkcα/β2/γ/η在ramos640细胞中,pkcα/β1/β2/γ/η在raji32细胞中,与其原始细胞相比过表达,更重要的是,两种耐药细胞中所有pkc亚型的磷酸化水平均显著升高(图12)。此外,我们检测了米哚妥林对调节pkc磷酸化的作用。我们观察到,它在耐药bl细胞和原始ramos细胞中强烈抑制pkc的磷酸化水平,但在原始raji细胞中没有,并且它降低了ramos细胞中pkcβ2/η、ramos640细胞中pkcα/η以及raji32细胞中pkcβ1/η的表达水平(图12)。
接下来,我们检测了几种pkc下游信号分子的磷酸化水平,包括bad、bcl-2和nf-κb亚基p65。我们首先发现它们的磷酸化水平显著升高(图12)。此外在两种耐药细胞中,bad的表达水平显著降低,p65的表达水平显着升高(图12)。所有上述变化都可能对细胞凋亡抑制有很大贡献,从而导致ramos640细胞和raji32细胞对利妥昔单抗的耐药性的发展。另外,在所有原始细胞和耐药细胞中,米哚妥林强烈抑制了bad、bcl-2和p65的磷酸化水平(图12)。进一步,米哚妥林分别明显地增加或减少了所有四种原始细胞或耐药细胞中的bad或p65的表达,并且仅在原始的和耐药的raji细胞中降低了bcl-2的表达(图12)。因此,米哚妥林抑制pkc及其下游信号,这可能在不同程度上导致ramos和raji细胞中的促凋亡作用。其中raji细胞似乎比ramos细胞更能抵抗米哚妥林介导的pkc磷酸化,因为米哚妥林未能抑制pkc磷酸化。
此外,我们检测了单独使用pan-pkc抑制剂米哚妥林(1μm)或与利妥昔单抗(针对raji细胞的用药浓度为32μg/ml,针对ramos细胞的用药浓度为640μg/ml)联用对原始和耐药bl细胞的促凋亡作用。
具体地,将原始细胞和耐药细胞以1×104个细胞/100μl/孔的密度接种到96孔板中,并分别分为四组,第一组用培养基培养48小时作为对照,第二组用利妥昔单抗浓度为640μg/ml或32μg/ml的培养基处理48小时,第三组用含米哚妥林浓度为1μm的培养基处理48小时,第四组用含利妥昔单抗浓度为640μg/ml或32μg/ml、米哚妥林浓度为1μm的培养基处理48小时。
使用cytotox-glotm细胞毒性测定试剂盒(promega公司,madison,wi)根据其技术公报所述的步骤进行细胞毒性分析,并根据下式计算细胞毒性:
细胞毒性(%)=死细胞发光量/总发光量×100%
除非另有说明,本发明数据以平均值±标准差表示。两组之间的显著差异使用未配对数据的双尾学生t检验来确定。在所有分析中,p<0.05被认为是统计学显著的。
正如我们所预料的那样,利妥昔单抗单独治疗在全部四种原始或耐药bl细胞中均未能诱导的细胞凋亡(图13和图14)。然而,与培养基对照相比,单独使用米哚妥林显著诱导了ramos细胞(从4.7%至63.3%)、ramos640细胞(从10.8%至50.2%)和raji32细胞(从6.4%至25.4%)的细胞凋亡,而raji细胞只是略微上升(从6.6%到10.9%),尽管p值达到了统计学显著性(p=0.0038)(图13和图14)。这些结果也从功能上确定了,一般来说,raji细胞比ramos细胞更能抵抗米哚妥林诱导的细胞凋亡。此外,米哚妥林与利妥昔单抗联用仅在原始细胞而非耐药ramos细胞和raji细胞中呈现轻微的进一步促凋亡效应(图13和图14),进一步证实了利妥昔单抗的促细胞凋亡效应(如果存在)是可忽略的。
实施例7米哚妥林加强了耐药bl细胞对利妥昔单抗介导的cdc的易感性
在本实施例中我们使用pan-pkc抑制剂米哚妥林来鉴定对pkc的抑制是否可以提高耐药bl细胞对利妥昔单抗治疗的敏感性。
具体地,将原始细胞和耐药细胞以1×104个细胞/100μl/孔的密度接种到96孔板中,并分别分为四组,第一组用培养基培养48小时作为对照,第二组用含20%(体积含量)nhs且利妥昔单抗浓度为640μg/ml或32μg/ml的培养基处理48小时,第三组用含米哚妥林浓度为1μm的培养基处理48小时,第四组用含20%(体积含量)nhs且利妥昔单抗浓度为640μg/ml或32μg/ml、米哚妥林浓度为1μm的培养基处理48小时。
使用cytotox-glotm细胞毒性测定试剂盒(promega公司,madison,wi)根据其技术公报所述的步骤进行细胞毒性分析,并根据下式计算细胞毒性:
细胞毒性(%)=死细胞发光量/总发光量×100%
除非另有说明,本发明数据以平均值±标准差表示。两组之间的显著差异使用未配对数据的双尾学生t检验来确定。在所有分析中,p<0.05被认为是统计学显著的。
除了cd20之外,利妥昔单抗介导的cdc可以通过mcrp的表达来调节,例如cd46、cd55、特别是cd59。我们观察到,米哚妥林(1μm)显著降低了所有四种bl细胞中cd20的表达水平,而cd59的表达水平的降低则主要在耐药细胞中;而对cd55和cd46的表达没有影响(图15)。这些结果表明,由于原始bl细胞中仅有cd20的表达降低,所以米哚妥林可能阻碍了利妥昔单抗介导的cdc,而由于耐药bl细胞中cd20和cd59两者的表达都降低了,因此其对耐药bl细胞的作用需要进一步检测。此外,这些结果显示了ipi-145和米哚妥林对调节cd20和cd59表达的影响之间的差异,其中ipi-145仅在耐药bl细胞中减少cd20的表达但不减少cd59的表达(图5)。
利妥昔单抗(针对raji细胞的用药浓度为32μg/ml,针对ramos细胞的用药浓度为640μg/ml)加nhs(20%,v/v)有效诱导了原始ramos细胞和raji细胞中的cdc,然而,添加米哚妥林(1μm)未能增强利妥昔单抗介导的cdc的易感性,尽管它可促进细胞凋亡(图16和图17)。这可能是由于利妥昔单抗单独治疗导致的cd20表达降低和已经很高的细胞死亡率。相反,利妥昔单抗的添加显著增强了原始bl细胞中米哚妥林的细胞毒性作用(图16和图17),表明在原始bl细胞中利妥昔单抗介导的cdc的作用大于的米哚妥林诱导的细胞凋亡。有趣的是,我们发现利妥昔单抗和米哚妥林联用的细胞毒性作用在耐药的ramos640细胞和raji32细胞中具有协同效果。如图16所示,利妥昔单抗和米哚妥林分别诱导了17.1%和54.3%的细胞死亡,而它们的组合诱导了72.8%的细胞死亡。类似地,如图17所示,利妥昔单抗和米哚妥林分别诱导28.0%和25.8%的细胞死亡,而它们的组合诱导62.9%的细胞死亡。该结果可能源于利妥昔单抗和米哚妥林独特的抗肿瘤机制。
实施例8利妥昔单抗与米哚妥林联用显著抑制了耐药细胞的肿瘤生长
鉴于米哚妥林的明显促细胞凋亡效应可能有助于完善利妥昔单抗的抗肿瘤活性,我们在接种了由表达萤光素酶的质粒转染的更具耐药性的raji32细胞的免疫缺陷小鼠中,测试了利妥昔单抗与米哚妥林联用的疗效。
质粒构建和慢病毒转导
萤火虫萤光素酶基因的cds(codingsequence,蛋白质编码区)通过pcr扩增从pgl3-basic质粒获得,并通过ecori和bamhi内切酶位点插入到pcdhcdna克隆和表达载体中。萤火虫萤光素酶cds扩增的引物如下所示:
正向引物5'-atggaagacgccaaaaacataaag-3'
反向引物5'-ttacacggcgatctttccgccctt-3'
将pcdh质粒与pmd.2g和pspax2质粒在293ft细胞中共转染以产生萤火虫荧光素酶过表达慢病毒。随后将该慢病毒加入到raji32细胞培养基中孵育48小时。本发明中用慢病毒转染的所有细胞均用gfp及mofloxdp仪(beckmancoulter公司,brea,ca)进行分类,称为raji32-luc细胞。
异种移植模型
8周龄雌性scid小鼠购自slac(shanghailaboratoryanimalcenter,上海实验动物中心)。将raji32-luc细胞重悬于pbs中,然后给每只小鼠腹膜内注射1.5×107个细胞。基于给药药物的不同,即生理盐水、利妥昔单抗、米哚妥林和利妥昔单抗加米哚妥林,将小鼠分成4组(每组7只小鼠)。肿瘤接种后第8、12和16天,腹腔注射118.4mg/kg利妥昔单抗,以及肿瘤接种后第8、9、10、11、12、13、14、15、16、17、18、19、20和21天,用米哚妥林20mg/kg灌胃。盐水给药的注射量时与利妥昔单抗相同。肿瘤接种后的第50、70和90天通过生物发光监测肿瘤的生长,将d-荧光素(promega公司,madison,wi)腹膜注射到小鼠(150mg/kg)体内,十分钟后,腹膜注射戊巴比妥(50mg/kg)麻醉小鼠,然后使用in-vivomsfxpro系统(bruker公司,billerica,ma)进行生物发光检测。用30秒的曝光时间捕获发光图像,并通过brukermi软件测量肿瘤的信号强度。记录每只小鼠的存活时间直到120天。所有动物实验均严格按照复旦大学上海医学院动物伦理委员会批准的实验方案进行。
除非另有说明,本发明数据以平均值±标准差表示。对于动物模型的总光子通量,通过单尾mannwhitney检验来确定显著性。我们应用mantel-cox检验来比较两组异种移植模型的存活率。在所有分析中,p<0.05被认为是统计学显著的。
肿瘤接种后第50天,我们检测了肿瘤的生长情况,结果如图18和图19所示,用总光子通量表示肿瘤的生长,按照生理盐水对照组、利妥昔单抗组、米哚妥林组、利妥昔单抗+米哚妥林组的顺序排列,其中所有相邻两组在肿瘤质量中均显示出统计学显著差异。
肿瘤接种后第70天的结果如图20和图21所示,生理盐水组的7只小鼠中有3只死亡,利妥昔单抗组的7只小鼠中有1只死亡,而利妥昔单抗+米哚妥林组的所有7只小鼠均存活(图20)。存活小鼠中的肿瘤块表现出相似的结果,即生理盐水组或利妥昔单抗组的肿瘤生长速度远高于米哚妥林或联合治疗组中的肿瘤(图21)。
肿瘤接种后第90天的结果如图22和图23所示,在生理盐水组、利妥昔单抗组、米哚妥林组和联合治疗组中分别有1只、1只、4只和6只小鼠存活(图22)。用生理盐水处理的存活小鼠中的肿瘤块大于利妥昔单抗处理的存活小鼠中的肿瘤块(图23)。
此外,图24的生存曲线分析表明,与单用利妥昔单抗相比,单独使用米哚妥林或与利妥昔单抗联合使用显著延长了存活率,表明由米哚妥林诱导的促凋亡作用对bl的治疗可能是必需和有益的,米哚妥林可作为补充的治疗药物使用,尤其是在利妥昔单抗耐药性bl的治疗方案中。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!