冻干脂质体的制作方法
相关申请本申请要求2011年10月21日提交的美国申请系列号61/550,047的权益,将其全部内容通过引用并入本文。本发明涉及生产冻干脂质体的组合物和方法,所述冻干脂质体包含至少两种治疗剂或诊断剂,可以在延长的时间段储存。在一个方面,本发明涉及任选地在包含低温保护剂的外部介质中的低-胆固醇脂质体,所述低温保护剂能抵抗脂质体的冷冻/解冻和脱水损害,因此保持其大小(粒度)和完整性。
背景技术:
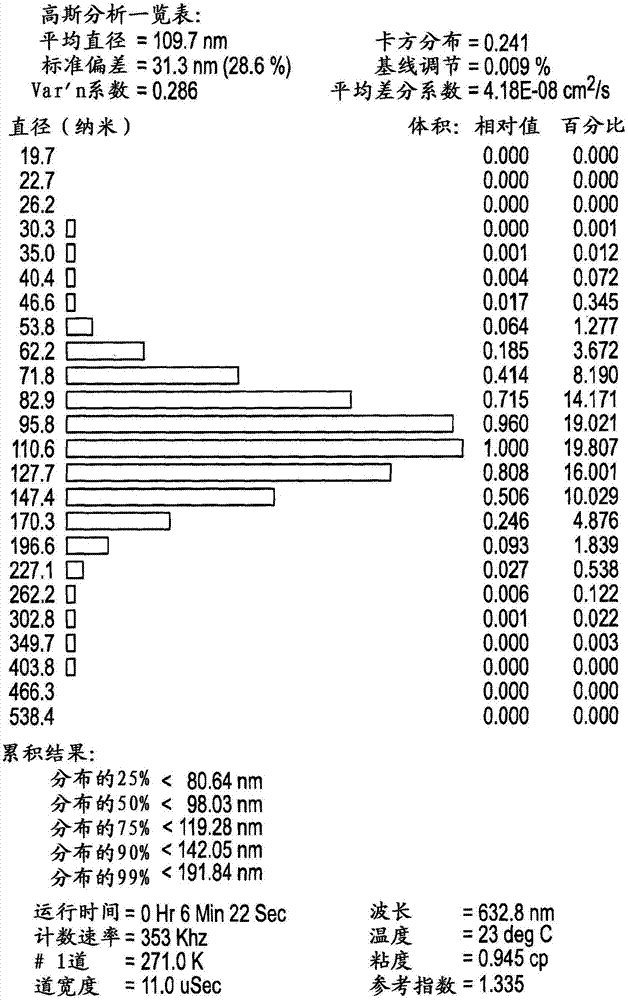
脂质体是封闭的小囊泡,具有包围水性核芯的至少一个脂质双层。脂质体内的空间和脂质层可以包埋多种物质,包括药物、化妆品、诊断剂、遗传物质和生物活性化合物。由于无毒性脂质充当脂质体的基质,它们通常显示出低毒性。低毒性结合脂质体提高试剂的血浆循环寿命的能力使得脂质体作为对于递送可药用活性剂特别有用的载体。在许多情况下,脂质体-递送的药物得到与毒性降低相匹配的更好的临床功效。脂质体制剂作为药物递送载体的实际应用受制剂的化学和物理稳定性的限制。商业化需要化学和物理水平两方面的长期稳定性。使用冷冻的或冷冻干燥的(冻干的)制剂以避免破坏不稳定的药物和/或脂质成分在稳定性方面提供了一些改善。然而,在冷冻干燥过程期间,冰晶形成可导致机械性破裂、脂质体聚集和融合(引起脂质体大小增加)。而且,包含冻干药物的脂质体,然后在室温下重构时,其双层结构通常出现变化,这导致加速的药物渗漏。之前,在制备冻干脂质体组合物方面的尝试依赖于常规脂质体,其在体温下通常为液相,其中脂质的移动是流动的且不受控制的。这样的常规脂质体分成两类。第一类保持液态,因为其包括其中凝胶-至-液体结晶温度(tc)低于体温的脂质(即,它们将在体温下为液相形式)。现有技术中通常使用这些脂质体,然而;对于许多包封试剂,成为液体的缺点是药物保留性差。第二类常规脂质体从不进行液体向凝胶的转变,因为其包括高含量的膜硬化剂(membranerigidificationagents),比如胆固醇(例如30-45mol%)。胆固醇起的作用是增加双层厚度和流动性,同时降低脂质体的膜透性、蛋白相互作用和脂蛋白失稳。在脂质体研究中,最常使用这些高含量的胆固醇,过去已经教导了其对于体内的足够的血浆稳定性和药物保留是必需的,尽管并非所有药物都可以充分地保留。在基本上不含胆固醇的脂质体中,某些药物在体外和体内都显示出更好的药物保留。参见,例如dossantos,等人,biochim.biophs.acta,(2002)1561:188-201。另一方面,凝胶相的脂质体更稳定,且显示出改善的药物保留。本发明利用在体温下为凝胶相的脂质体(即,体温低于脂质体的tc)。凝胶相脂质体可以采用大量脂质制备;然而,为了在体温下获得凝胶相,采用更饱和的酰基侧链磷脂酰基脂质(比如氢化大豆pc、二棕榈酰基磷脂酰胆碱(dppc)或二硬脂酰基磷脂酰胆碱(dspc))制备的凝胶相脂质体需要具有小于30%的胆固醇。在体温下没有显示出凝胶相的常规脂质体的一个实例是蛋黄磷脂酰胆碱(epc)制备的那些,其是显著渗漏的。之前,使用常规脂质体制备冻干脂质体组合物的尝试涉及空脂质体或仅包含单一试剂的脂质体。它们可以在脂质体的内部与外部使用低温保护剂,通常为糖,或者使用跨越脂质体膜的大渗透压梯度。例如,当低温保护剂以足量存在于脂质体的内部和外部时,理论上当这些量相等时,使用低温保护剂防止对包封单一试剂的“液体”epc脂质体的冷冻/解冻损害。参见,例如美国专利号5,077,056和4,883,665。脂质体内部介质中存在1%-10%的低温保护剂保护包封多柔比星的冻干epc脂质体-制剂,其中优选地内部摩尔渗透压浓度接近生理学摩尔渗透压浓度。参见,例如美国专利号4,927,571。已经表明在脂质体内部不能包括低温保护剂会导致重构时脂质体完整性丧失,特别是对于保留包封试剂而言。如下列文章中所述:“preventionofleakagerequiresthesugarbepresentbothinsideandoutsidetheliposome(渗漏的防止需要在脂质体的内部和外部都存在糖)”(lowery,m.(june2002)drugdevelopmentanddelivery,vol.2,no.4)。在一种情形中,也已经报道了对于氢化大豆pc∶胆固醇∶dspe-mpeg(51:44:5摩尔比)的脂质体而言,其中该脂质体制剂在外部介质中包含44mol%的胆固醇以及低温保护剂和高浓度的盐,防止了小囊泡聚集和融合以及防止了包埋药物的损失。存在44%胆固醇意味着脂质体在等于或低于体温下为液相形式。而且,仅当跨越膜存在大渗透压梯度时才获得保护作用,以致外部脂质体摩尔渗透压浓度显著地高于内部摩尔渗透压浓度。参见例如wo01/05372。膜结合低温保护剂也进一步改善了这些非凝胶相脂质体对冰冻和冷冻的抗性。特别地,已经报道经由低聚(环氧乙烷)连接基(由一至三个重复单元组成)接枝于epc或epc∶胆固醇(1:1摩尔比)脂质体膜表面的糖对于包含荧光探针的脂质体具有低温保护作用。参见,例如bendas,等人,eur.j.pharm.sci.(1996)4:211-222;goodrich,等人,biochem.(1991)30:5313-5318;u.s.patentno.4,915,951。baldeschwieler等人报道了在不存在未端糖基下,用低聚环氧乙烷(oligoethyleneoxide)连接基本身制备的脂质体不能抗冰冻之后的融合。美国专利号4,915,951。在包封单一试剂的pc脂质体制剂外部介质中的海藻糖提供了对脂质体聚集和融合的抗性。美国专利号6,319,517。生产稳定化以抗聚集的小脂质体的其它方法需要形成空心pc:胆固醇(摩尔比1:1)脂质体,向其中加入糖和单一试剂的溶液,然后接着干燥。在干燥过程期间,将一定百分比的试剂包埋在脂质体之内。据报道当在不存在糖下储存时,这些脂质体更稳定。参见,例如wo99/65465。如之前所述,冷冻干燥的大多数现有技术集中于冷冻干燥空心脂质体或包封单一试剂的脂质体。当两种或多种试剂被包封,特别是如果试剂的溶解度特性不同,则具有保持完整性的冷冻干燥更有挑战性。包封两种或多种试剂通常是有用的,因为许多危及生命的疾病(比如癌症)受多种分子机制的影响,并且因为其复杂性,采用单一试剂获得治愈仅取得有限的成功。因此,几乎所有的癌症治疗都涉及一种以上治疗剂的组合。这也适用于其它病症的治疗,包括感染和慢性疾病。pct公布wo03/041681,通过引用并入本文,报道了如果组合物中包括至少1mol%的磷酸肌醇(pi)或磷脂酰甘油(pg),则具有转变温度为38℃或更高的凝胶-相脂质体可以使用饱和的磷脂酰脂质(比如dppc和dspc)及较低含量(0-20%)的胆固醇制备。这些脂质体,当包含包封的依立替康和氟尿苷(fudr)的组合时,则显示在-20℃下冰冻时是稳定的。与冷冻干燥相比,简单冷冻通常较不苛刻且对脂质体完整性的破坏更小。使用脂质体作为这些组合的递送载体是有利的,特别地如果脂质体包括非拮抗比例的试剂且能够保持该比例。一般方法详细描述在美国专利7,850,990中,将其并入本文作为参考。该专利教导如何确定各种治疗剂(包括抗肿瘤剂)的非拮抗的或协同的比例,其在宽浓度范围保持这样的非拮抗作用或协同作用。该专利还教导了必需以施用比例递送药物,同时通过使递送载体控制药代动力学保持该比例。该专利中例举了包含非拮抗或协同比例的两种或多种治疗剂且保持该比例的脂质体,所述治疗剂包括依立替康和fudr。如果当重构时,保持脂质体的完整性和试剂的浓度及其比例,则包封在脂质体中的这种组合将受益于以冻干形式储存的优点。包封在脂质体中的阿糖胞苷和道诺霉素的一种特别有用的这种组合描述在美国专利8,022,279中,也将其并入本文作为参考。在pct公布wo2007/050784和pct公布wo2008/101214中描述了在治疗方案中使用这些组合,获得令人惊奇的好结果。在wo2009/097011和wo2009/070761、以及wo2010/043050中描述了采用脂质体包封期望的药物递送选择的其他制剂。这些制剂仅仅示例了其中在用于递送至患者的脂质体中包含两种或多种治疗剂的有用组合物。如上所述,制备通常当重构时保持其完整性的稳定的冻干脂质体组合物很困难且不可预知。对于两种或多种试剂的组合,获得这样稳定的脂质体组合物更加具有挑战性。因此,本发明的方法在获得冻干脂质体方面的成功是一项显著的成就,其中所述脂质体包含两种或多种治疗剂或诊断剂,并且其中当重构时脂质体保持其完整性。技术实现要素:一直报道为了在冷冻干燥后重构时保持脂质体完整性,特别地为了确保包封药剂的保留,在脂质体的内部与外部需要低温保护剂。本发明人确定了稳定的脂质体,其对于不仅包封一种而且包封两种或更多种活性剂(药剂)的脂质体的成功的冷冻干燥,不需要任何内部低温保护剂。本发明涉及成功的冻干凝胶相脂质体制剂,其包含多于一种治疗剂和/或诊断剂,并且不含任何内部低温保护剂。因此,在一个方面,本发明涉及一种冻干脂质体组合物,其中所述脂质体与至少两种治疗剂和/或诊断剂稳定相关,并且其中当重构所述组合物时,与冷冻干燥前的状态相比,所述脂质体的平均直径保持不变,且保持被包封在所述脂质体中的每种药剂的百分比维持在令人满意的水平。因此,脂质体的完整性测定以在脂质体重构之后保留的被包封药剂的百分比确定。用作令人满意地冷冻干燥的标准的其他参数是粒度分布的最小变化。一个特别重要的实施方案是其中所述药剂以规定比例包封在脂质体内部,并且其中当重构冻干形式时保持这些药剂的比例。获得该结果的典型的条件包括使用具有至少为室温且可以位于或高于人体温度的凝胶-向液晶转变温度(tc)的凝胶-相脂质体。体温被认为是约37℃。脂质体可以是用磷脂酰甘油和/或磷酸肌醇稳定的低胆固醇脂质体。脂质体基本上不包含任何内部低温保护剂,但是可以在其表面包含外部低温保护剂,并因此可以在包含低温保护剂的介质存在下冻干。术语“基本上不含内部低温保护剂”是指包括如下脂质体:不包含任何内部低温保护剂的脂质体,以及包含不会影响所述脂质体的冰冻和/或冷冻干燥过程的量的低温保护剂(即,125mm低温保护剂或更少,其为“无活性量”)。因此,“基本上没有内部低温保护剂”定义为在脂质体内部约0-125mm的低温保护剂。重要地是注意到防止冷冻干燥过程后的药物渗漏比脂质体粒度的保持显著更困难。如上所述,冷冻干燥之后的药物保留过去是经由在脂质体的内部和外部同时使用低温保护剂实现的。因此,在一个实施方案中,所述脂质体具有的膜的凝胶-向-液晶转变温度(tc’s)大于室温或高于25℃或37℃,使得至少在室温下例如25℃下,该脂质膜为足够凝胶态以保留药物。所述组合物提供被包封药剂的保留、减少聚集和当冷冻干燥和重构时的融合,因此向可用的组合物提供延长的储存期限。提高对冷冻干燥过程的保护与渗透压无关。这些脂质体在药学相关条件下保持其粒度分布和药物包封特性持续延长的期间。因此,制备冻干脂质体组合物的方法可以包括在脂质体外部包含选择浓度的低温保护剂,其中在冰冻和冻干之前的脂质体膜处于低于其相变温度tc的条件下。优选地,在低于该溶液的玻璃转化温度(tg)的温度下冰冻所述脂质体,所述溶液包含具有包封药物的脂质体以及包含低温保护剂的脂质体外介质。在其它方面,本发明还涉及制备根据上述实施方案的包含两种或多种治疗剂和/或诊断剂的冻干脂质体的方法、重构所述冻干组合物的方法、向动物施用所述重构的脂质体的方法、以及治疗受病症(例如癌症)影响、易患该疾病、或疑似受该疾病影响的动物的方法。附图说明图1显示在冰冻之前cpx-1脂质体的粒度特征。图2显示重构的cpx-1脂质体在冰冻、冷冻干燥和重构之后立即的粒度特征。图3显示重构的cpx-1脂质体在储存1个月后的粒度特征。图4a-4c显示重构的cpx-1脂质体在储存6个月后的粒度特征。具体实施方式本发明首次提供了冻干凝胶相脂质体组合物,其包含两种或更多种治疗剂和/或诊断剂,使得重构冻干组合物的特征和性质基本上与该组合物在冻干之前的特征和性质相当。这些特征可以包括脂质体的平均直径、粒度分布和内含物。脂质体的内含物指保留的药剂;在某些实施方案中,还保持所述药剂的比例。尽管在本申请中,脂质体包含治疗剂和/或诊断剂,但是“药物”有时用作指定这些的简写。所述凝胶相脂质体包含一个或多个封闭内部隔室的脂质双层。这些脂质体可以是双室囊泡或单室囊泡。单室脂质体(也称为单室囊泡或“ulv”)封闭单个内部水性隔室,归类为小单室囊泡(suv)或大单室囊泡(luv)。luv和suv的粒度范围分别为约50至500nm和20至50nm。双室脂质体具有两个脂质膜,其中内膜包围单个内部水性隔室,第二个较大外膜包围内膜,从而产生第二个内部水性隔室。可以通过获得粒度特征,比如在本文的图1-4中列举的那些,试验性评价凝胶相脂质体的粒度分布的保持。通过准弹性光散射测定的粒度分布通常呈现为直方图,其显示脂质体的平均直径。本领域最通常使用的有效粒度分布量度为d10、d90、d99或标准偏差或多分散性指数。“d99”值表示99%的脂质体小于参照粒度或大于参照粒度。如果例如排除较高或较低粒度很重要,则这点特别有用。例如,在某些实施方案中,期望确保不存在平均直径超过200nm的脂质体。使用具有d99值为178nm的一个特定实例来举例说明。测量d99值为178nm(如实施例2的表1所示)确保至少99%的脂质体数目小于178nm。对于平均直径,也通常使用d10和d90值,其中对于d10,是指不超过10%的数目小于最小参照粒度(即d10),并且对于d90,其中90%的数目处于或小于较高参照粒度限制。例如,如批次1和2所示,d10值为68nm,从而不超过10%的脂质体数目小于68nm。对于批次1和2,d90值表明90%的数目分别为处于或小于135或137nm。如所证实的,在冻干和重构之后保持脂质体的粒度分布在本文中定义为显示出与在冰冻和/或冻干之前所选择d值的参考值(referentvalue)相比,当重构时该参考值改变不超过50%、25%、20%、15%、10%、9%、8%、7%、6%或5%。所选择的d值可以为99、98、94及介于至90之间的整数,或d10。冻干脂质体的一个特征涉及组合物中脂质体的平均直径。当在冻干之后和重构时基于体积加权重(volumeweightedbasis)、及基于冰冻之前的直径,脂质体的平均直径增加不超过50%、25%、20%、15%、10%、9%、8%、7%、6%或5%时,脂质体组合物的平均直径在重构时得到保持。对于d90(或其它d值,比如上列那些)而言的相应值(concomitantvalue),比如d90参考值增加10%的平均脂质体直径增加10%,是确保颗粒(例如脂质体)粒度分布没有改变的一个量度。也可以优选地基于体积加权重评价该整体分布性质,如图1-4中所示。更详细地,脂质体的组合物包含通常符合高斯曲线的大量粒度。当在冰冻或冻干及重构之后重构时,脂质体的平均直径可以增加不超过其原始尺寸的约30%、25%、20%、15%、10%、9%、8%、7%、6%或5%。例如,如果当平均直径为90nm的脂质体样品重构时增加不超过30%,即约117nm,则其被认为能抵抗冰冻和/或冻干的影响。粒度增加大于这些表明发生了脂质体聚集和融合。可以使用足够灵敏的测量技术来测量粒度分布或平均直径的变化,以便可以测量小于10%的变化。保持完整性的另一个标准是被包封药剂的保留。与相对于冻干前的值评价的平均直径、粒度分布和药物比例不同,药物保留是相对于重构之后的全部药物本身评价的,即基于冻干组合物中的全部药物。包封在脂质体内部的药物百分比或在脂质体外的外部介质中的药物百分比(“未包封的”%)是相对于组合物中药物的总量计。在一个实施方案中,在冻干之后和当重构时,至少约75%的包封药物保持为被包封状态。至少约85%的每种药物可以保持为被包封和/或至少90%、或95%保持为被包封状态。这可以类似地通过周围介质中未包封药物的量来测定,当重构冻干脂质体时,所述未包封药物的量不应当超过原始包封量的25%、20%、15%、10%或5%。如果包封的治疗剂和/或诊断剂的比例相对于冻干前组合物本身的比例改变不超过20%、10%、9%、8%、7%、6%或5%,则视为当包封时保持该比例。比例可以用摩尔比表示。在一个实施方案中,其中与冻干之前测量的所述值相比,在所述脂质体冻干之后和当重构时,所述脂质体的平均直径增加不超过25%。在另一个实施方案中,其中与冻干之前测量的所述值相比,在所述脂质体冻干之后和当重构时,所述脂质体的平均直径改变不超过15%。在仍然其它的实施方案中,在所述脂质体冻干之后和当重构时,所述脂质体的平均直径改变不超过10%、9%、8%、7%、6%或5%。在某些实施方案中,当重构所述脂质体时,未包封药物的百分比不超过最初包封药物的25%。在其它实施方案中,当重构所述脂质体时,未包封药物的百分比不超过最初包封药物的15%。在其它实施方案中,当重构所述脂质体时,未包封药物的百分比不超过最初包封药物的10%,或者不超过9%、8%、7%、6%或5%。换言之,在某些实施方案中,当重构所述脂质体时,保留的包封药物的百分比不小于75%。在其它实施方案中,当重构所述脂质体时,保留的每种包封药物的百分比不小于85%或90%或95%。还包括这些参数的组合。例如,平均直径可以增加不超过25%,且包封药物的百分比为至少90%,或者平均直径可以增加不超过10%,且包封药物的百分比为至少90%。在某些实施方案中,与冻干之前相比,在所述脂质体冻干之后和当重构时,所述脂质体的粒度分布改变不超过25%。在其它实施方案中,与冻干之前相比,在所述脂质体冻干之后和当重构时,所述脂质体的粒度分布改变不超过15%、10%、9%、8%、7%、6%或5%。如上所述,预期成功地冻干和重构脂质体的这些参数或标准的不同组合-例如,至少85%的包封药物与平均直径增加不超过15%的组合,任选地与粒度分布改变不超过5%组合。这些参数的每种可能的组合都在本发明的范围之内。凝胶-相脂质体可以通过如下常规方法产生:例如醚注入法(deamer,等人,acad.sci.(1978)308:250)、表面活性剂法(brunner,等人,biochim.biophys.acta(1976)455:322)、冷冻-融化法(pick,等人,arch.biochim.biophys.(1981)212:186)、反相蒸发法(szoka,等人,biochim.biophys.acta.(1980)601:559-571)、超声波处理法(huang,等人,biochemistry(1969)8:344)、乙醇注入法(kremer,等人,biochemistry(1977)16:3932)、挤出法(hope,等人,biochim.biophys.acta(1985)812:55-65)及french压制法(barenholz,等人,febslett.(1979)99:210)。这些方法可以组合使用。小单层脂质体(囊泡)(suv)特别地可以通过超声波处理法、乙醇注入法和french压制法制备。大单层脂质体(luvs)可以通过醚注入法、表面活性剂法、冰冻融化法、反相蒸发法、french压制法或挤出法制备。优选地,根据挤出法制备luvs。冻干和重构是在其中脂质体位于凝胶相中的条件下进行的。因此,脂质体的凝胶-向-液体转化温度应大于室温,即约20-30℃,更优选地位于或高于体温。室温可以显著地变化,但是重要的是冻干过程在其中脂质体处于凝胶态的条件下开始。在某些实施方案中,tc为与体温至少一样高(即,约37℃)。在某些实施方案中,为了保持凝胶样状态,脂质体是在低于相变温度的温度下制备的。可以使用任何合适的内部介质。通常,内部介质为水性介质。所述内部介质基本上不含低温保护剂(即,少于125mm的低温保护剂)。内部介质可以包含少于100mm的低温保护剂,或者少于50mm的低温保护剂,或者不含任何低温保护剂。具有合适的tc值的脂质体制剂可以是“低胆固醇”脂质体,即在存在且包含不足以显著地改变脂质体的相变特性的量的胆固醇下,即通常为20mol%或更少胆固醇,制备的那些脂质体。大于20mol%的胆固醇拓宽了发生相变的温度范围,在较高的胆固醇水平下相变消失。具有低胆固醇的脂质体将具有少于20mol%或少于15mol%的胆固醇,或者10mol%或5mol%或更少的胆固醇或不含胆固醇。这样的脂质体最佳地需要至少1mol%的稳定剂比如pg或pi。在其中使用低温保护剂的那些方法中,低温保护剂优选地仅仅存在于制剂的外部介质中。通常,低温保护剂为二糖,比如蔗糖、麦芽糖、海藻糖和乳糖。低温保护剂可以是具有浓度为约100mm至500mm或约250-400mm或高于300mm的二糖,比如蔗糖。外部介质可以包含约100mm至500mm的低温保护剂且内部介质包含少于125mm的低温保护剂,或者外部介质包含约250mm至400mm的低温保护剂且内部介质包含少于100mm的低温保护剂,或者外部介质包含约250mm至400mm的低温保护剂且内部介质包含少于50mm的低温保护,或者外部介质包含约250mm至400mm的低温保护剂且内部介质不包含任何低温保护剂。低温保护剂可以是糖类,比如蔗糖。凝胶相脂质体制剂可以使用任何合适的方案冻干或冷冻干燥。冻干室的初始温度优选地低于溶液的玻璃转化温度(tg),所述溶液包含外部介质以及包含具有包封药物的脂质体。例如,脂质体可以在低于约-5℃、或低于约-10℃、或低于约-20℃、或低于约-30℃、或低于-40℃的温度下冰冻。在某些实施方案中,当使用蔗糖作为低温保护剂溶液时,冻干室的的初始温度低于蔗糖溶液的tg-32℃。“tg”包括“玻璃转化温度”和“玻璃相转化温度”,其大约是未冷冻溶液从软的粘性凝胶转化为硬且相对脆性形式的中点温度。冻干脂质体可以储存在室温或低于室温下。某些示例性的实施方案具有储存在5℃或低于5℃的脂质体。某些其它示例性的实施方案具有储存在25℃的脂质体。冻干产品保持稳定(例如,保持其相对粒径且保持包封的药物)至少约六个月、或至少约九个月、或至少约一年、或至少约二十四个月至三十六个月。包埋试剂为治疗剂或诊断剂,通常为抗癌剂。显著地,即使试剂在水性溶剂和非水性溶剂中的溶解度特性不同,凝胶相脂质体组合物的含量和完整性也保持不变。使用本发明的方法,log分配系数(logp)相差1.0之多的试剂可以成功地被保留。log分配系数相差1.5或2.0或3.0也是可容许的。一种试剂可以是两亲性的,而另一种试剂是水溶性的,或者一种试剂可以是疏水性的,而另一种试剂为水溶性的。logp值是基于在辛醇和水之间的分配系数-即,当化合物进行相分离时,在辛醇中的量与在水中的量的比例基于底数10的对数。抗癌剂可以包括蒽环霉素(例如,道诺霉素、多柔比星、表柔比星或伊达比星)。这些试剂是两亲性的。抗癌剂可以包括核苷类似物,例如亲水性的阿糖胞苷、5-fu或fudr。其它抗癌剂包括喜树碱或喜树碱衍生物,比如两亲性的依立替康。在某些情况下,蒽环霉素和核苷类似物两者都被包封,或者喜树碱或喜树碱衍生物和核苷类似物两者都被包封。将药剂包封和/或负载到脂质体中可以使用任何合适的负载技术进行,包括被动负载和主动负载。重要的实施方案包括在上述引用的美国专利7,850,990和u.s.8,022,279中描述的那些─即,摩尔比1:1的伊立替康:氟尿苷(fudr)的组合和摩尔比1:5的道诺霉素∶阿糖胞苷(arac)的组合。这些药物的具体制剂分别称为cpx-1和cpx-351。药物由被动负载或主动负载方法或其组合掺入脂质体的水性内部隔室。在被动负载中,生物活性剂可以简单地包括在由其形成脂质体的制剂中,或者可选地,活性剂可以加入到预形成的脂质体外部,并沿其浓度梯度被动负载到脂质体中。任选地,可以通过任何合适的方法从制剂除去未包封的物质。可选地,可以采用主动负载方法,比如离子梯度、离子载体、ph梯度和基于金属络合的基于金属负载方法。通常使用于合适药物的一个实施方案是经由基于金属的方法。脂质体的粒度为约80-500nm。在一个实施方案中,脂质体具有小于300nm的直径,有时小于200nm。在一个实例中,这些脂质体的标称粒度为约100nm。在某些实施方案中,脂质体膜由二硬脂酰磷脂酰胆碱(dspc)、二硬脂酰磷脂酰甘油(dspg)和胆固醇(chol)组成。在某些实施方案中,脂质体膜由50-80%的dspc、1-20%的dspg和1-20%的chol组成。在其它实施方案中,脂质体膜由50-80%的dspc或dppc、1-20%的dspg或二硬脂酰基磷脂酰肌醇(dspi)、1-20%的chol组成,并且该脂质体在脂质体内介质中包含少于125mm的低温保护剂。在某些示例性实施方案中,脂质体膜由50-80%的dspc或dppc、1-20%的dspg或dspi、1-20%的chol组成,并且该脂质体在脂质体内介质中包含少于50mm的低温保护剂。在其它示例性的实施方案中,脂质体膜由摩尔比约7:2:1的dspc、dspg和chol组成,并且在内部脂质体介质中不含任何低温保护剂。在一个实例中,脂质体是通过油包水衍生的脂质体方法(water-in-oilderivedliposomemethod)制备,并且将挤出的脂质体悬浮在ph7.0的磷酸盐-缓冲的蔗糖中。在另一个实例中,将挤出的脂质体悬浮在蔗糖中。在一个实施方案中,将挤出的脂质体悬浮在250-400mm的蔗糖中。可以使用将药物组合包封在脂质体中的任何合适的方式。在一个特定实施方案中,将依立替康和氟尿苷一起负载到dspc/dspg/chol(7/2/1)预形成的脂质体中,由此在内部介质中,在50℃下,使用硫酸铜或葡糖酸铜,氟尿苷被动负载到脂质体中,且依立替康主动负载到脂质体中。参见共同拥有的美国专利号7,850,990和7,238,367,将这两篇都并入作为参考。在另一个特定实施方案中,阿糖胞苷和道诺霉素被包封在脂质体中,由此使用基于葡糖酸铜/三乙醇胺的负载方法,以高包埋效率,阿糖胞苷被动包封到预形成的脂质体中,并且道诺霉素主动聚集在脂质体内部。参见,例如共同未决和共同拥有的pct申请wo05/102359和wo07/076117a2中,将这两篇全部内容也都并入本文作为参考。本发明的冻干组合物方便储存、保存且易于运输。这些冻干组合物经长时间保留其特性。本发明的组合物在合适的药用载体或介质中重构供使用。供使用的这些制剂是根据标准重构技术使用可药用载体制备的。通常,使用生理盐水作为可药用载体。其它合适的载体包括,例如水、缓冲的水、葡萄糖、0.4%氯化钠、0.3%甘氨酸等,包括用于增强稳定性的糖蛋白,比如白蛋白、脂蛋白、球蛋白等。这些组合物可以通过常规众所周知灭菌技术进行灭菌。可以将得到的水溶液包装供使用或在无菌条件下过滤并冻干,在给药前将得到的冻干制剂与无菌水溶液混合。所述组合物可以根据需要包含可药用辅助物质以接近生理条件,比如ph调节剂和缓冲剂、张力调节剂等,例如乙酸钠、乳酸钠、氯化钠、氯化钾、氯化钙等。另外,脂质体悬浮液可以包括脂质保护剂,其保护脂质在储存时抗自由基和脂质-过氧化物的损害。亲脂性的自由基淬灭剂,比如α生育酚和水溶性的铁-特异性螯合剂比如铁草铵是合适的。重构制剂可以给药至动物,包括人类或其它哺乳动物种类,比如非人灵长类、狗、猫、牛、马、绵羊等,并且可以用于治疗各种疾病。本发明的组合物的医学用途的实例包括但不限于治疗癌症,治疗心血管疾病比如高血压、心律失常和再狭窄,治疗细菌、真菌或寄生虫感染,通过使用本发明的组合物作为疫苗治疗和/或预防疾病、治疗炎症或治疗自身免疫疾病。对于治疗人类疾病,合格的医师将使用熟知的方案,确定如何使用本发明的组合物的剂量、方案和给药途径。这样的应用也可以利用剂量递增,使包封在本发明的脂质体和脂质载体中的生物活性剂显示出对受试者健康组织的毒性降低。药物组合物通常肠胃外给药,例如静脉内,但是可以采用其它途径。脂质体制剂的剂量将取决于药物与脂质的比例,给药医师的意见基于患者的年龄、体重和病症。总之,用于本发明的一种方法包括冻干脂质体组合物,其中所述脂质体包括20mol%或更少的胆固醇和两种或多种活性剂,并且其中当在室温下和在包含低温保护剂的外部介质中时,所述脂质体膜低于其相变温度;储存该冻干脂质体;和以预定水体积重构该冻干脂质体。脂质体在低于约-5℃、或低于约-10℃、或低于约-20℃、或者甚至低于约-30℃或-40℃的温度下冻干,并可以储存在等于或低于室温(约23-25℃)下。在一个实施方案中,脂质体组合物包含2-20%的胆固醇或在任何中间值比如10%的胆固醇。在一个实施方案中,冻干组合物包含约10%胆固醇、在外部介质中的选择浓度的二糖,其中在室温下进行的重构是在低于tc下进行,并且其中低温保护剂未结合且仅存在于脂质体的外部。在另一个实施方案中,冻干脂质体组合物包含两种或多种被包封药物,当用预定体积的水性介质重构时,得到包含下述成份的脂质体组合物:(a)包含20mol%或更少的胆固醇的脂质体,(b)粒度主要在约80-500纳米之间的脂质体,(c)脂质体-包埋的一种或多种药剂,其中所述药剂的包封%不少于约95%、90%、85%、80%或75%;和(d)在外部脂质体介质中约100mm-500mm之间的低温保护剂。在某些实施方案中,外部脂质体介质中存在250-400mm之间的低温保护剂。在某些实施方案中,外部脂质体介质中存在约9.5-10%的低温保护剂。在一个实施方案中,包含20mol%或更少的胆固醇、至少两种药物和在脂质体外部的至少约300mm蔗糖的单室或双室凝胶相脂质体被冻干,并且当重构时,至少约90%的每种包封药物被包封,并且平均脂质体直径变化小于约25%。除非从上下文显而易见其仅打算单一指示,否则如本文使用的“一个”或“一种”指“至少一个(一种)”或“一个或多个(一种或多种)”。提供下述实施例仅用于阐述,而不是限制本发明。实施例1cpx-1的冻干将依立替康和氟尿苷1:1共同包封在dspc/dspg/胆固醇(摩尔比7:2:1)脂质体中,并指定为cpx-1。冻干cpx-1得到稳定的负载药物脂质体,这样,活性药用成分从重构剂型的渗漏最小。在cpx-1中使用的依立替康盐酸盐具有3.94的预期log分配系数(logp)。氟尿苷具有-1.14的预期logp。使用多批次进行cpx-1脂质体药物产品的热分析,以提供关于玻璃转化温度(tg)、热容量变化、及其它放热情况的信息。通过冻干显微测定两批次cpx-1脂质体药物产品的塌陷温度(collapsetemperature)。将这些结果用于测定最终冻干周期。样品由用包含1:1比例的两种活性药用成分依立替康盐酸盐和氟尿苷的脂质体配制的蓝绿色本体水悬浮液组成。将样品储存在-20℃(或,在某些情况下-80℃)与环境相对湿度下,并在充填和冻干之前在冰箱中解冻过夜并充分混合。第1周期:使用20mla类移液管,将20cc的cpx-1填充到60cc玻璃模制(glassmolded)瓶中。将二十四个瓶装入lyostarii盘式干燥器(traydryer)中,其中两个产品的瓶配备热电偶探头以记录产品温度,并冷冻干燥四天半。在给瓶反填充氮气至室压力为约720,000mtorr之后,将这些瓶塞住,从盘式干燥器移出,并标记为批次tp-cpx1-001-032405。然后,将一些冻干瓶置于25℃和40℃下测定加速稳定性,其余瓶储存在-20℃下。第2周期:将约21ml的cpx-1分别填充到60cc玻璃模制瓶和50cc玻璃管瓶中。将这些瓶装入lyostariitm盘式干燥器中,其中在顶盘架的产品瓶中具有一个热电偶探头,且在底盘架的产品瓶中具有一个热电偶探头。当冻干周期完成时,给这些瓶反填充氮气至室压力为约720,000mtorr,塞住,从盘式干燥器移出,并标记为批次tp-cpx1-002-041305t。然后,将一些冻干瓶置于25℃和40℃下测定加速稳定性,其余瓶储存在-20℃下。第3周期:按类似于第2周期的方法制备供冻干的样品,不同仅在于填充到50cc玻璃管小瓶中。将密封瓶标记为cpx-1药物产品,批次tp-cpx1-003-051105t。然后,将一些冻干瓶置于25℃和40℃下测定加速稳定性,其余瓶储存在-20℃下。第4周期:按照类似于第2周期的方法制备供冻干的样品,不同在于将cpx-1填充到50cc玻璃管瓶中。将密封冻干的小瓶标记为cpx-1药物产品,批次为tp-cpx1-004-051805t,并储存在-20℃、5℃、25℃和40℃下进行稳定性研究。第5周期:按照类似于第2周期的方法制备供冻干的样品,并将其填充到50cc玻璃管瓶中。将密封冻干瓶标记为cpx-1药物产品tp-cpx1-005-062705t-300。将cpx-1脂质体药物产品瓶贮存在-20℃、5℃和25℃的稳定性室中。第一冻干周期试验(lyophilizationcyclerun)。第一冻干周期试验(第1周期)的主要目标是测定配制的本体cpx-1脂质体药物产品(cpx-1)是否可以采用温和的、两步初级干燥阶段成功地冷冻干燥。通过分析药物产品的温度和压力曲线及通过目测检查冻干产品饼的形态判断(gauged)冻干试验的成功性。第1周期的冻干产品曲线显示在-10℃的初级干燥步骤期间除去冰体(bulkice)。这是显然的,因为产品温度稍高于盘架温度。而且,测量实际压力加水蒸汽的分压的热电偶压力朝向电容压力计压力或实际压力降低。另外,冻干药物产品瓶变干,几乎没有或没有明显的产品饼塌陷。然而,观察到一些分析物浓缩或分层。为了最优化该周期,第二次试验改变热处理期和初级干燥步骤。第二冻干周期试验。使用与第1周期类似温和的初级和次级干燥阶段进行第二冻干试验(第2周期)。为了最大化在冻干器中冰的负载,将填充去离子水的瓶装入空的盘架空间中。也通过温度和压力曲线及通过目测检查冻干产品饼判断冻干试验的成功性。50cc管瓶中的药物产品似乎以更均质的方式冻干,即使对于经四天半周期的50cc玻璃管瓶和60cc玻璃模制瓶的产品温度和压力曲线类似。在达到次级干燥盘架温度之后约八个半小时,产品温度显示通过跨越冰障(即,产品温度超过0℃)冰体(bulkice)升华完成。然而,这些瓶没有被充分干燥。在初级干燥阶段结束时,产品温度低于盘架温度,并且热电偶压力和电容压力计压力之间的差异从试验开始至次级干燥阶段结束没有改变,其表明瓶中存在大量冰体。因为初级干燥阶段中使用的盘架温度没有赋予驱使产品升华速率朝向完成的足够能量,进行第三冻干周期,以通过使用增加冰升华而不超过塌陷温度的盘架温度和室压力驱使完成初级干燥阶段。第三冻干周期试验。基于第2周期的结果和热分析,调节用于第3周期的盘架温度和室压力以促进初级干燥,同时保持产品温度低于估计的-20℃塌陷温度。为了最大化冰的负载,在满载试验条件下进行该周期。对于第3周期获得的曲线图显示,在满载试验条件下,40小时之内,在100mtorr压力下-20℃的初始初级干燥盘架温度没有驱使冰体充分地升华。而且,由于该阶段持续时间有限,直到-10℃的初级干燥阶段结束时,热电偶压力朝向电容压力计压力才显著地减小。然而,该曲线表明-10℃的第二初级(secondprimary)干燥盘架温度和持续时间能够保持产品温度低于-20℃的塌陷温度,直到所有冰体都升华,这是显然的,因为在该阶段结束时产品温度快速升高至最终超过盘架温度。第四冻干周期试验。为了确定初级干燥阶段的盘架温度,第四冻干周期(第4周期)在满载试验条件下使用-10℃的盘架温度较长的持续时间与在-20℃下6小时的初始初级干燥步骤。基于冻干周期曲线和目测观察,对于初始初级干燥阶段-20℃的盘架温度似乎在干燥各个瓶方面具有很小的益处。在保持时间约60小时之后,产品温度探头高于-10℃的盘架温度。在次级干燥阶段间的热电偶压力表明各个瓶具有相对低的残留水分,因为产品温度曲线密切匹配盘架温度。评价各瓶冻干产品的药物物质的包封、脂质体粒径和平均残留水分。采用karlfischer法获取的平均残留含水量为3.1%,其不是过度干燥的脂质体产品。而且,粒径和依立替康包封%的分析发现与冻干前物质相比,冻干产品没有改变。然而,当在-20℃下储存13周时,未包封的氟尿苷的百分比从冻干前整体(bulk)的7.0%增加至冻干产品中的8.6%。而且,在25℃下对该产品加压四周之后,未包封氟尿苷的百分比增加至11.8%,其高于对于该药物产品未包封的氟尿苷少于10%的暂行规范。第五冻干周期试验。第五冻干周期试验(第5周期)的目标是将次级干燥阶段的盘架温度从+20℃降低至+10℃,以便当在满载试验条件下获得合适的残留水分时最小化氟尿苷渗漏。通过定期进行压力升高测量评价次级干燥阶段期间该物质的水分含量。第5周期的药物产品曲线表明在-10℃下初级干燥72至84小时之后,冰体大量升华。而且,基于压力检测器差异和压力升高研究,通过在50mtorr下使用+10℃的盘架温度12小时,该物质似乎被充分地干燥。为了评价该冻干物质的适合性,使用了用18号针和30cc注射器穿过塞子注入的19ml水评价来自第4和第5周期的冻干药物产品瓶的重构时间。对于第4和第5周期,平均重构时间分别确定为40和93秒。而且,第5周期的karlfischer结果获取的平均残留水分为3.2%,其与来自第4周期的各瓶有良好的一致性。也评价了药物物质的包封和脂质体粒度。对于第5周期的冻干药物产品,在-20℃下储存7周之后,未包封的依立替康的百分比为0.4%,并且在25℃储存4周之后,其为0.9%。与储存在-20℃下时的药物产品相比,储存在5℃下8周之后,冻干药物产品的粒度仅略有增加,但是储存在25℃下仅4周之后,粒度增加接近10nm。令人惊奇地,未包封氟尿苷的百分比显示与粒度变化类似的趋势。在-20℃下7周之后,未包封的氟尿苷的百分比为5.5%,在5℃下8周之后,其为7.7%,并且在25℃下4周之后其为18.7%。第5冻干周期试验,其在其次级干燥阶段期间采用降低的盘架温度,成功地得到增加包封产品的保留的可接受的冻干cpx-1脂质体药物产品。实施例2冻干脂质体的粒度特征随时间推移保持不变为了检查冰冻、冻干和贮存对双负载的cpx-1和cpx-351脂质体的粒度分布的影响,进行试验。cpx-351是一种摩尔比1:5的道诺霉素和阿糖胞苷在脂质体中的制剂,所述脂质体为摩尔比7:2:1的二硬脂酰基磷酸胆碱(dspc):二硬脂酰基磷脂酰甘油(dspg)∶和胆固醇(chol)。道诺霉素具有1.68的预测logp。阿糖胞苷具有-2.17的预测logp。在冰冻和冻干所述脂质体之前和之后,以及在储存该冻干制剂一个月和六个月之后,测量共同负载的脂质体的粒度分布。用外部缓冲液:300mm蔗糖、20mm磷酸盐、ph7.0制备cpx1脂质体。将900μl的等分试样加入到2ml瓶中,将其置于金属锅(预冷冻至-20℃)中,并在-20℃下储存过夜。在冰冻之后,将样品转移到冻干器(预冷冻至-20℃)。应用真空,盘架温度维持在-20℃下7小时,接着升高至-10℃约16小时。对于第三温度步骤,之后再升高至4℃另外的3小时将盘架温度,然后在室温下进行3小时干燥。将干样品用1ml的h2o水合,并且容易地溶解该冻干滤饼。然后,使用动态光散射(dls)分析样品。预冰冻的cpx-1脂质体显示110nm的平均颗粒直径(图1)。在冻干和再水合之后立即观察的脂质体粒度为116nm(图2)。将cpx-1冻干脂质体的两个样品储存在5℃下一个月或六个月,并且观察再水合组合物的脂质体粒度。各自的平均脂质体粒度分别为117nm和123nm(分别为图3和4)。图1-3显示体积加权分布。图4b显示可比较的体积加权分布。其它较不优选的算法的结果显示在图4a和4c中。除非另有说明,平均直径指体积加权分布。对于cpx-351脂质体,也进行类似于图1-4中显示的实验。如上所述,cpx-351是一种抗肿瘤药阿糖胞苷和道诺霉素盐酸盐固定组合的脂质体制剂。使用7:2:1摩尔比的dspc、dspg和chol与葡糖酸铜-三乙醇胺缓冲液ph7.4制备脂质体。将粗脂质体挤出得到脂质体颗粒的粒度分布,其中平均脂质体直径必须在80nm至110nm之间,d99不超过200nm(通过动态光散射分析)。通过被动负载机制包封阿糖胞苷。通过活性铜-介导的机制包封道诺霉素,得到摩尔比5:1的阿糖胞苷∶道诺霉素。除去任何未包封的药物物质,并通过渗滤改变本体缓冲液(bulkbuffer)。交换大量体积的300mm蔗糖,得到最终形式的cpx-351脂质体,然后对其进行冻干最佳化。将干燥的cpx-351样品用19ml的h2o重构,并且容易地再形成脂质体分散体。然后,使用动态光散射(dls)分析样品。预冻干的cpx-351脂质体显示约100nm的平均颗粒直径。对于批次1(下表1中的“1c001”),在冰冻之后以及在继而的冻干/再水合之后立即观察的脂质体粒度分别为99nm和100nm。对于第二批次,1d002,在冰冻之后以及在继而的冻干/再水合之后立即观察的cpx-351脂质体粒度分别为104nm和105nm。这些结果表明,当冰冻以及冻干和长时间储存时,共同负载依立替康加氟尿苷或阿糖胞苷加道诺霉素的dspc/dspg低胆固醇脂质体有效地保持其粒度分布特性。结果还表明用低胆固醇制备的这些凝胶相脂质体能够抵抗特别是在不存在高水平胆固醇下冰冻和冻干通常引起的聚集和融合。表1冰冻和冻干对cpx-351脂质体粒度的影响实施例3冻干脂质体的药物包封%随时间推移保持不变为了检查冰冻和/或冻干及储存对从双负载的cpx-1或cpx-351脂质体的药物渗漏程度的影响,进行试验。在冻干之后立即("初始")以及在5℃下储存6个月和9个月之后,测量共同负载的cpx-1脂质体中包封的依立替康和氟尿苷的量。稳定性研究表明依立替康的包封百分比(%)在冻干后立即测量为99%,在储存六个月后为97%,并且在储存9个月后为97%(下表2)。类似地,在冻干后立即测量氟尿苷的包封%为98%,在5℃下储存后6个月和9个月均为95%(下表3)。对于cpx-351脂质体,还研究了冰冻和冻干对药物包封%的影响。如下表4所示,在两个不同批次(1c001和1d002)中,共同负载的cpx-351脂质体中包封的阿糖胞苷的量在冰冻("frozen")后立即测量为100%,在冻干(“lyophilized”)后为98%。这两个批次中,道诺霉素的包封%在冰冻和冻干之后立即测量均为99%。当将cpx-351储存在5℃或25℃下时,药物包封也很稳定(参见表5和6)。这些结果显然表明在外部溶液中掺入低量的胆固醇和低温保护剂的cpx-1和cpx-351凝胶-相脂质体可以有效地被冰冻、脱水和重构,两种包封药物都具有最小的渗漏。表2重构的cpx-1脂质体中依立替康的包封%稳定性区间表3重构的cpx-1脂质体中氟尿苷的包封%稳定性区间表4重构的cpx-351脂质体中阿糖胞苷和道诺霉素的包封%表5cpx-351:阿糖胞苷的包封%冻干后的时间储存在5℃下储存在25℃下批次1c001初始98983个月98986个月98989个月98-批次1d001初始98983个月98996个月99999个月98-表6cpx-351:道诺霉素的包封%冻干后的时间储存在5℃下储存在25℃下批次1c001初始99993个月99996个月99999个月99-批次1d001初始99993个月99996个月99999个月99-当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1