一种多甲氧基黄烷酮在制备抗氧化应激药物中的应用的制作方法
本发明属于医药领域,涉及(2s)-5,6,7,3',4'-五甲氧基黄烷酮的应用,具体涉及(2s)-5,6,7,3',4'-五甲氧基黄烷酮在制备预防或治疗活性氧诱发疾病药物或保健品中的应用。
背景技术
近年来由于环境污染的加重和吸烟人数的增加,机体直接暴露于一些有毒物质或氧化剂中,例如碳硫氮氧化物(co、so2、no2等)、重金属(铅、铬、砷等)、汽车尾气和建筑矿物尘形成的雾霾等。这些物质会导致机体内活性氧(ros)水平异常升高,氧化还原失衡,引起氧化应激,继而损害细胞成分(如脂质,蛋白质和核酸),并引发包括慢性阻塞性肺疾病、呼吸道炎症、心血管疾病、神经退行性疾病和肿瘤在内的诸多疾病。
核转录因子nrf2(nuclearfactor-erythroid2-relatedfactor2)信号通路是机体抗氧化系统中的重要信号通路。当机体处于氧化应激状态时,nrf2进入细胞核,与抗氧化酶和ii相解毒酶启动子区域抗氧化反应原件(are)结合后,启动下游基因转录。nrf2调控的下游靶蛋白包括gst、nqo1等ii相解毒酶;ho-1、sod和γ-gcs等抗氧化酶。激活nrf2信号通路可诱导其下游调控的多种ii相解毒酶及抗氧化酶的表达,清除细胞内活性氧,维持细胞内氧化还原平衡状态,从而发挥内源性保护作用。
在过去十几年中,通过激活nrf2通路调节细胞内氧化还原平衡,清除活性氧,干预活性氧诱发疾病已经取得了显著成果。越来越多的研究探索并证实了在不同的病理条件下nrf2的保护作用,以及nrf2参与对抗污染物引起的损伤和氧化应激中的保护作用。在氧化应激诱发疾病模型中发现,激活nrf2通路能够上调ii相解毒酶及抗氧化酶水平,清除污染物中的致癌物或降低其毒性;上调nrf2的表达还能够增加细胞内谷胱甘肽水平,增强抗氧化酶活性,清除细胞内活性氧。因此,利用外源性nrf2激动剂激活nrf2信号通路,增强机体抗氧化能力,成为许多活性氧诱发疾病的治疗的有效策略。
天然产物是药物先导化合物的重要来源,对人类药物发展史做出了重要贡献。从天然产物中寻找具有预防和治疗作用的先导化合物,是药物研发的重要途径。目前,许多nrf2激动剂都是来源于天然产物或从天然产物中提取得到,例如来源于十字花科蔬菜中的萝卜硫素、来源于姜黄中的姜黄素、来源于肉桂中的肉桂醛等。黄酮作为nrf2激动剂的重要来源,具有成为防治氧化应激诱发疾病药物的潜力。尽管已经进行了大量关于黄酮的nrf2激动作用和抗氧化机制研究,但是这些黄酮多是市售可得或容易获得的成分,例如槲皮素、山奈酚、染料木黄酮等。目前仍有大量结果新颖、活性优异的黄酮类nrf2激动剂亟待研究,并且具有成为药物先导化合物的潜力。
技术实现要素:
为了解决以上技术问题,本发明提出提下技术方案:
本发明目的之一在于提供(2s)-5,6,7,3',4'-五甲氧基黄烷酮在制备治疗活性氧诱导疾病药物和保健品中的应用。该化合物的化学式如下:
本发明研究过程中发现,(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够促进nrf2、nqo1、γ-gcs蛋白水平和nqo1、gclmmrna水平的表达,其激活机制是通过诱导nrf2蛋白转位入核,抑制nrf2蛋白降解,增加nrf2蛋白稳定性实现的;采用香烟烟雾诱导的人支气管上皮beas-2b细胞损伤模型评价了(2s)-5,6,7,3',4'-五甲氧基黄烷酮的细胞保护作用,结果表明该化合物能够抑制香烟烟雾诱导的ros生成,增加细胞内源性抗氧化剂gsh水平,抑制香烟烟雾诱导的beas-2b细胞损伤;对肾小球膜系细胞sv40mes13细胞、大鼠星形胶质瘤细胞c6细胞表现出相似的细胞保护作用。上述实验结果表明,本发明涉及的(2s)-5,6,7,3',4'-五甲氧基黄烷酮具有防治慢性阻塞性肺疾病、呼吸道炎症、心血管疾病、神经退行性疾病和糖尿病肾病的作用。
优选的,上述应用中活性氧诱导疾病包括慢性阻塞性肺疾病、呼吸道炎症、心血管疾病、神经退行性疾病和肿瘤等疾病。
优选的,上述应用中,化合物(2s)-5,6,7,3',4'-五甲氧基黄烷酮的浓度为3.12~25μm,进一步优选的,为6.25μm。
本发明目的之二在于提供上述化合物的分离方法,该方法的步骤为:取猫须草地上部分粉碎,加入乙醇溶液回流提取,将提取液减压浓缩得到提取浸膏。向所得提取浸膏中加水混悬,依次采用石油醚、乙酸乙酯和正丁醇萃取,得到乙酸乙酯部分,取乙酸乙酯部分,以石油醚-丙酮为洗脱剂进行梯度洗脱,在薄层色谱的指导作用下将洗脱成分合并得到14个部分,按色谱洗脱出柱顺序记为frs.1-14。将其中fr.6采用mci柱分离,以甲醇水为洗脱剂进行梯度洗脱,得到六个部分,按色谱洗脱出柱顺序记为fr.6.1-fr.6.6。fr.6.5中有结晶,采用二氯甲烷-甲醇系统,重结晶得黄色针状结晶即为(2s)-5,6,7,3',4'-五甲氧基黄烷酮。
优选的,上述分离方法中的乙醇溶液为95%的乙醇溶液。
优选的,上述猫须草加入乙醇溶液回流提取四次,合并滤液;其中猫须草与乙醇溶液的比例为1:5至1:8。
优选的,上述石油醚-丙酮梯度洗脱,石油醚:丙酮从20:1至1:1等度洗脱。
优选的,上述甲醇-水梯度洗脱,甲醇:水从30:70等度洗脱。
优选的,上述二氯甲烷-甲醇系统中,二氯甲烷:甲醇=1:1。
本发明目的之三在于提供一种药物组合物,该药物组合物由(2s)-5,6,7,3',4'-五甲氧基黄烷酮或(2s)-5,6,7,3',4'-五甲氧基黄烷酮及其他黄烷酮类化合物组成。
优选的,上述药物组合物中,化合物(2s)-5,6,7,3',4'-五甲氧基黄烷酮的浓度为3.12~25μm,进一步优选的,为6.25μm。
本发明目的之四在于提供一种用于治疗活性氧诱导疾病的药物制剂,该药物制剂的成分为上述药物组合物及常规辅料。
优选的,上述药物制剂为胶囊剂、片剂、散剂、颗粒剂、注射剂、口服液、酒剂、丸剂、合剂或酊剂。
本发明目的之五在于提供一种用于治疗活性氧诱导疾病片剂的制备方法,将(2s)-5,6,7,3',4'-五甲氧基黄烷酮、淀粉及糊精混合后过筛,再加入羧甲基纤维素钠制粒,然后加入硬脂酸镁混合后压片即得片剂。
优选的,上述制备方法中,(2s)-5,6,7,3',4'-五甲氧基黄烷酮、淀粉及糊精质量比为1~2:1~2:2~4。
本发明目的之六在于提供一种(2s)-5,6,7,3',4'-五甲氧基黄烷酮作为nrf2激动剂的应用,或作为nrf2入核诱导剂的应用,或作为gsh诱导剂的应用。
本发明的有益效果
1.近些年来,随着环境污染程度的加重,空气中的有毒物质含量升高,导致氧化应激疾病的发病率升高,开发针对抗氧化应激疾病的药物具有重要意义。本发明中的(2s)-5,6,7,3',4'-五甲氧基黄烷酮对香烟诱导的支气管上皮beas-2b细胞损伤模型有良好的修复作用,表明该化合物能够抑制香烟烟雾诱导的活性氧生成。
2.现有技术中关于化合物(2s)-5,6,7,3',4'-五甲氧基黄烷酮分离方法及活性的研究较少,本发明通过研究提出了一种高效分离(2s)-5,6,7,3',4'-五甲氧基黄烷酮的方法,并确认了其抗氧化活性。发明人在现有技术中相关研究较为空白的前提下,完成对其提取分离及活性的研究,该研究成果具备非显而易见性。
3.kumar,h等人在文献"naturalproduct-derivedpharmacologicalmodulatorsofnrf2/arepathwayforchronicdiseases."naturalproductreports31.1(2013):109-139.中公开了许多天然提取物如芹菜素、木樨草素等虽然与本发明中化合物具有相似的母核结构,但却作为nrf2/are通路的抑制剂,表现出与本发明化合物完全相反的药理活性。本发明通过研究确认了化合物(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够促进nrf2、nqo1、γ-gcs蛋白水平和nqo1、gclmmrna水平的表达,其激活机制是通过诱导nrf2蛋白转位入核,抑制nrf2蛋白泛素化,增加nrf2蛋白稳定性实现的。这种作用机制的公开,能够帮助本领域技术人员针对相关靶点研发相关药物,具有重要的医学意义。
4.(2s)-5,6,7,3',4'-五甲氧基黄烷酮诱导活性评价实验结果表明,本发明中化合物对nqo1的诱导作用优于现有技术中其他化合物,诱导nrf2入核效果更强,在6.25μm下即可达到良好保护细胞的效果,保护效率高、成本经济。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
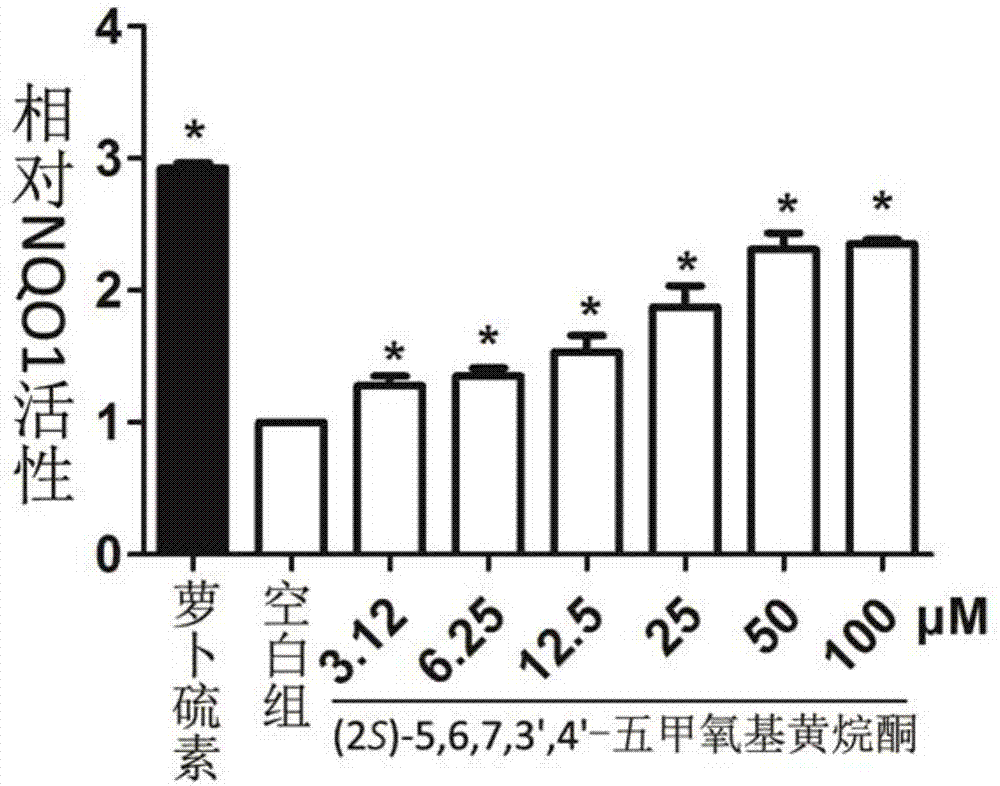
图1nqo1诱导活性试验的柱状图;
图1表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮对能够诱导hepa1c1c7细胞ii相解毒酶nqo1的表达并增强其活性,图中的(2s)-5,6,7,3',4'-五甲氧基黄烷酮浓度单位为μm,萝卜硫素2.0μm为阳性对照。
图2不同浓度(2s)-5,6,7,3',4'-五甲氧基黄烷酮的免疫印迹图;
图2表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够上调nrf2和其下游ii相解毒酶nqo1抗氧化酶和γ-gcs蛋白水平,其中,(2s)-5,6,7,3',4'-五甲氧基黄烷酮浓度单位为μm。
图3不同浓度(2s)-5,6,7,3',4'-五甲氧基黄烷酮的实时荧光pcr图;
图3表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够上调nqo1和gclmmrna水平,图中萝卜硫素2.0μm为对照。
图4细胞免疫的荧光显微照片图;
图4表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够促进nrf2转位入核,图中萝卜硫素2.0μm为对照,(2s)-5,6,7,3',4'-五甲氧基黄烷酮浓度为25μm。
图5(2s)-5,6,7,3',4'-五甲氧基黄烷酮的泛素化图;
图5表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够抑制nrf2蛋白泛素化,其中,(2s)-5,6,7,3',4'-五甲氧基黄烷酮浓度为25μm。
图6不同时间(2s)-5,6,7,3',4'-五甲氧基黄烷酮的免疫印迹图;
图6表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够延长nrf2蛋白半衰期,其中,(2s)-5,6,7,3',4'-五甲氧基黄烷酮浓度为25μm。
图7细胞内ros荧光显微照片图;
图7表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够抑制香烟烟雾诱导的ros生成,其中,(2s)-5,6,7,3',4'-五甲氧基黄烷酮浓度为6.25μm,香烟烟雾的浓度为180μg/ml。
图8(2s)-5,6,7,3',4'-五甲氧基黄烷酮对谷胱甘肽影响的柱状图;
图8表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够增加人支气管上皮beas-2b细胞内源性抗氧化剂谷胱甘肽水平,其中,萝卜硫素5μm为阳性对照,(2s)-5,6,7,3',4'-五甲氧基黄烷酮浓度单位为μm。
图9细胞毒性试验的细胞存活量的柱状图;
图9a为不同浓度(2s)-5,6,7,3',4'-五甲氧基黄烷酮对180μg/ml香烟烟雾诱导细胞毒性的保护作用,图9b表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮对不同浓度香烟烟雾诱导细胞毒性的保护作用,图9c表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮对转染nrf2-sirna的细胞无保护作用。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
正如背景技术所介绍的,现有技术中存在已研究黄酮多是市售可得或容易获得的成分的不足,为了解决如上的技术问题,本申请提出了(2s)-5,6,7,3',4'-五甲氧基黄烷酮在制备活性氧诱发疾病药物和保健品中的应用。
本发明的一种典型实施方式中,提供(2s)-5,6,7,3',4'-五甲氧基黄烷酮在制备治疗活性氧诱导疾病药物和保健品中的应用。该化合物的化学式如下:
优选的实施方式中,上述应用中活性氧诱导疾病包括慢性阻塞性肺疾病、呼吸道炎症、心血管疾病、神经退行性疾病和肿瘤等疾病。
优选的实施方式中,上述应用中,化合物(2s)-5,6,7,3',4'-五甲氧基黄烷酮的浓度为3.12~25μm,进一步优选的,为6.25μm。
本发明的又一种典型实施方式中,提供上述化合物的分离方法,该方法的步骤为:取猫须草地上部分粉碎,加入乙醇溶液回流提取,将提取液减压浓缩得到提取浸膏。向所得提取浸膏中加水混悬,依次采用石油醚、乙酸乙酯和正丁醇萃取,得到乙酸乙酯部分,取乙酸乙酯部分,以石油醚-丙酮为洗脱剂进行梯度洗脱,在薄层色谱的指导作用下将洗脱成分合并得到14个部分,按色谱洗脱出柱顺序记为frs.1-14。将其中fr.6采用mci柱分离,以甲醇水为洗脱剂进行梯度洗脱,得到六个部分,按色谱洗脱出柱顺序记为fr.6.1-fr.6.6。fr.6.5中有结晶,采用二氯甲烷-甲醇系统,重结晶得黄色针状结晶即为(2s)-5,6,7,3',4'-五甲氧基黄烷酮。
优选的实施方式中,上述分离方法中的乙醇溶液为95%的乙醇溶液。
优选的实施方式中,猫须草加入乙醇溶液后回流提取四次,合并滤液;其中,每次回流提取时,猫须草与乙醇溶液的比例为1:5至1:8。
优选的实施方式中,石油醚-丙酮梯度洗脱,石油醚:丙酮从20:1至1:1等度洗脱。
优选的实施方式中,甲醇-水梯度洗脱,甲醇:水从30:70等度洗脱。
优选的实施方式中,二氯甲烷-甲醇系统中,二氯甲烷:甲醇=1:1。
本发明的又一种典型实施方式中,提供一种药物组合物,该药物组合物由(2s)-5,6,7,3',4'-五甲氧基黄烷酮或(2s)-5,6,7,3',4'-五甲氧基黄烷酮及其他黄烷酮类化合物组成。
优选的实施方式中,上述药物组合物中,化合物(2s)-5,6,7,3',4'-五甲氧基黄烷酮的浓度为3.12~25μm,具体实施例中,为6.25μm。
本发明的又一种典型实施方式中,提供一种用于治疗活性氧诱导疾病的药物制剂,该药物制剂的成分为上述药物组合物及常规辅料。
优选的实施方式中,上述药物制剂为胶囊剂、片剂、散剂、颗粒剂、注射剂、口服液、酒剂、丸剂、合剂或酊剂。
本发明的又一种典型实施方式中,提供一种用于治疗活性氧诱导疾病片剂的制备方法,将(2s)-5,6,7,3',4'-五甲氧基黄烷酮、淀粉及糊精混合后过筛,再加入羧甲基纤维素钠制粒,然后加入硬脂酸镁混合后压片即得片剂。
优选的实施方式中,上述制备方法中,(2s)-5,6,7,3',4'-五甲氧基黄烷酮、淀粉及糊精质量比为1~2:1~2:2~4。
本发明的又一种典型实施方式中,提供一种(2s)-5,6,7,3',4'-五甲氧基黄烷酮作为nrf2激动剂的应用,或作为nrf2入核诱导剂的应用,或作为gsh诱导剂的应用。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
实施例1:(2s)-5,6,7,3',4'-五甲氧基黄烷酮的分离及认定
取猫须草地上部分6公斤粉碎后,以95%乙醇加热回流或冷浸提取4次猫须草与乙醇溶液的比例为1:5至1:8,合并提取液,通过减压浓缩得到提取浸膏600克。向所得浸膏中加入1升水混悬,依次采用石油醚、乙酸乙酯和正丁醇萃取,得乙酸乙酯部分100克。取乙酸乙酯部位,以石油醚-丙酮为洗脱剂,洗脱剂比例为石油醚-丙酮(20:1至1:1),以薄层色谱法指导合并,得14个部分,按色谱洗脱出柱顺序记为frs.1-14。fr.6采用mci柱分离,以甲醇水为洗脱剂,洗脱剂比例为甲醇-水(30:70至100:0)得6个部分,按色谱洗脱出柱顺序记为fr.6.1-fr.6.6。fr.6.5中有结晶,进一步采用二氯甲烷-甲醇(1:1)系统,重结晶得黄色针状结晶。通过核磁共振谱对其结构进行了确证,其波谱数据如下:
1hnmr(600mhz,dmso-d6):δh5.46(dd,j=16.0,3.0hz,h-2),3.15(dd,j=16.0,12.5hz,h-3a),2.63(dd,j=12.5,3.1hz,h-2b),6.53(s,h-8),7.14(d,j=1.8hz,h-2’),7.04(dd,j=8.7,1.8hz,h-5’),3.77(s,meo-5,6),3.84,3.78,3.67(each3h,s,meo-3’,4’,7)。对其结构解析,确证该黄色针状结晶为(2s)-5,6,7,3',4'-五甲氧基黄烷酮。
实施例2:(2s)-5,6,7,3',4'-五甲氧基黄烷酮的nqo1诱导活性评价
(1)小鼠肝癌细胞hepa1c1c细胞系的培养
小鼠肝癌细胞hepa1c1c细胞系购自美国模式培养物集存库(atcc),采用含10%胎牛血清(fbs)的mem培养基,置于37℃,5%co2培养箱中培养。
(2)nqo1诱导活性试验
将hepa1c1c7细胞(1.0×104个细胞/孔)接种于96孔板中,并用不同浓度的(2s)-5,6,7,3',4'-五甲氧基黄烷酮处理24小时。吸除培养基,加入27μl细胞裂解液[含0.8%毛地黄皂苷和2mmedta溶液(ph=7.8)],37℃孵育15分钟。加入170μl完全反应混合物(含有牛血清白蛋白,mtt,1.5%吐温20,0.5mtris-hcl,7.5mmfad,150mm葡萄糖-6-磷酸,葡萄糖-6-磷酸脱氢酶,50mmnadp和50mm甲萘醌)。室温放置约3-5分钟,酶标仪630nm波长下检测吸光度。sf(2.0μm)作为阳性对照。
结果:如图1所示,(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够激活hepa1c1c7细胞中nqo1活性,其最大诱导活性为2.35倍(50μm),阳性对照药物萝卜硫素(2.0μm)是空白对照组的2.92倍。上述结果表明,(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够激活ii相解毒酶,对人体细胞具有保护作用。
实施例2:(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够上调nrf2、γ-gcs和nqo1蛋白水平
(1)人支气管上皮beas-2b细胞的培养
人支气管上皮beas-2b细胞购自美国模式培养物集存库(atcc),采用1640培养基,并向其中加入10%胎牛血清(fbs),5%谷氨酰胺,置于37℃,5%co2培养箱中培养。
(2)免疫印迹分析(westernblot)检测细胞中蛋白水平的变化
将beas-2b细胞接种于直径35mm培养皿中,培养至密度达到70%-80%后,加入不同浓度的(2s)-5,6,7,3',4'-五甲氧基黄烷酮处理18h,pbs洗涤2次,加入细胞裂解液(50μg/ml抑肽酶,0.5mm苯甲基磺酰氟,1mm正钒酸钠,10mm氟化钠,10mmβ-磷酸甘油),收集蛋白并采用bradford法测定蛋白浓度。各取样品蛋白(100μg)上样,sds-page分离蛋白组分并采用电转移法将蛋白条带转移至硝酸纤维素薄膜上。薄膜经pbs配制5%的脱脂奶粉溶液室温封闭1h后,分别与各待测蛋白抗体4℃孵育过夜。经pbs洗涤后分别加入辣根过氧化物酶偶联的二抗孵育1h后,用增强型ecl化学发光进行蛋白分析。
结果:如图2所示,细胞经(2s)-5,6,7,3',4'-五甲氧基黄烷酮处理18h后,nrf2及其下游ii相解毒酶nqo1和抗氧化γ-gcs蛋白水平呈现剂量依赖性增加,证实该化合物能够在蛋白水平上激活nrf2信号通路。
实施例3:(2s)-5,6,7,3',4'-五甲氧基黄烷酮上调nqo1和gclmmrna水平
方法:实时荧光pcr检测细胞中mrna水平的变化
将beas-2b细胞(4×105个细胞/孔)接种到直径35mm培养皿中,过夜培养后用不同浓度的(2s)-5,6,7,3',4'-五甲氧基黄烷酮处理18h。收集蛋白,提取rna,测定各样品中rna浓度,经反转录反应后,在冰上配制以下pcr反应液加入到八连排中:0.2μl引物混合液(10μm)、0.2μldna模板、4.6μldepc水、5μlsybrpremixextaq(tlirnasehplus)(2×),离心后用荧光定量pcr仪检测,采用三步法进行扩增反应(一次循环:95℃、2min;45次循环:95℃、5s,55℃、30s,72℃、30s)。
结果:实时荧光pcr结果显示(图3),细胞经(2s)-5,6,7,3',4'-五甲氧基黄烷酮处理18h后,nqo1和gclmmrna水平呈现剂量依赖性增加,证实该化合物能够在rna水平上激活nrf2信号通路。
实施例4:(2s)-5,6,7,3',4'-五甲氧基黄烷酮促进nrf2蛋白转位入核
方法:免疫荧光法检测nrf2细胞内位置
将细胞爬片放置于24孔板中,接种beas-2b细胞,待细胞贴壁后加入(2s)-5,6,7,3',4'-五甲氧基黄烷酮处理8小时,用4℃预冷的pbs洗涤2次,加入500μl-20℃预冷的甲醇/丙酮(1:1)固定10min,再用4℃预冷的pbs洗涤3次,加入nrf2抗体4℃过夜孵育;pbs洗涤3次,二抗室温孵育1h;pbs洗涤3次,每孔加入500μldapi染色10min;用4℃预冷的pbs-tx洗涤3次,将爬片倒扣在荧光抗猝灭剂上,于暗室用荧光显微镜观察并拍照。
结果:免疫荧光结果显示(图4),正常状态下,nrf2位于细胞质中,加入(2s)-5,6,7,3',4'-五甲氧基黄烷酮和阳性对照萝卜硫素处理8小时后,nrf2转位进入细胞核。
实施例5:(2s)-5,6,7,3',4'-五甲氧基黄烷酮抑制nrf2蛋白泛素化降解
方法:免疫沉淀和免疫印迹分析结合检测nrf2泛素化水平
将beas-2b细胞接种于直径60培养皿中,细胞密度达到80%时转染nrf2,keap1,ha-ub和vector质粒。转染36h后,加入10μmmg132和药物处理细胞4h,收集蛋白分别进行免疫印迹和免疫沉淀分析,具体步骤如下:
(1)pbs洗涤1次,加入200μl含1mmdtt的2%sds/tbs收集蛋白,95℃变性10min,超声20s后离心,取30μl上清液至新的离心管中,加入2μl细胞裂解液进行免疫印迹分析;
(2)剩余液体按照1:4比例加入1%triton-x-100/tbs,加入10μlproteinabeads,4℃摇床震荡30min,离心30min后吸取上清液,加入1.5μlnrf2或igg抗体,4℃摇床震荡2h,加入50μlproteinabeads,4℃过夜,离心后弃去上清液,用含1mmdtt的0.5mlicl/tbs洗涤一次,然后用含1mmdtt的1%triton-x-100/tbs洗涤2次,加入15μl2×plb(passivelysisbuffer),加入等体积细胞裂解液煮沸10min,进行免疫印迹分析。
结果:如图5所示,经(2s)-5,6,7,3',4'-五甲氧基黄烷酮处理后,nrf2泛素化水平明显降低,表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够抑制nrf2蛋白泛素化降解。
实施例6:(2s)-5,6,7,3',4'-五甲氧基黄烷酮延长nrf2蛋白半衰期
方法:免疫印迹分析检测nrf2蛋白半衰期
将beas-2b细胞接种于直径35mm培养皿中,培养至密度达到70%-80%后,加入(2s)-5,6,7,3',4'-五甲氧基黄烷酮8h,然后加入放线菌酮,分别在0、10、20、30、40分钟收取蛋白,进行免疫印迹分析检测,采用imagej软件进行量化。
结果:如图6所示,空白组beas-2b细胞nrf2蛋白半衰期为12.9分钟,经(2s)-5,6,7,3',4'-五甲氧基黄烷酮处理8h后,nrf2蛋白半衰期延长至23.4分钟,表明(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够延长nrf2蛋白半衰期。
实施例7:(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够抑制香烟烟雾诱导的ros生成
方法:ros试剂盒检测细胞内活性氧含量
将beas-2b细胞(4×105个细胞/孔)接种到直径35培养皿中,培养过夜后先用(2s)-5,6,7,3',4'-五甲氧基黄烷酮预保护8h,再加入刺激物处理24h。按照ros检测试剂盒说明书进行以下操作:活性氧阳性对照物rosup按1:1000用无血清的培养基稀释,在加入dcfh-da前10~20min加入;去除原有细胞培养液,加入1ml稀释好的dcfh-da(1:1000无血清的培养基稀释),培养箱中放置20min;用pbs洗涤2次,于暗室用400×荧光显微镜观察并拍照。
结果:如图7所示,(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够显著抑制香烟烟雾诱导的ros生成,保护细胞免受ros引起的损伤。
实施例8:(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够增加细胞内源性抗氧化剂谷胱甘肽水平
方法:细胞内谷胱甘肽含量的测定
将细胞接种到直径60培养皿中,过夜培养后用不同浓度(2s)-5,6,7,3',4'-五甲氧基黄烷酮处理24h,消化收集细胞,pbs洗涤2-3次,低速离心收集细胞,加入220μl1mmedta/pbs溶液重悬细胞,超声破碎细胞,取100μl细胞悬液,按照谷胱甘肽测定试剂盒说明书操作,405nm波长下检测吸光度并计算谷胱甘肽含量。
结果:如图8所示,(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够显著增加细胞内谷胱甘肽水平,增强细胞内还原能力。
实施例9:(2s)-5,6,7,3',4'-五甲氧基黄烷酮对香烟烟雾诱导的人支气管上皮beas-2b细胞损伤的保护作用
方法:mtt法测定(2s)-5,6,7,3',4'-五甲氧基黄烷酮对香烟烟雾诱导细胞毒性的保护作用
将beas-2b细胞接种于96孔板上,细胞贴壁后,加入指定浓度(2s)-5,6,7,3',4'-五甲氧基黄烷酮预处理细胞8小时,再加入指定浓度的刺激物处理24小时,每孔加入20μl2mg/mlmtt溶液,置于培养箱中孵育3-4h,除去上清,每孔加入100μldmso,震荡溶解结晶紫,酶标仪570nm波长下检测吸光度。。
结果:如图9a所示,采用(2s)-5,6,7,3',4'-五甲氧基黄烷酮预处理细胞8小时,能够显著抑制180μg/ml香烟烟雾诱发的细胞毒性,增加细胞生存率,其中6.25μm浓度(2s)-5,6,7,3',4'-五甲氧基黄烷酮最佳。如图9b所示,采用6.25μm浓度(2s)-5,6,7,3',4'-五甲氧基黄烷酮作为保护药物,能够显著抑制100、150、180μg/ml的香烟烟雾诱发的细胞毒性,增加细胞生存率。如图9c所示,6.25μm浓度(2s)-5,6,7,3',4'-五甲氧基黄烷酮对转染nrf2-sirna的细胞无保护作用。结果证明,(2s)-5,6,7,3',4'-五甲氧基黄烷酮能够抑制香烟烟雾诱导的毒性,而且是通过激活nrf2通路来产生保护作用的。
实施例10:片剂的制备
(2s)-5,6,7,3',4'-五甲氧基黄烷酮(实施例1确证)1g,加入淀粉1g、糊精2g,过筛,加入羧甲基纤维素钠适量,制粒。加入硬脂酸镁适量,混匀,压片,即得。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!