多肽-药物共组装构筑还原响应型抗癌纳米药物的方法与流程
本发明属于纳米材料技术领域和生物医学材料领域,涉及一种还原响应型抗癌纳米药物的制备方法。
背景技术
癌症是严重威胁人类健康的一种疾病,从目前医学界取得的成就来看,癌症治疗的最主要方法还是化学药物疗法,该方法中所使用的大剂量抗癌药物虽然对肿瘤表现出了良好的治疗效果,但同时对人体正常细胞也会产生严重的毒副作用。抗癌纳米药物利用生物相容性好的材料负载药物,得到的纳米尺度药物可通过实体瘤的高通透性和滞留效应(epr效应)被肿瘤细胞摄取,因此降低了药物在正常细胞内释放的几率,减弱了对正常组织的损伤。
肿瘤细胞生命活动旺盛,增殖频繁,需要大量的氧气和营养物质支撑,快速的新陈代谢导致肿瘤细胞附近微环境与正常细胞有所差异,利用这一特性,通过设计对肿瘤微环境具有响应性的纳米药物是发展趋势。其中针对肿瘤细胞中还原型谷胱甘肽(gsh)的纳米药物的设计是重要的一类。肿瘤细胞内gsh的浓度可高达2~10mm,与正常血液及细胞中浓度0.002mm相比相差数千倍,利用这种差异可实现响应型纳米药物在肿瘤部位的快速释放,而在正常生理条件下缓慢释放或不释放。目前研究中还原响应性的实现主要依靠在纳米药物上修饰可被gsh断裂的二硫键基团。例如,lee等人制备了一种由聚乙二醇-短肽形成的有机高聚物,加入甲氨蝶蛉并采用3,3'-二硫代双(磺酸琥珀酰亚氨基丙酸酯)进行交联后形成生物相容性良好的纳米胶束,在gsh存在的情况下,该胶束二硫键断裂,药物释放。又如,徐福建等人利用含二硫键的硅烷和阿霉素在一锅法下制备出了一种具备自修饰能力、且可同时负载抗癌药物和dna的可降解微孔二氧化硅,这一载药体系在还原氛围下能够实现药物和基因的快速响应释放。然而,这些方法不仅增加了反应步骤,提高了成本,而且由于引入了新的化学基团或组分,增加了毒副作用的风险。
多肽由生命活动所必需的氨基酸组成,具有高生物相容性,低生物毒性,较好的水溶性等特征,进入人体后,多肽通过新陈代谢作用能快速降解,且不会对人体造成二次伤害。通过合理设计多肽氨基酸序列和引入特殊官能团,可以赋予多肽多种性质和功能。与其他生物材料相比,利用纯多肽作为药物载体可以减少载体的代谢负担,提高疏水性药物的溶解性,增强药物吸收的效果,在癌症治疗中具有优势。
目前,基于纯多肽材料的还原响应型抗癌纳米药物报道较少,通常为了实现响应性和高药物负载,需要引入非肽基团,不仅增加了成本也减弱了多肽作为药物载体的优势。
技术实现要素:
为了解决现有技术中存在的问题,本发明提供一种多肽-药物共组装构筑还原响应型抗癌纳米药物的方法,解决现有技术中纯多肽材料的还原响应型抗癌纳米药物合成成本高,毒性高的问题。具体技术方案如下:
本发明中的多肽由固相合成法获得,其氨基酸序列为:乙酰基-丙氨酸-苏氨酸-赖氨酸-苏氨酸-丙氨酸-半胱氨酸(二硫键)半胱氨酸-丙氨酸-苏氨酸-赖氨酸-苏氨酸-丙氨酸-乙酰基(ac-atktac(s-s)catkta-ac)。以该多肽为载体,负载抗癌药物,通过共组装得到纳米药物,具体方法包括如下步骤:
1)将多肽和抗癌药物分别溶解在有机溶剂中,按比例混合后加入缓冲液稀释到一定浓度;
2)将步骤1)中的混合液于特定温度下静置孵化;
3)步骤2)中混合液孵化完成后,离心后取上清液,获得具有一定粒径的纳米药物。
优选步骤1)所述的抗癌药物可以是姜黄素,10-羟基喜树碱,阿霉素或紫杉醇中的一种或几种。
优选步骤1)中用来溶解多肽和抗癌药物的有机溶剂可以是二甲基亚砜、乙醇、甲醇、丙酮、乙酸中的一种,溶解后多肽浓度为1mg/5~25μl有机溶剂,抗癌药物浓度为1mg/5~100μl有机溶剂。
优选步骤1)所述的多肽与抗癌药物的摩尔比例为5:1~5:10。
优选步骤1)所述的缓冲液可以是磷酸盐缓冲液、柠檬酸盐缓冲液、醋酸盐缓冲液、硼酸盐缓冲液中的一种,ph为5.0~9.0,缓冲液浓度为30~70mm,稀释后多肽终浓度浓度为0.3mg/ml~2.0mg/ml,药物终浓度为0.06mg/ml~4.0mg/ml。
优选步骤2)所述的孵化温度为15~30℃,孵化时间为1~6h。
优选步骤3)所述的离心时间为1~10min,离心转速为4000~9000rpm,所得纳米药物的尺寸在100~400nm。
本发明提供的抗癌纳米药物的制备方法是利用多肽与抗癌药物分子之间的相互作用,通过共组装形成粒径在100~400nm的纳米胶束。在还原性环境中,构成该纳米药物的多肽分子内的二硫键断裂,纳米胶束分解,所负载的抗癌药物发生释放。在体内,由于epr效应,纳米药物易于富集在肿瘤细胞周围,同时在肿瘤细胞过表达的gsh作用下,二硫键断裂,纳米胶束分解,快速释放出抗癌药物并大量积累在癌细胞内,从而引起细胞凋亡,达到肿瘤治疗的目的。本发明中所用抗癌药物为广谱抗癌药物,所适用的癌症包括宫颈癌、乳腺癌、肝癌、肾上腺癌等。
与已经报道的技术相比,本发明的优点主要有:
1)本发明中所用多肽仅由氨基酸组成,无需修饰其他非肽基团,合成简单。
2)本发明所用多肽生物相容性好,生物毒性低,体内容易降解。
3)本发明中所用多肽对gsh响应灵敏,能够实现药物在肿瘤部位的快速释放,提高药物利用效率。
4)该纳米药物能够在生物体内稳定发挥抗癌作用,且不对健康组织产生明显的毒副作用。
附图说明
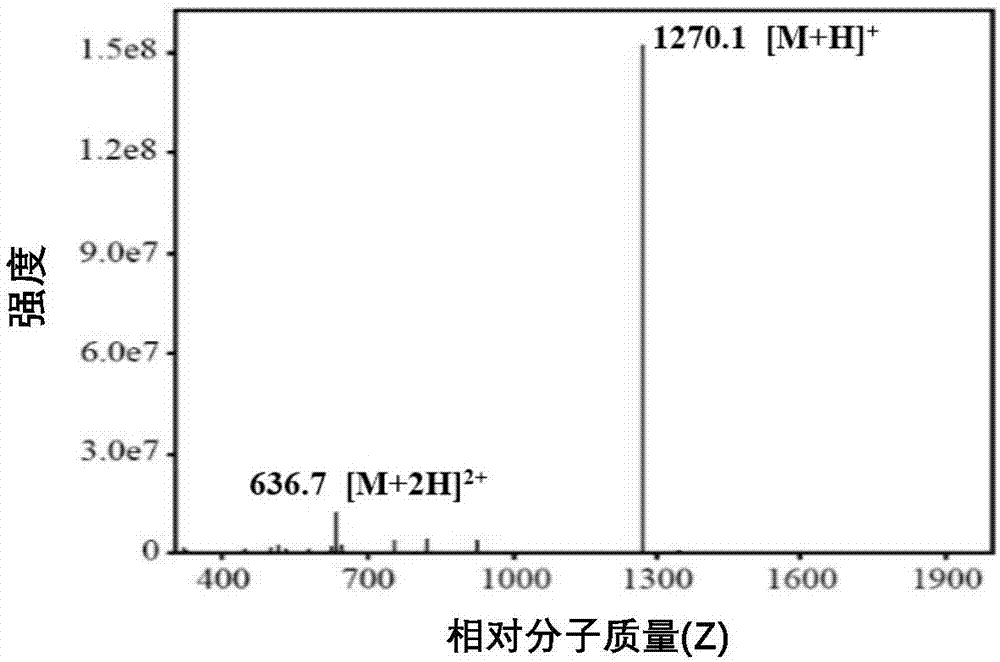
图1(a)为本发明中所设计多肽的分子式;(b)为该多肽的质谱图,质核比为1270.1;(c)为该多肽被gsh分解后的质谱图,质核比为656.1,表明在还原性环境中,多肽中的二硫键发生了断裂;
图2(a)为纳米药物在透射电子显微镜下的形貌图;(b)为纳米药物在原子力显微镜扫描下的形貌图;
图3为纳米药物在含不同gsh浓度溶液中药物的释放结果,图中横坐标为释放时间,纵坐标为药物释放百分比;
图4为多肽的生物相容性测试结果,图中横坐标为所用多肽浓度,纵坐标为存活细胞百分比;
图5为纳米药物的细胞毒性(mtt)实验结果,图中横坐标为药物浓度,纵坐标为存活细胞百分比;
图6为纳米药物的体内抗癌效果评价。其中(a)为纳米药物给药治疗周期内小鼠体重的变化趋势图,图中横坐标为给药天数,纵坐标为小鼠体重;(b)为给药治疗周期内肿瘤体积变化趋势图,图中横坐标为给药天数,纵坐标为肿瘤相对体积;(c)为给药结束后的小鼠照片;(d)为各实验组给药结束后肿瘤实物图及肿瘤平均质量,图中横坐标为给药天数,纵坐标为肿瘤质量,**p表示所得实验数据在统计学上意义上高度显著,*p表示所得实验结果在统计学意义上显著;
图7为给药治疗结束后小鼠肿瘤组织切片的tunel染色结果和h&e染色结果;
图8为给药治疗结束后小鼠肝、肾、脾组织切片的h&e染色结果。
具体实施方式
为了清楚了解本发明的技术方案,下面通过附图和实施例,对本发明的技术方案做进一步的详细描述。本发明的优选实施例详细描述如下,除详细描述的这些实施例外,本发明所包含的实施方式并不局限于此,还可以具有其他实施方式。
本发明多肽-药物共组装构筑还原响应型抗癌纳米药物的制备方法包括以下步骤:
实施例1
1)称取多肽和姜黄素(ccm)分别溶于四甲基亚砜(dmso)中,多肽浓度为1mg/20μldmso,ccm浓度为1mg/30μldmso,按多肽:ccm=5:3的摩尔比例混合上述两种溶液,随后加入ph=5.5的磷酸盐缓冲液稀释,缓冲液浓度为50mm,稀释后多肽终浓度为0.5mg/ml,姜黄素的终浓度为0.3mg/ml;
2)将步骤1)中的混合液置于16℃温度条件下孵化1h;
3)待步骤2)的混合液孵化结束后,混合溶液在6000rpm下离心3min,除去沉淀,取上清液,即获得纳米药物。
实施例2
1)称取多肽和姜黄素(ccm)分别溶于乙醇中,多肽浓度为1mg/5μl乙醇,ccm浓度为1mg/100μl乙醇,按多肽:ccm=5:1的摩尔比例混合上述两种溶液,随后加入ph=6.5的柠檬酸盐缓冲液稀释,缓冲液浓度为30mm,稀释后多肽终浓度为0.3mg/ml,姜黄素的终浓度为0.06mg/ml;
2)将步骤1)中的混合液置于30℃温度条件下孵化1h;
3)待步骤2)的混合液孵化结束后,混合溶液在4000rpm下离心10min,除去沉淀,取上清液,即获得纳米药物。
实施例3
1)称取多肽和10-羟基喜树碱(hcpt)分别溶于甲醇中,多肽浓度为1mg/10μl甲醇,ccm浓度为1mg/60μl甲醇,按多肽:hcpt=5:5的摩尔比例混合上述两种溶液,随后加入ph=5的柠檬酸盐缓冲液稀释,缓冲液浓度为45mm,稀释后多肽终浓度为0.8mg/ml,姜黄素的终浓度为0.8mg/ml;
2)将步骤1)中的混合液置于25℃温度条件下孵化2.5h;
3)待步骤2)的混合液孵化结束后,混合溶液在5000rpm下离心8min,除去沉淀,取上清液,即获得纳米药物。
实施例4
1)称取多肽和阿霉素(dox)分别溶于丙酮中,多肽浓度为1mg/15μl丙酮,ccm浓度为1mg/30μl丙酮,按多肽:dox=5:7的摩尔比例混合上述两种溶液,随后加入ph=8.0的醋酸盐缓冲液稀释,缓冲液浓度为60mm,稀释后多肽终浓度为1.5mg/ml,姜黄素的终浓度为2.1mg/ml;
2)将步骤1)中的混合液置于20℃温度条件下孵化4h;
3)待步骤2)的混合液孵化结束后,混合溶液在7000rpm下离心2.5min,除去沉淀,取上清液,即获得纳米药物。
实施例5
1)称取多肽和紫杉醇(tax)分别溶于乙酸中,多肽浓度为1mg/25μl乙酸,ccm浓度为1mg/5μl乙酸,按多肽:tax=5:10的摩尔比例混合上述两种溶液,随后加入ph=9.0的硼酸盐缓冲液稀释,缓冲液浓度为70mm,稀释后多肽终浓度为2.0mg/ml,姜黄素的终浓度为4.0mg/ml;
2)将步骤1)中的混合液置于15℃温度条件下孵化6h;
3)待步骤2)的混合液孵化结束后,混合溶液在9000rpm下离心1min,除去沉淀,取上清液,即获得纳米药物。
应用效果测试结果
以实施例1中所得的纳米药物为代表进行应用效果测试和评价:
图2a为采用透射电子显微镜对纳米药物进行检测,可见多肽与药物共组装后形成平均直径约为250nm的纳米胶束,图2b的原子力显微镜观察也证明了该结果,表明该纳米药物满足实体瘤满足epr效应对于纳米药物的粒径要求。
图3为纳米药物在ph7.4含不同浓度gsh的缓冲溶液中药物释放结果。可见,随着溶液中gsh浓度的增加,药物姜黄素自纳米胶束中释放的速率逐渐增加。当溶液中不含有gsh时,经过4h,药物的释放率仅为8%左右;当gsh浓度为正常细胞内gsh浓度(0.01mm)时,4h内药物的释放率在15%左右,缓慢的释放速率减弱了药物对正常细胞的毒害作用;而当gsh浓度达8mm时,4h内ccm释放率已达到90%左右,有利于杀灭癌细胞。这一结果证明了纳米药物在gsh溶液中可以实现响应性释放。
图4为利用宫颈癌细胞(hela细胞)检测本发明中所用多肽的生物相容性结果。取对数生长期的细胞接种在无菌96孔板中,大约105个细胞/孔,在达尔伯克氏改良伊格尔氏培养基(dmem培养基)中培养24h,细胞达到良好的贴壁状态后,将培养介质换成含有不同浓度多肽的培养液,多肽浓度依次为0、10、20、30、50、100、200μg/ml,每组分别设置5个孔。培养48h后,每孔加入10μl5mg/ml的3-(4,5-二甲基-2-噻唑基)-2,5-二苯基溴化四唑(mtt),继续培养4h。除去培养液,结晶体在振荡条件下用pbs清洗两遍,加入150μldmso溶解形成的紫色晶体,震荡条件下保证晶体溶解后形成的溶液均一。利用酶标仪在560nm处检测样品的吸光度。结果表明,在多肽加入浓度达到200μg/ml时,细胞存活率依旧高于95%,证明了该多肽生物相容性良好。
图5为利用hela细胞检测实施例1中纳米药物的抗癌活性。取对数生长期的细胞接种在无菌96孔板中,大约105个细胞/孔,在dmem中培养24h,细胞达到一个良好的贴壁状态后,将培养介质换成含不同浓度游离ccm、ccm@rrp的培养液(其中样品的浓度均以ccm计,分别为0、0.1、1、10、20、30、50μg/ml),每组分别设置5个孔。培养48h后,每孔加入10μl5mg/ml的mtt,继续培养4h,除去培养液,结晶体在振荡条件下用pbs清洗两遍,加入150μldmso溶解形成的晶体,震荡条件下保证晶体溶解后形成的溶液均一。采用酶标仪在560nm出检测样品的吸光度。可以看出,纳米药物对hela肿瘤细胞具有明显的毒性,在加入的共组装体中含有的抗癌药物姜黄素浓度达到50μg/ml后,细胞存活率仅为11.97%。
图6为通过建立hela宫颈癌裸鼠模型评价实施例1中纳米药物的体内抗癌效果。采用鼠龄4周左右的balb/c雌性裸鼠构建小鼠宫颈癌模型。hela细胞传代培养好后,将细胞浓度在1×106–1×107范围内的hela细胞重悬液按照100μl/只的量注射到小鼠左前肢腋下,每天称量小鼠的体重,并用游标卡尺测量肿瘤尺寸。在异源移植的肿瘤体积接近100mm3后,将小鼠分为4组,每组5只,其中,第一组为空白对照组,每3天注射一次100μl的多肽溶液;第二组为阳性对照组,每3天注射一次100μl游离药物溶液(溶液中姜黄素浓度按照2.5mg/kg(药物剂量/小鼠体积)的给药剂量计算,小鼠体重取平均值18g,下同);第三组为实验组,每3天注射一次100μl的纳米药物溶液。当肿瘤体积超过1000mm3后,牺牲实验中全部小鼠,取出小鼠体内的肿瘤,利用电子天平精确称量肿瘤的质量。
从图6a可以看出,三个给药组的小鼠体重均略有增长,生命状态良好。图6b表明,给药治疗14天后,各组肿瘤体积显示出明显差异,游离药物组的抗癌抑制率仅为36.14%(抗癌抑制率=(空白对照组肿瘤体积-实验组肿瘤体积)/空白对照组肿瘤体积*100%),而纳米药物组的抗癌抑制率为69.12%。在图6c与图6d中,可以明显看出纳米药物组肿瘤体积最小,质量最轻,表现出显著的抗肿瘤效果。
图7为给药结束后,将小鼠肿瘤切除,保存在浓度4%的多聚甲醛溶液中,随后采用石蜡进行包埋,固定处理一星期后,对由石蜡包埋的各组织进行切片(厚度为5μm)。按照h&e染色试剂盒与tunel试剂盒中的步骤对切片进行着色处理,采用倒置显微镜的明场通道进行观察,并分析实验结果。可以看出,纳米药物组中的肿瘤组织出现了明显细胞凋亡的现象,而其他两组的细胞凋亡现象并不明显,表明纳米药物在生物体内具有很好的抗癌疗效。
图8为给药结束后,同时收集小鼠的肝脏、脾脏和肾脏组织,保存在浓度4%的多聚甲醛溶液中,随后采用石蜡进行包埋,固定处理一星期后,对由石蜡包埋的各组织进行切片(厚度为5μm),按照h&e染色试剂盒的步骤对切片进行着色处理,采用倒置显微镜的明场通道进行观察,并分析实验结果。可以看出,游离药物组的肝、脾、肾组织切片中细胞密度相对较小,细胞核增大明显,表明游离药物对正常组织细胞造成了一定影响。而纳米药物组的肝、脾、肾组织切片形态并未有明显变化,这表明纳米药物可以有效减少抗癌药物对正常细胞的毒害作用,有助于减弱化疗药物对于机体的副作用。
最后应当说明的是:以上实施例仅用以说明本发明的技术方案而非对其限制,尽管参照上述实施例对本发明进行了详细的说明,所属领域的普通技术人员依然可以对本发明的具体实施方式进行修改或者等同替换,这些未脱离本发明精神和范围的任何修改或者等同替换,均在申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!