槲皮素在制备用于治疗慢性前列腺炎的药物中的应用的制作方法
本发明涉及槲皮素的一种新用途,即槲皮素在制备用于治疗慢性前列腺炎的药物中的应用。
背景技术:
前列腺炎是泌尿外科最常见的疾病之一,仅次于良性前列腺增生和前列腺癌,位居男性泌尿道常见病第三位。1995年美国国立卫生研究院(nih)将前列腺炎分为四类:i型,相当于传统分类方法中的急性细菌性前列腺炎;ⅱ型,相当于传统分类方法中的慢性细菌性前列腺炎;ⅲ型,慢性前列腺炎/慢性盆腔疼痛综合征;ⅳ型,无症状性前列腺炎。前列腺炎中,慢性前列腺炎/慢性盆腔疼痛综合症(cp/cpps)占其中的绝大多数。常规的治疗方法(比如抗菌剂、α-受体阻滞剂、消炎药、植物疗法、激素疗法和其他疗法甚至手术治疗),都很难获得理想的临床疗效。因此,寻找新的、有效的治疗cp/cpps的方法是泌尿外科医生和科研工作者的当务之急。
槲皮素是一种天然生物类黄酮化合物,广泛分布于红酒、洋葱、绿茶和各种水果和蔬菜中。
技术实现要素:
本发明的目的是提供槲皮素在制备用于治疗慢性前列腺炎的药物中的应用。
本发明提供了槲皮素的一种新用途,即槲皮素在制备用于治疗非细菌性前列腺炎的药物中的应用。
本发明还保护槲皮素在制备用于治疗慢性非细菌性前列腺炎的药物中的应用。
本发明还保护槲皮素在制备用于治疗慢性前列腺炎的药物中的应用。
本发明还保护槲皮素在制备用于治疗慢性前列腺炎/慢性盆腔疼痛综合征的药物中的应用。
本发明还保护一种用于治疗非细菌性前列腺炎的药物,其活性成分为槲皮素。
本发明还保护一种用于治疗慢性非细菌性前列腺炎的药物,其活性成分为槲皮素。
本发明还保护一种用于治疗慢性前列腺炎的药物,其活性成分为槲皮素。
本发明还保护一种用于治疗慢性前列腺炎/慢性盆腔疼痛综合征的药物,其活性成分为槲皮素。
本发明的发明人发现:在不影响体重的前提下,槲皮素能降低前列腺指数,减少前列腺间质内炎症细胞的浸润,说明槲皮素对慢性前列腺炎在组织学上有显著的抑制作用;槲皮素能显著降低前列腺炎组织中炎症细胞因子il-1β、il-2、il-6和tnf-α水平,说明槲皮素对慢性前列腺炎具有显著的抗炎作用;槲皮素能显著提高体内抗氧化酶(t-sod、cat、gsh-px)活性和减少氧化应激产物(mda)生成,说明本发明槲皮素对慢性前列腺炎具有显著的抗氧化作用。结果表明,槲皮素对慢性前列腺炎具有显著的治疗作用,本发明为开发临床用药奠定了基础。
附图说明
图1为体重和前列腺指数的结果。
图2为he染色的照片。
图3为炎症评分结果。
图4为前列腺组织内细胞因子il-1β、il-2、il-6和tnf-α水平。
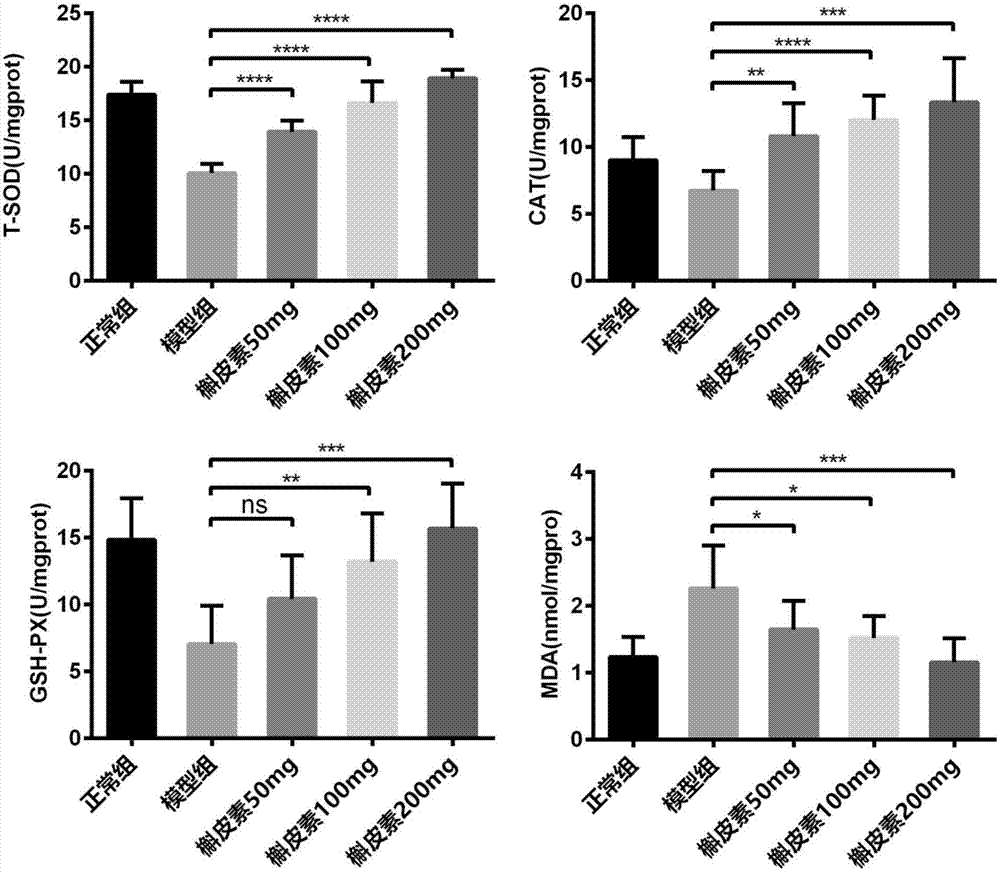
图5为前列腺组织内抗氧化酶活性和脂质过氧化物水平。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。羟丙基-β-环糊精:cas号为128446-35-5。槲皮素:cas号为cas:117-39-5。
实施例1、槲皮素对慢性前列腺炎的治疗效果
采用弗氏完全佐剂制备大鼠非细菌性前列腺炎模型。
一、制备槲皮素溶液
溶剂为羟丙基-β-环糊精溶液,制备方法为:将羟丙基-β-环糊精溶于双蒸水,使其浓度为25g/100ml。
分别制备1g/100ml槲皮素溶液、2g/100ml槲皮素溶液和4g/100ml槲皮素溶液。槲皮素溶液的制备方法:称取槲皮素,加入溶剂,用磁力搅拌器混匀30min,4℃保存,每次给药前先恢复至室温并充分混匀。
二、分组处理
6周龄雄性sd大鼠39只,体重240-260g,常规饲养1周后进行如下分组处理:
正常组(6只):不进行任何处理;
模型组(6只):试验第1天进行手术,试验第2天至第29天每天灌胃给予一次溶剂,单次体积同试验组;
槲皮素低剂量组(9只):试验第1天进行手术,试验第2天至第29天每天灌胃给予一次1g/100ml槲皮素溶液,单次剂量为50mg槲皮素/kg体重;
槲皮素中剂量组(9只):试验第1天进行手术,试验第2天至第29天每天灌胃给予一次2g/100ml槲皮素溶液,单次剂量为100mg槲皮素/kg体重;
槲皮素高剂量组(9只):试验第1天进行手术,试验第2天至第29天每天灌胃给予一次4g/100ml槲皮素溶液,单次剂量为200mg槲皮素/kg体重;
槲皮素低剂量组、槲皮素中剂量组和槲皮素高剂量组统称为试验组。
手术方法:以6%水合氯醛进行腹腔麻醉(0.5ml/kg),碘伏消毒腹部皮肤,下腹部正中纵行切口约1cm,打开腹腔,用棉签于膀胱下方找到前列腺并暴露良好,于前列腺腹叶注入弗氏完全佐剂0.1ml,生理盐水冲洗防止粘连,以可吸收线逐层缝合切口,碘伏消毒皮肤。
三、检测
试验第30天。各组sd大鼠称重后处死,取前列腺组织称湿重并计算前列腺指数,取前列腺组织进行he染色,另取前列腺组织检测细胞因子水平。
1、体重和前列腺指数
前列腺指数=前列腺湿重(mg)/大鼠体重(g)×10。前列腺指数反映炎症程度。
体重见图1a。各组大鼠体重无显著差异。
前列腺指数见图1b(*,p<0.05;**,p<0.01))。与正常组相比,模型组大鼠前列腺指数显著升高。与模型组相比,试验组大鼠前列腺指数呈不同程度下降,差异有显著统计学意义。
2、he染色
①前列腺组织制备石蜡切片。
②依次进行如下步骤:二甲苯20min→二甲苯→20min→无水乙醇10min→无水乙醇10min→95%酒精5min→90%酒精5min→80%酒精5min→70%酒精5min→蒸馏水洗。
③依次进行如下步骤(苏木素染细胞核):harris苏木素染3-8min→自来水洗→1%盐酸酒精分化数秒→自来水冲洗→0.6%氨水返蓝→流水冲洗。
④依次进行如下步骤(伊红染细胞质):伊红染液中染色1-3min。
⑤依次进行如下步骤(脱水封片):95%酒精5min→95%酒精5min→无水乙醇5min→无水乙醇5min→二甲苯5min→二甲苯5min→晾干→中性树胶封片。
⑥显微镜镜检,图像采集分析。
通过组织学评分进行评价,采用双盲的方法对每个腺体的几个切面进行评分,用总的评分除以切面数获得最终评分,用0-4分代表炎症程度:0分:无炎症;1分:轻度,但明确的血管周围单个核细胞套状聚集(浸润);2分:中度的血管周围单个核细胞浸润;3分:显著的血管周围单个核细胞浸润,出血,以及少量间质内单个核细胞浸润;4分:显著的血管周围单个核细胞浸润,出血,以及大量间质内单个核细胞浸润。
he染色的照片见图2(细胞核蓝色,细胞质红色)。正常组大鼠几乎没有炎症。模型组大鼠炎症表现最重。与模型组相比,试验组大鼠炎症细胞浸润数目依次下降。
炎症评分结果见图3(*,p<0.05)。与正常组相比,模型组大鼠炎症评分显著升高。与模型组相比,试验组大鼠炎症评分显著降低。
前列腺指数、he染色和炎症评分的结果表明,槲皮素对慢性前列腺炎有抑制作用。
3、检测前列腺组织内细胞因子il-1β、il-2、il-6和tnf-α水平。
(1)制作前列腺组织匀浆。
①取适量组织块,于预冷pbs缓冲液(0.01mol/l,ph7.0-7.4)中清洗去除血液,称重后备用(组织块较大先剪碎后再匀浆)。
②将组织块移入玻璃匀浆器,按照每20毫克组织加入150-250微升裂解液的比例加入ripa裂解液(取适当量的裂解液,在使用前数分钟内加入pmsf,使pmsf的最终浓度为1mm),进行充分研磨,该过程在冰上进行。
③将制备好的匀浆液于12000g离心30分钟,取上清液。
(2)采用试剂盒检测步骤(1)得到的上清液中细胞因子il-1β、il-2、il-6和tnf-α的水平。试剂盒:德国默克密理博公司,recytmag-65k。
结果见图4(*,p<0.05;**,p<0.01;***,p<0.001;****,p<0.0001)。与正常组相比,模型组大鼠il-1β、il-2、il-6和tnf-α水平较显著升高。与模型组相比,试验组大鼠il-1β、il-2、il-6和tnf-α水平呈不同程度下降,差异有显著统计学意义。
4、检测前列腺组织内抗氧化酶活性和脂质过氧化物水平
(1)制作前列腺组织匀浆。
同步骤3的(1)。
(2)采用试剂盒检测步骤(1)得到的上清液中总超氧化物歧化酶(t-sod)、过氧化氢酶(cat)、谷胱甘肽过氧化物酶(gsh-px)和丙二醛(mda)的水平。用于检测t-sod的试剂盒为南京建成生物工程研究所货号为a001-1的试剂盒。用于检测cat的试剂盒为南京建成生物工程研究所货号为a007-1的试剂盒。用于检测gsh-px的试剂盒为南京建成生物工程研究所货号为a005的试剂盒。用于检测mda的试剂盒为南京建成生物工程研究所货号为a003-1的试剂盒。
结果见图5(*代表p<0.05,**代表p<0.01,***代表p<0.001,****代表p<0.0001)。与正常组相比,模型组大鼠t-sod、cat和gsh-px显著降低。与模型组相比,试验组大鼠t-sod、cat和gsh-px活性呈不同程度升高,差异有显著统计学意义。与正常组相比,模型组大鼠mda水平明显升高。与模型组相比,试验组大鼠mda水平呈不同程度降低,差异有显著统计学意义。
- 还没有人留言评论。精彩留言会获得点赞!