一种用于宫颈癌前哨淋巴结的纳米胶束显像剂的制备与应用的制作方法
本发明涉及一种肿瘤靶向纳米药物的制备与应用,具体涉及用于宫颈癌前哨淋巴结的纳米胶束显像剂。
背景技术:
宫颈癌是世界范围内的第二常见的妇科肿瘤疾病。我国每年的新发病人数接近13.15万,因宫颈癌死亡的患者是3.3万人。转移是宫颈癌患者的主要死因。2017年指南推荐早期宫颈癌(ia期和ib期)主要依靠手术切除,广泛性子宫切除术加双侧盆腔淋巴结切除术(有或无前哨淋巴结显影)是ⅰa2、ⅰb、ⅱa期无生育要求患者首选的治疗方法。广泛性子宫切除术较单纯子宫切除术切除了更多宫旁组织,包括部分主韧带、子宫骶骨韧带和阴道上段以及盆腔淋巴结,必要时切除腹主动脉旁淋巴结。然而,大多数宫颈癌患者的术后病理证实的淋巴结转移率不超过13-27%,这意味着超过四分之三的患者不能受益于根治性盆腔淋巴结清扫术,这被认为是过度治疗。14-32%的患者淋巴结清扫后出现腿部淋巴水肿、神经损伤和形成淋巴囊肿。为了减少这种手术并发症的发生,前哨淋巴(sln)结显像的概念被逐渐引入和应用。妇科肿瘤学会(sgo)建议在早期宫颈癌的手术治疗中使用前哨淋巴结的显像。但是由于显像剂和技术的要求,前哨淋巴结显像在宫颈癌的应用还处于起步阶段。
传统的sln显像的临床方法包括亚甲蓝染色和放射性标记。但是,这些方法有一些缺点:注射胎盘蓝染料后,染料会长时间停留在注射点。此外,必须进行外科手术来暴露sln以便由具有临床经验的医师可视化检测;放射性材料检测sln总是伴随着患者低水平的辐射暴露;组织及其区域盆腔淋巴结受到辐射照射后,淋巴引流可能发生改变;对于sln放射性定位,需要一个特殊设施和安全宽敞的房间,但并不总是可用的;对于较大放射性材料(100-200nm)的淋巴结吸收通常需要很长的等待时间(例如24小时);胎盘蓝染料可能会对宫颈癌手术期间的术中脉搏血氧饱和度产生不良影响。由于这些原因,在临床上高分辨率的非侵入性探针是sln检测的首选。
最近,荧光探针由于其操作简单和生物相容性在显像引导的手术中被深入研究。特别是实时的近红外荧光(nirf)成像技术由于较高的深层组织穿透能力(高达1cm)和较低的组织自发荧光背景在淋巴管成像和sln的显像中具有很重要的临床应用价值。nir荧光染料,如吲哚菁绿(icg),经美国食品和药物管理局(fda)批准用于临床诊断,包括术中sln的显像。但是,icg的一些内在缺点包括其浓度依赖性的聚集导致荧光淬灭,体外水溶液稳定性性差等影响其体内显像效果。并且icg中缺乏反应性基团使得难以与其他药剂如靶向多肽进一步化学结合。
目前,为了解决这些问题,纳米材料被应用作为载体来加载icg,在临床前动物实验中取得较好的效果。近年来纳米材料的研究正成为医药学者研究的焦点,纳米载体作为控释系统所具有的特殊性质,使其在药物输送方面具有高效,稳定,特异性强等优点。因其粒径呈纳米态,可透过细胞膜和穿透血脑屏障等,能更好的向靶器官,靶细胞,靶分子输送药物,起到更好的治疗诊断效果。更重要的是除了epr效应的被动靶向,通过在纳米颗粒表面修饰肿瘤靶向肽还可以实现主动靶向。
尽管纳米医学的进步为sln的成像提供了一个有前途的策略,但是传统的靶向递送系统不能有效区分sln是否发生肿瘤转移。具有与癌细胞表面过表达的受体相互作用的配体的纳米载体可以主动靶向于肿瘤的原发灶,但是并不能有效靶向肿瘤的转移灶。这是因为肿瘤转移灶的异质性,原发肿瘤相关的生物标志物可能与转移灶不同。很少有研究在肿瘤转移灶的主动靶向中取得成功。因此大多数显像剂在肿瘤转移灶中聚集的很低,对肿瘤转移灶的诊断效果较差。在手术中,外科医生和患者都必须等待至少40分钟才能对切除的淋巴结进行病理学检查来判断是否发生肿瘤细胞侵犯来决定下一步清扫的范围。因此,一种理想的淋巴结显像剂应该首先能清晰的显像sln,并且可以在术中实时检测淋巴结中的肿瘤转移灶。因此,寻找一种特异性靶向肿瘤转移灶的纳米递送系统对于肿瘤转移的sln成像是非常必须的。
tmtp1是申请人所在的课题组利用细菌鞭毛肽库对具有不同转移潜能的前列腺癌细胞进行正负筛选,获得的重复性序列nvvrq。体内外实验验证tmtp1能够靶向高转移前列腺癌肿瘤、高转移潜能的乳腺癌原发灶及微转移灶。此外,tmtp1多肽对前列腺癌的自发肝转移灶即使直径仅有1mm亦有很好的识别能力。通过与各种凋亡肽和白喉毒素结合制备的多种结合肽和融合蛋白,对转移肿瘤具备显著地靶向杀伤作用,与放射性元素锝标记的spect显像剂,能特异性的对高转移肿瘤微转移灶显像。这些实验结果表明,tmtp1是一种靶向性良好的肿瘤导向肽,有望应用于恶性肿瘤及其转移灶的早期诊断及治疗。课题组进一步采用pulldown等技术显示xpnpep2可能即为tmtp1的受体。前期实验检测xpnpep2在宫颈癌、乳腺癌的转移灶和淋巴转移灶中高表达。xpnpep2通过emt促进宫颈癌的侵袭转移,并且xpnpep2的表达和宫颈癌的分级分期成正相关,xpnpep2可以作为宫颈癌一个潜在的转移的标志分子。这些前期基础为tmtp1主动靶向于宫颈癌转移的sln提供了可能。
纳米药物制造工艺,批量生产和生物安全性等问题目前阻碍纳米靶向药物的临床转化。peg-plga共聚物胶束颗粒具有优异的生物降解性和生物相容性,大小在5nm~100nm之间,更易被细胞摄取,尤其容易聚集在原发灶周围的转移淋巴结,并且peg和plga已经被fda批准。近年来,此类高分子纳米抗癌药物也已进入临床或不同临床试验阶段。基于聚乙二醇-聚乳酸共聚物(peg-pla)的载有紫杉醇(ptx)的胶束药物(genexol-pm)自2007年已在韩国用于临床治疗乳腺癌、肺癌和卵巢癌等。基于peg和聚多肽的多种抗癌纳米药物(如nk911,nk105等)已分别进入了临床i~iii期的试验阶段。本发明采用peg-plga共聚物一步法尽量简化制备过程,有助于克服纳米颗粒制作工艺的困难,为以后的临床转化提高条件。
本发明的目的,在于提供一种能够术中实时特异性识别诊断宫颈癌转移的前哨淋巴结的靶向纳米荧光显像剂,从而克服现有淋巴结显像剂特异性不强,操作不便,不能实时观察等问题,以期在临床治疗中发挥高效、特异的诊断作用。
技术实现要素:
本发明所要解决的技术问题是发明一种肿瘤靶向肽tmtp1(nvvrqc)表面修饰的包裹近红外荧光染料icg的peg-plga的胶束颗粒。通过该方案获得的靶向荧光纳米显像剂能够高效靶向于宫颈癌的原发灶和转移灶,尤其是肿瘤转移的前哨淋巴结,并且在生物体内具有安全性,从而达到在术中实时识别发生肿瘤细胞转移的前哨淋巴结,可以解决目前肿瘤淋巴结显像技术和实践中关键的不足之处。
本发明解决上述问题的技术方案如下:
一种用于淋巴结的近红外荧光纳米显像剂,
包括聚乙二醇-聚乳酸羟基乙酸共聚物形成的纳米胶束颗粒,所述胶束内部分散有近红外荧光染料,其中胶束表面用肿瘤靶向肽修饰。
所述近红外荧光染料选自菁染料类、罗丹明类、方酸类、卟啉类中的一种或多种,优选吲哚箐绿。
所述肿瘤靶向肽为环状多肽(nvvrqc)。
所述胶束表面用肿瘤靶向肽修饰是通过胶束的表面亲水基团peg端相连的马来酰胺和首尾酰胺键成环的环状多肽(nvvrqc)巯基连接。
所述聚乙二醇-聚乳酸羟基乙酸共聚物部分或全部被马来酰胺修饰,优选20%-100%重量百分比的聚乙二醇-聚乳酸羟基乙酸共聚物被马来酰胺修饰,更优选40%、45%、50%、55%、60%、70%、75%、80%、85%、90%、100%重量百分比的聚乙二醇-聚乳酸羟基乙酸共聚物被马来酰胺修饰。
所述聚乙二醇-聚乳酸羟基乙酸共聚物全部被马来酰胺修饰,其中多肽tmtp1和ma-peg-plga的质量比为由1:(2-40),优选1:10,1:15,1:20,1:25,1:30。
所述聚乙二醇-聚乳酸羟基乙酸共聚物部分被马来酰胺修饰,其中该共聚物包括ma-peg-plga和mpeg-plga,其中多肽tmtp1、ma-peg-plga和peg-plga的质量比为1:(10-50):(1-20),优选1:15:5。
所述peg(聚乙二醇)选自聚乙二醇二胺(nh2-peg-nh2)或者羟基聚乙二醇,优选聚乙二醇二胺;
所述peg分子量选自1kda-20kda,优选2kda、3kda、4kda和10kda,最优选3kda;
所述聚乳酸羟基乙酸共聚物中丙交酯和乙交酯的比例为(20-80):(20-80),丙交酯和乙交酯的比例优选80:20、75:25、50:50、25:75,更优选50:50;
所述纳米胶束的粒径为50-300nm,优选100nm。
本发明所述的纳米胶束显像剂在水溶液20天以上的荧光强度大于0.6,优选在水溶液20天以上的荧光强度大于0.7,在水溶液20天以上的荧光强度大于0.8。
本发明还提供一种注射剂,其包含上述纳米胶束显像剂和注射用水。
本发明用于宫颈癌前哨淋巴结的纳米胶束显像剂优选包括聚乙二醇-聚乳酸羟基乙酸共聚物(peg-plga)作为载体聚合形成胶束颗粒,内部包裹吲哚箐绿,环状tmtp1靶向肽修饰与胶束的表面,其中胶束的表面亲水基团peg端相连的马来酰胺和首尾酰胺键成环的tmtp1巯基连接。
本发明的有益效果:
本发明所述的淋巴结荧光纳米显像剂是peg-plga聚合形成的胶束颗粒,核心疏水区域包载icg,在不改变icg基本的近红外荧光性质的提前下,提高了其在水溶液中的稳定性,降低荧光的淬灭。
本发明所述的淋巴结显像剂的纳米药物大小是100nm,分散度较高,适合在淋巴结中聚集;并且纳米药物带负电荷,适合体内静脉注射,在血液中可以保持胶体稳定性。
本发明所述的淋巴结显像剂的纳米药物的合成是纳米沉淀一步法,工艺简单,易于控制条件,为以后大批量的临床转化提供前提。
本发明所述的淋巴结显像剂的纳米药物在脚垫淋巴结转移模型中能快速的从注射部位随淋巴管流到淋巴结,在前哨淋巴结中停留较长时间,易于和次级淋巴结区分。
本发明所述的淋巴结显像剂的纳米药物不仅能对sln显像,还能实时区分sln是否发生肿瘤转移,为以后术中指导手术切除范围提高实时的显像引导,这也是本发明的新颖性。
动物体内分布显像显示,该诊断剂主要通过肝脏代谢,少量通过泌尿系统,其他正常器官摄取很少。
本发明所述的淋巴结显像剂的纳米药物合成所需的peg,plga和icg都已被fda批准,并且对此药物进行生物毒性试验检测,此药物具有生物安全性。在上述技术方案的基础上,本发明还提供一种制备方法:包括以下步骤:合成环状多肽cyclic(nvvrqc),制备马来酰胺修饰的聚乙二醇-聚乳酸羟基乙酸共聚物(ma-peg-plga),合成环状多肽修饰的peg-plga共聚物,将制备得到的多肽修饰peg-plga共聚物和游离吲哚箐绿混匀制得纳米胶束显像剂。
其中制备ma-peg-plga的方法,包括以下步骤:称取ma(马来酰亚胺丁酸)、edc和nhs,并溶于dcm(二氯甲烷)混匀,反应5h,得到混合溶液i;称取聚乙二醇和三乙胺加入到混合溶液i,反应48h,得到ma端基的peg溶液;将plga(50/5020000)用edc和nhs在dcm里活化5h,得到plga的活化物,加入到上述peg溶液中,反应48h,得到混合溶液ii;用5:1的乙醚:甲醇混合溶液沉淀得到混合溶液ii,洗两遍,用真空干燥箱抽12h,生成ma-peg-plga聚合物。
其中选用的聚乙二醇分别是聚乙二醇二胺(nh2-peg-nh2)和羟基聚乙二醇(oh-peg-oh),nh2-peg-nh2和plga的反应效率明显高于oh-peg-oh。
其中选用的nh2-peg-nh2分子量有2kda、3kda、4kda和10kda,制备出的纳米粒在nh2-peg-nh2分子量在3kda时粒径大小是100nm左右,稳定性最好,优选分子量为3kda的nh2-peg-nh2.
其中选用的plga的丙交酯和乙交酯的比例在50:50时合成的纳米粒的粒径大小和稳定性优于75:25.
本发明还可以做如下改进:
进一步,本发明所述的多肽tmtp1和纳米材料ma-peg-plga的质量比由1:20调整为多肽tmtp1:ma-peg(3000)-plga(50/5020000)聚合物:mpeg5000-plga50/5020000共聚物为1:15:5。
采取上述进一步方案的有益效果为:优化纳米药物表面修饰的靶向多肽的比例,增强纳米药物的体内靶向性及发光强度。
进一步,本发明所述的纳米制备中沉降纳米颗粒的三蒸水的ph值由7调整为8。
采取上述进一步方案的有益效果为:提高peg-plga包载吲哚箐绿的水环境的ph值,提高吲哚箐绿的包封率。
附图说明
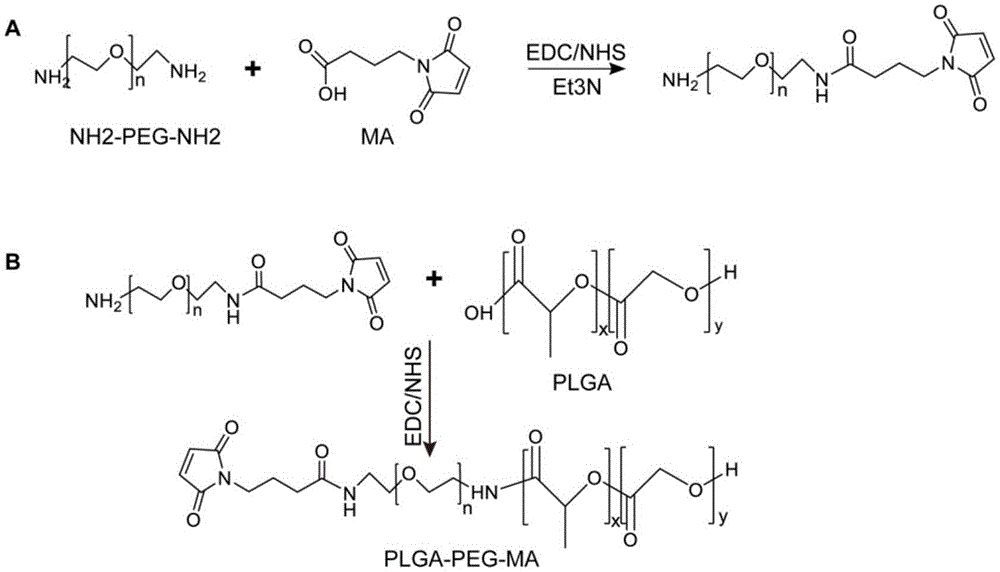
图1.合成ma-peg-plga共聚物的化学反应式。
图2.制备纳米胶束颗粒tmtp1-np/icg的化学反应式和结构图。
a.tmtp1多肽修饰的peg-plga共聚物的化学反应式。b.tmtp1-np/icg胶束颗粒的结构示意图。
图3.不同分子量大小peg合成纳米粒tmtp1-np/icg的理化性质。动态光散射仪测定不同分子量peg制备的胶束颗粒的大小分布,电荷,分散率以及药物包封率。
图4.优选peg大小为3kda的纳米粒的理化性质。a.电镜下胶束颗粒的大小和形态。大小约为100nm左右,呈圆形,形态基本一致。
b.紫外分光光度测定胶束颗粒的紫外吸收光谱。c.tmtp1-np/icg在水溶液中的稳定性。
图5.改进多肽和纳米材料配比后合成胶束动物体内对肿瘤靶向性的改变以及最优靶向性胶束的电镜形态和粒径大小分布。
图6.tmtp1-np/icg对肿瘤转移前哨淋巴结的显像。a.tmtp1-np/icg和np/icg在不同时间点对宫颈癌脚垫前哨淋巴结近红外显像,以及在30min和1h时解剖的前哨淋巴结和引流淋巴结的荧光强度。tmtp1-np/icg在任何时间点的前哨淋巴结的荧光光强度强于对照,并且在前哨淋巴结中停留较长时间,易于和引流淋巴结区分。b.在30min和1h时tmtp1-np/icg和np/icg对前哨淋巴结的显像荧光强度的统计。和体内结果一致。图c.在30min和1h时tmtp1-np/icg和np/icg对引流淋巴结的显像荧光强度的统计。和体内结果一致。图d.统计tmtp1-np/icg和np/icg在30min和1h对前哨淋巴结显像的荧光和对引流淋巴结的荧光的比值。图e.tmtp1-np/icg和np/icg在不同时间点对前哨淋巴结近红外显像的荧光统计。图f.荧光显微镜下前哨淋巴结冰冻切片的icg的荧光和xpnpep2的表达。
图7.tmtp1-np/icg在肿瘤转移模型中对肿瘤侵袭淋巴结和正常淋巴结显像的比较。a.双侧淋巴结近红外荧光成像示意图(右为肿瘤转移淋巴结t-sln,左为正常淋巴结n-sln)。b.tmtp1-np/icg和np/icg在不同时间点对t-sln和n-sln的近红外成像。c.t-sln和n-sln在不同时间点的荧光信号比率的定量分析。d.离体nir荧光图像和定量分析注射后2小时的t-sln和n-sln的荧光信号。
图8.tmtp1-np/icg胶束的体内毒性实验。a.正常裸鼠尾静脉注射tmtp1-np/icg和np/icg胶束后在不同时间点近红外成像。b.在用tmtp1-np/icg和np/icg胶束注射48小时后解剖主要器官体外近红外成像。c.统计分析裸鼠器官的荧光强度。d.在尾静脉注射tmtp1-np/icg和np/icg后28天,解剖裸鼠的心,肝,脾,肺和肾,并做组织病理学检查。
具体实施方式
以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
实施例1制备靶向肽修饰的荧光纳米显像剂
1.合成多肽tmtp1
使用多肽固相合成技术合成环状多肽c(nvvrqc)首尾酰胺键成环,该合成过程由武汉百意欣生物技术有限公司完成,合成的环状多肽c(nvvrqc)多肽纯度为98%,通过rp-hplc和ms技术检测,其分子量为699.2,质量为20mg。
2.荧光纳米显像剂的制备
(1)合成ma-peg-plga共聚物:先将ma(马来酰亚胺丁酸)用edc和nhs在dcm(二氯甲烷)里活化5h,再加入不同分子量大小的聚乙二醇二胺(2kda、3kda、4kda和10kda)和三乙胺反应48h,得到ma端基的peg溶液;将plga(50/5020000)用edc和nhs在dcm里活化5h,得到plga的活化物,分别加入到上述peg溶液中,反应48h;用5:1的乙醚:甲醇混合溶液沉淀产物,洗两遍,用真空干燥箱抽12h。
通过以上实验步骤得到ma-peg-plga共聚物,化学反应式如图1。
(2)合成tmtp1多肽表面修饰的icg胶束颗粒:将1mg环状tmtp1多肽和上述20mgma-peg-plga(质量比1:20)溶于1mldmf溶液中,避光室温摇床24h后得到plga-peg-tmtp1产物。200ug游离icg加入上述溶液中混匀后逐滴加入持续搅拌的15ml的三蒸水中,搅拌30min后高速离心,12000rpm/min,30min得到沉淀,15ml三蒸水重悬沉淀后再次高速离心30min后得到沉淀,用1ml的三蒸水重悬上述沉淀得到纳米溶液,呈绿色胶状。同样方法合成表面不连多肽的peg-plga胶束颗粒命名为np/icg。
通过以上步骤得到tmtp1-np/icg胶束颗粒,表面修饰tmtp1多肽,peg-plga聚合成胶束,包裹icg,化学反应式和纳米结构图如图1。
3.测定纳米粒的理化性质,优选出制备纳米粒的合适分子量大小的peg。
(1)通过动态光散射(dsl)测定负载icg的胶束平均直径,电势和粒径分布。比较不同分子量大小的peg合成的纳米粒的粒径大小,优选出大小最合适的纳米粒,如图3。
(2)测定胶束的icg包封率:首先,通过超速离心(15,000r/min,30min)从三蒸水溶液中沉淀出纳米颗粒。然后,收集上清液中的游离icg,并通过uv/vis分光计测量在λmax为784nm下的吸光光度值。根据下式计算icg的包封率(ee):ee(%)=(icg总投药-icg上清中)/icg总投药×100%,如图3。
(3)用阴性染色法通过电子显微镜(tem)观察负载icg的胶束的形态。使用紫外分光光度计测定胶束的紫外吸收光谱。
(4)在水溶液中icg荧光的稳定性:用三蒸水稀释胶束颗粒的icg浓度为10ug/ml,避光保存放于4℃冰箱中,每隔两天通过荧光分光光度仪测定其荧光强度,持续20天。对照组是游离的icg和表面没有修饰tmtp1多肽的icg胶束颗粒。
实验结果:在peg大小在3kda时纳米粒在电镜下成圆形,颗粒大小为100nm左右,负电荷-13.25mv,包封率在50%左右。紫外吸收光谱发生右移20nm。tmtp1-np/icg在水溶液中保持光谱性质的稳定长达20天。如图4。
实施例2调整胶束制备的材料和靶向肽的比例,改善纳米粒的理化性质和靶向性。
(1)按照实施例1的2(2)中制备纳米粒的方法“1mg环状tmtp1多肽和上述20mgma-peg-plga(质量比1:20)溶于1mldmf溶液中”,我们将1mg环状tmtp1多肽和上述20mgma-peg-plga(质量比1:20)调整为以下配比:
a.10mgma-peg-plga+10mgpeg(5000)-plga(50/5020000)+1mgtmtp1;
b.10mgma-peg-plga+10mgplga(50/5020000)+1mgtmtp1;
c.15mgma-peg-plga+5mgplga(50/5020000)+1mgtmtp1;
d.15mgma-peg-plga+5mgpeg(5000)-plga(50/5020000)+1mgtmtp1.其中ma-peg-plga为实施例1的2(1)方法合成的共聚物,peg(5000)-plga(50/5020000)即为单甲氧基聚乙二醇聚乳酸乙醇酸共聚物,购买于济南岱罡生物工程有限公司。plga(50/5020000)是50:50的聚乳酸-羟基乙酸共聚物,购买于济南岱罡生物工程有限公司。
制备出的纳米粒按照上述方法检测纳米粒粒径大小和包封率以及多肽连接效率。
(2)3-4周的balb/c-nude裸鼠购买于北京华阜康生物科技股份有限公司,分别在每只balb/c-nude裸鼠右侧臀部皮下处接种5×106个hela-luc细胞,约接种20天后裸鼠皮下瘤长到200mm3。将上述纳米粒尾静脉注射,icg的浓度按照裸鼠体重1.0mg/kg计算,24h后小动物成像仪下在激发波长795nm,发射波长835nm下显像,评估并比较它们对裸鼠皮下瘤的显像情况。
表1处方筛选比较结果
结果显示:根据icg包封率、tmtp1连接率、粒径大小以及动物体内靶向性综合评价15mgma-peg-plga+5mgpeg-plga+1mgtmtp1配比能有效改善在动物体内的靶向性。如图5。
实施例3脚垫淋巴结转移模型的建立和近红外荧光显像
1准备肿瘤细胞
细胞宫颈癌细胞系hela用含有10%血清的dmem培养基培养,(37℃,5%co2培养箱培养),通过lentivirus系统构建荧光素酶基因luc表达载体,稳定转染hela,嘌呤霉素药筛3天后得到稳定转染luc的hela-luc细胞。在培养瓶中扩增hela-luc细胞,待细胞生长至80%时用0.25%的胰酶消化,用完全培养基终止消化后将细胞收集到15ml离心管中,800rpm离心5分钟,弃去上清后细胞用pbs重悬,再次离心后,弃上清,pbs重悬,细胞计数计算细胞密度。
2肿瘤模型的建立
裸鼠脚垫淋巴结转移模型的建立:3-4周的balb/c-nude裸鼠1×107个hela-luc细胞右侧脚垫注射,2周后腹腔注射生物发光底物d-luciferin后在小动物成像仪下观察裸鼠脚垫淋巴结转移情况。
3荧光纳米显像剂在动物模型中近红外荧光成像
(1)裸鼠脚垫淋巴结转移模型中荧光纳米显像剂对肿瘤转移淋巴结的显像:待生物发光检测裸鼠发生膝后窝淋巴结转移后,1%戊巴比妥腹腔麻醉裸鼠后,tmtp1-np/icg纳米胶束注射裸鼠右侧脚垫,在5min,30min,1h,12h和24h时间点小动物成像仪下显像,在30min和1h时分别解剖5只裸鼠前哨淋巴结和引流淋巴结,体外小动物成像,比较小鼠前哨淋巴结的发光时间和荧光强度,引流淋巴结发光情况,分析tmtp1-np/icg在小鼠前哨淋巴结停留的时间以及和引流淋巴结区分的情况。24h后解剖裸鼠膝后窝淋巴结。对照组是裸鼠脚垫淋巴结转移模型右侧脚垫注射np/icg。每组裸鼠为15只。重复至少三次实验。评估并比较荧光纳米显像剂对宫颈癌转移淋巴结显像。
结果显示如图6,和对照组相比tmtp1-np/icg纳米胶束对肿瘤转移的sln特异性显像,荧光强度较强,持续时间较久,在注射30min时,tmtp1-np/icg在sln的荧光强度是对照组的4.32倍,并且tmtp1-np/icg胶束在转移的sln中停留较长时间,在注射tmtp1-np/icg纳米胶束后1小时内,可以清晰区分sln和次级引流ln。
(2)在裸鼠脚垫淋巴结转移模型中tmtp1-np/icg纳米胶束对转移淋巴结和正常淋巴结的显像比较:待生物发光检测裸鼠发生右侧膝后窝淋巴结转移后,1%戊巴比妥腹腔麻醉裸鼠后,tmtp1-np/icg纳米胶束同时分别注射裸鼠两侧脚垫,在5min,30min,1h,12h和24h时间点小动物成像下显像,比较tmtp1-np/icg纳米胶束对肿瘤转移淋巴结和正常淋巴结的显像。在1h时间点取三只裸鼠解剖左右侧膝后窝淋巴结,体外小动物成像,比较淋巴结荧光强度。对照组是裸鼠脚垫淋巴结转移模型右侧脚垫注射np/icg。每组裸鼠为15只。重复至少三次实验。
结果显示如图7,tmtp1-np/icg纳米胶束对肿瘤转移淋巴结的显像荧光强度是正常的2倍多,在5min,1h和3h时达到4.67倍,4.13倍和3.34倍。而对照组np/icg对肿瘤转移淋巴结和正常淋巴结的显像只在5min时有微弱的差别,随后就无明显差异。结果证明tmtp1-np/icg纳米胶束能靶向于肿瘤转移淋巴结,有效区分正常淋巴结。
实施例4tmtp1-np/icg纳米胶束在正常裸鼠体内分布和毒性试验
3-4周的balb/c-nude裸鼠,尾静脉注射tmtp1-np/icg胶束显像剂量的10倍,1%戊巴比妥腹腔麻醉裸鼠,对照组是对照纳米药物np/icg和正常未处理裸鼠,在1h,2h,24h和48h的时间点小动物成像仪下显像,并观察:2天内实验组和对照组小鼠无死亡。2天时取其中5只裸鼠解剖主要器官(心、肝、脾、肺、肾和小肠)体外小动物成像检测各器官的代谢情况。余下裸鼠继续饲养,每隔两天测量体重,观察小鼠饮食、呼吸、活动、反射、排便、痛觉、皮肤均正常。第28天时处死裸鼠解剖主要器官(心、肝、脾、肺和肾),石蜡包埋后he染色显微镜下观察各器官是否有变化。对照组分别是裸鼠尾静脉注射pbs和np/icg。每组裸鼠为15只。重复至少三次实验。
实验结果显示如图8,tmtp1-np/icg纳米胶束在正常裸鼠体内主要通过肝肾代谢,对裸鼠的心肝脾肺肾主要器官无损伤,不影响老鼠的体重,这些结果表明荧光纳米显像剂具有生物安全性。
实施例5组织免疫荧光分析其肿瘤组织中xpnpep2表达情况。
将荷瘤小鼠淋巴结oct包埋冰冻切片,组织免疫荧光步骤如下:
(1)pbs洗涤5min,3次,用4%多聚甲醛固定10min;
(2)pbs洗涤5min,3次;
(3)用含5%bsa+1%0triton-100的pbs孵育切片,在37℃孵育30min;
(4)按相应稀释比用1%bsa稀释一抗xpnpep21:50孵育切片,4℃过夜;
(5)次日室温复温30min,pbs洗涤5min,3次;
(6)按相应稀释比用1%bsa稀释红色荧光二抗1:100,二抗封闭,避光下37℃孵育1h;
(7)pbs洗涤5min,3次;
(8)pbs稀释hoechst1:1000,染核10min;
(9)pbs洗涤5min,3次,用防荧光灭火剂封片在荧光显微镜下照相。
结果显示,与对照组相比,tmtp1-np/icg纳米胶束在肿瘤组织和转移淋巴结的绿色荧光定位和xpnpep的红光基本一致,并且tmtp1-np/icg纳米胶束在肿瘤组织的荧光明显强于对照组icg/np。结果说明xpnpep2介导tmtp1-np/icg纳米胶束靶向于宫颈癌皮下瘤和肺转移灶。如图5和图6。
实施例6安全性检测
(1)细菌内毒素检测:取本品适量,以细菌内毒素检查用水稀释至少30倍后,依法检查(中国药典2010年版二部附录ⅺe),本品每1ml含内毒素的量应小于15eu。
(2)无菌检测:取本品,依法检查(中国药典2010年版二部附录ⅺh),应符合规定。
药品安全性检测实验结果:为了监控药品合成过程中的安全性,在不连续的3天按照实施例1所述的方法合成三批药品进行自检。1)三批药品的内毒素含量均小于15eu/ml。2)三批药品均未检测到细菌。以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>武汉凯德维斯生物技术有限公司
<120>一种用于宫颈癌前哨淋巴结的纳米胶束显像剂的制备与应用
<130>1
<160>1
<170>siposequencelisting1.0
<210>1
<211>6
<212>prt
<213>人工序列()
<400>1
asnvalvalargglncys
15
- 还没有人留言评论。精彩留言会获得点赞!