龙眼叶抗氧化有效部位及其制备方法与应用与流程
本发明涉及植物有效部位的分离及应用技术领域,具体涉及龙眼叶抗氧化有效部位及其制备方法与应用。
背景技术:
人体在正常代谢的情况下会产生活性氧,活性氧自由基超出一定范围会对机体造成损伤,其中影响较大的有超阴离子自由基o2-·、羟自由基·oh、氮氧自由基等。2型糖尿病患者由于体内胰岛素相对匮乏,血糖升高,而长期的高血糖则会导致活性氧增加,直接氧化损伤dna、脂质,还会诱发炎症,加重糖尿病及并发症的进程。目前发现许多疾病的发生发展都与自由基有关,临床上已把清除或者抑制自由基当成了一种辅助治疗手段。
龙眼叶,是一味具有广西民族特色的中药材,最早记载于《滇南本草图说》。为著名的亚热带水果--龙眼(dimocarpuslonganlour.)树的叶子或嫩芽。其性味甘、淡、平,具有发表清热、利湿解毒等主要功效。主要用于治疗感冒发热、疟疾、疔疮、湿疹等。龙眼原产于我国南部和越南北部的南亚热带区域,在我国已有2000多年栽培历史。我国龙眼栽培面积和产量均居世界首位。我国南方龙眼叶资源蕴藏量丰富,每年龙眼被摘之后,果农对树木进行截枝,大量的树叶被抛弃或燃烧,造成资源浪费和环境污染。龙眼叶主要含有鞣质、酚酸类、黄酮类及挥发油等成分。现代研究还发现,龙眼叶对降血糖、抑制α-葡萄糖苷酶活性有一定的作用。本发明筛选出龙眼叶抗氧化活性较强的部位,目前,尚未见相关报道。
以上背景技术内容的公开仅用于辅助理解本发明的发明构思及技术方案,其并不必然属于本专利申请的现有技术,在没有明确的证据表明上述内容在本专利申请的申请日已经公开的情况下,上述背景技术不应当用于评价本申请的新颖性和创造性。
技术实现要素:
本发明的目的在于提供一种从龙眼叶中提取的具有抗氧化作用的有效部位及其制备方法与应用。
为实现上述目的,本发明所采用的技术方案如下:
一种龙眼叶抗氧化有效部位,该有效部位为龙眼叶药材经粉碎后用乙醇加热回流提取,提取液减压回收乙醇后得浸膏,加水将浸膏混悬,依次用石油醚、乙酸乙酯萃取得到的乙酸乙酯部位。
进一步的,以上所述加热回流用乙醇浓度为50%乙醇至无水乙醇。
一种以上所述的龙眼叶抗氧化有效部位的制备方法,包括以下步骤:
s1.取干燥龙眼叶药材,粉碎后用乙醇加热回流提取,提取液回收乙醇后得浸膏;
s2.将浸膏加水混悬,依次用石油醚、乙酸乙酯萃取;
s3.将所得乙酸乙酯萃取液回收溶剂,挥干,得到乙酸乙酯部位。
进一步的,以上所述的龙眼叶抗氧化有效部位的制备方法,所述步骤s1项下“用乙醇加热回流提取”,其乙醇浓度为50%乙醇至无水乙醇。
进一步的,以上所述的龙眼叶抗氧化有效部位的制备方法,所述步骤s1项下“用乙醇加热回流提取”,其乙醇用量为5-8倍量。
进一步的,以上所述的龙眼叶抗氧化有效部位的制备方法,所述步骤s1项下“用乙醇加热回流提取”为依次用95%乙醇、50%乙醇加热回流提取。
进一步的,以上所述的龙眼叶抗氧化有效部位的制备方法,所述步骤s1项下“用乙醇加热回流提取”,其提取次数为2-3次。
进一步的,以上所述的龙眼叶抗氧化有效部位的制备方法,所述步骤s1项下“用乙醇加热回流提取”,其提取时间为每次1-2小时。
进一步的,以上所述的龙眼叶抗氧化有效部位的制备方法,所述步骤s2项下“依次用石油醚、乙酸乙酯萃取”,其各萃取步骤萃取至萃取液澄清透明。
以上所述的龙眼叶抗氧化部位的应用为用于制备清除或者抑制自由基的食品、保健食品、药物或化妆品方面的应用。
本发明的有益效果在于:
1、本发明所用的原材料为龙眼的叶或嫩芽,现有技术中大量的龙眼叶被废弃或燃烧,造成资源浪费和环境污染,本发明变废为宝,原材料来源丰富,价格低廉。
2、本发明通过现代化提取分离方法,结合大量药理实验筛选,优选得到具有很好清除超阴离子自由基o2-·、羟自由基·oh,并能有效抑制小鼠红细胞氧化溶血、小鼠肝微粒体脂质过氧化进程的龙眼叶有效部位,该有效部位活性强,药效好,质量安全可控。
3、本发明提供的具有抗氧化作用的龙眼叶有效部位可制备成食品、保健食品、药物或化妆品,能满足人们生活的多种需求和方便临床应用。同时本发明提供的龙眼叶有效部位的制备方法,操作简单易行,提取的有效部位收率高,可操作性强,适合工业化大生产。
附图说明
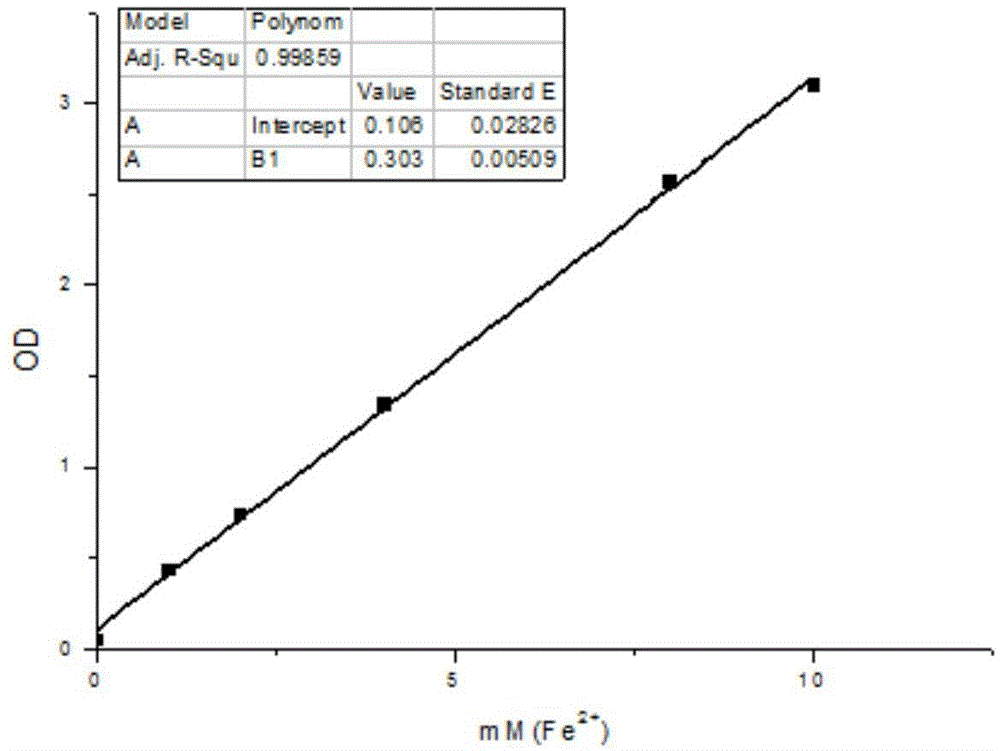
图1为feso4·7h2o标准曲线图;
图2为龙眼叶不同浓度不同极性部位总抗氧化能力图。
具体实施方式
下面结合具体实施例对本发明作进一步描述,但不限制本发明的保护范围和应用范围:一、龙眼叶抗氧化有效部位的制备
实施例1
龙眼叶抗氧化有效部位的制备方法,包括以下步骤:
s1.取干燥龙眼叶药材5kg,粉碎后依次用6倍量95%乙醇和50%乙醇各加热回流提取1次,每次2h,合并提取液,减压回收乙醇后得乙醇浸膏;
s2.取乙醇浸膏加水混悬,依次用石油醚(60-90℃)、乙酸乙酯、正丁醇各萃取至萃取液澄清透明;
s3.分别取各部位萃取液减压回收溶剂,挥干,得到龙眼叶石油醚部位浸膏、龙眼叶乙酸乙酯部位(efd,ethylfractionoftheleavesofdimocarpuslonganlour.)粉末、龙眼叶正丁醇部位粉末、龙眼叶水部位浸膏。
实施例2
龙眼叶抗氧化有效部位的制备方法,包括以下步骤:
s1.取干燥龙眼叶药材5kg,粉碎后依次用6倍量95%乙醇和50%乙醇加热回流提取2次,每次2h,合并提取液;
s2.提取液减压回收乙醇后得总提取部位。
实施例3
龙眼叶抗氧化有效部位的制备方法,包括以下步骤:
s1.取干燥龙眼叶药材5kg,粉碎后用6倍量纯化水加热回流提取2h,得提取液;
s2.取提取液浓缩得水煎液提取物;
实施例4
龙眼叶抗氧化有效部位的制备方法,包括以下步骤:
s1.取干燥龙眼叶药材5kg,粉碎后用8倍量40%乙醇加热回流提取2次,每次3h,合并提取液,减压回收乙醇后得乙醇浸膏;
s2.取乙醇浸膏加水混悬,依次用石油醚(60-90℃)、乙酸乙酯各萃取至萃取液澄清透明;
s3.取乙酸乙酯部位萃取液减压回收溶剂,挥干,得到龙眼叶乙酸乙酯部位。
实施例5
龙眼叶抗氧化有效部位的制备方法,包括以下步骤:
s1.取干燥龙眼叶药材5kg,粉碎后用8倍量50%乙醇加热回流提取2次,每次2h,合并提取液,减压回收乙醇后得乙醇浸膏;
s2.取乙醇浸膏加水混悬,依次用石油醚(30-60℃)、乙酸乙酯各萃取至萃取液澄清透明;
s3.取乙酸乙酯部位萃取液减压回收溶剂,挥干,得到龙眼叶乙酸乙酯部位。
实施例6
龙眼叶抗氧化有效部位的制备方法,包括以下步骤:
s1.取干燥龙眼叶药材5kg,粉碎后用6倍量75%乙醇加热回流提取2次,每次2h,合并提取液,减压回收乙醇后得乙醇浸膏;
s2.取乙醇浸膏加水混悬,依次用石油醚(90-120℃)、乙酸乙酯各萃取至萃取液澄清透明;
s3.取乙酸乙酯部位萃取液减压回收溶剂,挥干,得到龙眼叶乙酸乙酯部位。
实施例7
龙眼叶抗氧化有效部位的制备方法,包括以下步骤:
s1.取干燥龙眼叶药材5kg,粉碎后用5倍量无水乙醇加热回流提取3次,每次1h,合并提取液,减压回收乙醇后得乙醇浸膏;
s2.取乙醇浸膏加水混悬,依次用石油醚(60-90℃)、乙酸乙酯各萃取至萃取液澄清透明;
s3.取乙酸乙酯部位萃取液减压回收溶剂,挥干,得到龙眼叶乙酸乙酯部位。
二、龙眼叶抗氧化活性部位的筛选研究实验
1材料与仪器
1.1动物spf级雄性sd大鼠10只,体重180~220g,动物合格证号:scxk(湘)2016-0002;spf级雄性sd小鼠10只,体重18~22g,动物合格证号:scxk(湘)2013-0004;皆由湖南斯莱克景达实验动物有限公司提供。
1.2药物及试剂实施例1-3样品。tris(北京索莱宝科技有限公司,批号613t076),维生素e软胶囊(桂林南药股份有限公司,批号ve171004),抗坏血酸(vitc,天津市大茂化学试剂厂,批号20170314),总抗氧化能力测试盒(t-aoc,南京建成生物工程研究所,批号20171202),bca蛋白浓度测定试剂盒(碧云天生物科技公司,批号081517171220),丙二醛测试盒(mda,南京建成生物工程研究所,批号20171129)。
1.3仪器hh-s6型六孔水浴锅(巩义市予华仪器有限责任公司),uv-1780型紫外可见分光光度计(岛津仪器(苏州)有限公司),infinite200pro型酶标仪(奥地利tecan公司),s10型手提式高速分散器(宁波新芝生物科技股份有限公司),gl-88b型旋涡混合器(海门市其林贝尔仪器制造有限公司),sorvallst16r型高速冷冻离心机(美国thermofisher科技公司)。
2实验方法
2.2龙眼叶体外抗氧化活性研究
2.2.1frap法测定龙眼叶不同极性部位总抗氧化能力
配制不同浓度feso4·7h2o标准品以绘制标准曲线,按照总抗氧化能力(t-aoc)测试盒说明书进行操作,使用酶标仪在593nm处读取吸光度值并计算不同样品的总抗氧化能力。
2.2.2fenton-邻二氮菲法测定efd对·oh的清除率
10ml离心管中依次滴加0.75mmol·l-1邻二氮菲溶液1ml、0.2mol·l-1pbs(ph7.4)1ml、不同浓度样品1ml、0.75mmol·l-1硫酸亚铁溶液1ml和0.01%h2o2,摇匀,37℃水浴温育1h,在536nm波长处测吸光度a样品;以蒸馏水代替h2o2溶液同法操作,测吸光度a未损伤;以蒸馏水代替样品,测a损伤,计算·oh清除率。
·oh清除率(%)=[(a样品-a损伤)/(a未损伤-a损伤)]×100%
2.2.3邻苯三酚自氧化法测定efd对o2-·的清除率
新配0.5mol·l-1tris-hcl缓冲液(ph9.6)和2.5mmol·l-1邻苯三酚溶液,于30℃水浴温育30min,在干燥试管中分别加入3.0ml缓冲液、不同浓度样品0.4ml和0.4ml邻苯三酚溶液,快速摇匀并置于30℃水浴反应5min,以10mmol·l-1盐酸溶液调零,在325nm波长处测吸光度a1;另取试管,以0.4ml蒸馏水代替邻苯三酚溶液同法操作,测吸光度a2;以0.4ml蒸馏水代替样品,测a0,计算o2-·清除率。
o2-·清除率(%)=[1-(a1-a2)/a0]×100%
2.2.4h2o2诱导小鼠红细胞氧化溶血的实验
小鼠眼球采血,肝素管收集血液,4000r·min-1离心5min,弃去血浆,红细胞用适量冰生理盐水洗3次,取1ml红细胞置于干净锥形瓶,加入200ml冰生理盐水,即得0.5%红细胞混悬液。于10ml离心管中依次加入红细胞混悬液5ml、0.1mol·l-1h2o20.5ml、不同浓度样品0.5ml,混匀,37℃水浴1h,4000r·min-1离心10min,取上清液,在415nm处测吸光度a1;以蒸馏水代替样品溶液同法操作,测a0;以同体积蒸馏水代替样品和h2o2,测吸光度a2,计算不同样品对红细胞氧化溶血抑制率。
红细胞氧化溶血抑制率(%)=[(a0-a1)/(a0-a2)]×100%
2.2.5tba法测定小鼠肝微粒体产生的mda含量
用钙离子沉淀法制备肝微粒体,小鼠眼球采血后颈椎脱臼处死,迅速取出肝脏,去除胆囊,以冰生理盐水冲洗血渍后滤纸吸干,称重,按4倍量加入匀浆缓存液(tms),电动匀浆仪冰上匀浆,4℃下以10000r·min-1离心20min,上清液按每1ml加0.1ml88mmol·l-1cacl2溶液混匀,于4℃下16000r·min-1离心40min沉淀重悬于0.10mmol·l-1tris液(ph7.4)中洗涤,最后再于4℃下16000r·min-1离心20min,沉淀物悬浮于1ml的0.2mol·l-1pbs(ph7.4)中既得肝微粒体悬液,用二奎琳甲酸(bca)试剂盒进行蛋白含量测定。于离心管中加入肝微粒体悬液0.3ml、0.2mol·l-1pbs0.8ml、0.65mol·l-1vitc0.3ml、0.32mol·l-1feso4溶液0.3ml、不同浓度样品0.3ml(以维生素e为阳性对照、生理盐水为空白对照),37℃水浴1h,4000r·min-1离心5min取上清液按丙二醛(mda)测试盒说明书进行操作,使用酶标仪在532nm处读取吸光度值a并计算mda含量和过氧化抑制率。
过氧化抑制率(%)=(a空白组-a样品组/a空白组)×100%
2.4统计学分析
以
3结果
3.1龙眼叶体外抗氧化能力
3.1.1龙眼叶不同部位总抗氧化能力
配制不同浓度feso4·7h2o绘制标准曲线,见图1。与空白组比较,vitc和龙眼叶各不同极性部位提取物od值均有极其显著的统计学差异(p<0.01);同浓度的情况下,龙眼叶乙酸乙酯部位efd和其他部位相比,表现出的总抗氧化能力最强,其次为正丁醇部位,石油醚部位最弱,见表1、图2。故选择efd作为给药部位进行下一步实验。
表1龙眼叶不同部位总抗氧化能力(
注:与空白组比较:1)p<0.01。
3.1.2efd清除·oh的能力
与空白组相比,各浓度给药组a536显著增大,具有统计学差异(p<0.05);相同浓度的情况下,efd组比vitc组清除率更高,表现出了更强的·oh清除能力。见表2。
表2efd清除·oh的能力(
注:与空白组比较:1)p<0.05(下表均同)
3.1.3efd清除o2-·的能力
与空白组比较,各浓度给药组在325nm处测得的a1均明显减小,具有统计学差异(p<0.05);表明efd具有一定的o2-·清除能力,且与浓度呈量效相关性。见表3。
表3efd清除o2-.的能力(
3.1.4对h2o2诱导小鼠红细胞氧化溶血的影响
与空白组比较,各浓度给药组a415显著降低,具有统计学差异(p<0.05)。表明efd对h2o2诱导小鼠红细胞氧化溶血有一定的抑制作用。见表4。
表4efd对h2o2诱导小鼠红细胞氧化溶血的作用(
3.1.5对小鼠肝微粒体产生脂质过氧化产物mda的影响
与空白组相比较,各浓度给药组mda含量显著降低,具有统计学差异(p<0.05)。表明各浓度给药组对小鼠肝微粒体产生脂质过氧化产物mda均有抑制作用,且呈量效关系。见表5。
表5efd对小鼠肝微粒体产生脂质过氧化产物mda的影响(x±s,n=5)
三、本发明实施例总抗氧化能力
在龙眼叶不同部位总抗氧化能力的筛选研究实验的基础上,对实施例1、4-7的乙酸乙酯部位的总抗氧化能力进行了比较试验。
1材料
1.1药物及试剂实施例1、4-7中制备所得的龙眼叶乙酸乙酯部位;抗坏血酸(vitc,天津市大茂化学试剂厂,批号20170314);总抗氧化能力测试盒(t-aoc,南京建成生物工程研究所,批号20171202)。
1.2实验仪器
同2.2.1frap法测定龙眼叶不同极性部位总抗氧化能力试验
2实验方法
同2.2.1frap法测定龙眼叶不同极性部位总抗氧化能力试验
3统计学分析
以
4实验结果
与空白组比较,vitc和各实施例乙酸乙酯部位提取物od值均有极其显著的统计学差异(p<0.01);同浓度比较,实施4制备所得的乙酸乙酯部位的总抗氧化能力最小,说明经40%乙醇加热回流提取的乙酸乙酸部位总抗氧化能力较低,50%或以上乙醇加热回流提取的乙酸乙酯部位总抗氧化能力较高,故本发明选择50%或以上的乙醇加热回流提取。数据见表6。
表6不同实施例乙酸乙酯部位总抗氧化能力(
注:与空白组比较:1)p<0.01。
- 还没有人留言评论。精彩留言会获得点赞!