一种木犀草素纳米胶束及其制备方法与应用与流程
本发明涉及神经及脑损伤药物的技术领域。
背景技术
木犀草素(luteolin)是一种天然黄酮类化合物,多以糖苷的形式存在于多种植物中,以全叶青兰、辣椒、野菊花、金银花、紫苏中含量较高。
木犀草素具有良好的抗炎、抗过敏及抑制病毒的效果,可治疗咳嗽、咳痰、支气管哮喘等多种呼吸系统疾病,并能有效抑制pde、sars、hiv病毒。
现有技术还发现木犀草素可有效减少心血管疾病的发生,并具有一定的脑保护作用。
尽管现有技术中揭示了木犀草素的多种用途,但其更多的应用价值及作用机制仍需要不断的研究。
同时,尽管木犀草素具有上述多种药用价值,但其单体不溶于水,作为药物直接使用时,在人体内的生物利用度低,难以充分发挥药物疗效。
技术实现要素:
本发明的目的在于提供一种木犀草素纳米胶束,该纳米胶束具有良好的分散性和稳定性,能明显提高生命体细胞的摄取能力、提高木犀草素的生物利用度,并能有效延长药效、提高治疗能力。
本发明的目的还在于提出该木犀草素纳米胶束的制备方法。
本发明的目的还在于提出该木犀草素纳米胶束的新的应用。
本发明的技术方案如下:
一种木犀草素纳米胶束,其包括嵌段共聚物mpeg-plga、及由该嵌段共聚物包裹的木犀草素。
该技术方案中木犀草素为天然活性的疏水药物,若无嵌段共聚物mpeg-plga的包裹,其难溶于水,因此在以水为溶剂的应用形式中难以发挥药效,在人体内的生物利用度低、存留时间短。
而相对的,发明人发现该纳米胶束外部覆盖的mpeg-plga能够被细胞有效吸收,从而可使其内包裹的木犀草素的吸收量显著上升、吸收时间有效延长。同时,该方案中mpeg-plga与木犀草素能稳定的结合,形成均匀稳定的颗粒,mpeg-plga亦不会干扰木犀草素疗效的发挥,并且在治疗同一疾病时具有更好的疗效。此外,该方案中胶束表面的peg能够有效避免其被res等清除,增加了该纳米胶束在血液中的循环时间,进一步提高了治疗能力。
发明人还发现,相对于木犀草素的药用效果,上述结构的木犀草素纳米胶束还对mapk通路中的jnk等通路具有明显的干预效果,对脑缺血再灌注损伤具有良好的防治效果。
在一种具体的实施方式中,所述木犀草素纳米胶束的粒径为30~40nm。
发明人发现在该粒径下的木犀草素纳米胶束在水溶液中具有良好的分散性、稳定性,在人体内具有良好的吸收性、缓释性,如在体温37℃的条件下,可在12h内保持稳定,因此在临床使用中具有充分的作用时间。
优选的是,所述木犀草素的质量为所述所述嵌段共聚物质量的2~10%,进一步优选为5%。
发明人发现在该质量配比的情况下,所得产物稳定性较佳,治疗效果较好,特别是在5%的配比下,产物稳定性最佳,治疗效果最好。
本发明进一步提出了上述任一种木犀草素纳米胶束或其具体实施方式或其优选方案的制备方法,其包括以下步骤:
(1)将所述嵌段共聚物mpeg-plga及木犀草素共溶并分散于乙醇中,得到混合液;
(2)将所述混合液进行旋蒸除去乙醇,其后加入热水震荡至溶液澄清透明;
(3)将步骤(2)得到的透明溶液过孔径为0.22μm的微滤膜,其后除菌,冻干即可。
在该制备方法中,优选的是,所述木犀草素的质量为所述所述嵌段共聚物质量的2~10%,进一步优选为5%。
在上述制备方法中,可以理解的是,在实际操作时,技术人员可以进行多种合适的选择,如步骤(1)中所述mpeg-plga及木犀草素共溶并分散于乙醇的过程,操作人员可选择人工搅拌、机械搅拌、磁力搅拌、超声分散等多种形式进行,其目的均在于使得mpeg-plga与木犀草素在溶剂中形成均匀、透明、无不溶物的稳定溶液。
上述步骤(1)中乙醇的用量可根据原料mpeg-plga及木犀草素的含量,及实际应用的需要进行调整,其目的均在于能够得到均匀、透明、无不溶物的混合液,若进一步考虑生产成本,可在得到稳定混合液的前提下选择最少的溶剂用量。
上述步骤(2)中所述旋蒸的温度和时间可根据溶剂(乙醇)的沸点和含量进行选择,其目的均在于能够完全去除混合液中的溶剂。如当乙醇含量较少时,可选择30~60℃。
上述步骤(3)选择孔径为0.22μm的微滤膜,不仅在于控制和调整产品的最终粒径,同时可以起到除菌的效果。
通过上述制备方法得到的木犀草素纳米胶束在使用时,可加水进行复溶。
本发明进一步提出如下的一些对于上述任一种木犀草素纳米胶束或其具体实施方式或其优选方案的应用,包括:
将该木犀草素纳米胶束在用于防治神经细胞氧化损伤和/或神经细胞凋亡和/或神经细胞炎性的药物中的应用。
在该应用中,所述防治是指的预防/防护和治疗。其中预防是指的在预料可能会对神经细胞产生上述损害的情况下,提前使用该药物以避免上述伤害的产生,所述防护是指的在预料可能会对神经细胞产生上述损害的情况下,提前或同时使用该药物以以避免上述伤害的产生,所述治疗是指的在上述损害产生以后,使用该药物以减少或消除伤害。
或将该木犀草素纳米胶束在用于提高bcl-2含量和/或降低bax含量的药物中的应用。
或将该木犀草素纳米胶束在用于干预nf-κb和/或mapk通路表达的药物中的应用。
进一步的,所述mapk通路选自jnk、p38、erk通路中的一种或多种。
或将该木犀草素纳米胶束在用于保护和/或修复脑组织完整性的药物中的应用。
其中所述保护是指在预料可能会对脑组织完整性产生损害的情况下,提前或同时使用该药物以避免损害的产生,所述修复是指的在脑组织完整性受到损害以后,使用该药物以减轻或消除损害,提高脑组织完整性。
或将该木犀草素纳米胶束在用于防治脑缺血再灌注损伤的药物中的应用。
本发明具备以下有益效果:
(1)本发明得到了一种木犀草素纳米胶束,其具有良好的生物相容性和稳定性,可明显提高生命体细胞的摄取能力、提高木犀草素的生物利用度,并能有效延长药效、增加药物在血液中的循环时间,提升治疗效果。
(2)本发明的木犀草素纳米胶束可用于防治神经细胞氧化损伤,如在双氧水诱导的受损pc12细胞中应用后,相对于游离木犀草素,其细胞存活率可提高5%以上。
(3)本发明的木犀草素纳米胶束可通过抑制nf-κb及mapk通路的表达,抑制炎症因子的表达。
(4)本发明的木犀草素纳米胶束可通过提高bcl-2的含量、降低bax的含量,降低线粒体损伤,抑制细胞凋亡,如在双氧水诱导的受损pc12细胞中应用后,细胞中bcl-2的含量相对于游离木犀草素提高了30%以上,相对于未治疗组提高了135%以上。
(5)本发明的木犀草素纳米胶束可用于保护脑组织完整性,显著降低脑梗死体积。
(6)本发明的木犀草素纳米胶束可用于防治脑缺血再灌注损伤,且相对于游离的木犀草素,本发明的木犀草素纳米胶束具有更强的抗脑缺血再灌注损伤的能力。
附图说明
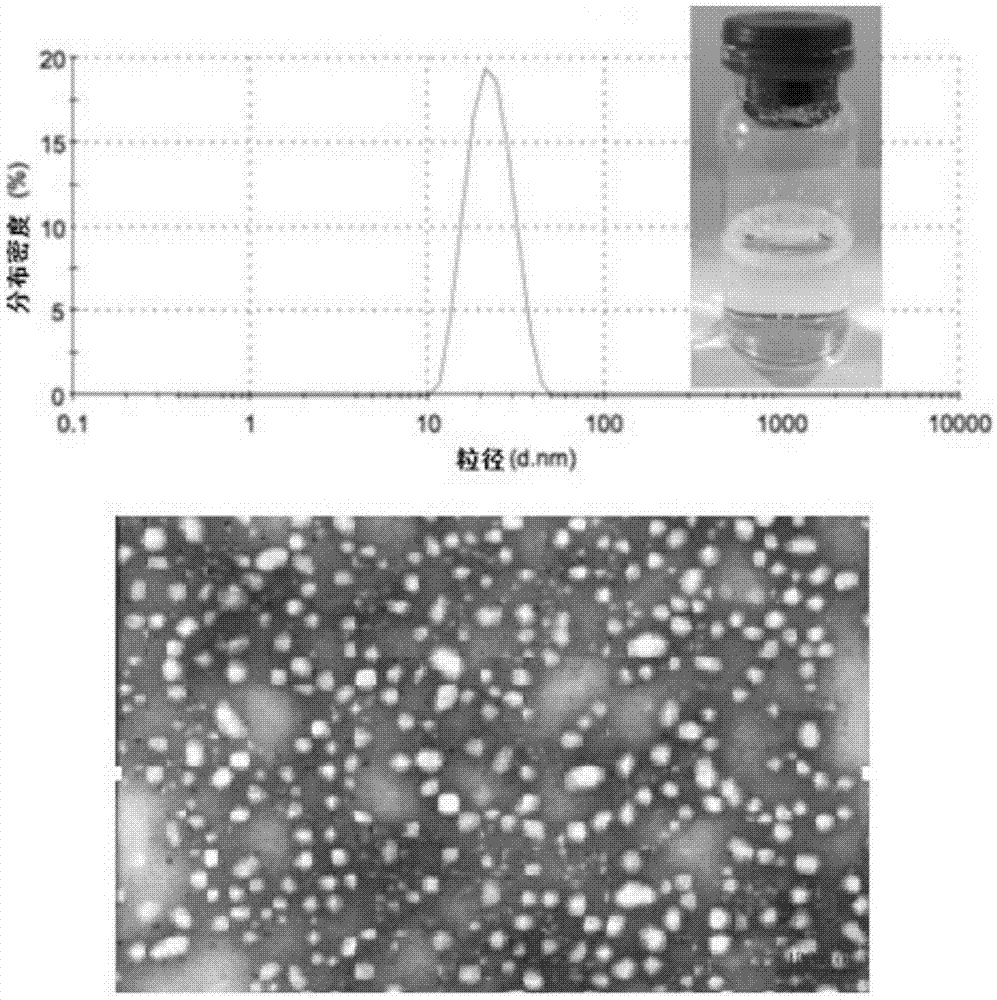
图1为实施例1所得木犀草素纳米胶束的粒径分布与复溶后溶液外观图及显微图;
图2为实施例1所得木犀草素纳米胶束在不同温度下的粒径变化情况统计图;
图3为实施例1所得木犀草素纳米胶束在不同温度下的多分散指数的变化情况统计图;
图4为实施例1所得木犀草素纳米胶束及其对比样品在不同时间下的释放情况统计图;
图5为实施例4中游离香豆素及香豆素纳米胶束的荧光显微对比图;
图6为实施例5中目的制剂与对比制剂的细胞存活率对比统计图;
图7为实施例6中不同处理组中bcl-2/bax的表达量对比图;
图8为实施例7中不同处理组中nf-κb通路蛋白表达量对比图;
图9为实施例7中不同处理组中mapk通路蛋白表达量对比图;
图10为实施例8中不同处理组大鼠脑组织切片染色对比图;
图11为实施例8中不同处理组大鼠脑组织检测结果统计图;
图12为实施例8中不同处理组大鼠脑组织he及nissl染色结果对比图;
图13为实施例8中不同处理组大鼠脑组织细胞完整性对比图;
图14为实施例8中不同处理组tunel荧光染色对比图;
图15为实施例8中不同处理组tunel荧光染色结果统计图;
图16为实施例8中不同处理组炎症因子及抗氧化作用对比图;
图17为实施例8中不同处理组mda含量、sod及gsh-px的活性对比图。
具体实施方式
以下通过一些具体实施例对本发明作进一步的详细说明,但不应将此理解为本发明的范围仅限于以下的实施例。在不脱离本发明上述方法思想的情况下,根据本领域普通技术知识和惯用手段做出的各种替换或变更,均应包含在本发明的范围内。
实施例1木犀草素纳米胶束的制备
通过以下过程制备木犀草素纳米胶束:
(1)将95mg嵌段共聚物mpeg-plga及5mg木犀草素共同加入2ml乙醇中,搅拌使其溶解并分散于乙醇中,得到混合液;
(2)将所述混合液在30~60℃下进行旋蒸1h,除去乙醇,其后加入热水震荡至溶液澄清透明;
(3)将步骤(2)得到的透明溶液过孔径为0.22μm的微滤膜,将得到的纳米胶束进行除菌,冻干即可。
所得的木犀草素纳米胶束粒径为30~40nm,如附图1所示,其由嵌段共聚物mpeg-plga与包裹于该嵌段共聚物内的木犀草素组成。
使用时,将冻干后的颗粒在水中进行复溶,溶液呈现淡黄色,澄清透明,其中木犀草素纳米胶束形态均一,在水溶液中具有良好的分散性,如附图1所示。
将分散后的纳米胶束在室温下存放,通过附图2~3可以观察到,胶束粒径长期稳定;将该纳米胶束在37℃,即体温状况下存放,可在12h内保持稳定。
将该纳米胶束与无包裹的木犀草素进行对比,如附图4所示,可知将该纳米胶束具有明显的缓释效果。
实施例2木犀草素纳米胶束的制备
通过以下过程制备木犀草素纳米胶束:
(1)将嵌段共聚物mpeg-plga95mg及木犀草素1.9mg共同加入溶剂乙醇2ml中,搅拌使其溶解并分散于乙醇中,得到混合液;
(2)将所述混合液在30~60℃下进行旋蒸1.1h,除去乙醇,其后加入热水震荡至溶液澄清透明;
(3)将步骤(2)得到的透明溶液过孔径为0.22μm的微滤膜,将得到的纳米胶束进行除菌,冻干即可。
所得的木犀草素纳米胶束粒径为30~40nm,由嵌段共聚物mpeg-plga与包裹于该嵌段共聚物内的木犀草素组成。
将冻干后的颗粒在水中进行复溶,溶液呈现淡黄色,澄清透明,其中木犀草素纳米胶束形态均一,在水溶液中具有良好的分散性。
将其进行与实施例1相同的稳定性及缓释性考察可以发现,该纳米胶可在室温下长期稳定存放;在37℃时,其可在12h左右保持稳定。相对于无包裹的木犀草素,其具有明显的缓释效果。
实施例3
木犀草素纳米胶束的制备
通过以下过程制备木犀草素纳米胶束:
(1)将嵌段共聚物mpeg-plga95mg及木犀草素9.5mg共同加入溶剂乙醇2.5ml中,搅拌使其溶解并分散于乙醇中,得到混合液;
(2)将所述混合液在30~60℃下进行旋蒸1.2h,除去乙醇,其后加入热水震荡至溶液澄清透明;
(3)将步骤(2)得到的透明溶液过孔径为0.22μm的微滤膜,将得到的纳米胶束进行除菌,冻干即可。
所得的木犀草素纳米胶束粒径为30~40nm,由嵌段共聚物mpeg-plga与包裹于该嵌段共聚物内的木犀草素组成。
将冻干后的颗粒在水中进行复溶,溶液呈现淡黄色,澄清透明,其中木犀草素纳米胶束形态均一,在水溶液中具有良好的分散性。
将其进行与实施例1相同的稳定性及缓释性考察可以发现,该纳米胶可在室温下长期稳定存放;在37℃时,其可在12h左右保持稳定。相对于无包裹的木犀草素,其具有明显的缓释效果。
将实施例1~3所得木犀草素纳米胶束对比可发现,实施例1所得纳米胶束在25~37℃内长期存放时粒径变化程度最小,说明其稳定性最佳,同时在关于治疗的试验中可以发现其治疗效果最佳。
实施例4细胞对mpeg-plga的摄取
(1)将嵌段共聚物mpeg-plga100mg及疏水性荧光探针香豆素5mg共同加入溶剂乙醇2ml中,搅拌使其溶解并分散于乙醇中,得到混合液;
(2)将所述混合液在30~60℃下进行旋蒸1h,除去乙醇,其后加入热水震荡至溶液澄清透明;
(3)将步骤(2)得到的透明溶液过孔径为0.22μm的微滤膜,将得到的纳米胶束进行除菌,冻干,得到含荧光探针的纳米胶束。
将该含荧光探针的纳米胶束及游离香豆素分别加入pc12细胞中,4h后,对细胞在荧光显微镜下观察,如附图5所示,可知含荧光探针的纳米胶束相对于游离的香豆素在细胞内具有更明显的荧光效果,说明mpeg-plga纳米胶束能够明显提高细胞对疏水药物的摄取能力。
实施例5木犀草素纳米胶束对细胞氧化损伤的作用
(1)根据实施例1的过程制备木犀草素纳米胶束,将其复于水中,形成目的制剂,取相同木犀草素含量的游离木犀草素,即不含有mpeg-plga外壳的天然活性物质木犀草素(游离木犀草素)作为对比制剂;
(2)建立pc12细胞氧化应激损伤模型
将pc12细胞在dmem培养基中培育过夜,加入适量双氧水,使pc12细胞产生氧化损伤,在损伤4h后加入游离木犀草素及木犀草素纳米胶束,继续培育24h,其后收集细胞样品,通过mtt法检测pc12细胞的生存率结果如附图6所示,从图中可以看出,目的制剂,即木犀草素纳米胶束相对于游离木犀草素具有更好的细胞氧化损伤防治功能,特别是在木犀草素浓度为10μm/ml的浓度条件下,细胞的存活率最高。
实施例6木犀草素纳米胶束对bcl-2/bax的调整
(1)根据实施例1的过程制备木犀草素纳米胶束,将其复于水中,形成目的制剂,取相同木犀草素含量的游离木犀草素,即不含有mpeg-plga外壳的天然活性物质木犀草素(游离木犀草素)作为对比制剂;
(2)建立pc12细胞氧化应激损伤模型
将pc12细胞在dmem培养基中培育过夜,加入适量双氧水,使pc12细胞产生氧化损伤,在损伤4h后将其分为三组,分别为模型组、给药组、对照组,其中给药组通过细胞给药方式施用所述目的制剂,对照组注射对比制剂,其后继续培育24h,收集这三组及另设的假手术组细胞样品,通过蛋白质印迹法分别检测各组pc12细胞的蛋白含量变化。
结果如附图7所示,从图中可以看出给药组相对于模型组及对照页bcl-2含量更高,bax含量更低,说明木犀草素纳米胶束可有效提高氧化损伤细胞中bcl-2/bax的比例,从而降低线粒体损伤,抑制细胞凋亡。
实施例7木犀草素对nf-κb和/或mapk通路的干预
(1)根据实施例1的过程制备木犀草素纳米胶束,将其复于水中,形成目的制剂,取相同木犀草素含量的游离木犀草素,即不含有mpeg-plga外壳的天然活性物质木犀草素作为对比制剂;
(2)建立pc12细胞氧化应激损伤模型
将pc12细胞在dmem培养基中培育过夜,加入适量双氧水,使pc12细胞产生氧化损伤,在损伤4h后将其分为三组,分别为模型组、给药组、对照组,其中给药组通过细胞给药方式施用所述目的制剂,对照组注射对比制剂,其后继续培育24h,收集这三组及另设的假手术组细胞样品,通过蛋白质印迹法分别检测各组pc12细胞的蛋白含量变化。
结果如附图8~9所示,从图中可以看出,木犀草素纳米胶束及游离木犀草素均能够起到抑制nf-κb及mapk通路的作用,且木犀草素纳米胶束更为显著,说明其具有更好的抑制炎症因子表达的效果。
实施例8木犀草素纳米胶束对脑的作用
(1)pmcao模型建立:
选择体重在300g左右的sd大鼠,于手术前12h禁食不禁水;在手术前通过配置好的水合氯醛进行麻醉,待大鼠完全麻醉后,进行手术;手术过程中先将大鼠颈总动脉结扎,同时在结扎端远侧开一小口,插入线栓,进线,当出现阻力时立即停止进线,其后将肌肉层层缝合,术后两小时拔线,得到的大鼠大脑的pmcao模型;作为对比,假手术组仅分离各动脉但不用线栓阻断大脑中动脉血流,其余操作与模型相同;
(2)评分:
对手术后的大鼠按下表进行进行神经功能评分:
选择分数为1分和2分的模型鼠进行进一步考察;
(3)分组及给药
将评分为2分的pmcao模型鼠随机分为4组,分别为假手术组,模型组(i/r),游离木犀草素组(f-lu组),木犀草素纳米胶束组(m-lu组),其中f-lu组及m-lu组分别于术后2h以游离木犀草素及实施例1制得的木犀草素纳米胶束进行尾静脉给药,给药剂量为10mg/kg,其中f-lu组及m-lu均以木犀草素含量计;24h后,处死大鼠,取其血液样品及脑组织进行检测。
通过图10~11可以看出,木犀草素具有明显的降低脑梗死体积的作用,且木犀草素纳米胶束的作用更为明显,可显著提高脑组织完整性。
通过图12~13(he及nissl染色实验)可以看出,木犀草素能够降低模型操作对脑组织结构的破坏,说明其具备治疗或修复脑损伤的作用,同时木犀草素能够降低半暗带区的神经元的损伤,且木犀草素纳米胶束的效果更为显著。
通过图14~15(tunel荧光染色实验)可以看出,木犀草素能够抑制因模型操作导致的脑组织细胞的凋亡。
从脑组织的炎症因子及抗氧化作用可以看出,木犀草素纳米胶束能够抑制tnf-α,il-1及il-6在半暗带区的表达,抑制炎症反应(如附图16);能降低mda的含量、提高sod及gsh-px的活力(如附图17),具有一定抗氧化应激的能力,具有较强的抗氧化及抗炎作用,具有较强的抗脑缺血再灌注损伤的能力。
- 还没有人留言评论。精彩留言会获得点赞!