一种金银花叶抗炎活性组分及其制备方法和应用与流程
本发明属于分析化学和生物医药技术领域,具体涉及一种金银花叶抗炎活性组分、制备方法及其抗炎应用。
背景技术
忍冬(英文名:lonicerajaponica),又名“金银花”,为半常绿藤本植物,忍冬科忍冬属,始载于《名医别录》。忍冬作为一种历史悠久的常用中药,自1995年,就有超过500种含有忍冬的中药处方被收录入《中华人民共和国药典》。金银花叶(leavesoflonicerajaponica,简称llj),早在明清时代就有记载“忍冬茎叶及花功用皆同”、“藤叶皆可用”。忍冬性寒味甘,具有清热解毒,疏散风热的功效。
现有技术中,常用金银花来制作茶或茶饮料,如cn201510718865.6金银花茶的制备方法,中国专利cn200810074299.x公开了一种金银花茶饮料等。炎症是机体组织对损伤因素产生的应激性的防御反应,体表的外伤感染和各组织器官的常见多发病症都属于炎症性的疾病。目前,尚未有关于金银花叶具有抗炎活性的相关报道。因此,开展金银花叶抗炎活性的相关研究意义重大,并且可以有效提升金银花叶子作为非药用部位的资源利用率。
技术实现要素:
本发明目的在于克服现有技术缺陷,提出一种金银花叶抗炎活性组分,为抗炎药物的研发提供理论依据。
本发明还提供了上述金银花叶抗炎活性组分的制备方法及其应用。
为实现上述目的,本发明采用如下技术方案:
一种金银花叶抗炎活性组分的制备方法,其包括如下步骤:
1)将粉碎过的干燥金银花叶先进行石油醚脱脂处理,然后用甲醇回流提取获得粘稠状粗提物;
2)用二次水溶解粘稠状粗提物获得悬浮液,再用正丁醇萃取,并经减压浓缩获得正丁醇相;
3)将正丁醇相进行柱层析分离,分别用10%、20%、30%、40%、50%、60%和70%的甲醇水溶液进行洗脱,选取50%甲醇水溶液洗脱所得的馏分即为金银花叶抗炎活性组分。
为了获得较好的脱脂处理效果,步骤1)中,脱脂处理具体为:将粉碎过的干燥金银花叶与石油醚按料液比1g:20―60ml在索氏提取器中混合后,于70―90℃脱脂至索氏提取器中溶液变成无色即可。
为了获得较好的回流提取效果,步骤1)中,回流提取具体为:按料液比1g:10―50ml加入浓度70―95%甲醇,回流提取2―5次,每次2―5h,回流提取结束后合并提取液即为粘稠状粗提物。
为了获得较好的萃取效果,步骤2)中,用二次水超声溶解粘稠状粗提物获得悬浮液,再用正丁醇等体积萃取。
本发明提供了采用上述制备方法制备得到的金银花叶抗炎活性组分。
本发明还提供了上述金银花叶抗炎活性组分在体外酶模型、巨噬细胞模型及小鼠足肿胀模型抗炎研究中的应用。
本发明还提供了上述金银花叶抗炎活性组分在制备抗炎药物中的应用。
和现有技术相比,本发明的有益效果在于:
1)本发明制备方法简单易操作,制备所得的金银花叶抗炎活性组分在体外酶模型、巨噬细胞模型及小鼠足肿胀模型抗炎研究中进行了应用,为金银花叶相关抗炎药物研发提供理论依据;
2)本发明首次制备了金银花叶抗炎活性组分,经hplc分析后发现:其主要含五种化合物,杂质较其它梯度洗脱馏分要少,有助于后续化合物的定性及定量。此外,分离纯化后的混合物抗炎活性研究,比之前文献报道的金银花叶粗提取物的抗炎活性研究更具高效性和针对性。
附图说明
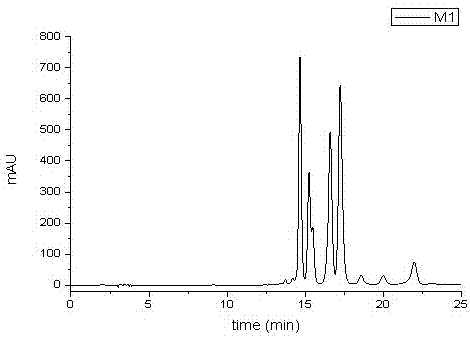
图1为实施例1所得金银花叶抗炎活性组分(m1)的hplc图;
图2为实施例1所得金银花叶抗炎活性组分(m1)抑制5-lox活性的量效关系图;
图3为实施例1所得金银花叶抗炎活性组分(m1,60μm)对raw264.7细胞形态的影响结果图;实验设置4组,具体如下:正常组(不加供试品,无lps);模型组(100ng/mllps);实验组(60μmm1+lps);阴性对照组(60μmm1);
图4为实施例1所得金银花叶抗炎活性组分(m1)对小鼠足跛肿胀的抑制作用图,地塞米松和生理盐水分别为阳性和阴性对照组,忍冬叶正丁醇相(jyhn-b)和m1为实验组。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
下述实施例中如无特殊说明,甲醇均指的是体积浓度。
实施例1
一种金银花叶抗炎活性组分的制备方法,步骤如下:
1)金银花叶化学成分的提取:摘取新鲜金银花叶约114g置于40℃烘箱中烘干至恒重,得到约37g干燥金银花叶,粉碎后过60目筛。精密称取10g过60目筛后的干燥金银花叶样品置索氏提取器中,加200ml石油醚于80℃下进行脱脂处理,至索氏提取器中溶液变成无色即可。脱脂后晾干,使用500ml80%甲醇于80℃下回流提取3次,每次3h,提取结束后合并3次提取液,得到棕褐色粘稠状粗提物;
2)将粗提物用二次水超声溶解至悬浮状,使用等体积的正丁醇进行萃取,萃取液减压浓缩后得到正丁醇相约1.4g;
3)柱层析分离:选用1.6cm×50cm层析柱,先将mcigelchp20p固体填料用甲醇浸泡,并充分搅拌以除去气泡,待填料静置沉淀后,湿法装柱,柱高约28cm(约50mlmci)。取步骤2)得到的约1.4g正丁醇相溶于5ml二次水中,湿法上样。分别使用10%、20%、30%、40%、50%、60%、70%的甲醇水溶液进行洗脱(每个梯度洗脱约5个柱体积)。选取50%甲醇水溶液洗脱所得的馏分即为金银花叶抗炎活性组分(40mg)。
色谱分析:将50%甲醇水洗脱所得的馏分(即金银花叶抗炎活性组分,后续统一简称为m1)进行hplc检测。使用cosmosil5c18-paq(4.6×250mm,5μm)柱;流动相为0.5%醋酸(a)-乙腈(b);流速为1ml/min;梯度洗脱:0-10min,12-20%b;10-20min,20%b;20-30min,20%-40%b;检测波长为327nm;柱温为25℃;进样量为10μl。
经hplc分析发现(见图1):本发明方法制备所得的金银花叶抗炎活性组分(m1)较纯,可用于进一步的抗炎活性研究实验。
实施例2
一种金银花叶抗炎活性组分的制备方法,步骤如下:
1)金银花叶化学成分的提取:精密称取10g过60目筛后的干燥金银花叶样品置索氏提取器中,加400ml石油醚于80℃下进行脱脂处理,至索氏提取器中溶液变成无色即可。脱脂后晾干,使用300ml80%甲醇于80℃下回流提取3次,每次3h,提取结束后合并3次提取液,得到棕褐色粘稠状粗提物;
2)将粗提物用二次水超声溶解至悬浮状,使用等体积的正丁醇进行萃取,萃取液减压浓缩后得到正丁醇相;
3)柱层析分离:选用1.6cm×50cm层析柱,填料mcigelchp20p。分别使用10%、20%、30%、40%、50%、60%、70%的甲醇水溶液进行洗脱。选取50%甲醇水溶液洗脱所得的馏分即为金银花叶抗炎活性组分。
应用试验
将实施例1制备所得的金银花叶抗炎活性组分(m1)用于体外酶模型、巨噬细胞模型及小鼠足肿胀模型抗炎活性的研究应用。
1.m1对5-lox的抑制作用研究
溶液配制:
缓冲溶液tris-hcl:称取3.0285gtris,用225ml二次水溶解,用1mol/l的盐酸溶液调节ph至7.0,定容到250ml;
fox(ferrousoxidation-xylenolorange)试剂的配制:量取25ml二次水和225ml甲醇于250ml容量瓶中,再加入340μl浓硫酸,称取24.5mg六水硫酸亚铁铵和19mg二甲酚橙加入,在-20℃避光保存;
亚油酸(la)的配制:用无水乙醇将10μlla稀释到15ml,n2保护下于-20℃下封存,即为la储备液。使用前再用缓冲溶液稀释15倍;
5-lox溶液的配制:将10μl酶原液加入到350μl缓冲溶液中,作为酶储备液。使用时用缓冲溶液稀释15倍得到酶稀释溶液。
具体步骤:移取80μl酶稀释溶液加入96孔板中,先加入不同浓度梯度的m1的dmso溶液10μl(空白加10μldmso),每个浓度平行六个孔,震荡混匀,25℃孵育15min后,再于酶标孔中加入10μl亚油酸,于25℃下孵育10min,随后加100μlfox试剂,25℃下孵育10min,最后测定体系在590nm下的吸光值。每个浓度平行6次。
5-lox活性抑制率的计算公式如下:
抑制率=(a待测-a空白)/a空白
ic50=抑制率达到50%时的待测样品浓度。
由抑制率公式计算抑制率,对混合物m1不同浓度及对应抑制率做图,结果见图2。
图2的结果显示:m1对5-lox有较强的抑制作用,其ic50为0.064mg/ml。
2.m1对小鼠巨噬细胞系raw264.7抗炎作用研究
raw264.7细胞培养:用含10%胎牛血清、青链霉素混合液(青霉素10ku/ml,链霉素10mg/ml,100×)的dmem培养基在5%co2,37℃的条件下培养细胞至对数期。
m1对细胞形态影响的观察:将m1溶于dmso中,用dmem培养基稀释至所需浓度,使dmso的含量不超过1‰。然后按6×105/孔的接种量,将细胞接种至6孔板中,于37℃、5%co2条件下培养24h后,更换新的dmem培养基。实验设置4组,具体如下:正常组(不加供试品,无lps);模型组(100ng/mllps);实验组(60μmm1+lps);阴性对照组(60μmm1)。孵育2h后,模型组和实验组加入100ng/ml的lps,正常组和阴性对照组加入相同体积的pbs,22h后显微镜下拍照(200x),结果见图3。
图3的实验结果表明:m1对正常细胞无明显影响,但是能够改善炎性细胞的形变,从而对细胞起保护作用。
m1对no产生量的影响:将raw264.7细胞按3×104每孔接种于96孔板中,在37℃、5%co2条件下培养,24h后换新dmem培养基。设置空白组、模型组、实验组(20μm、40μm、60μmm1+lps)和阴性实验对照组(20μmm1)。用新鲜dmem培养基将供试品母液混匀并稀释至终浓度为20μm、40μm、60μm。加药后37℃、5%co2孵育2h,然后模型组和实验组加入lps使终浓度为100ng/ml,正常组和阴性对照组加入相同体积pbs,继续培养20h后,取上清液50μl,按no试剂盒操作说明,读取540nm下吸光度值,计算各孔产生no的量。每组实验平行三次。试验结果见表1。
表1m1对lps刺激raw264.7释放no的影响(
由表1可以看出:m1能够明显降低lps诱导raw264.7中no的释放,并且呈现剂量依赖性。由此,m1对细胞作用安全,并且具有抗炎作用。
3.m1对大鼠足肿胀抗炎作用研究
首先将32只大鼠分成4组,各8只。第一组为生理盐水作为阴性对照组,第二组为地塞米松阳性对照组,第三组提取物的正丁醇相(jyhn-b)为给药组,第四组为忍冬叶50%甲醇水溶液洗脱所得的馏分(即金银花叶抗炎活性组分,m1,下表和图4中记为jyhn-b50%)的给药组。表示如下:
各组在注射完相应药物1h后,每只大白鼠右后足掌皮内注射新鲜鸡蛋清0.1ml。在注入蛋清前及注入后第10、20、30、40、50、60min,测定右后足容积,计算其肿胀率,计算公式如下:
肿胀率=(致炎后足体积―致炎前足体积)/致炎前足体积。
通过对实验数据的处理,得到不同时间段,各药物对大鼠足肿胀的影响结果,详见图4。由图4的结果可以发现:m1能够降低小鼠足肿胀率,起到明显的抗炎功效。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!