预防/治疗前列腺类疾病的中药组合物及其制备方法与流程
本发明属于医药卫生领域,涉及一种中药组合物及其制备方法,特别涉及一种预防或/和治疗前列腺疾病的中药组合物及其制备方法。
背景技术:
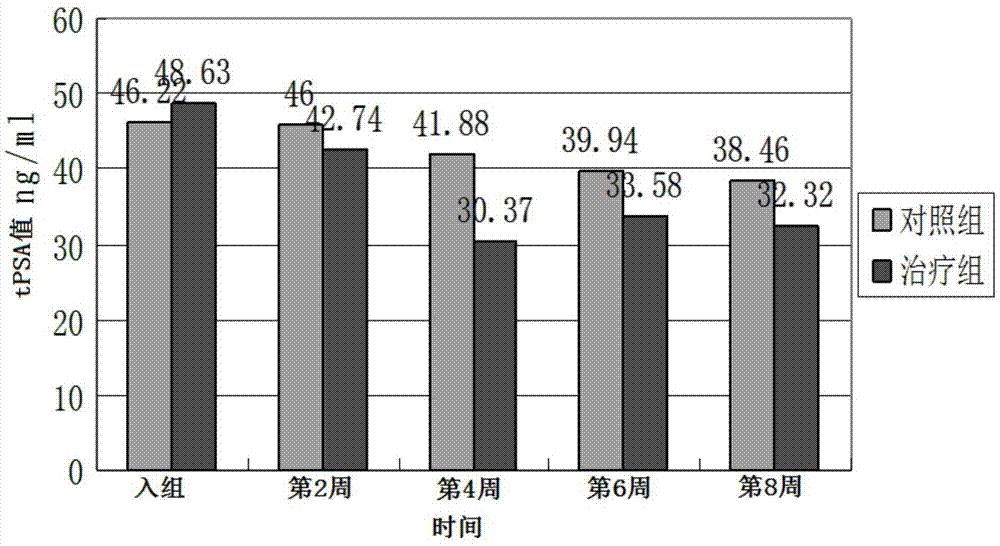
:近年来前列腺癌发病率逐渐增长,在全世界男性所患恶性肿瘤中位列第2位。2011年我国新发的前列腺癌的数量大约为4.9万例,增长的速度比欧美等发达国家更为快速,2018年我国前列腺癌在男性中发病率已迅速攀升至第六位,成为男性泌尿系统恶性肿瘤首位。而随着社会的进步和经济的发展,人们的生活习惯的改变,饮食不规律,过食肥甘厚味,劳欲无度,经济相对发达的地区也将逐渐成为全国前列腺癌的重灾区。大多数前列腺癌病人早期都可以从内分泌治疗获益,但经过18-24个月的治疗,前列腺癌细胞逐渐对雄激素剥夺产生耐受,对雄激素依赖的前列腺癌最终发展为去势抵抗性前列腺癌,出现内分泌药物治疗的抵抗,从而导致了传统内分泌药物对这一类患者几乎没有治疗效果。细胞毒药物(多西他赛、卡巴他赛)、新型抗雄药物(阿比特龙、恩杂鲁胺)、骨转移治疗、免疫治疗等是当前去势抵抗性前列腺癌的主要治疗方式。然而,上述药物仅能在有限的时间内控制肿瘤,患者无法通过这些药物治疗获得更好更长的生存,并且有不同副作用。此外,新型抗雄药物与化疗药物之间也存在交叉耐药性,新型抗雄药物昂贵的价格也会给患者及家庭造成巨大的经济和思想负担,部分患者因为无法承担其巨额的治疗费用而放弃治疗。去势抵抗性前列腺癌患者的生存预后都不理想,中位生存期不超过12个月,且最终死于前列腺癌。中医从整体观念和辨证论治的角度出发,前列腺癌患者经过中医药配合内分泌治疗,即使疾病进展到去势抵抗阶段,中医药的治疗甚至可作为去势抵抗性前列腺癌的主要治疗手段之一。应用中医药治疗去势抵抗性前列腺癌不仅可以提升正气,稳固癌灶,降低患者的前列腺癌抗原的水平,降防止复发转移,还可以提高临床疗效,改善生活质量,延长生存期。例如牟睿宇等研究“健脾利湿化瘀方”治疗晚期前列腺癌中采用生黄芪、刺五加、补骨脂为君药,扶正抗癌;采用紫石英、车前草为臣药,利尿除湿;采用大黄、姜黄为佐药,化瘀解毒;采用王不留行为使药,活血通经、利尿通淋;诸药共用,共奏利尿通淋、扶正抗癌之功;孙彬栩等研究“健脾利湿化瘀方”对人前列腺癌pc-3细胞荷瘤小鼠的抑瘤作用,其中,采用黄芪、王不留行为君药,扶正健脾,化瘀散结;以姜黄、大黄为臣药,活血通络;以补骨脂、刺五加、蛇六谷、白英为佐使药,利湿解毒,诸药共用,共奏散结消肿、解毒抗癌之功。贾英杰教授在查阅古医典籍文献并结合现代文献的meta分析的基础上继而对去势抵抗性前列腺癌本质病机进行概括和浓缩,认为其病位在前列腺,其病变相关脏腑与肝、脾、肾密切相关,“虚、毒、瘀、湿”是该病的病机要素,“脾虚湿困、气虚毒瘀”是去势抵抗性前列腺癌核心病机。然而部分补肾中药含有类似于雄激素样物质作用,如鹿茸、肉苁蓉等,故传统补肾方法可能会提升睾酮水平,冒然使用可能会加重病情,提升睾酮水平,而加重病情。据此,贾英杰教授提出了“补肾不如健脾、健脾即是补肾”治疗前列腺癌的理论,以“健脾利湿、解毒祛瘀”为去势抵抗性前列腺癌基本治疗大法,方从法出,组方生黄芪、补骨脂、王不留行等为治疗去势抵抗性前列腺癌的基础方。技术实现要素:本发明的目的是针对现有前列腺癌疾病尤其去势抵抗性前列腺癌治疗中存在的不足,提供一种预防或/和治疗前列腺类疾病的中药组合物、其制备方法及其用途。本发明的中药组合物与治疗前列腺癌疾病尤其是去势抵抗性前列腺癌的西医治疗药物联合用药,达到增加治疗效果,减轻不良反应,提高生活质量,延长生存时间,抑制激素非依赖性前列腺癌细胞增殖、侵袭、转移的效果。为实现本发明的目的,本发明一方面提供一种预防或/和治疗前列腺类疾病的中药组合物,包括如下原料:生黄芪、补骨脂、刺五加、姜黄、王不留行、炙甘草。其中,所述前列腺相关疾病为前列腺增生、前列腺肥大、前列腺炎、前列腺癌中的一种或多种。特别是,所述前列腺相关疾病为前列腺癌。尤其是,所述前列腺癌为激素依赖性前列腺癌或去势抵抗性前列腺癌,优选为去势抵抗性前列腺癌。特别是,所述原料的重量份配比为:尤其是,所述原料的重量份配比为:本发明的预防、治疗前列腺类疾病的组合物选择生黄芪、补骨脂、刺五加、姜黄、王不留行、炙甘草制备而成。本发明的中药组合物以生黄芪健脾以补先天、实脾利湿为君药,以刺五加、补骨脂温肾健脾、以助利水为臣药,以姜黄、王不留行化瘀消癥散积,共为佐药,甘草补脾和胃,调和诸药为使药。将这些中药材组合使用,使得各药材中的活性成分产生协同作用,相互增进,从而起到预防、缓解、治疗前列腺癌疾患。其中,黄芪为豆科植物蒙古黄芪或膜荚黄芪的干燥根,性温、味甘,归肺、脾经,具有补气固表,利尿托毒,排脓,敛疮生肌的功能,主要用于气虚乏力,食少便溏,中气下陷,久泻脱肛,便血崩漏,表虚自汗,气虚水肿,痈疽难溃,久溃不敛,血虚痿黄,内热消渴;慢性肾炎蛋白尿,糖尿病等。黄芪含多种微量元素。现代药理研究表明:黄芪能显著增加血液中的白细胞总数,促进中性粒细胞及巨噬细胞的吞噬功能和杀菌能力。黄芪水煎液灌胃给药能明显增强小鼠脾脏nk细胞的活性;黄芪多糖能刺激nk细胞的增殖,并使细胞体变大,黄芪对nk细胞活性的促进作用与其诱导的抗病毒活性相平行;黄芪能增强外周血淋巴细胞对il-2的反应性,使外周血淋巴细胞受il-2刺激后其增殖指数增高。黄芪能增强大鼠和小鼠的肌力;增强大鼠游泳耐疲劳的作用,并应激大鼠血浆皮质醇含量明显增加,其增强大鼠抗应激能力是通过增强肾上腺皮质功能来实现的。补骨脂,味苦、性辛、温,具有温肾健脾之功,还可固精缩尿、纳气平喘,可治疗脾肾阳虚所致的腰膝酸软、遗尿、尿频之症。现代药理研究表明补骨脂具有加强心收缩力,增加冠状动脉及末梢血管血流量的作用;抗菌作用;补骨脂提取液对离体及在位肠管有兴奋作用,对离体豚鼠子宫则松弛作用;以及雌激素样作用。刺五加,可补肝肾、强筋骨、利水消肿,可用于治疗小便不利、下肢水肿,此外刺五加还能够调节脏腑气血功能,改善血液循环,促进新陈代谢,现代药理研究显示,刺五加抗癌成份主要为苷类化合物和多糖,其水提物能够抑制腺癌细胞,促进肿瘤细胞凋亡,并能延缓细胞癌变。姜黄味辛,温,无毒,姜黄其功用在于行气、通经、止痛,可用于各类气滞血瘀所导致的痛证。姜黄主要成份姜黄素,现代药理研究表明姜黄素具有明确的抗肿瘤作用,其可诱导肿瘤细胞凋亡、抗肿瘤侵袭及转移,逆转肿瘤细胞耐药性及增加化疗敏感性。王不留行,性平、味苦,归肝、胃经。具有活血通经,下乳消肿,利尿通淋之效。《本草纲目》中亦有记载,言其“利小便”、“王不留行能走血分”,乃阳明冲任之药,俗有‘穿山甲、王不留行,妇人服了乳长流’之语,可见其性行而不住也。通过对王不留行进行系统地提取分离,得到两种活性较高的成分,鉴定为王不留行环肽a、王不留行环肽e,并证实该两种成分具有抑制血管生成的作用。研究发现王不留行环肽a具有抑制血管生成的作用。王不留行还可以降低p-erk、p-akt的相对表达量有关。炙甘草,味甘,性平。归心、脾、肺、胃经。具有补脾和胃,益气复脉的功效。现代研究,炙甘草含有甘草甜素、甘草次酸、甘草多糖、甘草查尔酮等多种化学成分,具有抗炎及抗变态反应作用,可调节机体免疫功能,抗肿瘤和止痛作用。甘草查尔酮a能加强前列腺癌细胞对trail的敏感性,加强trail凋亡通路的活性,促进细胞凋亡。甘草查尔酮a能抑制前列腺癌pc-3细胞中cyclinb1、cdc2、cdks4、cdks6表达,使cycline的表达增加,将细胞周期阻滞在g2/m期;其次甘草查尔酮a还能降低pc-3细胞中过磷酸化rb蛋白水平,其与转录因子e2f结合后可以促进细胞增殖,过磷酸化rb蛋白水平下降直接抑制了pc-3细胞的增殖。本发明另一方面提供一种预防或/和治疗前列腺类疾病的中药组合物的制备方法,包括如下进行的步骤:1)按照以下重量份配比准备原料:2)将原料混合均匀后,对混合原料进行加热水提取,收集提取液;3)将收集的提取液进行浓缩处理,即得。其中,步骤1)中所述原料的重量份配比为:特别是,步骤2)中所述加热水提取包括如下顺序进行的步骤:2a)向混合原料中加入水,进行浸泡,加入的水的重量与混合原料的重量之比为5-10:1,浸泡1-3小时后进行第一次加热提取,制得第一次提取液,加热温度为100℃,加热提取时间为0.5-2小时;2b)将第一次提取液进行过滤,收集滤液;2c)向滤渣中加入水,进行第二次加热提取,其中,加入的水的重量与混合原料的重量之比为3-7:1,加热温度为100℃,加热提取时间为20-90min;2d)过滤,将两次过滤的滤液合并。其中,步骤2a)中浸泡时间为2h;加入的水的重量与混合物的重量之比优选为7-8:1;步骤2c)中加入的水的重量与混合物的重量之比为5-7:1。特别是,步骤3)中所述浓缩处理过程中控制温度为80-100℃。尤其是,步骤3)中浓缩处理后的浓缩液的相对密度为1.05-1.3,优选为1.1-1.3。尤其是,步骤3)中浓缩处理至浓缩液的重量与原料药材的总重量之比为1:1。特别是,还包括步骤2a),将所述原料粉碎后再进行所述的加热水提取处理。尤其是,将所述原料粉碎成粗粉后再进行所述的加热水提取处理。本发明又一方面提供一种上述中药组合物在制备预防或/和治疗前列腺类疾病的药物或保健品中的应用。其中,所述前列腺类病理性病症为前列腺增生,前列腺肥大,前列腺癌等相关病症中的一种或多种,优选为前列腺癌中的一种或多种,特别是去势抵抗性前列腺癌。所述前列腺癌病理性病症为激素依赖性前列腺癌、去势抵抗性前列腺癌中的一种或多种,优选为去势抵抗性前列腺癌。本发明中药物组合物中可用的“药学上可接受的赋形剂”可以是药物制剂领域中任何常规的赋形剂,特定赋形剂的选择将取决于用于治疗特定患者的给药方式或疾病类型和状态。用于特定给药模式的合适药物组合物的制备方法完全在药物领域技术人员的知识范围内。例如,可以作为药学上可接受的赋形剂包括药学领域常规的稀释剂、载体、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体和润滑剂等。必要时,还可以在药物组合物中加入香味剂、防腐剂和甜味剂等。本发明的药物组合物可以制成片剂、粉剂、颗粒剂、胶囊、口服液等多种形式。本发明具有如下的明显优点:1、本发明的中药组合物具有显著的预防和治疗去势抵抗性前列腺癌的作用。本发明的中药组合物口服给药于去势抵抗性前列腺癌的患者,临床疗效观察显著降低患者总前列腺癌特异性抗原(tpsa)值、降低血清游离睾酮值、降低qlq-c30量表评分、减轻患者临床症状、改善患者生活质量、显著改善中医临床症状。2、本发明的体外试验研究证明中药组合物具有显著杀伤激素非依赖性前列腺癌细胞的作用。选取pc-3细胞、du-145细胞进行了体外实验,实验结果表明中药组合物能显著抑制激素非依赖性前列腺癌细胞的增殖、侵袭、转移。3、本发明的中药组合物的药理作用强,用于预防、缓解和/或治疗前列腺类疾病的功效显著,毒副作用小、安全性好,能够长期服用,且可用现代药理学分析其抗肿瘤的作用机理,具药用前景。4、本发明的产品原料来源丰富、价廉、临床使用安全,制备工艺简单,且服用量小,使用方便,因此易于推广。附图说明图1是两组患者治疗前后不同时间段的tpsa值的比较情况图。图2是两组患者治疗前后不同时间段血清游离睾酮变化情况图。图3是两组患者治疗前后不同时间段qlq-c30量表评分变化情况图。图4是不同中药汤剂浓度对pc-3细胞的抑瘤率图。具体实施方式下面结合具体实施例,进一步阐述本发明。但这些实施例仅限于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体实验条件的实验方法,通常按照常规条件,或按照厂商所建议的条件。以下通过试验例来进一步阐述本发明所述中药组合物的预防/治疗去势抵抗性前列腺癌的作用,这些试验例包括了本发明中药组合物的药效学试验。本发明采用临床疗效观察、体外试验来验证中药组合物预防/治疗去势抵抗性前列腺癌的作用。试验例1临床疗效观察1、研究对象选取中国天津中医药大学第一附属医院肿瘤科2012年1月至2016年6月的门诊及住院患者,明确诊断为去势抵抗性前列腺癌患者,符合诊断及纳入标准,年龄18-80岁,自愿接受观察治疗。收集符合纳入标准的去势抵抗性前列腺癌患者240例,将患者随机分为对照组(维持去势水平组)和治疗组(在对照组的基础上予口服“健脾利湿化瘀方”联合治疗),每组各120例。2组病例在病程、年龄分布等方面均无显著性差异,具有可比性。2、治疗方法对照组治疗方法:采用西医的标准治疗方法进行,具体如下:①不伴转移的crpc(去势抵抗性前列腺癌,m0):定期评估的基础上调整内分泌治疗。可根据患者情况选用第一代抗雄激素药物(氟他胺、比卡鲁胺)、雌莫司汀、类固醇激素治疗或抗雄激素撤退治疗;对于部分患者,在其充分知情的前提下可考虑实施局部治疗手段,如减瘤性前列腺切除术或针对前列腺的放疗。②无疼痛或轻微疼痛症状的转移性crpc:单纯去势:加用或换用第一代抗雄激素药物或皮质类固醇类药物;已行联合雄激素阻断治疗的患者暂停用用抗雄激素药物,观察抗雄激素治疗撤药反应;阿比特龙1000mg(1次/d)联合泼尼松5mg(2次/d);恩杂鲁胺160mg(1次/d);多西他赛75mg/m2(每3周1次)联合泼尼松5mg(2次/d)。③伴有显著疼痛症状的转移性crpc:多西他赛75mg/m2(每3周1次)联合泼尼松5mg(2次/d);阿比特龙1000mg(1次/d)联合泼尼松5mg(2次/d);恩杂鲁胺160mg(1次/d)。④骨相关治疗:支持治疗:每4周应用唑来膦酸4mg预防骨相关事件发生。治疗组的治疗方法:患者在对照组的基础上给予口服“健脾利湿化瘀方”汤剂,进行联合治疗,即对患者既采用西医的标准方法进行治疗,同时还口服本发明实施例3制备的汤药,每日1剂,每天2次,并停用其他药。3、观察指标和方法观察治疗前和治疗后第2、4、6、8周患者血液中总前列腺癌特异性抗原(tpsa)值、血清游离睾酮值(t),并由同一研究者按照欧洲癌症研究组织指定的癌症患者生命质量测定量表(eortcqlq-c30)对患者进行qlq-c30量表评分及按照中医临床症状评价标准对患者进行中医临床症状改善疗效评价。4、研究结果使用spss13.0软件包进行数据分析。计量数据以(±s)表示,组间比较采用t检验,前后对照资料采用配对t检验。计数资料运用卡方检验分析。等级资料采用秩和检验。p<0.05为统计学有差异,p<0.001为差异极显著。4.1中药组合物对crpc患者总前列腺癌特异性抗原(tpsa)值的影响对照组和治疗组患者总前列腺癌特异性抗原(tpsa)值测定结果如表1、图1所示。表1治疗前、治疗后tpsa值的比较(单位:ng/ml)(n=120)组别tpsa入组tpsa第2周tpsa第4周tpsa第6周tpsa第8周对照组46.22±16.6046.00±16.5041.88±13.4739.94±13.0738.46±13.86治疗组48.63±19.16□42.74±15.61▲30.37±10.88△33.58±15.71▼32.32±18.73▽与对照组相比△p、▼p、▽p均<0.05。治疗前,两组患者的tpsa值分别为:对照组46.2217±16.5953ng/ml、治疗组48.6273±19.15867ng/ml,*p=0.300>0.05,差异无统计学意义,具有可比性。两组患者经过不同治疗方案治疗2周后,两组tpsa均有所下降,但治疗组与对照组相比,▲p=0.117>0.05,差异无统计学意义。在治疗后第4周、第6周、第8周比较,两组tpsa值比较,△p=0.000、▼p=0.001、▽p=0.004均<0.05,差异具有统计学意义。本发明的中药组合物与标准西医治疗,能显著降低血液中总前列腺癌特异性抗原(tpsa)值,对总前列腺癌特异性抗原的表达有显著的抑制作用,与标准西医治疗联合用药,具有协同增效的作用,促进对肿瘤的杀伤作用。3.2中药组合物对去势抵抗性前列腺癌患者血清游离睾酮值的影响对照组和治疗组患者血清游离睾酮值测定结果如表2、图2所示。表2治疗前、治疗后血清游离睾酮变化情况(单位:ng/dl)(n=120)与对照组相比▼p、▽p均<0.01。治疗前,两组患者的血清游离睾酮水平相当□p=0.222>0.05,差异无统计学意义,具有可比性。两组患者经过不同治疗方案治疗后,第2周、第4周后,两组血清游离睾酮值比较均没有明显的变化,与各时间段对照组相比,▲p=0.704>0.05、△p=0.164>0.05,差异无统计学意义。但在治疗后第6周、第8周比较,两组▼p=0.002、▽p=0.000均<0.01,差异具有统计学意义。本发明的中药组合物与标准西医治疗,能显著降低血液中血清游离睾酮水平,对睾酮的合成有显著的抑制作用,与联合用药,具有协同增效的作用,促进对肿瘤的杀伤作用。3.3中药组合物对去势抵抗性前列腺癌患者qlq-c30量表评分的影响对照组和实验组患者qlq-c30量表评分测定结果如表3、图3所示。表3治疗前、治疗后不同时间段qlq-c30量表评分变化情况(n=120)组别治疗前治疗后第2周治疗后第4周治疗后第6周治疗后8周对照组70.55±19.0974.23±21.8173.56±16.5677.33±20.6580.41±21.00治疗组73.18±19.04□78.55±21.10▲74.75±16.91△75.62±22.07▼65.89±18.68▽与对照组相比▽p<0.01。治疗前,两组患者的qlq-c30量表评分比较,□p=0.287>0.05,差异无统计学意义,具有可比性。治疗后第2周、第4周、第6周,两组qlq-c30量表评分比较,▲p=0.120、△p=0.582、▼p=0.536均>0.05,差异无统计学意义。而在治疗第8周,两组患者qlq-c30量表评分比较,▽p=0.000<0.01,差异具有统计学意义。本发明的中药组合物与标准西医治疗联合用药,具有协同增效的作用,降低患者的qlq-c30量表评分,提高患者的生活质量。3.4中药组合物对去势抵抗性前列腺癌患者中医症状改善的影响根据前列腺癌的中医临床症状评价标准,由同一研究者按照中医临床症状评价标准对患者治疗前、治疗后进行评分,治疗前后症状总积分情况比较(疗前/疗后):显效:症状消失,或症状积分减少≥2/3;有效:症状减轻,积分减少≥1/3,≤2/3;无效:症状无减轻或减轻<1/3。对照组和治疗组患者中医症状改善测定结果如表4所示。表4两组在治疗后基于中医症状改善的疗效评价(n=120)组别显效有效无效改善率对照组4例(3.45%)15例(12.07%)101例(84.48%)15.52%治疗组23例(18.97%)56例(46.55%)41例(34.48%)65.52%△△与对照组相比△△p<0.05。在治疗后第8周,基于中医症状改善情况进行疗效评价,对照组中医临床症状改善的有效率为15.52%,而治疗组中医临床症状改善的有效率为65.52%,△△p<0.05,差异具有统计学意义。试验结果表明,中药组合物能在治疗后4周、第6周、第8周降低去势抵抗性前列腺癌患者的tpsa值,且与对照组相比较具有统计学差异(p<0.05);中药组合物能在在治疗后第6周、第8周降低去势抵抗性前列腺癌患者的血清游离睾酮值,且与对照组相比较具有显著统计学差异(p<0.01);中药组合物在治疗第8周,两组患者qlq-c30量表评分比较,具有显著统计学差异(p<0.01);中药组合物在治疗后第8周改善中医症状,且与对照组相比较具有统计学差异(p<0.05)。本发明的中药组合物与标准西医治疗联合用药,具有协同增效的作用,降低患者的中医症状评分,改善患者中医症状,提高患者的生活质量。试验例2体外实验1试验材料1.1实验细胞株实验所应用的pc-3细胞株(atcc公司,批号crl-1435)。1.2试剂与药品受试药物:本发明实施例3制备的健脾利湿化瘀汤剂(1g生药/ml);“健脾利湿化瘀方”汤剂(黄芪、刺五加、补骨脂、姜黄、王不留行、炙甘草)(中药汤剂由天津中医药大学中药炮制实验室熬制)。采用回流提取法熬制并浓缩至1g/ml。中药用高糖dmem培养基配成100mg/ml溶液,分装备用。0.25%的胰酶。0.5m的四乙酸二氨基乙烯(edta)。青、链霉素液。胎牛血清(gibco);l-谷氨酰胺;完全高糖dmem培养基(lifetechnologies);磷酸缓冲液(pbs):70%乙醇;bd,354480);cck-8试剂盒(默沙克)。1.3仪器、设备超净工作台(苏州净化设备有限公司);co2细胞培养箱(thermo311型);倒置荧光显微镜(nikontiu);高速低温冷冻离心机(美国sigma公司);0.22μm无菌滤器(millipore公司);酸碱平衡仪(上海精密科学仪器公司);高压蒸汽灭菌锅(上海申安医疗器械厂);电热恒温干燥箱(北京实验设备厂);恒温培养振荡器(北京实验设备厂);电热恒温水槽(北京六一仪器厂);4℃冰箱/-20℃冰箱/-80℃冰箱(美国revco公司);移液器(thermo公司);离心管(50ml)、细胞培养皿(美国bigco公司);一次性细胞培养皿(上海晶睿生物科技有限公司);电子天平(qhaus公司)。2实验方法将本发明中药组合物用高糖dmem培养基配成100mg/ml中药组合物溶液,分装备用。取指数期人前列癌pc-3细胞待生长至近融合状态,用0.25%的胰蛋白酶液消化,吸管反复吹打成单细胞悬液,计数板计数,配成10000个/ml的细胞悬液后,将细胞按4000个/孔接种于96孔板,含10%胎牛血清的rpmi-1640培养基中,置于37℃、5%co2培养箱培养24h;第二天,将中药组合物溶液10000rpm离心5min,取上清用0.22μm过滤器除菌,用培养基稀释成梯度浓度(200μg/ml、400μg/ml、600μg/ml、800μg/ml、1000μg/ml、1200μg/ml)的溶液,加入96孔板,200μl每孔,每个浓度重复6孔,培养48h;48h后,每个浓度取4孔加入20μlcck-8溶液,留2孔作为阴性对照,37℃孵育4h,于酶标仪测定波长450nm处各孔的光密度值(od值),并下列按公式计算细胞生长抑制率:抑制率(%)=(1-实验od值/对照od值)×100%,每次实验共重复3次,减少实验误差,并分别以各组浓度(concentration/μg/ml)横轴,以抑制率(inhibitionrate)为纵轴描绘各组pc-3细胞的生长抑制曲线。3实验结果“健脾利湿化瘀方”汤剂对pc-3细胞有显著抑制作用不同浓度“健脾利湿化瘀方”汤剂对pc-3细胞的抑制率测定结果如表5、图4所示。表5本发明中药组合物不同浓度对pc-3细胞的抑制率(%)组间比较,p<0.05,表示差异具有统计学意义。不同浓度的中药汤剂对pc-3细胞增殖的作用,结果细胞增殖均呈现不同程度的抑制。与未加药干预对照组相比,不同浓度组中药汤剂处理细胞48h后,各处理组od值均呈现出不同程度的下降,且随着中药汤剂的处理浓度的增大,od值也逐渐下降,即中药汤剂对pc-3细胞的增殖抑制作用有明显的剂量-效应依赖关系。根据公式:抑制率(%)=(1-实验od值/对照od值)×100%,计算出的细胞生长抑制率逐渐增大,亦呈现此种剂量-效应依赖关系。与对照组相比,不同浓度组的中药汤剂对pc-3细胞抑制率差异均具有统计学意义(p<0.05)。综上所述:中药组合物联合去雄治疗方案组能更进一步的降低患者总前列腺癌特异性抗原(tpsa)值、降低血清游离睾酮值、降低qlq-c30量表评分、显著改善中医临床症、减轻患者临床症状、改善患者生活质量。本发明的中药组合物抑制激素非依赖性前列腺癌pc-3细胞增殖作用强。因此,可以确定中药组合物具有显著的抗去势抵抗性前列腺癌肿瘤的作用,可以用作预防/治疗去势抵抗性前列腺癌的药物。实施例11)按照以下配比称取原料(单位:×100g)生黄芪30、补骨脂15、刺五加15、姜黄15、王不留行8、炙甘草8,其中,将生黄芪、补骨脂、刺五加、姜黄、王不留行、炙甘草分别粉碎成粗粉后,混合均匀,制成粗粉混合物后备用;2)将混合均匀的粗粉混合物置于中药提取罐中,加入自来水浸泡2小时(通常为1-3h),其中加入的自来水的重量与粗粉混合物的重量之比为6:1(通常为5-10:1);3)开启提取罐电源进行加热,加热至100℃,保持在此温度下恒温提取45min(通常为30-120min),然后过滤,得到第一次提取液备用;4)向滤渣中加入自来水,加入的自来水的重量与粗粉混合物的重量之比为3:1(通常为3-7:1),加热提取,加热温度为100℃,提取时间为30min(通常为20-90min),过滤得到第二次提取液;5)将2次提取液合并后置于三效真空高能蒸发浓缩罐内,进行浓缩处理,浓缩的相对压力为-0.07mpa,温度为80℃;浓缩得到相对密度为1.1的浸膏;6)浓缩浸膏进行干燥(通常为真空干燥),粉碎处理,得到本发明的药物组合物粉末,然后向药物组合物粉末中加入辅料淀粉,乙醇制粒,干燥,压制成本发明药物组合物片剂。实施例21)按照以下配比称取原料(单位:×100g)生黄芪20、补骨脂10、刺五加20、姜黄20、王不留行6、炙甘草6,其中,将生黄芪、补骨脂、刺五加、姜黄、王不留行、炙甘草分别粉碎成粗粉后,混合均匀,制成粗粉混合物后备用;步骤2)-5)与实施例1相同;6)对浸膏进行干燥(通常为真空干燥)处理,干燥后的固体进行粉碎,得到本发明的药物组合物粉末。实施例31)按照以下配比称取原料(单位:×100g)生黄芪30、补骨脂10、刺五加10、姜黄15、王不留行15、炙甘草10,其中,将生黄芪、补骨脂、刺五加、姜黄、王不留行、炙甘草分别粉碎成粗粉后,混合均匀,制成粗粉混合物后备用;2)将混合均匀的粗粉混合物置于中药提取罐中,加入自来水浸泡2小时,其中加入的自来水的重量与粗粉混合物的重量之比为8:1(通常为5-10:1);3)开启提取罐电源进行加热,加热至100℃,保持在此温度下恒温提取60min(通常为30-120min),然后过滤,得到第一次提取液备用;4)向滤渣中加入自来水,加入的自来水的重量与粗粉混合物的重量之比为6:1(通常为3-7:1),加热提取,加热温度为100℃,提取时间为60min(通常为20-90min),过滤得到第二次提取液;5)将2次提取液合并后置于三效真空高能蒸发浓缩罐内,浓缩的相对压力为-0.07mpa,温度为80℃,浓缩至浓缩液的重量与原料药材的总重量之比为1:1,即浓缩液的总重量为8.6kg,原料药材的总重量为8.6kg,制得本发明的药物组合物汤剂。实施例41)按照以下配比称取原料(单位:×100g)生黄芪40、补骨脂10、刺五加20、姜黄10、王不留行6、炙甘草10,其中,将生黄芪、补骨脂、刺五加、姜黄、王不留行、炙甘草分别粉碎成粗粉后,混合均匀,制成粗粉混合物后备用;2)将混合均匀的粗粉混合物置于中药提取罐中,加入自来水浸泡1小时,其中加入的自来水的重量与粗粉混合物的重量之比为10:1(通常为5-10:1);3)开启提取罐电源进行加热,加热至100℃,保持在此温度下恒温提取30min(通常为30-120min),然后过滤,得到第一次提取液备用;4)向滤渣中加入自来水,加入的自来水的重量与粗粉混合物的重量之比为3:1(通常为3-7:1),加热提取,加热温度为100℃,提取时间为90min(通常为20-90min),过滤得到第二次提取液;5)将2次提取液合并后置于三效真空高能蒸发浓缩罐内,进行浓缩处理,浓缩的相对压力为-0.07mpa,温度为80℃;浓缩得到相对密度为1.3的浸膏;6)浓缩浸膏进行干燥(通常为真空干燥),粉碎处理,得到本发明的药物组合物粉末,然后向药物组合物粉末中加入辅料微晶纤维素,乙醇制粒,干燥,制得本发明药物组合物颗粒剂。实施例51)按照以下配比称取原料(单位:×100g)生黄芪15、补骨脂5、刺五加10、姜黄30、王不留行5、炙甘草15,其中,将生黄芪、补骨脂、刺五加、姜黄、王不留行、炙甘草分别粉碎成粗粉后,混合均匀,制成粗粉混合物后备用;2)将混合均匀的粗粉混合物置于中药提取罐中,加入自来水浸泡1小时,其中加入的自来水的重量与粗粉混合物的重量之比为5:1(通常为5-10:1);3)开启提取罐电源进行加热,加热至100℃,保持在此温度下恒温提取120min(通常为30-120min),然后过滤,得到第一次提取液备用;4)向滤渣中加入自来水,加入的自来水的重量与粗粉混合物的重量之比为7:1(通常为3-7:1),加热提取,加热温度为100℃,提取时间为40min(通常为20-90min),过滤得到第二次提取液;5)将2次提取液合并后置于三效真空高能蒸发浓缩罐内,进行浓缩处理,浓缩的相对压力为-0.07mpa,温度为80℃;浓缩得到相对密度为1.2的浸膏;6)浓缩浸膏进行干燥(通常为真空干燥),粉碎处理,得到本发明的药物组合物粉末,然后向药物组合物粉末中加入辅料淀粉,乙醇制粒,干燥,制成颗粒,加入微粉硅胶,混匀,装入空胶囊壳,制得本发明药物组合物胶囊剂。实施例61)按照以下配比称取原料(单位:×100g)生黄芪60、补骨脂30、刺五加25、姜黄5、王不留行15、炙甘草5,其中,将生黄芪、补骨脂、刺五加、姜黄、王不留行、炙甘草分别粉碎成粗粉后,混合均匀,制成粗粉混合物后备用;2)将混合均匀的粗粉混合物置于中药提取罐中,加入自来水浸泡1小时,其中加入的自来水的重量与粗粉混合物的重量之比为7:1(通常为5-10:1);3)开启提取罐电源进行加热,加热至100℃,保持在此温度下恒温提取60min(通常为30-120min),然后过滤,得到第一次提取液备用;4)向滤渣中加入自来水,加入的自来水的重量与粗粉混合物的重量之比为5:1(通常为3-7:1),加热提取,加热温度为100℃,提取时间为20min(通常为20-90min),过滤得到第二次提取液;5)将2次提取液合并后置于三效真空高能蒸发浓缩罐内,进行浓缩处理,浓缩的相对压力为-0.07mpa,温度为80℃;浓缩得到相对密度为1.2的浸膏;6)浓缩浸膏进行干燥(通常为真空干燥),粉碎处理,得到本发明的药物组合物粉末,然后向药物组合物粉末中加入辅料微晶纤维素,乙醇制粒,干燥,制得本发明药物组合物颗粒剂。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1