一种体外控释药物及其制备方法与流程
本发明涉及一种体外控释药物靶向释放技术,具体涉及一种红外激光体外控释药物。
背景技术:
化学药物治疗已成为治疗人类疾病的重要途经。但目前市面上绝大多数药物,靶向性不佳,目标器官蓄积能力较差,使得治疗效果不尽如人意。如何高效地将治疗药物递送入目标器官,提高药物在治疗部位的浓度,降低其在正常组织中的浓度,成为制药领域研究的热点。
技术实现要素:
本发明的目的是为了解决现有技术中存在的缺陷,提供一种能够有效进行体外控制药物靶向释放的体系。
为了达到上述目的,本发明提供了一种体外控释药物,该体外控释药物采用红细胞为载体,其内包载有目标药物及红外荧光染料。
其中,目标药物可采用抗肿瘤药物;红外荧光染料优选采用icg(吲哚菁绿)。
目标药物优选dox(阿霉素);红细胞内包载dox的药物包载量为345.0-780.0mg/1010红细胞;所述红细胞内包载icg的染料包载量为22.0-38.0mg/1010红细胞。
本发明还提供了上述体外控释药物的制备方法,包括以下步骤:
(1)红细胞采集;
(2)采用低渗-重封闭法进行红细胞包载dox;
(3)将包载有dox的红细胞进行icg包载。
其中,步骤(2)中红细胞包载dox的具体过程如下:
a、制备红细胞悬浮液和dox溶液:采用ph值为7.4的pbs溶液制备50%v/v红细胞悬浮液,备用;将dox溶解于ph值为7.2-7.4的pbs溶液,制备得到dox溶液备用,其中dox浓度为1mg/ml;
b、低渗:将红细胞悬浮液重悬于dox溶液中,红细胞悬浮液与dox溶液的体积比为1:1-4;然后将混合后的悬浮液置于截留分子量为14kda的透析袋中,并在4℃下与低渗缓冲液放置4-12h;所述低渗缓冲液中含有:15mmnah2po4·2h2o,15mmnahco3,2mmatp,3mm还原型谷胱甘肽,20mm葡萄糖,5mmnacl,72mosm/kg,ph8;
c、高渗:将透析袋转移到50ml的再密封缓冲液中在37℃下放置30分钟;所述再密封缓冲液中含有:250mmnacl,12.5mm葡萄糖,12.5mm丙酮酸钠,12.5mm肌苷,12.5mmnah2po4·2h2o,0.63mm腺嘌呤,550mosm/kg,ph8;
d、等渗:在pbs缓冲液中洗涤两次以除去未包封的dox,获得包载dox的红细胞溶液,其中红细胞的体积浓度为1010-1013/ml。
步骤(3)中进行icg包载的具体过程如下:将包载有dox药物的红细胞溶液与icg溶液混合在pbs溶液中,超声5min,采用pbs溶液清洗未成功包载的icg,即得所述体外控释药物;所述icg溶液中icg的浓度为0.5mg/ml,icg溶液与包载有dox药物的红细胞溶液的比例为1:2-5。
本发明相比现有技术具有以下优点:
1、体外红外激光控制“靶向”释放:治疗药物释放实现体外控制释放,在体外采用激光器(808nm,0.1w-2.0w)对目标部位进行照射,从而实现控制药物释放的时间、部位及量,是治疗药物靶向释放到目标器官,提高肿瘤治疗效果,减少毒副作用研究成功的关键之一;
2、高载药量:利用天然良好载体——红细胞,实现治疗药物的高包载率,结合靶向释放,能够减少毒副作用的同时提高药物治疗效果;
3、良好的生物兼容性:克服了药物在体内弥散分布造成的对目标器官的伤害,也减少了药物被血液清除率的量,都是利用自身红细胞实现良好生物兼容性。
附图说明
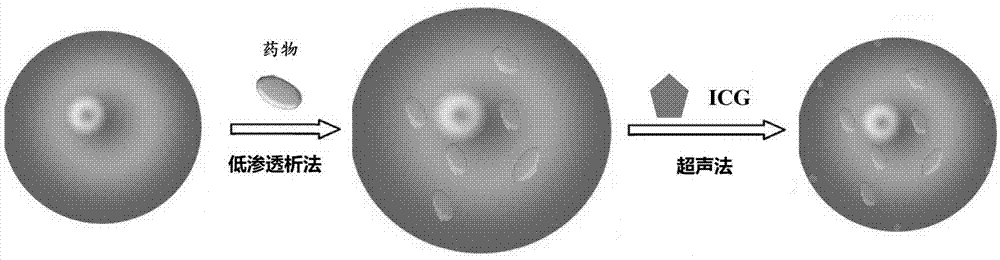
图1为本发明体外控释药物的制备流程图;
图2为本发明体外控释药物的tem表征图;
图3为本发明体外控释药物的靶向释放工作原理图;
图4为本发明体外控释药物在激光照射前后的对比图;
图5为本发明体外控释药物在激光照射前后的红细胞形态对比图;
图6为本发明体外控释药物随着激光照射时间变化,药物释放率变化曲线;
图7为本发明体外控释药物与dox单独给药应用于肿瘤靶向给药的对比示意图;
图4中,a为激光照射前,b为激光照射后;
图5中,off为激光照射前,on为激光照射后;
图7中,a为动物给药示意图,b为激光照射不同时间的活体成像对比图,c为体内器官聚集的活体成像对比图。
具体实施方式
下面结合附图对本发明进行详细说明。
如图1所示,本发明红外激光体外控释药物的具体制备过程如下:
1.红细胞包载目标药物
1.1红细胞采集
从sd大鼠心脏采集新鲜血液,并收集到抗凝管中。1200rpm离心10分钟,用pbs-7.4洗涤三次,去除红细胞以外的细胞。用pbs-7.4制备50%v/v细胞悬浮液并储存直至使用。
1.2红细胞低渗-重封闭法包载目标药物
将目标药物溶解与pbs,ph至7.2-7.4,本例中采用dox,配制溶液浓度为1mg/ml。使用低渗-重封闭法进行红细胞包载胰岛素。过程如下:
(1)低渗:将红细胞重悬于dox溶液中,红细胞与dox溶液的体积比为1:1,将所得悬浮液置于透析袋(14kda)中,并在4℃下与低渗缓冲液(15mmnah2po4·2h2o,15mmnahco3,2mmatp,3mm还原型谷胱甘肽,20mm葡萄糖,5mmnacl,72mosm/kg,ph8),放置8h。
(2)高渗:将透析袋转移到50ml的再密封缓冲液(250mmnacl,12.5mm葡萄糖,12.5mm丙酮酸钠,12.5mm肌苷,12.5mmnah2po4·2h2o,0.63mm腺嘌呤,550mosm/kg,ph8)在37℃下30分钟。
(3)等渗:在pbs缓冲液中洗涤两次以除去未包封的dox,获得包载dox的红细胞溶液,其中红细胞的浓度为1012/ml。
2.红细胞包载icg
将包载dox的红细胞与icg溶液(pbs为溶剂,浓度为0.5mg/ml)混合(混合体积比1:5)在pbs溶液中,超声5min,pbs清洗未成功修饰的icg,即得到dox-icg-er。
对红细胞的载药量进行测定,其中dox的包载量为547.7mg/1010红细胞;所述红细胞内包载icg的染料包载量为29.2mg/1010红细胞。
3.靶向释放研究
(1)采用激光共聚焦显微镜观察激光器(808nm,1w/分钟)照射2分钟后,溶液中icg荧光的变化及红细胞的形态变化。
(2)激光器(808nm,1w/分钟)照射不同时间,溶液中h2o2浓度的变化(3)激光器(808nm,1w/分钟)照射不同时间,目标药物(本次以dox为研究对象)的释放情况。
4.动物试验
(1)肿瘤模型的建立:健康balb/c裸鼠10只,雌雄不限,4~6周龄,体重20~25g,无菌环境下饲养,由南通大学动物中心提供。hela细胞用rpmi1640培养液培养。细胞铺满瓶底80%以上时,以0.25%胰蛋白酶-0.02%edta消化细胞1min,用含10%小牛血清的rpmi1640培养液吹打分散细胞,1000r/min离心5min,离心半径为5cm。弃上清,以pbs调整细胞数量,2×106/0.2ml,将细胞接种于裸鼠臀部皮下,10d后肿瘤逐渐长出。
(2)荷瘤动物活体成像:将荷瘤小鼠分为2组,每组5只,分别经尾静脉注射dox-icg-er和游离icg染料(icg剂量为5μg),注射后间隔不同时间(5min,30min,60min)对2组动物进行活体成像。6h后将动物人道处死,取心、肝、肺、肾及肿瘤进行离体成像。
4.结果:
4.1实验设计示意图
如图1所示为红细胞载药及icg的制备过程。
如图2所示为dox-icg-er的tem表征图,包载药物后,红细胞能够保持其双凹圆盘结构。
如图3所示dox-icg-er体外控制释放示意图。在体外采用激光808nm进行照射,icg被激发会产生h2o2,红细胞内的h2o2增高,导致红细胞膜上孔道打开,释放药物。
4.2体外试验结果
在体外模拟控制释放情况,如图4、5所示。
如图4所示,激光照射前,icg均在红细胞内部,激光照射后,icg导致红细胞破裂。
如图5所示,激光照射前,单个红细胞状态,呈现双凹圆盘形,激光照射后,红细胞表面孔道打开,内部的药物及icg均释放出来。
如图6所示,激光照射与药物释放的关系:随着激光照射时间的增加,药物释放率逐渐增大。
4.3动物试验
将荷瘤小鼠分成2组,对照组注射dox,药物组注射本发明icg-er包载dox的dox-icg-er。
结果如图7所示:图a给药示意图;图b5min,30min,60min的活体成像图,在肿瘤部位激光照射5min,dox-icg-er能够在肿瘤部位聚集。图c6h后,人道主义处死动物,取出动物的重要脏器,成像。可以看出dox-icg-er在肿瘤部位聚集的dox量要大于单独dox组。
- 还没有人留言评论。精彩留言会获得点赞!