SLFN5或SLFN5促进剂在制备肺癌治疗药物中的用途的制作方法
本发明属于生物医药研发领域,具体涉及slfn5或slfn5促进剂在制备肺癌治疗药物中的用途。
背景技术:
数据显示2017年全国恶性肿瘤中原发性非小细胞肺癌发病率和死亡率均排第一位,肺癌严重威胁人类健康。目前针对肺癌的治疗手段主要是根据肺癌的分期采取相应的手术切除、egfr单抗的靶向性治疗结合顺铂等化学药物以及中药治疗。肺癌致死的主要原因是癌细胞侵袭转移到其他的组织器官而无法进行手术切除。目前肺癌单抗药物仅作用于增殖靶点,因此寻找既作用于增殖又同时作用于侵袭转移的靶点药物是未来的药物开发方向。slfn5基因是schlafen(slfn)家族的成员,表达产生蛋白质产物。目前关于slfn5基因及其蛋白的功能作用报道极少,主要限于抑制免疫细胞的活性和抑制黑素瘤和肾透明细胞癌的侵袭能力的报道。目前尚没有slfn5在肺癌中的表达情况以及对于肺癌的增殖、凋亡、侵袭、转移功能的研究报道。
技术实现要素:
本发明要解决的技术问题是针对现有技术存在的不足,提供slfn5或slfn5促进剂在制备肺癌治疗药物中的用途,slfn5用于抑制肺癌细胞的增殖,促进其凋亡,抑制其迁移、侵袭,从而发挥抑制肺癌迁移和侵袭转移的作用。为了实现上述目的,本发明采用的技术方案如下:
根据本发明的一方面,提供的slfn5或slfn5促进剂在制备肺癌治疗药物中的用途。
在一种实施方式中,所述肺癌为原发性非小细胞癌,所述肺癌治疗药物至少具有以下功用之一:
(1)、抑制肺癌细胞的增殖;
(2)、促进肺癌细胞的凋亡;
(3)、抑制肺癌细胞的迁移;
(4)、抑制肺癌细胞的侵袭;
(5)、减少肺癌细胞侵袭数;
(6)、降低肺癌细胞侵袭深度;
(7)、抑制snail表达;
(8)、抑制mt1-mmp表达。
上述方案中的肺癌治疗药物,slfn5促进剂是指提高slfn5水平的物质。
具体地,所述提高slfn5水平可以采用各种化学、物理、生物的方法。
包括但不限于:
(1a)、调节slfn5通路以提高slfn5水平;
(2a)、于肺癌细胞内直接增加slfn5水平。
可将slfn5或slfn5模拟物递送至肺癌细胞内直接增加肺癌细胞内slfn5水平,也可通过过表达slfn5的方式直接增加肺癌细胞内slfn5水平,调节slfn5通路可以是采用slfn5激动剂来提高slfn5活性或促进slfn5转录或表达,从而提高slfn5水平。提高slfn5活性是指使slfn5活性提高。优选地,相比提高前,slfn5活性提高至少10%,较佳的提高至少30%,再佳的提高至少50%,更佳的提高70%,最佳的提高至少90%。
上述方案中,促进slfn5转录或表达是指:使slfn5高表达,或者提高slfn5转录活性,本领域技术人员可以使用常规方法对slfn5转录或表达进行调控。
上述方案优选地,slfn5转录或表达至少提高至少10%,较佳的提高至少30%,再佳的提高至少50%,更佳的提高70%,最佳的提高至少90%。
本发明实施例已证实,通过过表达slfn5的方式,直接增加肺癌细胞内slfn5水平,可抑制肺癌细胞增殖、转移、侵袭、促进肺癌细胞凋亡、治疗肺癌。而基于现有技术可知,前述调节slfn5代谢通路的方法可上调slfn5水平。由此推知,前述调节slfn5代谢通路的方法亦可获得抑制肺癌细胞增殖、转移、侵袭、促进肺癌细胞凋亡、治疗肺癌的效果,进而认为这些方法亦可抑制肺癌细胞增殖、转移、侵袭、促进肺癌细胞凋亡、治疗肺癌。
所述肺癌治疗药物必然包括slfn5或slfn5促进剂,并以slfn5或slfn5促进剂作为前述功用的有效成分,在所述肺癌治疗药物中,发挥前述功用的有效成分可以仅为slfn5或slfn5促进剂,亦可包含其他可起到类似功用的分子。
上述方案的优选的,slfn5或slfn5促进剂为所述肺癌治疗药物的唯一有效成分或有效成分之一。
上述方案中,所述肺癌治疗药物可以为单成分物质,亦可为多成分物质。
上述方案中,所述肺癌治疗药物的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
上述方案中,所述肺癌治疗药物主要针对的对象为哺乳动物,如啮齿类动物、灵长类动物等。
根据本发明的第二方面,为向对象施用slfn5或slfn5促进剂,提供用于在治疗肺癌的用途,在该种实施方式中,所述肺癌为原发性非小细胞癌;
所述对象可以为哺乳动物。所述哺乳动物优选为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等,所述灵长目动物优选为猴、猿或人。
所述对象可以是罹患肺癌的患者或者期待预防或缓解肺癌的个体。或者可以是罹患肺癌的患者或者期待预防或缓解肺癌的个体的离体肺癌细胞。
在该种实施方式中,slfn5或slfn5促进剂可以在接受肺癌治疗前、中、后向对象施用。
根据本发明的第三方面,本发明提供一种肺癌治疗药物,包括有效剂量的slfn5或slfn5促进剂;在该实施方式中,所述肺癌为原发性非小细胞癌。
在该种实施方式中,所述肺癌治疗药物包括有效剂量的slfn5或slfn5促进剂及药用载体。
在该种实施方式中,所述肺癌治疗药物必然包括slfn5或slfn5促进剂,并以slfn5或slfn5促进剂作为前述功用的有效成分。
在该种实施方式中,所述肺癌治疗药物中,发挥前述功用的有效成分可仅仅为slfn5或slfn5促进剂,亦可包含其他可起到类似功用的分子。
在该种实施方式中亦即,slfn5或slfn5促进剂为所述肺癌治疗药物的唯一有效成分或有效成分之一。
上述方案中,所述肺癌治疗药物可以为单成分物质,亦可为多成分物质。
上述方案中,所述肺癌治疗药物的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
上述方案中,所述肺癌治疗药物主要针对的对象为哺乳动物,如啮齿类动物、灵长类动物等。
根据本发明的第四方面,提供一种肺癌治疗药物组合,包括有效剂量的slfn5或slfn5促进剂和至少一种其他肺癌治疗药物,在该种实施方式中,所述肺癌为原发性非小细胞癌,所述联合治疗药物组合可以是以下形式中的任意一种,所述联合治疗药物组合可以是以下形式中的任意一种:
一)、将slfn5或slfn5促进剂和其他肺癌治疗药物分别制成独立的制剂,制剂的剂型可相同或不同,给药途径亦可相同或不同;当其他肺癌治疗药物为抗体时,一般采用胃肠外给药型。当其他肺癌治疗药物为化学药物时,给药形式可以比较丰富,可以是胃肠道给药亦可以是非胃肠道给药。一般推荐针对各化学药物的已知给药途径给药。
二)、将slfn5或slfn5促进剂和其他肺癌治疗药物配置成复方制剂,在将slfn5或slfn5促进剂和其他肺癌治疗药物采用相同给药途径给药并同时施加时,可采用将两者配置成复方制剂的形式。
根据本发明的第五方面,为向对象施用有效量的slfn5或slfn5促进剂,以及向对象施用有效量的其他肺癌治疗药物和/或向对象实施其他肺癌治疗的用途或手段,在该种实施方式中,所述肺癌为原发性非小细胞癌。
在该种实施方式中,可以同步地或顺序地给予有效量的slfn5或slfn5促进剂和至少一种有效量的其他肺癌治疗药物。
在该种实施方式中,基于slfn5为本发明首次发现的肺癌治疗靶点,在与slfn5或slfn5促进剂以外的其他肺癌治疗药物联合用药中,至少可以起到疗效相加的效果,进一步增强对于肺癌的治疗效果。
在该种实施方式中,其他肺癌治疗药物包括但不限制于:抗体药物、化学药物或靶向型药物等。
在该种实施方式中,所述slfn5或slfn5促进剂以是胃肠道给药或者胃肠外给药,其他的肺癌治疗药物可以是胃肠道给药或者胃肠外给药。
根据本发明的第六方面,提供一种slfn5或slfn5促进剂在制备具有以下任一项或多项作用的物质中的用途:
(71)、slfn5或slfn5促进剂用于制备抑制肺癌细胞增殖的物质中的用途;
(72)、slfn5或slfn5促进剂用于制备促进肺癌细胞凋亡的物质中的用途;
(73)、slfn5或slfn5促进剂用于制备抑制肺癌细胞迁移的物质中的用途;
(74)、slfn5或slfn5促进剂用于制备抑制肺癌细胞侵袭的物质中的用途;
(75)、slfn5或slfn5促进剂用于制备减少肺癌细胞侵袭数的物质中的用途;
(76)、slfn5或slfn5促进剂用于制备降低肺癌细胞侵袭深度的物质中的用途;
(77)、slfn5或slfn5促进剂用于制备抑制snail表达的物质中的用途;
(78)、slfn5或slfn5促进剂用于制备抑制mt1-mmp表达的物质中的用途。
上述物质并不必然必须为药物,在上述实施方式中,所述肺癌为原发性非小细胞肺癌。
根据本发明的第七方面,提供slfn5在制备或筛选肺癌治疗药物中的用途,在该种实施方式中,slfn5作为作用靶标,在该中实施方式中,所述用途具体是指:将slfn5作为作用靶标,对候选物质进行筛选,以找到slfn5促进剂,作为备选的肺癌治疗药物。
综上所述,本发明由于采用了以上技术方案,有益效果在于:
本发明经过广泛而深入的研究发现,slfn5能够抑制肺癌细胞的增殖,促进其凋亡,抑制其迁移、侵袭,并且发现slfn5是通过抑制转录因子snail的表达进而抑制细胞膜锚定型基质金属蛋白酶mt1-mmp的表达从而发挥抑制肺癌迁移和侵袭转移的作用,为临床上肺癌的治疗提供的新的靶点与思路。
附图说明
为了更清楚地说明本发明实例或现有技术中的技术方案,下面将对实施实例或现有技术描述中所需要的附图做简单地介绍,显然,下面描述中的附图仅仅是本发明的一些实例,对于本领域普通技术人员来说,在不付出创造性的前提下,还可以根据这些附图获得其他的附图。
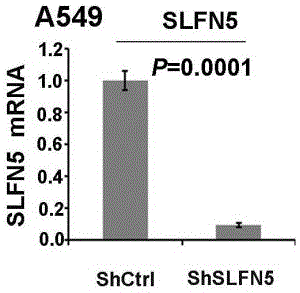
图1a:real-timepcr方法检测mrna水平shslfn5敲减效果;
图1b:westernblotting方法检测蛋白水平shslfn5敲减效果;
图2a:运用slfn5的特异性shrna(shslfn5)敲减slfn5,与对照shrna相比,shslfn5组细胞计数,第5、6、7天都明显增加,统计学分析均有显著差异(p<0.05);
图2b:运用cck8试剂盒检测两组增殖,结果显示shctrl组细胞增殖明显低于shslfn5组,统计学分析有显著差异(p<0.05);
图2c:荧光二抗染色分析,结果显示shctrl组细胞ki67明显低于shslfn5组;
图2d:ki-67免疫细胞化学染色:荧光二抗染色分析,结果显示shctrl组细胞ki67明显低于shslfn5组,统计学分析有显著差异(p<0.001);
图2e:克隆化实验检测,结果显示shctrl组细胞增殖明显低于shslfn5组;
图2f:克隆化实验检测,结果显示shctrl组细胞增殖明显低于shslfn5组,统计学分析有显著差异(p<0.05);
图3a:构建slfn5表达载体,转染a549细胞,筛选slfn5稳转细胞slfn5系(slfn5),与转染对照空载体(vector)相比,slfn5组细胞计数,第5、6、7天都明显低于vector组,统计学分析均有显著差异(p<0.05);
图3b:运用cck8试剂盒检测两组增殖,结果显示slfn5组细胞增殖明显低于vector组,统计学分析有显著差异(p<0.05);
图3c:荧光二抗染色分析,结果显示slfn5组细胞ki67明显低于vector组;
图3d:荧光二抗染色分析,结果显示slfn5组细胞ki67明显低于vector组,统计学分析有显著差异(p<0.001);
图3e:克隆化实验检测,结果显示slfn5组细胞增殖明显低于vector组;
图3f:克隆化实验检测,结果显示slfn5组细胞增殖明显低于vector组,统计学分析有显著差异(p<0.01);
图4a:tunel检测敲减slfn5对a549凋亡的影响;
图4b:tunel检测过表达slfn5对a549凋亡的影响;
图4c:流式细胞术检测敲减slfn5对a549凋亡的影响;
图4d:流式细胞术检测过表达slfn5对a549凋亡的影响;
图5a:敲减slfn5的细胞组迁移穿过小室膜底部的细胞数明显高于对照组,统计学比较二者有显著性差异(p<0.05)
图5b:侵袭实验观察发现,敲减slfn5的细胞组侵袭穿过matrigel到达底部的细胞数明显高于对照组,统计学比较二者有显著性差异(p<0.01);
图5c:敲减slfn5的细胞与对照组细胞预先荧光染色后放置在鸡胚绒毛尿囊膜上,冰冻切片,观察到对照组细胞未侵袭绒毛尿囊膜,而敲减slfn5的细胞(shslfn5)侵袭穿过绒毛尿囊膜,深入到鸡胚之内;
图5d:敲减slfn5的细胞与对照组细胞预先荧光染色后放置在鸡胚绒毛尿囊膜上,冰冻切片,观察到对照组细胞未侵袭绒毛尿囊膜,而敲减slfn5的细胞(shslfn5)侵袭穿过绒毛尿囊膜,深入到鸡胚之内,侵袭细胞数和侵袭深度与对照组比较都明显增加;
图5e:过表达slfn5的细胞放置在鸡胚绒毛尿囊膜上,冰冻切片染色,观察到对照组(vector)侵袭穿过绒毛尿囊膜,而过表达slfn5的细胞未侵袭穿过绒毛尿囊膜,与对照组相比,过表达slfn5组细胞侵袭细胞数和侵袭深度都明显低于对照组细胞;
图5f:过表达slfn5的细胞放置在鸡胚绒毛尿囊膜上,观察到对照组(vector)侵袭穿过绒毛尿囊膜,而过表达slfn5的细胞未侵袭穿过绒毛尿囊膜,与对照组相比,侵袭细胞数和侵袭深度都明显低于对照组细胞,统计学分析有显著差异(p<0.001);
图6a:发现slfn5对snail表达有抑制作用;
图6b:发现slfn5对snail表达有抑制作用;
图6c:发现slfn5对snail表达有抑制作用;
图6d:slfn5敲减促进mt1-mmp的mrna表达;
图6e:slfn5敲减促进mt1-mmp蛋白的表达;
图6f:slfn5敲减促进mt1-mmp蛋白的表达;
图6g:验证mt1-mmpsirna的敲减效果;
图6h:验证mt1-mmpsirna的敲减效果;
图6i:验证mt1-mmpsirna的敲减效果;
图6j:在shrna敲减slfn5的稳转细胞系(slfn5-sh)中进一步敲减mt1-mmp,发现敲减mt1-mmp能显著降低a549细胞的迁移能力;
图6k:在shrna敲减slfn5的稳转细胞系(slfn5-sh)中进一步敲减mt1-mmp,发现敲减mt1-mmp能显著降低a549细胞的迁移能力;
图6l:在shrna敲减slfn5的稳转细胞系(slfn5-sh)中进一步敲减mt1-mmp,发现敲减mt1-mmp能显著降低a549细胞的侵袭能力;
图6m:在shrna敲减slfn5的稳转细胞系(slfn5-sh)中进一步敲减mt1-mmp,发现敲减mt1-mmp能显著降低a549细胞的侵袭能力。
具体实施方式
下面将结合本发明实例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
根据本发明的slfn5或slfn5促进剂在制备肺癌治疗药物中的用途,本发明研究发现人slfn5能够抑制肺癌细胞的增殖,促进其凋亡,抑制其迁移、侵袭,并且发现slfn5是通过抑制转录因子snail的表达进而抑制细胞膜锚定型基质金属蛋白酶mt1-mmp的表达从而发挥抑制肺癌迁移和侵袭转移的作用。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning《分子克隆》:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology《现代分子生物学常用方法》,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology《酶学研究方法》,academicpress,sandiego;wolffe,chromatinstructureandfunction《染色质结构与功能》,thirdedition,academicpress,sandiego,1998;methodsinenzymology《酶学研究方法》,vol.304,chromatin《染色质》(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology《分子生物学研究方法》,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
实施例1方法
1、细胞培养
肺癌细胞系a549购自美国atcc。dmem高糖培养基,10%fbs(购自四季青公司),100u氨苄青霉素,100μg/ml链霉素,37℃,5%co2培养箱培养。
2、rt-pcr以及realtime-pcr方法
用trizol提取细胞总rna,两步法逆转录合成cdna。设计特异引物,采用sybrgreenpcrmastermix(appliedbiosystems)进行real-timepcr测定各基因表达水平,rt-pcr及2%琼脂糖凝胶电泳进行产物长度及单一条带特异性验证,如表1所示。
表1
3、westernblot
提取细胞总蛋白,常规sds-page分离蛋白条带,转硝酸纤维素膜,5%脱脂奶粉封闭,一抗4℃孵育过夜、二抗室温1小时作用,ecl试剂化学发光,胶片曝光,蛋白条带定性分析、半定量分析。一抗:anti-slfn5(sigma)1:2,000,anti-snail(santacluz),anti-mt1-mmp(abcam)。二抗用相应的hrp耦联anti-mouse或anti-rabbit抗体(cellsignallingtechnology)。
4、shrna转染
设计合成人slfn5(nm144975.3)特异的shrna序列:
5`-auucguuggagucugaguc-3`(seqidno.7),与序列中535-537区域互补。gc含量相同的shrna为阴性对照,x-tremegenehp(roche)转染细胞。4h后细胞换液为全培养基,real-timepcr检测slfn5knockdown敲减效果,进行后续分子生物学和功能学实验。
5、慢病毒载体构建及a549稳转细胞系构建
细胞培养,提取总rna,逆转录获得cdna。参照nm144975.3序列设计引物,pcr方法扩增获得slfn5的开放阅读框架,上游引物序列为:5’-gaggatccccgggtaccggtcgccaccatgagtcttaggattgatgtggatac-3’(seqidno.8);
下游引物序列为:
5’-tccttgtagtccatacccacagaagccttcagaatatacagatg-3’(seqidno.9),pcr产物大小2717bp。
pcr产物经agei/agei酶切连接到lenti-virus载体gv358载体中(载体图谱:http://www.genechem.com.cn/zaiti.aspx?zt=gv358)。
载体元件顺序ubi-mcs-3flag-sv40-egfp-ires-puromycin,egfp原件带独立启动子。转染293t细胞,用荧光显微镜验证重组载体的表达水平,提取细胞蛋白进行westernblot验证slfn5的特异性表达。转染后第4天收集培养基上清,超滤浓缩后进行病毒滴度鉴定,滴度达到108可用于实验。
培养人肺癌细胞系a549细胞系,分别转染lenti-slfn5慢病毒和病毒空白对照,egfp流式筛选,构建稳定表达slfn5和空载体的细胞系。anti-slfn5(sigma)一抗,荧光二抗染色,荧光显微镜观察表达slfn5的细胞百分比。进行real-timepcr和westernblot,分别从mrna水平和蛋白水平进一步确定稳定转染细胞系构建成功。
6、细胞免疫荧光
4%多聚甲醛固定,0.1%tritonx-100透膜,5%山羊血清和3%bsa封闭,分别用一抗anti-slfn5、anti-ki67、anti-mt1-mmp室温孵育2小时,alexa488或alexa594标记的荧光二抗(invitrogen)室温孵育1小时,dapi复染细胞核,荧光显微镜或激光共聚焦扫描显微镜观察结果。
7、cck-8增殖检测
96孔板每孔加入100μl2000个细胞,每孔加入10μlcck-8溶液(碧云天)。没有加入细胞的孔作为空白对照。细胞培养箱内继续孵育2小时,用酶标仪检测450nm吸光度。
8、tunel检测
细胞用pbs洗涤,4%多聚甲醛固定细胞30分钟,0.3%tritonx-100的pbs室温孵育5分钟。在样品上加50μltunel检测液(碧云天),37℃避光孵育60分钟。pbs或hbss洗涤3次。用抗荧光淬灭封片液封片后荧光显微镜下观察。cy3的激发波长为550nm,发射波长为570nm(红色荧光)。
9、transwell小室迁移和侵袭实验
侵袭实验:制备matrigel基质胶与dmem混合体系,比例为1:3,冰上操作,每个小室上腔室中加入100μl预混体系,将小室放入24孔板中置于37℃恒温孵箱中,4h后待其凝固进行下一步实验,下一步实验同迁移实验步骤一致。
迁移实验:用胰酶消化a549细胞,用无fbs的dmem冲洗细胞三次后,利用细胞计数板进行细胞计数。用无fbs的dmem冲洗小室(购买自corning)3次,小室内加入细胞5x105,向下腔室中加入15%fbs的dmem培养基100μl。将载有transwell小室的24孔板放入37度孵箱中,放置24h。取出transwell用pbs清洗小室3次,用固定液(碧云天)固定10min。吸除固定液,用pbs清洗小室3次,用结晶紫(碧云天)染色5min。吸去结晶紫,pbs清洗小室3次,用酒精棉球擦去表面上的细胞。显微镜下进行观察拍摄。
10、鸡胚体内侵袭转移试验
将荧光标记的细胞种植在鸡胚绒毛膜尿囊膜上表面,孵育箱内放置3天。终止实验,4%多聚甲醛固定样本。iv型胶原抗体染色,dapi复染细胞核,荧光显微镜下观察,照相记录结果,统计分析侵袭细胞数量和侵袭深度。
实施例2结果
1、shrna敲减slfn5稳转细胞系敲减效果验证,运用slfn5特异的shrna转染a549细胞并筛选稳转细胞系(shslfn5),同时转染对照shrna的细胞构建稳转细胞系(shctrl):real-timepcr检测mrna水平敲减效果(如图1a);westernblotting检测蛋白水平敲减效果(如图1b),mrna水平和蛋白水平敲减效果都比较理想,可以用于后续实验研究。
2、slfn5shrna敲减实验发现slfn5能抑制肺癌细胞系a549的增殖:
(1)细胞计数方法:运用slfn5的特异性shrna(shslfn5)敲减slfn5,与对照shrna相比,shslfn5组细胞计数,第5、6、7天都明显增加,统计学分析均有显著差异(p<0.05),如图2a所示。
(2)cck8方法测试:运用cck8试剂盒检测两组增殖,结果显示shctrl组细胞增殖明显低于shslfn5组,统计学分析有显著差异(p<0.05),如图2b所示。
(3)ki-67免疫细胞化学染色:荧光二抗染色分析,结果显示shctrl组细胞ki67明显低于shslfn5组,统计学分析有显著差异(p<0.001),如图2c和图2d所示;shctrl组ki-67染色很弱,表示shctrl组ki67表达量明显低于shslfn5组,shctrl组细胞增殖能力弱,说明slfn5能够抑制肺癌细胞增殖。图shctrl组ki-67染色很弱,表示shctrl组ki67表达量明显低于shslfn5组,shctrl组细胞增殖能力弱,说明slfn5能够抑制肺癌细胞增殖。
(4)细胞克隆实验:克隆化实验检测,结果显示shctrl组细胞增殖明显低于shslfn5组,统计学分析有显著差异(p<0.05),如图2e和图2f所示。
3、过表达slfn5发现slfn5能抑制肺癌细胞系a549的增殖:
(1)细胞计数方法:构建slfn5表达载体,转染a549细胞,筛选slfn5稳转细胞slfn5系(slfn5),与转染对照空载体(vector)相比,slfn5组细胞计数,第5、6、7天都明显低于vector组,统计学分析均有显著差异(p<0.05),如图3a所示。
(2)cck8方法测试:运用cck8试剂盒检测两组增殖,结果显示slfn5组细胞增殖明显低于vector组,统计学分析有显著差异(p<0.05),如图3b。
(3)ki-67免疫细胞化学染色:荧光二抗染色分析,结果显示slfn5组细胞ki67明显低于vector组,统计学分析有显著差异(p<0.001),如图3c和图3d所示;通过表达slfn5组ki-67染色很弱,明显低于载体对照组,说明slfn5抑制细胞的增殖。
(4)细胞克隆实验:克隆化实验检测,结果显示slfn5组细胞增殖明显低于vector组,统计学分析有显著差异(p<0.01),如图3e和图3f所示。
4、slfn5促进肺癌细胞系a549的凋亡:
(1)tunel染色:细胞核用dapi染色,凋亡细胞tunel染色为红色,slfn5敲减组细胞的tunel染色明显低于对照组细胞,统计学分析有显著差异(如图4a所示,shctrl组细胞tunel染色呈现的白色亮点为凋亡阳性染色,而shslfn5组细胞未见白色亮点表明凋亡阴性)。而过表达slfn5组细胞的tunel染色均高于空载体对照组,统计学分析有显著差异(如图4b所示)。
(2)流式分析:slfn5敲减组细胞的早期凋亡率和晚期凋亡率均低于对照组细胞,统计学分析有显著差异(如图4c所示)。而过表达slfn5组细胞的早期凋亡率和晚期凋亡率均高于空载体对照组,统计学分析有显著差异(如图4d所示)。
5、slfn5抑制肺癌细胞系a549的迁移、侵袭能力:
(1)敲减slfn5小室迁移实验:敲减slfn5的细胞组迁移穿过小室膜底部的细胞数明显高于对照组,统计学比较二者有显著性差异(p<0.05),如图5a所示。
(2)敲减slfn5侵袭实验:侵袭实验观察发现,敲减slfn5的细胞组侵袭穿过matrigel到达底部的细胞数明显高于对照组,统计学比较二者有显著性差异(p<0.01),如图5b所示。
(3)敲减slfn5鸡胚体内侵袭实验:敲减slfn5的细胞(绿色荧光标记)放置在鸡胚绒毛尿囊膜上,冰冻切片,h&e染色和dapi细胞核染色,观察到对照组未侵袭绒毛尿囊膜,而敲减slfn5的细胞(shslfn5)侵袭穿过绒毛尿囊膜,深入到鸡胚之内,侵袭细胞数和侵袭深度与对照组比较都明显增加,统计学分析有显著差异(p≤0.001),如图5c和图5d所示。
(4)过表达slfn5抑制鸡胚体内侵袭实验,过表达slfn5的细胞(绿色荧光标记)放置在鸡胚绒毛尿囊膜上,冰冻切片,h&e染色和dapi细胞核染色,观察到对照组(vector)侵袭穿过绒毛尿囊膜,而过表达slfn5的细胞未侵袭穿过绒毛尿囊膜,与对照组相比,侵袭细胞数和侵袭深度都明显低于对照组细胞,统计学分析有显著差异(p<0.001),如图5e和图5f所示,图5e中的载体对照组中,白色箭头指示侵袭进入鸡胚内部的肺癌细胞,而slfn5组肺癌细胞未见侵袭进入鸡胚内部,表明slfn5能抑制侵袭。
6、发现了slfn5抑制侵袭的机制:
(1)snail是肺癌a549细胞侵袭转移通路中起调控作用的转录因子,我们发现slfn5对snail表达有抑制作用(如图6a、图6b和图6c所示)。
(2)snail作为转录因子抑制细胞锚定型基质金属蛋白酶mt1-mmp的表达。mt1-mmp分布在细胞膜上,降解细胞周围环境的基质成分,使得肿瘤细胞能够迁移和侵袭转移。其高表达是肿瘤细胞侵袭转移的直接促进因素。我们研究发现,slfn5抑制mt1-mmp表达(实验数据如图6j、图6k、图6l和图6m所示),表明slfn5抑制肺癌细胞a549侵袭转移的机制是通过抑制snail的表达,进而抑制其调控的下游蛋白mt1-mmp的表达,从而达到抑制肿瘤细胞侵袭转移的作用。
(3)实验数据如下:slfn5敲减促进mt1-mmp的mrna表达(如图6d所示)和蛋白质表达(如图6e和图6f所示);验证mt1-mmpsirna的敲减效果(图6g、图6h、图6i);在shrna敲减slfn5的稳转细胞系(slfn5-sh)中进一步敲减mt1-mmp,发现敲减mt1-mmp能显著降低a549细胞的迁移(如图6j和图6k所示)和侵袭能力(如图6l和图6m所示)。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本使用新型的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!