一种含有微球的可注射透明质酸钠凝胶的制备方法与流程
本发明属于医药领域领域,也属于美容用填充材料领域,具体涉及一种含有含有微球的可注射透明质酸钠凝胶的制备方法。
背景技术:
透明质酸,又叫玻璃酸,玻尿酸,是一种天然的多糖结构,由重复的d-葡萄糖醛酸和n-乙酰基葡萄糖通过β-1,3-糖苷键构成的双糖结构组成,广泛存在于动物细胞间质中,是肌肤水嫩的重要基础物质,具有强大的吸水性及特殊的保水作用,是目前发现的自然界中保湿性最好的物质,被称为理想的天然保湿因子,另外,透明质酸还可以改善皮肤营养代谢,使皮肤柔嫩、光滑、去皱、增加弹性、防止衰老,在保湿的同时又是良好的透皮吸收促进剂,与其他营养成分配合使用,可以起到促进营养吸收的更理想效果。
自1950年发现该产品至今,透明质酸广泛的应用于医疗、美容领域,因其重要的保湿作用和形成的凝胶具有特殊的粘弹性,且生物适应性好,降解后易被人体吸收,保持肌肤水嫩,在美容行业主要应用于塑形,填充脸部或填充凹陷等,目前市售产品,如:瑞兰、伊婉、乔雅登等等,主要成分均为透明质酸,市场前景大好。
聚乳酸,是一种安全、无毒副作用的可降解材料。早期应用于工业制品,随着不断的深入研究,其应用也越来越广泛,如可降解的载药材料,药物缓释材料,生物支架等等。聚乳酸在人体内会分解成乳酸单体,而乳酸单体则会刺激人体成纤维细胞生产新的胶原蛋白,进而达到恢复肌肤弹性等填充目的。目前,聚乳酸的生物适应性、安全的降解能力受到美容领域的追捧,韩国的ganafill系列有一款产品将聚乳酸微球和透明质酸钠溶液共混后,直接注射填充。
与聚乳酸类似的材料也有,如聚乙丙交酯(pgla)、聚乙烯醇(pva)、聚l-丙交酯-己内酯(plcl)、对二氧环己酮(ppdo)、聚己内酯pcl或聚乳酸-羟基乙酸(plga)等等,属于人体可降解材料,也广泛应用于医疗美容领域。宝尼达就是应用透明质酸钠、羟丙甲基纤维素和聚乙烯醇微球作为主要材料。
但是,使用上述可降解的微球注射填充,需要保证其溶液具有一定的粘稠度,否则微球量越大,沉积的就越快;例如ganafill产品,透明质酸钠溶液黏性随时间逐渐降低,导致大量的聚乳酸微球沉积到一起,最后由于刺激严重而导致局部炎性结节,手术失败。
中国专利cn104258470b公开了“一种注射用聚乳酸微球和交联透明质酸混合凝胶及其制备方法”,该方法将注射用聚乳酸微球与交联透明质酸凝胶的盐溶液混合,利用交联透明质酸作为注射填充剂,从而克服透明质酸在体内降解迅速、存留时间短的缺点;另外,将其与聚乳酸微球共混,聚乳酸微球可以使产品在机体组织内存留时间更长,达到长期美容的效果。然而,简单的采用物理共混的方式将聚乳酸微球与交联透明质酸凝胶的盐溶液混合,虽然能够延长产品在机体组织内的留存时间,但是仍然解决不了透明质酸被吸收后,聚乳酸微球沉积的技术问题。
技术实现要素:
本发明的目的在于提供一种含有微球的可注射透明质酸钠凝胶的制备方法,该方法将微球材料与透明质酸钠溶液物理混合、再将透明质酸钠进行化学交联反应,使微球材料被固定在交联透明质酸钠凝胶的空间三维网状结构的空隙中,交联透明质酸钠凝胶在降解后,原位裸露出微球材料,成纤维细胞会在原位增生胶原蛋白,包裹住微球材料,有效的解决微球材料沉积结节的技术问题,同时也解决单纯使用微球美容产品所不具备的效果即时性。
为实现上述目的,本发明具体是采用如下技术方案实现的:
一种含有微球的可注射透明质酸钠凝胶的制备方法,具体包括以下步骤:
步骤s1、将透明质酸钠溶解到纯水中,得到溶液a;所述溶液a的浓度为1%~15%;
步骤s2、向溶液a中加入微球材料,均匀搅拌后得到均匀分散的悬浊液b;所述微球材料加入的质量是透明质酸钠质量的2-8倍;
步骤s3、调节悬浊液b的ph至适当值,得到悬浊液c;所述悬浊液c的ph值应该符合当前所选交联剂最适宜的ph值;
步骤s4、向悬浊液c中加入一定量的交联剂,并均匀搅拌得到混合均匀的悬浊液d,反应一定时间后,悬浊液d中的透明质酸钠交联形成含有均匀分散微球材料的胶体e;
步骤s5、将胶体e通过物理粉碎的方式,得到凝胶颗粒f;所述凝胶颗粒f的大小为25um~250um;
步骤s6、凝胶颗粒f通过不同目数的筛网,得到具有不同大小区间的凝胶颗粒g;所述凝胶颗粒g的大小控制在100~200um;
步骤s7、将凝胶颗粒g通过反复浸泡或者透析的方式,将可溶性杂质、交联剂除去,得到凝胶颗粒h;
步骤s8、使用平衡用pbs缓冲液反复浸泡得到凝胶颗粒i;
步骤s9、经过半脱水、加入添加剂、灌装、灭菌步骤得到最终含有均匀分散微球材料的透明质酸钠凝胶。
作为本发明的优选,所述透明质酸钠的分子量在20万~300万道尔顿,最好为40-100万道尔顿,溶液a的浓度最好为2%-8%。
作为本发明的优选,所述微球材料为左旋聚乳酸(plla)、聚乙丙交酯(pgla)、聚乙烯醇(pva)、聚l-丙交酯-己内酯(plcl)、对二氧环己酮(ppdo)、聚己内酯pcl或聚乳酸-羟基乙酸(plga)中的任意一种,所述微球材料的颗粒大小为10-100nm。
作为本发明的优选,所述交联剂为碳化二亚胺、己二酸二酰肼、二乙烯基砜、京尼平、1,4-丁二醇缩水甘油醚、二酸二酰肼、二醛类中的一种或两种及两种以上的混合物。
作为本发明的优选,步骤s7反复透析时,顺序依次为75%的乙醇、2.5%的食盐水、去离子水,重复至少两次。
作为本发明的优选,步骤s8平衡用pbs缓冲液的配置符合2015版药典,使用的pbs缓冲液的浓度应设置为使最终透明质酸钠凝胶的渗透压符合270omsmol/l-350omsmol/l,可以选取ph值为7.4,浓度为0.01mol/l~1mol//l(磷酸离子)浸泡一次。
作为本发明的优选,步骤s9经过轻微离心进行半脱水,离心时间2-5分钟,离心速度为1000r/min-1500r/min;使用高温蒸汽灭菌或钴60进行辐照灭菌,辐照剂量为3kgy~15kgy;步骤s9中所述的添加剂为未交联透明质酸、麻醉剂、功能分子中的一种或两种及两种以上的混合物。
作为本发明的进一步优选,步骤s4中选择选择碳化二亚胺与己二酸二酰肼作为交联剂时,悬浊液c最适宜的ph值为4~6之间,同时还需要加入一定量的催化剂;所述催化剂为1-羟基苯并三氮唑。
作为本发明的更进一步优选,所述透明质酸钠:碳化二亚胺:己二酸二酰肼:1-羟基苯并三氮唑的物质的量比为1:3:2:3,反应时间为2~10小时。
本发明的优点和有益效果是:
(1)本发明提供的方法简单、操作可行,该方法通过物理混合、化学交联的方式将微球材料均匀分散在交联透明质酸凝胶的空间三维网状结构的空隙中,当交联透明质酸凝胶降解后,微球也被缓慢释放,用以刺激自体胶原蛋白再生,有效解决微球沉积导致的局部炎性结节问题,也解决单纯使用微球美容产品所不具备的效果即时性。
(2)本发明提供的方法在制备过程中通过使用不同溶剂,反复浸泡或者透析的方式对凝胶颗粒g进行纯化,凝胶颗粒g溶胀,收缩,再溶胀,再收缩等过程后,能够清除交联透明质酸钠凝胶颗粒内的交联剂等杂质,使产品无毒、无任何刺激作用,安全简便,适合工业生产。
(3)采用本发明提供的方法制备的可注射凝胶作为医用填充剂时,有效解决现有产品的即时性和实效性,并且该方法还可以根据不同的微球材料以及不同的交联度来设定降解时间,满足不同需求。另外,该产品作为药物缓释剂,可以根据不同分子量,不同交联剂,及不同的药物缓释微球来调整药物释放的速度,可以起到长效的缓释作用,解决了目前药物缓释过快的问题。
附图说明
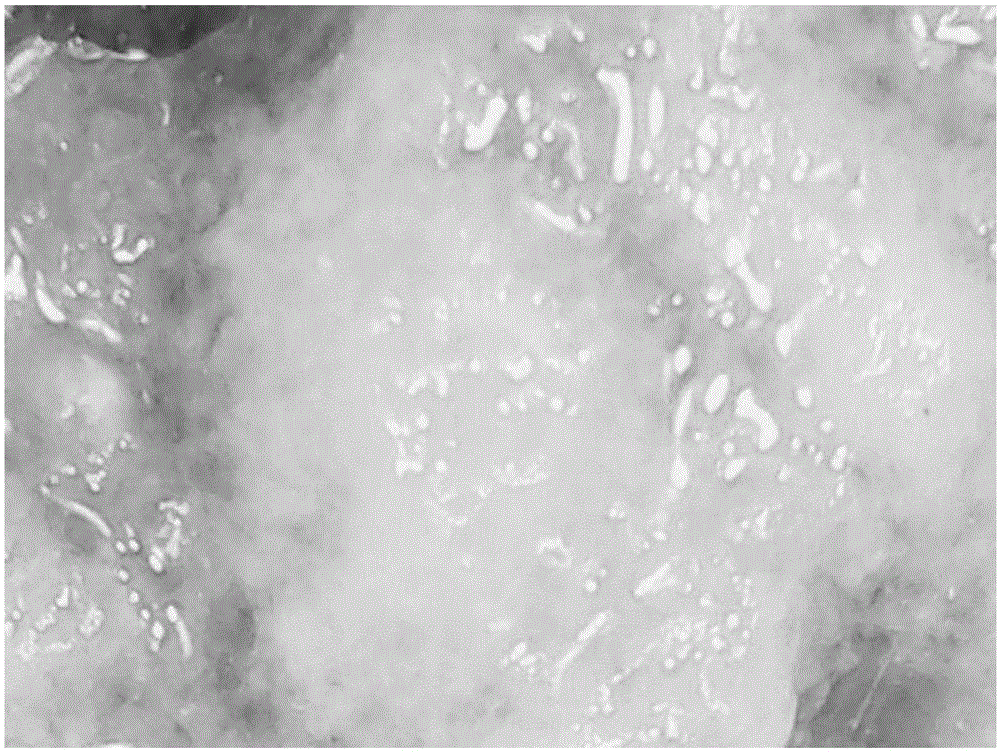
图1是实施例1所得凝胶颗粒在100倍显微镜下的放大图。
图2是实施例1所得凝胶颗粒在300倍显微镜下的放大图。
图3是实施例1所得凝胶颗粒在600倍显微镜下的放大图。
具体实施方式
为使本领域技术人员清楚本发明的技术方案和优点,下面通过实施例和对比例详细说明本发明的技术方案,但并用于限制本发明的保护范围。
实施例1
一种含有聚乳酸微球的可注射凝胶的制备方法,具体包括以下步骤:
步骤s1、将分子量为20万~40万道尔顿的透明质酸钠2g溶解到98ml纯水中,得到溶液浓度为2%的水溶液a;
步骤s2、向溶液a中加入5gplla微球(左旋聚乳酸微球,颗粒大小为20-40nm,分子量在10万道尔顿)材料,均匀搅拌后得到均匀分散的悬浊液b;
步骤s3、调节悬浊液b的ph值至4.75-5.25之间(1mol/l盐酸),得到悬浊液c;
步骤s4、向悬浊液c中加入交联剂和催化剂,交联剂为碳化二亚胺与己二酸二酰肼,催化剂为1-羟基苯并三氮唑(透明质酸钠:碳化二亚胺:己二酸二酰肼:1-羟基苯并三氮唑的物质的量比为1:3:1:3),并均匀搅拌得到混合均匀的悬浊液d,静止反应8小时后,悬浊液d中的透明质酸交联形成含有均匀左旋聚乳酸微球材料的胶体e;
步骤s5、将胶体e通过透明质酸微粒粉碎机粉碎,得到大小约为100um的凝胶颗粒f;
步骤s6、凝胶颗粒f通过200目的316l筛网得到凝胶颗粒g;
步骤s7、将凝胶颗粒g依次通过2l的乙醇(体积百分比75%)、2l的食盐水(2.5%)、2l的去离子水浸泡,每次浸泡6~8小时,反复进行三次,得到凝胶颗粒h;
步骤s8、使用2l,ph值为7.40,磷酸盐浓度为0.01mol/l的pbs缓冲液浸泡两次后得到凝胶颗粒i;
步骤s9、经过轻微离心进行半脱水(5min,1500r/min),加入利多卡因(0.03%,质量比),加入未交联透明质酸钠(2%,质量比,分子量20万~40万道尔顿),机械无菌灌装至2ml一次性注射器内,钴60辐照灭菌(10kgy),得可注射、无菌的的透明质酸钠凝胶。
实施例2
一种含有聚己内酯微球的可注射凝胶的制备方法,具体包括以下步骤:
步骤s1、将分子量为20万~40万道尔顿的透明质酸钠2g溶解到98ml纯水中,得到溶液浓度为2%的水溶液a;
步骤s2、向溶液a中加入5gpcl微球(聚己内酯,颗粒大小为20-40nm,分子量在5万道尔顿)材料,均匀搅拌后得到均匀分散的悬浊液b;
步骤s3、调节悬浊液b的ph值至4.75-5.25之间(1mol/l盐酸),得到悬浊液c;
步骤s4、向悬浊液c中加入交联剂和催化剂,交联剂为碳化二亚胺与己二酸二酰肼,催化剂为1-羟基苯并三氮唑(透明质酸钠:碳化二亚胺:己二酸二酰肼:1-羟基苯并三氮唑的物质的量比为1:3:1:3),并均匀搅拌得到混合均匀的悬浊液d,静止反应8小时后,悬浊液d中的透明质酸交联形成含有均匀左旋聚乳酸微球材料的胶体e;
步骤s5、将胶体e通过透明质酸微粒粉碎机粉碎,得到大小约为100um的凝胶颗粒f;
步骤s6、凝胶颗粒f通过200目的316l筛网得到凝胶颗粒g;
步骤s7、将凝胶颗粒g依次通过2l的乙醇(体积百分比75%)、2l的食盐水(2.5%)、2l的去离子水浸泡,每次浸泡6~8小时,反复进行三次,得到凝胶颗粒h;
步骤s8、使用2l,ph值为7.40,磷酸盐浓度为0.01mol/l的pbs缓冲液浸泡两次后得到凝胶颗粒i;
步骤s9、经过轻微离心进行半脱水(5min,1500r/min),加入利多卡因(0.03%,质量比),加入未交联透明质酸钠(2%,质量比,分子量20万~40万道尔顿),机械无菌灌装至2ml一次性注射器内,钴60辐照灭菌(10kgy),得可注射、无菌的的透明质酸钠凝胶。
实施例3
一种含有plcl微球的可注射凝胶的制备方法,具体包括以下步骤:
步骤s1、将分子量为100万~300万道尔顿的透明质酸钠2g溶解到48ml纯水中,得到溶液浓度为4%的水溶液a;
步骤s2、向溶液a中加入2.5gplcl微球(聚-左旋乳酸-聚己内酯,颗粒大小为20-40nm,分子量在3万道尔顿)材料,均匀搅拌后得到均匀分散的悬浊液b;
步骤s3、调节悬浊液b的ph值至4.75-5.25之间(1mol/l盐酸),得到悬浊液c;
步骤s4、向悬浊液c中加入交联剂和催化剂,交联剂为碳化二亚胺与己二酸二酰肼,催化剂为1-羟基苯并三氮唑(透明质酸钠:碳化二亚胺:己二酸二酰肼:1-羟基苯并三氮唑的物质的量比为1:3:1:3),并均匀搅拌得到混合均匀的悬浊液d,静止反应8小时后,悬浊液d中的透明质酸交联形成含有均匀左旋聚乳酸微球材料的胶体e;
步骤s5、将胶体e通过透明质酸微粒粉碎机粉碎,得到大小约为100um的凝胶颗粒f;
步骤s6、凝胶颗粒f通过200目的316l筛网得到凝胶颗粒g;
步骤s7、将凝胶颗粒g依次通过1l的乙醇(体积百分比75%)、2l的食盐水(2.5%)、2l的去离子水浸泡,每次浸泡6~8小时,反复进行三次,得到凝胶颗粒h;
步骤s8、使用1l,ph值为7.40,磷酸盐浓度为0.01mol/l的pbs缓冲液浸泡两次后得到凝胶颗粒i;
步骤s9、经过轻微离心进行半脱水(5min,1500r/min),加入利多卡因(0.03%,质量比),加入未交联透明质酸钠(2%,质量比,分子量20万~40万道尔顿),机械无菌灌装至2ml一次性注射器内,钴60辐照灭菌(5kgy),得可注射、无菌的的透明质酸钠凝胶。
实施例4
一种含有pva微球的可注射凝胶的制备方法,具体包括以下步骤:
步骤s1、将分子量为40万~100万道尔顿的透明质酸钠2g溶解到48ml纯水中,得到溶液浓度为4%的水溶液a;
步骤s2、向溶液a中加入2.5gpva微球(聚乙烯醇,颗粒大小为20-40nm,分子量在3万道尔顿)材料,均匀搅拌后得到均匀分散的悬浊液b;
步骤s3、调节悬浊液b的ph值至4.75-5.25之间(1mol/l盐酸),得到悬浊液c;
步骤s4、向悬浊液c中加入交联剂和催化剂,交联剂为碳化二亚胺与己二酸二酰肼,催化剂为1-羟基苯并三氮唑(透明质酸钠:碳化二亚胺:己二酸二酰肼:1-羟基苯并三氮唑的物质的量比为1:3:1:3),并均匀搅拌得到混合均匀的悬浊液d,静止反应8小时后,悬浊液d中的透明质酸交联形成含有均匀左旋聚乳酸微球材料的胶体e;
步骤s5、将胶体e通过透明质酸微粒粉碎机粉碎,得到大小约为100um的凝胶颗粒f;
步骤s6、凝胶颗粒f通过200目的316l筛网得到凝胶颗粒g;
步骤s7、将凝胶颗粒g依次通过1l的乙醇(体积百分比75%)、2l的食盐水(2.5%)、2l的去离子水浸泡,每次浸泡6~8小时,反复进行三次,得到凝胶颗粒h;
步骤s8、使用1l,ph值为7.40,磷酸盐浓度为0.01mol/l的pbs缓冲液浸泡两次后得到凝胶颗粒i;
步骤s9、经过轻微离心进行半脱水(5min,1500r/min),加入利多卡因(0.03%,质量比),加入未交联透明质酸钠(2%,质量比,分子量20万~40万道尔顿),机械无菌灌装至2ml一次性注射器内,钴60辐照灭菌(5kgy),得可注射、无菌的的透明质酸钠凝胶。
实施例5
一种含有plga微球的可注射凝胶的制备方法,具体包括以下步骤:
步骤s1、将分子量为40万~130万道尔顿的透明质酸钠2g溶解到48ml纯水中,得到溶液浓度为4%的水溶液a;
步骤s2、向溶液a中加入2gplga微球(聚乳酸-羟基乙酸共聚物,颗粒大小为10-50nm,730,分子量在5万道尔顿)材料,均匀搅拌后得到均匀分散的悬浊液b;
步骤s3、调节悬浊液b的11.0~11.5(0.5mol/l氢氧化钠),得到悬浊液c;
步骤s4、向悬浊液c中加入二乙烯基砜0.2g,并均匀搅拌得到混合均匀的悬浊液d,静止反应2小时后,悬浊液d中的透明质酸交联形成含有均匀plga微球材料的胶体e;
步骤s5、将胶体e通过透明质酸微粒粉碎机粉碎,得到大小约为50um的凝胶颗粒f;
步骤s6、凝胶颗粒f通过200目的316l筛网分离较大的颗粒,得筛分物,再通过400目筛网(316l)得到凝胶颗粒g;
步骤s7、将凝胶颗粒g依次通过2l的食盐水(2.5%)、2l的去离子水浸泡,透析8小时,得到凝胶颗粒h;
步骤s8、使用2l,ph值为7.40,磷酸盐浓度为0.015mol/l的pbs缓冲液浸泡两次后得到凝胶颗粒i;
步骤s9、经过轻微离心进行半脱水(2min,1000r/min),加入利多卡因(0.03%,质量比),加入未交联透明质酸钠(质量比2%,分子量20万~40万道尔顿),机械无菌灌装至2ml一次性注射器内,钴60辐照灭菌(5kgy),得可注射、无菌的的透明质酸钠凝胶。
实施例6
一种含有聚乳酸微球的可注射凝胶的制备方法,具体包括以下步骤:
步骤s1、将分子量为40万~130万道尔顿的透明质酸钠2g溶解到18ml纯水中,得到溶液浓度为10%的水溶液a;
步骤s2、向溶液a中加入2gplga微球(聚乳酸-羟基乙酸共聚物,颗粒大小为10-50nm,730,分子量在5万道尔顿)材料,均匀搅拌后得到均匀分散的悬浊液b;
步骤s3、调节悬浊液b的11.0~11.5(0.5mol/l氢氧化钠),得到悬浊液c;
步骤s4、向悬浊液c中加入二乙烯基砜0.2g,并均匀搅拌得到混合均匀的悬浊液d,静止反应2小时后,悬浊液d中的透明质酸交联形成含有均匀plga微球材料的胶体e;
步骤s5、将胶体e通过透明质酸微粒粉碎机粉碎,得到大小约为50um的凝胶颗粒f;
步骤s6、凝胶颗粒f通过200目的316l筛网分离较大的颗粒,得筛分物,再通过400目筛网(316l)得到凝胶颗粒g;
步骤s7、将凝胶颗粒g依次通过2l的食盐水(2.5%)、2l的去离子水浸泡,透析8小时,得到凝胶颗粒h;
步骤s8、使用2l,ph值为7.40,磷酸盐浓度为0.015mol/l的pbs缓冲液浸泡两次后得到凝胶颗粒i;
步骤s9、经过轻微离心进行半脱水(2min,1000r/min),加入利多卡因(0.03%,质量比),加入未交联透明质酸钠(质量比2%,分子量20万~40万道尔顿),机械无菌灌装至2ml一次性注射器内,钴60辐照灭菌(15kgy),得可注射、无菌的的透明质酸钠凝胶。
实施例7
一种含有聚乳酸微球的可注射凝胶的制备方法,具体包括以下步骤:
步骤s1、将分子量为40万~130万道尔顿的透明质酸钠2g溶解到18ml纯水中,得到溶液浓度为10%的水溶液a;
步骤s2、向溶液a中加入2gplga微球(聚乳酸-羟基乙酸共聚物,颗粒大小为10-50nm,730,分子量在5万道尔顿)材料,均匀搅拌后得到均匀分散的悬浊液b;
步骤s3、调节悬浊液b的11.0~11.5(0.5mol/l氢氧化钠),得到悬浊液c;
步骤s4、向悬浊液c中加入京尼平0.8g,并均匀搅拌得到混合均匀的悬浊液d,静止反应24小时后,悬浊液d中的透明质酸交联形成含有均匀plga微球材料的胶体e;
步骤s5、将胶体e通过透明质酸微粒粉碎机粉碎,得到大小约为50um的凝胶颗粒f;
步骤s6、凝胶颗粒f通过200目的316l筛网分离较大的颗粒,得筛分物,再通过400目筛网(316l)得到凝胶颗粒g;
步骤s7、将凝胶颗粒g依次通过2l的食盐水(2.5%)、2l的去离子水浸泡,透析8小时,得到凝胶颗粒h;
步骤s8、使用2l,ph值为7.40,磷酸盐浓度为0.015mol/l的pbs缓冲液浸泡两次后得到凝胶颗粒i;
步骤s9、经过轻微离心进行半脱水(2min,1000r/min),加入利多卡因(0.03%,质量比),加入未交联透明质酸钠(质量比2%,分子量20万~40万道尔顿),机械无菌灌装至2ml一次性注射器内,钴60辐照灭菌(15kgy),得可注射、无菌的的透明质酸钠凝胶。
实施例8
一种含有聚乳酸微球的可注射凝胶的制备方法,具体包括以下步骤:
步骤s1、将分子量为80万~300万道尔顿的透明质酸钠2g溶解到48ml纯水中,得到溶液浓度为4%的水溶液a;
步骤s2、向溶液a中加入5g聚l-丙交酯-己内酯(plcl)(70%的丙交酯、30%的己内酯,颗粒大小在10-60纳米,分子量在10万-40万之间)材料,均匀搅拌后得到均匀分散的悬浊液b;
步骤s3、调节悬浊液b的ph值至7.0~8.0(0.1mol/l氢氧化钠),得到悬浊液c;
步骤s4、向悬浊液c中加入1,4-丁二醇缩水甘油醚0.1g,并均匀搅拌得到混合均匀的悬浊液d,静止反应10小时后,悬浊液d中的透明质酸交联形成含有均匀plcl微球材料的胶体e;
步骤s5、将胶体e通过透明质酸微粒粉碎机粉碎,得到大小约为100-150um的凝胶颗粒f;
步骤s6、凝胶颗粒f通过200目的316l筛网得到凝胶颗粒g;
步骤s7、将凝胶颗粒g依次通过2l的食盐水(2.5%)、2l的去离子水透析8小时,得到凝胶颗粒h;
步骤s8、使用2l,ph值为7.40,磷酸盐浓度为0.05mol/l的pbs缓冲液浸泡两次后得到凝胶颗粒i;
步骤s9、经过轻微离心进行半脱水(2min,1000r/min),加入未交联透明质酸钠(质量比5%,分子量20万~40万道尔顿),机械无菌灌装至2ml一次性注射器内,钴60辐照灭菌(2kgy),得可注射、无菌的的透明质酸钠凝胶。
对比例1
一种含有聚乳酸微球的可注射凝胶的制备方法,重复实施例1:
在步骤s3中、调节悬浊液b的ph值至3.50(1mol/l盐酸),得到悬浊液c;
步骤s4、向悬浊液c中加入交联剂和催化剂,交联剂为碳化二亚胺与己二酸二酰肼,催化剂为1-羟基苯并三氮唑(透明质酸钠:碳化二亚胺:己二酸二酰肼:1-羟基苯并三氮唑的物质的量比为1:3:1:3),并均匀搅拌得到混合均匀的悬浊液d,静止反应8小时后,悬浊液d中的透明质酸交联形成含有均匀左旋聚乳酸微球材料的胶体e;
步骤s5、将胶体e通过透明质酸微粒粉碎机粉碎,得到大小约为100um的凝胶颗粒f;
结果:对比例1中所得胶体e在进行s5步骤中,所得凝胶颗粒机械性能较差,放入水中后,大部分直接将微球材料释放出来。
对比例2
一种含有聚乳酸微球的可注射凝胶的制备方法,重复实施例1中s1~s3步骤:
步骤s4、向悬浊液c中加入交联剂,交联剂为碳化二亚胺与己二酸二酰肼,(透明质酸钠:碳化二亚胺:己二酸二酰肼的物质的量比为1:3:1),并均匀搅拌得到混合均匀的悬浊液d,静止反应8小时后,悬浊液d中的透明质酸交联形成含有均匀左旋聚乳酸微球材料的胶体e;
重复步骤s5-s9,结果:对比例2中所得凝胶颗粒i会在几天后发生沉淀现象,释放出微球材料。
对比例3
一种含有聚乳酸微球的可注射凝胶的制备方法,
步骤s1、将分子量为300万~500万道尔顿的透明质酸钠2g溶解到98ml纯水中,得到溶液浓度为2%的水溶液a;
重复实施例1中步骤s2-s9,结果:对比例3中所得注射用凝胶会由于辐照降解,发生微球沉淀。
- 还没有人留言评论。精彩留言会获得点赞!