对非小细胞肺癌抑癌基因STK11突变敏感的药物及其筛选方法与流程
本发明属于医药领域,具体涉及一种对非小细胞肺癌中抑癌基因stk11突变敏感的药物及其筛选方法。
背景技术:
肺癌已成为我国首位恶性肿瘤死亡原因,吸烟、长期遭受空气污染和职业中接触致癌物,是增大国人患肺癌风险的主要因素。我国肺癌发病率每年增长26.9%,预计到2025年,我国肺癌病人将达到100万,成为世界第一肺癌大国。全球每年因肺癌死亡的人数超过100万,其中80-90%的患者为非小细胞肺癌。虽然肺癌治疗在过去的40年里有了一定进展,但是并不快。细胞毒性化疗联合手术治疗早期非小细胞肺癌可以提高5年生存率,联合胸部放射治疗iii期非小细胞肺癌和小细胞肺癌也可以提高5年生存率。应用新的维持疗法进行化疗可以延长iv期非小细胞肺癌和小细胞肺癌的生存期,而且毒性作用很小。然而,这一提高的幅度并不大,i-iii期肺癌患者5年生存率只提高了4%-5%,而iv期肺癌患者的生存期也只延长了几个月。所以新兴的分子细胞生物学技术、肿瘤免疫治疗以及基因靶向治疗等手段被人们寄予厚望,用于开发治疗肿瘤的有效方案。
基因组变异是肿瘤发生的根本生物学原因,它导致正常细胞转化为可以逃避凋亡、无限复制、侵袭及转移和免疫逃逸的“永生不死”的癌细胞。基因突变、dna拷贝数目变动、转录和表达水平差异最终都指向各种信号转导通路的异常,导致相应细胞功能改变,从而引发细胞不正常地失控增殖、生长。癌细胞中的基因变异始终是肿瘤研究中的热点。近年来,基于高通量测序技术的快速发展,更是为肿瘤细胞系和组织样本产生了高效可靠的基因组学的数据。基于异常的肿瘤信号传导通路(激活或者失活)为靶标研究抗肿瘤药物已逐步成为肿瘤治疗领域努力的方向之一。
分子靶向治疗的研究和发展主要依赖于基因变异导致的异常基因表达和异常信号的激活的研究。目前已知的癌症有200多种,但是,无论何种癌症,其特殊类别(分型)或发展的不同分期方面都发现有基因组的特异变化,而正是基因组的改变(突变)导致了细胞分化、发育和生长通路的不正常,从而引发细胞不正常地失控增殖、生长。在临床肿瘤学领域,分子靶向治疗的出现是在一定程度上实现了肿瘤诊疗的“个体化”。
目前已有一些关于非小细胞肺癌标记物的专利,如中国专利cn201010171879.8公开了一种涉及非小细胞肺癌分子标志物及其应用,具体涉及人富亮氨酸α2糖蛋白或其片段、人c4结合蛋白或其片段、人血清淀粉样蛋白或其片段、或其组合在制备用于检测对象是否患有非小细胞肺癌或对患有非小细胞肺癌患者进行预后的制剂中的应用,但此专利并没有涉及到抑癌基因skt11突变的情况;中国专利cn200910184518.4公开了一种与非小细胞肺癌预后相关的血清/血浆mirna标志物及其应用,涉及一种与非小细胞肺癌预后相关的血清/血浆mirna标志物及其应用,该标志物为mir-486、mir30d、mir-1或mir-499中的一种或多种,该标志物可用于制备非小细胞肺癌预后辅助诊断试剂盒或治疗非小细胞肺癌的药物,但此发明的重点为非小细胞肺癌预后的应用,在非小细胞肺癌的前期检测方面没有发挥作用。
丝氨酸/苏氨酸蛋白激酶11(stk11,亦称lkb1)在调节细胞能量代谢、细胞增殖、细胞凋亡和迁移等方面有重要的作用,stk11作为抑癌基因,其突变后功能丧失,是肿瘤发生发展的一个重要因素,在非小细胞肺癌(nsclc)中,具有stk11突变的病人很少带有能够被靶向治疗的基因突变(egfr等),导致此类病人无法受益于靶向药物治疗。
综上所述,充分利用stk11在非小细胞肺癌中突变频率很高的特点,寻找一种对非小细胞肺癌中抑癌基因stk11突变敏感的药物及其筛选方法,进而对小细胞肺癌的治疗提供新的候选药物和解决策略,为抗肿瘤药物的筛选提供借鉴和理论依据成为科研的重点研究方向。
技术实现要素:
术语:
除非另外定义,本文中使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同意义。
本发明中的术语“trizol”指的是一种新型总rna抽提试剂,可以直接从细胞或组织中提取总rna。
本发明中的术语“tcga”指的是美国政府发起的癌症和肿瘤基因图谱(cancergenomeatlas,tcga)计划,可以用于基因组分析。
本发明中的术语“cosmicdb”指的是人类癌症中发现的体细胞突变的在线数据库。
本发明中的术语“nci-60”指的是美国国家癌症研究所(nationalcancerinstitute,nci)于20世纪80年代开始建立的药物反应数据库,被广泛应用于癌症的研究来发现新的抗癌药物。
本发明中的术语“ampk”指的是amp依赖的蛋白激酶,是生物能量代谢调节的关键分子,是研究糖尿病及其他代谢相关疾病的核心。
本发明要解决的技术问题是提供一种对非小细胞肺癌抑癌基因stk11突变敏感的药物及其筛选方法。
针对基因改变及肿瘤相关信号通路的小分子靶向药物是抗肿瘤药物发展的主要方向之一,目前在临床应用中只有部分肿瘤能够受益于现有靶向药物的治疗,所以未来肿瘤个体化治疗的关键,将是充分利用有限资源,通过预测性生物标志物确保筛选出恰当的患者。
抑癌基因突变后功能丧失,作为直接的药物靶点仍然是药物研发中的重点,靶向抑癌基因突变的非小细胞肺癌(nsclc),一方面可以集中在其下游通路上,另一方面可以作为生物标记(biomarker)来预测抗肿瘤药物的有效群体。
为解决上述技术问题,一方面,本发明提供一种对非小细胞肺癌抑癌基因stk11突变敏感的药物。
所述的药物包括:
nsc642277(n-[(5s,8ar,9r)-9-(4-hydroxy-3,5-dimethoxyphenyl)-8-oxo-5a,6,8a,9-tetrahydro-5h-[2]benzofuro[5,6-f][1,3]benzodioxol-5-yl]-3-aminobenzamide)、nsc628676(furo[3',7]naphtho[2,3-d]-1,3-dioxol-6(5ah)-one,9-[(4-aminophenyl)amino]-5,8,8a,9-tetrahydro-5-(4-hydroxy-3,5-dimethoxyphenyl)-,dihydrochloride)和etoposide(依托泊甙)中的一个或多个;
所述的药物包括nsc642277、nsc628676和etoposide三种药物的任意质量分配比;
所述的药物包括以nsc642277、nsc628676和etoposide三种药物的任意一种为主要成分,加入药学上可接受的辅料制备成的制剂;
所述的药物制剂包括但不限于片剂、膏剂、散剂、汤剂、丸剂和胶囊剂;
进一步的,三种小分子药物在ncbi-pubchem的检索链接为:
nsc642277:https://pubchem.ncbi.nlm.nih.gov/compound/369910;
nsc628676:https://pubchem.ncbi.nlm.nih.gov/compound/363647;
etoposide:https://pubchem.ncbi.nlm.nih.gov/compound/36462#section=top。
另一方面,本发明提供一种对非小细胞肺癌抑癌基因stk11突变敏感的药物的筛选方法。
所述的一种对非小细胞肺癌中抑癌基因stk11突变敏感的药物的筛选方法,具体包括以下步骤:(1)stk11突变在非小细胞肺癌(nsclc)中突变的特异性挖掘;(2)靶向stk11突变nsclc的药物筛选;(3)体内验证候选药物对含有stk11突变的非小细胞肺癌的敏感性;(4)通过靶向stk11突变nsclc的药物的分子机制进行验证;
进一步的,具体的步骤为:
(1)stk11突变在非小细胞肺癌(nsclc)中突变的特异性挖掘:
通过数据挖掘tcga和cosmicdb数据库,主要包括肺腺癌(luad)、肺鳞癌(lusc)细胞和病人样本中的发生频率以及stk11突变在各种肿瘤中的发生情况;
(2)靶向stk11突变nsclc的药物筛选:
a.利用nci-60药物反应数据库,计算stk11突变与小分子药物反应的关系;
b.验证候选药物特异敏感性:为具有stk11突变的非小细胞肺癌构建stk11功能性恢复的稳定细胞系,并分析候选药物对具有stk11突变和stk11功能性恢复的非小细胞肺癌细胞增殖的影响;
c.选取stk11稳定表达的非小细胞肺癌细胞,利用rnai技术敲除沉默stk11,观察候选药物对stk11稳定表达和stk11沉默的肿瘤细胞增殖的影响;
(3)体内检测候选药物对含有stk11突变的非小细胞肺癌的敏感性:
首先构建stk11稳定表达且功能恢复的细胞株。皮下接种肿瘤细胞a549(突变stk11的细胞株)和a549-stk11(stk11功能恢复的细胞株)到小鼠右背侧,待肿瘤体积达到50mm3时,一周三次,以生理盐水为阴性对照,连续两个月灌胃候选药物,并观察肿瘤大小,最后处死裸鼠,解剖,组织保存。
(4)通过靶向stk11突变nsclc的药物的分子机制进行验证:
检测恢复stk11功能的非小细胞肺癌细胞中ampk的活性,验证stk11突变的癌细胞是否随着stk11的功能性恢复,ampk的磷酸化水平明显提高。
进一步的,所述步骤(3)中的候选药物为etoposide(依托泊甙)、nsc642277或nsc628676中的任意一种。
再一个方面,本发明还提供上述对非小细胞肺癌抑癌基因stk11突变敏感的药物及其筛选方法在医学检测和治疗领域中的应用。
本发明的有益效果:
(1)本发明充分利用stk11在非小细胞肺癌中具有突变的特异性,筛选出对stk11突变肿瘤具有特异敏感性的药物,且具有较高的药用价值,本发明中针对stk11突变nsclc候选药物的筛选方法,为认识人类非小细胞肺癌的发病机理提供了新的视角和思路。
(2)本发明利用抑癌基因stk11作为生物标记来进一步为非小细胞肺癌分型(是否具有stk11突变)具有重要的理论和实际意义,同时对有效推进以其他突变为生物标记的个性化治疗提供新思路和应用基础。
(3)本发明最主要的创新之处就在于选取高频率突变的抑癌基因stk11作为研究对象,并利用药物反应数据库筛选对stk11突变的非小细胞肺癌具有特异敏感性的小分子药物,抑癌基因的突变不同于原癌基因,它虽然不能作为直接的靶点,但是可以作为生物标记(biomarker)贡献于靶向治疗,为其他抑癌基因作为生物标记为肿瘤的个性化治疗提供了一个新的思路。
(4)本发明通过采用挖掘肿瘤基因组和高通量的药物反应数据库等手段,基于生物标记的研究,为靶向特定肿瘤类型的药物筛选方法提供了一个新的方向,且为将来利用生物信息学和系统生物学等学科交叉研究生命现象和解决生物问题提供了新的解决策略。
(5)本发明提供的非小细胞肺癌中抑癌基因stk11突变敏感的药物的筛选方法,操作简单,准确度高,具有广泛的适用性。
综上所述,本发明选取高频率突变的抑癌基因stk11作为研究对象,开发出了一种对非小细胞肺癌抑癌基因stk11突变敏感的药物的筛选方法及对非小细胞肺癌抑癌基因stk11突变敏感的药物,相比传统的非小细胞肺癌药物,针对性更强,且为靶向特定肿瘤类型的药物筛选提供了一个新的方向。
附图说明
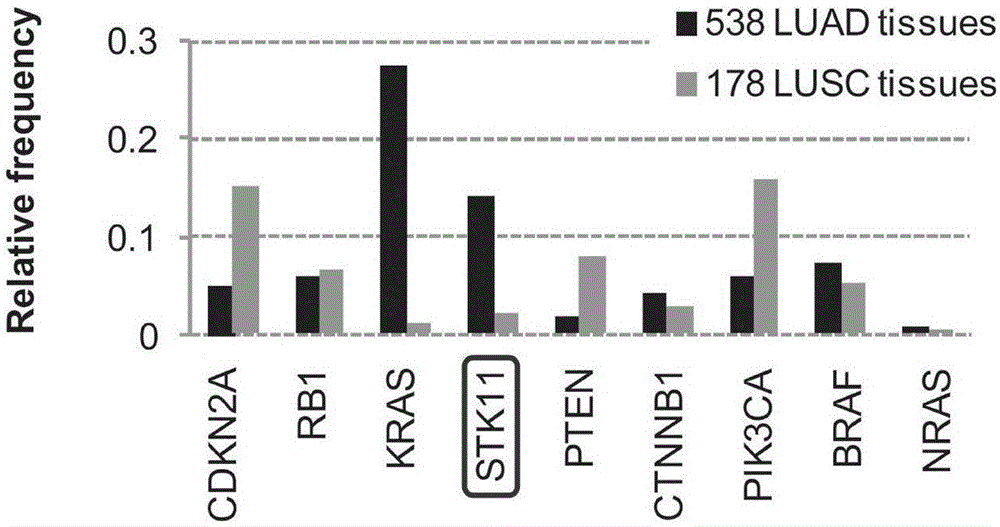
图1为肺腺癌(luad)和肺鳞癌(lusc)细胞在病人样本中的发生频率以及stk11突变在各种肿瘤中的发生情况结果图,可见stk11突变在nsclc的luad中具有突出的高突变率。
图2为nsc642277、nsc628676和etoposide对具有stk11突变的癌细胞具有选择敏感性的结果图,尤其是具有stk11突变的肺癌细胞。
图3为nsc642277、nsc628676和etoposide的化学结构式图,三者拥有类似的分子结构。
图4为nsc642277、nsc628676和etoposide对具有stk11突变和stk11正常表达的非小细胞肺癌细胞生长的影响结果图。
图5为nsc642277、nsc628676和etoposide对具有stk11突变和其恢复stk11正常表达后的非小细胞肺癌细胞生长的影响结果图。
图6为实施例6中在动物水平上揭示etoposide对具有stk11突变的非小细胞肺癌的特异敏感性的结果图。
图7为实施例7中在动物水平上揭示nsc642277对具有stk11突变的非小细胞肺癌的特异敏感性的结果图。
图8为实施例7中在动物水平上揭示nsc628676对具有stk11突变的非小细胞肺癌的特异敏感性的结果图。
图9为实施例4中stk11突变恢复的nsclc细胞ampk的活性的westernblot电泳图。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围之内。
实施例1候选药物和stk11突变关系的计算
为了定量计算候选药物和stk11突变的关系,使用倍性变化(foldchange)和p-value进行差异分析,计算公式如下:
即用stk11突变细胞的反应均值除以全部细胞样品的反应均值;
其差异的统计学意义用t-test方法,对每一个候选药物计算一个t统计量来衡量stk11突变细胞样品与全部细胞样品的反应差异,然后根据t分布计算显著性p值来衡量差异的显著性,t统计量计算公式如下:
三种候选药物(nsc642277、nsc628676和etoposide)以及三种已知药物gefitinib(吉非替尼)、cisplatin(顺式二氯二胺合铂)和paclitaxel(紫杉醇)与stk11突变的关系见表1。
表1:
实施例2细胞选择、细胞培养、质粒转染和表达
(1)nci-60肺癌细胞(两株stk11突变细胞a549和h460;两株stk11未突变细胞h322m和hop-62)购买自nationalcancerinstitute(ncidtp);
(2)细胞的培养、传代和冻存按照产品手册进行操作,培养在具有10%胎牛血清的rpmi-1640培养基中;
(3)质粒(plenti-lkb1-puro)由波士顿大学的罗教授慷慨赠送(bostonuniversityschoolofmedicine,boston,ma,usa),质粒的转染使用thermoscientifictrans-lentiviralpackagingkit(dharmaconinc.)试剂盒,并用2μg/ml嘌呤霉素(puromycin)来筛选出稳定表达stk11/lkb1的细胞系。
实施例3三种候选药物对细胞的增殖的影响
使用mtt细胞增殖实验检三种测候选药物(nsc642277、nsc628676和etoposide)对细胞活力的影响,收集对数期细胞,调整细胞悬液浓度加入96孔板,孵育在5%co2和37℃的培养箱中过夜,加入浓度梯度的候选药物,48小时后mtt检测,结果如附图4和附图5所示。
其中,附图4中,stk11mt为a549,nci-h460,nci-h1993,和nci-h1395,stk11wt为四株具有stk11正常表达的细胞nci-h226,nci-h322m,nci-h82,和nci-h524;附图5中,a549和h460是具有stk11突变的非小细胞肺癌细胞,a549-stk11和h460-stk11是通过基因改造后恢复stk11正常表达非小细胞肺癌细胞株。
实施例4westernblot实验检测目标蛋白质的表达
培养的细胞收获后,使用全细胞裂解液(wholecelllysates,wcl)裂解后离心,加入样品缓冲液煮沸,进行sds-page电泳,电泳结束后将蛋白转移到pvdf膜上,5%bsa封闭后,一抗孵育过夜,冲洗后hpr-标记的二抗室温孵育两个小时,冲洗后化学发光法检测enhancedchemiluminescence(ecl)detectionsystem,结果如图9所示。
实施例5利用sirna(smallinterferingrna)技术使肿瘤细胞内源性蛋白stk11等短时间缺失
利用sirna技术使肿瘤细胞内源性蛋白stk11等短时间缺失,转染操作按照liposuctionfectaminetm2000(invitrogen,carlsbad,ca,usa)手册进行操作,细胞生长至30%密度时,加入目标sirna转染,转染48小时后收集细胞进行相关实验。
实施例6异种移植小鼠模型用于体内实验
取雄性健康的裸鼠称重,饲养符合伦理学规定,将指数生长期的a549-stk11mt(具有stk11失活突变的非小细胞肺癌)或a549-stk11mt/wtstk11(stk11功能性恢复的非小细胞肺癌)细胞分别注射到小鼠右背侧,待肿瘤体积达到50mm3时,一周三次,以生理盐水作为阴性对照,连续两个月灌胃候选药物etoposide(依托泊甙),并观察肿瘤大小,最后处死裸鼠,解剖,组织保存,结果如附图6所示。
实施例7
将实施例6中的etoposide分别换成nsc642277和nsc628676,其他条件不变,均出现了和实施例6中相同的结果,nsc642277对应的结果如附图7所示,nsc628676对应的结果如附图8所示。
以上实施例的说明只是用于帮助理解本发明的方法及其核心思想。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!