封堵器的制作方法
本发明涉及介入式医疗器械领域,特别是涉及一种封堵器。
背景技术:
经皮介入技术是近年来发展非常迅速的疾病治疗手段,并且该技术适用领域也越来越广泛。其中采用导管介入治疗方法可以放置器械和药物到人体的心脏、动静脉血管等部位。其中器械可以为封堵器、血管塞、血管滤器等。
经导管介入封堵器是经导管介入治疗方法中常用的器械,可用于微创治疗房间隔缺损、室间隔缺损、动脉导管未闭和卵圆孔未闭等先天性心脏病。然而,封堵器在使用过程中,封堵器与血液接触的表面容易形成血栓,形成的血栓可能堵塞血管,进而导致血栓栓塞等问题。因此,加速封堵器的内皮化,防止血栓栓塞是亟待解决的问题。
目前,为了加速封堵器内皮化,一般采用在封堵器表面涂覆促内皮化材料的方法。然而,促内皮化材料较易溶于水,封堵器进入人体后,促内皮化材料很快溶解于血液中,并不能有效促进封堵器的内皮化,甚至完全被血液冲走而起不到任何作用。
技术实现要素:
基于此,有必要提供一种能够有效促内皮化的封堵器。
一种封堵器,包括封堵框架,所述封堵框架由可降解高分子丝编织而成,所述可降解高分子丝为促内皮化物质改性的可降解高分子丝。
在其中一个实施例中,所述促内皮化物质选自磷脂、生长因子、蛋白质、多肽及季铵盐中的至少一种。
在其中一个实施例中,所述可降解聚合物选自左旋聚乳酸、消旋聚乳酸、聚乙醇酸、聚乳酸-羟基乙酸共聚物、聚羟基脂肪酸脂、聚二氧环己酮、聚己内酯、聚葡萄糖酸、聚羟基丁酸、聚酸酐、聚磷酸酯、聚乙醇酸及聚二恶烷酮中的至少一种;或者,
所述可降解聚合物为形成左旋聚乳酸、消旋聚乳酸、聚乙醇酸、聚乳酸-羟基乙酸共聚物、聚羟基脂肪酸脂、聚二氧环己酮、聚己内酯、聚葡萄糖酸、聚羟基丁酸、聚酸酐、聚磷酸酯、聚乙醇酸及聚二恶烷酮的单体中的至少两种共聚形成的共聚物。
在其中一个实施例中,所述促内皮化物质和所述可降解聚合物的质量比不大于1:1。
在其中一个实施例中,所述促内皮化物质改性的可降解聚合物为促内皮化物质改性的可降解高分子丝,所述封堵框架由所述促内皮化物质改性的可降解高分子丝编织而成。
在其中一个实施例中,所述封堵框架由3d打印形成。
在其中一个实施例中,所述封堵器还包括远端封头和近端封头,所述远端封头设于所述封堵框架的远端,所述近端封头设于所述封堵框架的近端,所述远端封头和所述近端封头的材料均为促内皮化物质改性的可降解聚合物。
在其中一个实施例中,所述封堵器还包括远端标记结构,所述远端标记结构嵌设于所述远端封头上。
在其中一个实施例中,所述封堵器还包括近端标记结构,所述近端标记结构嵌设于所述近端封头上。
在其中一个实施例中,所述封堵器还包括阻流膜,所述阻流膜设于所述封堵框架中,所述阻流膜的材料为促内皮化物质改性的可降解聚合物。
在其中一个实施例中,所述封堵器还包括中部标记结构,所述中部标记结构设于所述阻流膜上。
在其中一个实施例中,所述可降解高分子丝的数量为20~144,所述可降解高分子丝的丝径为0.1~0.4毫米。
上述封堵器的封堵框架由促内皮化物质改性的可降解聚合物形成,将该封堵器植入生物体体内后,促内皮化物质能够逐渐释放而起到持续的、长效地促内皮化作用,有效地避免了促内皮化物质被血液冲走。因此,该封堵器的能够有效地促内皮化。
附图说明
图1为一实施方式的封堵器的结构示意图;
图2为另一实施方式的封堵器的结构示意图;
图3a和图3b为实施例1及其对比例的封堵器植入猪体内2个月后的sem图;
图4a和图4b为实施例2及其对比例的封堵器植入猪体内2个月后的sem图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
为了更加清楚地描述本发明的结构,采用“远端”、“近端”作为方位词,该方位词为介入医疗器械领域惯用术语,其中“远端”表示手术过程中远离操作者的一端,“近端”表示手术过程中靠近操作者的一端。
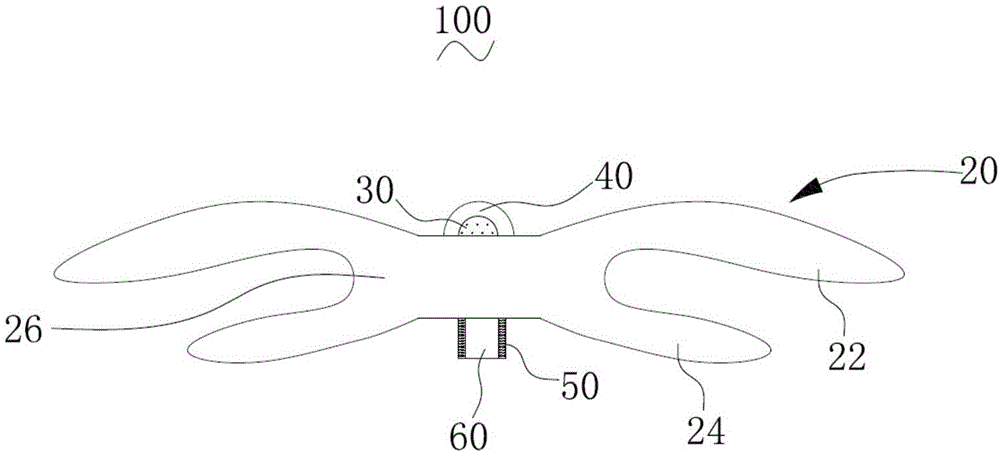
请参阅图1,一实施方式的封堵器100,包括封堵框架20。封堵框架20由可降解高分子材料形成。可降解高分子材料为促内皮化物质改性的可降解聚合物。促内皮化物质改性的可降解聚合物是指可降解聚合物的分子链上引入促内皮化改性物质。促内皮化改性物质与可降解聚合物通过化学键连接。
在一实施方式中,封堵框架20为由多根编织丝编织而成的网状结构。编织丝为促内皮化物质改性的可降解高分子丝。其中,促内皮化物质选自磷脂、生长因子、蛋白质、多肽及季铵盐中的至少一种。具体地,其中,磷脂选自卵磷脂、磷脂酰胆碱、磷脂酰乙醇胺、磷脂酰丝氨酸及磷脂酰肌醇中的至少一种。生长因子选自表皮细胞生长因子(egf)、成纤维细胞生长因子(fgf)及血小板衍生因子(pdgf)中的至少一种。蛋白质为层粘连蛋白或纤连蛋白。多肽选自酪氨酸-异亮氨酸-甘氨酸-丝氨酸-精氨酸五肽(yigsr)、环(精氨酸-甘氨酸-天冬氨酸-酪氨酸-赖氨酸)(tyr-rgd)及包含精氨酸-甘氨酸-天门冬氨酸(rgd)序列的多肽中的至少一种。其中,包含精氨酸-甘氨酸-天门冬氨酸(rgd)序列的多肽可以为精氨酸-甘氨酸-天门冬氨酸(rgd)多肽、精氨酸-甘氨酸-天门冬氨酸-丝氨酸(rgds)多肽等。上述促内皮化物质促内皮化的效果较好,有利于内皮较快地爬附于封堵框架20上,有效地避免血栓形成。
在一实施方式中,可降解高分子丝的材料选自左旋聚乳酸、消旋聚乳酸、聚乙醇酸、聚乳酸-羟基乙酸共聚物、聚羟基脂肪酸脂、聚二氧环己酮、聚己内酯、聚葡萄糖酸、聚羟基丁酸、聚酸酐、聚磷酸酯、聚乙醇酸及聚二恶烷酮中的至少一种。
在另一实施方式中,可降解高分子丝的材料为形成左旋聚乳酸、消旋聚乳酸、聚乙醇酸、聚乳酸-羟基乙酸共聚物、聚羟基脂肪酸脂、聚二氧环己酮、聚己内酯、聚葡萄糖酸、聚羟基丁酸、聚酸酐、聚磷酸酯、聚乙醇酸及聚二恶烷酮的单体中的至少两种共聚形成的共聚物。
在一实施方式中,为了使可降解高分子丝具有合适的降解速率,以满足早期支撑,且能够平缓降解而避免炎症反应,并使可降解高分子丝的降解与促内皮化物质的释放相匹配,可降解高分子丝的分子量为1,0000da~400,000da,可降解高分子丝的多分散系数为1.1~5。
在一实施方式中,为满足早期支撑,且能够平缓降解而避免炎症反应,同时能够合理地控制封堵器100的入鞘阻力,可降解高分子丝的数量为20~144,可降解高分子丝的丝径为0.1~0.4毫米。可降解高分子丝为截面为圆形的高分子丝,且可降解高分子丝为非孔隙结构,即可降解高分子丝上不形成有微孔结构。
在一实施方式中,为了使促内皮化物质的释放与可降解高分子丝的降解相匹配,以获得持续的、长效地促内皮化作用,并且促内皮化物质的引入不影响可降解高分子丝的力学性能,从而不影响封堵器100的整体性能,促内皮化物质和所述可降解高分子丝的质量比不大于1:1。
上述封堵器100的封堵框架20由促内皮化物质改性的可降解高分子丝的编织而成,将该封堵器100植入生物体体内后,促内皮化物质能够逐渐释放而起到持续的、长效地促内皮化作用,有效地避免了促内皮化物质被血液冲走。因此,该封堵器100的能够有效地促内皮化。
促内皮化物质改性的可降解高分子丝可通过购买获得,也采用本领域技术人员掌握的合成方法制备得到。
例如,当促内皮化物质为蛋白质或多肽时,可降解高分子材料为聚酯时,按以下方法制备促内皮化物质改性的可降解高分子丝。
第一步:酸酐(酸)改性聚酯的制备。
采用聚酯(如聚乳酸)和马来酸酐(或其类似物)在引发剂作用下反应,其类似物可以为马来酸或溴代马来酸酐等,引发剂可以为过氧化二苯甲酰(bpo)或偶氮二异丁腈(aibn)等。反应在惰性气体保护下进行,温度控制在60℃以上,反应时间为10h。其中反应物马来酸酐(或其类似物)和聚酯摩尔比应大于1:1,引发剂的摩尔量不小于马来酸酐(或其类似物)的千分之一。反应结束后,采用氯仿-乙醚共沉淀体系将合成产物分离提纯2次,将所得沉淀于真空条件下干燥12h,得产物。
反应第二步:氨基化聚酯的制备。
将酸酐(酸)改性聚酯和二胺化合物进行反应,二胺化合物可以是乙二胺、丙二胺或丁二胺等,反应溶剂可以为但不限于乙酸乙酯、氯仿或四氢呋喃,反应可以在室温下进行也可以在冰浴条件下进行,其中反应物二胺化合和马来酸酐(或其类似物)的摩尔比应大于1:1。反应时间为1h。反应完成后,采用thf-h2o共沉淀体系分离纯化,然后将沉淀在室温下真空干燥至恒重,得产物。
反应第三步:促内皮化物质改性的聚酯的制备。
采用将氨基化聚酯溶解于相应的溶剂中,溶剂可以是四氢呋喃、乙酸乙酯或氯仿等,加入促内皮化物质(蛋白质或多肽)并调节溶液为弱碱性,室温反应12h以上,为加快反应可以加入脱水剂二环己基碳二亚胺dcc、2-(7-氧化苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸盐hatu等;其中促内皮化物质和酸酐(酸)的摩尔比应大于2:1。反应温度为0℃,反应时间为48h。反应完成后,过滤以除去反应生成的反应生成的二环己基脲,滤液采用thf-h2o共沉淀体系除去未反应的促内皮化物质和过量的dcc,将沉淀物冷冻干燥至恒重,得产物。
当促内皮化物质为磷脂时,采用如下方法制备促内皮化物质改性的可降解高分子材料。
反应第一步:预聚物的制备。
采用磷脂和环酯单体在引发剂作用下进行酯交换反应,环酯单体可以是乙交酯、丙交酯、己内酯等,引发剂可以为异辛酸亚锡或辛酸亚锡等,反应温度控制在100~200℃,反应时间12h以上,其中卵磷脂和环酯单体的摩尔比应大于1:1。反应在惰性环境中进行。
反应第二步:磷脂改性聚氨酯的制备。
将预聚物和异氰酸酯在引发剂作用下进行反应,异氰酸酯为二苯基甲烷二异氰酸酯或六亚甲基二异氰酸酯,反应溶剂为甲苯或丙酮等,引发剂为异辛酸亚锡或辛酸亚锡等,反应温度控制在60℃以上,异氰酸酯和预聚物的摩尔比应大于1:1,反应在惰性环境中进行,反应时间为2小时以上。反应结束后,采用甲苯-乙醇共沉淀体系,将沉淀在真空条件下干燥至恒重,得产物。
采用挤出、膜加工、注塑成型、热压成型、纺丝成型、吹塑成型等工艺将按上述方法制备得到促内皮化物质改性的可降解高分子材料制备成促内皮化物质改性的可降解高分子丝、促内皮物质改性的可降解高分子薄膜和/或促内皮化物质改性的可降解高分子套管等。
以下以挤出工艺为例进行说明磷脂改性的聚氨酯编织丝的制备。为保证磷脂改性的聚氨酯的正常挤出,挤出机可以采用单螺杆挤出机、双螺杆挤出机等,控制螺杆直径为30~150mm,长径比15:1~30:1,料筒和螺杆间隙0.1~0.3mm,机头滤网80-120目,1~2层。其次,控制挤出机各区域的温度,保证挤出产品性能的稳定性。其中进料段的温度不宜过高,防止物料在进料段塑化,引起出料不均,同时为保证进料的稳定性,温度不应太低,因此温度一般控制在120~150℃;此外为保证挤出产品性能的稳定性、均一性及连续性,机头温度不应太高或太低,适宜温度为160~190℃;其他区域(熔融段、均化段)温度可控制在熔点附近分解温度以下140~180℃。
以挤出-拉伸工艺为例来说明rgds改性聚乳酸膜的制备。rgds改性的聚乳酸膜的制备可以分为两步。第一步为挤出-铸片。将rgds改性的聚乳酸干燥后,干燥温度可以为60~120℃,干燥时间可以为2~8h,将干燥后的rgds改性的聚乳酸倒入双螺杆或单螺杆挤出机中,控制拉伸机温度130~230℃(其中进料段的温度不宜过高,一般控制在130~160℃),模头温度180~230℃,rgds改性的聚乳酸经过挤出机的塑化和均化,从模头挤出,并经冷却辊得到薄膜,铸片辊温度15~35℃。在一实施方式中,进料段的温度为135℃,熔融段温度为175~195℃,均化段温度为200℃,机头温度210℃,经过铸片辊得到rgds改性的聚乳酸膜,厚度为0.13mm。第二步为薄膜拉伸。将薄膜放入拉伸机中进行拉伸,其中拉伸预热区温度为30~130℃,拉伸区40~140℃,定型区20~170℃,可以进行单向拉伸也可分别横向和纵向的拉伸,拉伸倍率可控制在1~10,进而可制备出厚度为0.02~0.5mm的rgds改性的聚乳酸薄膜,降解周期可控制在2月~10年。在一实施方式中,采用双向拉伸的方法,首先进行纵向拉伸,控制纵向拉伸预热区温度为50℃,拉伸区温度为80℃,定型区温度为40℃,拉伸倍率为2.0;待纵向拉伸完成再进行横向拉伸,控制拉伸预热区温度为70℃,拉伸区温度为100℃,定型区温度为80℃,拉伸倍率为3.0,得拉伸后的rgds改性的聚乳酸薄膜,厚度为0.02mm。
请再次参阅图1,本实施方式中,封堵框架20包括远端封堵单元22、近端封堵单元24和腰部26。腰部26的两端分别与远端封堵单元22和近端封堵单元24连接,形成两端大中间小的两盘一腰结构。远端封堵单元22、近端封堵单元24和腰部26为一体式结构。
可以理解,在其他实施方式中,封堵框架20的结构不限于两端大中间小的两盘一腰结构。例如,封堵框架20中的封堵单元的个数为一个,此时,封堵单元和腰部相连形成截面大致呈t形的封堵框架。
封堵器100还包括远端封头40和近端封头60,远端封头40和近端封头60均用于汇聚并固定编织丝。编织丝具有远端自由端和近端自由端。其中,远端封头40设于远端封堵单元22上,近端封头60设于近端封堵单元24上。远端封头40用于固定编织丝的远端自由端,近端封头60用于固定编织丝的近端自由端。并且,在一实施方式中,近端封头60上设有活动连接组件(图1未示),活动连接组件用于与输送系统活动连接,以固定封堵器100,并在将封堵器100输送至病变部位后,能够释放封堵器100。具体地,可以在近端封头60上设有螺纹、多股丝等与输送系统活动连接。
在一实施方式中,远端封头40和近端封头60的材料均为促内皮化物质改性的可降解高分子丝,有利于内皮细胞快速地在远端封头40和近端封头60上爬附。需要说明的是,远端封头40和近端封头60的材料可以相同,也可以不同。并且,无论远端封头40和近端封头60的材料是否相同,远端封头40和/或近端封头60的材料与封堵框架20的材料可以相同,也可以不同。
在一实施方式中,封堵器100还包括远端标记结构30。远端标记结构30嵌设于远端封头40上,有利于避免远端标记结构30脱落而掉入血液中,从而避免临床风险。
远端标记结构30在x射线影像设备下可视。远端标记结构30的材料为在x射线影像设备下可视的材料。可以是在x射线影像设备下可视的金属材料或非金属材料。例如,远端标记结构30的材料为铂金、铂合金、黄金、钽、铁、钨、不锈钢、镍钛合金、钴铬合金、黄金的合金、钨基合金及铁基合金中的至少一种。或者,远端标记结构30的材料也可以为溴化钠、碘化钠等非金属材料。
远端封头40材料为促内皮化物质改性的可降解高分子材料,有利于内皮细胞快速地在远端封头40上爬附,使得内皮细胞能够较快地包覆远端封头40,从而包覆嵌设于远端封头40上的远端标记结构30,因而能够避免在内皮细胞爬附之前,由于封堵框架20的编织丝断裂及远端封头40降解而使远端标记结构30从远端封头40上脱落,有利于提高临床使用的安全性。
在一实施方式中,封堵器100还包括近端标记结构50。远端标记结构50嵌设于近端封头60上,有利于避免近端标记结构50脱落而掉入血液中,从而避免临床风险。
近端标记结构50的材料亦为在x射线影像设备下可视的材料,使近端标记结构50在x射线影像设备下可视。近端标记结构50的材料与远端标记结构30的材料可以相同,也可以不同。
近端封头60材料为促内皮化物质改性的可降解高分子材料,有利于内皮细胞快速地在近端封头60上爬附,使得内皮细胞能够较快地包覆近端封头60,从而包覆嵌设于近端封头60上的近端标记结构50,因而能够避免在内皮细胞爬附之前,由于封堵框架20的编织丝断裂及近端封头60降解而使近端标记结构50从近端封头60上脱落,有利于提高临床使用的安全性。
请参阅图2,在一实施方式中,封堵器100还包括阻流膜80,阻流膜80设置于封堵框架20中。设置阻流膜80以提升封堵器100的阻流性能。
在一实施方式中的,阻流膜80的厚度为0.02~0.5mm,以使阻流膜80具有较好的阻流性能,同时不显著增加封堵器100的入鞘阻力。
在一实施方式中,阻流膜80的数量为三,三个阻流膜80分别设置于封堵框架20的远端封堵单元22、近端封堵单元24和腰部26中。设置三个阻流膜80有利于避免残余分流,进一步提高阻流性能,从而提高封堵效果。可以理解,在其他实施方式中,阻流膜80的数量不限于三个,可以是一个,也可以是两个。当只设一个阻流膜80时,阻流膜80可以设置于远端封堵单元22、近端封堵单元24和腰部26之一中。当设两个阻流膜80时,两个阻流膜80可以设置于远端封堵单元22、近端封堵单元24和腰部26中的两个中。
阻流膜80的材料为促内皮化物质改性的可降解高分子材料,使得内皮细胞较快地在阻流膜80上爬附。阻流膜80的材料可以与编织丝的材料相同,也可以不同。
在一实施方式中,封堵器100还包括中部标记结构70。中部标记结构70设置于阻流膜80上。中部标记结构70可以通过包埋方式的设置于阻流膜80的内部,也可以通过粘结或缝合的方式设置于阻流膜80的表面上。
阻流膜80的材料为促内皮化物质改性的可降解聚合物,使得内皮细胞较快地在阻流膜80上爬附,从而较好地形成包覆阻流膜80的内皮细胞膜层,中部标记结构70位于内皮细胞膜层的内部,有利于避免中部标记结构70脱落而流入血液中,引起临床风险。
在一实施方式中,中部标记结构70包括至少两个标记物72。标记物72的材料为在x射线影像设备下可视的材料。
在一实施方式中,标记物72为圆形的金属片。例如,可以为圆形的黄金片、铂金片、不锈钢片等等。进一步地,该金属片的厚度为50~500微米,直径为100~600微米,以保证封堵器100在dsa等x射线影像设备下的可视性,且该金属片不至于过大而影响封堵器100的输送。
在一实施方式中,标记物72的数量为2,两个标记物72设置于位于远端封堵单元22中的阻流膜80上。并且,两个标记物72的连线穿过阻流膜80的几何中心。标记物72与阻流膜80的几何中心的最大距离等于阻流膜80的几何中心至阻流膜80的边缘的距离。例如,当阻流膜80呈圆形时,标记物72与阻流膜80的圆心的最大距离等于阻流膜80的半径。
如此设置标记物72,使得在植入术中,在x射线影像设备下,阻流膜80上的两个标记物72与远端封头40中的远端标记结构30的连线呈三角形,通过该三角形的形态变化判断远端封堵单元22与缺损部位是否抵接。例如,当远端封堵单元22在左心房展开了,远端标记结构30和两个标记物72之间的连线呈三角形。在x光的引导下,牵拉封堵器100向近端移动使之靠近房间隔位置。当继续牵拉封堵器100向近端移动至远端封堵单元22与房间隔有部分抵接时,两个标记物72与远端标记结构30的连线仍然呈三角形,此时如果继续牵拉封堵器100,由于两个标记物72紧挨着房间隔,运动受限,而远端封头40的运动不受限,在此情况下,远端标记结构30和两个标记物72构成的三角形的形状将发生变化,三角形的高逐渐变小,直至三点成一线,即远端标记结构30和两个标记物72在一直线上。如果此时继续牵拉封堵器100,则远端封头40有可能越过房间隔缺损位置,容易造成封堵器100脱落。
按上述方式设置远端标记结构30和中部标记结构70,有利于准备定位封堵器100,从而提高手术成功率,有利于保证封堵效果,提高疗效。
在一实施方式中,当阻流膜80的数量为三时,标记物72的数量为6个,每个阻流膜80按上述方式设置有两个标记物72。如此,不仅能够准确地定位封堵器100,还能从整体上观察封堵器100的形态,在封堵器100完全释放后,判断远端封堵单元22、近端封堵单元24和腰部26的形态是否良好。
在一实施方式中,同时设置有远端标记结构30和近端标记结构50。当封堵器100释放后的封堵状态较差需要回收封堵器100进行重新释放时,或者,在发生封堵器100从心脏缺损部位上脱落的极端情况时,只要能够识别远端封头40和近端封头60之一,从而用抓捕器抓捕远端封头40和近端封头60之一即能实现封堵器100的回收,提高了封堵器100回收的成功性。
上述封堵器100不仅能够持续地、长效地促内皮化,使得内皮细胞能够快速地在封堵器100上爬付,有利于避免血栓的形成,从而避免血栓栓塞的发生,提高了临床使用的安全性。并且,该封堵器100的结构设计有利于在植入时准确定位,使得封堵器100准确地封堵心脏缺损部位,提高封堵效果。
在另一实施方式中,封堵框架20为由3d打印形成的网状结构。将促内皮化物质改性的可降解聚合物作为原料,采用3d打印的方法形成封堵框架20,如此,封堵框架20的促内皮化物质亦能够逐渐释放而起到持续的、长效地促内皮化作用。可以理解,采用3d打印,不仅仅打印出封堵框架20,还一体式地打印远端封头40和近端封头60。
采用3d打印制备封堵框架20时,首先将促内皮化物质改性的可降解聚合物干燥,并将干燥后的促内皮化物质改性的可降解聚合物倒入3d打印机的材料供料装置中。利用ug、solidworks或pro-e等三维设计软件绘制出封堵器的三维实体模型,并保存为.stl格式,然后将.stl格式的三维实体模型导入切片软件。最后,利用切片软件将.stl模型和工艺参数生成为3d打印路径文件gcode,3d打印机在代码的控制下逐层打印出封堵框架20、远端封头40和近端封头60。为保证打印出的封堵框架20、远端封头40和近端封头60具有较高的力学强度和完整性,应控制打印填充密度、打印温度、打印速度等工艺参数适当,因此在一实施方式中,打印温度为170~250℃,打印填充密度为50~90%,打印速度为70~140mm/s。在一实施方式中,打印温度为200℃,打印填充密度为70%,打印速度为80mm/s。
在一实施方式中,干燥的温度为60~120℃,干燥的时间可以2~8h。
促内皮化物质改性的可降解聚合物中,促内皮化物质和可降解聚合物的材料及配比关系、促内皮化物质改性的可降解聚合物的制备方法、阻流膜及各标记结构的设置等与上文所述相同,此处不再赘述。
以下通过具体实施例对上述封堵器进一步阐述。
以下实施例中,高分子丝的抗张强度按gb/t1040.1-2006测试,采用电子万能拉力机,样品标距10mm,拉伸速度控制为1mm/min。
实施例1
将3g重均分子量3w的消旋聚乳酸、马来酸酐和bpo按1:5:0.05的摩尔比混合均匀,并于室温真空干燥至恒重,然后在氮气保护下于100℃反应10h,然后采用氯仿-乙醚共沉淀体系将合成产物分离提纯2次,将所得沉淀于真空条件下干燥12h,得马来酸酐改性的聚乳酸,产率92%。在搅拌的条件下,将6g马来酸酐改性的聚乳酸溶于20ml四氢呋喃中,在冰浴条件下,向马来酸酐改性的聚乳酸的四氢呋喃溶液中滴入过量的乙二胺(20ml)溶液。待滴加完毕,室温反应1h。反应完成后,采用thf-h2o共沉淀体系分离纯化,然后将沉淀在室温下真空干燥至恒重,得氨基化聚乳酸,产率90%。将6g氨基化聚乳酸溶于100mlthf溶液中,加入0.25g二环己基碳二亚胺,并用n-甲基吗啡啉将反应混合物的ph调节至8~9。搅拌条件下将rgds的thf溶液20ml(含rdgs0.87g)滴入到上述反应混合物中,在0℃条件下搅拌反应48h后过滤,除去反应生成的二环己基脲,滤液采用thf-h2o共沉淀体系除去未反应的rgds和过量的dcc,将沉淀物冷冻干燥至恒重,得精氨酸-甘氨酸-天冬氨酸-丝氨酸(rgds)改性的聚乳酸。产率:90%。精氨酸-甘氨酸-天冬氨酸-丝氨酸(rgds)改性的聚乳酸的傅立叶红外数据为:[ft-ir:1680cm-1(-conh-),1540cm-1(-conh-),1734cm-1(o=c-o-c=o)]。
采用挤出机将精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸制备成精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝和套管,采用螺杆直径为30mm的单螺杆挤出机,其长径比为25:1,压缩比为3:1,料筒和螺杆的间隙为0.2mm,机头滤网为120目,2层。进料段的温度为145℃,熔融段温度为160℃,均化段温度为175℃,机头温度170℃。挤出之后经水冷即可得到精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝和精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸套管。精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝的丝径为0.40mm,其抗张强度为280mpa。
采用挤出-拉伸工艺将精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸制备成精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸薄膜。采用双向拉伸的方法,首先进行纵向拉伸,控制纵向拉伸预热区温度为50℃,拉伸区温度为80℃,定型区温度为40℃,拉伸倍率为2.0;待纵向拉伸完成再进行横向拉伸,控制拉伸预热区温度为70℃,拉伸区温度为100℃,定型区温度为80℃,拉伸倍率为3.0。精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸薄膜的厚度为0.02mm。
精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝用于编织封堵框架,精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸套管用于形成远端封头和近端封头,精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸薄膜用于制备阻流膜。
将一组包括丝径0.40mm的20根平行排列的精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝作为经度编织丝和一组包括丝径0.40mm的20根平行排列的精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝作为纬度编织丝上下交错编织形成编织网,将该编织网进行热定型形成封堵框架,封堵框架包括远端封堵单元、近端封堵单元及分别连接远端封堵单元和近端封堵单元的腰部,远端封堵单元上设有远端封头,近端封堵单元上设有近端封头,远端封头和近端封头上分别嵌设有远端标记结构和近端标记结构。分别将三个阻流膜缝合于远端封堵单元、近端封堵单元和腰部中,其中,三个阻流膜均为圆形,每个阻流膜上设有两个铂金标记物,两个铂金标记物位于阻流膜的同一直径的两端,阻流膜的圆心至铂金标记物的最大距离等于阻流膜的半径。其中,铂金标记物的厚度为50微米,直径为600微米。精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝中,精氨酸-甘氨酸-天冬氨酸-丝氨酸和聚乳酸的质量比为1:10,聚乳酸的分子量为3w,聚乳酸的多分散系数为1.2。远端封头、近端封头和阻流膜的材料均与编织丝的材料相同。
将实施例1的封堵器植入到八马猪的房间隔位置,并以结构和规格均相同,但材料为未改性的聚乳酸的封堵器为对照组。2个月后分别取出相应的组织,扫描电镜下观察组织的内皮化程度,结果如图3a和图3b所示。2个月后精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织的封堵器已经完成内皮化,封堵器的表面有一层较厚的内皮细胞;而未改性的聚乳酸编织封堵器表面仍有裸露的丝材,并未完全内皮化。
实施例2
将卵磷脂28.27g、l-丙交酯14.4g、异辛酸亚锡0.05g分别加入反应瓶中,搅拌均匀,控制反应温度120℃,真空反应36h得到预聚物,该预聚物的分子量为1000,产率100%。将30g得到的预聚物溶解在100ml甲苯中,加入0.04g辛酸亚锡,然后在氮气条件下滴入六亚甲基二异氰酸酯(15.3g)的甲苯溶液20ml,在120℃的条件下反应7h。采用甲苯-乙醇共沉淀体系,将沉淀在真空条件下干燥至恒重,得卵磷脂改性的聚氨酯,产率:90%。卵磷脂改性的聚氨酯的傅立叶红外数据为:[ftir:970cm-1(-n(ch3)),1528cm-1(-nh)]
采用挤出机将卵磷脂改性的聚氨酯制备成卵磷脂改性的聚氨酯编织丝,采用膜加工工艺将卵磷脂改性的聚氨酯制备成卵磷脂改性的聚氨酯薄膜和卵磷脂改性的聚氨酯套管。采用挤出-拉伸工艺将卵磷脂改性的聚氨酯制成卵磷脂改性的聚氨酯薄膜。采用双向拉伸的方法,首先进行纵向拉伸,控制纵向拉伸预热区温度为50℃,拉伸区温度为80℃,定型区温度为40℃,拉伸倍率为2.0;待纵向拉伸完成再进行横向拉伸,控制拉伸预热区温度为70℃,拉伸区温度为100℃,定型区温度为80℃,拉伸倍率为3.0。卵磷脂改性的聚氨酯薄膜的厚度为0.5mm。
卵磷脂改性的聚氨酯编织丝用于编织封堵框架,卵磷脂改性的聚氨酯套管用于形成远端封头和近端封头,卵磷脂改性的聚氨酯薄膜用于制备阻流膜。
采用螺杆直径为30mm的单螺杆挤出机,其长径比为25:1,压缩比为3:1,料筒和螺杆的间隙为0.2mm,机头滤网为120目,2层。进料段的温度为145℃,熔融段温度为155~165℃,均化段温度为175℃,机头温度170℃。挤出之后经水冷即可得到卵磷脂改性的聚氨酯编织丝,卵磷脂改性的聚氨酯编织丝的丝径为0.1mm,其抗张强度为350mpa。
将一组包括30根丝径0.10mm的平行排列的卵磷脂改性的聚氨酯编织丝作为经度编织丝和一组包括30根丝径0.10mm的平行排列的卵磷脂改性的聚氨酯编织丝作为纬度编织丝上下交错编织形成编织网,将该编织网进行热定型形成封堵框架,将该编织网进行热定型形成封堵框架,封堵框架包括远端封堵单元、近端封堵单元及分别连接远端封堵单元和近端封堵单元的腰部,远端封堵单元上设有远端封头,近端封堵单元上设有近端封头,远端封头和近端封头上分别嵌设有远端标记结构和近端标记结构。分别将三个阻流膜缝合于远端封堵单元、近端封堵单元和腰部中,其中,三个阻流膜均为圆形,每个阻流膜上设有两个黄金标记物,两个黄金标记物位于阻流膜的同一直径的两端,阻流膜的圆心至黄金标记物的最大距离等于阻流膜的半径。其中,黄金标记物的厚度为500微米,直径为100微米。卵磷脂改性的聚氨酯聚乳酸编织丝中,卵磷脂和聚氨酯的质量比为2:8,聚氨酯的分子量为10w,聚氨酯的多分散系数为1.1。远端封头、近端封头和阻流膜的材料均与编织丝的材料相同。
将实施例2的封堵器植入到八马猪的房间隔位置,并以结构和规格均相同,但材料为未改性的聚氨酯的封堵器为对照组。2个月后分别取出相应的组织,扫描电镜下观察组织的内皮化程度,结果如图4a和图4b所示。2个月后卵磷脂改性的聚氨酯编织的封堵器已经完成内皮化,封堵器的表面有一层较厚的内皮细胞;而未改性的聚氨酯编织封堵器表面仍有裸露的丝材,并未完全内皮化。
实施例3
将磷脂酰胆碱28.27g、丙交酯14.4g、异辛酸亚锡0.05g分别加入反应瓶中,搅拌均匀,控制反应温度120℃,真空反应36h得到预聚物,该预聚物的分子量为1000,产率100%。将30g得到的预聚物溶解在100ml甲苯中,加入0.04g辛酸亚锡,然后在氮气条件下滴入六亚甲基二异氰酸酯(15.3g)的甲苯溶液20ml,在120℃的条件下反应7h。采用甲苯-乙醇共沉淀体系,将沉淀在真空条件下干燥至恒重,得磷脂酰胆碱改性的聚乳酸,产率:90%。磷脂酰胆碱改性的聚乳酸的红外数据为:[ftir:970cm-1(-n(ch3)),1540cm-1(-nh),1735cm-1(-c=o)]。
采用挤出机将磷脂酰胆碱改性的聚乳酸制备成磷脂酰胆碱改性的聚乳酸编织丝和套管,采用膜加工工艺将磷脂酰胆碱改性的聚乳酸制备成磷脂酰胆碱改性的聚乳酸薄膜。磷脂酰胆碱改性的聚乳酸编织丝用于编织封堵框架,磷脂酰胆碱改性的聚乳酸套管用于形成远端封头和近端封头,磷脂酰胆碱改性的聚乳酸薄膜用于制备阻流膜。
挤出工艺和挤出-拉伸工艺与实施例2基本相同,不同的是编织丝的丝径不同,此处不再赘述。其中,磷脂酰胆碱改性的聚乳酸编织丝的丝径为0.2mm,其抗张强度为640mpa。磷脂酰胆碱改性的聚乳酸薄膜的厚度为0.05mm。
将一组包括50根丝径0.20mm的平行排列的磷脂酰胆碱改性的聚乳酸编织丝作为经度编织丝和一组包括50根丝径0.20mm的平行排列的磷脂酰胆碱改性的聚乳酸编织丝作为纬度编织丝上下交错编织形成编织网,将该编织网进行热定型形成封堵框架,封堵框架包括远端封堵单元、近端封堵单元及分别连接远端封堵单元和近端封堵单元的腰部,远端封堵单元上设有远端封头,近端封堵单元上设有近端封头,远端封头和近端封头上分别嵌设有远端标记结构和近端标记结构。分别将三个阻流膜缝合于远端封堵单元、近端封堵单元和腰部中,其中,三个阻流膜均为圆形,位于远端封堵单元和近端封堵单元的阻流膜中,每个设有两个铂金标记物,两个铂金标记物位于阻流膜的同一直径的两端,阻流膜的圆心至铂金标记物的最大距离等于阻流膜的半径。其中,铂金标记物的厚度为100微米,直径为100微米。磷脂酰胆碱改性的聚乳酸中,磷脂酰胆碱和聚乳酸的质量比为1:5,聚乳酸的分子量为40w,聚乳酸的多分散系数为5.0。远端封头、近端封头和阻流膜的材料均与编织丝的材料相同。
实施例4
将3g重均分子量10w的消旋聚乳酸、马来酸酐和bpo按1:5:0.05的摩尔比混合均匀,并于室温真空干燥至恒重,然后在氮气保护下于100℃反应10h,然后并采用氯仿-乙醚共沉淀体系将合成产物分离提纯2次,将所得沉淀于真空条件下干燥12h,得马来酸酐改性的聚乳酸,产率92%。在搅拌的条件下,将6g马来酸酐改性的聚乳酸溶于20ml四氢呋喃中,在冰浴条件下,向马来酸酐改性的聚乳酸的四氢呋喃溶液中滴入过量的乙二胺(20ml)溶液。待滴加完毕,室温反应1h。反应完成后,采用thf-h2o共沉淀体系分离纯化,然后将沉淀在室温下真空干燥至恒重,得氨基化聚乳酸,产率90%。将6g氨基化聚乳酸溶于100mlthf溶液中,加入0.25g二环己基碳二亚胺,并用n-甲基吗啡啉将反应混合物的ph调节至8~9。搅拌条件下将rgd的thf溶液20ml(含rdg0.87g)滴入到上述反应混合物中,在0℃条件下搅拌反应48h后过滤,除去反应生成的二环己基脲,滤液采用thf-h2o共沉淀体系除去未反应的rgd和过量的dcc,将沉淀物冷冻干燥至恒重,得精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸。产率:90%。精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸的红外数据为:[ft-ir:1680cm-1(-conh-),1540cm-1(-conh-),1734cm-1(o=c-o-c=o)]。
采用挤出机将精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸制备成精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸编织丝和套管,采用膜加工工艺将精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸制备成精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸薄膜。精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸编织丝用于编织封堵框架,精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸套管用于形成远端封头和近端封头,精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸薄膜用于制备阻流膜。
挤出工艺和挤出-拉伸工艺与实施例1基本相同,不同的是编织丝的丝径不同,此处不再赘述。其中,精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸编织丝的丝径为0.3mm,其抗张强度为560mpa。精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸薄膜的厚度为0.1mm。
将一组包括30根丝径0.30mm的平行排列的精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸编织丝作为经度编织丝和一组包括15根丝径0.30mm的平行排列的精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸编织丝编织丝作为纬度编织丝上下交错编织形成编织网,将该编织网进行热定型形成封堵框架,封堵框架包括远端封堵单元、近端封堵单元及分别连接远端封堵单元和近端封堵单元的腰部。分别将三个阻流膜缝合于远端封堵单元、近端封堵单元和腰部中,其中,三个阻流膜均为圆形,每个阻流膜上设有两个铂金标记物,两个铂金标记物位于阻流膜的同一直径的两端,阻流膜的圆心至铂金标记物的最大距离等于阻流膜的半径。其中,铂金标记物的厚度为120微米,直径为300微米。精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸编织丝中,精氨酸-甘氨酸-天门冬氨酸和聚乳酸的质量比为1:7,聚乳酸的分子量为10w,聚乳酸的多分散系数为3.0。远端封头、近端封头和阻流膜的材料均与编织丝的材料相同。
实施例5
采用与实施例1基本相同的方法制备精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝、套管和薄膜。不同的是,编织丝的丝径为0.4mm,其抗张强度为600mpa。精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸薄膜的厚度为0.2mm。
将一组包括丝径0.40mm的10根平行排列的精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝作为经度编织丝和一组包括丝径0.40mm的10根平行排列的精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝作为纬度编织丝上下交错编织形成编织网,将该编织网进行热定型形成封堵框架,封堵框架包括远端封堵单元、近端封堵单元及分别连接远端封堵单元和近端封堵单元的腰部,远端封堵单元上设有远端封头,近端封堵单元上设有近端封头,远端封头和近端封头上分别嵌设有远端标记结构和近端标记结构。分别将三个阻流膜缝合于远端封堵单元、近端封堵单元和腰部中,其中,三个阻流膜均为圆形,每个阻流膜上设有两个铂金标记物,两个铂金标记物位于阻流膜的同一直径的两端,阻流膜的圆心至铂金标记物的最大距离等于阻流膜的半径。其中,铂金标记物的厚度为200微米,直径为200微米。精氨酸-甘氨酸-天冬氨酸-丝氨酸改性的聚乳酸编织丝中,精氨酸-甘氨酸-天冬氨酸-丝氨酸和聚乳酸的质量比为1:1,聚乳酸的分子量为20w,聚乳酸的多分散系数为1.1。远端封头、近端封头和阻流膜的材料均与编织丝的材料相同。
实施例6
采用与实施例4相同的方法制备精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸,并将精氨酸-甘氨酸-天门冬氨酸改性的聚乳酸于80℃下干燥2h后倒入3d打印机的材料供料装置中。其次将干燥好的改性聚乳酸置于3d打印机的材料供料装置中,打印得到封堵框架,封堵框架包括远端封堵单元、近端封堵单元及分别连接远端封堵单元和近端封堵单元的腰部,远端封堵单元上设有远端封头,近端封堵单元上设有近端封头。其中,打印温度为200℃,打印填充密度为70%,打印速度为120mm/s。
进一步,分别将三个阻流膜缝合于远端封堵单元、近端封堵单元和腰部中,其中,三个阻流膜均为圆形,每个阻流膜上设有两个铂金标记物,两个铂金标记物位于阻流膜的同一直径的两端,阻流膜的圆心至铂金标记物的最大距离等于阻流膜的半径。其中,铂金标记物的厚度为250微米,直径为80微米。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!