利用基于MYC癌基因过表达的合成致死的方法与流程
本发明通用性的涉及用rho激酶抑制剂处理表现出高水平myc蛋白表达的癌细胞的亚类的产品和方法。
相关申请交叉引用
本申请要求2017年6月4日提交的美国申请号为62/514,861,题为“在myc过表达癌症中利用合成致死的材料和方法”的临时申请的权益。
背景技术:
myc家族突变和过表达的倾向对许多类型的人类癌症的发生有贡献。事实上,在超过50%的人类癌症中发现了致癌myc家族失调。myc癌基因家族包括三个成员,即c-myc、mycn和mycl。总的来说,这个“超转录因子”家族被认为是调节整个人类基因组的至少15%(并且在其他动物中也是如此)。因此,许多细胞过程,例如核糖体生物发生、蛋白质翻译、细胞周期进程和代谢都依赖于对myc基因类别的适当调节。
myc基因(也称为mycc或c-myc)是一种在细胞周期进程、凋亡和细胞转化中发挥作用的原癌基因。许多类型的癌细胞表现出myc基因的扩增。已发现由wnt-apc通路缺陷导致的人结肠癌增强tcf介导的myc转录激活。在t细胞白血病中,notch信号传导的失调与诱导myc的表达有关。然而,肿瘤发生也可以由该基因的易位引起。例如,伯基特淋巴瘤(burkittlymphoma)和多发性骨髓瘤都以myc基因的易位为标志。
转基因小鼠研究表明,即使myc癌基因的短暂破坏也足以引起肿瘤消退,这表明在癌症治疗中靶向myc癌基因可能具有有益效果。尽管如此,由于许多原因,开发靶向myc癌基因的药物已被证明具有挑战性。首先,myc是一种核蛋白,因此开发特异性单克隆抗体在技术上是不切实际的。接下来,与激酶不同,转录因子缺乏特异的活性位点供小分子相互作用并抑制转录活性。
因此,科学研究支持了许多原因,为什么靶向myc癌基因可以是癌症治疗的有效策略。尽管如此,直接靶向myc似乎在技术上并不切实可行。因此,本领域需要一种有效方法来处理过表达myc的癌细胞。
技术实现要素:
一方面,本发明涉及治疗癌细胞的方法,所述方法包括向癌细胞群体施用有效量的rock抑制剂。在本发明进一步的实施方案中,所述rock抑制剂是二甲基法舒地尔(dimethylfasudil)。在本发明的一些实施方案中,被应用本方法的癌细胞以高于基础水平表达myc基因。所述基础水平是被认为“正常”的基因表达水平(即没有与该水平相关的病理)。例如,基础水平是不促进癌变的myc基因表达水平。
在本发明的另一实施方案中,所述方法包括治疗癌细胞的方法,所述方法以一定量的rock抑制剂靶向myc基因。适当的量是减少肿瘤增殖的rock抑制剂的量。在本发明的优选实施方案中,所述rock抑制剂是二甲基法舒地尔。
在本发明另一个可选的实施方案中,所述方法包括用rock抑制剂,优选二甲基法舒地尔,通过在所述癌细胞中诱导细胞凋亡来治疗癌细胞。
在本发明的另一个可选的实施方案中,所述方法包括鉴别响应于通过用rock抑制剂,优选二甲基法舒地尔,进行处理而抑制肿瘤细胞增殖的癌的亚型,包括步骤(i)接收来自受试对象的癌样品,(ii)在受试对象的样品中检测myc基因的异常,和(iii)基于所发现的异常鉴别影响受试对象的癌分类的类型。根据本发明的实施方案,异常的类型包括但不限于myc基因的表达水平、基因中的基因突变以及基因的位置和数量。
根据另一实施方案,所要求保护的抑制肿瘤细胞增殖的方法包括向过表达myc基因的癌细胞的样品施用有效剂量的二甲基法舒地尔的步骤。
根据另一个可选的实施方案,治疗对rock抑制剂有响应的癌细胞的方法包括以下步骤:(i)鉴别带有myc基因异常的癌细胞,并施用有效剂量的rock抑制剂,优选使用二甲基法舒地尔。
根据要求保护的发明的实施方案,所述方法适用于哺乳动物,包括人类。
根据本发明的优选实施方案,rock抑制剂的有效量是足以抑制癌细胞增殖的量。在可选的实施方案中,rock抑制剂的有效量是杀伤癌细胞的量。然而,在另一实施方案中,rock抑制剂的有效量是减缓增殖速率的量。
附图说明
本专利或申请文件包含至少一幅以彩色作成的图。在请求并支付必要费用后,将由当局提供本专利或专利申请公开有彩图的复制本。
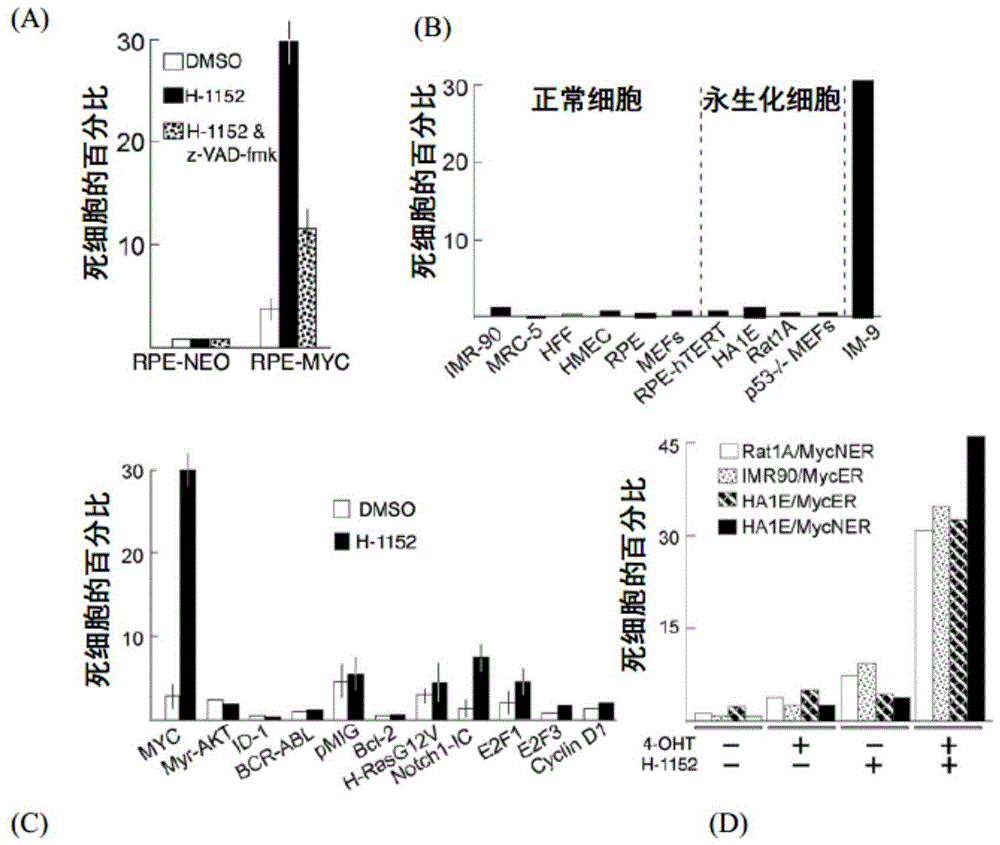
图1示出当myc过表达时,h-1152引发强烈的细胞毒性。图1(a)示出由h-1152靶向的过表达myc的人细胞的合成致死。用0.1%dmso,6μmh-1152或6μmh-1152+100μmz-vad-fmk处理过表达myc的人细胞(rpe-myc)或没有过表达myc(rpe-neo)的人细胞72小时。通过台盼蓝排除测试法测定细胞存活率。每列代表3次独立实验的平均值,每个实验进行三份平行测试。误差线表示一倍标准差。图1(b)显示了h-1152对正常细胞和myc-过表达人癌细胞系im-9的细胞毒性。将h-1152以6μm施加于指定的细胞3天。通过台盼蓝排除测试法测定细胞存活率。示出代表性实验。图1(c)示出h-1152优先选择在过表达myc的大鼠细胞中的毒性。将携带空载体或各种指定癌基因的rat1a细胞用0.1%dmso或6μmh-1152处理3天。通过台盼蓝排除测试法测定细胞存活率。每列代表3次独立实验的平均值,每个实验进行三份平行测试。误差线表示一倍标准差。图1(d)示出通过h-1152与myc或mycn的急性激活相结合的细胞死亡的协同诱导。将表达mycer或mycner的大鼠(rat1a)或人(ha1e和imr-90)细胞与或不与6μmh-1152和/或200nm4-oht一起孵育3天。通过台盼蓝排除测试法测定细胞存活率。示出代表性实验。
图2示出h-1152在过表达myc的细胞中引发线粒体依赖的细胞凋亡。图2(a)示出h-1152对线粒体膜电位δψm的影响。将rpe-myc细胞暴露于6μmh-115248小时,然后用40nmmitotrackerred(molecularprobes)孵育30分钟并固定。将固定的细胞用dapi(蓝色)对dna染色,然后用共聚焦激光显微镜分析。箭头指示凋亡细胞核。比例尺,10μm。参见附录a-免疫荧光显微方法。图2(b)示出对所示测试呈阳性的细胞百分比。用0.1%dmso或6μmh-1152处理rpe-myc和rpe-neo细胞3天,然后进行指定的测定。每列代表3次独立实验的平均值,每个实验进行三份平行测试。误差线表示一倍标准差。
图3显示了h-1152如何不依赖于其对rock激酶活性的抑制而引起myc-表达细胞的杀伤。图3(a)示出h-1152及其三种类似物的化学结构。图3(b)表明h-1152,而不是其他的rock激酶抑制剂,如何优先选择杀伤rpe-myc细胞。用指定浓度的各种rock激酶抑制剂处理rpe-myc和rpe-neo细胞72小时。通过台盼蓝排除测试法测定细胞存活率。每列代表3次独立实验的平均值,每个实验进行三份平行测试。误差线表示一倍标准差。
图4说明了rock1和rockii的组合消耗如何不能杀伤rpe-myc细胞。将rpe-neo和rpe-myc细胞用针对rock1和rock2的esirna单独或组合处理4天。转染aurora-besirna作为阳性对照以引发选择性杀伤rpe-myc而不是rpe-neo细胞。然后通过台盼蓝排除测试法测定细胞存活率。通过台盼蓝排除测试法测定细胞存活率。每列代表3次独立实验的平均值,每个实验进行三份平行测试。误差线表示一倍标准差。
图5通过示出h-1152对75种人癌细胞系的细胞毒性,说明myc丰度是人肿瘤细胞系对h-1152的响应的单变量预测因子。用0.1%dmso或6μmh-1152将myc高组和myc低组中的细胞系处理4天。然后通过台盼蓝排除测试法测定细胞存活率。图5(a)是表示两个独立实验的平均值的直方图。图5(b)示出具有数据群的箱线图,显示75种人癌细胞系中h-1152敏感性的分布。结果表示为在h-1152存在下的死细胞的百分比减去在dmso存在下的死细胞百分比。红色、黄色和绿色点分别代表具有丰富的myc,mycn和l-myc的细胞系。用双侧mann-whitney检验比较两个数据集,表明p<0.0001。
图6表明癌细胞系中的myc高丰度使细胞对h-1152的杀伤敏感。图6(a)示出在人癌细胞系中通过其同源rnai消耗myc。rna干扰方法见附录b。人癌细胞系,包括hela(泳道1和2),calu-6(泳道3和4),nci-h841(泳道5和6),c-33-a(泳道7和8)和du-145(泳道9和10),用对照荧光素酶esirna(泳道1、3、5、7和9)或mycesirna(泳道2、4、6、8和10)转染。在sirna转染后3天制备提取物并对myc和肌动蛋白的表达进行免疫印迹。图6(b)示出通过消耗myc而抑制h-1152毒性。用对照荧光素酶esirna或mycesirna以2天间隔转染指定的癌细胞系两次,然后在第二次sirna转染12小时后暴露于6μmh-1152。在施用h-1152四天后通过台盼蓝排除测试法测定细胞存活率。每列代表3次独立实验的平均值,每个实验进行三份平行测试。误差线代表标准差。与用对照rnai和h-1152处理的细胞相比,单星表明p<0.001。有关统计分析的更多信息,请参见附录c。
图7表明h-1152如何对过表达myc的癌细胞的肿瘤发生展现出来治疗功效。图7(a)示出癌细胞系中的myc表达。对来自四种人癌细胞系(1.nci-h524,2.nci-h841,3.nci-h211,4.nci-h2199)的提取物,通过免疫印迹对myc和微管蛋白进行印迹。图7(b)–(e)证明了h-1152在体内的治疗功效。有关小鼠体内测试的方法,请参阅附录d。将两个myc高细胞系和两个myc低细胞系皮下植入无胸腺小鼠中(每次注射一百万至一千万个细胞)。当肿瘤达到约50-70mm3时,将荷瘤小鼠随机分组,每天两次接受载体或h-1152经口腔灌胃(每次注射60mg/kg体重),直至终点。在指定的时间点测定肿瘤体积。图7(b)示出nci-h524的结果;图7(c)示出nci-h841的结果;图7(d)示出nci-h2199的结果;图7(e)示出nci-h211的结果。
图8是总结人癌细胞系myc丰度和响应的表。
具体实施方式
本发明提供了使用rho相关蛋白激酶(下文称“rock”)的抑制剂治疗癌细胞的方法。具体地,该方法涉及使用rock抑制剂处理癌细胞,特别是表现出myc癌基因高表达水平的细胞。本文考虑的方法可以单独使用或与传统的癌症治疗如化学治疗和/或放射治疗一起使用。
rock是一个激酶家族,包含属于丝氨酸-苏氨酸激酶的agc(pka/pkg/pkc)家族的同源物rock1和rock2。作为gtp酶rho的下游效应蛋白,rock是细胞骨架的主要调节因子。基于其在肌动蛋白解聚、肌动蛋白纤维收缩和丝稳定中的作用,rock活性对于适当的细胞迁移是至关重要的。
rock1和rock2在它们之间显示出显著的同源性,在它们的氨基酸序列中有超过65%的同一性。值得注意的是,rock1和rock2在其激酶结构域之间具有最高的氨基酸同源性(92%),导致相似的体外激酶活性。然而,rock1和rock2的ph-c1结构域对膜脂具有不同的结合偏好:表明rock2的ph-c1结构域与(3,4,5)-三磷酸磷脂酰肌醇和(4,5)-二磷酸磷脂酰肌醇强烈结合,而rock1的ph-c1结构域没有。结合潜力的这种差异可能表明为什么rock1和rock2具有不同的亚细胞分布,其取决于细胞类型和方法而变化,以及为什么它们具有重叠但在功能上有分化。
本发明基于以下发现:rock1和rock2抑制剂二甲基法舒地尔(下文中称为“h-1152”)在各种过表达myc的细胞中引起细胞毒性。h-1152是rock1和rock2的有效、选择性的和可逆的抑制剂,被开发来治疗神经疾病和心血管疾病。尽管如此,在过表达myc的细胞中筛选诱导致死相互作用的各种小分子已揭示h-1152在myc过表达细胞系如im-9中引发细胞死亡是有效的,但在正常和永生化细胞中不具有相似的致死作用。
本发明的第一方面涉及以有效量处理癌细胞(并因此诱导细胞毒性,抑制细胞增殖和/或存活)的方法。该方法涉及向癌细胞群体施用h-1152。
在本发明的一个实施方案中,由h-1152处理靶向的癌细胞群体是造血淋巴组织。恶性血液病占美国新诊断癌症的9.5%。造血和淋巴组织的肿瘤影响循环和免疫系统的成员,即血液、骨髓、淋巴和淋巴系统。这些系统中癌症的常见原因是染色体易位。本发明的一个实施方案涉及伯基特淋巴瘤。这种类型的癌症通常针对淋巴系统,但尤其针对b淋巴细胞。尽管存在各种类型的伯基特淋巴瘤,它们都以染色体易位所致的myc基因失调为特征。在大约80%的伯基特淋巴瘤中观察到典型的myc向免疫球蛋白重链基因座的易位。myc的其他变异易位涉及κ或λ轻链基因座,每种类型易位的类型以所有伯基特淋巴瘤病例的约10%的频率发生。本发明的另一个实施方案涉及白血病,包括但不限于急性t细胞白血病,其中观察到myc基因易位到t细胞受体基因座之一中。本发明的其他实施方案涉及急性髓性白血病、急性淋巴细胞白血病、慢性髓性白血病、急性淋巴细胞白血病,神经母细胞瘤和导管癌。
在本发明的另一个实施方案中,癌细胞群体源于实体瘤,例如肉瘤(例如骨肉瘤),癌(例如来自前列腺的腺癌;肺的小细胞癌乳腺癌),wilms瘤,鳞状细胞癌和淋巴瘤。
根据本发明的一些实施方案,确定肿瘤细胞是否过表达myc癌基因。过表达可以通过多种方式定义,但从最本质上讲,它被定义为高于正常的基因表达水平。已知基因表达模式在正常细胞和癌细胞之间复杂地不同。因此,基因的正常表达定义为不诱导明显变化的蛋白质水平,而基因的过表达定义为导致表型变化的水平。
基因过表达主要通过两种方式。在一个简化模型中,基因由于变构反应而过表达。另一个是由于基因重复。
基因过表达的测定是通过许多不同的方法和技术完成的。一种方法将正常人和患者组织中的基因的mrna水平相比较(优选年龄、性别和种族相同,以使不同的因素最小化)。可以使用rna印迹(northernblotting)或rt-qpcr定量和比较mrna水平。另一种方法是使用诸如免疫印迹(westernblotting)的技术测量蛋白质定量的水平。然而,前述方法仅出于说明的目的而给出。本领域普通技术人员可以利用多种定性和定量技术中的任何一种或多种来确定myc基因是否在患者中过表达。以下是通过患者的细胞分离确定myc表达的一个实例(具有选择的替代方案)。
分离组织细胞供myc分析
首先进行活检,从患者中提取癌性原代组织样品。用蛋白水解酶(例如胰蛋白酶和胶原酶)处理组织样品,以破坏将组织样品保持在一起的细胞外基质。优选地,用诸如乙二胺四乙酸(“edta”)的试剂进一步处理组织样品来螯合钙离子,以破坏细胞-细胞粘附。然后通过温和搅动将组织解离成单个活细胞。利用抗体的特异性结合性质进一步精制细胞悬液。与表面蛋白特异性结合的抗体偶联于基质,例如胶原蛋白、多糖珠、塑料和荧光染料,其被进一步利用来分离细胞。使用荧光染料作为标记,通过电子荧光激活细胞分选仪从未标记的细胞中分选细胞。
另一种分离细胞的方法是进行激光显微切割。该方法需要仔细剥离为显微镜准备的薄组织切片。在一种方法中,癌组织切片以薄塑料膜包被。用聚焦的红外激光束脉冲照射包含所选细胞的区域。由此,该区域熔化,导致下面细胞结合。然后移走捕获的细胞供另外的分析。
myc丰度的定量测定
一旦分离出癌组织细胞,进行myc蛋白丰度的定量分析,以确定癌细胞是否适合所要求的处理。进行这种分析的一种方法是将组织细胞中的myc表达与在人视网膜色素上皮细胞中稳定导入了myc选择标记和htert的细胞系进行比较。有关myc稳定细胞的制备,请参见附录e。
测定myc表达的另一种方法是从邻近的正常细胞中分离肿瘤细胞并测定。正常细胞和癌细胞的外观有显着的表型差异。与正常细胞不同,癌细胞由于不能停止生长而具有异常形状。因此,癌细胞保持倍增,形成肿瘤。由于癌细胞在正常细胞的背景下是明显的,因此可以将每种类型的细胞-肿瘤细胞和正常细胞分离,用于定量基因表达。例如,如果患者患有肝癌,将肿瘤肝细胞中myc表达水平与相邻但正常细胞的myc表达水平进行比较。类似地,如果患者一侧乳房患有乳腺癌,则可以针对来自未受影响的乳房2的正常myc表达来测定来自乳房1的乳腺肿瘤的myc表达水平。
一旦收集疑似癌细胞和对照组(例如来自细胞系的正常细胞或来自邻近区域的正常细胞)供分析,可通过免疫印迹分析确定myc的表达。关于免疫印迹的实验方案,参见附录f。选择表达可比水平的myc的癌细胞作为要求保护的发明的候选。
用h-1152处理
选定候选后,用h-1152处理。将h-1152新鲜溶解于载体(10%dmso,90%聚乙二醇300)中,并通过每天两次经口灌胃给予。
在治疗和/或诊断应用中,本发明的化合物可以配制用于多种给药方式,包括全身和局部给药或局部给药。技术和制剂通常可以在remington:thescienceandpracticeofpharmacy(第20版)lippincott,williams&wilkins(2000)中找到。
根据本发明的实施方案,h-1152在宽剂量范围上有效。例如,在成年人的处理中,剂量可以为0.01mg至1000mg。尽管取决于多种因素,但优选的剂量是每天10mg至30mg的h-1152。确切的剂量取决于给药途径、给药化合物的形式、待处理的受试对象、待处理的受试对象的体重,以及主治医师的偏好和经验。
在本发明的另一个实施方案中,处理癌细胞的方法包括用一定量的h-1152靶向myc基因。某些癌类型以可识别的突变为标志。例如,myc的thr-58和ser-62的突变存在于普遍类型的伯基特淋巴瘤中。这些突变与可以扰乱基因改变的乳腺肿瘤发生的稳定的突变蛋白相关。在这种情况下,当鉴定出myc基因中的突变时,治疗可通过rock抑制剂如h-1152起效。
类似地,本发明的备选实施方案要求一种鉴别对rock抑制有响应的癌亚型的方法,该方法通过接受来自受试对象的癌样品,测试myc基因的异常,然后使用试验的结果解读影响受试对象的癌亚型的类型。例如,癌症患者可以用h-1152处理,并且注意到肿瘤已经停止进展或已经消退。根据要求保护的发明的该备选实施方案,可以收获肿瘤细胞并测定myc分析,因为它们显示出对rock抑制剂的响应。测定后,就可以确定myc基因是否改变,无论是通过突变还是易位(或两者)。此类信息可用于诊断目的或改进处理。
根据本发明的许多实施方案显示对处理而言表现得最有前景的rock抑制剂是h-1152。以下部分为在癌处理中使用h-1152提供实验支持。
结果–myc-过表达细胞中的选择性细胞毒性
为了确定h-1152在过表达myc的细胞中引起细胞毒性,用myc或新霉素选择标记基因(“neo”)与htert组合稳定转染人视网膜色素上皮细胞。在用h-1152处理3天后,30%的用myc基因稳定转染的细胞被杀死,而用neo基因转染的细胞没有被杀死。供测试h-1152溶剂的细胞毒性的单独对照实验证明溶剂在myc-表达或neo-表达的细胞中未能引起任何细胞死亡。图1a。
由于在人工诱导myc表达基因中观察到h-1152的上述作用,因此在多种正常细胞和永生化细胞中评估了h-1152的作用。处理3天后的结果是相似的。详细地,在评估的细胞系中,无论细胞系是正常细胞还是永生化细胞,h-1152对细胞毒性的影响可忽略不计。观察到的一个例外是过表达myc的im-9细胞。在h-1152处理3天后,im-9细胞系中的细胞致死率约为30%。图1b。
为了确定h-1152的细胞毒性是否依赖于myc-表达或任何癌基因,对表达myc以及其他活性细胞癌基因的大鼠1a细胞评估致死性。在具有各种活性癌基因的不同细胞中,仅有表达myc的细胞在用h-1152处理后表现出细胞死亡。图1c。
h-1152甚至在myc急性激活时有效
为了否定myc基因的持续表达引起受h-1152影响的未鉴定靶标的可能性,测定了h-1152在急性激活细胞中的敏感性。通过myc-雌激素受体嵌合体的方式发挥myc的急性激活。通过加入4-羟基-他莫昔芬(“4-oh”)迅速激活该受体。虽然4-oh和h-1152本身导致低水平的细胞死亡,但这些药物共同地协同起作用,在人肺成纤维细胞(imr-90)和肾上皮ha1e细胞系(ha1e)中引发超过30%的细胞致死率。图1d。用mycn基因的急性激活进行类似的实验。mycn与myc都具有高度序列相似性和重要的生化和基因活性。与myc表达一样,用4-oht激活mycn-雌激素受体嵌合体导致h-1152应用时的高细胞致死率。因此,无论myc是组成型表达还是急性激活,h-1152都会引起myc-依赖性细胞致死。此外,这种敏感性对于成纤维细胞和上皮细胞也成立。
h-1152诱导的细胞致死引发细胞凋亡
为了确定在用h-1152处理的表达myc的细胞中诱导细胞死亡的机制,对处理过的细胞观察凋亡特征。记录经典凋亡的征候,例如核凝聚、caspase3的激活和切割caspase3的下游靶标,聚(adp-核糖)聚合酶(“parp”)。图2b。此外,对诸如线粒体膜电位消失,细胞色素c从线粒体释放到胞浆中,以及caspase9的激活等事件的观察都表明通过线粒体依赖性凋亡途径的激活导致的细胞死亡。图2a。为了进一步支持h-1152促进线粒体依赖性凋亡途径的观察结果,用h-1152和泛caspase(pancaspase)抑制剂z-vad-fmk处理过表达myc的细胞。虽然单独的h-1152在处理的细胞中引起约30%的致死率,但加入泛caspase抑制剂使细胞致死率降低约一半,导致15%的细胞致死率。由于细胞凋亡被有效抑制,细胞死亡水平也降低了。因此,h-1152通过激活线粒体依赖性凋亡途径促进细胞死亡。
h-1152诱导的致死独立于rock抑制
为了确认h-1152在过表达myc的癌细胞中所致的致死性是由于rock激酶的抑制而不是由于非预期的靶标,将h-1152的作用与其他五种rock抑制剂进行比较。在这五种中,法舒地尔、羟基法舒地尔和瑞舒地尔(rapasudil,k-155)是h-1152的类似物。法舒地尔对rockii的ic50为330nm,羟基法舒地尔对rocki和rockii的ic50为720nm和730nm,瑞舒地尔(k-155)对rocki和rockii的ic50为51nm和19nm。(图3a)。对于剩下的两种,y-27634对rocki和rockii的ic50分别为140nm和300nm。gsk429286a/rho-15对rocki和rockii的ic50分别为14nm和63nm。
测定用rpe-myc转染的细胞中的致死率,表明尽管所有五种试剂都是rock抑制剂,但仅有以h-1152处理显示了显著的细胞死亡。图3b。实际上,即使将这些抑制剂增加15倍至100μm也未能杀死rpe-myc转染的细胞。图3b。这些数据导致发现h-1152引起的myc依赖性致死不是由rho激酶的抑制介导的。
为了支持这一发现,在rpe-myc细胞中通过rnai抑制rocki和rockii的表达。如果h-1152通过抑制rock1和/或rockii引起细胞毒性,则rnai会产生类似的细胞毒性特征。然而,用rnai抑制rock1和rockii未能产生类似的致死率;尽管抑制了rock1和/或rockii的表达,却有超过90%的rpe-myc细胞存活。图4。因此,h-1152的myc-依赖性细胞毒性不归因于rock1和rockii的失能和抑制。
myc丰度与h-1152敏感性正相关
为了确定人类癌细胞对h-1152的敏感性是否与myc表达相关,将相比于rpe-myc细胞表现出接近或更高的myc表达的四十(40)个细胞系(“myc高”)与表现出接近或低于rpe-neo的24个细胞系(“myc低”)进行比较。参见图8。myc高组还包括8个具有丰富mycn表达的细胞系和3个大量表达l-myc的细胞系。用6μmh-1152处理4天,在myc高组中的细胞系比在myc低组中的细胞系引起高得多的百分比的大量细胞死亡。(图5a,b)。两个数据集之间的差异具有统计显著性。
虽然h-1152敏感性与myc表达之间存在正相关,但仍存在一些异常值。结果表明,myc低组的24个细胞系中的3个对h-1152仍然敏感,提示不同于过表达myc的致癌元件可能赋予细胞对h-1152的敏感性(图5a,b)。相反,当用h-1152处理时,myc高组的51个细胞系中的11个没有经历凋亡,表明另外的病变可能抑制由h-1152引起的myc-依赖性细胞凋亡(图5a,b)。
myc的消耗调节对h-1152的细胞毒性敏感性
为了确认人癌细胞中丰富的myc是否是h-1152敏感性的原因,在选择的myc高癌细胞系即hela、nci-h841、c-33-a、calu-6和mda-mb-157中使用同源sirna阻断myc的表达。单独消耗myc,在h-1152处理时未能引起任何明显的毒性水平。而myc的消耗在96小时时对h-1152引起的细胞毒性提供了50%至75%的保护。(图6b)。因此,这些结果表明,在人癌细胞系中需要丰富的myc表达来诱导响应h-1152激发的细胞凋亡。
h-1152有效对抗具有丰富myc表达的肿瘤
为了确定组织培养结果是否可以在体内复制,来自myc高组的两个细胞系,即nci-h841和nci-h524,以及来自myc低组的两个细胞系,即nci-h211和nci-h2199。皮下植入后,所有四种细胞系都能够在无胸腺小鼠中形成异种移植肿瘤。在检测到可见肿瘤后,将小鼠随机分组接受h-1152或载体处理。植入myc高细胞的小鼠稳定了肿瘤发展(图7b)或减缓了肿瘤发展(图7c)。相反,h-1152未能在来自myc低组的细胞系中影响肿瘤发展(图7d,e)。这些结果共同表明,可以用h-1152治疗表现出高水平myc表达的肿瘤细胞。此外,myc家族癌基因的过表达或myc靶基因的分子特征可以作为对h-1152及其类似物敏感性的预测生物标志物。
潜在的类似物
在评估h-1152在细胞致死中的功效时,确定两个甲基对于h-1152引发myc依赖性细胞毒性是必要的。因此,本发明的其他实施方案包括用一个或两个甲基上有修饰的h-1152处理表达myc的肿瘤细胞。
虽然公开了多个实施例,但是通过该详细描述,本发明的其他实施例对于本领域技术人员而言将变得显而易见。在不脱离本发明的精神和范围的情况下,本发明能够在各种明显的方面进行无数修改。因此,附图和描述本质上被认为是说明性的而非限制性的。
附录a-免疫荧光显微术
将细胞在6孔板中的盖玻片上培养,用4%多聚甲醛或4%多聚甲醛接甲醇处理来固定,然后用0.3%tritonx-100透化。可以使用来自cellsignalingtechnology的活性caspase3,活性caspase9和切割的parp的兔多克隆抗体。用德克萨斯红缀合的或异硫氰酸荧光素缀合的二抗检测一抗,所述二抗可购自jacksonimmunoresearch。免疫染色后,用含有4',6'-二脒基-2-苯基吲哚(dapi)的vectashield封固溶液(vectorlaboratories)将细胞固定在显微镜载玻片上。
为了测定线粒体膜电位,将细胞在盖玻片上培养,并在37℃下暴露于40nmmitotracker#redcmxros(molecularprobes)30分钟,该染料在线粒体中的积累是线粒体电位的函数。在4%多聚甲醛中固定后,用来自vectorlaboratories的含dapi的vectashield封固溶液将细胞固定在显微镜载玻片上。对于荧光检测,可以使用evosfl自动显微镜(thermofisher)。
附录b-rna干扰
通过用大肠杆菌核糖核酸酶iii消化对应于同源基因的全长编码序列的双链rna,产生myc、萤火虫荧光素酶、rock1和rock2的esirna。小于30bp的esirna用deae柱纯化,并根据制造商的说明用例如lipofectamine2000(invitrogen)等试剂转染到细胞中。
附录c-统计分析
用graphpadprism软件进行统计分析。用student非配对双尾t检验评估差异的统计学显着性。p值小于0.05被认为统计学显著。
附录d-小鼠体内实验方案
根据mbicr的机构动物关怀和使用委员会批准的实验方案饲养和处理实验小鼠。为了产生供处理实验用的荷瘤小鼠,将磷酸盐缓冲盐水(pbs)中的一百万至一千万个人癌细胞皮下注射到每只无胸腺小鼠的右肋腹皮下。当大多数小鼠的肿瘤体积达到约50mm3时,将荷瘤小鼠随机分组,以双盲方式随机接受载体或h-1152治疗。每组使用10只小鼠。将h-1152新鲜溶解于载体(10%dmso,90%聚乙二醇300)中,并且每天通过经口灌胃给予两次(每次剂量60mg/kg体重)。在指定的时间点用数显卡尺监测注射部位的肿瘤直径,并使用下式计算体积:v(mm3)=a×b×b/2,其中a和b分别代表肿瘤的最大和最小直径。
附录e-myc稳定细胞系的制备
人原代细胞和肿瘤细胞系可以从美国模式培养物保藏所获得。通过用htert与新霉素抗性基因或myc癌基因组合转染人原代视网膜色素上皮细胞,然后用1μg/ml嘌呤霉素选择,产生rpe-neo和rpe-myc细胞。
附录f-免疫印迹实验方案
在补充了蛋白酶抑制剂混合物的裂解缓冲液[50mmtris(ph7.5),200mmnacl,0.1%sds,1%tritonx-100,0.1mmdtt,和0.5mmegta]中,在4℃下将细胞孵育15分钟来制备全细胞提取物。将提取物以8,000×g离心10分钟以除去不溶物。用蛋白质测试法测定上清液中的蛋白质浓度。在nupage(4-12%)bis-tris凝胶上分离含有50-100μg蛋白质的裂解物,并转移到硝酸纤维素膜上。在pbs缓冲液中用5%脱脂奶将膜封闭1小时,然后在4℃下与封闭缓冲液中1:1,000稀释的一抗孵育过夜。对myc、mycn和微管蛋白使用兔多克隆抗体。
- 还没有人留言评论。精彩留言会获得点赞!