MRSA感染保护剂的制作方法
本发明涉及mrsa感染保护剂。
背景技术:
mrsa(甲氧西林抗性金黄色葡萄球菌,methicillin-resistantstaphylococcusaureus)为引起医疗相关感染的代表性细菌,作为医院内分离到的抗性细菌,分离频度最高。
在日本已许可的抗mrsa药物有万古霉素(vancomycin,vcm)、替考拉宁(teicoplanin,teic)、阿贝卡星(arbekacin,abk)、利奈唑胺(linezolid,lzd)、达托霉素(daptomycin,dap)5种,为了合理使用抗mrsa药物,已制订了mrsa传染病的治疗指南(非专利文献1)。
但是,近年来有报告出现了对这些抗mrsa药物抗性的细菌,期望开发新的抗mrsa药物。
现有技术文献
非专利文献
非专利文献1:mrsa传染病的治疗指南2013年6月9日公益社团法人日本化学疗法学会
技术实现要素:
发明要解决的问题
本发明的目的在于提供新的mrsa感染保护剂。
解决问题的方法
经过本发明人深入努力的结果,发现属于肠球菌属(enterococcus)的乳酸菌可保护mrsa感染,从而完成了本发明。
本发明的要点如下所述。
(1)含有肠球菌属细菌的mrsa感染保护剂。
(2)含有肠球菌属细菌的mrsa感染保护用药物。
(3)含有肠球菌属细菌的mrsa感染保护用食品。
(4)mrsa传染病的预防和/或治疗方法,其包括,将药学上有效量的肠球菌属细菌施用给受试者。
(5)肠球菌属细菌用于mrsa传染病的预防和/或治疗的用途。
(6)肠球菌属细菌,其用于mrsa传染病的预防和/或治疗方法中。
发明效果
根据本发明,可针对mrsa感染提供保护。
本说明书中包含在作为本申请的优先权的基础的日本专利申请日本特愿2017-13789及日本特愿2017-115577的说明书和/或附图中记载的内容。
附图说明
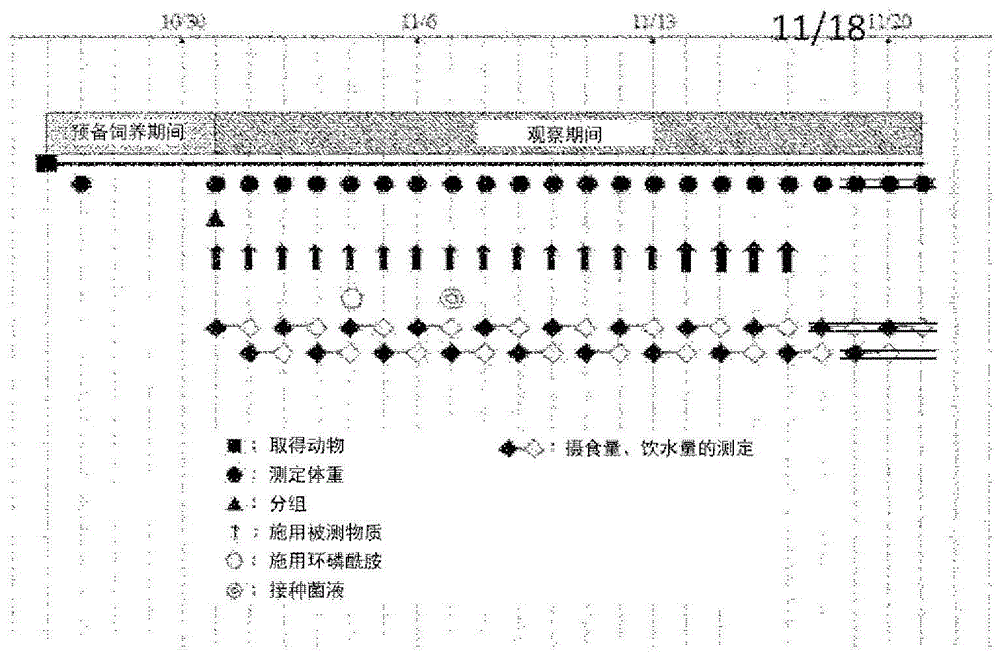
[图1]示出实施例1的试验时间表。
[图2]示出实施例1的试验结果(生存率)。
[图3]示出实施例1的试验结果(体重)。
[图4]示出实施例1的试验结果(摄食量)。
[图5]示出实施例1的试验结果(饮水量)。
[图6]示出实施例2的试验时间表。
[图7]示出实施例2的试验结果(生存率)。
[图8]示出实施例2的试验结果(体重)。
[图9]示出实施例2的试验结果(摄食量)。
[图10]示出实施例2的试验结果(饮水量)。
具体实施方式
以下,对本发明的实施方式进行更详细地说明。
本发明提供含有肠球菌属细菌的mrsa感染保护剂。
肠球菌属细菌只要为乳酸球菌即可(例如:粪肠球菌(enterococcusfaecalis)、屎肠球菌(enterococcusfaecium)、鸟肠球菌(enterococcusavium)、鹑鸡肠球菌(enterococcusgallinarum)、铅黄肠球菌(enterococcuscasseliflavus)等),优选具有生物应答调节物质(biologicalresponsemodifier,brm)活性(药学志112:919-9251992;药学志113:396-3991992;动物临床医学3:11-201994)的那些。粪肠球菌作为具有brm活性的乳酸球菌是已知的。粪肠球菌ef-2001株可以从日本berumu株式会社(东京都千代田区永田町2-14-3)获得。
粪肠球菌-2001株可以从正常人的粪便提取,其具有下述性质。
为革兰氏阳性球菌。菌落形态(色氨酸琼脂培养基,培养24小时):直径1.0mm、光滑、正圆形、白色菌落细菌形态:球至卵圆形(1.0×1.5μm),在液体培养基中常形成链。不形成芽胞。兼性厌氧。发酵葡萄糖而产生乳酸(最终ph4.3)。非产气。过氧化氢酶阴性。于10~45℃进行增殖(最适为37℃)。在ph9.6,6.5%nacl、40%胆汁中增殖。0.04%亚碲酸钾阳性。0.01%四唑
对于肠球菌属细菌而言,可以为活菌,也可以为死菌,也可以对菌体实施破坏处理(匀浆处理、酶处理、超声波处理等)、加热、干燥(冷冻干燥、喷雾干燥等)等处理。菌体可以与稀释剂混合后,添加糊料而制成颗粒状。对稀释剂、糊料而言,从作为在食品、药物中添加的物质而许可的材料中进行选择即可。
本发明的mrsa感染保护剂可以用于mrsa传染病的预防和/或治疗。本发明的mrsa感染保护剂可以作为药物、或作为食品添加剂使用。
本发明提供含有肠球菌属细菌的mrsa感染保护用药物。
在用作药物的情况下,将肠球菌属细菌单独,或与赋形剂或载体混合而制剂成为片剂、胶囊剂、散剂、颗粒剂、液剂、糖浆、气溶胶、栓剂、注射剂等即可。对赋形剂或载体而言,只要为本领域中常规使用的,药学上允许的那些即可,对其种类及组成进行适当选择。例如,作为液态载体,可以使用水、植物油等。作为固体载体,可使用:乳糖、白糖、葡萄糖等糖类,马铃薯淀粉、玉米淀粉等淀粉,结晶纤维素等纤维素衍生物等。也可以添加硬脂酸镁等润滑剂,明胶、羟丙基纤维素等粘合剂,羧甲基纤维素等崩解剂等。此外,也可以添加抗氧化剂、着色剂、矫味剂、保存剂等。另外,也可以以冷冻干燥制剂形式使用。
肠球菌属细菌可通过口服、经鼻、直肠、经皮、皮下、静脉内、肌内等各种路径进行施用。
肠球菌属细菌在制剂中的含量,根据制剂的种类而不同,通常为0.001~100质量%、优选为0.01~100质量%。
肠球菌属细菌的给药物量,只要是药学上有效的量(即可确认mrsa感染保护效果的量)即可,根据剂型、施用路径、患者的年龄、体重、疾病的危重度等而不同,例如,每1次的给药物量在成人的情况下,换算成肠球菌属细菌的量,约为1亿~1,000亿cfu/kg体重、优选约为60亿~120亿cfu/kg体重,优选以每日1次至多次进行施用。
肠球菌属细菌也可以添加到食品中。本发明提供含有肠球菌属细菌的mrsa感染保护用食品。
在本发明的食品中,也可以添加:蛋白质、脂质、碳水化合物、钠等一般成分,钾、钙、镁、磷等矿物质类,铁、锌、铜、硒、铬等微量元素,维生素a、β-胡萝卜素、维生素b1、维生素b2、维生素b6、维生素b12、维生素c、烟酸、叶酸、维生素d3、维生素e、生物素、泛酸等维生素类,辅酶q10、α-硫辛酸、低聚半乳糖、膳食纤维、赋形剂(水、羧甲基纤维素、乳糖等)、甜味料、矫味剂(苹果酸、柠檬酸、氨基酸等)、香料等。在将本发明的食品制成液剂时,作为将食品成分分散或溶解的液体,可以使用水、生理盐水、果汁等,出于在口服施用中改善味觉的目的,优选使用果汁。
本发明的食品也可以制成粉末、颗粒、片剂、液剂等任何形状,但为了使病人、老年人可以容易摄取,因此,优选制成果冻等凝胶态产品。
作为胶凝剂,可以使用:糊精、琼脂、黄原胶、刺槐豆胶、卡拉胶、果胶等增稠多糖类,结冷胶、洋车前子胶,塔拉胶、瓜尔胶、葡甘露聚糖、藻酸盐、罗望子籽胶、纤维素等,优选使用一种或两种以上的增稠多糖类。凝胶态产品的凝胶强度,优选在5℃的凝胶强度为7,000±2,000n/m2,另外,在凝胶强度为7,000±2,000n/m2时,更优选粘附能量为60±40j/m3、凝聚性为0.7±0.1j/m3。像这样粘附性低、凝聚性高的凝胶具有优异的适吞咽性。
凝胶强度可以如下所述测定。作为凝胶强度测定仪器,使用山电公司稠度测定仪及φ16mm的活塞,利用测定温度25℃、压缩速度(活塞按入速度)10mm/s、测定应变率(相对于试样的厚度的按入率)40.00%,活塞按入距离10.00mm,活塞按入次数2次进行测定。
对粘附能量而言,可以通过在上述凝胶强度测定中,在按入1次后,拔出活塞时的负的能量进行测定。
对凝聚性而言,可以通过在上述凝胶强度测定中,按入2次时,第1次和第2次的能量的比率进行测定。
肠球菌属细菌的摄取量,只要是可确认mrsa感染保护效果的量即可,根据剂型、施用路径、患者的年龄、体重、疾病的危重度等而不同,例如,在成人的情况下,每次摄取量换算成肠球菌属细菌的量约为1亿~1,000亿cfu/kg体重、优选约为60亿~120亿cfu/kg体重,以每日1次至多次进行摄取即可。
实施例
以下,结合实施例对本发明进行详细的说明,但本发明并不限定于这些实施例。
[实施例1]乳酸菌ef-2001株的mrsa感染保护试验
组构成:3组比较(各组n=10)
a:对照组
b:乳酸菌粉末ef-2001(40mg/125ml)组
c:乳酸菌粉末ef-2001(80mg/125ml)组
试验方法:使用小鼠(balb/c)4周龄,在每日1次地口服施用被测物质(乳酸菌粉末ef-2001(日本berumu株式会社))1周之后,使其感染甲氧西林抗性金黄色葡萄球菌(atcc43300,以下称为“mrsa”)(腹膜内施用环磷酰胺(注射用安道生(注册商标)100mg,盐野义制药株式会社)200mg/kg(液量:10ml/kg)3天之后,于腹膜内接种接种菌液0.5ml(5×106cfu)),之后,观察2周(图1)。在对照组中,代替被测物质而施用了注射用水(株式会社大塚制药工厂)。使其自由摄取饲料(crf-1,orientalyeast株式会社)和饮料水(自来水)。
统计学方法:对各组算出生存率。对体重而言,算出各组的平均值及标准误差。对显著性差异检验而言,对于观察结束日的生存率,在对照组和各组之间进行了fisher精确概率检验。试验期间,对全体绘制kaplan-meier曲线并进行了时序检验(logranktest)。将危险率设为5%为显著,分别分成低于5%及低于1%进行表示。需要说明的是,统计分析使用了市售的统计程序(sas系统:sasinstitutejapan)。
检查内容:生存率、体重、摄食量及饮水量
结果:
生存率(图2)
a组的生存率为mrsa接种之后4天后达到40%,将12天后的生存率在a组和b组及c组中进行比较时,b组c组的生存率显著更高。
体重(图3)
体重为各组的生存动物的平均体重。在接种mrsa后第1天与b组及c组相比,a组的体重为显著低值。另外,在a组中,在mrsa接种第12天仍没有增加到mrsa接种前的体重,但b组及c组已经恢复了mrsa接种前的体重。
摄食量(图4)
在mrsa接种之后第1天,与b组及c组相比,a组的摄食量显著少。
饮水量(图5)
在mrsa接种之后第1天,与b组及c组相比,a组的饮水量显著少。
[实施例2]乳酸菌ef-2001株的mrsa感染之后的治疗效果试验
组构成:2组比较(各组n=10)
a:对照组
b:乳酸菌粉末ef-2001(80mg/125ml)组
试验方法:使用小鼠(balb/c)4周龄,使其感染甲氧西林抗性金黄色葡萄球菌(atcc43300,以下称为“mrsa”)(腹膜内施用环磷酰胺(注射用安道生(注册商标)100mg,盐野义制药株式会社)200mg/kg(液量:10ml/kg)3天之后,于腹膜内接种接种菌液0.5ml(5×106cfu))之后,每日1次地口服施用被测物质(乳酸菌粉末ef-2001(日本berumu株式会社))10天(图6)。在对照组中,代替被测物质而施用了注射用水(株式会社大塚制药工厂)。使其自由摄取饲料(crf-1,orientalyeast株式会社)和饮料水(自来水)。
统计学方法:对两组均算出生存率。对体重而言,算出两组各自的平均值及标准误差。对显著性差异检验而言,对于观察结束日的生存率,与对照组之间进行了fisher精确概率检验。试验期间,对全体实施了kaplan-meier曲线而进行了logrank法检验。将危险率设为5%为显著,分别分成低于5%及低于1%进行表示。需要说明的是,统计分析使用了市售的统计程序(sas系统:sasinstitutejapan)。
检查内容:生存率、体重、摄食量及饮水量
结果:
生存率(图7)
a组的生存率为mrsa接种之后3日后达到40%,将10天后的生存率在a组和b组中进行比较时,b组的生存率显著更高。
体重(图8)
体重为两组各自的生存动物的平均体重。对于体重而言,在mrsa接种后在两组间观察不到差异,两组均恢复了mrsa接种前的体重。
摄食量(图9)
在mrsa接种后第4及5天,与b组相比,a组的摄食量显著少。
饮水量(图10)
两组的饮水量没有确认到显著性差异。
本说明书中引用的全部出版物、专利及专利申请均整体作为参考并入本说明书中。
工业实用性
本发明可以利用于mrsa感染保护。
- 还没有人留言评论。精彩留言会获得点赞!