用于组织样本处理的系统和方法与流程
本申请根据35u.s.c.§119(e)要求2017年9月11日提交的美国临时专利申请序列第62/556,910号和2017年2月9日提交的美国临时专利申请序列第62/457,078号的益处,所述申请中的每个的公开内容由此通过引用全文并入本文中。
申请的实施例涉及用于组织样本处理的系统和方法,如用于病理程序。
背景技术:
当医学专业人员感知在患者器官中癌症或其它异常的风险时,医学专业人员可从器官获取组织样本以供病理学家分析。在一些已知的活检过程中,将组织样本放置在组织样本盒中,并且如用条形码或序列号标记盒,并且与患者相关联。根据具体程序以及组织样本的类型,可将组织样本放置在组织样本接收基质上或组织样本接收基质中,以试图维持组织样本的定向和物理完整性,并且将基质和组织样本均放置在盒内。将盒和组织样本转移到组织病理学实验室,所述实验室通常位于组织样本获取位置的场外。
组织病理学实验室接收盒和组织样本并且处理组织样本用于显微镜评估。在一些组织病理学程序中,组织样本可化学固定、脱水、嵌入石蜡材料中,并且模制以形成包括组织样本的石蜡块。可用切片机将石蜡块和其中的组织样本切成薄切片。薄切片可定位在载玻片上,用于由病理学家在显微镜下检查。病理学家可尝试识别和定位在组织样本中的异常组织,如癌性细胞。组织样本的组织病理学检查的结果可传回到医学专业人员和患者。
技术实现要素:
在一些实施例中,组织样本管理系统包括中央网络、与中央网络通信的医学专业人员系统,和与中央网络通信的病理学实验室系统。中央网络包括至少一个处理器和数据库。医学专业人员系统包括至少一个第一数据输入装置,其配置成用于输入关于组织样本的信息。病理学实验室系统包括至少一个成像装置和至少一个第二数据输入装置,其可配置成用于获取组织样本和包括切片代码的对应基质的图像。中央网络配置成从至少一个第一数据输入装置和至少一个第二数据输入装置接收数据,并且处理通过至少一个成像装置获取的图像以至少识别和记录基质的切片代码。
在一些实施例中,用于组织样本处理的方法包括提供具有切片代码和测量标记的基质,基质用于接收组织样本,在基质中获取组织样本的第一图像,将第一图像传输到中央网络,用中央网络处理器从第一图像识别切片代码,将切片代码数字地存储在中央网络的数据库中,将存储的切片代码与从中获得组织样本的患者的识别信息相关联,在至少某一病理处理之后,在具有切片代码和测量标记的基质中获取组织样本的第二图像,将第二图像传输到中央网络,用处理器从第二图像识别切片代码,用处理器从第二图像识别测量标记,并且将第二图像与从中获得组织样本的患者的识别信息相关联。基质配置成表现出与组织样本在进行病理处理时的收缩率基本上相同的收缩率。
在一些实施例中,组织样本接收基质包括可切片字母数字代码、至少一个组织样本容器,和沿至少一个组织样本容器的至少一个侧壁形成的测量标记。组织样本接收基质包括包含一种或多种蛋白质和一种或多种脂质的材料。
在一些实施例中,组织样本接收基质包括切片机器可读条形码、至少一个组织样本容器,和沿至少一个组织样本容器的至少一个侧壁形成的测量标记。组织样本接收基质还包括包含一种或多种蛋白质和一种或多种脂质的材料。
附图说明
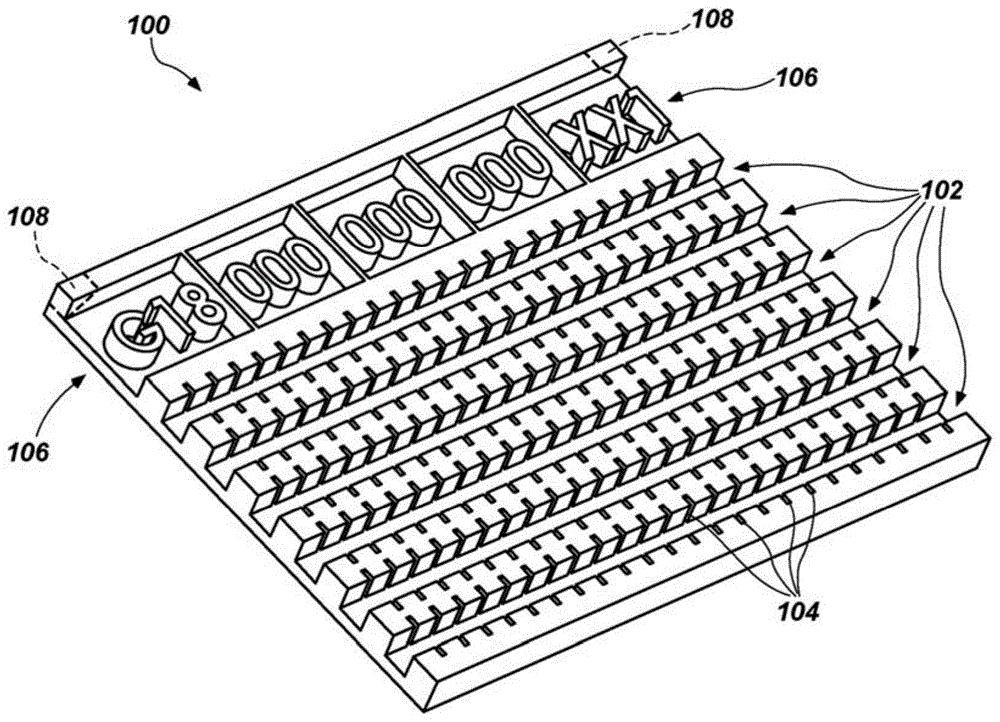
图1a示出根据本公开的实施例的组织样本容器的透视图。
图1b示出图1a的组织样本接收基质的俯视图。
图2示出根据本公开另一个实施例的组织样本接收基质的俯视图。
图3说明根据本公开的实施例的组织样本管理系统的框图。
图4说明根据本公开的实施例在病理处理中处置组织样本的方法的流程图。
图5示出根据本公开另一个实施例的组织样本接收基质的俯视图。
图6示出根据本公开的另一个实施例的组织样本接收基质的透视图。
具体实施方式
以下描述提供具体细节,如材料类型、材料厚度和处理条件,以便提供对本公开的实施例的充分描述。然而,所属领域的一般技术人员将理解,本公开的实施例可在不采用这些具体细节的情况下实践。实际上,本公开的实施例可结合在行业中采用的传统技术、系统和材料实践。
在以下详细描述中,参考附图形成了本发明的一部分的附图,并且其中通过说明的方式示出其中可实践本公开的具体实施例。足够详细地描述这些实施例,以使得所属领域一般技术人员能够实践本公开。然而,可利用其它实施例,并且可在不脱离本公开的范围的情况下进行结构、材料、程序和其它改变。本文中呈现的说明不意指为任何特定系统、装置、结构或处理的实际视图,而仅仅是用于描述本公开的实施例的理想化图示。本文呈现的附图不必按比例绘制。
如本文所用,任何关系术语,如“上”、“左”、“右”、“底部”等,用于清楚和方便理解本公开和附图,并且不暗示或取决于任何具体的偏好、定向或顺序,除非上下文另有明确指示。
如本文所用,关于给定参数、特性或条件的术语“基本上”意指并包含在所属领域的一般技术人员将理解的给定参数、特性或条件满足方差度(如在可接受制造公差内)的程度。举例来说,基本上满足的参数可为至少约90%满足、至少约95%满足,或甚至至少约99%满足。
图1a示出根据本公开的实施例的组织样本接收基质100的透视图。图1b示出图1a的组织样本接收基质100的俯视图。组织样本接收基质100在本文中也称为基质100。基质100可由包括各自在不同浓度下的一种或多种蛋白和一种或多种脂质的材料形成。一种或多种蛋白质和一种或多种脂质的存在、类型和浓度可使得基质100的材料能够被调谐到待用基质100病理处理的具体类型的组织。各种类型的组织具有不同的脂质含量。举例来说,乳腺和大脑组织具有相对高的脂质浓度,而前列腺、肾脏和肌肉组织具有相对较低的脂质浓度。不同类型组织的不同脂质浓度在病理组织处理期间导致不同的收缩率,因为通常在病理组织处理期间去除脂质和水。将基质100调谐到特定组织类型可包括选择一种或多种蛋白质和一种或多种脂质的类型和浓度,以基本上匹配特定组织类型的收缩率。因此,基质100可配置成用于在病理组织处理期间以与待用基质100处理的特定组织样本基本相同的速率收缩。
用于基质100的实例合适材料描述于2013年12月26日提交的标题为“接收组织样本的基质和其用途(matrixforreceivingatissuesampleandusethereof)”的美国专利申请序列第14/129,377号,并且于2017年12月26日以美国专利9,851,349发布,所述专利的全部公开内容以引用的方式并入本文中。借助于实例而非限制,并且根据待用基质100处理的组织类型,基质100的材料可包括约2%到约14%w/v一种或多种蛋白质(包括动物类蛋白质、植物类蛋白质和/或合成蛋白质)和约2.1%到约20%w/v一种或多种脂质(包括动物类脂质、植物类脂质和/或合成脂质)。基质100的材料还可包括以下中的一种或多种:约2%到约15%w/v甘油;约1%到约10%消泡剂(例如琼脂糖);浓度为约10到约600mm的无机缓冲液;胶凝剂(例如碳水化合物,如海藻酸、角叉菜胶、魔芋胶等);和水。
在一些实施例中,基质100可设定大小、形状,并且配置成在整个病理处理中将一个或多个组织样本维持在初始定向上。举例来说,如图1a和1b所示,基质100可配置成用于通过包括多个组织样本容器102(也称为通道102)接收针芯活检组织样本,所述组织样本容器102的尺寸和形状适于接收相应的针芯活检组织样本。因此,基质100可设置有具有不同宽度和/或长度的通道102,以便容纳使用不同直径和长度的针获取的针芯活检。如借助于实例在图1a和1b中所示,基质100可包括六个通道102。在附加实施例中,基质100可包括另一个数量的通道,如两个、三个、四个、五个、八个、十个,或十二个。可改变基质100的大小以容纳更多或更少的通道102。
测量标记104可在与多个通道102相邻并且在其之间的基质100中形成,如沿限定通道102的基质100的侧壁。测量标记104可沿多个通道102并且与其相邻以预定的已知初始间隔定位,例如,以1mm、2mm、5mm、0.1英寸(0.254cm)、0.2英寸(0.508cm)、0.25英寸(0.635cm)等初始间隔。如本文所用,术语“初始间隔”是指如当形成基质100时和/或当基质100在其中或其上接收组织样本时测量的间隔。在测量标记104之间的间隔可在基质100和相应的组织样本的病理处理期间如由于水和/或脂质损失改变(例如,收缩)。如上文所提到,当基质100适当地被调谐到与基质100一起处理的特定组织样本时,基质100可表现出与特定组织样本基本上相同的收缩率。因此,组织样本的任何部分可具有在整个病理处理中基本上维持的相对于基质100的位置。组织样本的一部分(例如,癌性部分)的初始长度、大小和位置,如在组织样本被取出并且来自患者并且放置在原始基质100上时最初存在的,可在由病理处理引起的任何收缩之后确认。举例来说,可通过从处理的组织样本的末端计数测量标记104来确定组织样本的一部分的初始位置,以确定初始间隔的数量,并且因此确定其中所关注部分位于组织样本上的原始距离。
测量标记104可由在基质100的材料中的狭缝限定。测量标记104可部分延伸(如图1a和1b所示)或完全穿过与多个通道102相邻并在其之间的基质100的部分。测量标记104的深度可至少与通道102的深度相同,使得测量标记104可存在于基质100的稍后形成的水平切片中,所述基质还包括在通道102中的一个或多个内的组织样本的一部分。如图1a和1b所示,测量标记104可沿通道102中的每个的两侧形成。然而,在其它实施例中,测量标记104可仅沿通道102中的每个的一侧形成。
基质100还可包括切片代码106,用于基质100的唯一和肯定识别和数字登记,在其中或其上接收的组织样本,和在处理的各个阶段其它相应的数据(例如,患者信息、医学专业人员信息、程序信息等)。如本文所用,术语“切片”是指可以存在于包括组织样本的基质的每个切片中的特征,使得切片特征存在于包括组织样本的每个所得的载玻片上。切片代码106可接近基质100的侧面或末端并且沿其定位。切片代码106可为机器可读和/或人可读的任何代码。举例来说,如图1a和1b所示,切片代码106可为或包括一系列字母数字符号。切片代码106可作为凸起的字母数字符号(如图1a和1b所示)或作为在基质100的周围材料内的字母数字凹陷提供。可替代地或另外地,切片代码106可作为如通过颜色或纹理与基质100的周围部分可区分的基质100的部分提供。切片代码106可从基质100的顶表面延伸到至少与通道102相同的深度,使得切片代码106可存在于基质100的稍后形成的水平切片中,所述基质还包括在通道102中的一个或多个内的组织样本的一部分。在基质100自身中提供切片代码106可减少或消除手动标记含有组织样本和基质100的组织盒的传统需要。此外,不管在整个病理中是否使用相同的组织盒,都可以识别和跟踪基质100和组织样本。
尽管上文所描述并且在图1a和1b中示出切片代码106为字母数字字符,但是本公开不限于此。相当相反,切片代码106可为任何人可读和/或机器可读的数据表示,其被配置和定位成存在于由基质制成的水平切片中,所述基质还包括对应的组织样本的部分。切片代码106可在组织学处理之后(和期间)包括在组织学染色之后相容并且可见。切片代码106可为或包括为字母数字、二进制、颜色、几何图案和形状、线,条形、矩形、点、六边形、圆柱形、棱柱、立方体等的符号。举例来说,切片代码106可为条形码,如下所描述并在图5中示出。在附加实施例中,可不存在切片代码106。
再次参考图1a和1b,任选地,基质100可包括至少一个深度计108,以便于确定从基质100和对应的组织样本获取的切片的深度。借助于实例,至少一个深度计108可包括至少延伸通过多个通道102的深度的倾斜表面,如在图1a和1b中用虚线示出。举例来说,倾斜表面可具有相对于基质100的底表面约3到45度的角度。因此,与至少一个深度计108相邻的基质100的一部分的形状和/或长度可根据获取基质100的切片的深度改变。识别至少一个深度计108在特定切片中出现的侧向位置可提供关于获取切片的深度(例如,相对于其它切片的深度或绝对深度)的信息。尽管在图1a和1b中说明至少一个深度计108定位在基质100的左上角和右上角中,但是至少一个深度计108可定位在基质100中的一个或多个其它位置处。此外,可以存在多于两个深度计108,以便即使基质100没有水平地定位在石蜡块内也能够以附加精确度识别深度。
在其它实施例中,至少一个深度计108可为在基质100内的不同深度处形成的一系列特征(例如,凹陷、盲孔、柱)。在基质100的切片中的一系列特征中的特定特征的存在或不存在可提供关于获取切片的深度的信息。
在一些实施例中,可对基质100的材料进行染色以提供与嵌入和/或组织样本材料的对比,如用于更清楚地识别和区分测量标记104、切片代码106和/或至少一个深度计108。
借助于实例而非限制,基质100,其包括通道102、测量标记104、切片代码106,和如果存在,至少一个深度规108,可使用模具、模切机、激光雕刻装置或立铣刀装置形成。在一些实施例中,可形成用于基质100的材料片,并且可使用具有或不具有计算机控制能力的激光雕刻装置或立铣刀装置切割材料片。这类实例雕刻技术可用于形成通道102、测量标记104、切片代码106(其可对于形成的每个基质100是唯一的),和/或至少一个深度计108。
图2示出根据本公开的另一个实施例的组织样本接收基质200(为简单起见,在本文中也被称为基质200)的俯视图。基质200可由可调谐到不同组织类型(即,可定制以表现出与不同组织类型基本上相似的收缩率)的材料形成,如上文所论述。基质200可配置成接收非针芯活检的组织样本,如切口活检、切除活检、液体试样(例如,尿液样本或血液样本),或凝胶状试样(例如,凝胶化的液体试样)。这类组织样本可能无法有效地配合在细长通道内。因此,基质200可包括至少一个中央组织样本容器202(在本文中也被称为中央容器202),如在图2中所示的中央矩形容器202。在一些实施例中,基质可包括多于一个中央容器202,如但不限于四个中央容器202(例如,基质200的每个象限中的一个)。
中心容器202可至少部分被基质200中的一个或多个突起包围,其可包括测量标记204,如上文所描述。测量标记204可沿中央容器202的一个、两个、三个或所有四个侧面存在。基质200还可包括切片代码206,如上文所描述。
因此,根据本公开的基质100、200可配置成用于与不同的组织和活组织检查类型、形状和大小一起接收和处理。可提供具有不同材料特性(例如,蛋白质、脂质和/或碳水化合物浓度)的各种基质100、200用于基本上匹配各种组织类型(例如,前列腺、乳腺、肝脏、大脑、肌肉、肾脏等)的收缩率。此外,可为使用不同程序(如不同形状和大小的针芯活检、切口活检和切除活检)获取的组织样本提供各种基质100、200。可通过使用在基质100、200上或其中的测量标记104、204或的其它标识符保存、确定、记录和登记组织样本或其任何部分的原始定向和位置。基质100、200的每个实例可设置有唯一切片代码,用于在病理处理的任何阶段识别和关联基质100、200和对应的组织样本。任选地,在一些实施例中,跟踪装置,如射频识别(“rfid”)芯片可在基质100、200内提供,或者附接到基质100、200,用于在处理期间基质100、200的附加追踪能力。
图3说明根据本公开的实施例的组织样本管理系统300的框图。组织样本管理系统300可包括类似于公开于2015年8月28日提交的标题为“用于现场记录和管理活检试样和患者具体信息的系统、方法和设备(system,method,andapparatusfordocumentingandmanagingbiopsyspecimensandpatient-specificinformationon-site)”的美国专利申请序列第14/771,427号,于2016年3月24日公布为美国专利申请公开案第2016/0085913号(在下文中“'913公开”)中的系统的特征,所述专利的全部公开内容以引用的方式并入本文中。组织样本管理系统300可包括中央网络302、与中央网络302通信的医学专业人员系统304,和与中央网络302通信的病理学实验室系统306。任选地,人工智能(ai)系统308(或专家系统)也可与中央网络302通信。在中央网络302和医学专业人员系统304、病理学实验室系统306和ai系统308之间的通信可通过无线链路(例如wifi、wimax、蜂窝、pcs、3g、4g、lte等)和有线链路(例如乙太网、电缆、光纤等)中的一种或多种来完成。
中央网络302可包括服务器310、中央处理器312和数据库314。中央网络302可为所谓“云”网络,其远离医学专业人员系统304、病理学实验室系统306和ai系统308。替代地,中央网络302可物理地位于医学专业人员系统304或病理学实验室系统306中的一个或两个附近,如在医院或医疗综合体处。服务器310可与包括医学专业人员系统304、病理学实验室系统306和ai系统308的客户端交互。数据库314可用于登记、存储、关联和调用来自医学专业人员系统304、病理学实验室系统306和ai系统308的数据,如患者数据(例如,患者识别、患者医疗记录、过敏史等)、组织样本数据(例如,组织的类型、组织样本的大小、获取的活检的类型、从中获取组织样本的患者的器官或身体的位置、组织样本的定向,在组织样本上潜在异常细胞的位置等)、基质数据(例如,基质的类型、基质的组成、在基质中的切片代码、在基质上的测量标记的初始间隔等)、医学专业人员数据(例如,医学专业人员的识别、医学专业人员的联系信息等),和病理程序数据(例如,程序步骤的时间、在程序中使用的化学品的类型和浓度、病理学家识别、病理学实验室识别等)。中央网络302可以此方式链接到医学专业人员系统304和病理实验室系统306,以便从其接收信息并向其提供信息。
医学专业人员系统304可包括至少一个第一成像装置316(例如,数码相机、扫描仪、蜂窝电话相机、网络摄像机、平板计算机相机等),用于获取通过医学专业人员从患者获得的组织样本和对应基质的图像。可将图像从医学专业人员系统304数字地发送到中央网络302,用于其登记、储存和处理。在一些实施例中,至少一个第一成像装置316可为专用相机,其配置成用于获取组织样本和基质的图像,如在组织盒内。借助于实例而非限制,至少一个第一成像装置316可如上文以引用的方式并入的'913公开中示出和描述配置。
医学专业人员系统304还可包括至少一个第一数据输入装置318。举例来说,至少一个第一数据输入装置318可包括移动装置、台式计算机、平板电脑或膝上型计算机中的一种或多种。可提供至少一个第一数据输入装置318用于接收来自医学专业人员的输入,如患者的识别、从中获取组织样本的器官或身体部位的识别、待执行活检程序(例如,针芯活检、切口活检、切除活检)的类型的识别,关于用于获取活检的原因的注释等。至少一个第一数据输入装置318可被编程以引导医学专业人员通过数据输入处理,如通过提供选择选项(例如,以说明器官、列表、菜单等的形式),用于校验的信息和/或用于文本数据输入的字段。已接收组织样本的特定基质的切片代码可通过医学专业人员输入或验证。至少一个第一数据输入装置318可与至少一个第一成像装置316通信,用于从其接收图像。至少一个第一数据输入装置318可被编程以显示来自至少一个第一成像装置316的图像,以供医学专业人员审查、校验和/或注释。数据可从至少一个第一数据输入装置318传输到中央网络302。
至少一个第一数据输入装置318还可从引导的活检系统,如计算机断层扫描(ct)活检系统、磁共振成像(mri)活检系统、x射线活检系统或超声波活检系统接收数据。举例来说,医学专业人员可使用这类引导的活检系统来观察程序,同时从患者的器官获得组织样本。引导的活检系统可将图像或视频传输到至少一个第一数据输入装置318,用于记录和关联获得的特定组织样本和对应的基质。可在稍后的时间调用来自引导的活检查系统的这类数据,以识别在从其获取所关注组织样本的患者器官上或中的特定二维(2d)或三维(3d)位置和定向。在组织样本病理处理之后,可将所关注组织样本的位置和定向与通过病理学家或ai系统308确定的异常细胞的位置比较。即使当组织样本经历显着的收缩时,也可使用在基质中的测量标记来促进异常细胞相对于原始组织样本的原始位置和定向的识别,如上文所描述。可生成从中获取组织样本的器官的数字3d模型,并且可将组织样本与数字3d模型叠加以观察从中获得组织样本的原始位置和定向。另外,可在数字3d模型上识别组织样本的任何异常(例如,癌性)部分的位置。
在将组织样本放置在基质中或基质上并且通过医学专业人员完成任何成像和数据输入,并且将基质和组织样本放置在组织盒中之后,组织盒320可从医学专业人员系统304转移到病理学实验室系统306。病理学实验室系统306可包括至少一个第二成像装置322和至少一个第二数据输入装置324。至少一个第二成像装置322可用于在病理学处理的任何步骤获取组织样本和对应的基质(包括其中的测量标记和切片代码)的图像,所述病理学处理的步骤包括但不限于从医学专业人员系统304接收组织盒320、粗略检查、固定、脱水、澄清、渗透、嵌入、切片和载玻片制备及审查。在一些实施例中,至少一个第二成像装置322可为专用相机,其配置用于获取如在组织盒内的组织样本和基质的图像。借助于实例而非限制,至少一个第二成像装置322可如在上文以引用的方式并入的'913公开中示出和描述配置。
病理学家或实验室技术人员可使用至少一个第二数据输入装置324来输入和/或验证关于例如组织样本、基质、组织样本和基质所经受的病理学程序的数据,任何异常组织的识别等。至少一个第二数据输入装置324可从至少一个第二成像装置322接收图像,以供病理学家或实验室技术人员审查和/或注释,或用于通过ai系统308处理。数据和图像可从病理学实验室系统306传输到中央网络302且任选地传输到ai系统308。另外地或可替代地,数据和图像可从病理实验室系统306传输到医学专业人员系统304(例如,直接或间接通过中央网络302)以供医学专业人员审查。
ai系统308可为与中央网络302通信的独立系统,如在图3中所描绘。替代地,例如,ai系统308可为例如中央网络302、医学专业人员系统304或病理学实验室系统306的组成部分。ai系统308可包括ai处理器326,其被编程以处理组织样本和基质(例如,上文参考图1a、1b和2描述的基质100、200)的图像,以便识别和定位在组织样本中的所关注细胞材料(例如,用于识别癌性组织、识别良性组织、用于原发性癌症筛查、用于提供癌症诊断、用于对癌性病变进行分级等),以解释测量标记、以识别深度计、区分组织样本和基质的相邻部分、以测量组织样本的特征(例如,识别组织样本或其识别部分的长度、宽度和深度),以确定所识别异常细胞(例如无论通过ai系统308或通过由病理学家识别)的涉及百分比(即总组织面积的百分比),和/或识别在基质中的切片代码。ai处理器326可被编程以将在组织样本中识别的异常细胞与在基质中的特定测量标记相关联,以确定异常细胞在组织样本上的初始(例如,在病理处理之前)位置。ai处理器326还可被编程以将特定组织样本和其图像与在对应的基质中的特定切片代码相关联,用于数字登记基质和组织样本并将基质和组织样本与从中获得组织样本的患者相关联。此外,ai系统308可促进诊断处理,如通过分析数字图像(例如,整个载玻片图像)并且识别和定位在诊断中关注的异常细胞(例如,癌性细胞)和/或不受关注的正常细胞。举例来说,ai系统308可使用所属领域已知的工具,如可可购自加利福尼亚州山景城的谷歌有限责任公司(googlellcofmountainview,ca),并且可以在https://ai.google/在线获得的ai工具来配置和编程。机器学习可用于开发ai系统308,用于识别异常细胞、区分组织样本与周围基质,和/或用于执行其它任务,如本文所描述的。在一些实施例中,计算、存储和联网能力可在本地和/或通过远程服务,如通过第三方供应商的云计算提供。
在一些实施例中,ai系统308可在病理处理的一个或多个阶段使用。借助于实例而非限制,ai系统308可配置成在其中切片代码为可见的病理处理的任何阶段,如在粗略检查期间、在部分处理之后,和/或在完全处理之后(例如,准备好的幻灯片)识别在基质中的切片代码。ai系统308可配置成从组织样本和基质的图像进行粗略测量,如通过区分组织样本与基质的周围部分并确定测量(例如,长度、宽度、表面积、位置,等)。ai系统308可配置成从病理学家接收与准备好的载玻片的数字图像有关的信息,所述载片包括组织样本和周围的基质材料,如异常细胞的所识别位置,并且进一步处理所述信息。举例来说,病理学家可使用医学专业人员系统304的至少一个第一数据输入装置318(例如,触摸屏)环绕在数字图像上的异常细胞,并且ai系统308可确定异常细胞的大小、位置和涉及百分比。可替代地或另外,ai系统308自身可从数字图像识别异常细胞,并且然后可确定异常细胞的大小、位置和涉及百分比。ai系统308还可配置成将在基质中的异常细胞的位置与在从中接收组织样本的患者的器官中的异常细胞的原始位置相关联。
信息可自动地或根据需要(例如,如医学专业人员、病理学家或实验室技术人员的要求)传输到中央网络302、医学专业系统304、病理学实验室系统306和ai系统308中的任何一个或从中央网络302、医学专业系统304、病理学实验室系统306和ai系统308传输。因此,组织样本管理系统300可促进与组织样本和对应的基质有关的信息的通信、登记和评估。如上文参考图1a、1b和2所描述的基质的切片代码可促进与特定组织样本有关的数据的登记、评估和关联。如上文参考图1a、1b和2所描述的基质的测量标记可促进精确识别在特定组织样本内异常细胞的原始位置、大小和形状。
图4说明根据本公开的实施例在病理处理中处置组织样本的方法400的流程图。当组织样本定位在对应的基质内和/或在病理实验室接收时,可通过在进一步处理和修改之前检查组织样本执行粗略检查402。可以通过直接观察组织样本执行粗略检查402,或者可通过审查组织样本(例如,通过医学专业人员、通过,或通过实验室技术人员或病理学家)获取的图像执行粗略检查402。组织样本和对应的基质可化学固定404。化学固定404可通过将组织样本和对应的基质定位在固定流体(如福尔马林)内完成,以将组织样本和基质的主要生物化学成分物理地固定在适当位置。
组织样本和基质可通过暴露于浓度逐渐增加的乙醇溶液(至多100%乙醇)脱水406。脱水406处理可从组织样本和基质去除基本上所有的水。组织样本和基质的附加组分也可在脱水406期间去除,如水溶性蛋白质和一些脂质。因此,组织样本和基质可经历某种收缩。
组织样本和基质可通过暴露于清除剂(如二甲苯)澄清408以去除乙醇并且用清除剂替换乙醇。清除剂可与蜡,如石蜡混溶。清除剂还可从组织样本和基质去除脂质,导致附加收缩。
接下来,可通过将组织样本和基质暴露于熔融蜡(如石蜡)完成渗透410。蜡可替换在组织样本和基质内的清除剂,这可导致附加收缩。
在渗透410之后,渗透的组织样本和基质可定位在用于嵌入412的模具内。在嵌入412处理中,可将附加熔融蜡(例如,石蜡)添加到模具以产生包含渗透的组织样本和基质的蜡块。蜡可冷却并且硬化。
蜡块(包括其中嵌入的组织样本和基质)可如通过切片机切片414。切片414可产生蜡、组织样本和基质的薄切片。嵌入的基质的测量标记和切片代码可在含有嵌入的组织样本的部分的每个切片中可见。因此,每个切片可以肉眼被识别为属于特定基质和对应的组织样本。深度计(如果存在)可提供在其中单个切片起源的石蜡块形式内的深度信息。
载玻片制备和审查416可包括将切片定位在相应的载玻片上用于在显微镜下审查(或用于在显微镜下成像供数字审查)。任选地,可用组织结构染色剂染色切片,以便增加组织的对比度和/或突出所关注的具体组织特征。组织结构染色可通过病理学家根据待突出的组织或细胞材料的类型选择。病理学家可审查其切片或图像以识别异常(例如,癌性)细胞材料(若存在)。可替代地或另外,载玻片的图像可通过ai系统308处理和审查,如上文参考图3所描述。
在上文所描述的任何病理学处理动作中,可对组织样本和基质进行成像418。所得的(一个或多个)图像可传输到中央网络302,用于识别、校验、登记、数字储存、与从中获取组织样本的患者的关联等。通过中央网络302(和/或通过ai系统308,见图3)的这类处理可通过存在切片代码、一个或多个组织样本容器、在基质中的测量标记,和/或在基质中的深度仪,这可在上文所描述的任何病理学处理动作下可辨别。
参考图5,示出组织样本接收基质500(在本文中也被称为基质500)的另一个实施例的俯视图。基质500可类似于上文所描述并且在图1a和1b中示出的基质100。因此,基质500可包括一个或多个组织样本容器502(例如,通道)、沿组织样本容器502的一个或多个侧壁的测量标记504,和切片代码506。然而,基质500的切片代码506可被实施为条形码,包括不同长度和/或宽度的条。切片代码506可为机器可读的。切片代码506可包括基质500的凸起部分、在基质500中的凹陷,和/或基质500的染色部分。在另外的实施例中,可包括条形码和字母数字(或其它人可读或机器可读)切片代码。
参考图6,说明组织样本接收基质600(在本文中也被称为基质600)的另一个实施例。基质600可由可调谐到不同组织类型(即,可定制以表现出与不同组织类型基本上相似的收缩率)的材料形成,如上文所论述。基质600可配置成接收至少一个组织样本601(包括例如第一组织样本601a、第二组织样本601b和第三组织样本601c),其为针芯活检、切口活检、切除活检、液体试样(例如,尿液样本或血液样本),或凝胶状试样(例如,凝胶化的液体试样)。待通过基质600接收的至少一个组织样本601可为未处理的、部分处理的或完全处理的。举例来说,至少一个组织样本601最初可为直接从患者获取的新鲜组织样本601,部分处理的组织样本601(例如,化学固定、脱水、澄清和渗透,但尚未嵌入或切片),或完全处理的组织样本601(例如,嵌入和切片的组织样本601的一部分)。
基质600可配置成从单个患者或从相应的不同患者接收和维持不同的组织样本601a、601b和601c。举例来说,基质600可包括第一载体602a、第二载体602b和第三载体602c(统称为载体602),用于分别接收不同的组织样本601a、601b和601c。载体602中的每个可包括外部大体上矩形的侧壁。深度计608(例如,倾斜表面)可在载体602中的每个的侧壁中或其上形成。在一些实施例中,载体602可各自彼此区分,如通过使用一种或多种颜色(例如,染料)、图案、切片代码或其它区分特征。载体602可为或包括可调谐的基质材料,如上文所描述。在一些实施例中,载体602可包括切片代码,如上文所描述。在一些实施例中,载体602可包括一个或多个切片测量标记,如上文所描述。载体602可至少部分填充有填充剂基质材料604,其中可嵌入至少一个组织样本601。载体602可定位在支撑构件606内,所述支撑构件606也可为或包括可调谐的基质材料,如上文所描述。
支撑构件606可包括用于唯一识别支撑构件606和基质600的切片代码610。在一些实施例中,支撑构件606还可包括切片载体标识符612a、612b、612c(统称为切片载体标识符612),其可分别邻近第一载体602a、第二载体602b和第三载体602c定位。。因此,从整个基质600获取的切片可包括切片代码610和切片载体标识符612,用于唯一识别载体602和基质600中的每个。
在操作中,借助于实例,基质600和载体602可如下使用。载体602最初可具有定位在其外表面614上的粘合膜或物质,以覆盖其内部容器616。第一组织样本601a可(例如,从患者、从包括组织的部分或完全处理的块、从块的完全处理的切片等)获取并且粘附到在第一载体602a上方的粘合膜或物质。填充剂基质材料604可定位在第一组织样本601a上方的内部容器616内并且允许硬化。举例来说,填充剂基质材料604当被引入内部容器616时最初可为液体形式,并且然后可通过冷却、通过随时间固化或通过暴露于催化剂硬化。可选地,如rfid芯片的跟踪装置可嵌入或附接到填充剂基质材料604,如在与第一组织样本601a相对的一侧上。
类似地,可获取第二组织样本601b并且将其粘附到在第二载体602b上方的粘合膜或物质,并且填充剂基质材料604可在第二载体602b的内部容器616内和在第二组织样本601b上方定位和硬化。可选地,rfid芯片可嵌入或附接到在第二载体602b内的填充剂基质材料604。可获取第三组织样本601c并且将其粘附到在第三载体602c上方的粘合膜或物质,并且填充剂基质材料604可在第三载体602c的内部容器616内和第三组织样本601c上方定位和硬化。任选地,rfid芯片可嵌入或附接到在第三载体602c内的填充剂基质材料604。组织样本601可源自单个患者或多个相应的患者。
包括组织样本601和填充剂基质材料604的以此方式制备的载体602可定位在单个支撑构件606内用于附加处理,如通过执行上文参考图4所描述的动作中的一个或多个。
基质600可启用包括来自单个患者或来自多个不同患者的那些的多个组织样本601的所谓“多路复用”(即,同时处理),同时使用例如切片代码、rfid芯片和/或其它识别特征(例如,颜色、图案等)维持组织样本601的明确识别。多路复用可导致显著的成本节省,如通过减少所需的劳动力、材料(例如染料、化学品等)和处理时间。此外,载体602的区别特征(例如,颜色、切片代码等)和/或切片载体标识符612可如上文所描述手动或使用ai系统记录、与患者信息相关联和/或登记。此外,切片代码610、切片载体标识符612和深度计608可在由基质600形成的任何切片载玻片中为可感知的。因此,即使与由相同基质600制备的其它切片分开观察,也可唯一地识别基质600和组织样本601的任何切片。
本公开中所描述的基质可提供用于组织处置、处理、成像和评估的标准平台。这类标准平台可改进在不同实验室之间的组织样本处置的一致性,降低组织样本图像产生的可变性。此外,可更容易地维持组织样本在基质内的定向。此外,通过在基质中提供可用于将图像的部分分离的区分特征,本文公开的基质的配置可以使得能够仅对基质和组织样本的图像的一部分进行图像处理。这些可能的改进中的每一个都可促进(例如,加速)ai处理和组织样本评估的开发和商业化。基质还可促进通过病理学家的组织样本的评估和注释,如用于识别在具体样本中的异常细胞和/或用于向ai系统提供反馈数据用于改进ai系统。可提供实验室信息系统(lis)以包括具体用于ai系统和能力开发的整个载玻片图像注释功能。
上文所描述并且在附图中说明的本公开的实施例不限制本发明的范围,因为这些实施例仅仅是本公开的实施例的实例。本发明涵盖在所附权利要求及其法律等效物中。任何等效实施例都在本公开的范围内。实际上,除了本文示出和描述的那些之外,本公开的各种修改,如描述的元素的其它组合和修改,对于所属领域的一般技术人员将从描述中变得显而易见。这类实施例、组合和修改也落入所附权利要求和其法律等效物的范围内。
权利要求书(按照条约第19条的修改)
1.一种组织样本管理系统,其包含:
中央网络,其至少包括中央处理器和数据库;
与所述中央网络通信的医学专业人员系统,所述医学专业人员系统包括至少一个第一数据输入装置,所述至少一个第一数据输入装置配置成用于输入关于组织样本的信息;和
与所述中央网络通信的病理学实验室系统,所述病理学实验室系统包括至少一个成像装置和至少一个第二数据输入装置,所述至少一个成像装置配置成用于获取所述组织样本和包括切片代码的对应基质的图像,其中所述基质配置成在整个病理处理中维持所述组织样本的初始定向和位置;
其中所述中央网络配置成从所述至少一个第一数据输入装置和所述至少一个第二数据输入装置接收数据,并且处理通过所述至少一个成像装置获取的所述图像以至少识别和记录所述基质的所述切片代码。
2.根据权利要求1所述的系统,其进一步包含与所述中央网络通信的人工智能系统,所述人工智能系统配置成进一步处理通过所述至少成像装置获取的所述图像以识别所述基质的至少一个特征,从而识别所述组织样本相对于所述基质的所述定向和位置。
3.根据权利要求2所述的系统,其中所述人工智能系统配置成从通过所述至少一个成像装置获取的所述图像识别以下中的至少一个:在所述基质中形成的测量标记;或所述基质的所述切片代码。
4.根据权利要求2所述的系统,其中所述人工智能系统进一步配置成从通过所述至少一个成像装置获取的所述图像识别所关注细胞材料在所述组织样本中的位置。
5.根据权利要求2所述的系统,其中所述人工智能系统进一步配置成从通过所述至少一个成像装置获取的所述图像识别所述组织样本的粗略测量。
6.根据权利要求2所述的系统,其中所述人工智能系统进一步配置成区分所述组织样本与所述基质的至少周围部分。
7.根据权利要求2所述的系统,其中所述人工智能系统进一步配置成将所述组织样本的所识别部分与在从中接收所述组织样本的患者的器官上的所述组织样本的所识别部分的原始位置相关联。
8.根据权利要求2所述的系统,其中所述人工智能系统进一步配置成确定在所述组织样本中异常细胞材料的涉及百分比的估算值。
9.根据权利要求1所述的系统,其中所述医学专业人员系统进一步包含至少一个附加成像装置,其配置成用于获取所述组织样本和包括所述切片代码的所述对应基质的图像。
10.根据权利要求1至9中任一项所述的系统,其中所述基质的所述切片代码包含字母数字切片代码或条形码。
11.根据权利要求10所述的系统,其中所述基质包含至少一个组织样本容器。
12.根据权利要求11所述的系统,其中所述至少一个组织样本容器包含在所述基质中形成的多个通道。
13.根据权利要求10所述的系统,其中所述基质包含包含一种或多种蛋白质和一种或多种脂质的材料。
14.根据权利要求13所述的系统,其中所述基质的所述材料包含某一浓度的所述一种或多种脂质,选择所述浓度以向所述组织样本接收基质提供与将通过所述组织样本接收基质接收的特定组织类型的收缩率基本上相同的收缩率。
15.根据权利要求13所述的系统,其中所述基质的所述材料包含约2%到约14%w/v的所述一种或多种蛋白质和约2.1%到约20%w/v的所述一种或多种脂质。
16.根据权利要求13所述的系统,其中所述组织样本接收基质的所述材料进一步包含胶凝剂。
17.根据权利要求10所述的系统,其中所述基质包含至少一个深度计。
18.根据权利要求17所述的系统,其中所述深度计包含所述基质的成角度的表面。
19.一种用于组织样本处理的方法,其包含:
提供用于接收组织样本的基质,其中所述基质具有切片代码和以预定初始间隔定位在所述基质中的测量标记,并且其中所述基质配置成表现出相对于所述组织样本在进行病理处理时的收缩率一致的收缩率,以在整个所述病理处理中维持所述组织样本的初始定向和位置;
在所述基质中获取所述组织样本的第一图像;
将所述第一图像传输到至少包括处理器和数据库的中央网络;
用所述处理器从所述第一图像识别所述切片代码;
将所述切片代码数字地存储在所述数据库中;
将所述存储的切片代码与从中获得所述组织样本的患者的识别信息相关联;
在至少某一病理处理之后,在具有所述切片代码和测量标记的所述基质中获取所述组织样本的第二图像;
将所述第二图像传输到所述中央网络;
用所述处理器从所述第二图像识别所述切片代码;
用所述处理器从所述第二图像识别所述测量标记;和
将所述第二图像与从中获得所述组织样本的所述患者的所述识别信息相关联。
20.根据权利要求19所述的方法,其进一步包含用所述处理器从所述第二图像识别所述基质的深度计。
- 还没有人留言评论。精彩留言会获得点赞!